
Это не сказка и даже не сон — две недели in vitro живет эмбрион!
08 июня 2016
Это не сказка и даже не сон — две недели in vitro живет эмбрион!
- 1597
- 0
- 3
Возможно, рассказы фантастов не так уж и фантастичны, и эра искусственно выращиваемых людей не за горами!
-
Автор
-
Редакторы
Темы
Смотрели ли вы фильм «Матрица»? А может быть, читали «О дивный новый мир» Олдоса Хаксли? Помните о тех необычных методиках выращивания людей, которые там описаны? Начиная со стадии эмбриона, человека растили в специальном инкубаторе, не используя при этом материнский организм. Удивительно, но благодаря последним научным открытиям, художественный вымысел не кажется таким уж фантастическим. По крайней мере, первые шаги в этом направлении уже сделаны: биологи научились культивировать человеческий эмбрион в лабораторных условиях вплоть до 14 дня его развития!
До сих пор ранние стадии развития человека в утробе матери оставались скрытыми от глаз ученых, но усовершенствованные методы культивирования эмбрионов на стадии бластоцисты вне матки обещают облегчить шаги в этом направлении исследований. Эмбриологам из США и Великобритании удалось вырастить человеческие эмбрионы в лабораторных условиях до 13 дня развития после оплодотворения, побив предыдущий рекорд в 9 дней [1], [2]. Новое достижение уже позволило ученым обнаружить такие аспекты раннего развития человека, которые до этого были неизвестны. А метод, предложенный ими, поможет определить, почему в некоторых случаях беременность может самопроизвольно прерываться.
Что мы знали об эмбриональном развитии раньше...
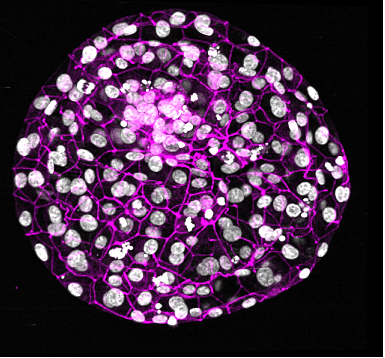
Рисунок 1. Трехмерное изображение передней половины бластоцисты на шестой день после оплодотворения.
В целом, изучение раннего развития человеческих эмбрионов — задача непростая: не так много материала доступно для исследований, на которые, в свою очередь, налагается множество этических и правовых ограничений. Однако знание и понимание механизмов развития плода крайне важны для: а) улучшения репродуктивных технологий; б) совершенствования культур стволовых клеток, необходимых для регенеративной медицины; в) изучения раннего самопроизвольного прерывания беременности. Сообщается, что человеческие эмбрионы, полученные путем экстракорпорального оплодотворения (ЭКО) [3], [4], могут самоорганизовываться в чашке Петри, формируя основные клеточные линии плода и его соединительные ткани. Это первый шаг на пути понимания и более четкого представления о начале человеческой жизни [5].
У млекопитающих, в том числе и у человека, оплодотворенная яйцеклетка в первые дни развития претерпевает ряд клеточных делений, что приводит к формированию бластоцисты (рис. 1). Именно в этот момент клетка принимает первые «решения» о том, какой клеточной линии она даст начало. Клеточная линия эпибласт формирует единый плод, в то время как две другие клеточные линии берут на себя ответственность за продуцирование неэмбриональных тканей: вначале — трофэктодермы, а затем — примитивной энтодермы (рис. 2). Трофэктодерма дает начало клеткам, которые образуют бόльшую часть плаценты, тогда как примитивная энтодерма формирует несколько слоев желточного мешка — зародышевого органа, который необходим для раннего кровоснабжения плода. Механизмы, лежащие в основе специализации клеточных линий бластоцисты, хорошо изучены у мышей, и считалось, что эти пути эволюционно консервативны для разных видов млекопитающих.
Однако это представление в свете новых знаний трансформировалось. Многие из генов, которые регулируют решения о клеточной дифференцировке в эмбрионах мышей, экспрессируются и в человеческих эмбрионах. Однако время начала и остановки каскада реакций, регулирующих их экспрессию, различается у разных видов. Бластоцисты имплантируются в слизистую оболочку матки мышей всего через пять дней после оплодотворения, тогда как у людей имплантация происходит на два дня позже. Этот период очень важен, поскольку именно тогда клетки трофэктодермы начинают взаимодействовать с маткой, и эмбрион совершает, пожалуй, самый важный шаг в своем развитии — переходит на стадию гаструляции. В этот момент так называемая первичная (примитивная) полоска — клеточная масса, продуцируемая эпибластом, — дает начало трем зародышевым листкам, которые в итоге формируют все ткани будущего организма.
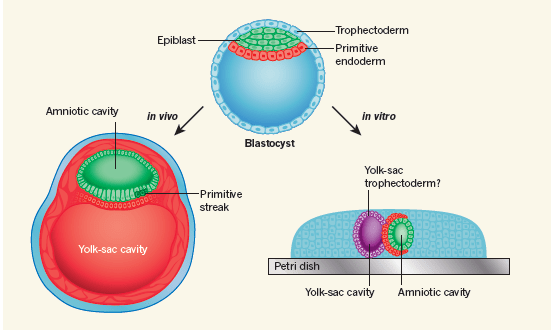
Рисунок 2. Развитие человеческого эмбриона в естественных условиях и in vitro. Во время раннего эмбрионального развития человека клетки образуют структуру, называемую бластоцистой. Бластоциста состоит из трех клеточных линий: эпибласта, формирующего сам плод, а также трофэктодермы и примитивной энтодермы, поддерживающих его рост. В естественных условиях (слева) примерно через 12 дней после оплодотворения бластоцисты имплантируются в матку и претерпевают дифференцировку клеток. Эпибласт формирует амниотическую полость и клеточную массу, называемую примитивной полоской (primitive streak), которая будет производить три основных слоя тканей организма. Клетки, полученные из примитивной энтодермы, образуют желток, который участвует в кровоснабжении плода. Клетки трофэктодермы образуют внешние структуры. Аналогичные структуры и полости образуются и у эмбрионов, выращенных in vitro (справа), хотя их пространственное распределение несколько отличается от такового у «естественных» эмбрионов. Метод выращивания человеческих эмбрионов in vitro позволил наблюдать неизвестный ранее тип клеток, происхождение которых пока остается неясным.
У мышей было показано, что образование первичной полоски инициируют сигналы от примитивной энтодермы и трофэктодермы, тогда как у людей этот период развития был совершенно не изучен и представлялся этаким «черным ящиком». Было известно только, что существуют значительные различия между тем, как имплантируются в матку зародыши приматов и мышей. В частности, эпибласт мыши образует чашевидную структуру, на одной стороне которой формируются примитивная полоска и амниотическая складка (позже она превращается в плодный пузырь, заполненный жидкостью). В противоположность этому, эпибласт приматов вначале образует центральную амниотическую полость и только затем уплощается, чтобы сформировать диск, на одном из концов которого возникнет примитивная полоска. Поэтому стало очевидным, что между видами существуют определенные различия во взаимоотношениях клеточных линий и что разработка стратегии культивирования человеческих эмбрионов in vitro на ранней стадии постимплантационного периода улучшит наше понимание этих различий.
...и что знаем теперь
Группе американских и британских исследователей удалось вырастить вне матки человеческие эмбрионы, полученные путем ЭКО, до стадии, эквивалентной 13-му дню после оплодотворения в естественных условиях. Для достижения такого результата они использовали систему культивирования эмбрионов мышей, но с улучшенной культуральной средой и более оптимальным субстратом для прикрепления эмбриона. В таких условиях бластоцисты прикреплялись к чашке, трофэктодерма расширялась и демонстрировала признаки дифференциации в специализированные плацентарные типы клеток, а примитивная энтодерма отделялась от эпибласта. Было обнаружено, что небольшая центральная полость развилась в эпибласт. Это напоминает формирование амниотической полости у макак-резусов, хотя без надежных молекулярных маркеров амниотической ткани нельзя подтвердить стопроцентную идентичность событий.
Также наблюдали формирование второй полости в растущей примитивной энтодерме, которая предположительно является полостью желточного мешка. Сообщается, что клетки, выстилающие эту полость, экспрессировали гены, характерные для клеток трофэктодермального происхождения. Авторы предположили, что это некий новый вид клеток, и назвали его трофэктодермой желточного мешка. Однако при анатомическом описании возникло предположение, что эти клетки получены всё же из примитивной энтодермы и просто демонстрируют профиль экспрессии генов, отличный от мышиного. После 12-го дня культивирования эмбриона происходил коллапс полости и начиналось неорганизованное развитие, хотя дифференциация трофэктодермы продолжалась.
Несмотря на то, что эти исследования представляют собой важные шаги в сторону ясного понимания биологии развития человека во время имплантационного периода, существует ряд ограничений, которые еще предстоит преодолеть. Проблемой представляется и то, что культивируемые эмбрионы в основном плоские, двумерные, поэтому являются явно несовершенными моделями нормального, 3D, эмбрионального развития. Кроме того, однозначно идентифицировать типы клеток, полостей и структур в культурах пока довольно сложно.
Разработанный метод культивирования эмбрионов может помочь в изучении роли сигнальных молекул неэмбриональных тканей в формировании эпибласта. Путем сопоставления полученных результатов и профиля сигнальных молекул, обнаруженных в культуре эмбриональных стволовых клеток (они имитируют события гаструляции), можно лучше понять, как стимулировать стволовые клетки дифференцироваться в другие типы клеток — например обладающие терапевтическим потенциалом. Крайне информативной должна стать 3D-система культивирования бластоциста, над разработкой которой еще предстоит потрудиться. Если топологические отношения между разными типами клеток в таких 3D-культурах будут нормальными, система предположительно позволит наблюдать гаструляцию в лабораторных условиях. Однако в настоящее время работа с человеческой эмбриональной культурой ограничена международным соглашением: работу необходимо прервать либо по истечении 14 дней роста эмбриона, либо в начале формирования примитивной полоски — в зависимости от того, какой этап наступит раньше. Интересно, будет ли изменено это правило, если удастся осуществлять нормальную гаструляцию в лабораторных условиях?
Усовершенствованные и более долгоживущие культуры могли бы обеспечить человечество важной информацией о биологии развития, повысить эффективность такой процедуры, как ЭКО, и привести к лучшему пониманию дифференцировки стволовых клеток. Тем не менее разработка таких систем культивирования эмбрионов in vitro вновь поднимает вопрос о том, как и на каких сроках стόит применять этические нормы и ограничения.
Литература
- Deglincerti A., Croft G.F., Pietila L.N., Zernicka-Goetz M., Siggia E.D., Brivanlou A.H. (2016). Self-organization of the in vitro attached human embryo. Nature. 533, 251–254;
- Shahbazi M.N., Jedrusik A., Vuoristo S., Recher G., Hupalowska A., Bolton V. et al. (2016). Self-organisation of the human embryo in the absence of maternal tissues. Nat. Cell Biol. 18, 700–708;
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- Дети из пробирки;
- Rossant J. (2016). Human embryology: implantation barrier overcome. Nature. 533, 182–183.






