«За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!
05 октября 2010
«За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!
- 3441
- 6
- 4
Одна из первых крупных побед Эдвардса на поприще экстракорпорального оплодотворения — нахождение условий, в которых оплодотворённую «в пробирке» яйцеклетку удаётся довести до стадии восьми бластомеров
коллаж по иллюстрации из [4]
-
Автор
-
Редакторы
Несмотря на то, что в завещании Нобеля номинация называется «по физиологии и медицине», большинство премий последних лет (если не десятков лет!) было посвящено скорее молекулярной биологии, чем медицине как таковой. Конечно, первая непосредственно связана со второй, но всё-таки от описания молекулярного механизма до лечения дорога неблизкая. Тем приятнее узнать, что в 2010 году премия вручена британцу Роберту Эдвардсу именно за медицинские достижения, причём настолько неоспоримые, что можно без преувеличения сказать: самим фактом своего существования этим достижениям (или самому Эдвардсу?) обязаны около четырёх миллионов человек.
Уже никого не удивляет, что Нобелевская премия по физиологии и медицине почти всё время вручается не за медицину как таковую, а за открытия в области молекулярной биологии, которые только десятилетия спустя воплотятся во что-то значимое для рядовых пациентов больниц и посетителей поликлиник. Например, в 2009 году премия была вручена за изучение структуры теломеров и фермент теломеразу [1], на год раньше — за вирусологические исследования [2], в 2007 году была отмечена технология «нокаутных» мышей [3]. Бесспорно, все эти открытия самым существенным образом повлияли на облик современной биомедицинской науки, но сами по себе они к медицине не относятся. Возможно, лишь премию 2005 года можно классифицировать как чисто медицинскую — она была вручена «за открытие бактерии Helicobacter pylori и её роли в гастрите и язвенной болезни».
В 2010 году Нобелевская премия вручена за стопроцентно медицинскую работу — экстракорпоральное оплодотворение (по-английски это называется in vitro-fertilization). Единственным лауреатом стал «отец-основатель» этой отрасли — британец Роберт Эдвардс (Robert G. Edwards), занимающийся вопросами лечения бесплодия и искусственного оплодотворения с 1950-х годов. Звёздный час Эдвардса настал 25-го июля 1978 года, когда после десятилетий работы на свет появился первый «ребёнок из пробирки» — Луиза Браун, ставшая во главе вереницы из четырёх миллионов людей, чьё рождение стало возможным благодаря достижениям фундаментальной науки.
Бесплодие — горе для супругов
Более 10% супружеских пар на свете бесплодны. Для большей части из них это огромное разочарование и причина психологической травмы и депрессий на всю жизнь. В прошлом медицина мало что могла предложить таким людям — за исключением «колдовства», заговóров и прочих второсортных услуг. В наше время ситуация кардинальным образом переменилась — экстракорпоральное оплодотворение (ЭКО) позволяет исправить ситуацию, когда яйцеклетка и сперматозоид неспособны соединиться или даже просто встретиться внутри тела без посторонней помощи.
Плоды фундаментальных исследований
Британский физиолог Роберт Эдвардс начал заниматься биологией размножения в 1950-х, и уже тогда он осознал, что оплодотворение вне тела станет способом, с помощью которого можно начать бороться с бесплодием. К тому времени искусственное оплодотворение уже было продемонстрировано на кроликах, и Эдвардс решил заняться аналогичной проблемой у людей.
Эта задача превзошла предыдущую по сложности многократно: жизненный цикл яйцеклеток человека и кролика кардинально отличается. В течение более чем десятилетия Эдвардс и ряд его коллег занимались изучением созревания яйцеклетки, влиянием на этот процесс половых гормонов и подбором условий и подходящего момента времени, когда яйцеклетку удалось бы оплодотворить в пробирке, — а ведь для искусственного оплодотворения и сперму нужно специальным образом «активировать».
В 1969 году казалось, что успех близко — оплодотворение в пробирке произошло. Однако зигота (оплодотворённая яйцеклетка) делилась лишь один раз, а дальнейшего развития уже не происходило. Эдвардс предположил, что развитие продолжится, если для искусственного оплодотворения брать яйцеклетку, созревшую в яичнике, — на стадии, предшествующей овуляции. Однако он понятия не имел, как достать такую клетку, не повредив при этом здоровью женщины.
От эксперимента — к клинической практике
Выход предложил Патрик Стептоу (Patrick Steptoe), британский гинеколог, который в то время с «боями» внедрял в медицинский обиход лапароскопию — метод, позволяющий с помощью гибкого оптического инструмента исследовать яичники. Стептоу приспособил лапароскоп для изъятия созревающей яйцеклетки из яичника, чтобы перенести её на питательную среду с целью искусственного оплодотворения. Получавшаяся в результате зигота делилась уже три-четыре раза и достигала стадии восьми (или 16) бластомеров [4] (см. заглавную картинку).
В этот момент фундаментальные исследования породили существенный резонанс в обществе, — не в последнюю очередь благодаря увещеваниям религиозных лидеров. Поднимался вопрос этичности искусственного оплодотворения, подобно тому как недавно отчаянно дискутировали о христианской приемлемости стволовых клеток. В результате этого многообещающие работы Эдвардса и Стептоу не получили финансовой поддержки Совета медицинских исследований Великобритании, — чиновники побоялись финансировать столь рискованный и неоднозначный с этической точки зрения (как тогда казалось) проект. Однако работа не прервалась: на помощь пришли частные спонсоры.
Ребёнок из пробирки
Дальнейшие исследования при частной финансовой поддержке показали, что стабильное развитие эмбриона и его успешная имплантация в стенку матки возможны в случае максимального соответствия всей процедуры естественному менструальному циклу женщины, — лишь в этом случае удавалось добиться нормального протекания беременности. Однако пока исследователи поняли, что используемая для индукции созревания ооцитов гормональная терапия «мешает» подсаженным эмбрионам имплантироваться в слизистую матки, было сделано более сотни попыток, заканчивавшихся выкидышами. Первая почти успешная беременность (1976 г.), когда имплантацию проводили уже после отмены гормональной терапии и согласно менструальному циклу, оказалась внематочной, и её пришлось прервать. В 1977 году в клинику обратились Лесли и Джон Брауны, к тому моменту на протяжении уже девяти лет безуспешно пытавшиеся завести ребёнка.
После проведения процедуры ЭКО оплодотворённая яйцеклетка на стадии 8 клеток (эти три деления протекают в течение 2,5 дней после искусственного оплодотворения) была «возвращена» миссис Браун. Их дочь, Луиза Браун, родилась в положенный срок — 25 июля 1978 года — при помощи кесарева сечения. О своём головокружительном успехе исследователи сообщили в одном из самых знаменитых медицинских журналов — The Lancet (рис. 1) [5]. Кстати, совсем недавно вышла статья, в которой детально анализируются мотивы отказа Совета медицинских исследований в финансировании Эдвардса и фактически приносятся ему запоздалые извинения [6].

Рисунок 1. Роберт Эдвардс (слева) на 30-летии своего первого «ребенка из пробирки» — Луизы Браун (справа). Лучшим возможным подтверждением безопасности и эффективности разработанной Эдвардсом методики экстракорпорального оплодотворения является Кэмерон, сын Луизы, который появился на свет здоровым и без помощи технологии искусственного оплодотворения. В центре — мать Луизы, Лесли Браун.
Новая эра началась: искусственное оплодотворение перенеслось из области нереальных мечтаний в сферу практической медицины.
ЭКО шагает по миру
Окрылённые своим успехом, Эдвардс и Стептоу открыли первую в мире ЭКО-клинику — Боурн-Холл в Кембридже, где Стептоу до самой смерти в 1988 г. был главврачом, а Эдвардс — начальником исследовательского подразделения, пока не вышел на пенсию. (По-видимому, Стептоу не разделил с Эдвардсом «нобелевку» лишь по той причине, что не дожил до этого момента: по условию Нобеля, премия не вручается посмертно.)
Роберт Эдвардс не только изобрёл, но и в течение всей жизни защищал методику искусственного оплодотворения от нападок консерваторов и религиозных троллей, а также с честью отстаивал свои научные взгляды перед невеждами и толпами сомневающихся.
В настоящее время техника ЭКО (рис. 2) получила широчайшее распространение по всему миру, и, по сравнению с первоначальным вариантом, существенно усовершенствовалась. В частности, забор яйцеклетки больше не производится лапароскопом — его заменил более аккуратный и безопасный ультразвуковой метод, позволяющий к тому же оценивать созревание яйцеклеток. Разработана методика индукции созревания яйцеклеток in vitro — то, чего не удалось достичь в 1969-м, и что важно для женщин с нарушенной гормональной регуляцией или пациенток после химеотерапии, рискующих потерять пул ооцитов. Ещё одно важное достижение — цитоплазматическая инъекция сперматозоида, позволяющая обойти многие виды мужского бесплодия. Чтобы снизить риск рождения детей с врождёнными дефектами, стали использовать предимплантационную генетическую диагностику.
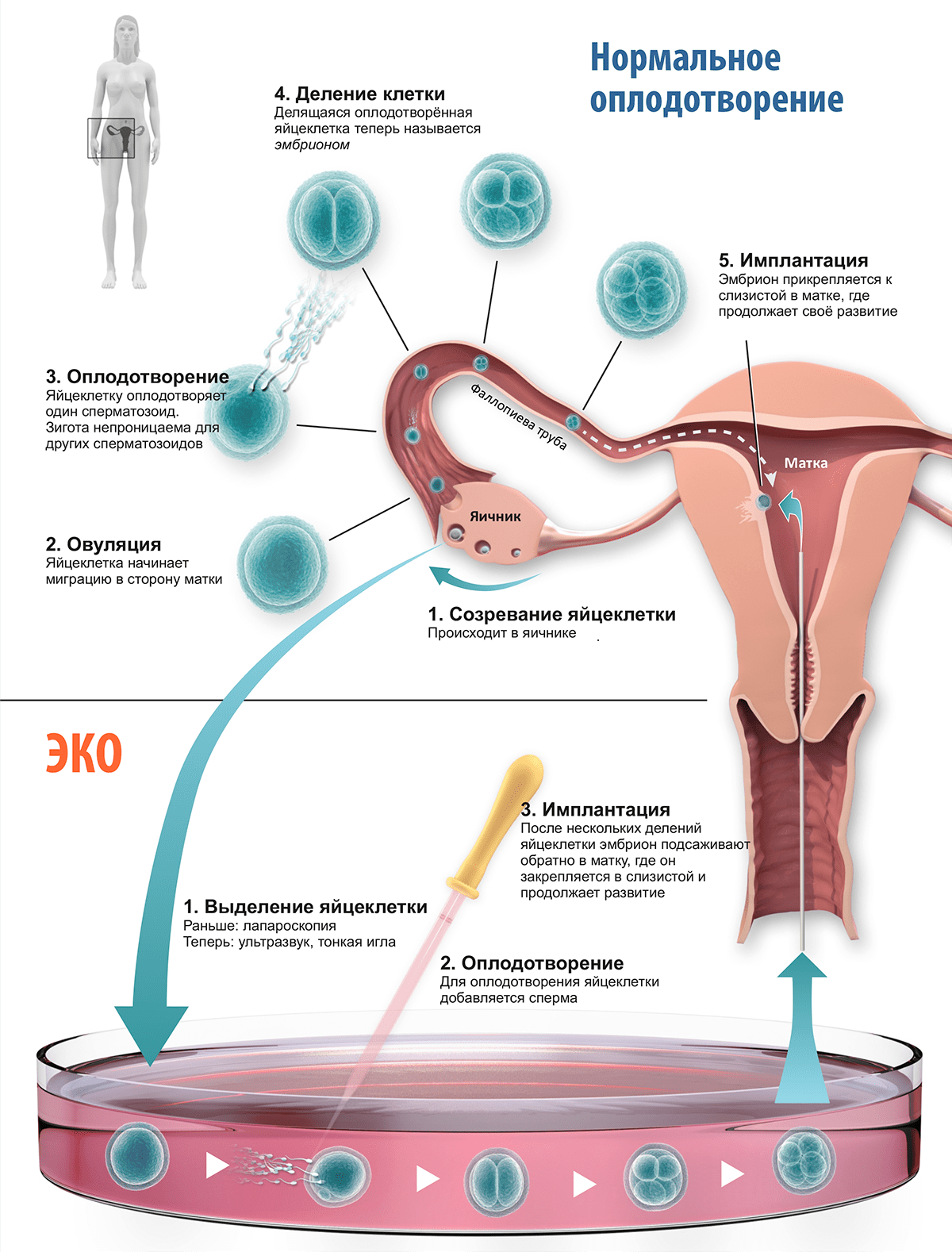
Рисунок 2. Принципы ЭКО, разработанные Эдвардсом. Для искусственного оплодотворения с помощью лапароскопа (или более современных инструментов) отбирается пре-овуляционная яйцеклетка, «заторможенная» на стадии метафазы второго деления мейоза. Далее яйцеклетку помещают на питательную среду, и добавляют сперму, которая, благодаря специальным свойствам среды, приобретает «активность», необходимую для оплодотворения. Взаимодействие со спермой запускает в яйцеклетке завершающую стадию мейоза, что приводит к образованию двух гаплоидных наборов хромосом, один из которых сольётся с гаплоидным же набором сперматозоида, а второй деградирует. Оплодотворение переводит яйцеклетку на стадию зиготы, которая начинает делиться и претерпевает 3 или 4 деления, доходя до стадии 8 или 16 бластомеров. Эмбрион на стадии 8 клеток (это 2,5 дня с момента оплодотворения) с помощью иглы возвращают в матку, где он продолжает развитие до стадии бластулы, после чего имплантируется в слизистую стенку, называемую эндометрием; эндометрий в ответ образует плаценту. Дальнейшее развитие плода, вплоть до разрешения родами, происходит именно здесь.
[7], рисунок адаптирован
ЭКО — довольно эффективная и безопасная процедура, позволившая миллионам пар познать счастье иметь детей. Небольшой список возможных осложнений возглавляет высокая частота многоплодных беременностей (это происходит из-за того, что в матку помещают сразу несколько зародышей — чтобы «наверняка») и преждевременные роды (но это скорее проблема позднородящих женщин или следствие той же самой причины, что и вызвала бесплодие). В целом «дети из пробирки» такие же здоровые, как и остальные, — лучше всего это подтверждается тем, что у Луизы Браун и многих её «товарищей» есть собственные здоровые дети, появившиеся на свет «по старинке».
Двадцатый век явил миру несколько инфернальных фигур, на счет которых можно отнести миллионы смертей. Однако вряд ли с ходу можно вспомнить другого человека, «повинного» в четырёх миллионах жизней, иначе не состоявшихся бы, — а именно такому количеству людей Эдвардс может считаться «повивальным дедом», — браво, Роберт!
Статья написана по мотивам официального пресс-релиза нобелевского комитета [7].
Модифицированная версия этой статьи была опубликована в журнале New Scientist [8].
Литература
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Нобелевскую премию 2008 года по физиологии и медицине вручили за вирусологические исследования;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- R. G. EDWARDS, P. C. STEPTOE, J. M. PURDY. (1970). Fertilization and Cleavage in vitro of Preovulator Human Oocytes. Nature. 227, 1307-1309;
- P.C. Steptoe, R.G. Edwards. (1978). BIRTH AFTER THE REIMPLANTATION OF A HUMAN EMBRYO. The Lancet. 312, 366;
- Martin H. Johnson, Sarah B. Franklin, Matthew Cottingham, Nick Hopwood. (2010). Why the Medical Research Council refused Robert Edwards and Patrick Steptoe support for research on human conception in 1971. Human Reproduction. 25, 2157-2174;
- The Nobel Prize in Physiology or Medicine 2010. (2010). The Nobel Prize;
- Чугунов А.О. (2010). ЭКОпремия. New Scientist. 2, 11–13.