Гемофильная палочка: колесо Фортуны
14 июля 2023
Гемофильная палочка: колесо Фортуны
- 5042
- 0
- 4
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Вакцины против гемофильной палочки типа b не так знамениты, как их коллеги, защищающие от коклюша, свинки, полиомиелита и других опасных инфекций, о которых мы уже писали. Между тем, Hib-инфекция продолжает уносить тысячи детских жизней по всему миру. Давайте разбираться, почему гемофильная палочка все еще остается одной из ведущих причин пневмонии и менингита и как при помощи вакцинации удается существенно снизить урон, который она наносит.
Вакцинация
Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
С гемофильной палочкой люди знакомы уже очень давно. Но если в XIX веке ее считали возбудителем гриппа (потому и палочка называется Haemophilus influenzae), то сегодня мы продвинулись в изучении этих бактерий гораздо дальше и поняли, что к гриппу она не имеет никакого отношения.
Кто ты такая, гемофильная палочка?
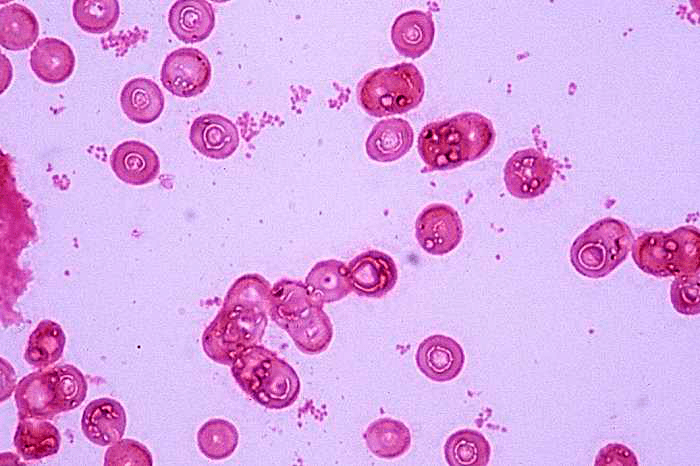
Haemophilus influenzae — это грамотрицательная коккобацилла из семейства Pastuerellaceae, которая не образует спор (рис. 2). Вырастить в лаборатории ее можно только в присутствии порфирина и никотинамидадениндинуклеотида, или НАД (оба вещества можно найти в эритроцитах — красных клетках крови), что отличает ее от сестер рода Haemophilus.
Полисахаридная капсула есть у некоторых штаммов Haemophilus influenzae, включая палочки типа b (рис. 3). Она играет важную роль в проникновении патогена в организм человека: облегчает борьбу бактерии с иммунными клетками на первой стадии заражения и защищает ее от фагоцитоза. Эта капсула так важна, что у наиболее вирулентных штаммов гемофильной палочки гены, отвечающие за ее производство, благодаря дупликации (удвоению) ДНК имеют несколько копий [6].
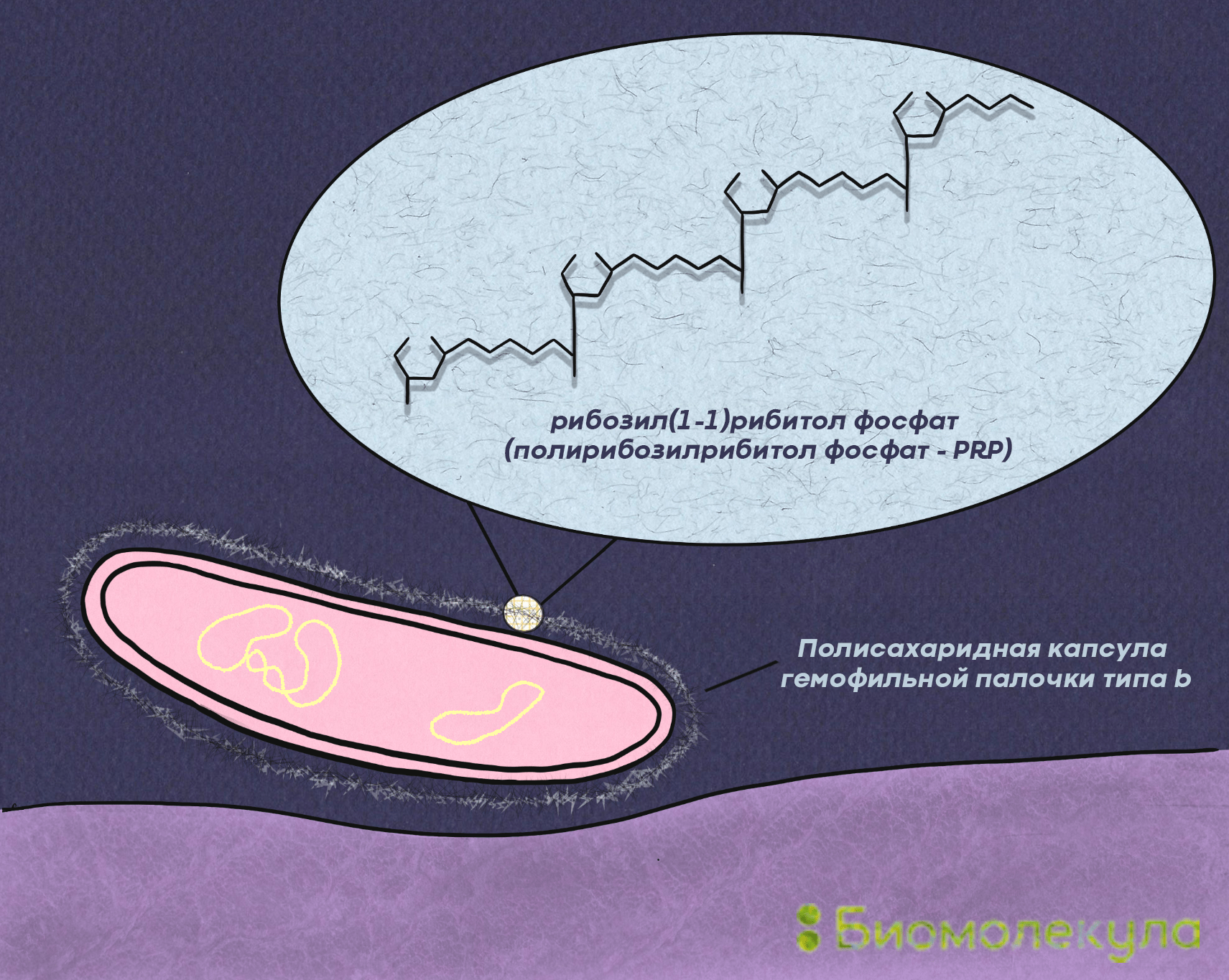
Рисунок 3. Полисахаридная капсула Hib имеет в составе полирибозилрибитолфосфат (PRP)
Среди других факторов вирулентности Haemophilus influenzae — липоолигосахарид клеточной оболочки и нитеобразные белковые ворсинки (пили), которые помогают бактериям связываться с клетками ротоглотки. Пили есть не у всех штаммов: гемофильная палочка имеет изменяющийся во времени синтез белков, ответственных за их образование, что дает ей определенные преимущества при захвате новых территорий — вне клеток человека выигрышнее иметь жгутики, а внутри клеток они будут скорее мешать [7].
Hib против человека: чем опасны гемофильные палочки типа b?
Так как для человека опасность представляют в первую очередь гемофильные палочки типа b, основные исследования связаны именно с ними. И главная цель этих исследований — борьба с теми тяжелыми детскими заболеваниями, которые вызывает Hib-инфекция.
Гемофильные палочки передаются от человека к человеку воздушно-капельным путем: при кашле, чихании, во время разговора. Заразиться можно также через посуду и игрушки, а новорожденный может получить инфекцию от матери во время родов. Опасным может быть контакт не только с больным в острой фазе инфекции, но и с носителем, у которого бактерии живут в носоглотке, не вызывая симптомов.
До широкого охвата вакцинами бактерии типа b вызывали примерно 95% всех инвазивных инфекций, связанных с гемофильными палочками. В США это до 88 случаев на 100 тысяч детей до 5 лет ежегодно и почти 20 тысяч случаев заболеваний в год (из них половина — случаи менингита) , [8], [9]. В Европе цифры схожи, если брать в расчет разницу в доле регистрируемых случаев и в методах, которыми пользуется эпиднадзор разных стран при подсчете выявленных кейсов заболевания.
Оценивая бремя гемофильной палочки, нужно учитывать трудности, связанные с выявлением этого возбудителя в лабораторных условиях. Из-за неправильного взятия люмбальной пункции или начала антибиотикотерапии результаты анализов могут быть смазаны, а причина болезни установлена неверно. — Ред.
Вплоть до недавнего времени бактерия уносила множество жизней по всему миру, еще больше детей становилось инвалидами. Например, в 2000 году из-за заражения ею умерло порядка 371 тысячи пациентов, а в 2008 году эта цифра составила около 200 тысяч [10]. С появлением широкой вакцинации против Hib-инфекции тяжелые случаи связанных с ней заболеваний стали встречаться реже, однако полностью не исчезли. Во многом влияние гемофильной палочки на заболеваемость зависит от уровня иммунизации в конкретном регионе. В странах, где вакцинация охватывает бóльшую часть населения (в европейском регионе это 81%), случаев гемофильных инвазивных инфекций в разы меньше.
Особой опасности подвержены самые маленькие — дети до двух лет, при этом заболеваемость остается высокой среди детей до пяти лет. Также в группу риска по заболеваниям, ассоциированным с гемофильной палочкой, входят:
- Пожилые люди в возрасте 65 лет и старше.
- Некоторые этнические группы (американские индейцы, коренные жители Аляски, люди африканского происхождения).
- Люди с заболеваниями, снижающими иммунную защиту (сюда относятся серповидно-клеточная анемия, врожденное отсутствие селезенки, ВИЧ-инфекция, синдром дефицита антител и комплемента, онкологические заболевания, требующие лучевой, химиотерапии или трансплантации стволовых клеток костного мозга) [11].
- Дети на искусственном вскармливании. Дети на грудном вскармливании младше шести месяцев болеют реже благодаря материнским антителам [12].
- Дети, живущие в условиях пансиона или совместно с братьями и сестрами. Они больше других подвержены заражению из-за большего числа контактов. Гемофильная палочка очень заразна. На игрушках, побывавших во рту у ребенка, она может сохраняться до двух суток [13].
Чем же может грозить человеку встреча с этими бактериями?
К сожалению, предсказать тяжесть болезни непросто, это своего рода биологическое колесо фартуны. Иногда заражение гемофильной палочкой вообще никак не вредит здоровью. Попав на слизистые, она может быть уничтожена иммунной системой или может остаться там как условный патоген, мирно сосуществуя с организмом человека.
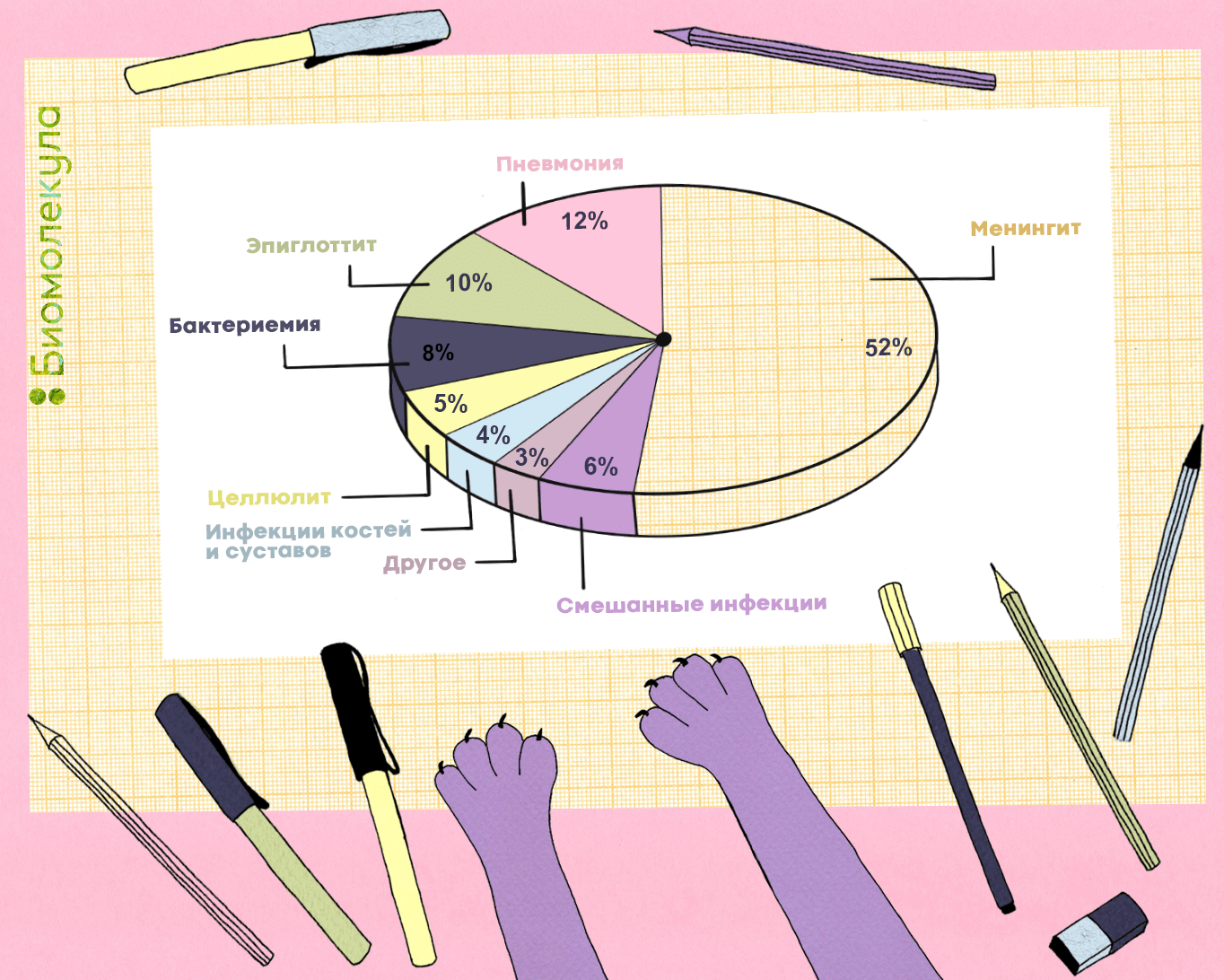
Однако часто Hib становится возбудителем самых разных заболеваний от относительно безобидных отитов до серьезных инвазивных поражений тех органов и систем, где бактерий быть вообще не должно. Это, например, менингиты — воспаление оболочек головного и спинного мозга, артриты и остеомиелит [14], кожные инфекции [15] или бактериемия — заражение крови. Все инвазивные заболевания протекают крайне сложно, требуют лечения в стационаре и могут закончиться смертью. Менингит и пневмония при этом остаются самыми распространенными и известными формами Hib-инфекции (рис. 4).
Менингит
Hib — это третий по значимости возбудитель гнойных менингитов после менингококка и пневмококка.
О том, каким бывает менингит и что его вызывает, можно подробно почитать в соответствующей статье спецпроекта о вакцинации [16]. — Ред.
Эта грозная болезнь развивается, если бактерии, проникая сквозь мелкие капилляры сосудистого сплетения, попадают в жидкость вокруг головного или спинного мозга.
Среди классических симптомов менингита — высокая температура, напряженность затылочных мышц, спутанное сознание, у малышей — выбухание родничка. К менее типичным признакам относят снижение аппетита, гипотермию (падение температуры тела) и повышенную раздражительность.
Воспаление и отек оболочек мозга — крайне опасное состояние. У 15–30% детей, перенесших менингит [17], развиваются стойкие неврологические осложнения, например, потеря слуха. Риск получить хотя бы одно серьезное осложнение после болезни составляет примерно 9,5% [18].
Коэффициент летальности от Hib-менингита без лечения достигает 90%, при лечении же сильно зависит от качества врачебной помощи и тяжести состояния и осложнений (есть ли паралич, судороги, когнитивные нарушения) и колеблется от 3–5 до 60%. Самый низкий показатель (что ожидаемо) в странах с высоким уровнем дохода [19], где заболевшие дети получают помощь оперативнее, и практически у всех есть доступ к необходимым лекарствам.
Пневмония
Пневмония — это воспаление легких, вызывать которое могут как бактерии, так и вирусы. Среди бактерий первенство здесь стоит отдать пневмококку (про него уже есть статья [20] в этом спецпроекте), но и Hib-инфекцию списывать со счетов не стоит .
Точную долю Hib-инфекции в общем числе всех пневмоний посчитать довольно проблематично из-за отсутствия удобного неинвазивного метода выявления возбудителя болезни (анализ крови часто дает отрицательный результат, а посев из носоглотки тут неинформативен — носительство гемофильной палочки не означает, что именно она вызвала пневмонию). Один из способов оценить распространенность таких пневмоний — проследить, упала ли заболеваемость после внедрения вакцин против Hib, эффективность которых уже известна. Метаанализ исследований именно такого типа показывает, что гемофильная палочка ответственна примерно за 5% клинических случаев пневмонии у детей до 5 лет. Для случаев, где изменения в легочной ткани видны на рентгене, цифра выше — 21% [10].
Симптомы пневмонии, вызванной гемофильной палочкой, типичны. Это сильный кашель и боль в груди, высокая температура, одышка и усталость.
Ужасный и молниеносный эпиглоттит
Воспаление надгортанника (это и есть эпиглоттит, рис. 5) почти всегда бывает следствием заражения гемофильной палочкой . Это заболевание опасно тем, что из-за отека тканей ротоглотки дыхание больного может быть полностью перекрыто — человек просто задохнется. Угроза для детей выше, чем для взрослых, так как дыхательные пути у них ýже.
Менее распространенные причины эпиглоттита — стрептококковая инфекция, грибковые и вирусные инфекции (такое воспаление могут вызвать вирусы ветряной оспы и простого герпеса), травмы горла и курение.
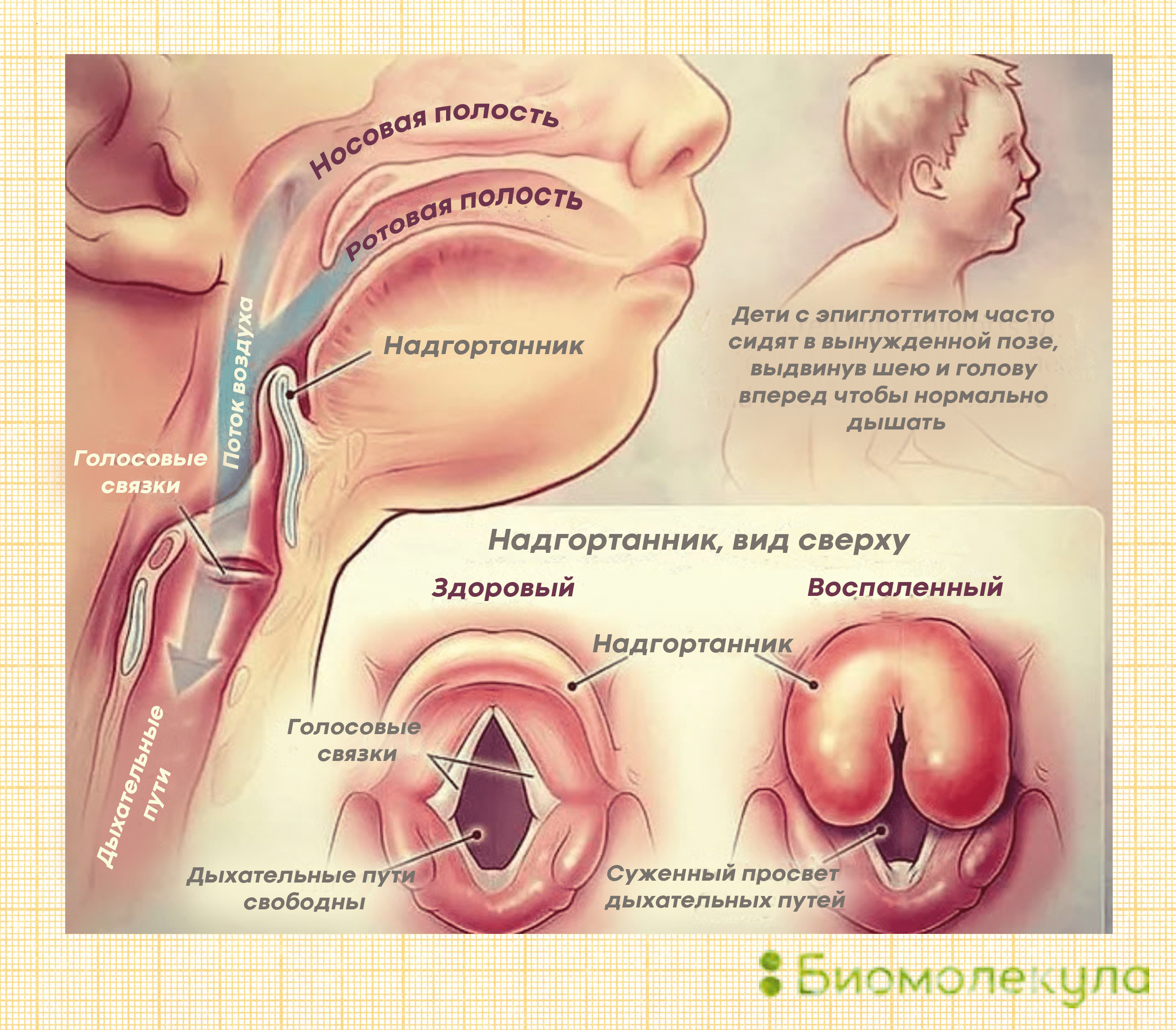
Рисунок 5. При эпиглоттите из-за воспаления надгортанник увеличивается в размере и перекрывает дыхательные пути
Дети, заболевшие эпиглоттитом, часто не успевают получить экстренную медицинскую помощь — кислородную маску или трахеостомию. Кора их головного мозга начинает отмирать из-за недостатка кислорода в течение считанных часов и уже не имеет шансов на восстановление в будущем.
Симптомы у маленьких детей нарастают очень быстро. Сперва у ребенка начинает болеть горло, повышается температура, затем ему становится трудно глотать и дышать. Облегчение часто наступает при наклоне головы вперед, поэтому у ребенка появляется характерная поза с выдвинутой головой (рис. 5). Также при эпиглоттите обычно наблюдаются: странные высокие звуки при дыхании, повышенное слюноотделение, хрипота и потеря голоса. Именно по этим признакам родители самых маленьких могут вовремя понять, с чем столкнулись. Если у ребенка есть некоторые из перечисленных симптомов, с вызовом скорой медлить нельзя.
Как лечат Hib-инфекцию и сложно ли с ней бороться
Одним из первых лечебных средств против гемофильной палочки стала гипериммунная кроличья сыворотка, содержащая антитела к антигенам полисахаридной капсулы бактерий. В 1940-е годы большим подспорьем в лечении детей, заболевших Hib-инфекцией, стало открытие новых антибиотиков. С тех пор в тактике врачей мало что изменилось. Главные составляющие успеха при ведении пациентов все те же: быстро и правильно поставленный диагноз, назначение эффективных антибиотиков и поддерживающее лечение, которое облегчает симптомы. Разве что препаратов стало гораздо больше.
Год за годом фармкомпании инвестируют деньги в создание все новых антибактериальных средств, и не просто так. Сегодня основная проблема при лечении гемофильной и многих других инфекций — растущая антибиотикорезистентность бактерий .
Первые устойчивые к антибиотикам бактерии Hib были обнаружены еще в начале 70-х годов. Сейчас на 20–60% изолятов этих бактерий традиционный ампициллин уже не действует [22]. Есть также бактерии, невосприимчивые к хлорамфениколу, тетрациклину, триметоприм-сульфаметоксазолу, некоторым цефалоспоринам (цефтриаксону) [23].
Поэтому в разных странах рекомендации по назначению антибиотиков могут различаться. Все зависит от того, к каким лекарствам чаще всего устойчивы бактерии, циркулирующие в той или иной популяции. Так, в США препараты первого ряда при эмпирическом лечении Hib-менингита (когда есть только предположение относительно возбудителя болезни) — это цефотаксим и цефтриаксон [24]. В России типичная схема отличается и включает цефотаксим плюс ампициллин. Затем, после взятия анализов, лекарства подбирают, исходя из характеристик конкретной бактерии и ее чувствительности к терапии.
В целях профилактики вторичных инфекций внутри семей или в тесных коллективах может применяться профилактика в виде приема рифампицина. Обычно ее рекомендуют, если среди контактов с первичным заболевшим есть непривитые.
Вакцинация против Hib-инфекции: какую вакцину выбрать?
Одной из главных побед в борьбе с гемофильной палочкой стала разработка эффективных вакцин против нее. Первую вакцину зарегистрировали в США в начале 80-х годов XX века. Она представляла собой очищенный полисахарид бактериальной капсулы (PRP, мы уже рассматривали его на рисунке 3), а ее главным недостатком была слабая эффективность у детей до 1,5 лет [25], ведь для малышей болезнь представляет наибольшую опасность. Поэтому довольно быстро на смену ей пришли конъюгированные препараты, содержащие помимо полисахарида белок-носитель.
Их также сначала начали применять в США, а затем и во множестве других стран. Эти вакцины оказались высокоэффективны (эффективность около 95% [26]) и действенны для детей до двух лет, и в 90-е годы их уже широко использовали для иммунизации детей младше полугода (начиная с 6 недель), тогда как исследование и внедрение полисахаридных вакцин первого поколения постепенно сошло на нет.
Сегодня на международном рынке представлен целый ряд одно- и мультикомпонентных препаратов, защищающих от Hib-инфекции. Hib-компонент в них представлен PRP-полисахаридом, соединенным с одним из трех белков-носителей. Это столбнячный анатоксин, мутантный дифтерийный анатоксин CRM197 и белковый мембранный комплекс менингококка, штамм В11 (табл. 1). Количество антигена от препарата к препарату также различается.
| Название вакцины | Инфекции, против которых защищает | Белок-носитель | Количество PRP-полисахарида гемофильной палочки типа b в одной дозе, мкг |
|---|---|---|---|
| Pentacel (Sanofi Pasteur) | Hib, дифтерия, бесклеточный коклюш, столбняк, полиомиелит | Столбнячный анатоксин | 10 |
| Pentavac (Sanofi Pasteur) | Hib, дифтерия, бесклеточный коклюш, столбняк, полиомиелит | Столбнячный анатоксин | 10 |
| Pentaxim (Sanofi Pasteur) | Hib, дифтерия, бесклеточный коклюш, столбняк, полиомиелит | Столбнячный анатоксин | 10 |
| Hexaxim (Sanofi Pasteur) | Hib, дифтерия, бесклеточный коклюш, столбняк, гепатит В, полиомиелит | Столбнячный анатоксин | 12 |
| Infanrix Hexa (GSK) | Hib, дифтерия, бесклеточный коклюш, столбняк, гепатит В, полиомиелит | Столбнячный анатоксин | 10 |
| Hexyon (Sanofi Pasteur) | Hib, дифтерия, бесклеточный коклюш, столбняк, гепатит В, полиомиелит | Столбнячный анатоксин | 12 |
| Vaxelis (MSP Vaccine Company) | Hib, дифтерия, бесклеточный коклюш, столбняк, гепатит В, полиомиелит | Белковый мембранный комплекс менингококка, штамм В11 | 3 |
| QuattVaxem (Novartis) | Hib, дифтерия, столбняк, цельноклеточный коклюш | Мутантный дифтерийный анатоксин CRM197 | 10 |
| TETRAct-HIB (Sanofi Pasteur) | Hib, дифтерия, столбняк, цельноклеточный коклюш | Столбнячный анатоксин | 10 |
| Diphtheria-Tetanus-Pertussis (whole cell) — Haemophilus influenzae type b (Serum Institute of India) | Hib, дифтерия, столбняк, цельноклеточный коклюш | Столбнячный анатоксин | 10 |
| Quinvaxem (Berna Biotech Korea Corporation, a Crucell Company) | Hib, дифтерия, столбняк, бесклеточный коклюш, гепатит В | Мутантный дифтерийный анатоксин CRM197 | 10 |
| Pentabio (Biofarma, Indonesia) | Hib, дифтерия, столбняк, цельноклеточный коклюш, гепатит В | Столбнячный анатоксин | 10 |
| Diphtheria-Tetanus-Pertussis (whole cell) — Hepatitis B — Haemophilus influenzae type b (Serum Institute of India) | Hib, дифтерия, столбняк, цельноклеточный коклюш, гепатит В | Столбнячный анатоксин | 10 |
| Tritanrix HepB+Hib (GlaxoSmithKline) | Hib, дифтерия, столбняк, цельноклеточный коклюш, гепатит В | Столбнячный анатоксин | 10 |
| Euforvac-Hib (LG Lifesciences, Republic of Korea) | Hib, дифтерия, столбняк, цельноклеточный коклюш, гепатит В | Столбнячный анатоксин | 10 |
| Easyfive-TT (Panacea Biotech, India) | Hib, дифтерия, столбняк, цельноклеточный коклюш, гепатит В | Столбнячный анатоксин | 10 |
| Shan-5 (Shantha Biotechnics Private Ltd., India) | Hib, дифтерия, столбняк, цельноклеточный коклюш | Столбнячный анатоксин | 10 |
| MenHibRix (GlaxoSmithKline) | Hib, менингококк серотипов С и Y | Столбнячный анатоксин | 2,5 |
| Comvax (Merck & Co.) | Hib, гепатит B | Белковый мембранный комплекс менингококка, штамм В11 | 7,5 |
| Hiberix (GSK) | Hib | Столбнячный анатоксин | 10 |
| Quimi-Hib (Center for Genetic Engineering and Biotechnology, Cuba) | Hib | Столбнячный анатоксин | 10 |
| Pedvax (Merck & Co.) | Hib | Белковый мембранный комплекс менингококка, штамм В11 | 7,5 |
| Vaxem Hib (Novartis Vaccines and Diagnostics s.r.l.) | Hib | Мутантный дифтерийный анатоксин CRM197 | 10 |
| ActHIB (Sanofi Pasteur) | Hib | Столбнячный анатоксин | 10 |
| Haemophilus influenzae type b (Serum Institute of India) | Hib | Столбнячный анатоксин | 10 |
Эффективность всех этих вакцин с точки зрения защиты от Hib-инфекций схожа. Некоторые исследования показывают, что вакцины, конъюгированные со столбнячным анатоксином, обладают большей иммуногенностью после завершения первичного курса иммунизации из трех доз [30], а конъюгаты с мембранными белками менингококка вызывают сильный иммунный ответ раньше других, уже после первого укола [31].
График вакцинации
Современные графики вакцинации разнятся, но в большинстве развитых стран включают 2 или 3 прививки с интервалом 4–8 недель в рамках основного курса с ревакцинацией на втором году жизни (в таблице 2 можно увидеть примеры графиков). Как правило, первую дозу вводят в возрасте двух месяцев. При этом согласно ВОЗ, начинать вакцинацию можно уже в шесть недель [37]. Более ранний ввод может снизить защитный эффект.
График с ревакцинацией позволяет сформировать длительную защиту с достаточно высоким титром антител даже через 10 лет после получения прививок [38]. Тем не менее в отдельных регионах, включая Гамбию, ревакцинация не проводится, и данные некоторых исследований говорят о том, что даже первичный набор из трех инъекций может помочь значительно снизить заболеваемость [39]. С другой стороны, иногда в регионах, где ревакцинация не проводится, возникают неожиданные всплески болезни [40]. Необходимость проведения ревакцинации в странах третьего мира, таким образом, пока остается спорной.
| Страна | Первичная вакцинация | Ревакцинация |
|---|---|---|
| Великобритания | 3 инъекции в 2, 3 и 4 месяца | 1 инъекция в 12 месяцев |
| Бельгия | 3 инъекции в 2, 3 и 4 месяца | 1 инъекция в 15 месяцев |
| Германия | 2 инъекции в 2 и 4 месяца | 1 инъекция в 11 месяцев |
| США | 2 инъекции в 2 и 4 месяца для вакцин на основе мембранного белкового комплекса менингококка 3 инъекции в 2, 4 и 6 месяцев для вакцин, где конъюгат — дифтерийный или столбнячный анатоксин |
1 инъекция в возрасте от 12 до 15 месяцев |
| Гамбия | 3 инъекции в 2, 3 и 4 месяца | Нет |
| Россия | 3 инъекции в 3, 4,5 и 6 месяцев | 1 инъекция в возрасте 18 месяцев |
Многовалентные препараты, включающие Hib-компонент, можно комбинировать между собой. Это значит, что начать курс вакцинации можно с помощью одной вакцины, а закончить с помощью другой. На эффективности это никак не отразится [41]. Сочетаемость многовалентных вакцин с одновалентными пока не так хорошо исследована, поэтому в некоторых источниках переходить на них в середине курса прививок не рекомендуют.
С точки зрения комфорта как для ребенка, так и родителя многокомпонентные препараты, защищающие сразу от 5 или 6 опасных заболеваний, предпочтительнее. Все они, включая шестивалентные [42], обеспечивают достаточную защиту от инвазивных инфекций. Здесь стоит сказать, что вакцины с цельноклеточным коклюшным компонентом в составе, как правило, чаще вызывают побочные симптомы, такие как боль и покраснение в месте инъекции . А вот вакцины, содержащие бесклеточный коклюшный компонент, связаны с накоплением меньшего количества антител против антигенов гемофильной палочки в сравнении с введением Hib-вакцины отдельно [43], хотя качество иммунизации от этого, судя по всему, и не страдает [44].
Подробно о вакцинах против коклюша и связанных с ними побочных эффектах читайте в статье «Коклюш: кашель, который убивает» [45]. — Ред.
Многие источники рекомендуют вакцинировать недоношенных детей против Hib-инфекции согласно их хронологическому (фактическому) возрасту. Однако есть данные и о том, что в 2 и 4 месяца их иммунная система реагирует на прививки слабее, чем у доношенных малышей. Это может означать, что более позднее введение прививок у них может дать более эффективную защиту от инфекции.
Схема догоняющей вакцинации для детей, не получивших вакцину ранее, будет зависеть от возраста, в котором сделан первый укол. Например, в США три дозы вакцины рекомендованы только для детей, не достигших 7 месяцев к моменту начала иммунизации. Если вакцинировать ребенка начали позже, количество доз снижается:
- с 7 до 11 месяцев это две дозы с интервалом 4 недели и бустер в 12–15 месяцев;
- с 12 до 14 месяцев — 1 доза и бустер через 8 недель;
- с 1,5 до 5 лет — всего 1 инъекция.
Детям, которые переболели Hib-инфекцией, вакцинироваться все равно нужно. Перенесенная болезнь не обеспечивает защиты от повторного тяжелого заболевания.
Неиммунизированным детям старше пяти лет и взрослым вакцинация не рекомендуется, если нет специальных показаний. Например, одну дозу вакцины следует получить при наличии асплении или перед удалением селезенки (даже если курс вакцинации был пройден), детям и подросткам — при ВИЧ-инфекции. Поводом к вакцинации может послужить также противоопухолевая терапия [37]. Три дозы должны получать все пациенты, которым проводилась трансплантация стволовых кроветворных клеток костного мозга, вне зависимости от того, были ли они привиты ранее.
Кого и чем прививают против гемофильной палочки в России
В конце 2021 года вакцина против гемофильной палочки типа b вошла в обновленный Национальный календарь профилактических прививок. С этого момента ею рекомендовано иммунизировать всех детей, а не только тех, кто относится к группе риска по гемофильной инфекции.
Три дозы вакцины малыши получают планово в 3, 4,5 и 6 месяцев. В полтора года проводится ревакцинация.
В нашей стране зарегистрированы 4 препарата зарубежного производства. Два из них защищают сразу от 5 или 6 инфекций. Это «Пентаксим» (Sanofi Pasteur) и «Инфанрикс гекса» (GSK). Два другие — «Хиберикс» (GSK) и «Акт-ХИБ» (Sanofi Pasteur) — однокомпонентные. Все четыре представлены в таблице 1.
Кроме того, с 2011 года ростовский НИИ микробиологии и паразитологии выпускает отечественную гемофильную вакцину тип b, конъюгированную со столбнячным анатоксином (1 доза содержит от 9,5 до 14,3 мкг PRP).
Безопасность Hib-вакцин
Все конъюгированные Hib-вакцины вводят внутримышечно. Младенцы получают инъекцию в переднюю мышцу бедра, а дети постарше — в дельтовидную мышцу (в плечо).
Эти прививки обычно переносятся очень легко [49]. Сообщения о тяжелых побочных эффектах, полученные за всю историю их применения, а это больше 30 лет, можно пересчитать по пальцам [49], [50], [51]. Временные легкие симптомы после вакцинации возникают, как правило, на следующий день и могут включать:
- отек, покраснение или боль в месте укола (у 5–30% вакцинированных, исчезают в течение двух суток);
- повышение температуры (у 31%);
- плаксивость (11%);
- раздражительность (10%);
- сыпь (9%).
Риск местных реакций выше после инъекции препаратами, где конъюгатом выступает столбнячный анатоксин [52]. Единственное противопоказание к иммунизации — повышенная чувствительность к компонентам препарата.
Охват вакцинами: победим ли мы Hib-инфекцию?
В 2006 году ВОЗ рекомендовала внедрение вакцинации против Hib для младенцев во всем мире вне зависимости от того, насколько широко распространена инфекция в тех или иных регионах. К сожалению, из-за сложностей в проведении широкомасштабных программ по иммунизации сегодня примерно 35% всех детей в мире все еще не имеют доступа к Hib-вакцинам. В основном это дети из стран Азии и Африки.
Большой сдвиг в деле распространения вакцин против гемофильной инфекции, особенно вакцины «Пентаксим», произошел благодаря работе альянса GAVI (Global Alliance for Vaccines and Immunisation). Это межнациональное партнерство, в котором участвуют и правительственные, и частные организации (например, ВОЗ, ЮНИСЕФ, Всемирный банк, Фонд Билла и Мелинды Гейтс), было создано в 2000 году специально для того, чтобы обеспечивать вакцинами детей из бедных стран, где иммунизация невозможна без поддержки извне. За время своего существования альянс помог предотвратить миллионы смертей от гепатита В, пневмококка, коклюша, желтой лихорадки, полиомиелита и других тяжелых болезней.
В некоторых регионах бесплатно в рамках всеобщей иммунизации прививают не всех, а только детей из групп повышенного риска — тех, для кого заражение, скорее всего, станет фатальным или будет иметь тяжелые последствия. Это недоношенные, маловесные дети, дети из домов ребенка, рожденные от ВИЧ-матерей или с подтвержденной ВИЧ-инфекцией (хотя для них эффективность вакцин может быть ниже, вакцинироваться нужно, чтобы снизить риск тяжелых инфекционных осложнений [59]), с онкологическими заболеваниями и др. Такой подход среди современных педиатров считается неоправданным, так как встреча с гемофильной палочкой может быть опасна и для здорового ребенка. Выборочная вакцинация — это полумера, вызванная недостатком финансирования, и со временем она уходит в прошлое. Так, еще в 2021 году в России прививка против Hib обязательной не была, а сегодня это изменилось, и есть все основания полагать, что широкий охват вакцинами позволит значительно сократить или даже свести на нет случаи инвазивных Hib-ассоциированных инфекций у детей, как этого удалось добиться в других странах, использующих эту тактику.
Литература
- The 1918–1919 Influenza Pandemic. (2012). AAI Newsletter. 12–13;
- Peter K. Olitsky, Frederick L. Gates. (1922). EXPERIMENTAL STUDIES OF THE NASOPHARYNGEAL SECRETIONS FROM INFLUENZA PATIENTS. Journal of Experimental Medicine. 36, 685-696;
- Wilson Smith, C.H. Andrewes, P.P. Laidlaw. (1933). A VIRUS OBTAINED FROM INFLUENZA PATIENTS. The Lancet. 222, 66-68;
- Королева М.А., Королева И.С., Грубер И.М., Черкасова Л.С. (2017). Фенотипическая характеристика и динамика чувствительности к антибактериальным препаратам российских штаммов Haemophilus influenzae (2004–2016 гг.). «Эпидемиология и вакцинопрофилактика». 2 (93), 36–44;
- Robert D. Fleischmann, Mark D. Adams, Owen White, Rebecca A. Clayton, Ewen F. Kirkness, et. al.. (1995). Whole-Genome Random Sequencing and Assembly of Haemophilus influenzae Rd. Science. 269, 496-512;
- Kentaro Ueno, Junichiro Nishi, Naoko Imuta, Koichi Tokuda, Yoshifumi Kawano. (2010). Presence of multiple copies of capsulation loci in invasiveHaemophilus influenzaetype b (Hib) strains in Japan before introduction of the Hib conjugate vaccine. Microbiology and Immunology. 54, 160-163;
- S L Kaplan, E O Mason, B L Wiedermann. (1983). Role of adherence in the pathogenesis of Haemophilus influenzae type b infection in infant rats. Infect Immun. 42, 612-617;
- William G. Adams. (1993). Decline of Childhood Haemophilus influenzae Type b (Hib) Disease in the Hib Vaccine Era. JAMA. 269, 221;
- Stephen L. Cochi. (1985). Immunization of US Children With Hemophilus influenzae Type b Polysaccharide Vaccine. JAMA. 253, 521;
- James P Watt, Lara J Wolfson, Katherine L O'Brien, Emily Henkle, Maria Deloria-Knoll, et. al.. (2009). Burden of disease caused by Haemophilus influenzae type b in children younger than 5 years: global estimates. The Lancet. 374, 903-911;
- Causes, How It Spreads, and People at Increased Risk. (2022). CDC;
- R. A. Insel, M. Amstey, M. E. Pichichero. (1985). Postimmunization Antibody to the Haemophilus influenzae Type b Capsule in Breast Milk. Journal of Infectious Diseases. 152, 407-408;
- Murphy T.V., Clements J.F., Petroni M., Coury S., Stetler L. (1989). Haemophilus influenzae type b in respiratory secretions. Pediatr. Infect. Dis J. 8(3), 148–151;
- Andrew Howard, Darius Viskontas, Charles Sabbagh. (1999). . J Pediatr Orthop. 19, 705;
- B Ambati. (2000). Periorbital and orbital cellulitis before and after the advent of haemophilus influenzae type B vaccination. Ophthalmology. 107, 1450-1453;
- Менингит: многоликий убийца;
- Meenakshi Ramakrishnan, Aaron J Ulland, Laura C Steinhardt, Jennifer C Moïsi, Fred Were, Orin S Levine. (2009). Sequelae due to bacterial meningitis among African children: a systematic literature review. BMC Med. 7;
- Karen Edmond, Andrew Clark, Viola S Korczak, Colin Sanderson, Ulla K Griffiths, Igor Rudan. (2010). Global and regional risk of disabling sequelae from bacterial meningitis: a systematic review and meta-analysis. The Lancet Infectious Diseases. 10, 317-328;
- JAY D. WENGER. (1998). Epidemiology of Haemophilus influenzae type b disease and impact of Haemophilus influenzae type b conjugate vaccines in the United States and Canada. The Pediatric Infectious Disease Journal. 17, S132-S136;
- Пневмококк и его инфекции;
- Timothy F. Murphy, Howard Faden, Lauren O. Bakaletz, Jennelle M. Kyd, Arne Forsgren, et. al.. (2009). Nontypeable Haemophilus influenzae as a Pathogen in Children. Pediatric Infectious Disease Journal. 28, 43-48;
- Wang S.R., Lo W.T., Chou C.Y. et al. (2008). Low rate of nasopharyngeal carriage and high rate of ampicillin resistance for Haemophilus influenzae among healthy children younger than 5 years old in northern Taiwan. Journal of Microbiology, Immunology, and Infection. 41(1), 32–40;
- Young Ho Kwak, He Sun Jung, Su Eun Park, Jin Young Park, Eui Chong Kim, et. al.. (2000). Serotypes and antimicrobial susceptibility in clinical isolates ofHaemophilus influenzaefrom Korean children in prevaccination era. J Korean Med Sci. 15, 616;
- Red Book (2021–2024): Report of the Committee on Infectious Diseases / ed. by Kimberlin D.W., Barnett E.D., Lynfield R., Sawyer M.H. American Academy of Pediatrics, 2021;
- Heikki Peltola, Helena Käyhty, Marita Virtanen, P. Helena Mäkelä. (1984). Prevention ofHemophilus influenzaeType B Bacteremic Infections with the Capsular Polysaccharide Vaccine. N Engl J Med. 310, 1561-1566;
- Heikki Peltola, Preben Aavitsland, Kjeld Gade Hansen, Kristín E. Jónsdóttir, Hanne Nøkleby, Victoria Romanus. (1999). Perspective: A Five‐Country Analysis of the Impact of Four DifferentHaemophilus influenzaeType b Conjugates and Vaccination Strategies in Scandinavia. J INFECT DIS. 179, 223-229;
- Dominic F. Kelly, E. Richard Moxon, Andrew J. Pollard. (2004). Haemophilus influenzae type b conjugate vaccines. Immunology. 113, 163-174;
- Dan M. Granoff, K. Lynn Cates. (1985). Haemophilus influenzae type b polysaccharide vaccines. The Journal of Pediatrics. 107, 330-336;
- Martha Lepow, Martin Randolph, Richard Cimma, Douglas Larsen, Matthew Rogan, et. al.. (1986). Persistence of antibody and response to booster dose of Haemophilus influenzae type b polysaccharide diphtheria toxoid conjugate vaccine in infants immunized at 9 to 15 months of age. The Journal of Pediatrics. 108, 882-886;
- Michael D. Decker, Kathryn M. Edwards, Roberta Bradley, Pamela Palmer. (1992). Comparative trial in infants of four conjugate Haemophilus influenzae type b vaccines. The Journal of Pediatrics. 120, 184-189;
- D.M. Granoff, E.L. Anderson, M.T. Osterholm, S.J. Holmes, J.E. McHugh, et. al.. (1992). Differences in the immunogenicity of three Haemophilus influenzae type b conjugate vaccines in infants. The Journal of Pediatrics. 121, 187-194;
- T NOLAN. (2004). Antibody persistence, PRP-specific immune memory, and booster responses in infants immunised with a combination DTPa?HBV?IPV/Hib vaccine. Vaccine. 23, 14-20;
- P. T. Heath, R. Booy, H. Griffiths, E. Clutterbuck, H. J. Azzopardi, et. al.. (2000). Clinical and Immunological Risk Factors Associated withHaemophilus influenzaeType b Conjugate Vaccine Failure in Childhood. CLIN INFECT DIS. 31, 973-980;
- Shamez Ladhani, Ray Borrow, Paul T. Heath, Mary E. Ramsay, Robert Booy. (2010). Low serum serotype-specific pneumococcal antibody concentrations in young children with Haemophilus influenzae serotype b (Hib) vaccine failure. Vaccine. 28, 4440-4444;
- Shamez N. Ladhani, Sonia Davila, Martin L. Hibberd, Paul T. Heath, Mary E. Ramsay, et. al.. (2010). Association between Single‐Nucleotide Polymorphisms inMal/TIRAPandInterleukin‐10Genes and Susceptibility to InvasiveHaemophilus influenzaeSerotype b Infection in Immunized Children. CLIN INFECT DIS. 51, 761-767;
- Marina Cerquetti, Rita Cardines, Marta Luisa Ciofi degli Atti, Maria Giufré, Antonino Bella, et. al.. (2005). Presence of Multiple Copies of the Capsulation b Locus in InvasiveHaemophilus influenzaeType b (Hib) Strains Isolated from Children with Hib Conjugate Vaccine Failure. J INFECT DIS. 192, 819-823;
- WHO Position Paper on Haemophilus influenzae type b conjugate vaccines. (2006). WHO;
- P.Helena Mäkelä, Helena Käyhty, Tuija Leino, Kari Auranen, Heikki Peltola, et. al.. (2003). Long-term persistence of immunity after immunisation with Haemophilus influenzae type b conjugate vaccine. Vaccine. 22, 287-292;
- Richard A Adegbola, Ousman Secka, George Lahai, Nellie Lloyd-Evans, Alpha Njie, et. al.. (2005). Elimination of Haemophilus influenzae type b (Hib) disease from The Gambia after the introduction of routine immunisation with a Hib conjugate vaccine: a prospective study. The Lancet. 366, 144-150;
- Grant A. Mackenzie, Usman N.A. Ikumapayi, Susana Scott, Olubukola Idoko, Aderonke Odutola, et. al.. (2015). Increased Disease due to Haemophilus influenzae Type b. Pediatric Infectious Disease Journal. 34, e107-e112;
- Edwin L. Anderson. (1995). Interchangeability of Conjugated Haemophilus influenzae Type b Vaccines in Infants. JAMA. 273, 849;
- Fred Zepp, Heinz-Josef Schmitt, Jan Cleerbout, Thomas Verstraeten, Lode Schuerman, Jeanne-Marie Jacquet. (2009). Review of 8 years of experience with Infanrix hexa™ (DTPa–HBV–IPV/Hib hexavalent vaccine). Expert Review of Vaccines. 8, 663-678;
- Juhani Eskola, Rose-Marie Ölander, Tapani Hovi, Leila Litmanen, Sara Peltola, Helena Käyhty. (1996). Randomised trial of the effect of co-administration with acellular pertussis DTP vaccine on immunogenicity of Haemophilus influenzae type b conjugate vaccine. The Lancet. 348, 1688-1692;
- Philippe A. Denoël, David Goldblatt, Isabel de Vleeschauwer, Jeanne-Marie Jacquet, Michael E. Pichichero, Jan T. Poolman. (2007). Quality of theHaemophilus influenzaeType b (Hib) Antibody Response Induced by Diphtheria-Tetanus-Acellular Pertussis/Hib Combination Vaccines. Clin Vaccine Immunol. 14, 1362-1369;
- Коклюш: кашель, который убивает;
- Вакцинация перед школой: гайд для родителей;
- Mathuram Santosham, Janet A. Englund, Pamela McInnes, Janne Croll, Claudette M. Thompson, et. al.. (2001). Safety and antibody persistence following Haemophilus influenzae type b conjugate or pneumococcal polysaccharide vaccines given before pregnancy in women of childbearing age and their infants. The Pediatric Infectious Disease Journal. 20, 931-940;
- JANET A. ENGLUND, W. PAUL GLEZEN, CLAUDETTE THOMPSON, RAANA ANWARUDDIN, CONNIE S. TURNER, GEORGE R. SIBER. (1997). Haemophilus influenzae type b-specific antibody in infants after maternal immunization. The Pediatric Infectious Disease Journal. 16, 1122-1130;
- Recommendations for Use of Haemophilus b Conjugate Vaccines and a Combined Diphtheria, Tetanus, Pertussis, and Haemophilus b Vaccine Recommendations of the Advisory Committee on Immunization Practices (ACIP). (1993). CDC;
- Kathleen R. Stratton. (1994). Adverse Events Associated With Childhood Vaccines Other Than Pertussis and Rubella. JAMA. 271, 1602;
- Pedro L. Moro, Christopher Jankosky, David Menschik, Paige Lewis, Jonathan Duffy, et. al.. (2015). Adverse Events following Haemophilus influenzae Type b Vaccines in the Vaccine Adverse Event Reporting System, 1990-2013. The Journal of Pediatrics. 166, 992-997;
- Bo A. Claesson, Birger Trollfors, Teresa Lagergård, Nina Knutsson, Rachel Schneerson, John B. Robbins. (2005). ANTIBODIES AGAINST HAEMOPHILUS INFLUENZAE TYPE b CAPSULAR POLYSACCHARIDE AND TETANUS TOXOID BEFORE AND AFTER A BOOSTER DOSE OF THE CARRIER PROTEIN NINE YEARS AFTER PRIMARY VACCINATION WITH A PROTEIN CONJUGATE VACCINE. Pediatric Infectious Disease Journal. 24, 463-464;
- Shamez N. Ladhani, Sarah Collins, Anna Vickers, David J. Litt, Carina Crawford, et. al.. (2012). InvasiveHaemophilus influenzaeSerotype e and f Disease, England and Wales. Emerg. Infect. Dis.. 18, 725-732;
- Michael G. Bruce, Tammy Zulz, Carolynn DeByle, Ros Singleton, Debby Hurlburt, et. al.. (2013). Haemophilus influenzae Serotype a Invasive Disease, Alaska, USA, 1983–2011. Emerg. Infect. Dis.. 19, 932-937;
- Marc Lipsitch. (1999). Bacterial Vaccines and Serotype Replacement: Lessons fromHaemophilus influenzaeand Prospects forStreptococcus pneumoniae. Emerg. Infect. Dis.. 5, 336-345;
- AR Foxwell, AW Cripps, KBG Dear. (2003) Haemophilus influenzae oral whole cell vaccination for preventing acute exacerbations of chronic bronchitis;
- Timothy F. Murphy. (2015). Vaccines for Nontypeable Haemophilus influenzae: the Future Is Now. Clin. Vaccine Immunol.. 22, 459-466;
- Timothy F Murphy. (2005). Vaccine development for non-typeableHaemophilus influenzaeandMoraxella catarrhalis: progress and challenges. Expert Review of Vaccines. 4, 843-853;
- SHABIR A. MADHI, KAREN PETERSEN, MANIKANT KHOOSAL, ROBIN E. HUEBNER, NONTOMBI MBELLE, et. al.. (2002). Reduced effectiveness of Haemophilus influenzae type b conjugate vaccine in children with a high prevalence of human immunodeficiency virus type 1 infection. The Pediatric Infectious Disease Journal. 21, 315-321;
- Prstková K. Zubní kámen: bakalářská práce. — Brno, 2008. — 69 p.;
- Абрамцева М.В., Тарасов А.П., Немировская Т.И., Ковтун В.П., Волков В.А., Мовсесянц А.А. (2017). Гемофильная инфекция типа b. заболеваемость и вакцинопрофилактика. БИОпрепараты. «Профилактика, диагностика, лечение». 2, 78–86;
- Heikki Peltola. (2000). Worldwide Haemophilus influenzae Type b Disease at the Beginning of the 21st Century: Global Analysis of the Disease Burden 25 Years after the Use of the Polysaccharide Vaccine and a Decade after the Advent of Conjugates. Clin Microbiol Rev. 13, 302-317;
- Srinivas Acharya Nanduri, Andrea R. Sutherland, Lance K. Gordon, Mathuram Santosham. (2018). Haemophilus influenzae Type b Vaccines. Plotkin's Vaccines. 301-318.e10.