Генетические заболевания породистых кошек
23 декабря 2024
Генетические заболевания породистых кошек
- 798
- 2
- 2
«Cat Caught in a Rainbow» — картина известного британского художника Луиса Уильяма Уэйна (1860–1939).
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Кошки живут бок о бок с человеком уже очень давно. Многие люди относятся к этим животным с особой теплотой и любовью. Я, кстати, в их числе. Поэтому, мне захотелось написать статью об угрозах, которые могут подстерегать наших питомцев. В ней перечисляются наиболее распространенные генетические заболевания породистых кошек, описываются механизмы возникновения мутаций и последствия, к которым они могут привести.
Прочитав эту статью, хозяева могут узнать о возможных рисках для здоровья своих питомцев и задуматься над проведением генетического тестирования для того, чтобы предотвратить или отсрочить развитие заболевания. Тестирование особенно важно, если владелец хочет заниматься разведением породы своего питомца. При правильном использовании, генетическое тестирование может предотвратить появление больных животных, что приведет к снижению частоты мутации в популяции и, возможно, к окончательному искоренению заболевания.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Школьная» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Одомашнивание кошки произошло примерно 9500 лет назад на Ближнем Востоке. С тех пор кошки стали верным спутником человека. Они внесли большой вклад в развитие культуры многих цивилизаций: успели побывать воплощением богини у египтян, олицетворением любви у викингов, символом благополучия на Руси…
Этот список можно продолжать еще долго. А кошки тем временем продолжают жить с человеком бок о бок. Но годы идут и все вокруг меняется. У викингов и жителей Древней Руси не было генетического тестирования, которое могло бы обнаружить нарушения в геноме их питомцев. А вот у нас оно есть практически в каждой ветеринарной клинике.
Для проведения генетического тестирования нужен образец ДНК животного, который часто берут из крови или из буккального эпителия, мазка внутренней стороны щеки. Потом в лаборатории методом ПЦР (полимеразной цепной реакции) увеличивают число копий ДНК. Полученные копии генома проверяют на наличие определенных мутаций. Генетическое тестирование проводится для всех заболеваний, описанных в статье ниже.
Повесть о нашем наследии
Понимание данных терминов поможет читателю оценить частоту проявления заболеваний, описанных в статье.
Тип наследования — это определение наследуемого признака по следующим критериям:
-
расположение аллеля, определяющего признак (в половой хромосоме или в аутосоме);
-
рецессивность или доминантность аллеля.
Описанные в этой статье мутации, которые становятся причинами заболеваний, касаются только аллелей, лежащих в аутосомах. Следовательно, они все не сцеплены с полом.
А вот про доминантность и рецессивность хочется написать подробнее.
Для начала, гомозигота (АА или аа) — это клетка или организм (потому как организм состоит из клеток), в наследственном наборе у которого гомологичные (парные) хромосомы несут одну и ту же форму (аллель) данного гена. А гетерозигота (Аа) — это клетка или организм, в наследственном наборе у которого гомологичные хромосомы несут разные аллели данного гена.
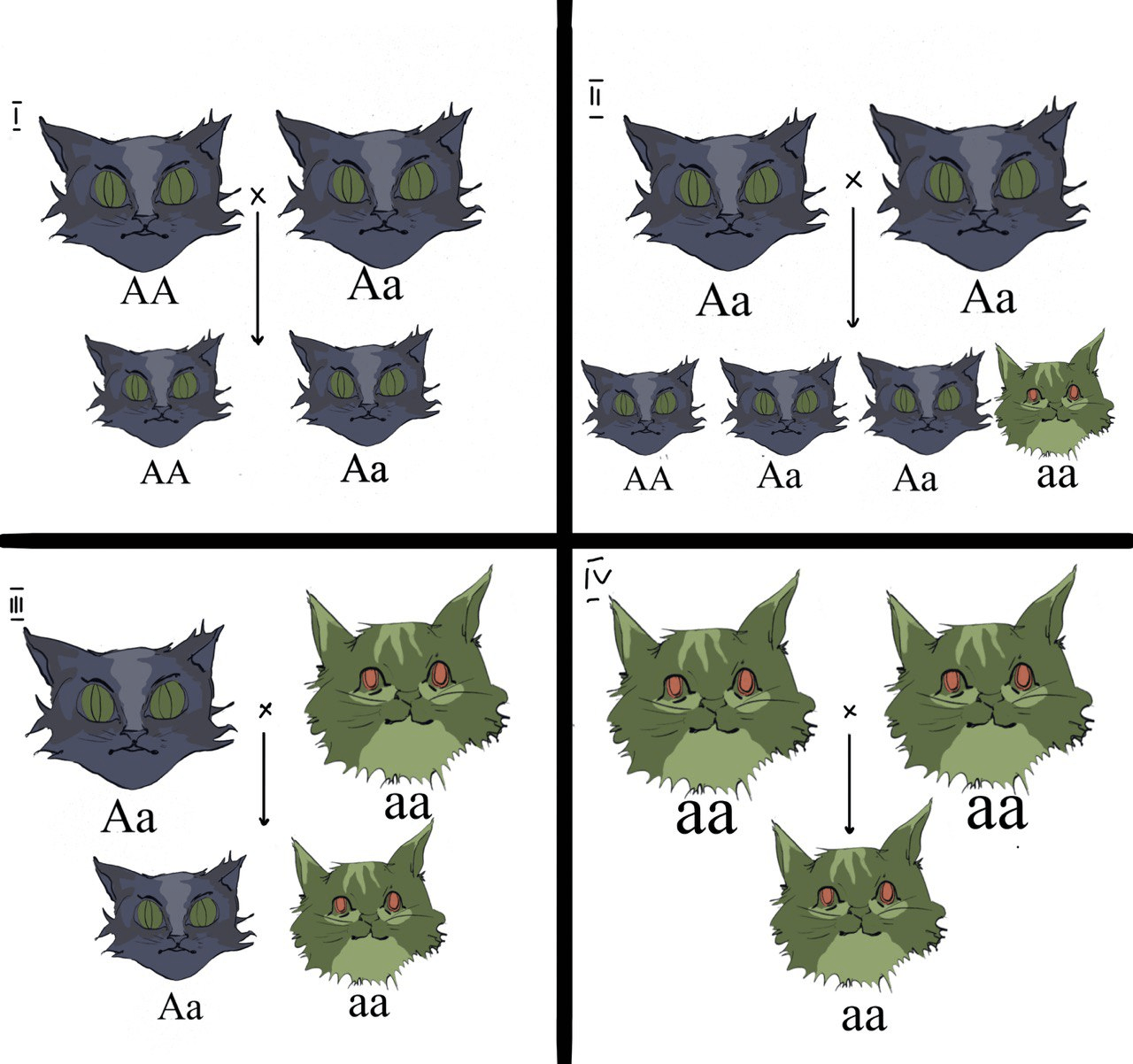
Рисунок 1а. Аутосомно-доминантный тип наследования. Черные коты — больные, зеленые — здоровые. Крестик стоит между родителями, а стрелка указывает на их потомство.
рисунок автора
Доминантность — форма «взаимоотношений» между аллелями одного гена, при которой один из них (доминантный) подавляет проявление другого (рецессивного) и таким образом определяет проявление признака как у доминантных гомозигот (АА), так и у гетерозигот (Аа) (рис. 1а). Таким образом, при аутосомно-доминантном типе наследования признак будет проявляться во всех поколениях, кроме случая скрещивания двух гомозигот, рецессивных по этому признаку (аа) (рис. 1а, случай 4).
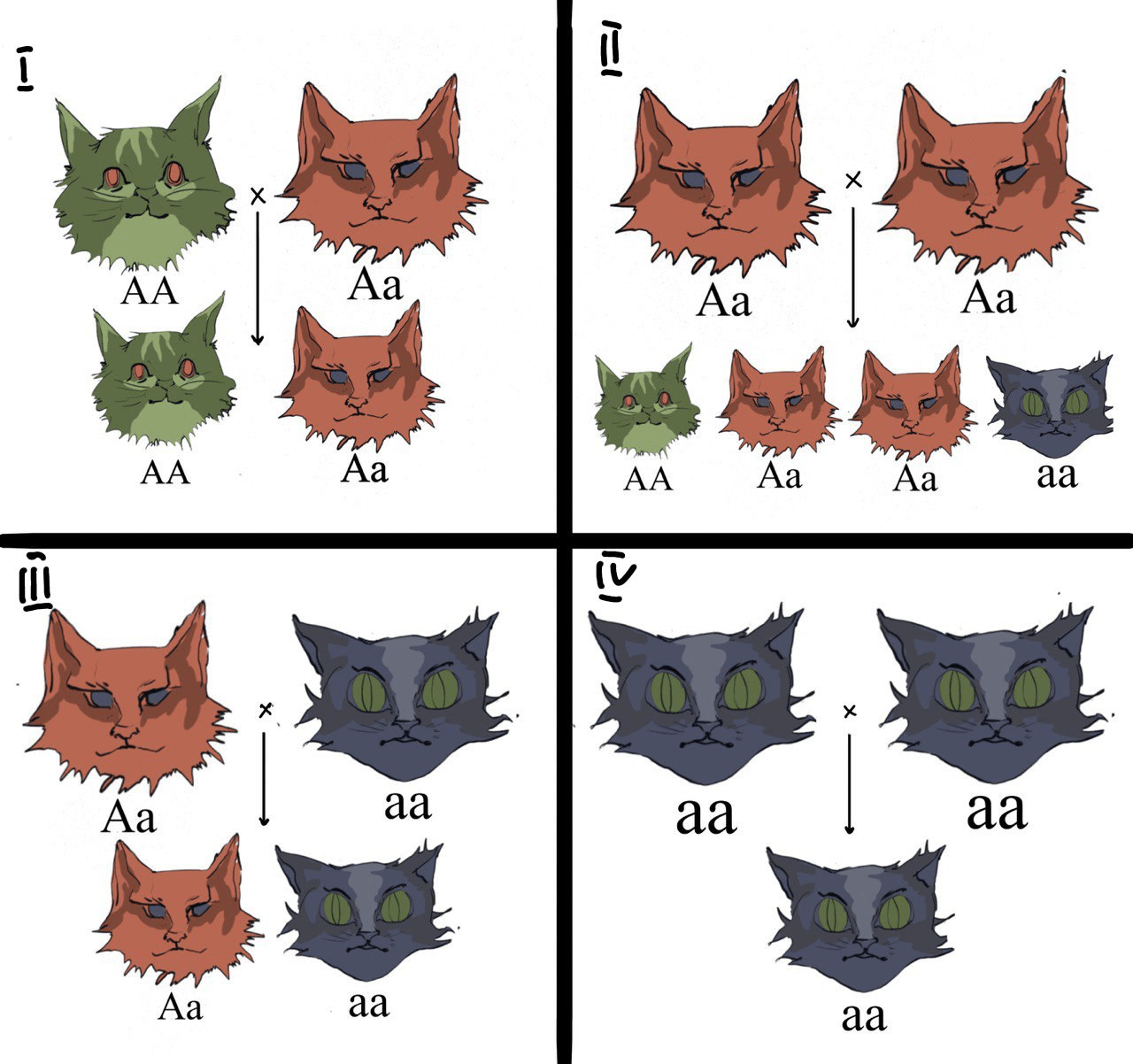
Рисунок 1б. Аутосомно-рецессивный тип наследования. Черные коты — больные, зеленые — здоровые, красные — носители заболевания. Крестик стоит между родителями, а стрелка указывает на их потомство.
рисунок автора
В случае аутосомно-рецессивного типа наследования признак может не проявляться у одних поколений и проявиться у других. Проявляется он только у тех, у кого оба аллеля рецессивные. При скрещивании доминантных гомозигот (АА) с другой доминантной гомозиготой или с гетерозиготой (Аа), заболевание вообще не проявится (рис. 1б, случай 1). Если оба родители гетерозиготы (Aa), они являются носителями рецессивного аллеля, но обладают доминантным признаком. При скрещивании Aa и Aa, ½ потомков будут носителями заболевания, ¼ заболевшими и ¼ здоровыми (рис. 1б, случай 2). При скрещивании рецессивной гомозиготы (аа) с гетерозиготой (Аа) у ½ рецессивный аллель гена проявит себя у половины потомков (рис. 1б, случай 3) [1].
В общем, заболевания, которые наследуются по аутосомно-доминантному типу наследования, встречаются намного чаще, чем те, которые наследуются по аутосомно-рецессивному.
Ну что ж, а теперь начнем!
Сердцу не прикажешь
Гипертрофическая кардиомиопатия — это заболевание, характеризующееся утолщением стенки левого и/или правого желудочка. Помимо кошек, оно также очень часто встречается у людей. Возможно, поэтому, пока я искала материалы для своей статьи, мне показалось, что исследований по именно этой кошачьей (и не только) болезни оказалось больше всего. Кроме того, это самая распространенная болезнь сердца у кошек, она поражает до 15% популяции.
Сердце — это высокоточная и самостоятельная машина, но, из-за одной небольшой поломки, в его работе все может пойти не так. А дело вот в чем. В результате мутации, в гене MYBPC3 происходит замена аланина на пролин (c.91 G > C). Этот ген кодирует белок С, связывающий сердечный миозин [2]. Миозин совместно с актином образует миофибриллы, которые обеспечивают сокращение кардиомиоцита, мышечной клетки сердца. Из-за замены одной из составляющих белка, его функции, конечно же, нарушаются и кардиомиоциты теряют упорядоченность своей структуры. В результате, кардиомиоциты сокращаются интенсивнее, чем обычно. Из-за такого избыточного напряжения, мышечные стенки сердца гипертрофируются, то есть чрезмерно увеличивается в объеме.
Тип наследования заболевания аутосомно-доминантный. У кошек породы мейн-кун, гетерозиготных по этой мутации, чаще всего не развивается утолщение стенок, и заболевание протекает без симптомов. А вот у гомозиготных развивается утолщение стенки со всеми из этого вытекающими [3].
Во время систолы (сокращения правого и левого желудочка) передняя створка митрального клапана (клапан между левым предсердием и левым желудочком) контактирует с утолщенной межжелудочковой стенкой. Таким образом создается препятствие выбросу крови из левого желудочка (рис. 2).
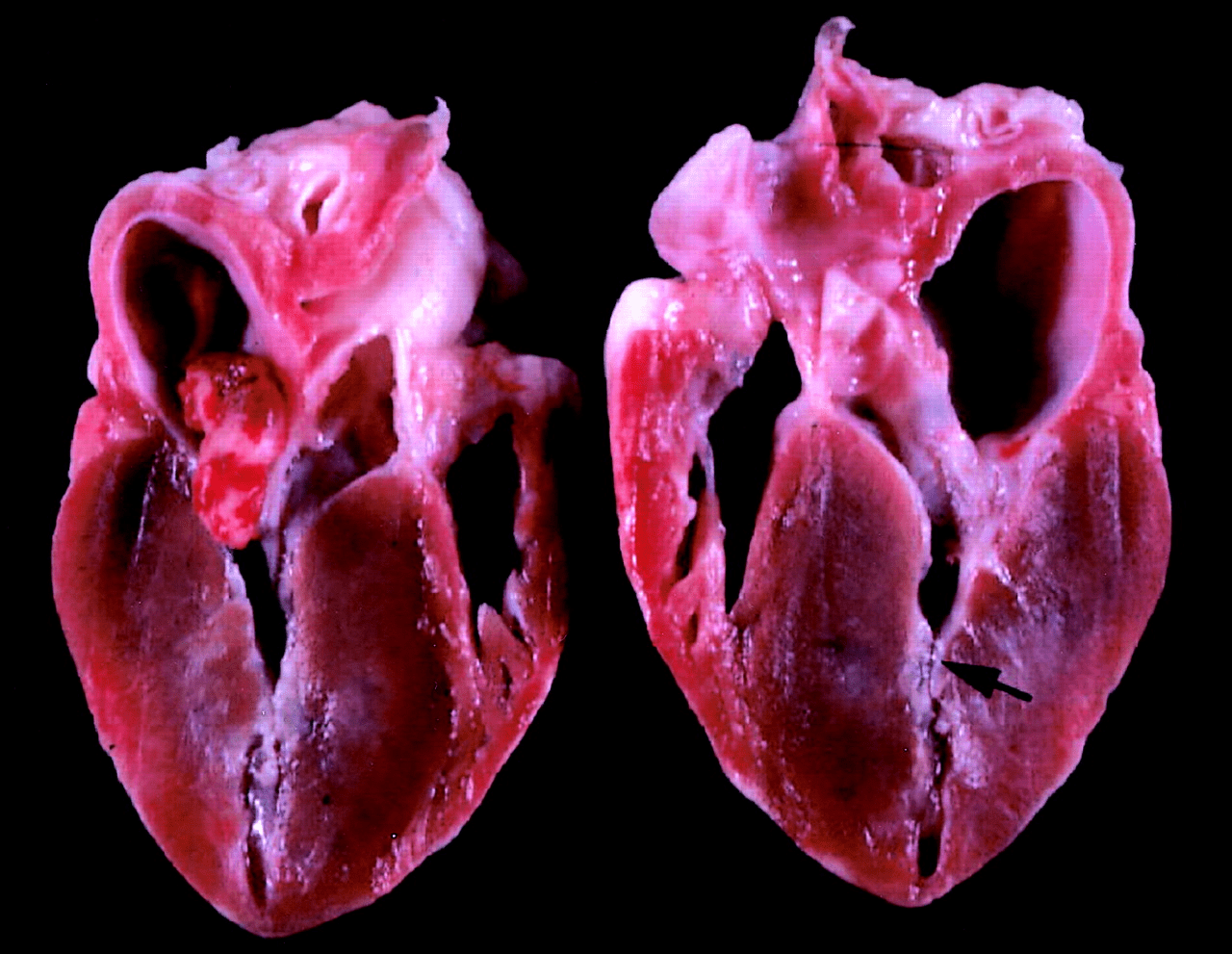
Рисунок 2. Сердце мейн-куна с тяжелой формой гипертрофической кардиомиопатии. Черная стрелка указывает на гипертрофированную стенку левого желудочка.
Развивается синдром малого выброса — обмороки, одышка, сердечные и грудные боли. Может возникнуть осложнение в виде тромбоэмболии (закупорки кровеносных сосудов тромбом).
Заболевание проявляется в самом начале жизни животного, начиная с полугода. Лечение у кошек медикаментозное и напрямую зависит от своевременности диагностики. При тромбоэмболии дополнительно включают антиагреганты, снижающие свертываемость крови. Если заболевание обнаружено на ранних стадиях, то при адекватном лечении, питании и соблюдении режима продолжительность жизни практически не сокращается.
Гипертрофическая кардиомиопатия встречается чаще всего у мейн-кунов, но также и у пород: рэгдолл, скоттиш-фолд, оцикет, британская, американская короткошерстная и бенгальская кошки.
Киста популяции или загадка полицистина-1
Поликистоз почек по праву считается самым распространенным заболеванием у кошек, встречается у 20% популяции кошек. Оно характеризуется развитием кист, которые увеличиваются в количестве и размере пропорционально с возрастом. Кисты — это заполненные жидкостью мешочки, которые сами по себе являются доброкачественными образованиями, но, если становятся слишком большими, могут нарушить работу близлежащих органов. В результате мутации, о которой рассказано ниже, кисты появляются в основном почках (рис. 3). Но также они могут появляться в головном мозге, щитовидной железе, яичниках и тд.
Тип наследования заболевания аутосомно-доминантный. В гене PKD1 кошек происходит мутация c.10063 C > A (замена цитозина на аденин). Эта мутация приводит к преждевременному появлению стоп-кодона в информационной РНК. Процесс трансляции из-за этого нарушается, синтез белка останавливается слишком рано. Это приводит к потере 25% С-конца белка полицистина-1.
Пока неизвестно как точно мутировавший полицистин-1 влияет на появление кист в организме кошек. Есть предположения про его анти-апоптическую активность. Это значит, что он мешает организму самому избавляться от поломавшихся клеток, и те остаются дальше бесконтрольно делиться. Возможно также, что он влияет на пролиферацию (разрастание ткани путем деления) и дифференцировку клеток эпителия почечных канальцев. Пролиферацию он стимулирует, а вот дифференцировку клеток нарушает, вызывая дегенерацию почечных канальцев и нарушая их функции. Таким образом, заболевание может быть вызвано совокупностью этих и других факторов [3].
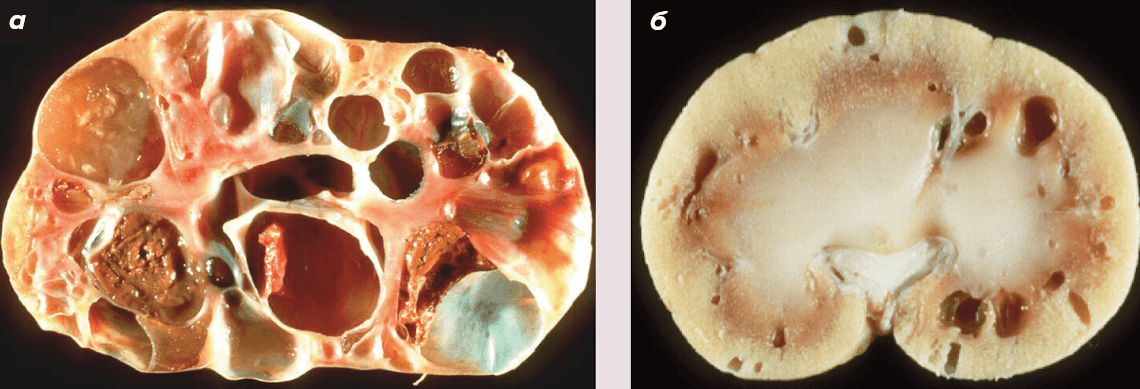
Рисунок 3. Тяжелая (а) и легкая (б) форма поликистоза почек.
Интересно, что поликистоз почек сначала обнаружили только у персидских кошек. Но после того, как люди научились делать генетические тесты, оказалось, что все особи тех пород, которые получились путем скрещивания с персами, тоже рискуют заболеть. Например, такие породы как шотландская вислоухая кошка и селкирк-рекс [4].
Симптомами могут быть: плохое настроение, анорексия, потеря веса, повышенная жажда, изменение частоты мочеиспускания, повышение артериального давления, цианоз (посинение) слизистых оболочек [7].
Важно! Точная причина поликистоза, как было сказано ранее, пока неизвестна. Поэтому и лекарств для полного выздоровления нет. Но при своевременной диагностике, в том числе с участием генетического тестирования, можно подобрать препараты, которые продлят жизнь любимого питомца и улучшат ее качество [8].
Битва на мусорной свалке
Мукополисахаридоз VI типа — это одна из лизосомальных болезней накопления , считается, что примерно 6% мировой популяции кошек являются ее носителями. Лизосомы в клетках выполняют функцию «мусорщиков». Это небольшие одномембранные пузырьки с кислой средой и множеством разных ферментов внутри. Они поглощают вредные для клетки продукты обмена, с помощью гидролиза расщепляют их на мелкие молекулы и аккуратно выводят в межклеточное пространство. В этих процессах участвует множество ферментов (гидролаз), которые катализируют тот самый гидролиз [9]. В результате дефицита одного из этих ферментов расщепить «мусор» до конца не удается и он начинает накапливаться внутри клеток.
Про методы лечения лизосомальных болезней накопления у людей можно почитать в статье «“Обличая порок стяжательства”: можно ли победить болезни накопления генной терапией?». — Ред.
Заболевание наследуется по аутосомному-рецессивному типу. У кошек, мутация заключается в замене азотистых оснований в гене ARSB c.1427 T > C (тимин мутирует в цитозин). Из-за этого в процессе синтеза фермента арилсульфатазы В происходит аминокислотная замена, лейцин заменяется на пролин. Этот фермент как раз один из тех гидролаз, которые катализируют гидролиз в лизосомах. Но после таких изменений, фермент не будет работать и ненужные продукты метаболизма,которые должны были расщепиться, будут копиться в клетках [10].
Заболевание характеризуется накоплением гликозаминогликанов (мукополисахаридов) во многих клетках тела, в частности клетках печени, кожи, мышц, костного мозга и лейкоцитах [10].
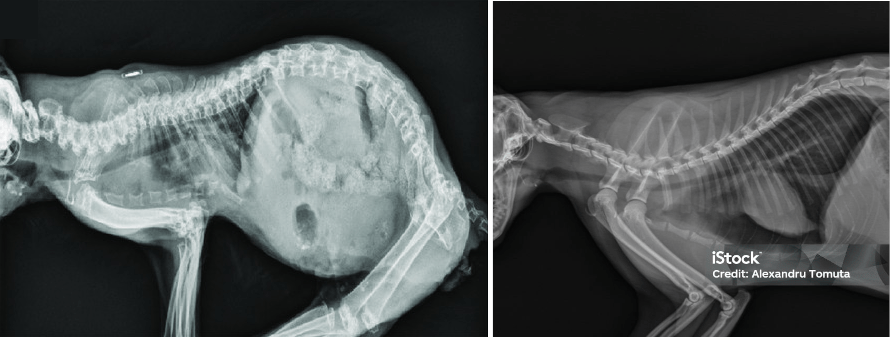
Первые симптомы проявляются обычно в возрасте 6–8 недель, когда деформация скелета приводит к развитию «крадущейся» походки (рис. 4, котик начинает передвигаться на полусогнутых лапах, как будто крадется), и прогрессируют до 9 месяцев, после чего состояние может стабилизироваться. Мукополисахаридоз часто фенотипически выражается у кошек в виде уплощенной мордочки с широко расставленными глазами с помутневшей роговицей и маленькими ушами. Итого, основные симптомы — это замедление роста, деформация скелета, увеличение печени и помутнение роговицы [12].
Заболевание, к сожалению, пока что не лечится полностью. Лечение в основном симптоматическое, например, обезболивание и физиотерапия.Чаще всего болеют сиамские и домашние короткошерстные кошки.
Кровь не водица
Дефицит эритроцитарной пируваткиназы кошек характеризуется анемией. Анемия — это состояние, вызванное пониженным числом эритроцитов или уровнем концентрации гемоглобина в них. В случае дефицита эритроцитарной пируваткиназы анемия вызвана недостаточной активностью фермента пируваткиназы.
У эритроцитов млекопитающих, в процессе созревания, теряется ядро и клеточные органеллы. Это дает эритроцитам больше места для хранения гемоглобина, нужного для увеличения эффективности транспорта кислорода. Но отсутствие ядра имеет также и негативные последствия. Например, эритроцит не может самостоятельно делиться и восстанавливаться, ведь у него нет с собой своей ДНК. Кроме того, у них нет митохондрий и единственным путем синтеза АТФ становится гликолиз. Фермент пируваткиназа играет очень важную роль в этом процессе. Во время последнего этапа гликолиза она катализирует превращение фосфоенолпирувата в пируват [13]. В нарушении работы пируваткиназы как раз и заключается причина анемии.
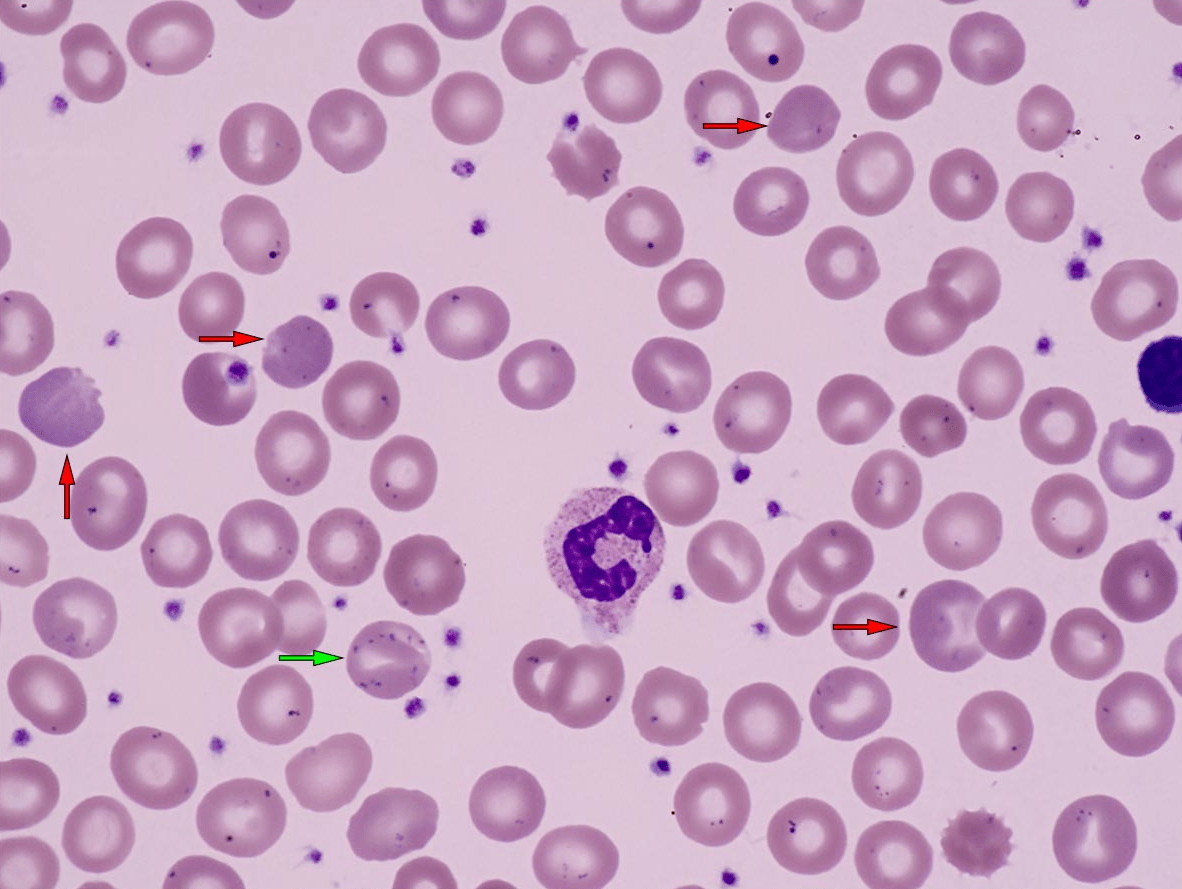
Рисунок 5. Последствия нарушения метаболизма эритроцитов (красные стрелки) — незрелые эритроциты в крови (полихромазия), эритроциты неправильного размера (анизоцитоз).
Тип наследования заболевания аутосомно-рецессивный. Оно возникает в результате мутации гена PKLR, кодирующего фермент пируваткиназу. В гене PKLR происходит мутация c.799 C > T (замена цитозина на тимин). Кошка с таким мутантным геном продуцирует мРНК печени и крови с делецией из 13 пар нуклеотидов. Происходит сдвиг рамки считывания, и появляется преждевременный стоп-кодон (см. «Киста популяции или загадка полицистина-1»).
Из-за этой мутации пируваткиназа не синтезируется до конца, ее функции нарушаются и гликолиз становится менее эффективным [14]. В результате, в эритроцитах синтезируется меньше АТФ, их продолжительность жизни снижается. А как мы знаем, эритроциты не могут сами, с помощью деления, увеличивать свою численность. И если они умирают быстрее, чем нужно, их общее количество уменьшается. Так организм и приходит к состоянию нехватки эритроцитов, анемии. Доставка кислорода к клеткам тела сильно затрудняется, в общем, беда.
Кроме того, из-за повышения смертности эритроцитов, в крови происходит увеличение количества продуктов их распада. Например, один из опасных продуктов распада — билирубин (рис. 6). Это токсичное вещество желто-коричневого цвета, которое образуется в эритроцитах в процессе окисления гем в составе гемоглобина. Токсичность билирубина заключается в том, что при накоплении его в подкожном жире и нервной ткани, сильно нарушаются процессы синтеза АТФ. Клеткам становится труднее вырабатывать энергию для своей жизнедеятельности. Это состояние называется желтухой [15].
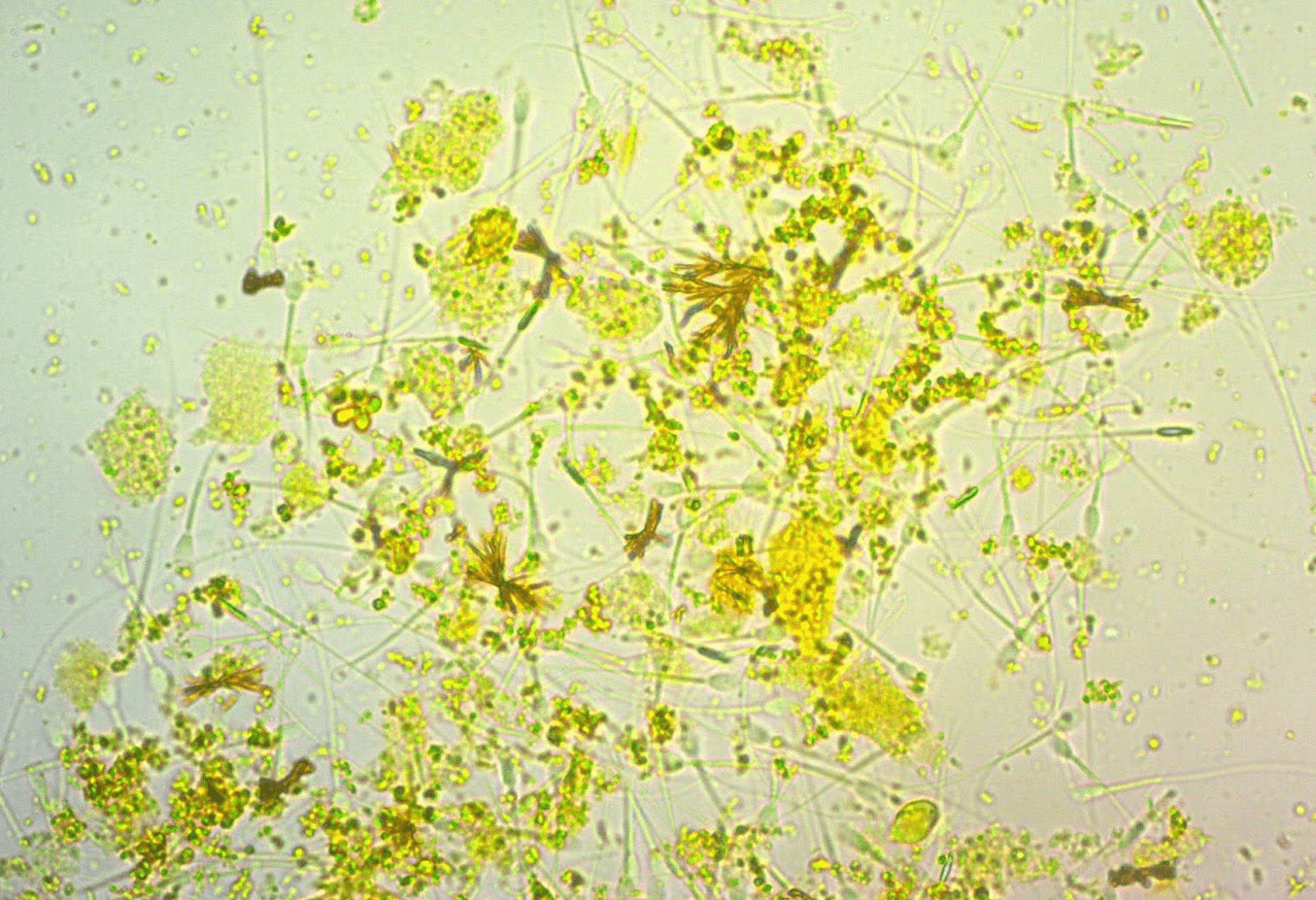
Рисунок 6. Кристаллы билирубина в моче. Для кошек — всегда патология.
При заболевании у кошек наблюдается сильная вялость, слабость, потеря веса и желтуха. Мутация встречается у 15% кошек в Великобритании и Америке, чаще всего у абиссинских и сомалийских пород, а также у случайно выведенных домашних короткошерстных кошек [14].
Глаза боятся
Прогрессирующая атрофия сетчатки (rdAC-PRA) кошек — группа заболеваний сетчатки, вызывающих поражение фоторецепторных клеток (палочек и колбочек) вплоть до их гибели.

Рисунок 7. Расширенные зрачки даже в условиях прямого освещения (в норме, при прямом воздействии света на глаз, зрачок сужается).
Свет входит в глаз через роговицу и, пройдя через всю толщу сетчатки, попадает на отростки светочувствительных клеток — палочек и колбочек (рис. 8). Они отправляют сообщения в мозг через зрительный нерв. Мозг переводит эти сообщения в изображения. Из-за наследственной дегенерации палочек-колбочек сигнал может начать передаваться не полностью или вообще не передаваться.
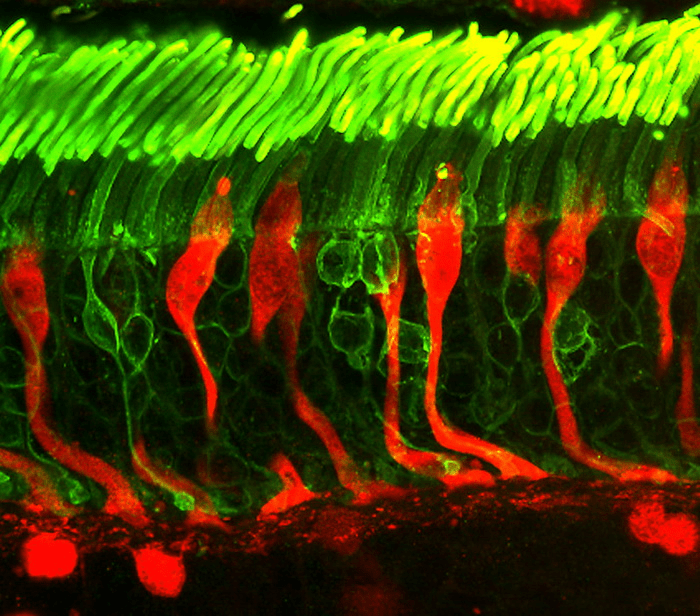
Рисунок 8. Светочувствительные клетки. Зеленым окрашены палочки, красным — колбочки.
На настоящее время для некоторых пород кошек описана наследственная форма поздней дегенерации рецепторов, называемая rdAc [17]. Тип наследования заболевания аутосомно-рецессивный, позиция мутации неизвестна. О мутантном варианте гена CEP290, вызывающем rdAc, до недавних пор не находили ни у кого, кроме абиссинской и сомали. Но оказалось, что он широко распространен и среди других пород кошек. Например, у американской короткошерстной, европейской короткошерстной, донской, гавана браун, хайлендер, мейн-кун, пикси-боб, скоттиш-фолд, сфинкс и теннесси-рекс [18].
Там чудеса: там леший бродит, глюкоза на ветвях сидит
Гликогеноз IV типа норвежских лесных кошек — это болезнь накопления мутировавшего гликогена в миоцитах (клетках мышечной ткани), гепатоцитах (клетках печени) и нейронах (клетках нервной ткани), которым страдают до 4% норвежских кошек. В норме гликоген представляет собой длинный и очень ветвистый полисахарид, состоящий из остатков альфа-глюкозы. В основном он содержится в местах высокой метаболической активности, например, в печени и мышцах, где служит важным источником энергии. При внезапном недостатке глюкозы гликоген расщепляется под воздействием ферментов. Образовавшаяся из него глюкоза поступает в кровь и обеспечивает клетки энергией. Разветвленное строение гликогена (рис. 9) обеспечивает ему быстрое освобождение углеводных остатков и очень компактную структуру. Как раз дефицит фермента, ветвящего гликоген и приводит к гликогенозу IV типа [19].

Рисунок 9. Схема разветвленной структуры гликогена.
Тип наследования — аутосомно-рецессивный. Пораженные кошки гомозиготны по сложной перестройке ДНК в гене GBE1, который кодирует фермент разветвления гликогена. Один из экзонов (кодирующих участков гена) вырезается, а на его место становится фрагмент из 334 пар нуклеотидов, который простирается от интрона 11 до интрона 12. После таких масштабных изменений функции фермента нарушаются. В результате, структура гликогена меняется, он перестает ветвиться, соответственно, труднее расщепляется до глюкозы и становится менее компактным.
Наиболее распространенной формой проявления заболевания является мертворождение или смерть в течение нескольких часов после рождения. Скорее всего, это связано с тем, что гликоген труднее расщепляется и котятам не хватает глюкозы для производства энергии во время родов и в первые часы жизни. Но если котенок все-таки выживает, то к 8-месячному возрасту у него наблюдается сильная мышечная слабость, атрофия и судороги, а также неспособность пользоваться конечностями.
Гликогеноз не проявляется у особей, гетерозиготных по мутации. Но они будут носителями и передадут заболевание части своего потомства [20].
Заключение
Заболевания, описанные в статье, я отбирала так:
-
На сайтах нескольких московских ветеринарных клиник посмотрела списки заболеваний для которых проводится генетическое тестирование.
-
Выбрала заболевания, для которых подробно описаны механизмы наследования и патология.
Поэтому в статье описаны далеко не все возможные генетические заболевания кошек, а лишь те, для которых проводится генетическое тестирование и про которые есть подробные исследования в открытом доступе.
И все же в статье были представлены одни из наиболее частых генетических заболеваний породистых кошек. На них обязательно стоит обратить внимание, если хотить сделать своему питомцу генетическое тестирование. Но есть и многие другие, так что, в любом случае, для начала нужно проконсультироваться со специалистом.
Стоит ответственно относиться к проблеме генетических заболеваний. Ведь даже если у животного нет явных признаков болезни, оно все равно может оказаться носителем мутантного аллеля. Берегите своих домашних любимцев!
Литература
- Шапошникова С. (2024). Типы наследования. Основы биологии;
- Mia TN Godiksen, Sara Granstrøm, Jørgen Koch, Michael Christiansen. (2011). Hypertrophic cardiomyopathy in young Maine Coon cats caused by the p.A31P cMyBP-C mutation - the clinical significance of having the mutation. Acta Vet Scand. 53;
- Madhulika Sharma, Gail A. Reif, Darren P. Wallace. (2019). In vitro cyst formation of ADPKD cells. Methods in Cell Biology. 93-111;
- Leslie A Lyons. (2015). DNA mutations of the cat. Journal of Feline Medicine and Surgery. 17, 203-219;
- Как нонсенс-мутации ген обижали, и что потом было;
- Как нонсенс-мутации ген обижали. А может, не обижали, и всё было иначе?;
- Дорофеева В.П., Процкая А.С., Осипова М.Е. (2018). Возрастные и породные аспекты поликистоза почек у кошек. Вестник Омского государственного аграрного университета. 2, 83–88;
- Поликистоз почек у кошек. (2024). Городской ветеринарный онкологический центр «Прайд»;
- Кольман Я., Рём К.-Г. Наглядная биохимия. М.: «Мир», 2000. — 469 с.;
- Giancarlo Parenti, Generoso Andria, Andrea Ballabio. (2015). Lysosomal Storage Diseases: From Pathophysiology to Therapy. Annu. Rev. Med. 66, 471-486;
- P. Wang, J. Sorenson, S. Strickland, C. Mingus, M.E. Haskins, U. Giger. (2015). Mucopolysaccharidosis
VII in a Cat Caused by 2 Adjacent Missense Mutations in theGUSB Gene. Veterinary Internal Medicine. 29, 1022-1028; - Мукополисахаридоз VI (MPS VI) кошек. (2024). Независимая ветеринарная лаборатория «Шанс Био»;
- A. V. Bankole, E. A. Chernyak. (2020). Pyruvate kinase deficiency: epidemiology, molecular analyses and modern diagnostic approaches (literature review). Ross. ž. det. gematol. onkol. 7, 86-93;
- Robert A Grahn, Jennifer C Grahn, Maria CT Penedo, Chris R Helps, Leslie A Lyons. (2012). Erythrocyte Pyruvate Kinase Deficiency mutation identified in multiple breeds of domestic cats. BMC Vet Res. 8, 207;
- Существуют три типа нарушений обмена билирубина. (2024). Биохимия для студента;
- Annie Oh, Jacqueline W. Pearce, Barbara Gandolfi, Erica K. Creighton, William K. Suedmeyer, et. al. (2017). Early-Onset Progressive Retinal Atrophy Associated with an IQCB1 Variant in African Black-Footed Cats (Felis nigripes). Sci Rep. 7;
- Прогрессирующая атрофия сетчатки. (2024). Vet Union;
- Progressive Retinal Atrophy (PRA rdAc) (Abyssinian). (2024). UC Davis School of Veterinary Medicine, Veterinary Genetics Laboratory;
- John C. Fyfe, Rebeccah L. Kurzhals, Michelle G. Hawkins, Ping Wang, Naoya Yuhki, et. al. (2007). A complex rearrangement in GBE1 causes both perinatal hypoglycemic collapse and late-juvenile-onset neuromuscular degeneration in glycogen storage disease type IV of Norwegian forest cats. Molecular Genetics and Metabolism. 90, 383-392;
- Glycogen Storage Disease type IV (GSD IV) in Norwegian Forest Cats. (2024). UC Davis School of Veterinary Medicine, Veterinary Genetics Laboratory.