
«Обличая порок стяжательства»: можно ли победить болезни накопления генной терапией?
27 декабря 2024
«Обличая порок стяжательства»: можно ли победить болезни накопления генной терапией?
- 1555
- 0
- 10
Лизосомные болезни накопления перспективны для генной терапии, ведь потенциально она способна их излечивать, закрывая (пока) неудовлетворенную медицинскую потребность. Правда, на пути внедрения генной терапии в данную область пока еще много подводных камней.
иллюстрация Елены Беловой
-
Автор
-
Редакторы
-
Иллюстратор
Терапия наследуемых моногенных заболеваний — серьезный вызов мировому здравоохранению, ведь далеко не все из них в принципе поддаются лечению. Особая их группа — лизосомные болезни накопления: хотя по отдельности они весьма редки, но в совокупности встречаются довольно часто, причем нередко бывают летальны. Причина этих патологий — снижение уровня одного или нескольких лизосомных ферментов, что приводит к накоплению в организме их субстратов, а это — к полиорганной недостаточности и зачастую к преждевременной смерти. Эти болезни сами по себе не проходят, но достаточно «хороши» для генной терапии: в теории тут достаточно лишь «починить» поломанный ген или же доставить его здоровую копию в нужные клетки и ткани, и — вуаля! — пациент излечится. На практике всё, конечно, не так просто...
Генная и клеточная терапии

Четвертый сезон спецпроекта о генной и клеточной терапиях рассказывает о конкретных применениях этих новейших методов для лечения нейромоторных, онкологических, офтальмологических и других заболеваний.
Партнер спецпроекта — Департамент разработки генотерапевтических препаратов одной из крупнейших российских биотехнологических компаний — BIOCAD. BIOCAD заслужил серьезные позиции на мировом фармацевтическом рынке благодаря выпуску лекарственных препаратов на основе антител.
Знания о лизосомных болезнях накопления (ЛБН) накапливаются уже более столетия (рис. 1): первые их фенотипы и клинические формы были описаны еще в XIX веке — задолго до того, как были открыты лизосомы. В то время изучение этих расстройств было в основном эмпирическим и основывалось исключительно на описанных характеристиках наблюдаемых недугов.
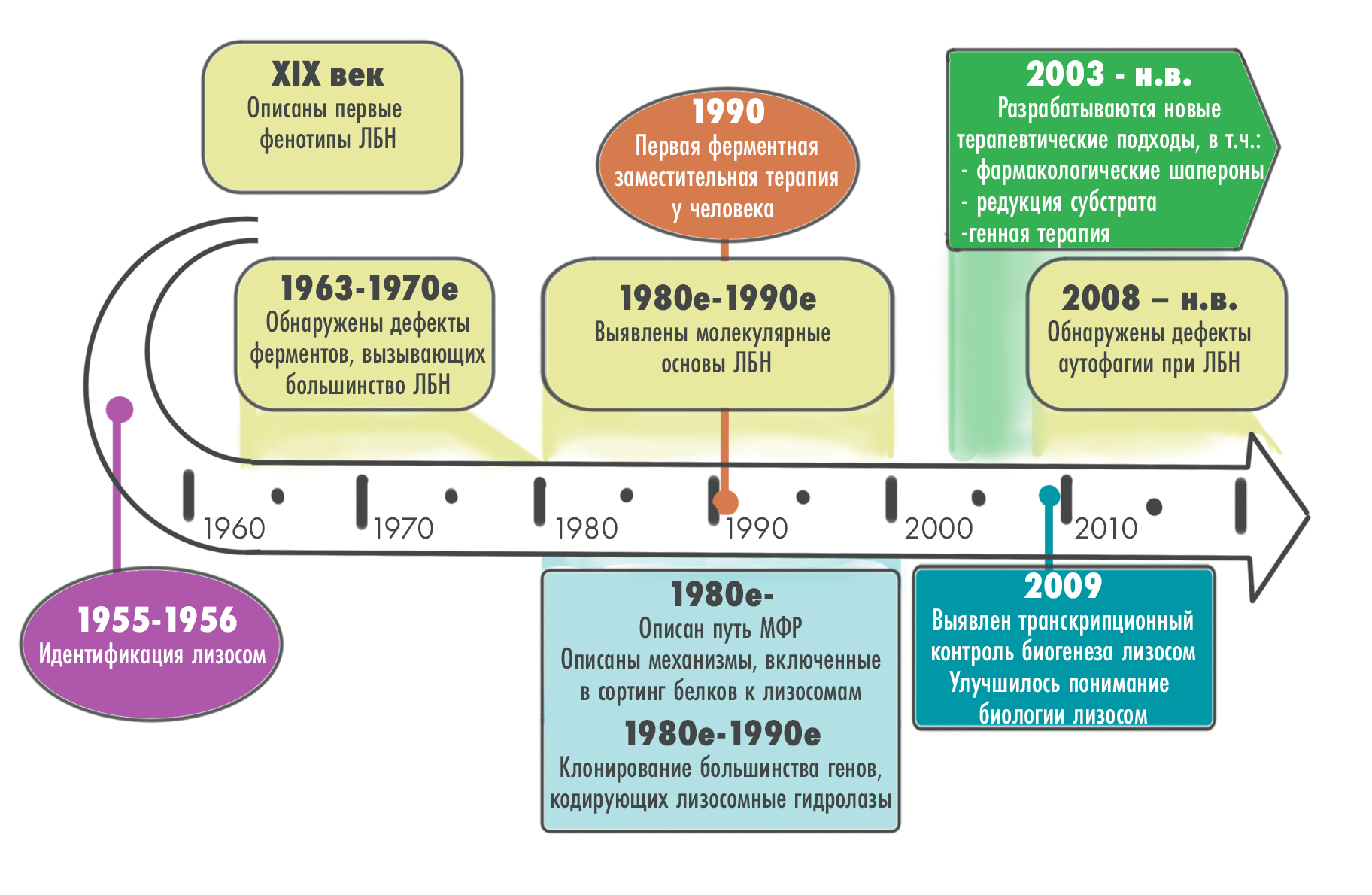
Рисунок 1. Основные вехи в развитии знаний об ЛБН
иллюстрация Елены Беловой по [1]
Биохимические и клеточные основы ЛБН выявили гораздо позже, в их основу легли научные работы бельгийского биохимика и цитолога Кристиана де Дюва, получившего «за открытия, касающиеся структурной и функциональной организации клетки» Нобелевскую премию по физиологии и/или медицине в 1974 году (рис. 2).

Рисунок 2. Кристиан Рене Мари Жозеф виконт де Дюв. Нобелевскую премию 1974 года присудили ему не только за открытия и описание лизосом и их функций, но что называется «по совокупности»: он открыл и объяснил существование двух других типов органелл — пероксисом и провакуолей; ввел в клеточную биологию несколько новых терминов (весьма много объясняющих): помимо уже упомянутых «лизосомы» и «пероксисомы», это такие принципиальные понятия как «аутофагия», «эндоцитоз» и «экзоцитоз». Помимо этого де Дюв известен и как популяризатор науки: его знаменитая книга «Путешествие в мир живой клетки» переведена на русский еще в 1980-х и была очень популярна в Советском Союзе (а позже в России).
Суть новаторских открытий де Дюва состояла в идентификации, изучении и описании нескольких клеточных органелл и их функций, важнейшей из которых была лизосома. В 1950–1960-х годах он и его коллеги, используя методы фракционирования клеток, цитологических исследований и биохимических анализов, идентифицировали и охарактеризовали лизосому как наполненную различными гидролитическими ферментами органеллу, ответственную за внутриклеточное пищеварение и рециркуляцию макромолекул. Тогда это стало большим научным прорывом, приведшим, в том числе, и к пониманию физиологической основы ЛБН.
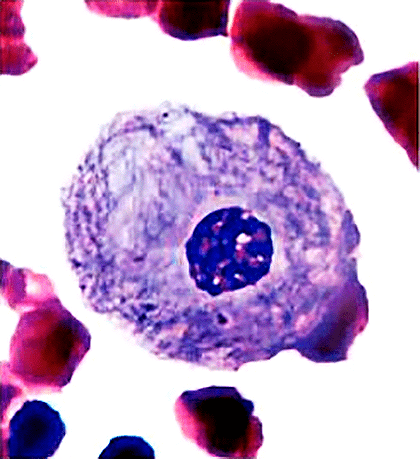
Рисунок 3. Клетка человека с болезнью Гоше. При этой болезни фермент глюкоцереброзидаза не может функционировать должным образом, и её субстрат — глюкоцереброзид — накапливается в лизосомах макрофагов, где в норме обычно разрушается. Макрофаги увеличиваются в размерах, и их видимая структура на гистологических срезах приобретает вид смятой бумаги.
Первым заболеванием, идентифицированным именно как ЛБН, стала болезнь Помпе — произошло это в 1963 году благодаря бельгийскому физиологу и врачу Анри Эрсу. Он показал, что это известное с 1930-х расстройство вызвано отсутствием кислой α-глюкозидазы, и что такой дефицит отвечает за накопление гликогена в клетках и тканях. Эрс также предположил, что и другие заболевания, например болезни накопления мукополисахаридов, могут быть вызваны аналогичным дефицитом ферментов.
В 1960–1970-е годы ученые активно изучали биохимию ЛБН и постепенно определяли, накопление каких веществ и дефицит каких ферментов винить в их развитии [1]. Как раз примерно тогда болезнь Гоше — наиболее распространенная ЛБН — «попала в прицел» ученых. Они довольно быстро установили основную метаболическую аномалию при этой болезни: недостаточную активность фермента глюкоцереброзидазы, катализирующего гидролитическое расщепление глюкозы из глюкоцереброзида (рис. 3).
Эта информация стала основой для разработки фермент-заместительной терапии (ФЗТ), которая сначала базировалась на «сборе и добыче» нативного материала: недостающий фермент глюкоцереброзидазу выделяли из плаценты человека, что было трудоемко, дорого и не сказать чтобы совсем безопасно... Поэтому неудивительно, что вскоре «натуральные ферменты» сменились их рекомбинантными аналогами — благо, уже появились методики клонирования и выделения ДНК и генная инженерия [2–5].
Разработка этих препаратов стала возможной благодаря доктору Роско Брэди из Национального института здравоохранения США, который не только описал болезнь Гоше как ЛБН (симптомы, известные еще с XIX века, связал с недостаточностью определенного фермента), но и сделал первые попытки её лечения с помощью ФЗТ. Эта занимательная история (как и многие другие, связанные с развитием современных методов лечения) подробно описана в статье «Три поколения лекарств» [3] проекта «Современные лекарства», с которым мы очень рекомендуем ознакомиться.
Появление ФЗТ революционизировало медпомощь при ЛБН, ведь до её внедрения лечение этих недугов было во многом паллиативным: направленным на облегчение определенных симптомов. Единственным доступным ранее лечением, потенциально способным изменить естественное течение заболевания, была трансплантация гемопоэтических стволовых клеток [2], но помогала она далеко не всегда и не всем (об этом и разных других вариантах терапии расскажем далее).
Эпидемиология ЛБН
Если рассматривать ЛБН по отдельности, они очень редки — орфанны, причем некоторые из них настолько, что в литературе описано всего несколько случаев заболеваемости. Однако в сумме эти заболевания встречаются более-менее повсеместно, а наиболее распространенные среди них — болезни Фабри [6] и Гоше, метахроматическая лейкодистрофия и болезнь Помпе (рис. 4).
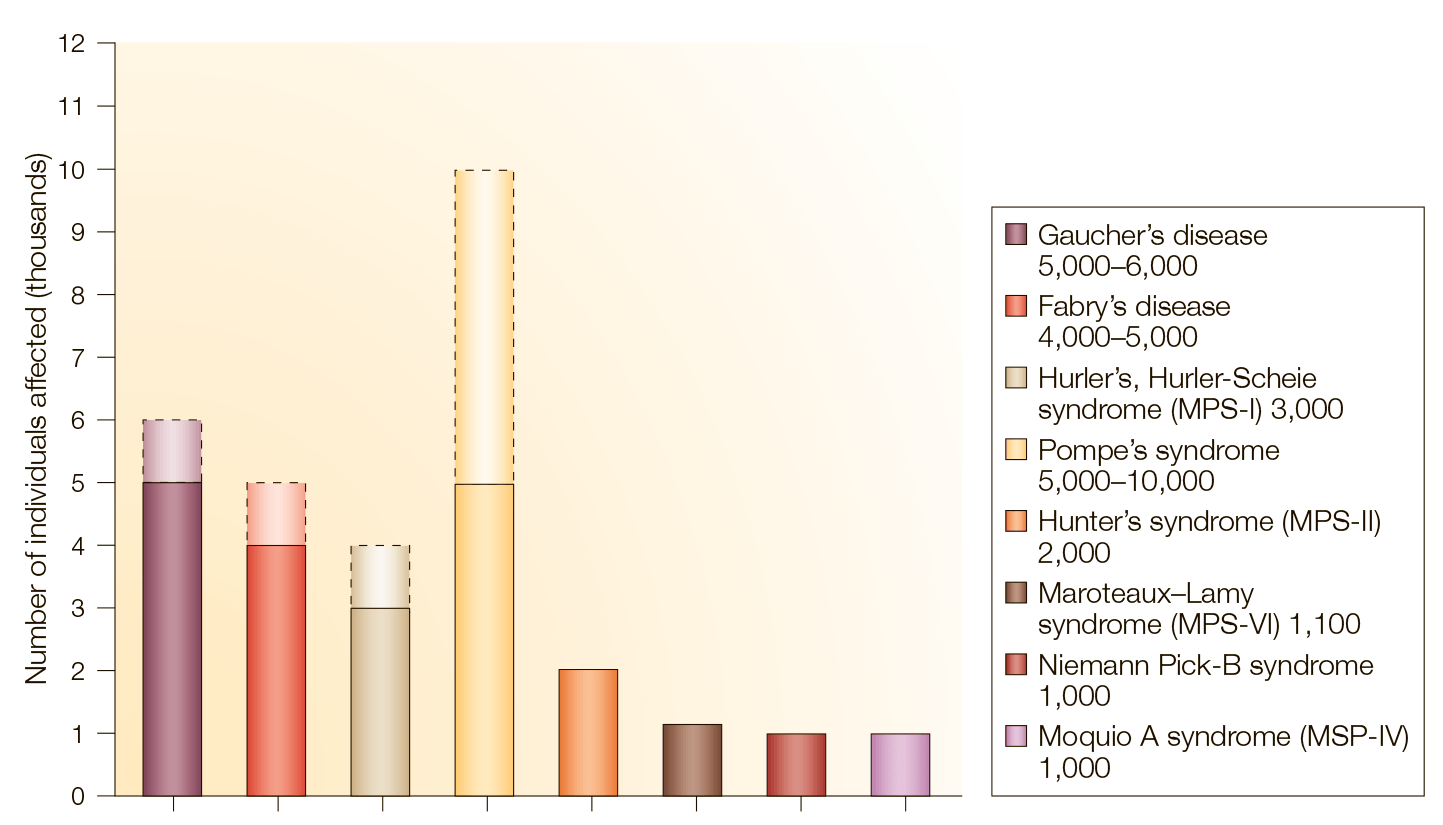
Рисунок 4. Распространенность разных лизосомных болезней накопления в мире. Пунктиром обозначены максимальные показатели заболеваемости.
Если же думать об ЛБН как о группе патологий, то тогда их встречаемость уже не так редка: от 1 на 5000 до 1 на 8000 чел (по разным источникам) [2]. При этом в распространенности ЛБН немалую роль играют как этническая принадлежность, так и географическая локализация потенциальных больных. К примеру, болезнь Гоше в общей популяции встречается с частотой примерно 1 случай на 40 000 – 60 000 человек. У восточноевропейских евреев же (ашкенази) она встречается уже чаще: у 1 на 800 чел., а болезнь Тея-Сакса у них же — с частотой 1 на 3900 чел. Болезнь Ниманна-Пика типа A и муколипидоз типа IV также встречаются у ашкенази с повышенной частотой. В финской же популяции такое заболевание, как аспартилглюкозаминурия, встречается с частотой 1:18500, а также у финнов довольно распространена болезнь Салла.
В целом культурная и географическая генетическая изоляция с сопутствующими ей «эффектами основателя» может способствовать формированию прецедентов подобного рода более высокой заболеваемости [7].
Основные симптомы, признаки и причины ЛБН
Хотя каждая отдельная ЛБН вызывается мутациями в различных генах с последующим дефицитом активности (или нарушением функциональности) соответствующего им фермента, все они сходны в том, что приводят к накоплению в организме тех или иных субстратов (в норме деградируемых лизосомами). Конкретные «хранимые» субстраты (как и места их скопления) в организме бывают разными, а на основе типа такого субстрата разные ЛБН объединяются в отдельные подкатегории: мукополисахаридозы, липидозы, гликогенозы, олигосахаридозы и др. (рис. 5).
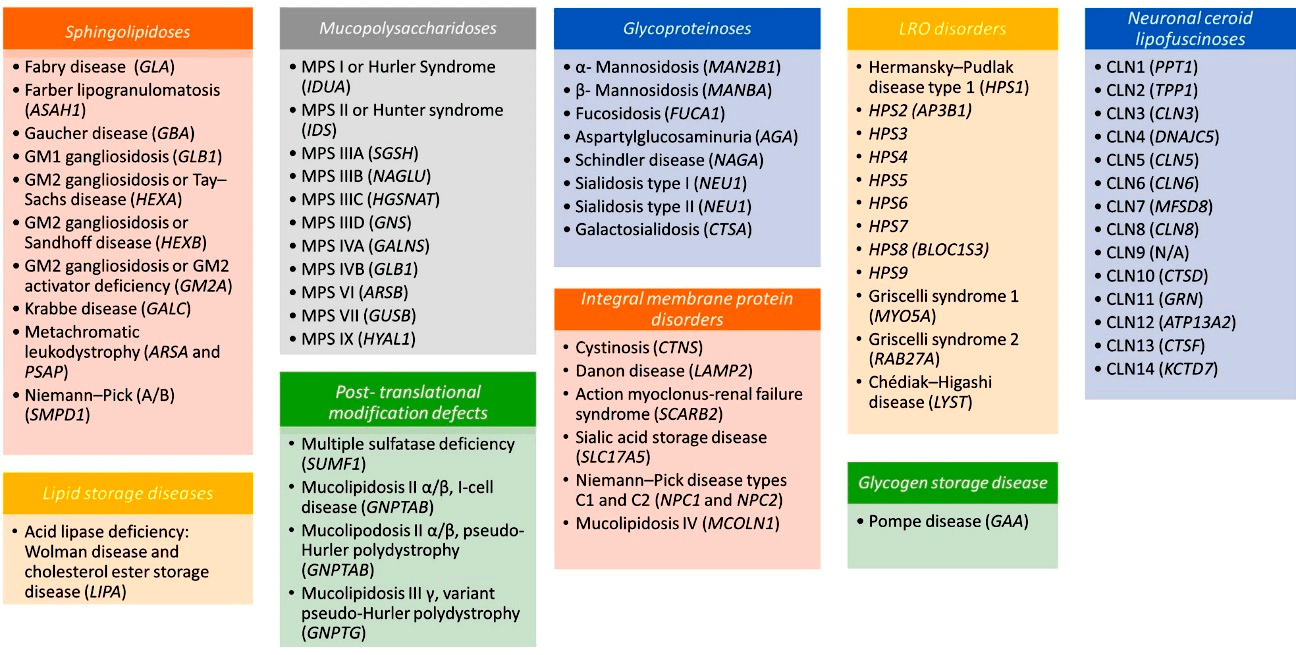
Рисунок 5. Классификация лизосомных болезней накопления в соответствии с особенностями биохимии их патогенеза и типом накапливаемого субстрата; нарушенный при данном заболевании ген указан в скобках
Такая классификация используется главным образом для удобства, ведь субстратная специфичность многих лизосомных ферментов частично перекрывается [8] и поэтому заболевания во многих подкатегориях похожи. В частности, аномалии костей, увеличение органов (органомегалия), дисфункции центральной нервной системы, грубые черты лица и жесткие волосы — общие черты многих ЛБН [9]. С другой стороны, от типа накапливаемого субстрата и мест его скопления (например, в печени, селезенке, костях, других органах) зависят нюансы симптоматики различных ЛБН (о чем мы поговорим далее). Кстати, это также сильно влияет на особенности индивидуального патогенеза и прогноза течения болезни, ведь даже при одном и том же заболевании степень накопления субстратов в разных органах и тканях у разных больных может различаться (как и негативное воздействие на организм).
Далее мы для начала обсудим патогенез и современные варианты лечения некоторых наиболее распространенных ЛБН: мукополисахаридозов, болезней Гоше, Фабри и Помпе, а затем (уже в контексте применения одобренной генной терапии) затронем особенности течения (и лечения) метахроматической лейкодистрофии.
Терапевтические стратегии при разных ЛБН
В целом все существующие ныне способы лечения ЛБН нацелены на восстановление баланса в производстве/расщеплении субстратов в лизосоме, и на сегодня для этого имеются следующие стратегии (рис. 6):
- ферментная заместительная терапия (ФЗТ, или enzyme replacement therapy, ERT) — внутривенное введение правильно функционирующей формы фермента, нарушенного при заболевании;
- второе поколение ФЗТ — «тюнингованные» ферменты (дополнительное гликозилирование, «сшивание» с FC-фрагментами антител и т. д.): это дает новые терапевтические возможности (пример будет ниже);
- трансплантация гемопоэтических стволовых клеток (ТГСК; HSCT) работает благодаря замечательным свойствам стволовых клеток секретировать недостающие ферменты и колонизировать ткани с их дефицитом, что и помогает восстанавливать баланс в производстве/расщеплении субстратов;
- фармакологические шапероны стабилизируют мутировавшие ферменты, чтобы предотвратить их деградацию в эндоплазматическом ретикулуме и, соответственно, облегчить их перемещение в лизосому (где они и расщепляют накопленные субстраты);
- субстрат-снижающая терапия (ССТ; substrate reduction therapy) — таргетное ингибирование фермента, участвующего в биосинтезе субстрата (или одного из его предшественников) малыми молекулами, также нацеленное на восстановление баланса в производстве/расщеплении субстратов;
- генная терапия направлена на введение функционального гена или исправление дефектного гена (или его транскрипта) внутри клеток. При этом могут использоваться подходы in vivo и ex vivo (и в этой статье мы их рассмотрим подробно).
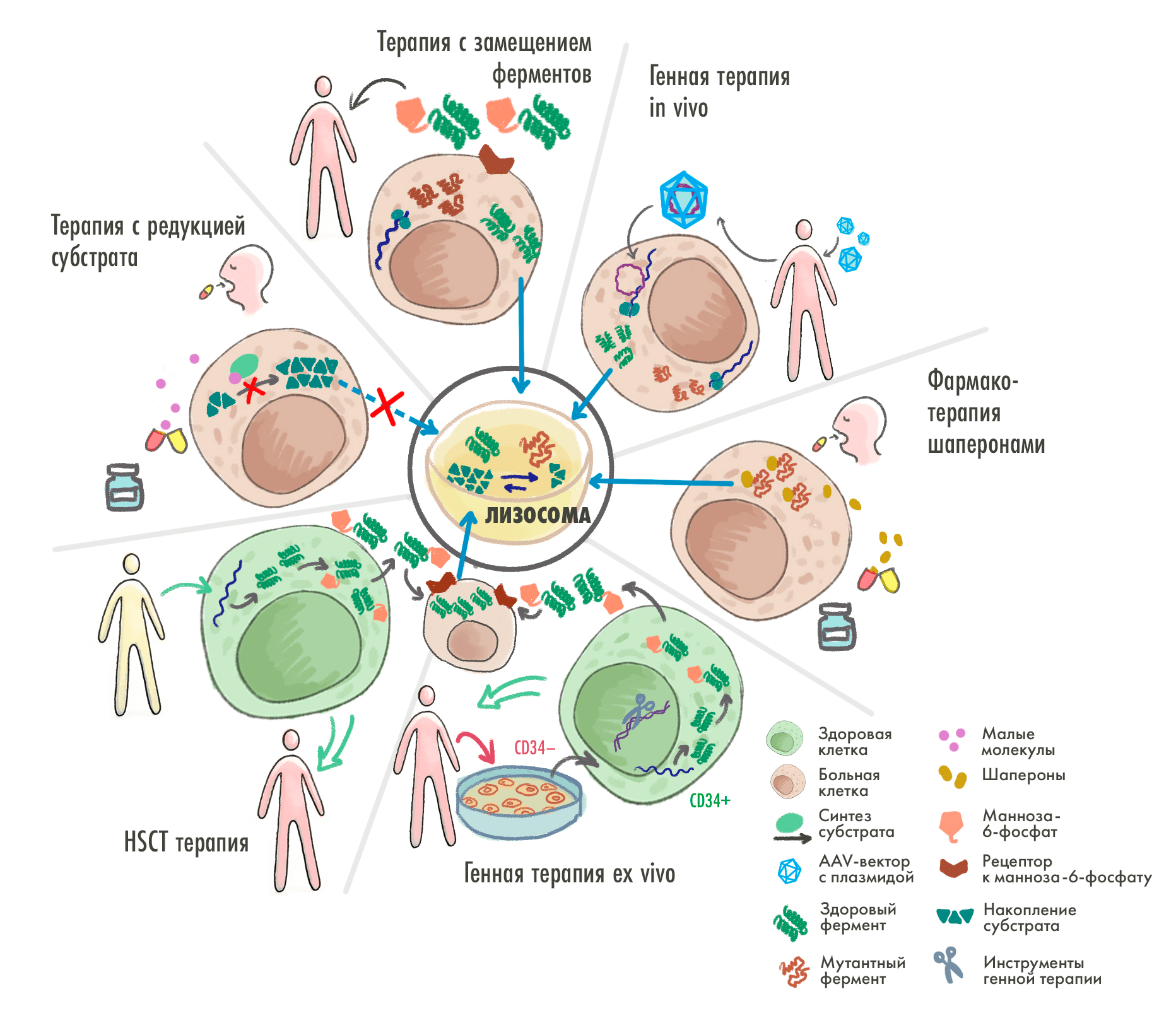
Рисунок 6. Подходы к терапии ЛБН. В их основе лежит физиология лизосомы, и все они направлены на восстановление баланса производства/расщепления субстрата в ней.
иллюстрация Елены Беловой по [46]
Как мы увидим далее, все эти лечебные подходы имеют свои плюсы и минусы, но ни один (пока?) до конца не излечивает (и, к сожалению, многие имеют серьезнейшие побочные эффекты).
Предпосылки внедрения генной терапии, или Почему лечение ЛБН не так эффективно, как хотелось бы?
В этой немного вводной части мы обсудим патогенез и текущие терапии самых распространенных хронических болезней накопления (болезни Фабри, Гоше, Помпе и мукополисахаридозов), при которых подбор действительно эффективного лечения важен как никогда, однако возможности современной медицины (как мы увидим) далеко не всегда позволяют в полной мере это обеспечить.
Болезнь Фабри —
редкое заболевание накопления, при котором дефицит α-галактозидазы А (α-Gal A) приводит к накоплению глоботриаозилцерамида (GL-3) и некоторых других гликосфинголипидов в различных клетках. «Излишний» GL-3 может привести к прогрессирующему повреждению клеток, фиброзу, хронической боли, недостаточности органов и в конечном итоге (если всё это не лечить) к преждевременной смерти [10]. Из органов в первую очередь затрагиваются почки, сердце, нервная система (рис. 7), но также описаны и респираторные заболевания, включая обструкцию дыхательных путей, интерстициальные заболевания легких и повышенную заболеваемость обструктивным апноэ во время сна (ОАС). Эти состояния прогрессируют, то есть со временем ухудшаются, хотя происходить это может медленно. У мужчин обычно возникают серьезные проблемы со здоровьем к 30–45 годам; у женщин проблем может не быть до 50 лет и намного старше.
В случае болезни Фабри ожидаемая продолжительность жизни во многом зависит от своевременности постановки диагноза и оперативности назначения соответствующего лечения (это верно и для других болезней накопления), хотя, увы, в среднем такие пациенты живут меньше, чем здоровые люди. Опубликованные для США данные показывают, что мужчины, страдающие болезнью Фабри, в среднем живут лишь 58 лет по сравнению с 75 годами для мужчин в общей популяции [11]. Для женщин с болезнью Фабри средняя продолжительность жизни составляет уже 75 лет по сравнению с 80 годами для здоровых.
Кстати, на «Биомолекуле» в цикле «Орфанные заболевания» уже выходила статья про этот недуг: «Болезнь Фабри: частая среди редких» [6] — читайте там больше об истории открытия, патогенезе и современном лечении, в том числе разрабатываемом в России.
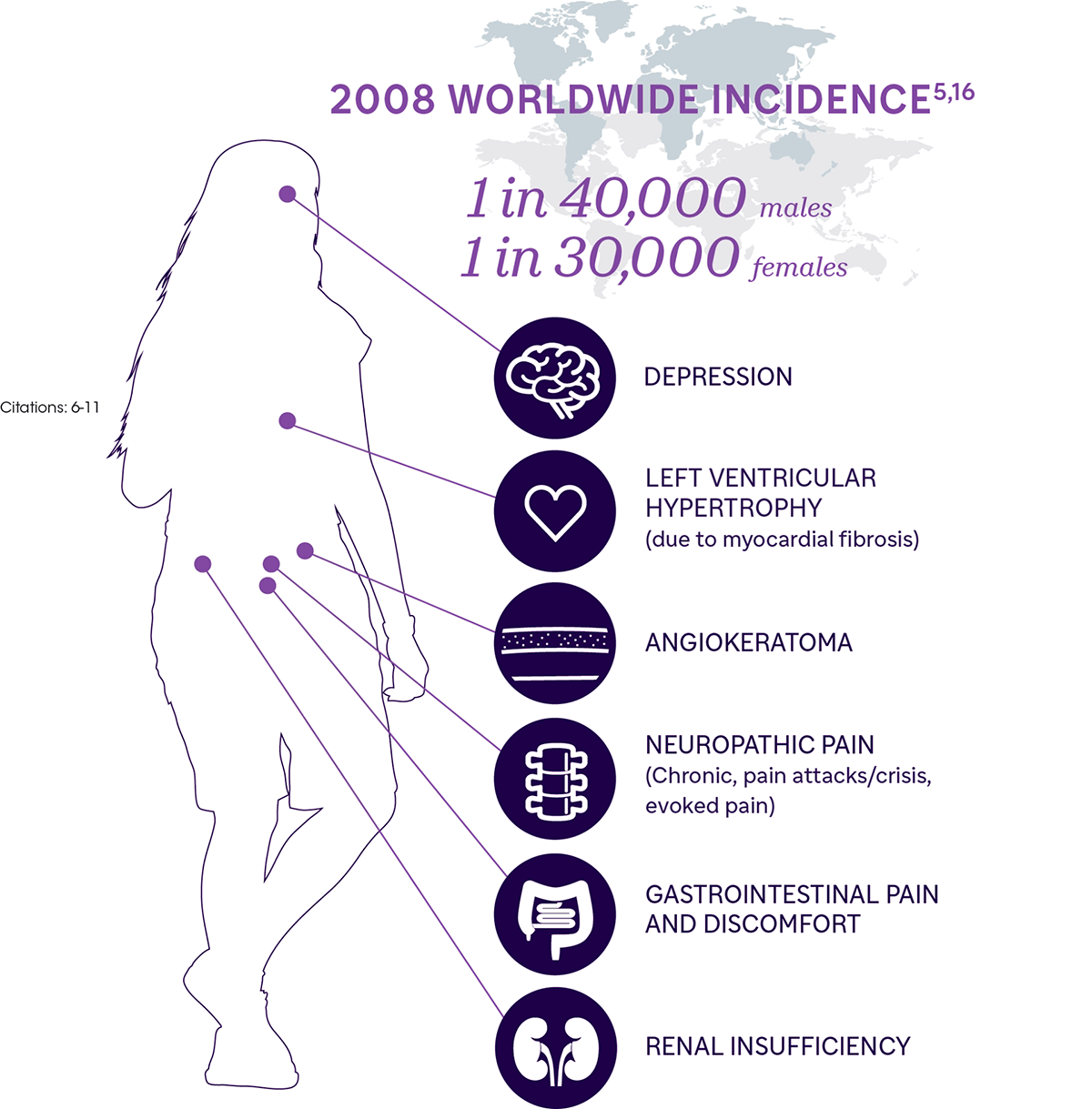
Рисунок 7. Болезнь Фабри и основные органы, поражаемые этим заболеванием. Прогрессирующее накопление субстрата связано со многими признаками и симптомами, включая почечную недостаточность, сердечно-сосудистые нарушения, невропатию и дерматологические нарушения (проявляющиеся в виде ангиокератом). Накопление субстрата в клетках сердечно-сосудистой системы приводит к тяжелым и опасным нарушениям, которые становятся одной из основных причин смерти при болезни Фабри. Наиболее распространены гипертрофия левого желудочка, аритмии и инсульты из-за накопления сфинголипидов. Жизнь с сильным болевым синдромом часто также негативно влияет на психическое состояние пациентов: среди них распространены депрессии и тревожные расстройства. Больше читайте в статье Биомолекулы «Болезнь Фабри: частая среди редких» [6].
Основой терапии болезни Фабри является ФЗТ. В Соединенных Штатах для этого довольно давно (еще в 2003 г.) одобрена агалсидаза бета (Fabrazyme) , а уже совсем недавно (в 2023 г.) там же получил одобрение препарат Elfabrio: это пегилированная форма агалсидазы альфа. Пегилирование продлевает «жизнь» фермента: пациенты могут реже делать утомительные инъекции, что повышает качество жизни и приверженность лечению. Обычная же (не пегилированная) форма агалсидазы альфа — это препарат Replagal, коммерчески доступный во многих странах (но не в США), включая Канаду, Россию, Великобританию, Мексику, Израиль и весь Евросоюз.
Кстати биосимиляр данного лекарства (под коммерческим названием «Фабагал») планирует производить российская компания «Петровакс» [12]: в 2023 году они получили на него регистрационное удостоверение, а уже на конец 2024 года планируют запуск производства полного цикла (включая субстанцию) для выпуска коммерческих серий.
К сожалению, ФЗТ при болезни Фабри трудно назвать идеальной — она купирует далеко не все симптомы: патологические процессы нарушения функции почек и гипертрофии левого желудочка могут продолжаться [13]; кроме того, существенным недостатком являются возможные аллергические реакции на инъекции, в том числе тяжелые. Так или иначе, правильный протокол лечения этой болезни зачастую требует применения нескольких препаратов в составе комплексной терапии.
Одна из возможных альтернатив ФЗТ — мигаластат (Galafold компании Amicus Therapeutics): фармакологический шаперон, то есть низкомолекулярное соединение, которое связывается с активным сайтом мутантного фермента альфа-галактозидазы и стабилизирует его. Это лекарство принимается перорально и потому подходит пациентам, не переносящим ФЗТ из-за образования нейтрализующих антител к вводимому ферменту, аллергических реакций, связанных с инфузией, или по каким-либо другим причинам. К сожалению, эта альтернатива помогает далеко не всем: мигаластат работает, если у больного мутации приводят к неправильному сворачиванию альфа-галактозидазы; в том же случае, если этот фермент совсем отсутствует, фармакологический шаперон будет бессилен. Считается, что только примерно у 35–50% пациентов с болезнью Фабри могут быть варианты мутаций, поддающиеся лечению мигаластатом.
Болезнь Гоше —
возникает в результате недостатка лизосомального фермента глюкоцереброзидазы и вытекающего накопления его субстрата глюкоцереброзида. С течением болезни этот и другие гликолипиды начинают накапливаться в лизосомах макрофагов, что приводит к разным нарушениям.
В какой-то момент «нагруженные» липидами макрофаги скапливаются в селезенке, печени, костном мозге, костях, других тканях и органах и вызывают их системное поражение: гематологические нарушения, увеличение органов, повреждения скелета. В зависимости от наличия или отсутствия неврологических поражений описаны три клинических подтипа болезни Гоше:
- I тип — без неврологических нарушений, это наиболее распространенная форма заболевания. Его клиническая картина варьирует от бессимптомного течения на протяжении всей жизни до форм патологий, проявляющихся еще в детстве. В последнем случае замедляются рост и половое созревание, увеличиваются печень и селезенка, возникают аномалии костей; болезнь Гоше I типа может вызвать серьезные заболевания печени, включая повышенный риск кровотечения в желудке и пищеводе и рак печени. Симптомы этой болезни могут проявиться в любом возрасте, но средний возраст больных в момент манифестации — 30 лет. Современное лечение этого недуга (см. ниже) довольно эффективно и при его корректном применении позволяет рассчитывать на почти нормальную продолжительность жизни [14].
- II тип встречается реже и характеризуется ранним и тяжелым поражением центральной нервной системы, также увеличением печени и селезенки, что приводит к смерти в возрасте до трех лет; в настоящее время от этого заболевания нет лекарства. Текущая терапия в основном паллиативная: поддерживающий уход с вниманием к вопросам, общим и для других нейродегенеративных состояний (таким как питание); а также и к более специфичным для данного недуга проблемам: риску аспирации дыхательных путей, необходимости респираторной поддержки, и пр.
- III тип также называют ювенильной, или подострой неврологической болезнью Гоше: для нее характерны внутренние симптомы, описанные для болезни Гоше I типа, — они часто развиваются на первом году жизни, обычно в сочетании с неврологическими глазодвигательными нарушениями, проявляющимися позднее — в возрасте 6–15 лет. Продолжительность жизни больных болезнью Гоше III типа, увы, невелика: 12–17 лет, в редких случаях — 30–40 лет.
Лечение болезни Гоше I и III типов состоит либо из ФЗТ, либо из субстрат-снижающей терапии (ССТ). Существует три одобренных FDA препарата ФЗТ: имиглюцераза (Cerezyme), велаглюцераза альфа (VPRIV) и талиглюцераза альфа (Elelyso); и два одобренных FDA препарата ССТ: миглустат (Zavesca) и элиглустат (Cerdelga).
ССТ работает путем ингибирования фермента глюкозилцерамидсинтазы, блокируя первый этап в синтезе гликосфинголипидов, тем самым ограничивая выработку глюкоцереброзида. Одно из преимуществ ССТ — пероральное, а не внутривенное введение. Клиническая практика сильно различается, но большинство вновь диагностированных пациентов начинают с ФЗТ. Некоторые переходят на ССТ в более позднем возрасте. Детям с болезнью Гоше следует начинать ФЗТ, как только у них появляются симптомы. Талиглюцераза альфа, миглустат и элиглустат одобрены только для использования у взрослых. Как ФЗТ, так и ССТ по итогу применения увеличивают количество тромбоцитов и концентрацию гемоглобина, уменьшают объем печени и селезенки и снижают биомаркеры, характерные для болезни Гоше (такие как хитотриозидаза) [13].
Несмотря на то, что ФЗТ и ССТ улучшают гематологические показатели и состояние внутренних органов, они, по-видимому, не влияют (или мало влияют) на неврологические нарушения [13]. Теоретически болезни I и III типа можно также вылечить с помощью трансплантации гемопоэтических стволовых клеток, но это считается крайней мерой, поскольку может привести к смерти или инвалидности.
Болезнь Помпе —
прогрессирующее, мультисистемное, изнурительное и часто опасное для жизни нервно-мышечное расстройство. Вызывается она отсутствием или дефицитом фермента кислой альфа-глюкозидазы (GAA), отвечающим за расщепление гликогена внутри клеток. Без достаточного количества этого фермента гликоген накапливается в первую очередь в мышечных клетках (также в гепатоцитах, эндотелиальных клетках, нейронах ЦНС), что в какой-то момент неминуемо нарушает мышечную функцию. Выходит так потому, что прогрессирующее накопление гликогена приводит к разрыву лизосомальных мембран, вызывая утечку гидролитического материала в цитоплазму различных мышечных (и что особо значимо — скелетных и сердечных) клеток с нарушением их сократимости. Всё это приводит к мышечной слабости, истощению: во многом за счет поражения расположенных ближе к центру тела (проксимальных) мышц и легочной функции болеющих людей.
Младенцы, у которых почти полностью отсутствует активность кислой альфа-глюкозидазы (менее 1% от нормы), — это пациенты с классической (инфантильной или младенческой) болезнью Помпе (МБП), и участь их наиболее печальна. Симптомы этого недуга манифестируют в среднем между 1,6 и 2 месяцами жизни (хотя могут проявляться даже до рождения, когда ребенок еще находится в матке [15]), и до появления ФЗТ такие дети чаще всего умирали в первый год жизни от сердечной недостаточности.
Но и сейчас выжившим благодаря лечению часто требуется респираторная поддержка, включая искусственную вентиляцию легких, зонды для кормления, ходунки и/или инвалидные коляски. При этом смертность таких маленьких пациентов всё равно очень высока (в разном возрасте различна), и невелика их общая продолжительность жизни. Для получающих лечение самыми сложными оказываются первые три года жизни, так как в этот период умирают очень многие (по некоторым данным около 50%); а следующий пик снижения выживаемости приходится на возраст уже после 12 лет. Оценить средний возраст выживаемости при МБП пока довольно сложно, так как статистики не хватает [16].
У лиц с болезнью Помпе с поздним началом (БППН) активность фермента может составлять 40% или менее от нормы, а симптомы проявляются в любом возрасте: от детства до взрослой жизни. Как правило, чем раньше началась болезнь, тем тяжелее она протекает и быстрее прогрессирует. Если БППН проявилась уже во взрослом возрасте, нормальная функция сердца таких пациентов может сохраняться, и они могут страдать лишь от слабости проксимальных мышц.
Соответственно, продолжительность жизни людей с БППН также сильно варьирует: смерть может наступить в период от раннего детства до старости, на что влияют характер течения недуга, наличие респираторных проблем, других сопутствующих заболеваний и т.д. Происходит так во многом потому, что заболевание патофизиологически очень гетерогенно, что вызывает разнообразие клинических проявлений. Из-за отсутствия данных (ФЗТ стала доступна только около 15 лет назад) всё еще довольно сложно точно оценить влияние современных методов лечения на продолжительность жизни пациентов с БППН.
Текущее лечение: неполный триумф ФЗТ
Препараты ФЗТ, содержащие GAA (препараты Myozyme, Lumizyme) когда-то радикально изменили специфику прогноза при МБП. Связано это с тем, что ФЗТ очень хорошо помогает при «сердечных» осложнениях этой болезни: снижает гипертрофическую кардиомиопатию с улучшением и/или нормализацией индекса массы левого желудочка и других «сердечных параметров» (иногда в течение всего нескольких недель после начала такой терапии); после этого аритмии возникают уже у меньшего числа пациентов. Благодаря всему этому сердечные осложнения при МБП уменьшились, выживаемость повысилась, однако это хроническое расстройство всё еще идет с тяжелыми нервно-мышечными отклонениями (скелетные мышцы плохо реагируют на ФЗТ) и до сих пор летально, хотя пациенты и живут зачастую немного дольше.
91% пациентов с МБП, получавших лечение с помощью ФЗТ, имеют слабость и гипотонию, 91% — дизартрию, 45% — дисфагию, 36% — зависимость от зонда для кормления, 36% нуждаются во вспомогательных устройствах для передвижения, и многим из них необходим дополнительный кислород: искусственная вентиляция легких при дыхательной недостаточности и ОАС. У пациентов с БППН всё уже «получше»: у них стабилизируется функция дыхания, улучшается моторика, поддерживается способность передвигаться и увеличивается выживаемость. На фоне проводимой ФЗТ такие пациенты могут дожить до старости с хорошими показателями качества жизни.
К сожалению, при всех плюсах ФЗТ нужно признать, что для пациентов с болезнью Помпе это далеко не панацея: из-за крайне сложного патогенеза им зачастую требуется многопрофильная помощь [13].
Мукополисахаридозы (МПС) —
это ЛБН, вызванные дефицитом лизосомных гидролаз, участвующих в деградации гликозаминогликанов (ГАГ). В настоящее время известно десять различных типов МПС, и каждый из них может «являться миру» в широком диапазоне клинической тяжести. Например, при МПС I самая тяжелая форма называется синдромом Гурлер; промежуточная по тяжести — синдромом Гурлер—Шейе; а наименее тяжелая — синдромом Шейе [18]. При этом МПС I и II — это наиболее распространенные типы мукополисахаридозов. Клинические проявления всех этих заболеваний различаются в зависимости от типа «дефицитного» фермента и степени его остаточной активности; однако симптомы их обычно прогрессируют — это грубые черты лица, гепатоспленомегалия, пороки клапанов сердца, респираторные заболевания и аномалии костей/суставов.
Первичное поражение ЦНС присутствует при большинстве МПС, особенно при тяжелых формах I–III и VII типов, причем проявляется всё это в том числе снижением интеллекта, зачастую грубым, прогрессирующим по мере развития заболевания. Дисфункции ЦНС, как правило, начинают проявляться на 2–3 году жизни, что в конечном итоге приводит к потере освоенных маленькими пациентами нейромоторных навыков. Эти разрушительные симптомы неумолимы в своем ухудшении, приводя зачастую к преждевременной смерти [19].
Собственно смертность, связанная с этими болезнями, часто обусловлена как раз тяжелой нейродегенерацией, респираторными инфекциями и дисфункциями сердца. Прогноз при этом почти всегда неблагоприятный, ведь мукополисахаридозы характеризуются катастрофическими системными нарушениями. Продолжительность жизни тут невелика (хоть для разных форм и различна): от 6–10 лет при синдроме Гурлер до 30–40 лет при менее тяжелых формах [20].
Лечение этих болезней в настоящее время основано главным образом на применении ФЗТ, а также трансплантации гемопоэтических стволовых клеток. Используемые ФЗТ ныне это: ларонидаза (Aldurazyme) для МПС I, идурсульфаза (Elaprase) для МПС II и вестронидаза альфа (Mepsevii) при лечении МПС VII. Такие лекарства способны замедлять прогрессирование этих заболеваний, но не излечивают, а поскольку вводимые ферменты не проникают через ГЭБ, они также мало что дают в плане облегчения неврологических симптомов (которые, очевидно, здесь являются одной из основных проблем).
Трансплантация гемопоэтических стволовых клеток может быть проведена у пациентов с МПС I в возрасте до двух лет , и хороша она как раз тем, что способна стабилизировать нейрокогнитивную функцию за счет восстановления микроглии и соответствующей нормализации активности лизосомных ферментов в мозге. Вот почему эта процедура — часто единственный способ значительно снизить клинические проявления тяжелых форм МПС I (особенно в части поражения ЦНС) [13]. К сожалению, при всех её плюсах, эффективность всё же ограничена, неся при этом крайне высокие риски тяжелых осложнений и летальности, и показана пациентам далеко не всегда.
Ранняя трансплантация лучше тем, что симптомы заболевания еще не столь остры, а потому можно надеяться на неплохую эффективность [13].
В меньшей степени доказана польза этого метода при МПС II [13].
Генная терапия как альтернатива традиционному лечению
Итак, как мы отметили выше, существующую терапию ЛБН совсем не помешало бы принципиально улучшить, поскольку ее нынешний потолок возможностей — не излечение, а лишь замедление заболевания и повышение выживаемости и качества жизни (хотя и это достигается далеко не всегда). Та же терапия ФЗТ (а это пока что «золотой стандарт») при всех своих преимуществах полна недостатков: лечение это во многом симптоматическое, требующее обременительных еженедельных инфузий и помогающее далеко не всем. Главные её недостатки — неспособность рекомбинантных ферментов свободно проникать во все пораженные ткани (особенно в центральную нервную систему) из-за их размера, высокая изменчивость иммунного ответа пациентов (вызывающая множество побочных эффектов и иногда снижение эффективности), а также лишь временный терапевтический эффект [21].
Вот почему медицинская потребность в лечении ЛБН далеко не удовлетворена, и помочь тут должна генная терапия — о чем мы уже довольно много написали в остальных статьях спецпроекта. Дело в том, что ЛБН сами по себе очень хорошо подходят для генной терапии, чему есть целый ряд причин. Во-первых, они моногенны: в теории, для их коррекции достаточно лишь «починить» один поломанный ген или же доставить его «здоровую копию» в нужные клетки и ткани. Облегчает такую стратегию и тот факт, что синтез целевых ферментов здесь, как правило, не подчиняется сложным регуляторным механизмам, и даже небольшого увеличения ферментативной активности зачастую достаточно для заметного улучшения.
В генном лечении таких болезней есть простор для творчества: тут можно использовать широкий спектр различных стратегий в зависимости от тканей, на которые необходимо воздействовать; и характеристик белка, который необходимо заменить. Функциональный ген может быть доставлен в клетки посредством прямого переноса вирусным вектором в подходе in vivo; или же опосредовано вместе с предварительно модифицированными теми же вирусными векторами клетками (а это уже лечение ex vivo) [21].
Подробнее об особенностях используемых в генной терапии технологий (в том числе на примерах уже одобренных лекарств) узнайте из самой первой и самой базовой статьи этого спецпроекта: «Генная терапия: познакомьтесь с лекарствами будущего» [22].
Что же, давайте пристальней взглянем на текущий ландшафт генного лечения: поймем, какие здесь уже есть успехи, а над чем ученым и исследователям еще предстоит плотно поработать.
Единственная пока одобренная генная терапия ЛБН: Libmeldy
Мы уже писали ранее об одобрении препарата Libmeldy (Orchard Therapeutics, теперь часть Kyowa Hakko Kirin) в Евросоюзе (в 2020 г.) [23], ну а в марте 2024 года это лекарство одобрили уже и в США под названием Lenmeldy. При этом установленная в Штатах стоимость ($4,25 млн) моментально сделала его самым дорогим лекарством в мире (на текущий момент — когда-то это была «Золгенсма» [24]). Этот препарат показал эффективность в лечении метахроматической лейкодистрофии (МЛД) — редкого заболевания, при котором страдает фермент арилсульфатаза (ARSA), в норме разрушающий сложные липиды — сульфатиды. Эти молекулы содержатся во всех тканях организма человека, но особо значимы для миелинизации нервных волокон (являясь составной частью миелина).
Поскольку миелин критически важен для корректной передачи нервного сигнала в ЦНС, его разрушение вследствие аномального накопления сульфатидов влечет множественные и прогрессирующие нарушения когнитивных и двигательных функций, включая тяжелые: мышечную атрофию, потерю зрения, слабоумие и в конечном итоге смерть. Полностью вылечить заболевание традиционными методами невозможно, однако аллогенная трансплантация гемопоэтических стволовых клеток в ряде случаев приостановит течение болезни (хотя её применение и само по себе связано со значительным риском летальности).
Libmeldy же — это по сути те же самые гемопоэтические стволовые клетки, только: а) исходно полученные из организма самого пациента (аутологичные), что снижает риски осложнений, связанных с включением трансплантационного иммунитета; б) перед введением пациенту они генетически модифицируются внедрением гена ARSA при помощи лентивирусного вектора (а это и есть терапия ex vivo ).
О том, как лентивирусные векторы помогают генным терапевтам в лечении ex vivo, служа главным инструментом доставки генов в этом протоколе, читайте в статье: «Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo» [25].
На данный момент срок наблюдения за получившими Libmeldy довольно длительный: до 12 лет (медиана 6,76); суммарное количество таких пациентов более 30 (в двух клинических исследованиях и программах расширенного доступа) [26].
Во всех этих исследованиях выяснилось, что у пациентов после лечебной инфузии довольно быстро восстанавливалась нормальная активность ARSA — в мононуклеарах периферической крови через три месяца, в спинномозговой жидкости — через 3–6 месяцев. Но главным были данные по общей выживаемости и выживаемости без тяжелых двигательных нарушений; и по состоянию когнитивных функций у пациентов. Здесь наблюдались разительные клинические улучшения: ведь в когорте без генного лечения пациенты если и выживали, то находились в крайне плачевном состоянии с постоянным ухудшением двигательных и когнитивных способностей [26].
Профиль безопасности Libmeldy также был приличным для такого рода генно-клеточного лечения: не было зафиксировано случаев смерти, связанных с трансплантацией ГСК. У одного из пациентов наблюдалась длительная тромбоцитопения и анемия; ряд серьезных побочных эффектов также был связан с кондиционированием бусульфаном (что неудивительно — это химиотерапевтический препарат со всеми вытекающими последствиями). Известно и о трех случаях смерти, с терапией не связанных (инсульт у одного человека; еще двое пациентов скончались ввиду быстрого развития заболевания — здесь, к сожалению, лечение просто-напросто не сработало).
Сложно втиснуть что-либо в заполненный до отказа чемодан, не освободив сначала для этого места. Трансплантация костного мозга требует похожей операции: сначала нужно «расчистить поляну», убив уже имеющиеся у пациента клетки костного мозга с помощью химиотерапевтических препаратов — это и есть кондиционирование.
Так или иначе, взвешивая параметры пользы и риска у Libmeldy, ученые определили, что их соотношение благоприятное: долгосрочная устойчивость лечения (за известный период наблюдения), а также в целом уже достаточно многообещающие терапевтические результаты. Конечно, нужно еще выяснить, распространится ли эффект от этого препарата на всю жизнь больного (как в общем-то задумано), а для этого потребуются дальнейшие наблюдения. Но ведь раньше МЛД нельзя было вылечить вовсе, так что польза от генной терапии тут уже очевидна: она дает прежде безнадежным пациентам шанс на продление жизни.
Клинические испытания
Различные генные терапии в настоящее время изучаются в клинических испытаниях, и поверхностный взгляд дает ощущение, что как ценность этого лечения, так и коммерческие перспективы для компаний-разработчиков пока недостаточны. Дело в том, что хотя фармкомпании активно инвестируют в генное лечение, они далеко не всегда доводят свои проекты до конца (исследования часто завершаются задолго до возможного одобрения у регулирующих органов и вывода на рынок). Далее рассмотрим всё это на конкретных примерах.
Лечение болезни Фабри
Терапия ex vivo
Тут гемопоэтические стволовые клетки сначала трансдуцировали лентивирусным вектором, кодирующим α-Gal A, затем вводили их обратно пациентам в нескольких клинических исследованиях. Задумка неплохая: ожидалось, что трансплантированные клетки уже в организме пациента дадут начало зрелым форменным элементам, содержащим здоровый ген α-галактозидазы, что позволило бы обеспечить достаточное количество функционального фермента, подарив пациентам длительный (или даже пожизненный) терапевтический эффект.
Исследования препарата AVR-RD-01 проводила компания Avrobio, и по промежуточным данным казалось, что в будущем ему светит успех. Первые результаты продемонстрировали безопасность и определенную эффективность: у пациентов повышался уровень α-Gal A, снижался уровень Gb3 в крови и уменьшались его скопления в почках; при этом сохранялась их стабильная функция. Однако уже позднее Avrobio сообщили о более изменчивых клинических ответах — например, у пяти пациентов активность α-Gal A неожиданно упала, а модифицированные стволовые клетки у них не росли и не размножались.
Учитывая все эти не самые обнадеживающие результаты, еще в начале 2022 года компания Avrobio снизила приоритеты для своей программы генной терапии болезни Фабри (а потом и вовсе закрылась), и на данный момент все три упомянутых выше исследования прекращены.
Терапия in vivo
Недавно в клинические испытания попали сразу четыре различных in vivo препарата: FLT-190, ST-920, AMT-191 и 4D-310. Все они инфузионного типа и содержат векторы аденоассоциированного вируса (AAV) для прямого введения пациентам. Эти векторы содержат гены α-Gal A, и их прямая инъекция должна привести к синтезу белка, компенсации его недостатка и к выздоровлению. Давайте кратко рассмотрим каждый из этих препаратов.
AAV — второй популярный инструмент генных терапевтов: в отличие от упомянутых выше лентивирусов, применимых для лечения ex vivo, AAV следует использовать именно для прямого введения in vivo. Этому способствует наличие множества их серотипов с различным тропизмом (сродством к разным типам клеток и тканей, позволяющим направлять векторы именно туда, где они больше всего нужны для излечения). О том, как всё это работает, и о самих этих векторах читайте в статье «Биомолекулы»: «Крохотные курьеры: как аденоассоциированные вирусы спасают жизни» [27].
FLT-190 — препарат компании Spur therapeutics (ранее Freeline). Результаты его исследования первоначально были позитивными: лекарство хорошо переносилось пациентами и обеспечивало стойкое и дозозависимое увеличение уровней α-Gal A в плазме, причем оно сохранялось до двух лет. Вроде бы при таком раскладе «дальше должно быть больше», однако компания очень быстро свернула эти испытания, сосредоточив усилия на другой своей генной терапии: FLT-201 при болезни Гоше (см. ниже), а FLT-190, по всей видимости были признан нерентабельным. По словам представителей Spur, хотя первоначально они были «воодушевлены данными по FLT-190», но именно FLT-201 несет бо́льшую ценность для пациентов (читаем: и перспективы бо́льшей прибыли).
AMT-191 — о данной генной терапии известно пока не очень много: компания UniQure еще только набирает пациентов в свое исследование. В нем больных будут распределять в две когорты, каждой из которых введут векторы на основе AAV5 в разных дозах. И хотя пока что трудно сказать что-либо определенное об эффективности и безопасности этого лечения, некоторый оптимизм внушает достаточно большой и весьма успешный опыт UniQure в деле вывода на рынок подобного рода лекарств. Дело в том, что они были пионерами, зарегистрировав вообще первый в Европе генотерапевтический препарат (Glybera) [22]; ну а платформа AAV5, использующаяся в AMT-191, уже хорошо зарекомендовала себя в лечении гемофилии .
Именно на AAV5 функционирует препарат Hemgenix, одобренный для применения при гемофилии B в Европе и США: мы писали об этом в статье «Как болезни крови генной терапией лечили» [23]; также мы рассказывали про это лекарство, когда оно находилось еще на этапе клинических испытаний: «АМТ-061 — генная терапия, способная на революцию в лечении гемофилии» [28].
4D-310 (от компании 4DMT) применяет для направленной доставки в ткани сердца особый вариант аденоассоциированного вектора — C102, имеющий тропизм к мышечным клеткам. Использование такого вектора более чем оправдано, ведь одна из основных причин смертности при болезни Фабри — накопление субстрата в клетках сердечно-сосудистой системы. Так что в теории тут всё очень интересно и перспективно, но что на практике? Если говорить о результатах исследований этого препарата, сейчас они скорее позитивные, хотя нельзя сказать, что для 4D-310 всё проходило гладко: у трех из шести участников его клинического испытания в какой-то момент развился хотя и очень редкий, но опасный атипичный гемолитико-уремический синдром. Такой недуг характеризуется прежде всего разрушением эритроцитов, низким количеством тромбоцитов, нарушением функции почек и неблагоприятным прогнозом (вплоть до летального исхода). Из-за этой проблемы в 2023 году FDA наложило запрет на клиническое исследование этого лекарства (правда, компания продолжила его испытывать в азиатско-тихоокеанском регионе).
На деле же всё оказалось не так страшно: за состоянием пациентов с осложнением внимательно наблюдали, и вскоре они пошли на поправку (всё разрешилось в течение месяца), а уже к концу 2023 года FDA разрешило продолжить исследования. По последним данным, новых тяжелых нежелательных явлений у пациентов не обнаружено, но зафиксировано клинически значимое улучшение работы сердца, связанное с активностью введенного трансгена. Опросы показывают, что терапия также улучшила их качество жизни, и исследования продолжаются.
ST-920 компании Sangamo Therapeutics сейчас ближе всего к одобрению, ведь на данный момент эта терапия находится в фазе 3 клинических испытаний, и при этом с одной стороны уже получила статус Fast Track от FDA в США, а с другой — EMA предоставило ей право на участие в программе PRIME в Европе. Данные клинических испытаний по 13 первым пациентам здесь также весьма обнадеживают — у всех наблюдалось устойчивое повышение активности α-Gal A в крови, а средний уровень его субстрата Gb3 снизился на 78%. Пациенты также сообщали об улучшении показателей качества жизни, не испытывая при этом серьезных побочных эффектов.
Однако есть здесь «ложка дегтя», способная затормозить выход этого препарата на рынок: представители Sangamo заявили, что компания не будет вкладывать средства в проведение регистрационных испытаний, пока не найдет партнера по коммерциализации.
Fast track — статус от FDA, призванный облегчить разработку и ускорить рассмотрение (и как следствие — возможное одобрение) данной организацией экспериментальных методов лечения серьезных заболеваний с неудовлетворенной (пока еще) потребностью. Цель — как можно быстрее предоставить пациентам такие новые важные лекарства.
PRIME — программа поддержки лекарственных средств от EMA (также удовлетворяющих незакрытые медицинские потребности) за счет оптимизации получения надежных данных об их преимуществах и рисках, а также ускорения рассмотрения и одобрения (для применения у людей) в Евросоюзе; и всё это опять же — чтобы пациенты поскорее получили доступ к этим прорывным лекарствам.
Лечение болезни Гоше 2 типа in vivo
Генная терапия болезни Гоше в настоящее время изучается в нескольких клинических испытаниях, по большинству из которых данных пока немного. Одно из них — PROVIDE — проводится Prevail Therapeutics (недавно приобретена фармгигантом Eli Lilly), и тут страдающим болезнью Гоше 2 типа младенцам в составе вектора AAV9 вводили ген GBA1 (кодирующий глюкоцереброзидазу). Цель — изучить иммуногенность данного вектора и оценить изменения уровней глюкоцереброзидазы в крови и спинномозговой жидкости в ответ на терапию. Результаты пока не опубликованы... [29] Также Spur Therapeutics объявила об обновленных результатах клинического исследования фаз 1/2 GALILEO-1, оценивающего FLT-201, — генную терапию на основе вектора AAVS3 , специфичного для гепатоцитов, а также о планах по запуску фазы 3 этой терапии.
AAVS3 — плод рационального редизайна природных серотипов AAV, заражающий клетки печени даже лучше, чем часто используемые в клинике варианты векторов AAV5 и AAV8 [30]. Подробнее о возможностях инжиниринга AAV (на пользу медицины) расскажет статья: «Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo» [31].
По результатам анализа эффективности: уровни гемоглобина и тромбоцитов нормализовались у пяти пациентов, получавших генную терапию (по состоянию на 30 июня 2024 г.). У четверых из них ранее также сохранялся высокий уровень в крови специфичного для болезни Гоше биомаркера глюкозилсфингозина (Lyso-Gb1) , который значительно снизился после лечения FLT-201. У двух же пациентов даже наличие нейтрализующих глюкоцереброзидазу антител не смогло принципиально повлиять на эффективность лечения.
Этот маркер свидетельствует о накоплении нерасщепленного глюкоцереброзидазой субстрата в организме.
Также известно, что один принявший участие в исследовании пациент с изнуряющей хронической болью и усталостью после лечения сообщил о значительном снижении этих симптомов и об улучшении функционального состояния. Spur характеризуют безопасность и переносимость FLT-201 как «благоприятные» на основе данных о всех шести пациентах, прошедших лечение в GALILEO-1 (один был исключен из анализа эффективности, так как у него нашли антитела к AAVS3).
Лечение болезни Гоше 1 типа ex vivo
В 2019 году компания Avrobio запустила исследование GUARD, в котором изучала препарат AVR-RD-02 — это гемопоэтические стволовые клетки самого пациента, которые у него «изъяли», внедрили в них лентивирусным вектором ген GBA, а затем ввели обратно ему же в протоколе ex vivo. По результатам этого исследования есть данные о безопасности и эффективности: у четырех пролеченных пациентов наблюдалась нормализация активности глюкоцереброзидазы в плазме и лейкоцитах периферической крови; количество Lyso-Gb1 у них также снизилось на 21–70% (в сравнении с уровнем, когда они были на ФЗТ). Кроме того, у некоторых пациентов снизились и симптомы органомегалии: селезенка и печень существенно (на >10%) уменьшились в объеме. Серьезных нежелательных явлений не было; в целом, у всех четырех пациентов наблюдались улучшения по сравнению с исходными показателями на ФЗТ.
К сожалению, как мы уже упоминали, Avrobio закрылась после неудачи по болезни Фабри, досрочно прекратив это исследование в августе 2023 года.
Болезнь Помпе
Лечение классической (инфантильной) формы болезни Помпе доставкой вектором AAV1 гена GAA в мышечные клетки диафрагмы
Университет Флориды в США спонсировал клиническое исследование фаз 1/2, в котором приняли участие девять детей в возрасте 2–18 лет с инфантильной формой болезни Помпе, находящихся в достаточно тяжелом состоянии. У всех была дыхательная недостаточность — легкие не могли эффективно насыщать кровь кислородом и выводить излишки углекислого газа из организма. При этом маленькие пациенты не реагировали ни на ФЗТ, ни на предоперационные упражнения для их дыхательных мышц (проводимые с использованием специального тренажера — Inspiratory Muscle Strength Training [32]).
Всем участникам этого исследования вводили ген GAA вместе с вектором AAV1 в диафрагмальную мышцу (посредством трех инъекций с каждой стороны). Цель — оценка безопасности лечения в первый год после инъекций. Результаты были в основном положительными, без серьезных нежелательных явлений. Однако поскольку введение в диафрагму — само по себе хирургическое вмешательство, — были проблемы, связанные уже с этим: плевральный выпот; скопление жидкости между слоями ткани, выстилающей легкие и грудную клетку; и боль (которую можно контролировать приемом лекарств). Другие осложнения, связанные с процедурой, включали коллапс легкого и травматическое повреждение легкого — все они купировались в течение времени наблюдения (в том числе с помощью сопроводительной терапии). Самое страшное, что произошло: почти четыре года спустя один из пациентов скончался из-за мозгового кровотечения, вызванного токсическим накоплением гликогена из-за болезни (но не связанным с введением вектора).
В плане эффективности результаты испытаний продемонстрировали, что сочетание генной терапии с дыхательными упражнениями, направленными на укрепление мышц, необходимых для втягивания воздуха в легкие, привело к улучшению двигательной функции диафрагмы. Преимущества были особенно выражены у самых младших пациентов: правда, у них нервно-мышечная функция и так была лучше всех, и искусственная вентиляция легких им требовалась меньше остальных.
Данные первых пяти участников исследования [33] показали, что объем дыхания без посторонней помощи увеличился на 28,8% спустя полгода после генного лечения. Время без ИВЛ также увеличилось, хотя это изменение и не было статистически значимым.
Несмотря на положительные в целом результаты, сделать по ним далеко идущие выводы пока сложно: малый размер выборки, недостаточная длительность наблюдения, малая изученность эффективности внутридиафрагмального введения AAV1 — всё это делает данные по эффективности и безопасности неполными (а значит, для корректной оценки этой терапии потребуются дополнительные исследования) [34].
ACTUS-101 от AskBio —
лечение болезни Помпе с поздним началом (БППН) с помощью псевдотипированных векторов AAV2/8, представляющих собой капсид AAV8, полученный с использованием гена rep от AAV2 и содержащий терапевтический трансген, ограниченный инвертированными концевыми повторами (ITR) от AAV2. Такая модификация способствует эффективной трансдукции гепатоцитов и высокому уровню экспрессии терапевтического трансгена (рис. 9) [49–51].
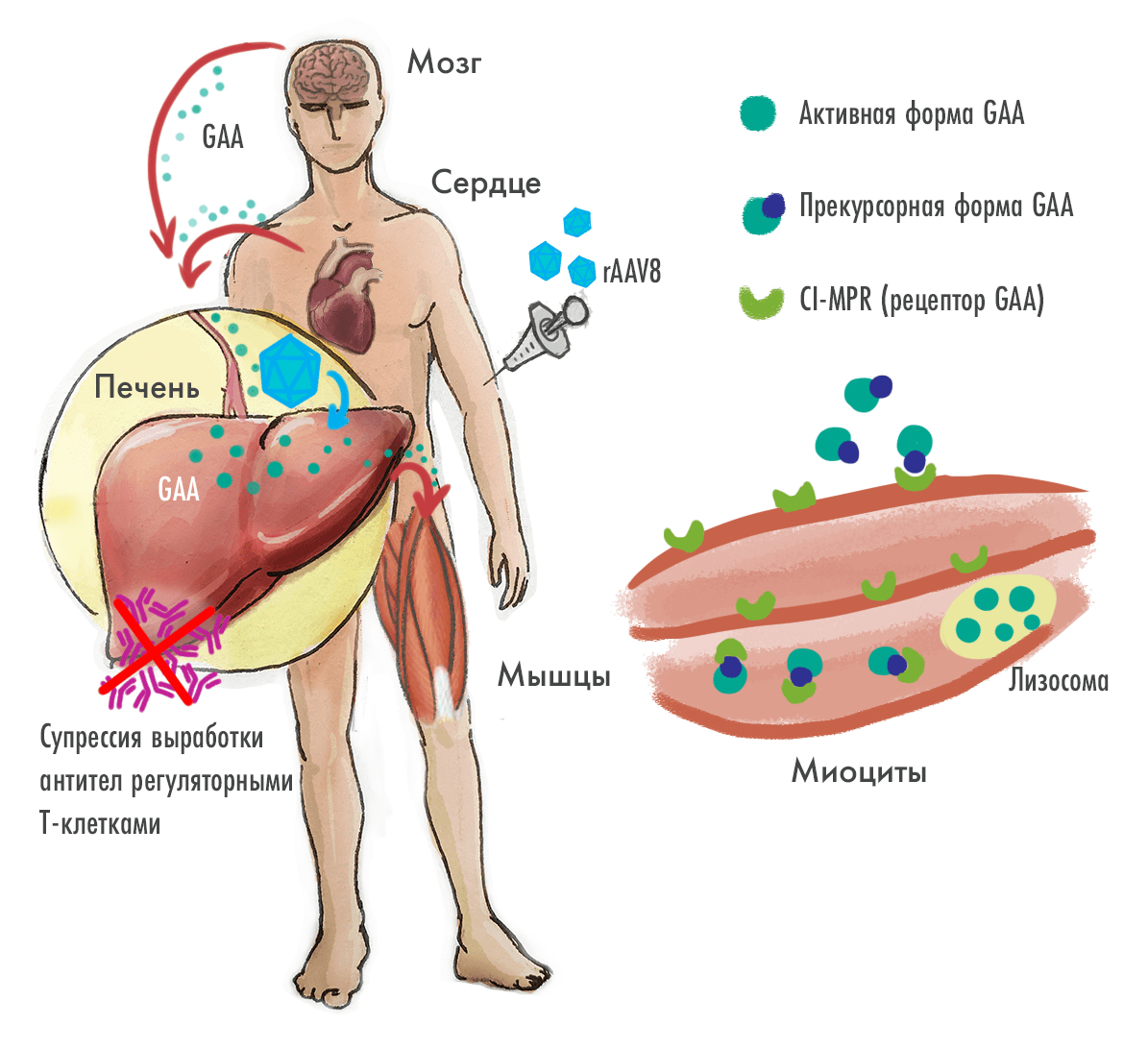
Рисунок 9. Принцип генной терапии, нацеленной на печень
иллюстрация Елены Беловой по [47]
Вообще-то в последнее время векторы на основе аденоассоциированного вируса всё чаще используются для трансдукции печени с целью получения в организме секретируемых ею белков, например факторов свертывания (так лечат гемофилию с помощью AAV5, см. выше) и лизосомальных ферментов, — а это может помочь уже в лечении болезней накопления (таких как болезнь Помпе). Суть данного подхода вот какая: инфицируя клетки печени — гепатоциты — и оставаясь в них, векторы начинают вырабатывать соответствующие терапевтические белки, которые транспортируются по всему организму вместе с кровью, оказывая системное терапевтическое воздействие.
Вектор AAV2/8 в ACTUS-101 кодирует кислую альфа-глюкозидазу (GAA) и нацелен на устранение её дефицита у пациентов с болезнью Помпе. Представители компании AskBio еще в январе 2019 объявили, что доза данного вектора была введена первому пациенту, но с тех пор обновлений по их исследованию было немного. Последние новости были представлены на 25-м ежегодном собрании Американского общества генной и клеточной терапии (ASGCT) в мае 2022 года: через две недели после начала лечения препаратом ACTUS-101 три пациента продемонстрировали устойчивое повышение уровня GAA в сыворотке крови — на 101–235%. Уже к 24-й неделе все они соответствовали критериям отмены ФЗТ, и это сохранялось в дальнейшем (по данным на 52-ю и 104-ю недели лечения), хотя один из пациентов вскоре предпочел возобновить заместительную терапию (на 97-й неделе).
Исследование это имело несколько ограничений: оно не было сравнительным, не оценивало неврологические изменения (в ЦНС, ПНС) под влиянием вектора, а его статистическая мощность была недостаточной для оценки эффективности. Однако здесь не было и связанных с лечением серьезных нежелательных явлений, а остановка развития симптомов болезни Помпе после прекращения ФЗТ, как минимум, оправдывает дальнейшую разработку и исследование этой терапии [35].
AT-845 от Astellas Pharma —
экспериментальная генная терапия на основе вектора AAV8 для лечения БППН. Вектор здесь оснащен «мышечно-специфичным» промотором: ведь именно здесь так не хватает кодируемого данного генной терапией белка. В теории всё это поможет избежать (или хотя бы минимизировать) снижения эффективности адресной доставки фермента в мышцу . Так что как ни крути — это довольно-таки перспективный подход.
Это ограничение как для ФЗТ, так и для системной доставки целевых ферментов с помощью трансгенных гепатоцитов, инфицированных векторами AAV (как в случае ACTUS-101) [36]. В обоих случаях ферменту еще нужно попасть в мышечные клетки, тогда как при синтезе прямо в мышечных клетках фермент уже находится в месте назначения.
Лечебный вектор в данном случае также доставляет ген человеческого GAA и в клиническом исследовании FORTIS уже предварительно продемонстрировал неплохую эффективность. Судите сами: из четырех получивших генное лечение, трое смогли прекратить инъекции ФЗТ, повысив качество своей жизни. Все они с течением времени после начала генной терапии показали стабильную форсированную жизненную емкость легких. Аналогично их результаты в тесте 6-минутной ходьбы оставались стабильными даже после того, как они прекратили использовать ФЗТ. Если при лечении AT-845 и были нежелательные явления, то исключительно легкие, так что исследование продолжается.
Тест с 6-минутной ходьбой используют (в том числе и при болезни Помпе) для определения функционального статуса пациентов с патологией органов дыхания, оценки прогноза заболевания и эффективности терапии.
Мукополисахаридозы
МПС I и II
Подход ex vivo
В исследовании восемь двухлетних детей с тяжелым МПС I (синдромом Гурлер) после миелоаблативного кондиционирования получили аутологичные гемопоэтические стволовые клетки, трансдуцированные ex vivo с помощью лентивирусного вектора, кодирующего α-L-идуронидазу (IDUA) [37]. После двухлетнего наблюдения это лечение было признано безопасным, и у всех пациентов наблюдалось быстрое и устойчивое приживление генно-скорректированных клеток. Также наблюдалась устойчивая супрафизиологическая активность IDUA в крови с нормализацией экскреции глюкозаминогликанов (ГАГ) с мочой у большинства пациентов. Интересно, что в цереброспинальной жидкости появилась активность IDUA, а концентрации ГАГ, напротив, снижались, что говорит о биохимической нормализации ЦНС.
Системный эффект терапии подтверждался также стабильными когнитивными показателями, улучшением двигательного развития и снижением скованности суставов. Примечательно, что все включенные пациенты изначально были бессимптомными, что подчеркивает, что эффективным может быть только своевременно начатое лечение [38].
Подход in vivo
Чтобы сделать производство трансгена как можно более быстрым (это позволит лечить большее количество пациентов — с симптомами уже на момент постановки диагноза), для МПС I активно исследуются подходы in vivo. Например, IDUA доставляется вектором AAV9 непосредственно в центральную нервную систему, что в теории очень перспективно, но, к сожалению, довольно инвазивно (рис. 10). Результаты исследования пока не опубликованы.
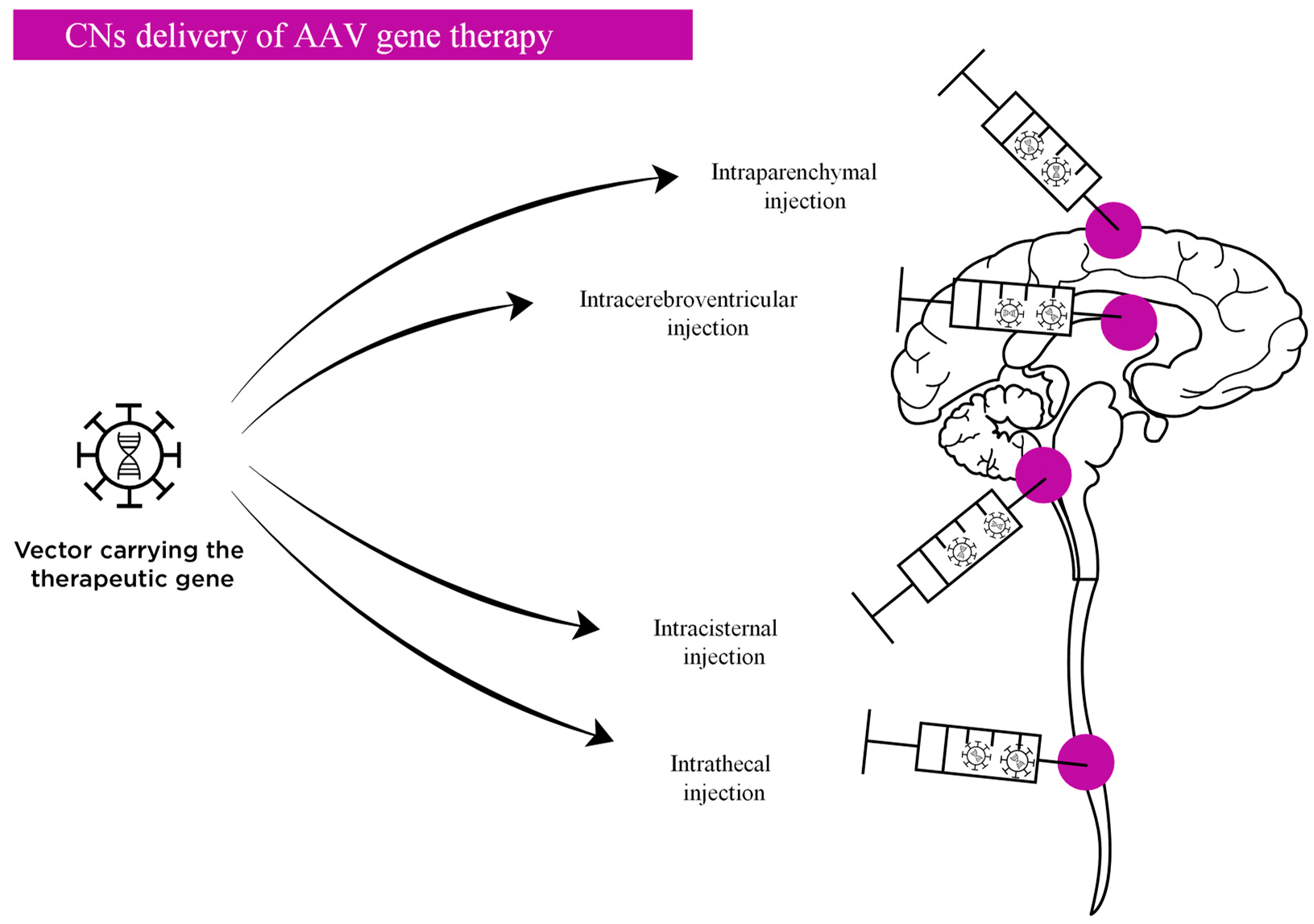
Рисунок 10. Прямые пути введения в ЦНС in vivo при МПС. Этот подход включает интрапаренхиматозное, интрацеребровентрикулярное, интрацистернальное и интратекальное введение. К сожалению, стратегии прямого воздействия на ЦНС обычно очень инвазивны.
При МПС I вектором AAV пробовали также доставлять инструменты генного редактирования в клетки печени, а именно — небезызвестные нуклеазы на основе белков с доменом «цинковые пальцы» (ZFN) . Исследование это имело благоприятный профиль безопасности, и даже выявило факт целевого редактирования генома в клетках печени, но вот незадача — синтез фермента в крови тут не поддерживался. Аналогичный подход использования ZFN с аналогичными же результатами продемонстрировали и при МПС II (оба этих исследования запустила компания Sangamo Therapeutics) [38], [39].
О том, как работает этот инструмент генного редактирования, можно прочитать в статье «Биомолекулы»: «12 методов в картинках: генная инженерия. Часть II» [5].
Есть еще несколько исследований терапии in vivo с использованием AAV при МПС II [38], однако данных о них сейчас так мало, что рассказывать тут пока особо не о чем...
МПС III (Синдром Санфилиппо)
Лечение ex vivo
В настоящее время проводится клиническое исследование генной терапии ex vivo МПС IIIA с использованием аутологичных гемопоэтических стволовых клеток, трансдуцированных лентивирусным вектором с геном SGSH — именно он кодирует дефектный при этой болезни фермент гепаран-N-сульфатазу (сульфамидазу). Предварительные данные по первому пациенту, прошедшему лечение, здесь уже несколько обнадеживают, показывая экспрессию целевого фермента, а также снижение концентрации ГАГ в плазме крови, спинномозговой жидкости и моче. Однако, поскольку результаты исследования еще опубликованы, делать выводы пока рано.
Лечение in vivo
В рамках in vivo подхода проведены два клинических исследования с использованием доставки AAV непосредственно в мозг при МПС IIIA и МПС IIIB у очень юных больных: от 1,5 до 6 лет (в каждом исследовании участвовало по четыре пациента). В обоих случаях наблюдалась устойчивая выработка дефицитного фермента в месте введения и улучшение нейрокогнитивных функций, особенно заметное у самых маленьких больных [38].
В первом исследовании для повышения активности фермента использовали вектор AAVrh.10, несущий как ген SGSH, так и SUMF1, поскольку последний кодирует «модифицирующий сульфатазу фактор 1», посттрансляционно активирующий сульфамидазу. Вероятно, именно такой подход обеспечил эффект: пролеченные пациенты демонстрировали стабильные двигательные и когнитивные навыки, что побудило спонсора этого исследования — компанию Lysogene — запустить еще одно, более крупное, испытание. Речь о многоцентровом КИ AAVance, в котором участвовали 20 пациентов: в мозг им вводили уже на порядок более высокие дозы вектора AAVrh.10 с усиленным промотором для эффективного управления экспрессией SGSH [40].
К сожалению, это исследование не достигло первичной конечной точки по эффективности: для 12 пациентов из основной когорты (старше 30 месяцев) оно не продемонстрировало статистически значимого улучшения коэффициента развития (DQ) через два года после введения препарата. Вторичные конечные точки эффективности для этих пациентов также не были достигнуты: ими были процент субъектов с улучшением или стабилизацией когнитивного, языкового и моторного возраста развития, а также отсутствие снижения баллов VABS-II (т.н. шкалы адаптивного поведения Вайнленда).
DQ — это мера развития по сравнению с нормативными значениями для населения, сродни коэффициенту интеллекта или IQ.
Шестеро пациентов младше 30 месяцев из вспомогательной когорты как раз смогли достичь описанных выше и первичной, и вторичных точек, что еще раз указывает на необходимость как можно более раннего начала генетического лечения.
Ко всему прочему, в США исследование AAVance приостановило FDA после того, как у некоторых пациентов на снимках МРТ нашли кисты в местах инъекций в мозг [40], [41]. На ClinicalTrials.gov статус исследования сейчас помечен как «неизвестно», и, похоже, это же можно сказать и о будущем этой (всё же довольно многообещающей) генной терапии.
Генная терапия UX111 (Ultragenyx)
Довольно-таки многообещающие результаты были получены компанией Ultragenyx, запустившей клиническое исследование своей генной терапии in vivo UX111. Этот подход включает однократную внутривенную инфузию с использованием самокомплементарного вектора AAV9 для доставки функциональной копии гена SGSH в клетки.
«Самокомплементарность» (self-complementary AAV, scAAV) означает, что вектор имеет двойную спираль ДНК (обычные AAV содержат одноцепочечный генетический материал), что позволяет ускорить экспрессию, а значит — поскорее получить и лечебный эффект [31].
В целом, в когорте 3 клинического исследования Transpher A фазы 1/2/3 10 из 22 пациентов получали лечение в период до развития выраженной нейродегенерации, и основным его эффектом было быстрое снижение уровня гепарансульфата (ГС) в цереброспинальной жидкости (что свидетельствует о компенсации ферментативной недостаточности). Важно: с точки зрения безопасности в исследовании Transpher A пока что не было зарегистрировано ни одного случая смерти, серьезных нежелательных явлений, связанных с приемом препарата, или каких-либо тяжелых побочных эффектов.
У маленьких пациентов также наблюдали некоторое улучшение нейрокогнитивных показателей, обычно страдающих при МПС IIIA. Всё это дало право претендовать на большее: UX111 уже получила статусы Fast Track в США и PRIME в Европе, и, вероятно, близка к одобрению.
МПС VI
Мукополисахаридоз VI типа обычно не затрагивает мозг, а потому и лечение, не требующее болезненных инъекций в ЦНС, тут может быть попроще, на уровне системных инъекций. Собственно, это-то и было продемонстрировано в исследовании, где нацеленный на печень AAV8 помог скомпенсировать нарушенный при МПС VI фермент арилсульфатазу B (ARSB). Участники в группе с высоким дозированием вектора показали устойчивую активность ARSB в сыворотке крови (30–100% от среднего значения для здорового человека) и улучшения биохимических показателей, свидетельствующие о коррекции ферментативной недостаточности. У этих пациентов клинического ухудшения не наблюдалось в течение двух лет после начала генного лечения, несмотря на прерывание ФЗТ [38].
Заключение
Итак, интерес к лечению ЛБН пока только растет, ведь имеющуюся здесь неудовлетворенную потребность постепенно получается закрывать благодаря внедрению самых разных передовых терапевтических подходов (многие из которых мы рассмотрели выше). Надо сказать, что сама эта потребность при разных лизосомных болезнях (а иногда и при разных формах одной и той же ЛБН) зачастую сильно варьирует: при легком течении необходимость внедрения новых терапий не столь критична — потребности таких пациентов вполне можно «удовлетворить» и текущим лечением. Совсем другое дело, если форма заболевания очень тяжелая, и больные при доступе только к «обычному» лечению практически обречены: в этом случае инновационные методы генных терапий могут подарить им надежду на жизнь и здоровье, а это очень трудно переоценить.
Возможные в будущем улучшения генных вмешательств: замещение векторов AAV для системной доставки генов во многом более безопасными невирусными методами, постепенно внедряемыми в область генной терапии, ну и расширение потенциала генных коррекций инструментами геномного редактирования (CRISPR-Cas, ZFN, base-editing, prime-editing и др.), также медленно, но верно проникающими в современную терапевтическую практику.
Продолжение исследований в этой области важно и по другой причине: в последнее время всё чаще признается, что молекулярные пути, связанные с патофизиологией лизосомных болезней, нарушаются при гораздо более распространенных нейродегенеративных расстройствах [42]. Дело в том, что хотя основным виновником сбоев в организме при ЛБН и считается накопление первичных субстратов (в норме расщепляемых лизосомными ферментами), теперь уже известно, что тут существует целый каскад других молекулярных отклонений. В частности, нарушения регуляции сигнальных путей, активация воспаления, накопление токсичных веществ (не имеющих прямого отношения к первичным субстратам), например таких склонных к агрегации белков как альфа-синуклеин [43], прионный белок, белок-тау, бета-амилоид и прочие. А ведь все эти накапливаемые «белковые товарищи» нам совсем не товарищи: они, как известно, связаны с патогенезом болезней Альцгеймера, Паркинсона и Хантингтона [44]. Из-за широкой распространенности подобных недугов, ученые очень-очень интересуются связью между патогенными процессами при ЛБН и нейродегенеративными заболеваниями, и, похоже, между ними действительно имеется кое-что общее [1]...
В частности, многие недавние исследования указывают на взаимосвязь между механизмами развития генетически обусловленных лизосомных расстройств и болезнью Паркинсона. Аномалии в лизосомах, по всей видимости, влияют на развитие этого заболевания; вероятны также связи и между другими нейродегенеративными расстройствами и ЛБН [45]. Если же в будущем связи такого рода удастся полностью прояснить, это может стать основой для использования при лечении нейродегенеративных заболеваний лекарств, которые применимы и при ЛБН. Хочется верить, что когда (и если) это произойдет, уже будет много подобного рода эффективного лечения. А для его разработки особенно привлекательна как раз генная терапия — ведь как мы уже говорили: она потенциально может излечивать лизосомные болезни.
Литература
- Giancarlo Parenti, Diego L Medina, Andrea Ballabio. (2021). The rapidly evolving view of lysosomal storage diseases. EMBO Mol Med. 13;
- Fabry Disease: Perspectives from 5 Years of FOS / ed. by Mehta A., Beck M., Sunder-Plassmann G. Oxford: Oxford PharmaGenesis, 2006;
- Три поколения лекарств;
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Болезнь Фабри: частая среди редких;
- Rajkumar V. and Dumpa V. Lysosomal Storage Disease. In: StatPearls. Treasure Island (FL): StatPearls Publishing, 2024;
- Fabiano de Oliveira Poswar, Filippo Vairo, Maira Burin, Kristiane Michelin-Tirelli, Ana Carolina Brusius-Facchin, et. al.. (2019). Lysosomal diseases: Overview on current diagnosis and treatment. Genet. Mol. Biol.. 42, 165-177;
- Peter J. Meikle. (1999). Prevalence of Lysosomal Storage Disorders. JAMA. 281, 249;
- An overview of Lysosomal Storage Disorders & Sanofi`s Commitment to the Development and Provision of Treatments. (2023). Sanofi;
- Stephen Waldek, Manesh R. Patel, Maryam Banikazemi, Roberta Lemay, Philip Lee. (2009). Life expectancy and cause of death in males and females with Fabry disease: Findings from the Fabry Registry. Genetics in Medicine. 11, 790-796;
- От бизнеса ученых к законотворчеству;
- Angela Sun. (2018). Lysosomal storage disease overview. Ann. Transl. Med. 6, 476.-476.;
- Stone W.L., Basit H., Mukkamalla S.K.R., Master S.R. Gaucher Disease. In: StatPearls. Treasure Island (FL): StatPearls Publishing, 2024;
- A. D. Dornelles, A. P. P. Junges, B. Krug, C. Gonçalves, H. A. de Oliveira Junior, I. V. D. Schwartz. (2024). Efficacy and safety of enzyme replacement therapy with alglucosidase alfa for the treatment of patients with infantile-onset Pompe disease: a systematic review and metanalysis. Front. Pediatr.. 12;
- Marine Tardieu, Céline Cudejko, Aline Cano, Célia Hoebeke, Delphine Bernoux, et. al.. (2023). Long‐term follow‐up of 64 children with classical infantile‐onset Pompe disease since 2004: A French real‐life observational study. Euro J of Neurology. 30, 2828-2837;
- Hannah A. Blair. (2023). Cipaglucosidase Alfa: First Approval. Drugs. 83, 739-745;
- Paola Faverio, Anna Stainer, Federica De Giacomi, Serena Gasperini, Serena Motta, et. al.. (2019). Molecular Pathways and Respiratory Involvement in Lysosomal Storage Diseases. IJMS. 20, 327;
- Johanna H. van der Lee, Jonathan Morton, Heather R. Adams, Lorne Clarke, Berendine Johanne Ebbink, et. al.. (2017). Cognitive endpoints for therapy development for neuronopathic mucopolysaccharidoses: Results of a consensus procedure. Molecular Genetics and Metabolism. 121, 70-79;
- Нестерова Ю. (2017). Мукополисахаридоз: короткая жизнь с надеждой на будущее. MedAboutMe;
- Valentina La Cognata, Maria Guarnaccia, Agata Polizzi, Martino Ruggieri, Sebastiano Cavallaro. (2020). Highlights on Genomics Applications for Lysosomal Storage Diseases. Cells. 9, 1902;
- Генная терапия: познакомьтесь с лекарствами будущего;
- Как болезни крови генной терапией лечили;
- Самое дорогостоящее лекарство в мире;
- Лентивирусные векторы: как они стали лучшими векторами для терапии ex vivo;
- Francesca Fumagalli, Valeria Calbi, Fabiola De Mattia, Alberto Zambon, Vera Gallo, et. al.. (2024). P005: Atidarsagene autotemcel (hematopoietic stem cell–gene therapy) preserves cognitive and motor development in metachromatic leukodystrophy with up to 12 years follow-up*. Genetics in Medicine Open. 2, 100882;
- Крохотные курьеры: как аденоассоциированные вирусы спасают жизни;
- АМТ-061 — генная терапия, способная на революцию в лечении гемофилии;
- Akhil Kulkarni, Tiffany Chen, Ellen Sidransky, Tae-Un Han. (2024). Advancements in Viral Gene Therapy for Gaucher Disease. Genes. 15, 364;
- Jey M. Jeyakumar, Azadeh Kia, Lawrence C. S. Tam, Jenny McIntosh, Justyna Spiewak, et. al.. (2023). Preclinical evaluation of FLT190, a liver-directed AAV gene therapy for Fabry disease. Gene Ther. 30, 487-502;
- Время первых: как аденоассоциированные вирусы стали лучшими в доставке генов in vivo;
- Jun Kido, Keishin Sugawara, Kimitoshi Nakamura. (2023). Gene therapy for lysosomal storage diseases: Current clinical trial prospects. Front. Genet.. 14;
- Barbara K. Smith, Shelley W. Collins, Thomas J. Conlon, Cathryn S. Mah, Lee Ann Lawson, et. al.. (2013). Phase I/II Trial of Adeno-Associated Virus–Mediated Alpha-Glucosidase Gene Therapy to the Diaphragm for Chronic Respiratory Failure in Pompe Disease: Initial Safety and Ventilatory Outcomes. Human Gene Therapy. 24, 630-640;
- Barbara K. Smith, A. Daniel Martin, Lee Ann Lawson, Valerie Vernot, Jordan Marcus, et. al.. (2017). Inspiratory muscle conditioning exercise and diaphragm gene therapy in Pompe disease: Clinical evidence of respiratory plasticity. Experimental Neurology. 287, 216-224;
- Edward C. Smith, Sam Hopkins, Laura E. Case, Ming Xu, Crista Walters, et. al.. (2023). Phase I study of liver depot gene therapy in late-onset Pompe disease. Molecular Therapy. 31, 1994-2004;
- Michelle Eggers, Charles H Vannoy, Jianyong Huang, Pravinkumar Purushothaman, Jacqueline Brassard, et. al.. (2022). Muscle‐directed gene therapy corrects Pompe disease and uncovers species‐specific GAA immunogenicity. EMBO Mol Med. 14;
- Bernhard Gentner, Francesca Tucci, Stefania Galimberti, Francesca Fumagalli, Maurizio De Pellegrin, et. al.. (2021). Hematopoietic Stem- and Progenitor-Cell Gene Therapy for Hurler Syndrome. N Engl J Med. 385, 1929-1940;
- Alessandro Rossi, Nicola Brunetti‐Pierri. (2024). Gene therapies for mucopolysaccharidoses. J of Inher Metab Disea. 47, 135-144;
- Paul Harmatz, Carlos E. Prada, Barbara K. Burton, Heather Lau, Craig M. Kessler, et. al.. (2022). First-in-human in vivo genome editing via AAV-zinc-finger nucleases for mucopolysaccharidosis I/II and hemophilia B. Molecular Therapy. 30, 3587-3600;
- Marianna Bugiani, Truus E. M. Abbink, Arthur W. D. Edridge, Lia van der Hoek, Anne E. J. Hillen, et. al.. (2023). Focal lesions following intracerebral gene therapy for mucopolysaccharidosis
IIIA . Ann Clin Transl Neurol. 10, 904-917; - Lysogene Provides Updates and Topline Results from Phase 2/3 AAVance Gene Therapy Clinical Study. (2022). BioSpace;
- Fabiano de Oliveira Poswar, Filippo Vairo, Maira Burin, Kristiane Michelin-Tirelli, Ana Carolina Brusius-Facchin, et. al.. (2019). Lysosomal diseases: Overview on current diagnosis and treatment. Genet. Mol. Biol.. 42, 165-177;
- Белок альфа-синуклеин — важный участник проявления болезни Паркинсона?;
- Нейродегенерации, или Массовые вымирания нейронов;
- Rebecca Mächtel, Fanni Annamária Boros, Jan Philipp Dobert, Philipp Arnold, Friederike Zunke. (2023). From Lysosomal Storage Disorders to Parkinson’s Disease – Challenges and Opportunities. Journal of Molecular Biology. 435, 167932;
- Carlos Fernández-Pereira, Beatriz San Millán-Tejado, María Gallardo-Gómez, Tania Pérez-Márquez, Marta Alves-Villar, et. al.. (2021). Therapeutic Approaches in Lysosomal Storage Diseases. Biomolecules. 11, 1775;
- Priya S. Kishnani, Dwight D. Koeberl. (2019). Liver depot gene therapy for Pompe disease. Ann. Transl. Med. 7, 288-288;
- María José de Castro, Mireia del Toro, Roberto Giugliani, María Luz Couce. (2021). Gene Therapy for Neuronopathic Mucopolysaccharidoses: State of the Art. IJMS. 22, 9200;
- Крохотные курьеры: как аденоассоциированные вирусы спасают жизни;
- Sang-oh Han, Giuseppe Ronzitti, Benjamin Arnson, Christian Leborgne, Songtao Li, et. al.. (2017). Low-Dose Liver-Targeted Gene Therapy for Pompe Disease Enhances Therapeutic Efficacy of ERT via Immune Tolerance Induction. Molecular Therapy - Methods & Clinical Development. 4, 126-136;
- Guang-Ping Gao, Mauricio R. Alvira, Lili Wang, Roberto Calcedo, Julie Johnston, James M. Wilson. (2002). Novel adeno-associated viruses from rhesus monkeys as vectors for human gene therapy. Proc. Natl. Acad. Sci. U.S.A.. 99, 11854-11859.






