Генномодифицированные клетки борются со страшной болезнью
30 декабря 2019
Генномодифицированные клетки борются со страшной болезнью
- 1574
- 0
- 11
Генномодифицированные кроветворные стволовые клетки способны компенсировать врожденный недостаток фермента, приводящий к деградации нервных волокон
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Темы
В последней статье спецпроекта о современных лекарствах речь пойдет об очень редком заболевании — метахроматической лейкодистрофии. Однако революционный подход, который уже показал эффективность в ее лечении, может быть распространен и на более частые болезни. Теперь важно, чтобы последующие клинические данные не обманули ожиданий.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.

Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Что такое метахроматическая лейкодистрофия?
Метахроматическую лейкодистрофию (MLD) еще называют сульфатидным липидозом. Это одна из многочисленных так называемых лизосомных болезней накопления. Их общая черта в том, что в результате генетического дефекта у человека нарушается нормальная работа одного из ферментов, отвечающих за превращения веществ в лизосомах. В зависимости от того, какой фермент «сломан», в лизосомах накапливаются разные соединения, и при этом поражаются разные органы. Самые известные и распространенные болезни накопления — Гоше, Помпе, Фабри и Хантера.
При MLD не работает (или недостаточно активен) фермент арилсульфатаза А (ARSA), которая катализирует отщепление сульфата от цереброзидсульфата с образованием цереброзида — главного гликолипида миелина (рис. 1) [6].
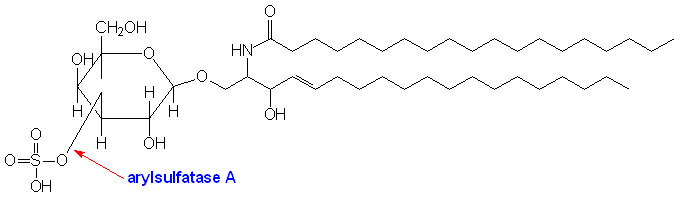
Рисунок 1. Структура цереброзидсульфата (3-О-сульфогалактозилцерамида). Стрелкой показана связь, которую расщепляет арилсульфатаза А.
Иногда MLD вызывается дефектами гена, кодирующего сапозин Б — белок, необходимый для активности ARSA. Однако чаще MLD развивается как следствие мутаций в гене ARSA. В настоящее время известно более 60 мутаций ARSA, которые приводят к нарушениям различной тяжести в зависимости от снижения активности фермента.
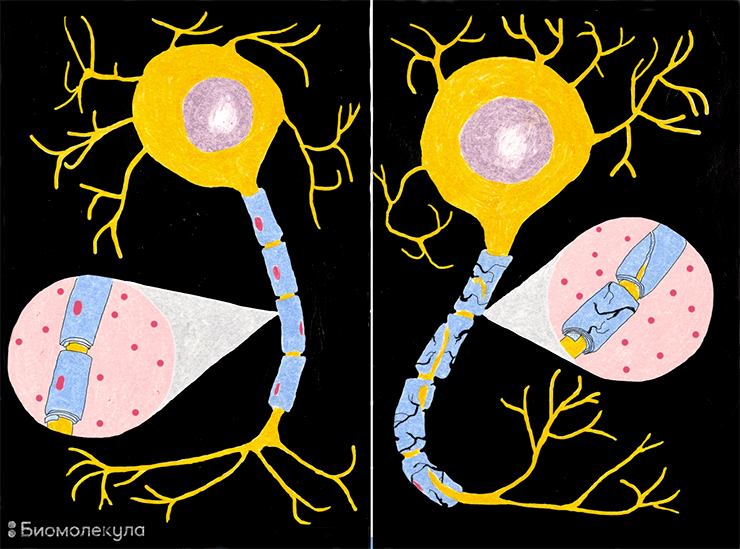
Что же это за нарушения и как они проявляются? Фермент ARSA в норме больше всего активен в клетках, которые вырабатывают миелин, то есть в олигодендроцитах ЦНС и в Шванновских клетках периферической нервной системы. При дисфункции ARSA в лизосомах этих клеток накапливается цереброзидсульфат (или сульфатид, откуда второе название болезни — сульфатидный липидоз), что в итоге приводит к их гибели. Поэтому MLD в первую очередь приводит к разрушению белого вещества (миелина), отсюда и название — лейкодистрофия (от греч. λευκός — «белый», δυσ- — «нарушение», τροφή — «рост») (рис. 2). Метахроматической лейкодистрофия называется из-за того, что цвет гранул цереброзидсульфата при микроскопическом исследовании резко отличается от фона (от греч. μετά — «рядом, другой» и χρῶμα — «цвет»). Основные проявления MLD — неврологические: в первую очередь задержка умственного развития и нарушения моторных навыков [7]. Также часто развиваются потеря чувствительности конечностей (периферическая нейропатия), недержание мочи, судороги, паралич, потеря речи, слуха и зрения.
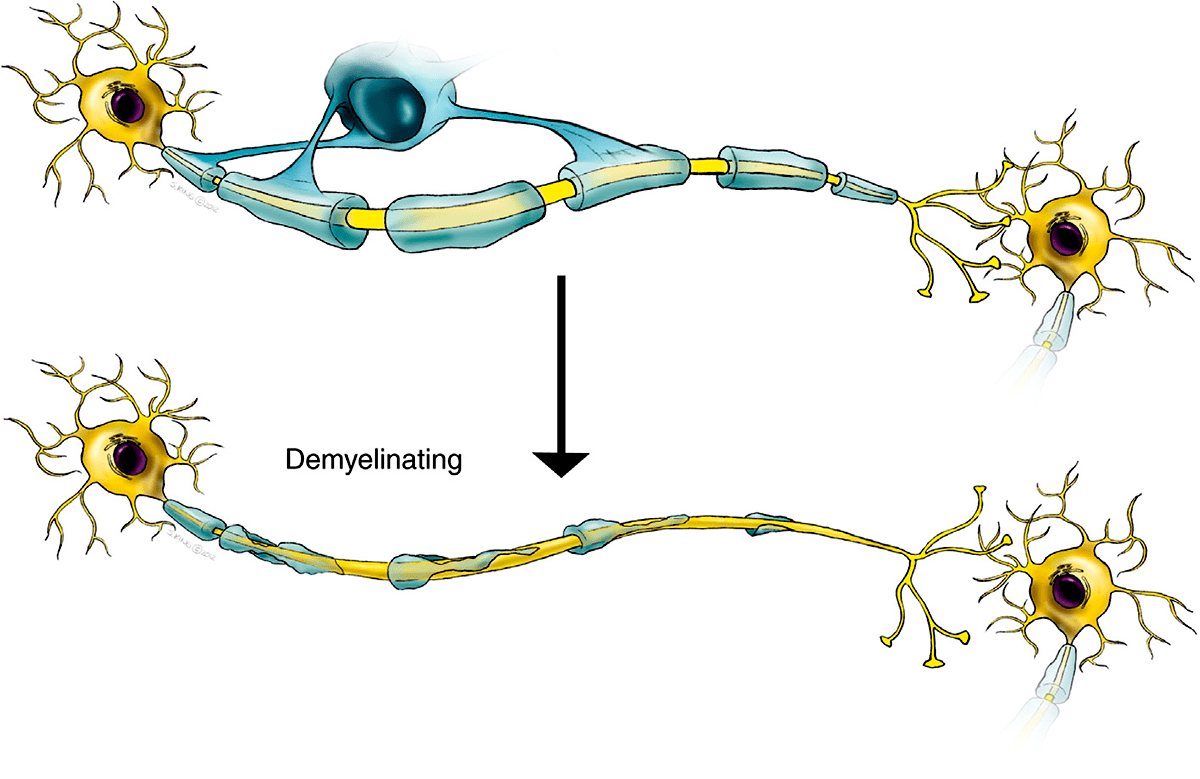
Рисунок 2. Демиелинизация — разрушение миелинового слоя, который в норме окружает аксон нервной клетки. Миелин защищает аксон и способствует нормальному проведению нервного импульса, отчасти действуя подобно изоляции электрического провода. При разрушении миелиновой оболочки аксоны также постепенно деградируют.
Начало болезни, ее течение и прогноз зависят от возраста наступления болезни. У 50–60% пациентов симптомы наступают на втором году жизни. Для них характерна прогрессирующая слабость мышц, потеря способности ходить и стоять; затем, наоборот, мышцы становятся ригидными. Такие пациенты не доживают до взрослого возраста. У 20–30% пациентов болезнь наступает после четырех лет. Симптомы развиваются медленнее, чем при младенческой форме, и пациенты, как правило, живут около 20 лет после постановки диагноза. Болезнь начинается с проблем в школе — ухудшается поведение и успеваемость. У 15–20% пациентов болезнь наступает в юности, первые симптомы — алкоголизм, наркомания, часто присоединяются галлюцинации.
Частота MLD колеблется от одного человека на 40 000 до одного на миллион в зависимости от популяции, в среднем примерно один на 100 000. Таким образом, в России должно быть примерно 1400 таких больных, а в США — около 3200.
Лечение MLD
В отличие от других болезней лизосомного накопления, для MLD нет ферментозаместительной терапии (и вообще никакой одобренной специфической терапии).
Аллогенная (то есть от другого человека) трансплантация гемопоэтических (кроветворных) стволовых клеток помогает некоторым пациентам задержать ухудшение состояния, но не способна совсем остановить его [8]. К тому же она несет риск осложнений, в том числе фатальных. Одно из самых опасных — реакция «трансплантат против хозяина» (РТПХ; graft versus host disease, GVHD), при которой донорские клетки иммунной системы начинают атаковать ткани реципиента из-за несовместимости белков HLA (human leukocyte antigen, которые также называют белками главного комплекса гистосовместимости, major histocompatibility complex, или MHC).
Потенциально более безопасным и эффективным методом терапии может стать трансплантация стволовых клеток пуповинной крови или мезенхимальных стволовых клеток [9], однако пока период наблюдения и количество пациентов недостаточны для окончательных выводов.
В разработке находится вводимая интратекально (то есть в позвоночник под оболочки спинного мозга) человеческая рекомбинантная ARSA [10]. Если фермент вводить внутривенно, он не пересечет гематоэнцефалический барьер (ГЭБ), а ведь доставить его надо именно в клетки нервной системы, которые находятся за ГЭБ. Правда, по последним опубликованным данным, даже интратекальная ферментозаместительная терапия смогла разве что немного замедлить прогрессирование болезни, но не остановить ее. При этом мышам, у которых был нокаутирован ген ARSA, терапия прекрасно помогала, что лишний раз подчеркивает трудности с трансляцией результатов экспериментов с животными на человека.
Таким образом, большинство пациентов получает только симптоматическую терапию (например, противоэпилептические препараты в случае судорог, мышечные релаксанты или физиотерапию [9]), которая, хотя и облегчает их состояние, но не влияет на причину и патогенез болезни, и поэтому не сказывается на скорости ее прогрессии.
И тут на сцену выходит передовая терапия: подход, объединяющий две ипостаси advanced therapies — генную и клеточную терапии [1].
Лентивирусы и клетки пациента
Попытки лечения MLD методами генной терапии предпринимаются с 1990-х годов [11]. В рамках подхода in vivo, когда вектор с целевым геном вводится прямо в организм человека (этот подход мы рассматривали в другой статье спецпроекта — про генную терапию гемофилии [4]), по-видимому, дальше обезьян дело не пошло. Единственное зарегистрированное исследование, проведенное всего на пяти пациентах, не имеет опубликованных результатов. Скорее всего, пока что не существует вирусных векторов, которые бы достаточно эффективно трансдуцировали олигодендроциты.
Ученые из итальянского института San Raffaele Telethon Institute for Gene Therapy в Милане сделали выбор в пользу генной терапии ex vivo с использованием аутологичных клеток (полученных от самого пациента). Исследователи отбирали гемопоэтические стволовые клетки костного мозга пациентов и трансдуцировали их лентивирусным вектором, несущим нормальный ген ARSA [12]. Лентивирусный вектор (безопасное производное вируса иммунодефицита человека) обеспечивает встраивание гена, который он несет, в геном клетки, которую заражает. Перед переносом генномодифицированных клеток пациенту проводят химиотерапию для уничтожения его собственных кроветворных стволовых клеток (рис. 4) [13].
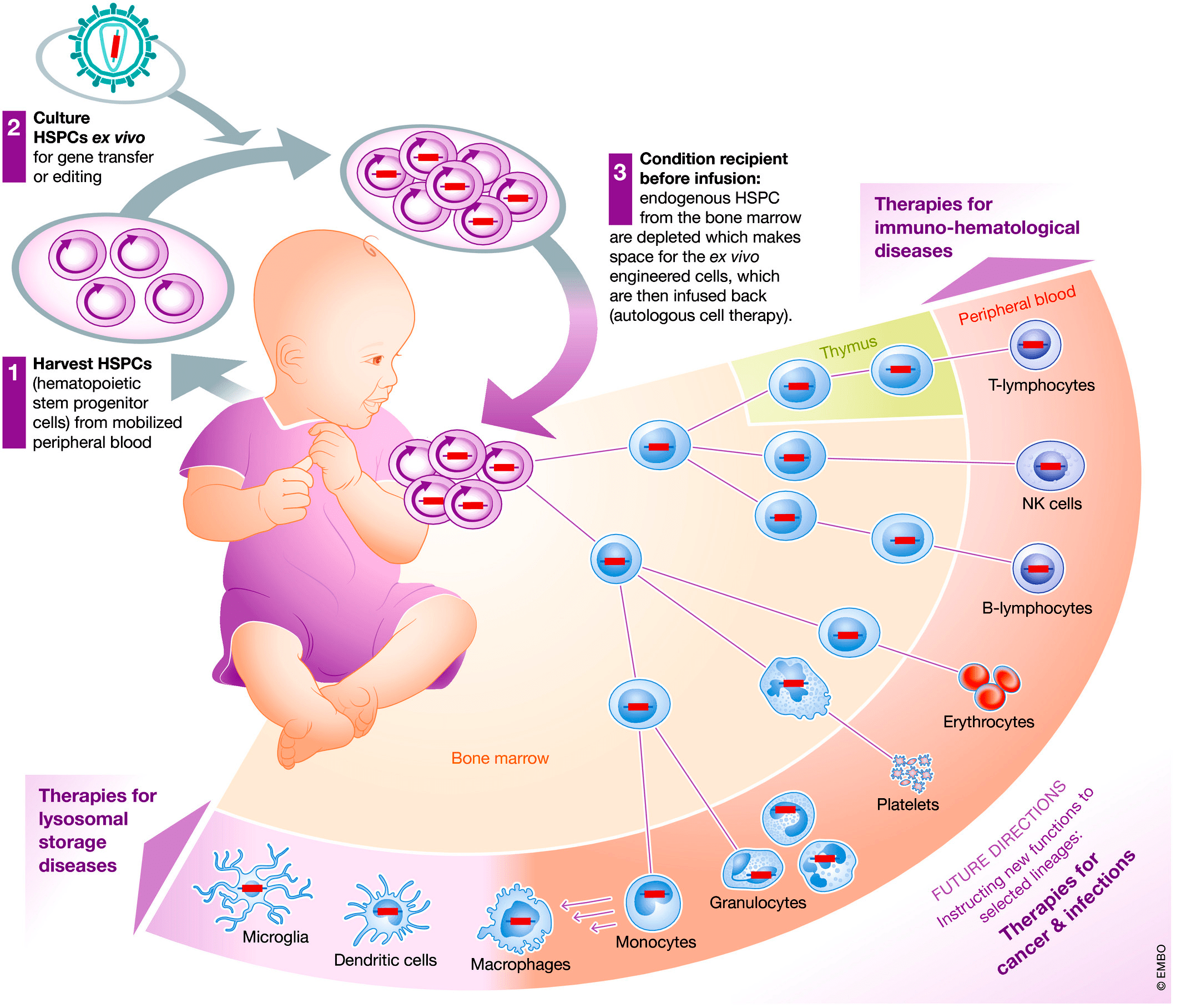
Рисунок 4. Последовательность действий при терапии генномодифицированными кроветворными стволовыми клетками. 1 — Сбор стволовых клеток. 2 — Трансдукция вирусным вектором ex vivo. 3 — Кондиционирование химиотерапией и введение клеток. Показано появление дифференцированных клеток крови с генной модификацией и их распространение по организму.
Как было показано и у мышей, и у людей, генномодифицированные стволовые клетки проникают за гематоэнцефалический барьер и секретируют там ARSA [14]. За счет наличия остатков манноза-6-фосфата на поверхности ARSA проникает в лизосомы клеток нервной системы и обеспечивает нормальное превращение цереброзидсульфата в цереброзид.
В 2013 году опубликовали первые клинические данные на трех пациентах в возрасте 7–15 месяцев [12]. В течение 18–24 месяцев после терапии у них сохранялись генномодифицированные клетки и наблюдалось достаточное число копий вектора на клетку и высокий уровень ARSA. Но что самое главное, у пациентов полностью затормозилось развитие симптомов и прогрессия поражений мозга на МРТ.
В сентябре 2019 года были опубликованы свежие данные. Сейчас период наблюдения за первым пролеченным пациентом уже превысил восемь лет, и он развивается так же, как и его нормальные сверстники. Всего пролечено 29 пациентов, из них терапия помогла 25-и. На рис. 5 приведены данные по умственному развитию пациентов, пролеченных в младенческом возрасте.
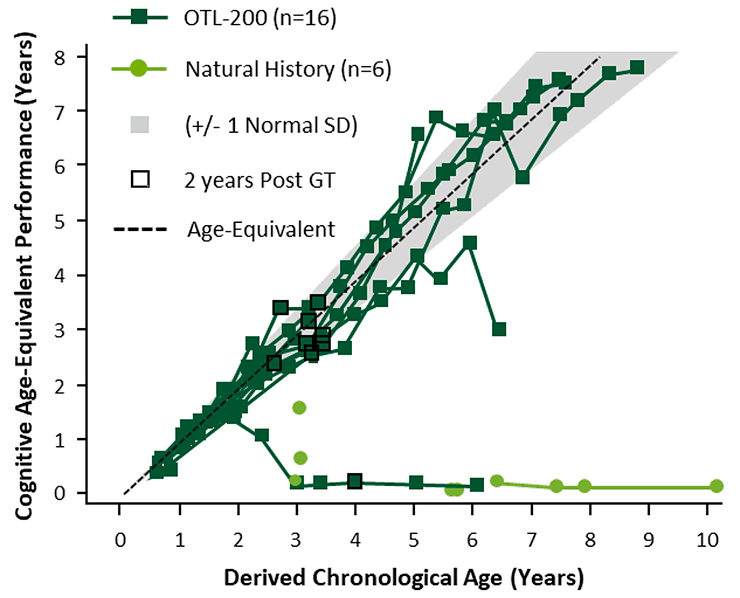
Рисунок 5. Динамика когнитивного развития леченых пациентов (темные квадраты) по сравнению с естественным течением болезни (светлые круги). Пунктиром отмечено развитие среднего здорового ребенка.
Процедура оказалась абсолютно безопасной, и, главное, ни у одного из пациентов не было отмечено признаков репликации вируса, клональной экспансии (превалирование какого-либо из клонов стволовых клеток, которое может свидетельствовать о том, что встраивание лентивируса дало клетке пролиферативное преимущество) или злокачественных заболеваний.
В первой половине 2020 года компания Orchard Therapeutics, которая коммерциализирует эту разработку, планирует подать пакет документов для разрешения на продажу в Европейское медицинское агентство.
Заключение
На наших глазах разворачивается потрясающая картина, когда болезни, ранее считавшиеся неизлечимыми и смертельными, удается вылечить, возможно, насовсем. Да, пока что это заболевания, затрагивающие максимум тысячи пациентов, а само лечение стоит почти всегда ошеломляюще дорого. Однако лиха беда начало: по мере того, как ученые всё лучше овладевают навыками создания безопасных и эффективных методов терапии на основе генномодифицированных клеток, нам станут наверняка подвластны и более распространенные заболевания, а цена таких «клеточных лекарств» неизбежно снизится.
Этой статьей мы завершаем спецпроект «Современные лекарства», но уверены, что стоим только в самом начале большого пути к лекарствам будущего, и впереди нас ждет немало удивительных открытий и новых методов терапии. Так что и спецпроект, скорее всего, продлится :-)
Литература
- Три поколения лекарств;
- Поиск лекарственных мишеней;
- «Аймовиг» — спасение от мигрени?;
- АМТ-061 — генная терапия, способная на революцию в лечении гемофилии;
- РНК-интерференция: повторный успех;
- Обёртка для аксона;
- Metachromatic leukodystrophy. (2019). U.S. National Library of Medicine;
- L D de Hosson, B P C van de Warrenburg, F W M B Preijers, N M A Blijlevens, B A van der Reijden, et. al.. (2011). Adult metachromatic leukodystrophy treated by allo-SCT and a review of the literature. Bone Marrow Transplant. 46, 1071-1076;
- Spyros P. Batzios, Dimitrios I. Zafeiriou. (2012). Developing treatment options for metachromatic leukodystrophy. Molecular Genetics and Metabolism. 105, 56-63;
- Steven Troy, Margaret Wasilewski, Jack Beusmans, CJ Godfrey. (2019). Pharmacokinetic Modeling of Intrathecally Administered Recombinant Human Arylsulfatase A (TAK‐611) in Children with Metachromatic Leukodystrophy (MLD). Clin. Pharmacol. Ther.;
- TOYA OHASHI, KAZUHIKO WATABE, YUMI SATO, IZUMU SAITO, JOHN A BARRANGER, et. al.. (1996). Gene therapy for metachromatic leukodystrophy. Pediatrics International. 38, 193-201;
- A. Biffi, E. Montini, L. Lorioli, M. Cesani, F. Fumagalli, et. al.. (2013). Lentiviral Hematopoietic Stem Cell Gene Therapy Benefits Metachromatic Leukodystrophy. Science. 341, 1233158-1233158;
- Luigi Naldini. (2019). Genetic engineering of hematopoiesis: current stage of clinical translation and future perspectives. EMBO Mol Med. 11;
- Rachele Penati, Francesca Fumagalli, Valeria Calbi, Maria Ester Bernardo, Alessandro Aiuti. (2017). Gene therapy for lysosomal storage disorders: recent advances for metachromatic leukodystrophy and mucopolysaccaridosis I. J Inherit Metab Dis. 40, 543-554;
- Robert H. Miller, Sharyl Fyffe-Maricich, Andrew C. Caprariello. (2017). Animal Models for the Study of Multiple Sclerosis. Animal Models for the Study of Human Disease. 967-988.