РНК-интерференция: повторный успех
25 декабря 2019
РНК-интерференция: повторный успех
- 2040
- 1
- 5
РНК-препараты способны избирательно проникать в печень и воздействовать на мишень на уровне трансляции
иллюстрация Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
В ноябре 2019 года Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило к применению «Гивлаари» (Givlaari, МНН — givosiran) для лечения взрослых пациентов с острой печеночной порфирией. Этот препарат стал вторым лекарством в мире, использующим механизм РНК-интерференции, и первым средством лечения этой болезни. Наша статья расскажет о механизме действия препарата, истории его создания и других разработках в этой области.
Современные лекарства
Спецпроект о современных лекарствах, истории их создания, методах разработки и тенденциях развития.

Партнер спецпроекта — компания Cytiva — образовалась в результате продажи подразделения GE Healthcare Biopharma корпорации Danaher Corporation. Cytiva — глобальный поставщик технологий и услуг, которые продвигают и ускоряют разработку и производство терапевтических средств. У компании богатое наследие, насчитывающее сотни лет. Клиенты Cytiva проводят мероприятия по спасению жизни, начиная от фундаментальных биологических исследований и заканчивая разработкой инновационных вакцин, биологических препаратов и новейших клеточных и генных терапий. Задача компании — предоставить инструменты и услуги, которые им необходимы, чтобы они работали лучше, быстрее и безопаснее, что приведет к лучшим результатам для пациентов.
Что такое порфирия?
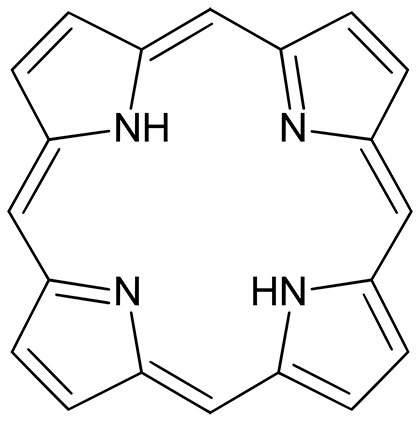
Рисунок 1. Простейший порфирин — порфин
Порфирии — это семейство заболеваний, связанных с дефектами ферментов, которые отвечают за синтез гема. Результатом их дисфункции становится накопление в различных органах и тканях порфиринов — макроциклических соединений с четырьмя атомами азота (рис. 1) [5].
В случае печеночных порфирий у пациента повреждены ферменты печени, отвечающие за путь синтеза гема. Как правило, острая печеночная порфирия имеет генетическую природу и наследуется аутосомно-доминантным способом (рис. 2).
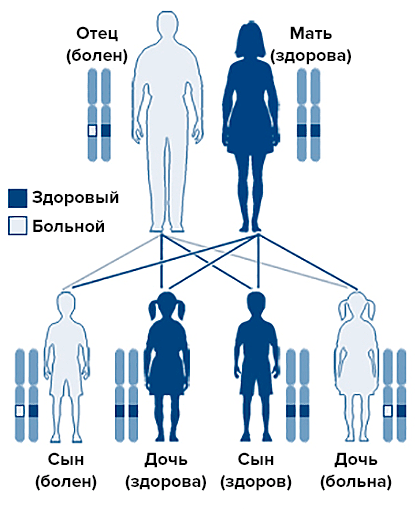
Рисунок 2. Аутосомно-доминантное наследование. При этом типе наследования генетический дефект находится не на половой хромосоме, и мальчики и девочки болеют с одинаковой частотой.
«Википедия», рисунок адаптирован
По идее, женщин и мужчин с порфирией должно быть поровну, однако на деле примерно 80% больных — женщины. Это связано с тем, что приступы порфирии провоцируются повышением концентрации прогестерона и чаще всего приходятся на период за 2–4 дня до менструации.
Пусть синтеза гема включает в себя восемь ферментов, четыре из которых находятся в цитозоле, а четыре — в митохондриях (рис. 3) [6]. Мутации каждого могут приводить к порфирии.
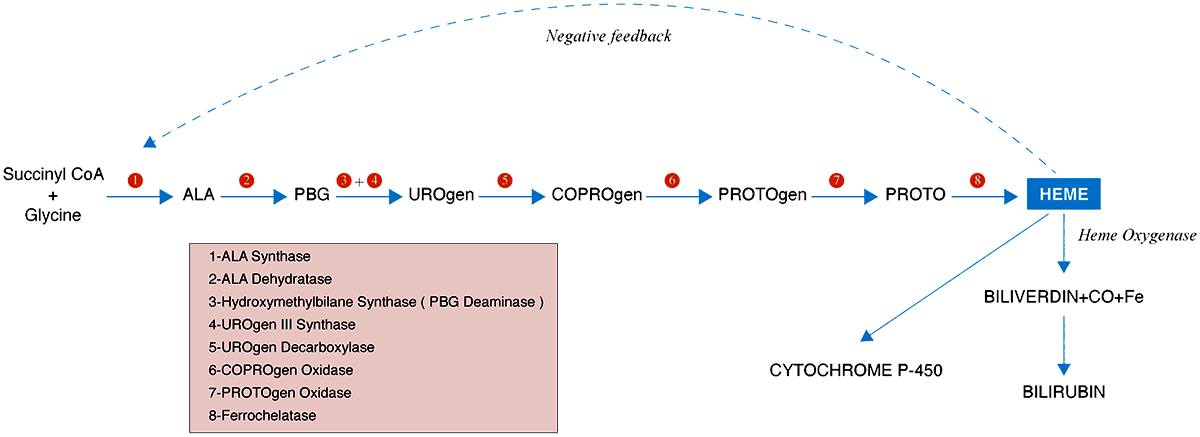
Рисунок 3. Путь синтеза гема. Начало синтеза гема — реакция между сукцинил-КоА и глицином, при которой получается дельта-(ALA).
Основные промежуточные вещества, которые накапливаются при поломках этого пути — это аминолевулиновая кислота (ALA) и порфобилиноген (PBG). Они обладают нейротоксическим эффектом, поэтому острая печеночная порфирия выражается в первую очередь в неврологических нарушениях: судорогах, психозе, болях в животе и спине, острой полинейропатии. При тяжелом приступе возможна тошнота и рвота, расстройство сознания и даже кома. Также при тяжелой порфирии повышается вероятность развития рака печени, гипертензии, почечной недостаточности. У таких пациентов вероятность смерти в три раза выше по сравнению со средней по популяции [7].
Болезнь не такая уж редкая: ее частота — от 5 до 10 человек на 100 000, то есть в России, предположительно, 7–14 тысяч таких пациентов. Многие живут, не зная о болезни, так как обострения у них случаются редко и проходят сами. Однако у части пациентов обострения происходят регулярно и без быстрой лекарственной помощи могут привести к смерти.
Тяжелый приступ требует немедленной госпитализации, внутривенного введения гемина и симптоматических препаратов: опиатов, гипотонических растворов. Гемин — это комплекс железа с гемом и ионом хлора, восполняющий недостаток гема в организме больного порфирией и с помощью петли обратной связи снижающий синтез порфиринов. Гемин можно использовать и для профилактики частых приступов, однако постоянное введение гема приводит к гемохроматозу — избыточному накоплению железа в тканях и органах, что служит причиной печеночной и сердечной недостаточностей. Кроме того, части пациентов с порфирией гемин не помогает. Единственной потенциально излечивающей опцией была пересадка печени — непростая и не всегда доступная процедура, которая, конечно, влечет за собой собственные осложнения.
Стоимость годового лечения пациента с тяжелой порфирией в США доходит до $400 000 – 650 000 в год.
Очевидно, пациентам с острой печеночной порфирией требуются безопасные и эффективные лекарства, специфически направленные на причину заболевания. И теперь у них наконец-то появилась такая опция.
Гивосиран
Как и первый зарегистрированный препарат на основе РНК-интерференции — патисиран (той же компании Alnylam) [8], — гивосиран представляет собой двухцепочечную молекулу РНК. В случае гивосирана антисмысловая цепь РНК комплементарна мРНК, кодирующей фермент ALA-синтазу, первую в цепи превращений сукцинил-КоА в гем (рис. 3). Однако прежде чем молекула доберется до мРНК, свяжется с ней и уничтожит по механизму интерференции, ей нужно достаточно долгое время «продержаться» сначала в кровотоке, затем попасть в целевые клетки (в данном случае — гепатоциты), а потом оказаться достаточно стабильной в цитоплазме. РНК — достаточно лабильная молекула и довольно легко гидролизуется, чему способствует и слабощелочная среда крови. В двухцепочечном состоянии РНК более стабильна, однако все равно подвержена гидролизу, особенно учитывая наличие в крови и цитоплазме нуклеаз, которые катализируют гидролиз РНК.
Кроме того, задача проникновения РНК в клетки тоже не из простых [9]. «Голая» РНК, будучи отрицательно заряженной, просто так не будет проходить через липидный бислой [10].
Успех компании Alnylam во многом обусловлен теми изобретениями, которые легли в основу ее продуктов. Они были сделаны основателем компании Томасом Тушлем (Thomas Tuschl) в конце 1990-х — начале 2000-х. Во-первых, для повышения стабильности РНК-дуплекса применили химическую модификацию нуклеотидов в составе молекулы: все остатки рибозы содержат в 2′ положении замену кислорода на фтор или на метокси-группу. Кроме того, некоторые остатки соединены фосфоротиоатной связью, то есть один из атомов кислорода фосфатной группы заменен на серу. Во-вторых, для того чтобы гивосиран лучше проникал именно в гепатоциты, на 3′-конце смысловой цепи находится разветвленная группа с тремя остатками N-ацетилгалактозамина (GalNAc). Эта группа связывается с асиалогликопротеиновым рецептором на гепатоцитах и обеспечивает проникновение молекулы внутрь клеток (рис. 6) [11].
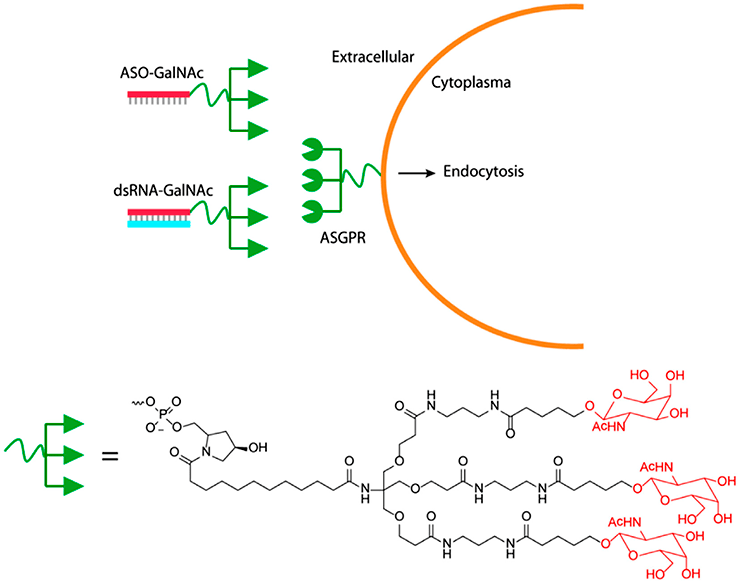
Рисунок 6. Конъюгация GalNAc c двойной цепочкой РНК для обеспечения проникновения в клетки печени. ASGPR — асиалогликопротеиновый рецептор.
До того, как начать клинические исследования, гивосиран изучали на клетках (in vitro) и на млекопитающих (in vivo): мышах, крысах, кроликах и макаках резусах, где он показал свою высокую эффективность и безопасность.
Эффективность и безопасность гивосирана для людей изучали в клиническим исследовании на 98 пациентах, у которых перед включением в исследование было в среднем 7–8 приступов за последние 6 месяцев. Результаты оказались впечатляющими: за 6 месяцев исследования в группе гивосирана число приступов было в среднем 1,9, а в группе плацебо — 6,5. Также гивосиран снижал необходимость использования гемина и уменьшал уровни нейротоксических вещества ALA и PBG. Из побочных эффектов наиболее значимыми были реакции в месте подкожного введения препарата, они развивались у 25% пациентов. Также возможны почечная и печеночная токсичности. Большой плюс препарата — необходимость применения одной дозы всего лишь раз в месяц.
Компания получила регистрацию от FDA в ноябре 2019 года и тут же сообщила о том, что уже договорилась с несколькими страховыми компаниями о покрытии лечения страховкой. Стоимость гивосирана установлена на уровне $575 000, что компания оправдывает высокой эффективностью и малой распространенностью заболевания.
Пациентам со страховкой препарат достанется бесплатно или почти бесплатно. При оплате препарата будут использовать инновационную стратегию возмещения: полную стоимость пациент выплатит, только если в реальных условиях препарат покажет себя не хуже, чем в клинических исследованиях.
В 2020 году ожидается одобрение Европейского медицинского агентства, к 2025 году аналитики прогнозируют продажи в районе $500 млн.
Заключение
Успех гивосирана — еще один триумф тщательного научного подхода к поиску мишени, способа воздействия на нее и созданию эффективного средства такого воздействия. Препараты на основе РНК находятся в самом начале пути, и провалов пока было больше, чем успехов [12]. Однако за последние три года произошел сдвиг: начали регистрироваться препараты, доказавшие свою эффективность в качественных исследованиях. До сих пор это были лекарства от очень редких болезней, наследственных заболеваний печени или мышц. Это понятно, потому что в данные органы проще доставить РНК-препарат. Однако буквально только что, в декабре 2019 года, Alnylam сообщила об успехе препарата для лечения редкого наследственного заболевания почек.
Есть надежда на РНК-препараты и в более широких показаниях: The Medicines Company сообщила в ноябре о положительных промежуточных результатах исследования инклисирана (inclisiran), еще одного препарата на основе РНК-интерференции, который она приобрела у того же Alnylam. Это лекарство, блокирующее синтез фермента PCSK9 при сердечно-сосудистых заболеваниях, тем самым снижая в крови уровень липопротеинов низкой плотности. Против этой мишени на рынке уже есть несколько антител, и РНК-препарат может составить им достойную конкуренцию. Целый ряд компаний также исследует РНК-препараты против гепатита В.
Итак, мы видим, что эпоха РНК-терапии только начинается, и по мере накопления опыта и знаний в этой области нас ждет еще немало удивительных открытий и лекарств.
Литература
- Три поколения лекарств;
- Поиск лекарственных мишеней;
- «Аймовиг» — спасение от мигрени?;
- АМТ-061 — генная терапия, способная на революцию в лечении гемофилии;
- Kothadia J.P., LaFreniere K., Shah J.M. Acute hepatic porphyria. StatPearls Publishing, 2019;
- Bissell D.M. and Wang B. (2015). Acute Hepatic Porphyria. JCTH. 3, 17-26;
- Jennifer B. Jeans, Kay Savik, Cynthia R. Gross, Mary K. Weimer, Irene C. Bossenmaier, et. al.. (1996). Mortality in patients with acute intermittent porphyria requiring hospitalization: A United States case series. Am. J. Med. Genet.. 65, 269-273;
- Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!;
- Xiulong Shen, David R Corey. (2018). Chemistry, mechanism and clinical status of antisense oligonucleotides and duplex RNAs. Nucleic Acids Research. 46, 1584-1600;
- Donald H Burke. (2012). Cell-Penetrating RNAs: New Keys to the Castle. Molecular Therapy. 20, 251-253;
- Xiulong Shen, David R Corey. (2018). Chemistry, mechanism and clinical status of antisense oligonucleotides and duplex RNAs. Nucleic Acids Research. 46, 1584-1600;
- Ai-Ming Yu, Chao Jian, Allan H. Yu, Mei-Juan Tu. (2019). RNA therapy: Are we using the right molecules?. Pharmacology & Therapeutics. 196, 91-104.