«Голодные игры» микробов: как заморить врага голодом, используя геномные данные для поиска скрытых защитников в кишечнике
17 ноября 2025
«Голодные игры» микробов: как заморить врага голодом, используя геномные данные для поиска скрытых защитников в кишечнике
- 139
- 0
- 2
Поле битвы кишечного микробиома: микробные супергерои морят злодея голодом, съедая его еду первыми.
Рисунок в полном размере.
иллюстрация авторов, адаптировано ChatGPT
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Пока одни микробы защищают наш организм, другие (в частности, Clostridioides difficile) ждут удобного момента, чтобы завладеть территорией. Стоит неблагоприятным факторам нарушить баланс микробного мира (например, вы приняли антибиотик) — и враг пробуждается. Но что, если бактерии-защитники могут подавлять рост нарушителей спокойствия просто уничтожая их продовольственные запасы? Представьте себе невидимую войну в глубинах кишечника, где победа определяется не мощностью оружия, а — внезапно — скоростью поедания, и отнюдь не друг друга, а обычных продуктов питания самих бактерий!
Мы построили биоинформатический конвейер, который по геномам предсказывает, какие микробы способны лишать C. difficile жизненно важных аминокислот и тем самым не позволять ей эффективно колонизировать кишечник. Этот подход открывает путь к выявлению наиболее перспективных микробных защитников — потенциальных пробиотических микроорганизмов.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Проблема инфекции, вызываемой Clostridioides difficile (КДИ), заметно заострилась за последние 15–20 лет (рис. 1), что связано с нерациональным назначением антибиотиков и слабым развитием противоэпидемических подходов. В большинстве случаев болезнь поражает пациентов, проходящих лечение в стационаре с самыми разнообразными диагнозами (от терапии до хирургии и онкологии), и относится к инфекциям, связанным с оказанием медицинской помощи. Вероятно, это повлияло на длительное нахождение клостридиальной инфекции в тени, вдали от пристального внимания специалистов-инфектологов.
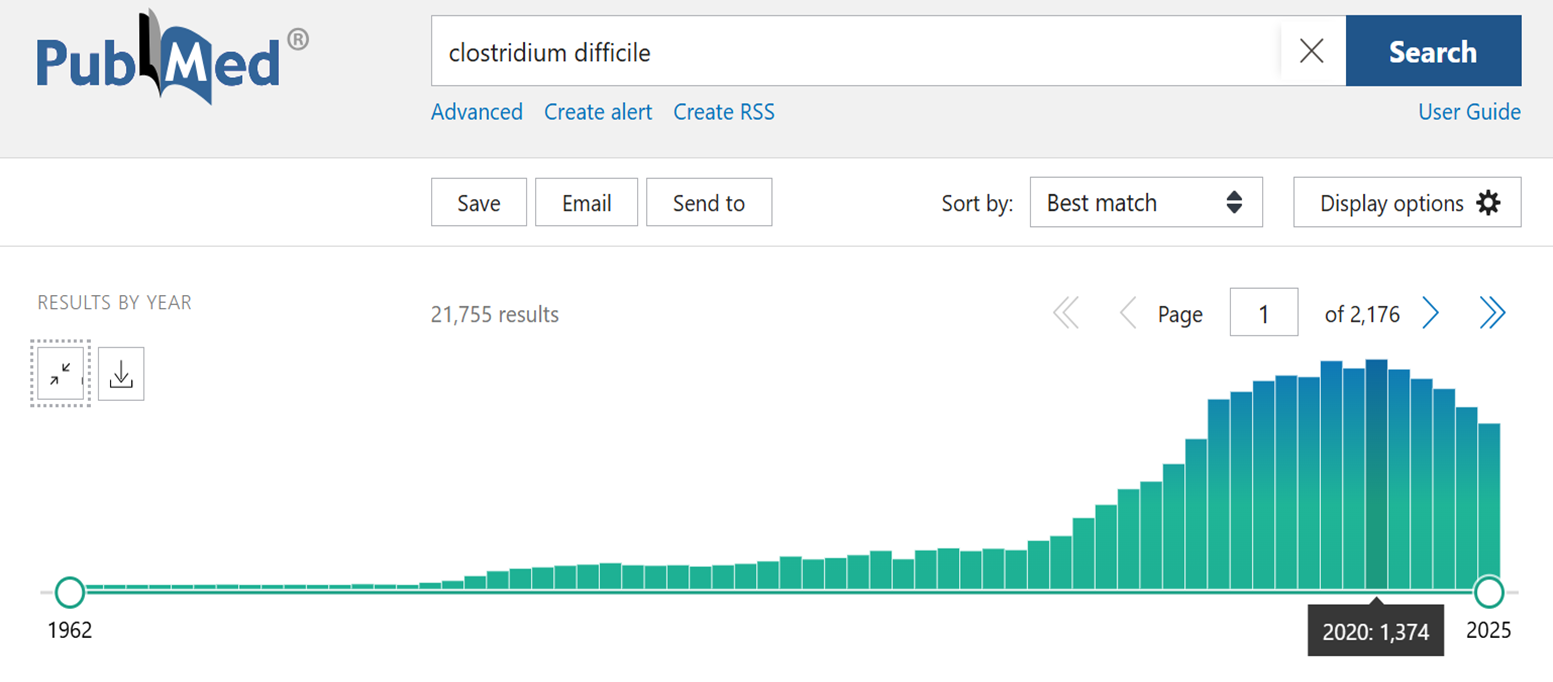
Рисунок 1. Число публикаций с упоминанием Clostridium difficile в PubMed (1962–2025 гг.).

Фото 1. А.Т. Эбенезер, А.Н. Холодная, постерная сессия конференции «Геномика, метагеномика и молекулярная биология микроорганизмов», г. Москва, Сколковский институт Науки и Технологий, 2025 г.
В этой связи в 2023 году на базе кафедры инфекционных болезней и эпидемиологии ПСПБГМУ им. И.П. Павлова создан Центр Дисбиозов для решения задач как практической организации помощи пациентам с С. difficile-инфекцией, так и разработки научных направлений, способствующих поиску новых подходов в лечении и профилактике (руководитель научной группы — автор этой статьи, к.м.н. Холодная А.Н.).
С 2023 года Центр также сотрудничает со школой Медицинской и биологической физики МФТИ, на базе которой в том числе проводится работа, о которой расскажем ниже. Данное исследование было подготовлено нами в рамках магистерского проекта А. Эбенезера (соавтора этой статьи) для IV-й Международной конференции «Геномика, метагеномика и молекулярная биология микроорганизмов» (г. Москва, 25–26 октября 2025 г) (см. фото 1).
Встреча с врагом: Clostridioides difficile
Вы когда-нибудь задумывались, что на самом деле происходит в недрах кишечника после приема антибактериального препарата? Представьте себе бурлящий микробный город: миллиарды бактерий работают сообща, обмениваются питательными веществами, поддерживают порядок. И вдруг, словно буря, на него обрушиваются антибиотики, сметая миротворцев и оставляя после себя пустые улицы. В этот хаос врывается возмутитель спокойствия: Clostridioides difficile — упрямая, продуцирующая токсины бактерия, ответственная за тысячи внутрибольничных инфекций каждый год. Но что, если ключ к борьбе с этим злодеем — не очередной антимикробный препарат... а группа крошечных союзников, уже живущих внутри нас ?
Такое уже бывало: «Биомолекула» писала о том, как с одной клостридией можно бороться с помощью... другой клостридии [6]. — Ред.
В потаённом мире нашего кишечника большинство бактерий живут мирно, а многие помогают нам и даже защищают [7]. Однако некоторые могут стать смертельно опасными при определенных условиях, среди них — Clostridioides difficile. Дело в том, что, когда пациентам назначают антибиотики широкого спектра действия с целью уничтожить патогенные микроорганизмы, нормальная кишечная микробиота также страдает, и численность ее уменьшается. Одновременно с этим, С. difficile известна своей способностью к спорообразованию и множественной антибактериальной резистентностью. Так, сегодня во всем мире есть только три антибактериальных препарата, к которым она чувствительна (и только два из них зарегистрированы к применению в России).
Споры и даже небольшие популяции С. difficile, будучи ограниченными в своем росте защитными свойствами нормальной миробиоты, могут длительное время жить в кишечнике человека совершенно бессимптомно. Но на фоне стандартной антибактериальной терапии создается экологический вакуум: нормальная микробиота сокращается, а C. difficile получает возможность размножения и массивной колонизации кишечника (рис. 2). Справедливости ради следует отметить, что такой сценарий может разворачиваться не только вследствие воздействия антимикробной терапии, но и ряда других факторов, способствующих формированию дисбиоза кишечника — оперативные вмешательства, прием иммуносупрессивных препаратов, течение воспалительных заболеваний кишечника и т.д. Одно верно всегда — если собственная микробиота не повреждена — инфекция не развивается [6]. Этот факт делает ее практически уникальной по сравнению с классическими заболеваниями, вызываемыми патогенными микробами.
В активной форме клостридия выделяет токсины, повреждающие слизистую оболочку желудочно-кишечного тракта. Это приводит к воспалению, тяжелой диарее и, в ряде случаев, к опасным для жизни осложнениям [8], [9].
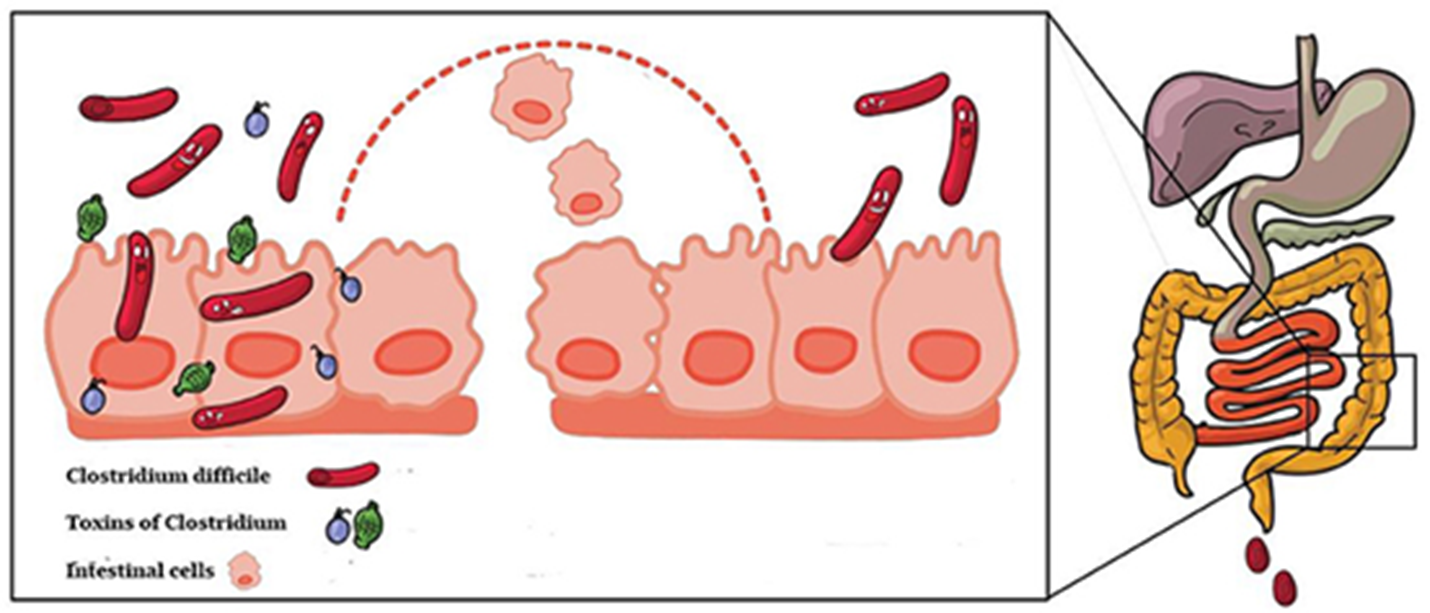
Рисунок 2. Споры Clostridioides difficile: от спящего врага к активной инфекции. Когда антибиотики нарушают микробное равновесие, споры C. difficile пробуждаются, превращаясь в активные формы бактерии.
Заболевание, которое развивается, так и названо — С. difficile-инфекция, однако во многих случаях используют еще один термин — псевдомембранозный колит, который отражает картину, наблюдаемую на слизистой кишечника у больного: появление наложений фибрина — псевдомембран (рис. 3).
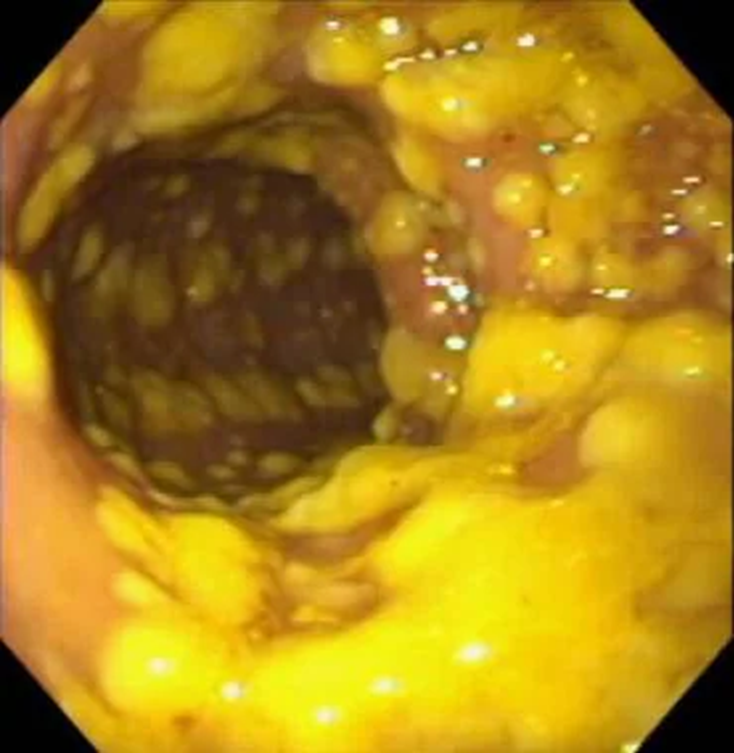
Рисунок 3. Эндоскопическая картина множественных псевдомембран на слизистой толстой кишки при C. difficile-инфекции.
Статистика тревожная. Так, в США, где отлажена система регистрации данного заболевания, ежегодно выявляется более 450 000 случаев заражения, и около 30 000 пациентов умирают от осложнений (наиболее тяжелое — токсическая дилатация кишечника: когда воспаление проникает вглубь слоев кишечной стенки и, как следствие, развивается транслокация бактерий из кишечника в кровоток с развитием сепсиса) [10]. Инфекция трудно поддается лечению, а у многих пациентов, кроме того, наблюдаются повторные рецидивы. Ученые давно ищут более эффективные стратегии борьбы с этим патогеном. Помимо антибиотиков, такие подходы, как трансплантация фекальной микробиоты и пробиотическая терапия, показали себя многообещающими, но до сих пор не до конца раскрыты механизмы, с помощью которых комменсальные микробы могут противостоять экспансии C. difficile [11]. В частности, мало изучены возможности конкуренции за питательные вещества.
Проблема: битва за питательные вещества
Кишечник — это экосистема, где живут, взаимодействуют и конкурируют триллионы микроорганизмов. Какие же дополнительные преимущества есть у C. difficile в микробных войнах? Секрет кроется в ее метаболизме. C. difficile обладает удивительной способностью извлекать энергию из аминокислот в бескислородных условиях, когда другие питательные вещества недоступны. Данная реакция называется Стиклендская ферментация и встречается преимущественно среди представителей класса Clostridia. Это древний метаболический путь, который позволяет бактерии расти без углеводов, используя аминокислоты в качестве единственного источника углерода и энергии. Аминогруппа аминокислот может проявлять восстановительные свойства, а карбоксильная — кислотные. Поэтому в реакцию вступают аминокислоты парами (одни как доноры электронов, другие — как акцепторы), а в результате образуются молекулы АТФ (рис. 4) [12].
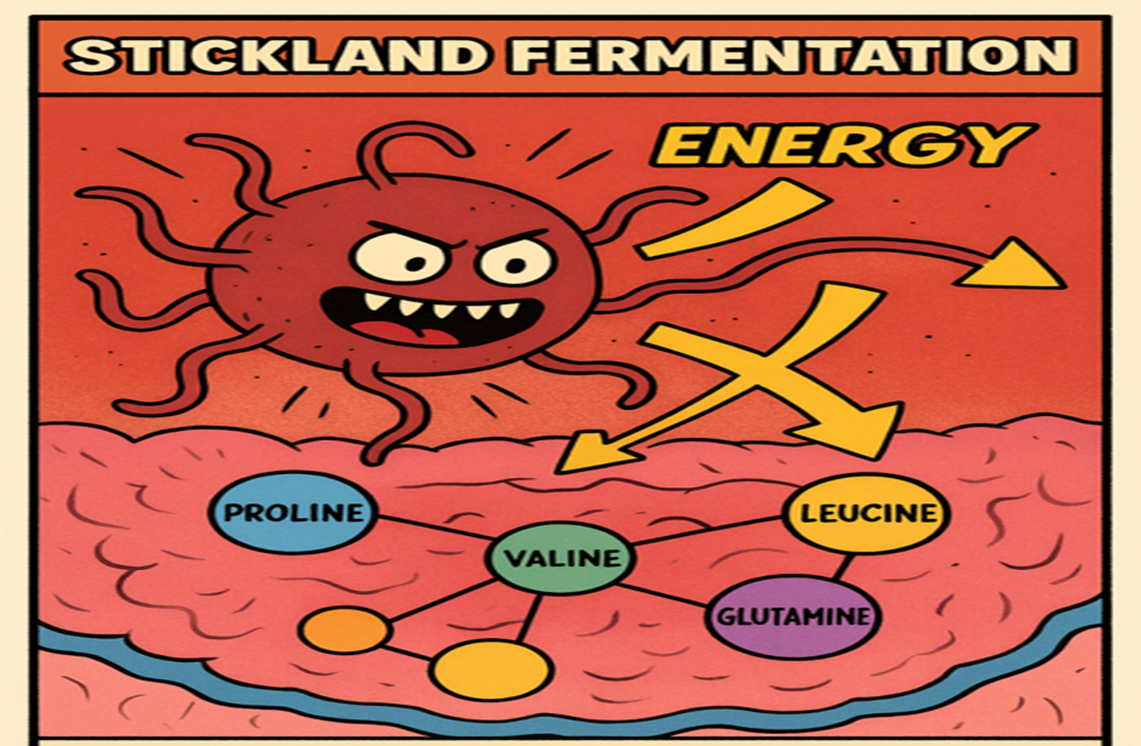
Рисунок 4. Секретная суперсила клостридии: патоген использует аминокислоты в качестве доноров и акцепторов электронов, превращая кишечник в персональную электростанцию.
иллюстрация авторов, адаптировано ChatGPT
Проще говоря, аминокислоты — это не просто еда для C. difficile; это — ее спасательный круг при неблагоприятных условиях среды в кишечнике, когда численность видов, не обладающих такими способностями, сокращается из-за пищевых ограничений.
Именно это подсказало нам идею сфокусироваться на метаболической конкуренции клостридии и потенциальных защитных штаммов за аминокислоты. То есть, среди всех микробных игроков мы изначально обратились к принципиально не менее стойким, чем клостридия.
Идея исследования заключается в том, чтобы найти комменсальные виды — «хороших парней», которые могут употреблять достаточно аминокислот, чтобы оставить C. difficile смертельно голодной.
Аминокислоты в центре внимания
Мы обратились к ранее опубликованным данным для уточнения перечня аминокислот, имеющих принципиальное значение для жизнедеятельности С. difficile. В работе Arrieta-Ortiz et al. 2021 года на основании оценки предшествующих экспериментальных данных, а также реконструкций метаболических путей были установлены 14 таких аминокислот [13]. В «биохимическое меню» бактерии вошли как аминокислоты, обеспечивающие реакции Стиклендской ферментации (например, пролин и аминокислоты с разветвленной цепью), так и участвующие в синтезе клеточной стенки и ответе на оксидативный стресс (аргинин, глутамат, лизин, метионин).
Мы предположили: если другая бактерия аналогично предрасположена метаболизировать большинство этих аминокислот — она прямой конкурент для C. difficile. С экологической точки зрения она заняла бы ту же метаболическую нишу.
Вычислительное решение: построение пайплайна
Тестирование каждого бактериального кандидата на эффективную конкуренцию с клостридией в лаборатории стало бы медленным и дорогостоящим. Вместо этого мы построили вычислительный конвейер для прогнозирования на основе генетических данных.
В ранее проведенных исследованиях предполагалось в частности, что выделение токсина клостридией является ее конкуретной стратегией, которая позволяет избавляться от конкурентов за питательные вещества [14].
Представьте себе генетический сканер, который инспектирует генетический код бактерий и спрашивает: «может ли этот микроорганизм метаболизировать те же аминокислоты, что и C. difficile?» Идея проста: если понять, какие бактерии способны метаболизировать те же аминокислоты, что и C. difficile, можно предсказать, кто будет соперничать с нею за питательные вещества.
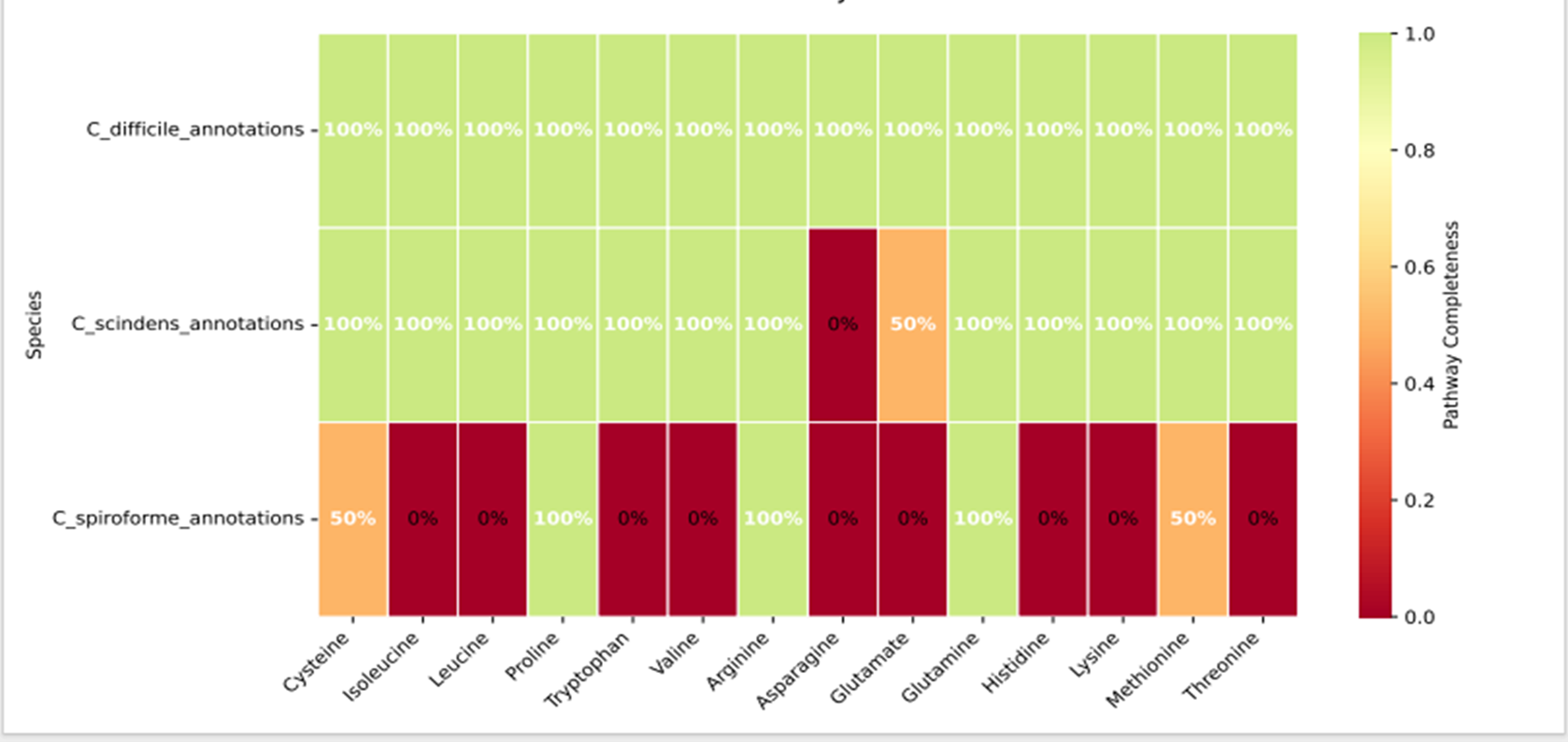
Для проверки гипотезы мы загрузили из базы NCBI геномы и протеомы нескольких видов: собственно C. difficile (скачать архив), Thomasclavelia spiroformis (ex. Сlostridium spiroforme) (скачать архив) и Clostridium scindens (скачать архив). Последний был интересен, так как ранее в экспериментах на животных [15] он уже показал свой пробиотический потенциал в отношении C. difficile-инфекции. А вот про Thomasclavelia spiroformis в своей предыдущей работе [5] мы показали, что именно этот вид представлен у бессимптомных носителей C. difficile по сравнению с теми, у кого развилась клиническая картина заболевания.
Далее мы связали «наши» микробные гены с ортологами KEGG Orthology Database через сервис eggNOG-mapper, что дает представление о функции гена в метаболических путях. Результаты собираются в виде идентификаторов KEGG Orthologs — своеобразных «метаболических штрих-кодов» (рис. 5). Алгоритм затем сравнивает наборы этих штрих-кодов между разными бактериями. Чем ближе метаболические возможности какой-либо бактерии к C. difficile, тем выше вероятность, что они будут конкурировать.
Наши находки: от сухих геномных данных к картине микробного противостояния
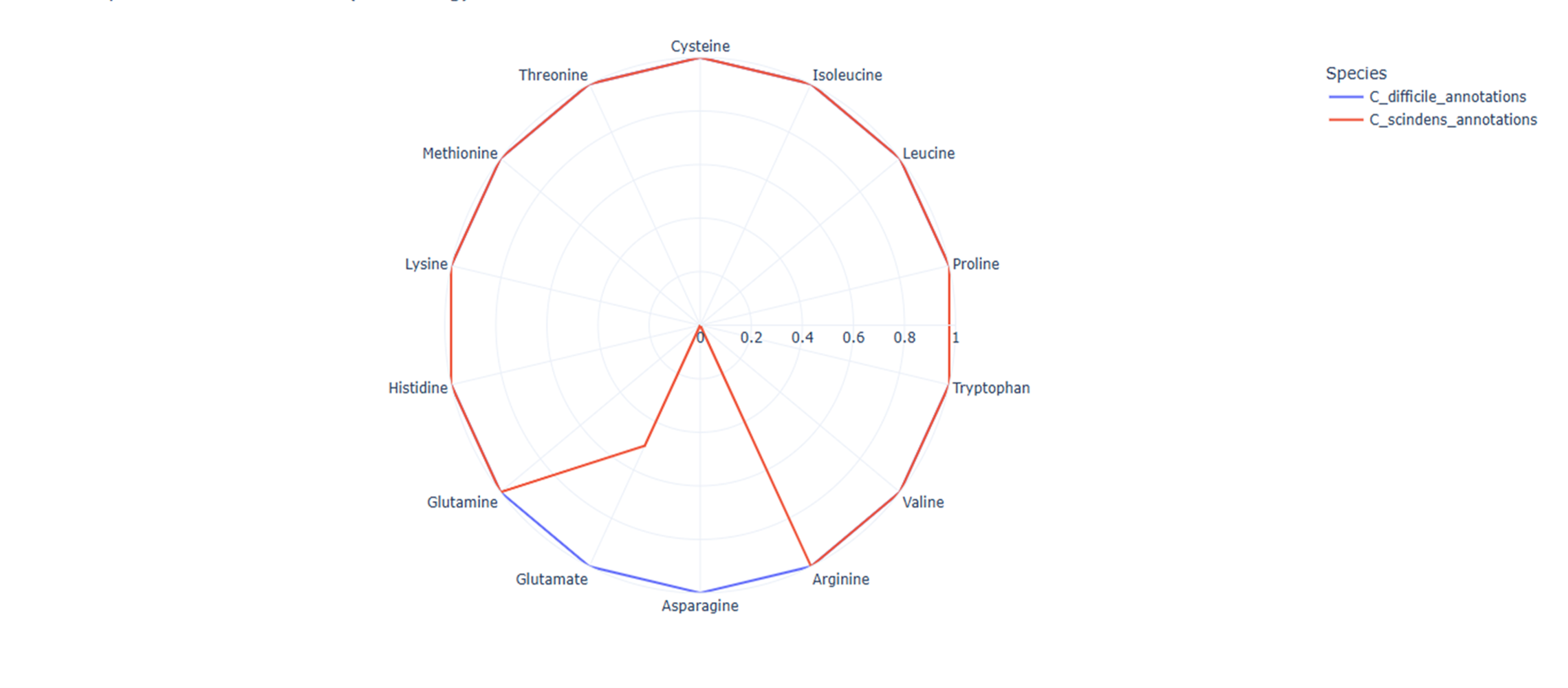
Для Clostridium scindens в нашем анализе достигнуто 85,7% совпадений по генетически обусловленным возможностям метаболизма аминокислот, то есть потенциально она способна метаболизировать почти тот же набор аминокислот, что и Clostridioides difficile. Следует отметить, что ранее рассматриваемые механизмы ее протективного действия были сосредоточены в основном вокруг выработки антимикробных веществ и вторичных желчных кислот, ингибирующих рост C. difficile [16]. Наши результаты, таким образом, раскрывают смысл ее разнообразных способов борьбы против C. difficile — они «жестко конкурируют за питание».
Для Clostridium spiroforme мы получили 21,4% совпадений, что, на первый взгляд, не так уж и много. Однако, принимая во внимание наши предшествующие данные, требуются дальнейшая оценка для подтверждения либо исключения ее протективного потенциала (рис. 6).

Рисунок 6. Метаболическое противостояние.
иллюстрация авторов
Почему это важно: на пути к терапии, основанной на прицельной коррекции микробиома
Наш пайплайн обеспечивает систематический, воспроизводимый способ для оценки метаболического потенциала микроорганизмов и перспективы их защитных в отношении C. difficile-инфекции свойств. Стандартные следующие шаги после предварительной оценки должны включать анализ генома для уточнения отсутствия генов антибиотикорезистентности, а также генов факторов вирулентности, в частности, кодирующих токсины.
Конечно, наше исследование имеет ограничения. Точность прогнозирования сильно зависит от качества имеющихся геномных данных, а реальные взаимодействия микроорганизмов сложны и многогранны. Тем не менее, разработанный подход, объединяя вычислительную биологию и микробную экологию, вносит вклад не только в тактическую разработку конкретных решений, но и в стратегию развития защитных средств на полях сражений за здоровый микробиом. В будущем, вполне вероятно, специально подобранные коктейли защитных микробов станут альтернативой антибактериальной терапии в решении задач борьбы с патогенами.
Литература
- Галкина А.А., Холодная А.Н., Спиридонова А.А., Косова В.А., Лялина Л.В. (2023). Частота обнаружения Cl. difficile у пациентов в различных отделениях многопрофильного стационара. ВИЧ-инфекция и иммуносупрессии. 15, 71–72;
- Акимкин В.Г. Контроль и профилактика инфекций, связанных с оказанием медицинской помощи // Сборник тезисов X Конгресса с международным участием. Москва, 2022, 132 с.;
- Акопов А.Л., Амосов В.И., Баранова Е.И., Власов Т.Д., Горбачева И.А. Актуальные вопросы экспериментальной и клинической медицины-2023 // Сборник тезисов LXXXIV научно-практической конференции с международным участием. Санкт-Петербург, 2023, 421 с.;
- Осипова Е.О. Характеристика кишечного биоценоза у пациентов, перенесших Clostridioides difficile-инфекцию на фоне воспалительных заболеваний кишечника. Актуальные вопросы экспериментальной и клинической медицины — 2025 // Сборник тезисов LXXXVI Ежегодной итоговой научно-практической конференции студентов и молодых ученых с международным участием. Санкт-Петербург, 2025. С. 76–77;
- Труды 66-й всероссийской научной конференции МФТИ, 1–6 апреля 2024 г. Москва, 01–06 апреля 2024 года, 284 с.;
- Клостридия клостридии волк: С. difficile vs С. scindens;
- Как микробиота поможет в борьбе со старением?;
- Mada P., Alam M. Clostridioides difficile infection. Treasure Island (FL): StatPearls Publishing, 2024;
- Michel Delmée. (2021). Clostridium difficile: Bacteria That Can Infect People Taking Antibiotics. Front. Young Minds. 9;
- Jun Xia, Tan Liu, Rui Wan, Jing Zhang, Quanzhu Fu. (2025). Global burden and trends of the Clostridioides difficile infection-associated diseases from 1990 to 2021: an observational trend study. Annals of Medicine. 57;
- Чего от нас хотят микробы?;
- Aidan Pavao, Madeline Graham, Mario L. Arrieta-Ortiz, Selva Rupa Christinal Immanuel, Nitin S. Baliga, Lynn Bry. (2022). Reconsidering the in vivo functions of Clostridial Stickland amino acid fermentations. Anaerobe. 76, 102600;
- Mario L. Arrieta-Ortiz, Selva Rupa Christinal Immanuel, Serdar Turkarslan, Wei-Ju Wu, Brintha P. Girinathan, et. al.. (2021). Predictive regulatory and metabolic network models for systems analysis of Clostridioides difficile. Cell Host & Microbe. 29, 1709-1723.e5;
- Joshua R. Fletcher, Colleen M. Pike, Ruth J. Parsons, Alissa J. Rivera, Matthew H. Foley, et. al.. (2021). Clostridioides difficile exploits toxin-mediated inflammation to alter the host nutritional landscape and exclude competitors from the gut microbiota. Nat Commun. 12;
- Carmen Saenz, Qing Fang, Thiyagarajan Gnanasekaran, Samuel Addison Jack Trammell, June Daphne Arnold Buijink, et. al.. (2023). Clostridium scindens secretome suppresses virulence gene expression of Clostridioides difficile in a bile acid-independent manner. Microbiol Spectr. 11;
- Arthur S. McMillan, Casey M. Theriot. (2024). Bile acids impact the microbiota, host, and C. difficile dynamics providing insight into mechanisms of efficacy of FMTs and microbiota-focused therapeutics. Gut Microbes. 16.