Ядерная ламина и пространственная организация хроматина у дрозофилы
02 апреля 2019
Ядерная ламина и пространственная организация хроматина у дрозофилы
- 1805
- 1
- 3
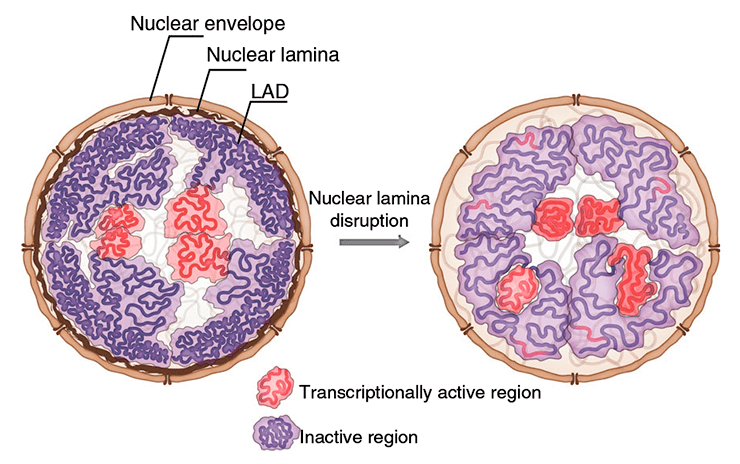
Организация хроматина у дрозофилы изменяется при разрушении ядерной ламины
-
Автор
-
Редакторы
Хотя ядерная ламина (белковая «сетка», играющая роль каркаса клеточного ядра) описана очень давно, ее роль в определении архитектуры хроматина долгое время оставалась неясной. Недавно на страницах журнала Nature Communications группа российских исследователей, в числе которых специалисты из Института биологии гена, МГУ, КФУ и Сколковского института науки и технологий, сообщила, что в отсутствие ядерной ламины в клетках дрозофилы линии S2 наблюдается общее повышение компактизации хроматина, сопровождающееся его отдалением от ядерной оболочки. Наша статья посвящена этому интересному открытию.
Давно ушли в прошлое времена, когда клеточное ядро считали компартментом, содержащим неупорядоченную мешанину из наследственного материала и ферментов, обеспечивающих его удвоение и транскрипцию. В действительности, внутри ядро в высшей степени неоднородно: отдельные хромосомы вовсе не перепутаны между собой, а занимают четко обособленные хромосомные территории, разделенные так называемыми интерхроматиновыми доменами. Более того, хроматин даже в пределах одной хромосомы может подразделяться на топологически ассоциированные домены (ТАДы) . Нередко хроматиновые домены ассоциированы с определенными ядерными структурами, в частности, ядерной ламиной. Это «сетка» из белков-ламинов, которая выстилает ядерную оболочку изнутри и обеспечивает структурную поддержку формы клеточного ядра. У млекопитающих, нематод и дрозофил вблизи ламины нередко находятся особые ламиноассоциированные домены хроматина (ЛАДы), и содержащиеся в них гены экспрессируются на низком уровне или не экспрессируются вовсе [1].
О современных представлениях об организации хроматина в клеточном ядре подробно рассказывается в статье «Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра» [2].
Замечено, что, если ген, находящийся в ЛАДе, активировать (такое часто происходит, например, с тканеспецифичными генами в дифференцирующихся клетках), то он отдаляется от ядерной оболочки к внутренней части ядра [1]. Также известно, что с ядерной ламиной связаны некоторые белки-репрессоры транскрипции, такие как гистондеацетилазы. Однако как именно ядерная ламина влияет на архитектуру хроматина, долгое время известно не было. Группа российских исследователей изучила, чем отличается структура хроматина в клетках дрозофилы линии S2, у которых гены всех ламинов подверглись нокдауну и ядерная ламина отсутствует. Ученые пришли к довольно неожиданным результатам: плотность хроматина в ЛАДах несколько снижается, что сопровождается повышением уровня ацетилирования гистона H3 в этих доменах и активацией транскрипции расположенных в них генов, однако общий уровень компактизации хроматина повышается [1]. Но обо всем по порядку.
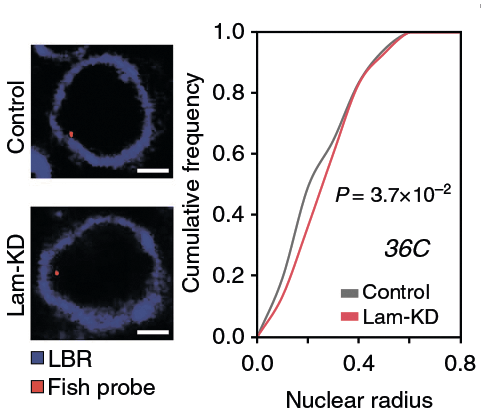
Рисунок 1. Смещение доменов хроматина, расположенных вблизи ядерной оболочки, к центру ядра в клетках Lam-KD. Ядерная оболочка визуализирована с помощью антител к ламин-связывающим рецепторам (lamin-binding receptor, LBR). Красная точка — сместившаяся к центру ядра проба FISH. P-значение, равное 0,037, свидетельствует о статистически значимом сдвиге.
Чтобы изучить, как ядерная ламина влияет на архитектуру хроматина, исследователи провели нокдаун генов ламинов с помощью РНК-интерференции в клетках дрозофилы линии S2. В этих клетках (здесь и далее такие клетки мы будем обозначать Lam-KD), как показала флуоресцентная микроскопия, наблюдается небольшой, но статистически значимый сдвиг распределения хроматина по ядру: его домены, расположенные вблизи ядерной оболочки, перемещаются ближе к центру ядра (рис. 1). Вообще, в Lam-KD хроматин словно бы «сжимается»: при нокдауне ламинов его объем значительно снижается, при том, что объем самого ядра остается неизменным. Что же касается уровня экспрессии генов в ЛАДах, то в отсутствие ламины в этих доменах происходит частичная дерепрессия расположенных там генов, что повышает общий уровень транскрипции [1] .
О том, как аппарат транскрипции взаимодействует с хроматином, рассказывается в статье «Транскрипция в хроматине: как проходить сквозь стены» [3].
Более того, оказалось, что в Lam-KD в связанных с ламиной доменах хроматина значительно повышен уровень ацетилирования гистона H3 — эпигенетическая метка транскрипционно активного хроматина . Вероятно, гистондеацетилазы, связанные с ламиной, по крайней мере отчасти ответственны за низкий уровень ацетилирования гистона H3 и, соответственно, подавленную транскрипцию в ЛАДах [1].
Что такое эпигенетика и как работают эпигенетические метки, читайте в статьях на «Биомолекуле»: «Эпигенетика: невидимый командир генома» [4] и «Эпигеном: параллельная реальность внутри клетки» [5].
Однако что происходит при нокдауне ламинов с хроматином в целом? С помощью метода Hi-C ученые исследовали расположение отдельных ТАДов в нормальных клетках и в Lam-KD.
Метод Hi-C предназначен для определения взаимодействия последовательностей ДНК во всём геноме [2].
Оказалось, что в целом отсутствие ламины не только не повлияло на жизнеспособность клеток, но и не оказало значительного влияния на расположение ТАДов. Однако в Lam-KD те домены, которые активны в нормальных клетках, становятся более плотными, а неактивные домены, напротив, — менее плотными. В их числе — ТАДы, связанные с ламиной: в Lam-KD плотность хроматина в них понижена. Чтобы выяснить, каким образом ламина способствует компактизации связанных с ней доменов хроматина, ученые моделировали поведение полимера, чей способ укладки близок к укладке глобулярных доменов хроматина с неацетилированными нуклеосомами, в присутствии поверхности, способной взаимодействовать с глобулярными доменами полимера (в данной модели она соответствует ядерной ламине). Моделирование показало, что взаимодействие домена хроматина с ядерной ламиной само по себе вызывает его компактизацию [1].
Итак, в отсутствие ядерной ламины хроматин в клетках дрозофилы в целом становится плотнее и смещается от периферии ядра к его центральной части, однако поведение конкретного домена зависит от его активности: активные домены компактизируются, а неактивные ведут себя противоположным образом. Домены, в нормальных клетках связанные с ламиной, компактизованы не только из-за действия репрессирующих гистондеацетилаз, находящихся на ламине, но и под действием ламины самой по себе. Стоит отметить, что ламина не ограничивает пространство, доступное для данного хроматинового домена: скорее, она служит поверхностью, к которой заякоривается хроматин [1].
А что же насчет млекопитающих? Результаты исследований, проведенных на мышиных эмбриональных стволовых клетках, несколько отличаются от результатов, полученных на дрозофиле. У обоих организмов в отсутствие всех ламинов расположение ТАДов в целом сохраняется, а домены хроматина, в норме связанные с ламиной, становятся менее конденсированными. Однако у мышей декомпактизация этих доменов не сопровождается их смещением от ядерной оболочки к центру ядра и активацией транскрипции расположенных в них генов. Так что и у дрозофилы, и у млекопитающих ядерная ламина вызывает компактизацию и репрессию прилегающего к ней хроматина [1].
Литература
- Sergey V. Ulianov, Semen A. Doronin, Ekaterina E. Khrameeva, Pavel I. Kos, Artem V. Luzhin, et. al.. (2019). Nuclear lamina integrity is required for proper spatial organization of chromatin in Drosophila. Nat Commun. 10;
- Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра;
- Транскрипция в хроматине: как проходить сквозь стены;
- Эпигенетика: невидимый командир генома;
- Эпигеном: параллельная реальность внутри клетки.