
Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра
28 июня 2018
Новый взгляд на геном: не просто цепочка генов, а трехмерная сеть, интегрирующая функциональные домены ядра
- 4975
- 0
- 26
«Не то, что мните вы, геномы». На самом деле геном — не просто абстрактная цепочка генов, а сложнейшая трехмерная структура, динамически сворачивающаяся и разворачивающаяся в зависимости от текущего состояния клетки.
рисунок Елены Беловой по [22]
-
Автор
-
Редакторы
-
Иллюстратор
Редакция журнала «Биохимия» и «Биомолекула» предлагают вашему вниманию специальный выпуск журнала, посвященный 3D-организации генома, функциональной компартментализации клеточного ядра и регуляции транскрипции. В выпуске представлены статьи ведущих отечественных и ряда зарубежных ученых, которые кратко резюмирует «Биомолекула». Большое внимание уделяется значению стохастических процессов в установлении 3D-архитектуры генома и эпигенетической роли пространственной организации генома.
«Биохимия» — «Биомолекуле»
Выдающийся франко-швейцарский ученый Вильгельм Бернард (Wilhelm Bernhard) уже в 70-е годы прошлого века осознал, что необходимо интегрировать в единое научное направление цитологию и биохимию, фактически предвосхитив появление научного направления, которое теперь мы называем «молекулярная и клеточная биология». Именно продвижению этой идеи должны были способствовать созданные по инициативе Вильгельма Бернарда регулярные конференции по структуре и функциям клеточного ядра. В прошлом году прошла такая и в России: 19–22 июня 2017 года в Нижнем Новгороде состоялся уже 25-й симпозиум из этой серии.
В 70-е годы прошлого века биохимики рассматривали клеточное ядро как некий реакционный компартмент, в котором сосредоточены молекулы наследственности (ДНК) и ферменты, необходимые для ее удвоения и считывания информации в виде молекул РНК. Происходящие в клеточном ядре процессы пытались понять на основе знаний о кинетике ферментативных реакций в растворе. Будучи специалистом по электронной микроскопии, Вильгельм Бернард хорошо осознавал, что клеточное ядро неоднородно. Соответственно, скорее следовало говорить о том, что оно представляет собой не единый реакционный компартмент, а совокупность относительно изолированных областей.
Эта идея нашла многочисленные подтверждения в последующих исследованиях, которые продемонстрировали, что различные функциональные процессы в клеточном ядре пространственно изолированы. Например, показали, что работающие РНК- и ДНК-полимеразы собраны в кластеры, получившие название транскрипционных и репликационных фабрик [1], [2]. Обнаружили многочисленные внутриядерные компартменты, в которых сосредоточены те или иные ферменты. Наконец, коллектив немецких ученых под руководством Томаса Кремера (Thomas Cremer) продемонстрировал, что в интерфазном ядре индивидуальные хромосомы занимают обособленные (не перекрывающиеся) позиции, получившие название хромосомных территорий [3–5].
Как только научный мир признал факт существования структурно-функциональной компартментализации клеточного ядра, встал вопрос о том, существует ли какая-то структурная платформа, поддерживающая эту компартментализацию. В цитоплазме такой платформой является цитоскелет. Начальные наблюдения, сделанные еще в 1960-х годах рядом ученых, в том числе в России Ильёй Борисовичем Збарским, свидетельствовали о том, что подобная цитоскелету белковая структура существует и в клеточном ядре. Американский ученый Рональд Березни (Ronald Berezney) назвал эту структуру ядерным матриксом. Изучение ядерного матрикса сыграло важную роль в развитии современных представлений о компартментализации клеточного ядра. Многие из наблюдений, сделанных при изучении ядерного матрикса, актуальны и сейчас. Об этом рассказывается в заключительной части статьи Сергея Разина и Алексея Гаврилова в специальном выпуске журнала «Биохимия» [6]. Тем не менее никаких убедительных доказательств существования этой структуры в живых клетках получено не было. Сеть внутриядерных белковых филаментов, которую можно увидеть при электронномикроскопическом исследовании ядер после экстракции хроматина, скорее всего, возникает в результате агрегации белков в интерхроматиновых каналах.
Что же тогда является платформой, на которой собираются функциональные компартменты клеточного ядра? Современная гипотеза состоит в том, что этой платформой является сам упакованный геном. В ее обоснование ключевой вклад внесли работы Томаса Кремера и соавторов, о которых рассказывается в их обзорной статье в спецвыпуске журнала «Биохимия» [7]. Работы этой группы ученых начались с поиска ответа на вопрос: что происходит с хромосомами по завершении митоза? Все знают, что во время митоза пары хромосом имеют вид конденсированных палочек, связанных перетяжками в центромерных областях. А вот что происходит с ними по завершении этого процесса, долгое время оставалось неясным.
Клеточное ядро подобно фабрике, где выполнение отдельных процессов разделено во времени и пространстве
В 70-е годы прошлого века наиболее популярная точка зрения состояла в том, что по завершении митоза хромосомы полностью деконденсируются, распределяясь по всему объему ядра и перемешиваясь с другими хромосомами. Томас Кремер и соавторы сделали простой эксперимент. Они повредили небольшую область клеточного ядра с помощью направленного пучка ультрафиолетового света. Существует техническая возможность посмотреть во время следующего митоза, какие из хромосом оказались повреждены. Если бы ДНК каждой хромосомы была распределена по всему объему ядра, то можно было бы ожидать, что повредятся все хромосомы. Однако на деле поврежденными оказывались лишь несколько хромосом. Это позволило заключить, что хромосомы занимают ограниченные области внутри клеточного ядра.
Как и вообще в науке, дальнейший прогресс в этих исследованиях был обусловлен развитием экспериментальных технологий. С появлением конфокальной микроскопии [8] и методов визуализации индивидуальных хромосом посредством флуоресцентной гибридизации in situ (FISH) с наборами хромосом-специфичных проб, удалось показать, что интерфазные хромосомы действительно занимают ограниченные и в первом приближении неперекрывающиеся области, получившие название «хромосомные территории» (рис. 1).
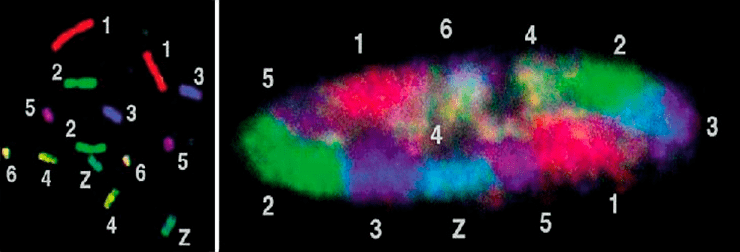
Рисунок 1. Каждой хромосоме — свою территорию. Большие хромосомы курицы окрашены наборами разноцветных флуоресцентных хромосом-специфичных проб. Слева показана окраска хромосом в метафазе, а справа — в интерфазном ядре. Можно видеть, что хромосомы занимают неперекрывающиеся области ядра.
Между хромосомными территориями находится так называемый интерхроматиновый домен, а внутри него располагаются различные функциональные компартменты, о которых говорилось выше. Хромосомные территории в каждом ядре позиционируются посредством прикрепления к ядерной оболочке (ламине) и ядрышку (рис. 2). Кроме того, существуют и «сцепки» между хромосомными территориями, возникающие благодаря тому, что некоторые участки разных хромосом привлекаются к одним и тем же функциональным компартментам (транскрипционным фабрикам, компартментам сплайстинга и т.д.) в интерхроматиновом домене. В силу этого возникает единый и при этом относительно «жесткий» хроматиновый домен, который и служит структурной платформой для всей внутриядерной организации.
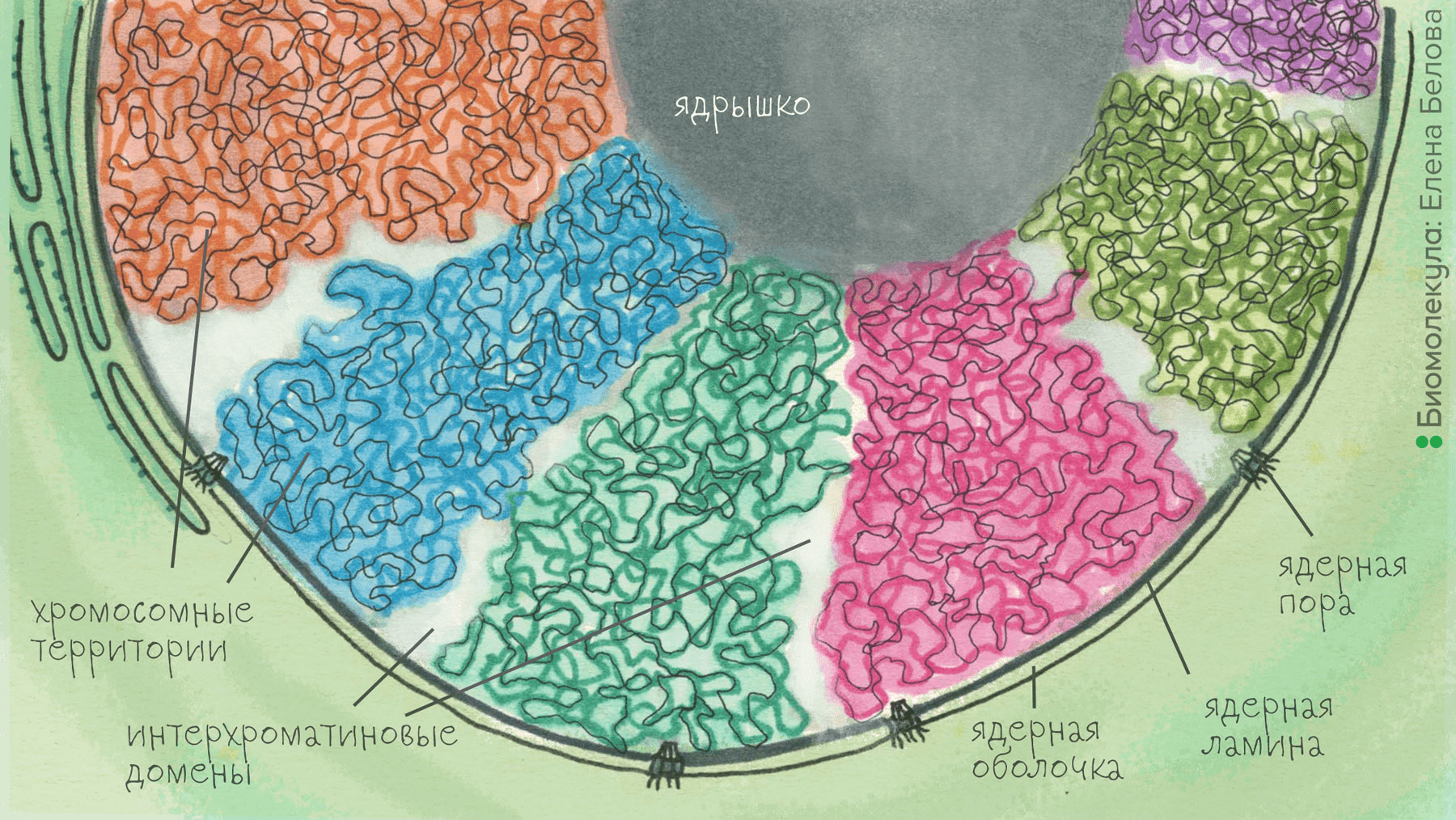
Рисунок 2. Хроматиновый компартмент и интерхроматиновый домен. Отдельные хромосомные территории (показаны разными цветами) прикрепляются к ядрышку и ядерной ламине. В ряде мест хромосомные территории контактируют друг с другом, в силу чего формируется единый хроматиновый компартмент. Интерхроматиновым доменом являются относительно свободные от хроматина места между хромосомными территориями, а также полости (каналы), пронизывающие хромосомные территории.
рисунок Елены Беловой по [24]
Модель хромосомных территорий и интерхроматинового домена сформулировал Томас Кремер в конце 80-х годов прошлого века, и в последующие годы ее совершенствовали и уточняли по мере появления новых экспериментальных данных. В статье Томаса Кремера и соавторов, опубликованной в спецвыпуске журнала «Биохимия» [7], представлена современная версия модели, учитывающая последние результаты авторов, полученные с использованием микроскопии высокого и сверхвысокого разрешения (SIM, STORM) [9], [10].
Наиболее важные уточнения состоят в том, что интерхроматиновые каналы пронизывают хромосомные территории. Последние представляют собой свернутую цепочку из глобулярных хроматиновых доменов (содержащих ~1 млн пар нуклеотидов ДНК), которые иногда организованы в кластеры. Существенно, что внутренние области таких глобулярных доменов содержат преимущественно неактивный хроматин, тогда как транскрибирующиеся гены находятся на поверхности глобулярных доменов в так называемом перихроматиновом слое (рис. 3). Эта организация обеспечивает предпочтительную доступность транскрипционноактивной фракции генома для регуляторных белков и аппарата транскрипции. Одновременно обеспечивается возможность транспорта новосинтезированных РНК к ядерным порам по сети интерхроматиновых каналов.

Рисунок 3. Модель организации хроматинового домена в виде сети «активный ядерный компартмент — неактивный ядерный компартмент». Внутренние области компактных хроматиновых доменов, содержащие преимущественно неактивный хроматин, показаны красным. Слой активного хроматина на поверхности этих доменов показан оранжевым. Активный хроматин уложен менее компактно, для него характерны многочисленные выпетливания хроматиновой фибриллы в интерхроматиновый компартмент (белые области на рисунке). С петлями хроматиновой фибриллы связаны работающие молекулы РНК-полимеразы II, которые организованы в транскрипционные фабрики (фиолетовые тельца в интерхроматиновом компартменте). В интерхроматиновом компартменте присутствуют и другие функциональные ядерные домены, в том числе спеклы сплайсинга (желтые). Типичный хроматиновый домен, состоящий из неактивного хроматина окруженного «короной» активного хроматина, выделен черным пунктиром в центре рисунка. Размеры и форма таких хроматиновых доменов могут существенно варьировать.
рисунок Елены Беловой по [7]
Возникновение 3D-геномики
Работы коллектива исследователей, возглавляемого Томасом Кремером, раскрыли важные особенности структурно-функциональной организации клеточного ядра. Однако ультраструктурные исследования в принципе не могут дать ответа на вопрос о том, как устанавливается и поддерживается пространственная организация генома. В раскрытии механизмов, поддерживающих пространственную организация эукариотического генома, а стало быть и структурно-функциональную компартментализацию клеточного ядра, ключевую роль сыграли работы молекулярных биологов, выполненные на протяжении последних 15 лет. Результаты этих работ анализируются в обзорной статье Разина и Гаврилова, опубликованной в спецвыпуске журнала «Биохимия» [6].
Ключевой инструмент, позволивший изучать 3D-организацию генома, — процедура лигирования близкорасположенных фрагментов ДНК, разработанная американским ученым Джобом Деккером (Job Dekker). Нить ДНК разрезается на фрагменты внутри фиксированных формальдегидом ядер, и возникающие свободные концы ДНК вновь сшивают с помощью ДНК-лигаз. При этом во многих случаях восстанавливается целостность исходной цепи ДНК, однако возможна и перекрестная сшивка фрагментов, физически расположенных рядом, но разнесенных далеко друг от друга на молекуле ДНК. Такое может произойти в случае петель на ДНК: фрагменты нити, расположенные в основании петли, сближены друг с другом.
На основе процедуры лигирования близкорасположенных фрагментов ДНК разработан ряд экспериментальных протоколов, адаптированных для решения разных задач и в совокупности именуемых С-методами (от названия исходной процедуры — Chromosome Conformation Capture; сокращенно — 3C). Принцип одного из этих методов — Hi-C, позволяющего строить полногеномные профили пространственных взаимодействий удаленных фрагментов ДНК, — показан на рисунке 4.
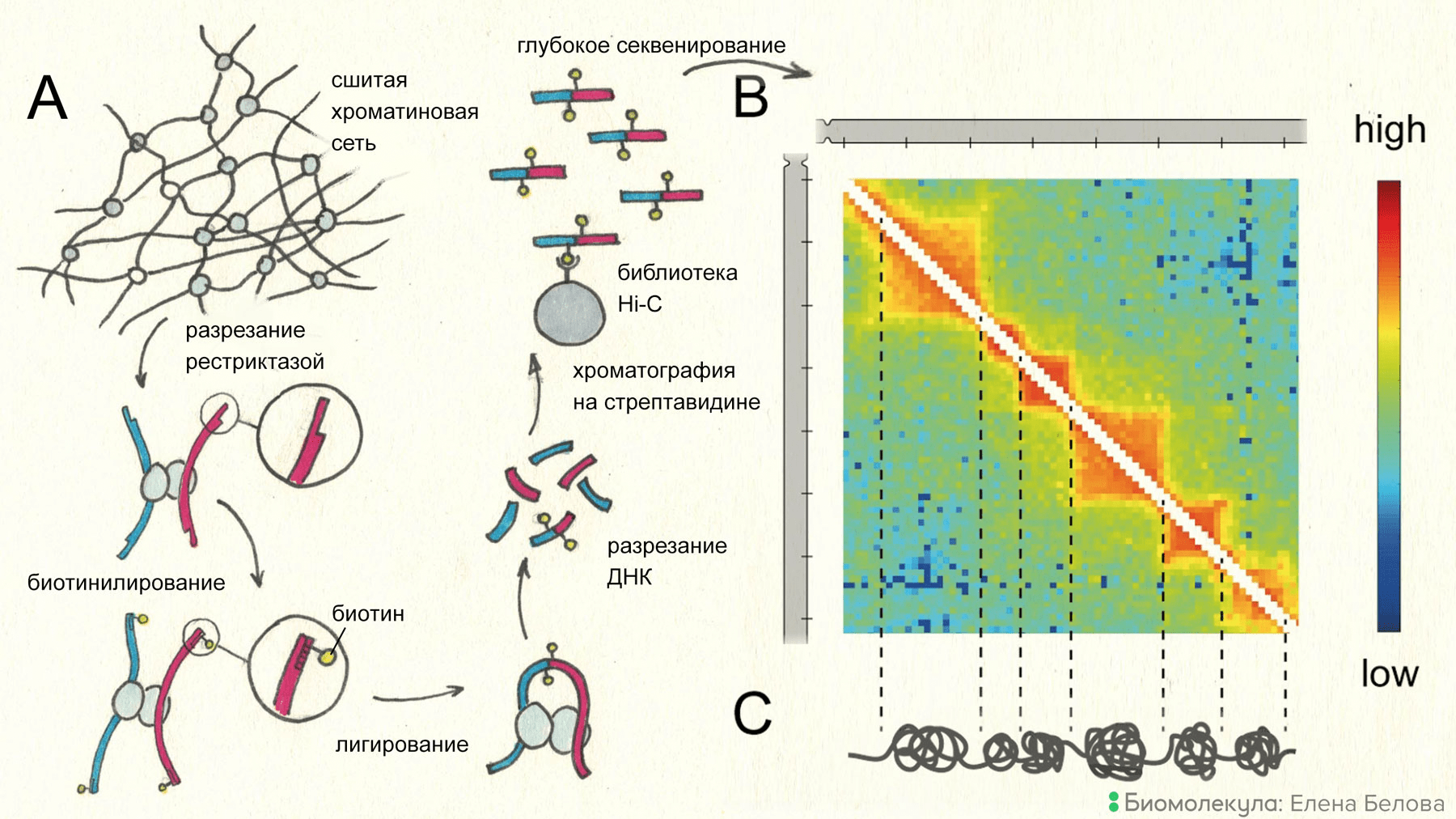
Рисунок 4. Принцип метода Hi-C. Конфигурация хроматиновой фибриллы в ядре фиксируют формальдегидом. После экстракции непришитых гистонов ДНК разрезают рестриктазой и застраивают липкие концы с использованием биотинилированного предшественника. Далее проводят лигирование. При этом возможно образование сшивок между отдаленными фрагментами ДНК, которые оказались сближены в силу особенностей укладки хроматиновой фибриллы. Сшитые фрагменты выделяют посредством аффинной хроматографии на шариках со стрептавидином, который специфически связывает биотин. Полученный препарат секвенируют и результаты накладывают на референсный геном. Получаемая в итоге «тепловая карта» позволяет судить о частотах контактов между удаленными геномными элементами. На приведенной в секции B тепловой карте красный цвет соответствует наиболее высокой частоте пространственных взаимодействий. Выраженные треугольники на карте свидетельствуют о существовании контактных доменов, внутри которых пространственные взаимодействия наблюдаются намного чаще, чем между доменами. Контактные домены обычно отождествляют с хроматиновыми глобулами, хотя убедительные свидетельства в пользу такой интерпретации появились лишь недавно [11].
рисунок Елены Беловой по [24]
С использованием С-методов были раскрыты некоторые важные принципы пространственной организации генома . В частности, показали, что хромосома разделяется на так называемые топологически-ассоциированные домены, ТАДы (рис. 4С), размер которых в клетках млекопитающих составляет ~1 м.п.н. Основной характеристикой ТАДов является то, что пространственные контакты внутри ТАДа происходят существенно чаще, чем между ними. Это может происходить, например, в том случае, когда в границах ТАДа хроматиновая фибрилла организована в компактную глобулу. Легко видеть возможное соответствие ТАДов глобулярным доменам, которые обнаружили Томас Кремер и соавторы. Действительно, визуализация индивидуальных ТАДов с использованием техники FISH и микроскопии высокого разрешения продемонстрировала, что ТАДы обычно имеют глобулярную форму.
Также с помощью методики Hi-C были раскрыты подробности «молекулярных путешествий» некодирующей РНК Xist, функция которой — инактивация некоторых генов на X-хромосоме: «Загадочное путешествие некодирующей РНК Xist по X-хромосоме» [12]. — Ред.
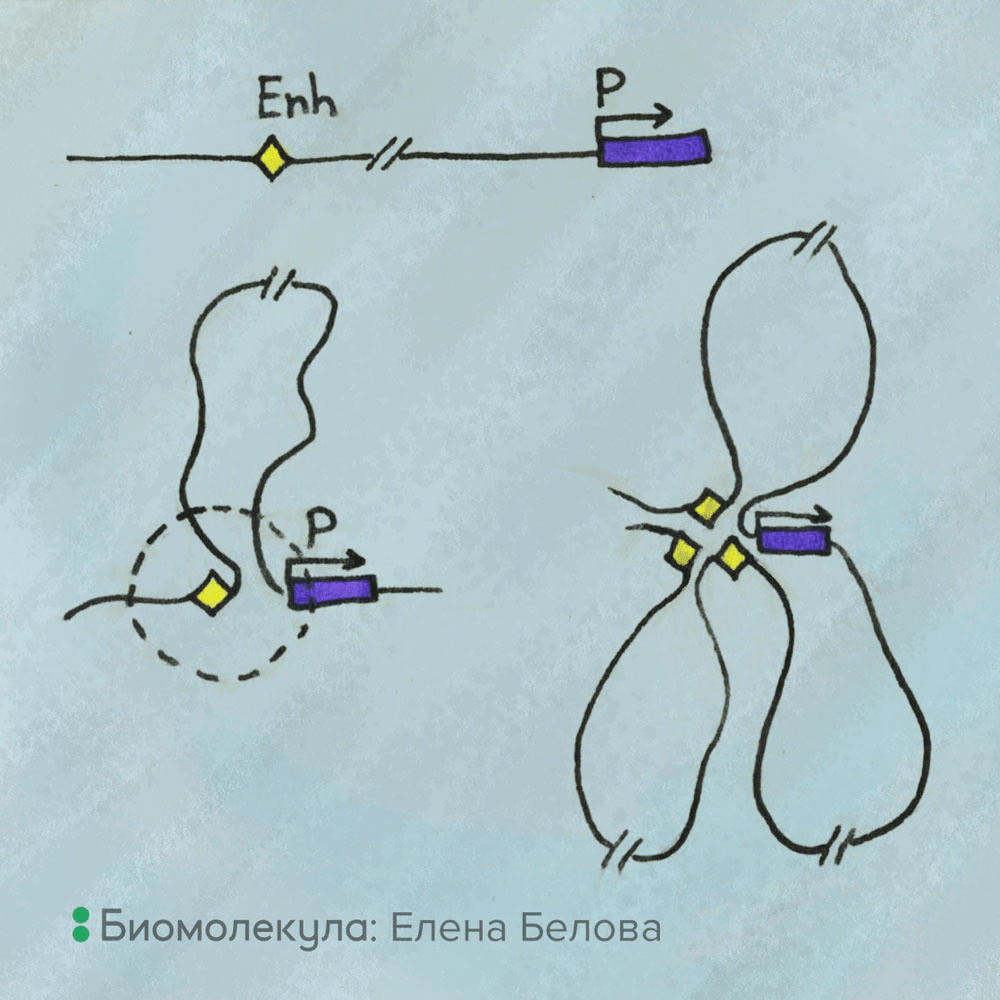
Рисунок 5. Как работают энхансеры: удаленные от своего промотора в последовательности ДНК, они могут быть сближены в пространстве. Вверху — На линейной ДНК ген, расположенный далеко от энхансера, оказывается вне зоны действия энхансера. Слева — Выпетливание разделяющего энхансер и промотор сегмента хроматиновой фибриллы перемещает промотор в сферу действия энхансера (область, ограниченная пунктиром). Справа — На уровне 3D-организации генома один ген может оказаться в сфере действия нескольких энхансеров.
рисунок Елены Беловой
Помимо организации в ТАДы, характерной особенностью упаковки эукариотических геномов является существование большого количества хроматиновых петель различного рода. Из них с функциональной точки зрения наибольший интерес представляют выпетливания хроматиновой фибриллы, обеспечивающие приближение энхансеров к промоторам. В свете этих результатов стало очевидным, что на уровне 3D-организации генома работают важные эпигенетические механизмы, контролирующие транскрипцию [13].
На подсознательном уровне большинство людей, в том числе и ученых-биологов, все еще рассматривают геном как линейную цепь генов и регуляторных элементов. Трендом времени является, однако, представление о геноме как о трехмерной структуре, обеспечивающей возможность установления контактов между генами и удаленными регуляторными элементами. Сейчас известно, что в геноме человека количество регуляторных модулей (энхансеров) в разы превышает количество генов [14], [15]. Именно трехмерная организация генома обеспечивает возможность активации тех или иных генов одновременно несколькими энхансерами в различных комбинациях (рис. 5), что позволяет системе регуляции транскрипции лучше адаптироваться к изменяющимся потребностям клетки.
Осознание этого факта привело к возникновению 3D-геномики, которая позволяет объяснить многие непонятные ранее феномены. Ясно, что организация генома в ТАДы накладывает определенные ограничения на возможность установления пространственных контактов между удаленными регуляторными элементами. Такие контакты, как правило, устанавливаются внутри ТАДов. В силу этого сфера активности энхансеров часто ограничивается пределами соответствующего ТАДа. Слияние ТАДов или возникновение новых ТАДов в результате хромосомных перестроек (таких, как делеции и инверсии) может привести к нарушению работы большого числа генов и, как уже показано, является причиной возникновения ряда наследственных заболеваний. Обо всем этом можно прочитать в статье Разина и Гаврилова в спецвыпуске журнала «Биохимия» [6].
От констатации фактов к раскрытию механизмов
Учитывая очевидную функциональную роль 3D-организации генома, важно понять, как эта организация складывается и какие силы ее поддерживают. Что касается ТАДов, то существуют две не исключающие друг друга модели. Одна из них, которую можно назвать моделью динамического выпетливания ДНК (DNA loop extrusion), постулирует, что в сегментах генома, ограниченных конвергентными сайтами связывания архитектурного белка CTCF, происходит динамическое выпетливание хроматиновой фибриллы, которое может начаться в любой точке и продолжается до сайта связывания CTCF. В результате в разных клетках рядом оказываются разные участки данной области генома. При интеграции данных по клеточной популяции получается домен, внутри которого предпочтительно реализуются пространственные контакты ДНК. Эта модель подробно обсуждается в недавней статье на «Биомолекуле»: «Организовать геном: запутанная история гипотез и экспериментов» [16].
Недостатком модели является то, что ТАД представляется популяционным феноменом, в то время как хроматиновые глобулы можно видеть в индивидуальных клетках. Другая модель, предложенная отечественными учеными, постулирует, что ТАДы — это компактные хроматиновые домены, существующие в индивидуальных клетках [17]. Движущей силой, обеспечивающей возникновение таких доменов, представляется электростатическое взаимодействие между нуклеосомами неактивного хроматина. Эта модель хорошо согласуется с описанными выше результатами Томаса Кремера и соавторов, но не объясняет предпочтительной локализации конвергентных сайтов связывания CTCF на границах ТАДов в клетках млекопитающих.
Роль стохастических процессов в клеточном ядре — как хаос порождает порядок
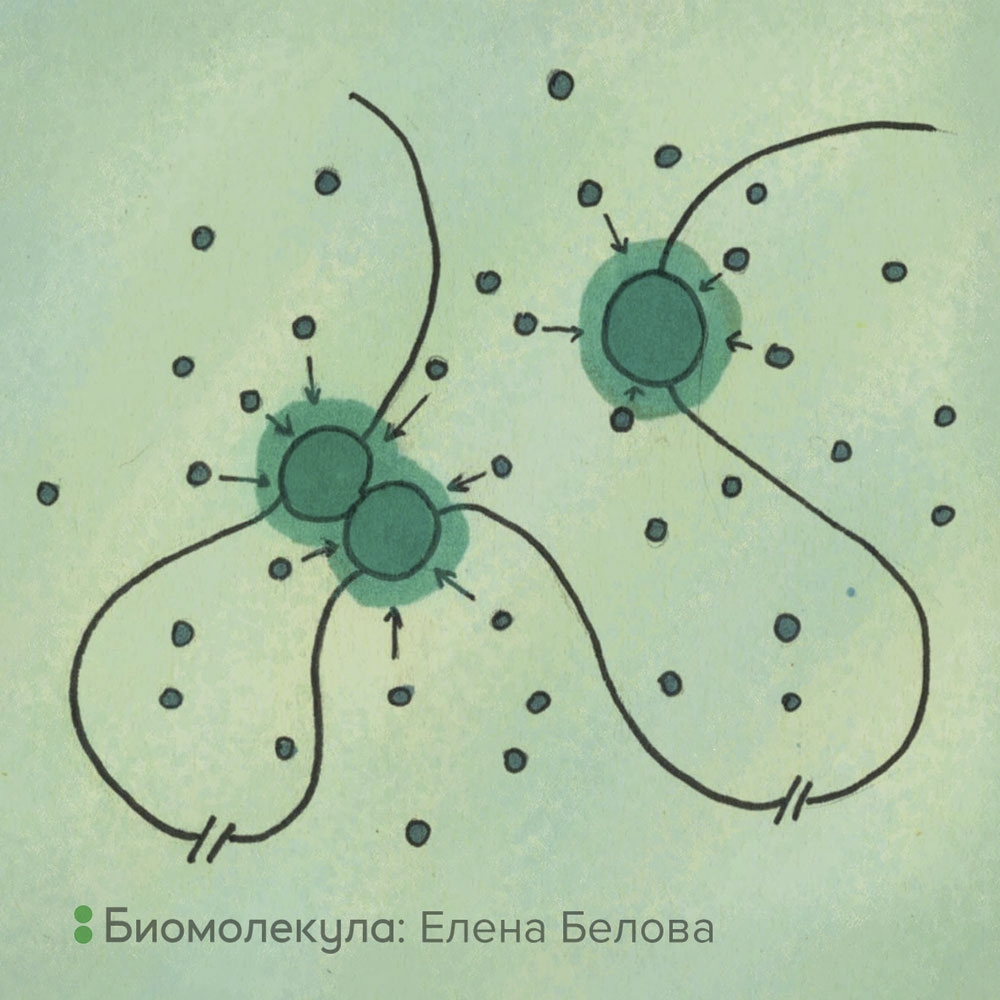
Рисунок 6. Энтропийные силы, возникающие в условиях макромолекулярного скопления, способствуют созданию макромолекулярных агрегатов. Находясь в постоянном температурном движении, малые молекулы бомбардируют более крупные молекулярные комплексы с разных направлений. В том случае, если по стечению обстоятельств два крупных объекта окажутся рядом, микромолекулы не смогут бомбардировать их со стороны контактирующих поверхностей, в силу чего крупные объекты будут постепенно объединяться в еще более крупные агрегаты, подобно мусору на поверхности воды. Кроме того, объединение двух крупных объектов сокращает так называемый исключенный объем (зеленые короны вокруг крупных объектов), что дает выигрыш в энтропии. Связанные с ДНК макромолекулярные комплексы также будут объединяться под действием энтропийных сил, что может приводить к образованию петель ДНК.
рисунок Елены Беловой
Кажущимся недостатком всех моделей пространственной организации ТАДов является то, что поддержание 3D-организации генома обеспечивается относительно слабыми взаимодействиями. В какой-то мере все эти модели похожи на создание трехмерной конструкции из водопроводных труб, удерживаемых пластилином. Впрочем, роль слабых взаимодействий в молекулярной биологии не стоит недооценивать: об этом идет речь в статье «Роль слабых взаимодействий в биополимерах» на «Биомолекуле» [18].
В клеточном ядре существуют силы, способствующие удержанию вместе крупных объектов, которые стабилизируют 3D-геном и внутриядерные компартменты. Об этих силах рассказывается в статье Рональда Хэнкока (Ronald Hancock) [19]. Он одним из первых обратил внимание на то, что концентрация макромолекул в ядре столь высока, что она соответствует условиям макромолекулярного скопления. В этих условиях термодинамически выгодным оказывается объединение крупных объектов в еще более крупные агрегаты (рис. 6). В крайних случаях при этом происходит разделение фаз [20]. Так возникают различные ядерные компартменты, в том числе ядрышко, спеклы сплайсинга, тельца Кахаля и т.д. Эти компартменты не окружены мембранами и существуют до тех пор, пока выполняются условия макромолекулярного скопления. Хэнкок продемонстрировал, что все эти компартменты можно разбирать и собирать вновь, изменяя уровень макромолекулярного скопления. Энтропийные силы, возникающие в этих условиях, поддерживают и компактную организацию различных хроматиновых структур, таких как метафазные хромосомы, гетерохроматиновые кластеры и глобулярные хроматиновые домены (ТАДы) в составе интерфазных хромосом.
В контексте 3D-геномики возможно совершенно новое объяснение биологической роли бессмысленных, на первый взгляд, участков нуклеотидной последовательности. Не кодируя никакие белки, эти участки генома могут, тем не менее, существенно влиять на транскрипцию тех или иных генов, модулируя способ пространственной укладки протяженных областей генома. Конкретные механизмы такого влияния еще предстоит выяснить. Это может стать ключом к раскрытию возможной роли повторяющихся последовательностей в работе генома. В этой связи в спецвыпуск журнала «Биохимия» включена статья Ольги Подгорной и соавторов, в которой суммируются современные знания, включая и результаты собственных работ авторов, о повторяющихся последовательностях генома млекопитающих [21].
Литература
- P. R. Cook. (1999). The Organization of Replication and Transcription. Science. 284, 1790-1795;
- Razin S.V., Gavrilov A.A., Yarovaya O.V. (2010). Transcription factories and spatial organization of eukaryotic genomes. Biochemistry (Mosc.). 75, 1307–1315;
- T. Cremer, A. Kurz, R. Zirbel, S. Dietzel, B. Rinke, et. al.. (1993). Role of Chromosome Territories in the Functional Compartmentalization of the Cell Nucleus. Cold Spring Harbor Symposia on Quantitative Biology. 58, 777-792;
- T. Cremer, C. Cremer. (2001). Chromosome territories, nuclear architecture and gene regulation in mammalian cells. Nat Rev Genet. 2, 292-301;
- T. Cremer, M. Cremer. (2010). Chromosome Territories. Cold Spring Harbor Perspectives in Biology. 2, a003889-a003889;
- Razin S.V. snd Gavrilov A.A. (2018). Structural–functional domains of the eukaryotic genome. Biochemistry (Mosc.). 83, 302–312;
- Cremer T., Cremer M., Cremer C. (2018). The 4D nucleome: genome compartmentalization in an evolutionary context. Biochemistry (Mosc.). 83, 313–325;
- 12 методов в картинках: микроскопия;
- Лучше один раз увидеть, или Микроскопия сверхвысокого разрешения;
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Quentin Szabo, Daniel Jost, Jia-Ming Chang, Diego I. Cattoni, Giorgio L. Papadopoulos, et. al.. (2018). TADs are 3D structural units of higher-order chromosome organization in Drosophila. Sci. Adv.. 4, eaar8082;
- Загадочное путешествие некодирующей РНК Xist по X-хромосоме;
- Эпигенетика: невидимый командир генома;
- Геном человека: полезная книга, или глянцевый журнал?;
- Сколько сора в нашей ДНК;
- Организовать геном: запутанная история гипотез и экспериментов;
- Sergey V. Ulianov, Ekaterina E. Khrameeva, Alexey A. Gavrilov, Ilya M. Flyamer, Pavel Kos, et. al.. (2016). Active chromatin and transcription play a key role in chromosome partitioning into topologically associating domains. Genome Res.. 26, 70-84;
- Роль слабых взаимодействий в биополимерах;
- Hancock R. (2018). Crowding, entropic forces, and confinement: crucial factors for structures and functions in the cell nucleus. Biochemistry (Mosc). 83, 326–337;
- Разделяй и властвуй: роль разделения фаз в жизни клетки;
- Podgornaya O.I., Ostromyshenskii D.I., Enukashvily N.I. (2018). Who needs this junk, or genomic dark matter. Biochemistry (Mosc). 83, 450–466;
- Pamela K Geyer, Michael W Vitalini, Lori L Wallrath. (2011). Nuclear organization: taking a position on gene expression. Current Opinion in Cell Biology. 23, 354-359;
- Felix A. Habermann, Marion Cremer, Joachim Walter, Gregor Kreth, Johann von Hase, et. al.. (2001). . Chromosome Research. 9, 569-584;
- Sergey V. Ulianov, Alexey A. Gavrilov, Sergey V. Razin. (2015). Nuclear Compartments, Genome Folding, and Enhancer-Promoter Communication. International Review of Cell and Molecular Biology. 183-244.






