
Ядерный магнитный резонанс, или волшебная палочка для химиков и биологов
27 сентября 2021
Ядерный магнитный резонанс, или волшебная палочка для химиков и биологов
- 3337
- 0
- 3
Компьютер, обрабатывающий результаты работы спектрометра Bruker.
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Ядерный магнитный резонанс находит широкое применение как в науке в качестве мощного метода анализа структуры органических веществ (в том числе, биомолекул), так и в медицине для обнаружения различных патологий. А что это такое, как работает, как развивается этот метод? Читайте в этой статье.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Биофизика» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания «БиоЛайн».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Как же иногда хочется чудес! Взмахнуть волшебной палочкой — и все свершится, появятся все необходимые данные, и все закономерности станут ясны — как устроен наш мир, почему он так устроен и что будет дальше? Сейчас известно уже немало методов анализа структуры соединений, хотя еще буквально век назад заглянуть внутрь вещества казалось задачей непосильной. Одними из тех, кто разрешил ее, стали Эдвард Миллс Персел и Феликс Блох — физики, получившие Нобелевскую премию за открытие явления ЯМР. Сейчас это явление имеет большое значение для решения различных задач химии и биологии. Конечно, существуют и другие методы, которые также помогают ученым в этих областях — например, рентгеноструктурный анализ, позволяющий говорить о структуре наиболее детально. Есть и метод криоэлектронной микроскопии, в последние годы дополнивший арсенал методов структурной биологии. Однако эти методы приведены здесь лишь для ознакомления, так как каждый из них заслуживает отдельной статьи. Вернемся к основной теме.
«Биомолекула» уже посвящала этим методам отдельные статьи. Мы призываем читателей не повторять ошибки автора этой заметки и ознакомиться с ними: «12 методов в картинках: структурная биология», «Сверхпроводящие магниты и рецепторы биомембран: Лаборатория биомолекулярной ЯМР-спектроскопии ИБХ РАН», «Фемтосекундные рентгеновские лазеры — кристаллография будущего», «Крупные подробности микроскопического мира: Нобелевская премия по химии 2017» и другие публикации раздела Структурная биология [1–4].
Однако эта статья, хотя и совершенно упускает из виду существование структурной биологии, очень удачно рассказывает о самых основах методиках ЯМР-спектроскопии, которая в таком ключе еще не была разобрана на «Биомолекуле». — Ред.
Что же такое ЯМР? Это явление, вызванное взаимодействием магнитного поля ядра какого-либо атома (однако не всякое ядро способно к взаимодействию) с внешним магнитным полем [5]. Способность или неспособность воспринимать воздействие магнитного поля зависит от четности или нечетности составляющих ядро частиц. Именно это характеризует спин, т.е. собственный магнитный момент ядра, который может быть целым или полуцелым. Именно для ядер с полуцелым значением спина воздействие поля ощутимо. Спин можно сравнить с уровнем общительности — кто-то готов и открыт к новым контактам, как ядра, имеющие полуцелый спин; а кто-то инертен и предпочитает оставаться один, как ядра со спином целым.
Перейдем к описанию непосредственно процесса — например, вы общаетесь, взаимодействуете с людьми, и их эмоции оказывают влияние на ваше собственное душевное состояние. Как же приятно находиться в гармонии с чьими-либо чувствами, быть с кем-то «на одной волне». Для ядерного магнитного резонанса это выражение стоит понимать в самом прямом смысле: ядро подстраивается под внешнее поле, поглощает электромагнитную энергию, которую приносят радиоволны. В момент, когда поглощение энергии, то есть «взаимопонимание» между ядром и внешним полем достигает максимума, наступает момент резкого возрастания «настроения» — амплитуды. Мгновение этого «искреннего счастья» — резонанса — мы и можем увидеть в виде пика на спектре (рис. 1).
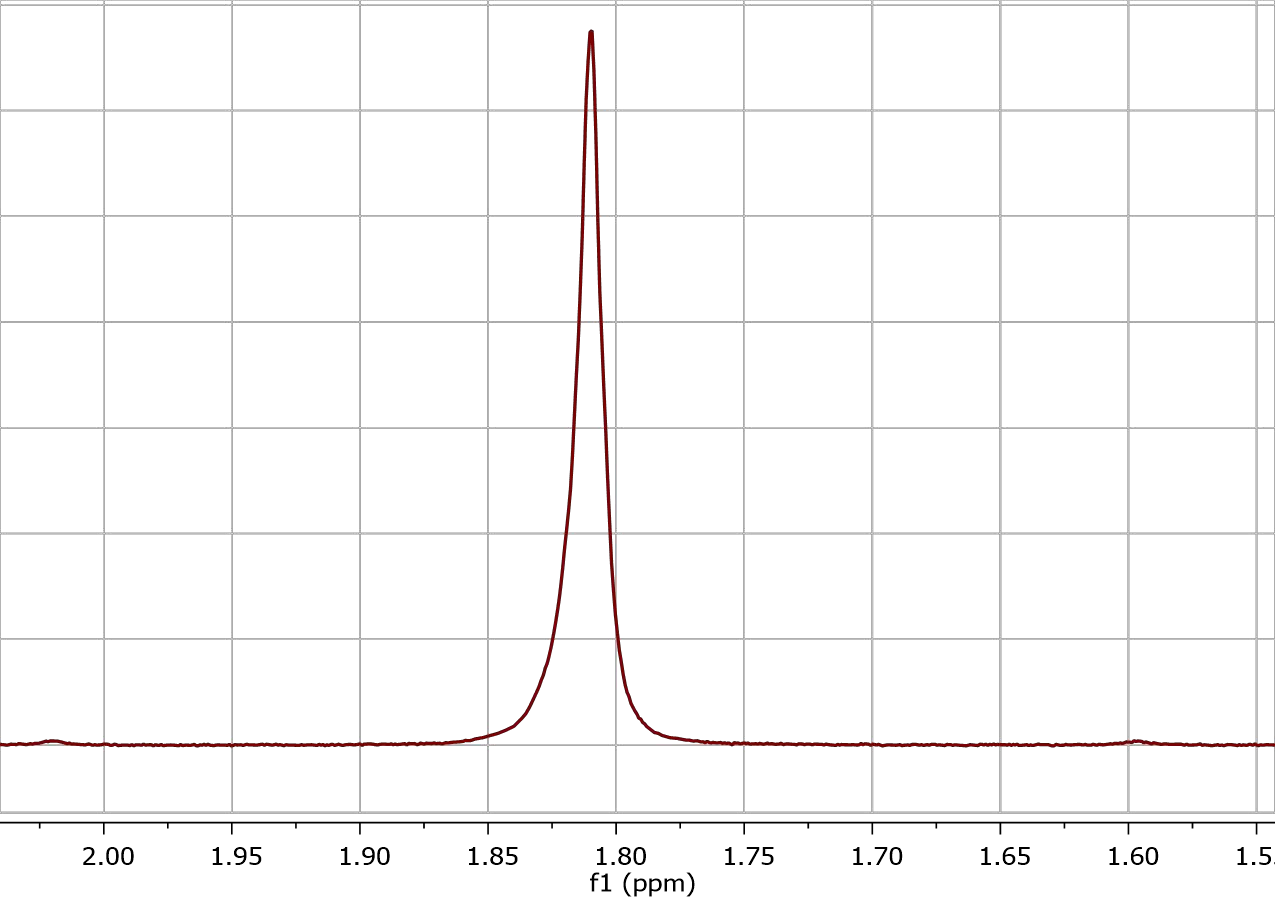
Рисунок 1. Пик в ЯМР-спектре 1H, снятый на спектрометре Bruker, где ppm — химический сдвиг.
Не все ядра согласны на подобное вмешательство в личную жизнь — повторюсь, эффект ЯМР можно наблюдать лишь для тех, чье спиновое квантовое число отлично от нуля, то есть число протонов и нейтронов в составе не является четным. Например, привычный для нас водород 1Н (протий) активно используется для регистрации ЯМР-спектров, тогда как его ближайший родственник — дейтерий 2H (2D), — напротив, используется в том случае, когда видеть сигнал нам не нужно. Сигнал сам по себе является количественным изображением частоты поглощения ядра во время резонанса.
Однако в молекулах так много ядер одинакового состава, как же мы можем анализировать их сигналы? Сможем ли мы их различить? Да, поскольку резонансная частота зависит не только от состава ядра. Посмотрев на человека, мы с высокой точностью можем сказать что-то о его окружении: «скажи мне, кто твой друг, и я скажу, кто ты». Аналогично и в ЯМР. Химики исследуют, конечно, не одинокие ядра, а вещества, т.е. группы ядер с различным наполнением их электронной оболочки. У каждой такой группы, например, карбоксильной (СООН) или гидроксильной (ОН) есть характерная область положения пика, поскольку окружение углерода влияет на его сдвиг, да и сами ядра кислорода и водорода при снятии соответствующего спектра по ним дадут свои пики. Также существует зависимость формы и количества линий сигнала от ближайших соседей ядра. Большую роль это играет для обработки спектров 1Н — если протон не имеет других соседей-протонов на ближайших атомах, следовательно, это синглет, и линия будет одна; если он имеет одного соседа — дублет, два соседа — соответственно, триплет (рис. 2). Почему так происходит? В резонансе ядро чувствует вмешательство других, и его сигнал становится как бы расщепленным, потому что он и его сосед могли бы дать даже один сигнал, но достигают расщепления из-за своей неодинаковости. Немаловажна и площадь под пиком — как размер дома увеличивается с ростом числа квартир в нем, так в спектре площадь под графиком прямо пропорциональна количеству ядер, которые внесли вклад в его создание.
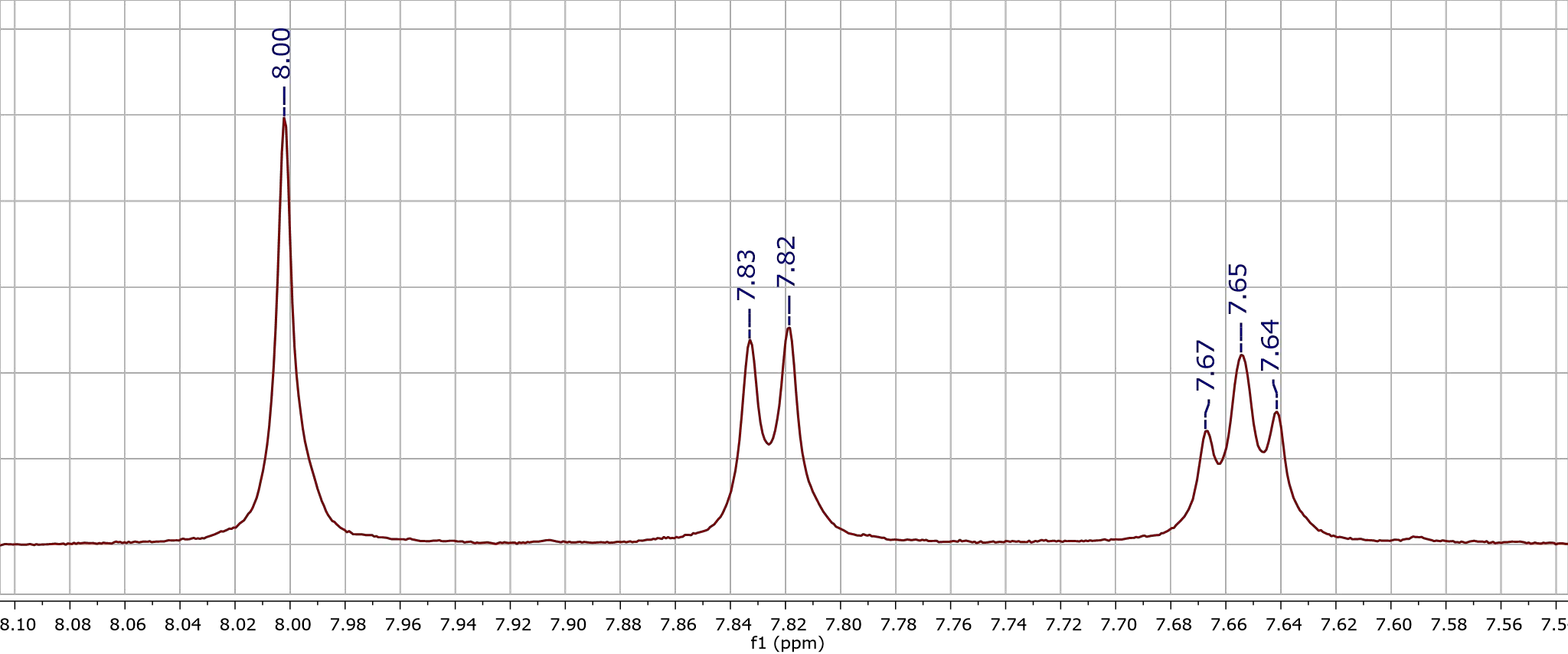
Рисунок 2. Сигналы в спектре 1Н с различным количеством линий. Классический спектр частот от 8,0 до 7,5 ppm, снятый на аппарате Bruker.
О каком графике вообще идет речь? По оси ординат откладывают интенсивность сигнала, т.е. интенсивность частоты поглощения, по оси абсцисс — химический сдвиг. Химическим сдвигом называется отношение резонансной частоты к рабочей частоте прибора; измеряется он в миллионных долях (parts per million, ppm). Для каждой функциональный группы, класса соединений есть характерная область химического сдвига — так же, как и для каждой группы людей можно выделить характерные черты, как, например, для школьников, родителей или студентов. У каждой из групп в коллективе будут свои порядки, правила и предпочтения. Именно эта величина позволяет нам с высокой точностью сказать, какое именно ядро было подвергнуто воздействию магнитного поля.
Но откуда вообще мы берем ядра? Безусловно, неинтересно, да и попросту невозможно взять одно-единственное ядро и поместить его в прибор. Куда интереснее анализировать группы ядер, разбираться в запутанных взаимоотношениях целого коллектива. Например, изучать таким способом строение различных сложных органических веществ с множеством функциональных групп, циклов, кратных связей. Для этого пользуются спектрами 13С и 1Н. И если с протоном все понятно, то 13С — это изотоп, то есть ядро с таким же количеством протонов, но другим числом нейтронов. Иногда для анализа молекулы в нее специально вводят метку изотопа. Сейчас мы можем получать не только простые наборы пиков. Например, подбирая время и интенсивность излучения, мы можем снять спектр 13С, где линии атомов, связанных с одним и тремя атомами водорода, направлены в одну сторону (по положительному направлению оси), а связанных с двумя атомами водорода или не связанных вовсе — в другую (по отрицательному направлению оси) (рис. 3).
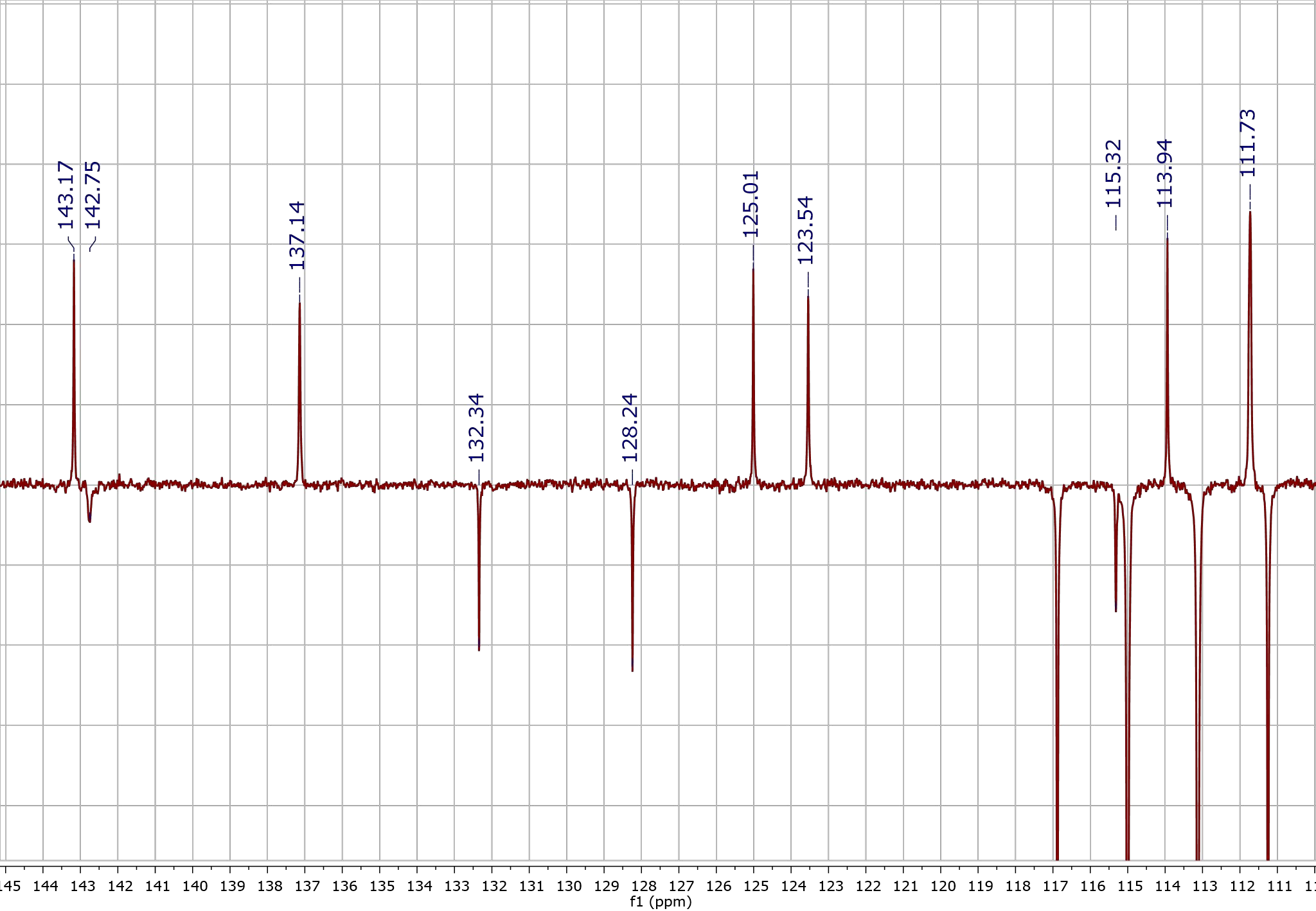
Рисунок 3. Спектр 13С, где линии сигналов CH-групп направлены вверх, а сигналы четвертичных атомов углерода — вниз. Такая сортировка обоснована тем, что протонированные углероды имеют пики, направленные в положительную область, а депротонированные — в отрицательную (либо наоборот, это зависит от настроек программы, где открыт спектр, в данном случае это программа от компании Mestrelab Research).
Спектр снят на аппарате Bruker.
Можно поставить эксперимент при различных температурах — как человек в накаленной обстановке мыслит более порывисто, эмоционально, так и ядра при высоких температурах дают более расплывчатые пики. При охлаждении веществ чувствительность прибора растет, и можно получить более детализованные спектры (рис. 4). Сам по себе спектрометр для точности охлаждается жидким азотом либо жидким гелием, который заполняет колбу вокруг области снятия спектра.
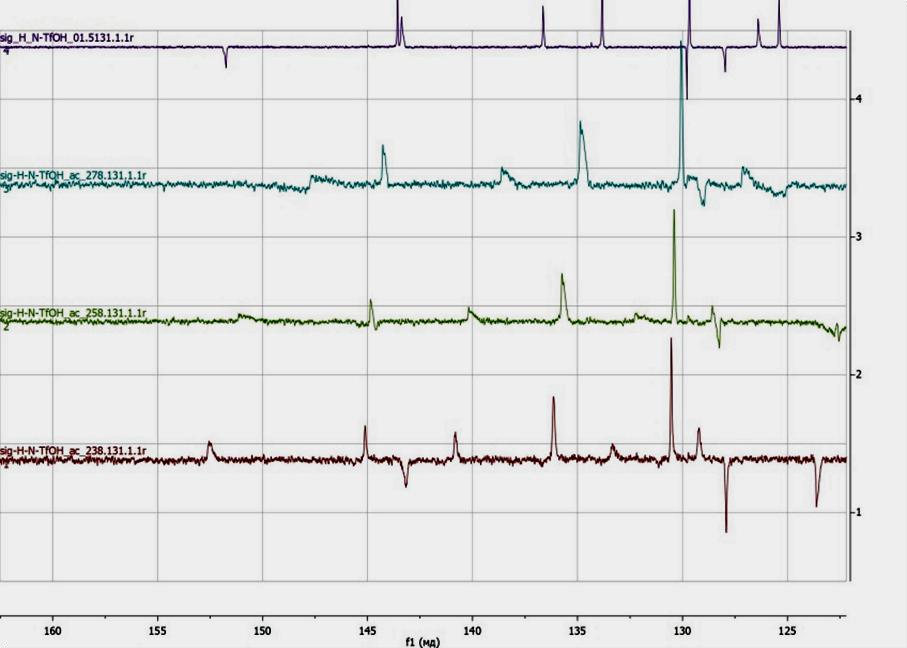
Рисунок 4. Спектры 13С при разных температурах (снизу вверх: 238, 258, 278, 298 К), которые позволяют сделать вывод о изменении хим. сдвига при разных температурах.
Спектр снят на приборе Bruker.
Более того, возможно создавать комбинации спектров: например, 1Н—1Н или 13С—13С, когда мы откладываем по оси х один из спектров, а по оси у — другой, получая таким образом пересечения, по которым можем судить о связи атомов. Более того 1Н—13С — последний вариант сочетания — имеет два основных вида: HMQC — HETeronuclear MultyQuantum Correlation (рис. 5) для оценки взаимодействия ближайших атомов и HMBC — HETeronuclear Multiple Bond Correlation для изучения взаимного влияния на дальних расстояниях. То есть в HMQC мы рассматриваем близкие, или, условно, родственные взаимоотношения атомов, самый близкий их круг общения, а в HMBC — дружеские или приятельские, то есть более дальние связи.
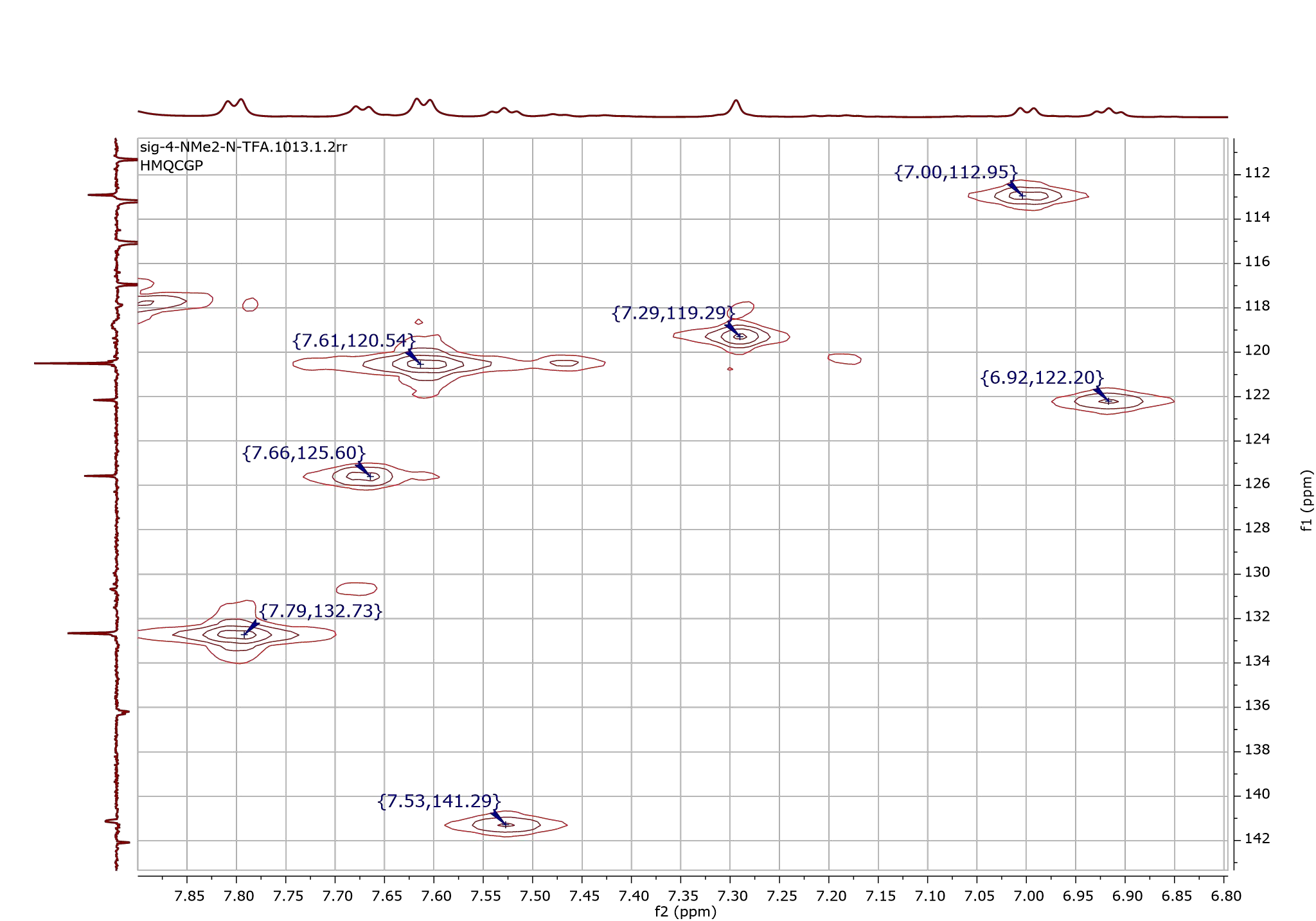
Рисунок 5. Спектр HMQС 1Н—13С, который показывает нам близкие связи между атомами углерода и водорода. Каждый пик дает нам сведение о том, какая пара углерод—водород у нас имеется.
Спектр снят на приборе Bruker.
Расплывчатые «пятнышки» на пересечении одномерных сигналов, т.е. случай наложения двух привычных нам спектров — точка на выше показанном спектре — называются кросс-пиками. Это пики, образованные слиянием двух спектров: если одномерный спектр — это зависимость интенсивности сигнала от химического сдвига, то двумерный спектр показывает зависимость интенсивности от двух частот, каждая из которых является базовой для изначально взятого графика. Как перекрестки на дорогах двух одномерных пиков, они показывают, судьбы каких ядер пересекаются. С их помощью мы можем сопоставить, с каким из атомов углерода связан тот или иной атом водорода — для этого достаточно посмотреть на координаты кросс-пика, т.е. точки пересечения на выше показанном спектре: каждая из них будет являться химическим сдвигом одного из связанных ядер. Но и это не предел — существуют виды спектроскопии, основанные на изучении сочетания химического сдвига с каким-либо другим параметром, характерным для химического соединения. Например, спектр DOSY — Diffusion Ordered SpectroscopY, диффузионно упорядоченная спектроскопия, где по одной из осей откладываются химические сдвиги, а по второй, обычно вертикальной, коэффициент самодиффузии (рис. 6). Он характеризует скорость самодиффузии — частного случая диффузии в чистом веществе или растворе постоянного состава, при котором диффундируют собственные частицы вещества. И если в нашей анализируемой пробе есть смесь двух молекул разной полярности и размера, то мы увидим два спектра, соответствующие коэффициентам самодиффузии разных молекул.
Рисунок 6. DOSY спектр 1Н для одной молекулы, на котором мы видим, что молекула не имеет изомеров и примесей, поскольку видим только один набор пиков. Фон является градиентным, поскольку так нагляднее демонстрируется коэффициент диффузии.
Спектр снят на приборе Bruker.
Таким образом, ЯМР позволяет нам детально изучить тайны химических структур. О коллективе ядер можно узнать очень многое — от численности до взаимоотношений. Не только установить порядок связей в структуре, но и рассмотреть взаимное влияние друг на друга, оценить зарядовую структуру молекулы. Кто слишком «негативен» и положительного заряда ему недостает, а кто настолько позитивен, что явно принял один, а может быть и несколько протонов. Кто общителен и находится в плотном зарядовом окружении, а кто предпочитает быть один и испытывать меньшее влияние зарядов остального общества. В какой точке структуры с большей вероятностью будут происходить изменения при смене pH — и какими эти изменения будут. Например, при протонировании структуры гемииндигоидов (рис. 7) при различных рН протонируется либо кислород, либо азот, либо углерод!
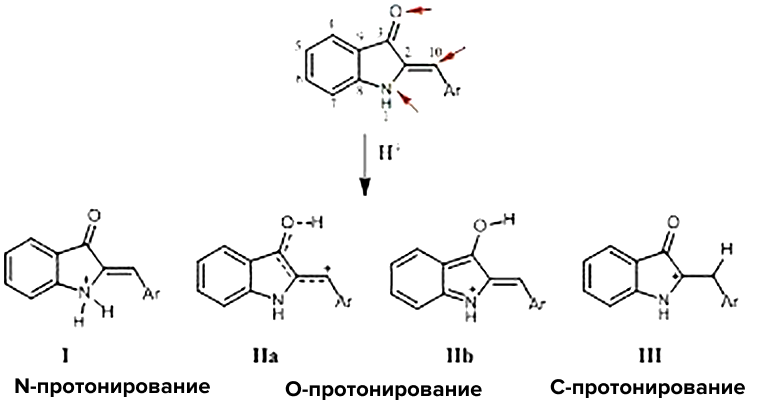
Рисунок 7. Строение типичного гемииндигоида и пути его протонирования.
Дополнительно в начале было упомянуто о том, что ЯМР позволяет обнаружить различные патологии. Осветим и эту тему — исследователь может брать в качестве образца не только вещество, но и какую-либо биологическую жидкость, например, кровь или слезы. Тогда спектр, конечно, будет иметь гораздо больше пиков, но и расшифровка принесет немалое удовольствие. В частности, есть статья, посвященная поиску биомаркеров сердечно-сосудистых заболеваний и абсолютных биомаркеров ишемической болезни сердца [6]. Исследования были проведены на аппарате Bruker AVANCE 600 III; для образцов были использованы не только пробы биологических жидкостей человека, но и пробы, взятые у сусликов и крыс. В результате было получено, что абсолютного маркера для сердечно-сосудистых заболеваний нет, и причина этого заключается в гомеостазе и коммуникационной функции крови. Даже при наличии патологий показатели различных жидкостей всегда будут скорректированы внутренними механизмами организма до нормы, что заставляет предполагать несостоятельность метода ЯМР для подобной диагностики, однако не отрицая возможность использования его в смежных исследованиях.
Не чудо ли это? ЯМР — настоящая волшебная палочка для множества химиков и биологов, с помощью которой можно колдовством науки получить практически любую информацию о веществе.
Литература
- 12 методов в картинках: структурная биология;
- Сверхпроводящие магниты и рецепторы биомембран: Лаборатория биомолекулярной ЯМР-спектроскопии ИБХ РАН;
- Фемтосекундные рентгеновские лазеры — кристаллография будущего;
- Крупные подробности микроскопического мира: Нобелевская премия по химии 2017;
- Гюнтер Х. Введение в курс спектроскопии ЯМР. М. «Мир», 1984. — 465 c.;
- P.M. Beskaravainy, M.V. Molchanov, A.V. Suslikov, S.I. Paskevich, V.P. Kutyshenko, S.I. Vorob’ev. (2015). NMR study of human biological fluids for detection of pathologies. BIOMED KHIM. 61, 141-149.







