
Искусственный интеллект против CUP-синдрома: в поисках невидимого
14 января 2026
Искусственный интеллект против CUP-синдрома: в поисках невидимого
- 132
- 0
- 2
Как цифровая лупа, машинное обучение выявляет скрытые закономерности в опухолевой ткани, анализируя особенности ее структуры с высокой точностью. Благодаря этому искусственный интеллект способен определить вероятный первоисточник в тех случаях, где традиционная диагностика остается без ответа.
Рисунок в полном размере.
сгенерировано нейросетью
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: «Рак без начала» — звучит как название научно-фантастической книги, но на самом деле это суровая реальность для многих пациентов. Когда в организме развиваются метастазы, а традиционные методы диагностики не позволяют определить первоисточник, диагноз звучит как приговор — рак неизвестной первичной локализации, или CUP-синдром. Это состояние представляет собой сложную диагностическую задачу, характеризующуюся метастатическими опухолями неустановленного происхождения и неблагоприятным прогнозом. Тем не менее, последние достижения в области искусственного интеллекта открывают новые возможности для диагностики, вселяя надежду на улучшение результатов терапии.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в спецноминации «Искусственный интеллект в биологии» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания Центральный университет в лице совместной с институтом AIRI Лаборатории ИИ, анализа данных и моделирования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Загадочная сущность CUP-синдрома
На протяжении десятилетий в онкологии доминирует строгая и логически выверенная парадигма, согласно которой злокачественный процесс начинается в виде четко локализованного первичного новообразования. Эта исходная опухоль, будь то в легочной паренхиме или ткани молочной железы, рассматривается как эпицентр всего последующего патогенеза. Именно из этого очага, после накопления определенных молекулярно-генетических изменений (о которых более подробно рассказано в статье «От медицинской онкологии к молекулярной биологии рака» [1]), и происходит распространение раковых клеток с формированием вторичных, метастатических опухолей [2].
Это краеугольная концепция всей современной онкологической практики, определяя и терминологию, и выбор терапевтической стратегии. Международная классификация опирается на локализацию первичного очага, поэтому рак всегда именуется по месту возникновения (например, «рак легкого» или «рак молочной железы»), даже при наличии отдаленных метастазов. Такой принцип предопределяет и диагностический подход, поскольку главная задача заключается в как можно более раннем обнаружении первичной опухоли, до развития метастазов, когда заболевание все еще поддается радикальному хирургическому лечению. Всесторонний обзор традиционных методов, используемых в диагностике новообразований, представлен в статье «Онкодиагностика — вызовы и решения» [3]. Кроме того, вся последующая терапия, будь то химиотерапия или таргетное лечение, подбирается на основе патоморфологического и молекулярного профиля именно первичной опухоли, а не ее метастазов. Эта централизованная система, выстроенная вокруг приоритета первоисточника, продолжает демонстрировать свою эффективность на практике, внося значительный вклад в последовательное снижение онкологической смертности в развитых странах. Таким образом, даже при метастатическом раке биология исходной опухоли остается главным компасом для клинических решений.
Теперь представьте иную реальность: у пациента выявляются множественные метастатические очаги, в то время как исчерпывающий диагностический поиск не позволяет идентифицировать первичную опухоль. Это не что иное, как рак неизвестной первичной локализации, или CUP-синдром (от англ. Cancer of Unknown Primary) — гетерогенная форма рака, при котором опухоль изначально проявляет себя агрессивным метастазированием при скрытом, неустановленном первоисточнике [4]. Процесс метастазирования предполагает, что клетки первичной опухоли проникают в микроокружение и распространяются в отдаленные участки через кровеносную или лимфатическую системы, образуя вторичные пораженные участки — метастазы. Так почему же метастазы обнаруживаются, а сама опухоль — нет? Вероятных причин выдвигают три: (1) первичная опухоль слишком мала, что позволяет ей избегать обнаружения при использовании современных методов визуализации; (2) организм по неизвестной причине самостоятельно уничтожил первичный очаг (это явление называется спонтанной регрессией); (3) раковые клетки при CUP-синдроме мигрируют вскоре после возникновения первичного очага, однако сама первичная опухоль не развивается или вовсе отсутствует (рис. 1) [4].
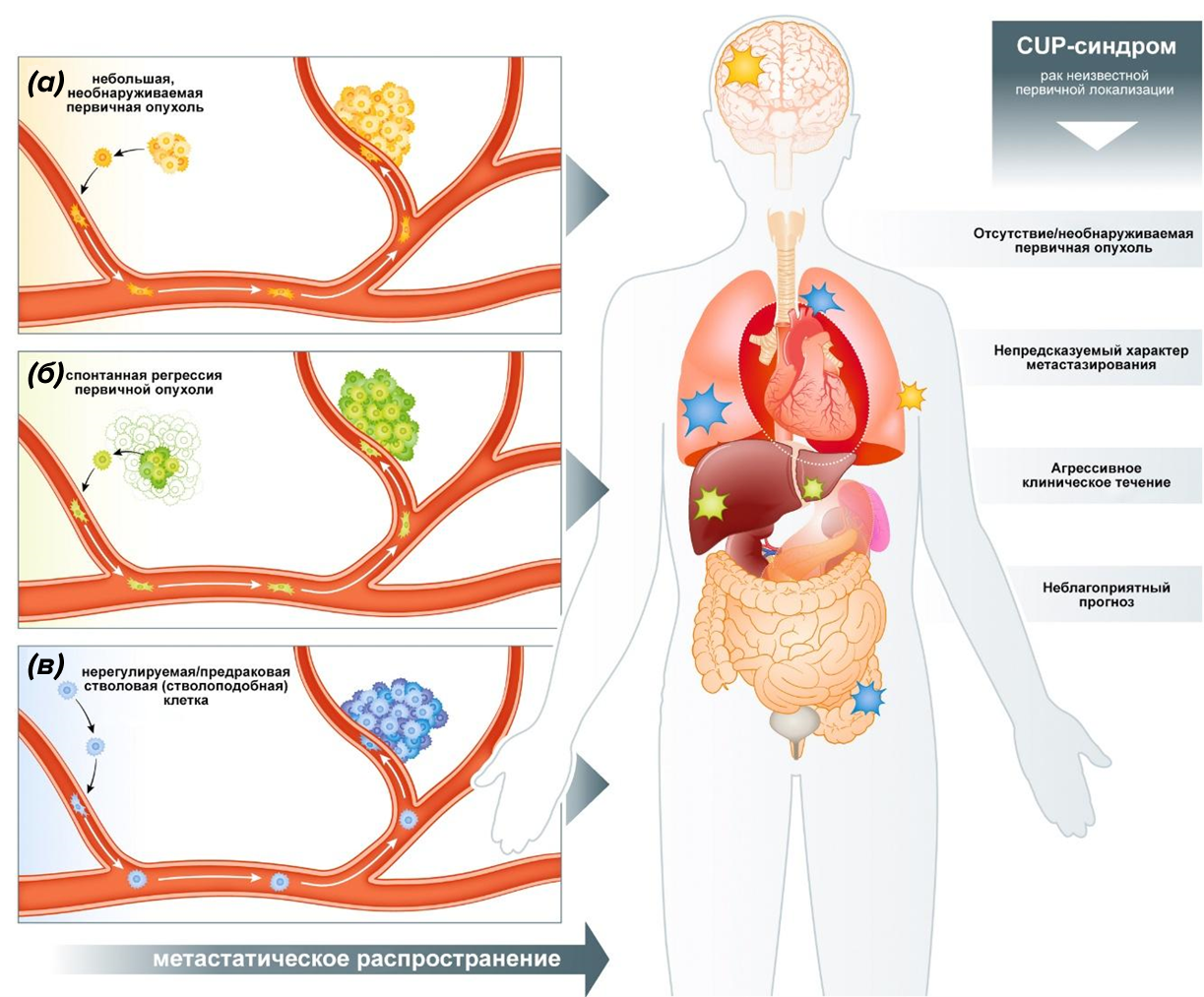
Рисунок 1. Патогенез CUP-синдрома включает несколько гипотетических сценариев развития. (а) — наличие небольшой первичной опухоли, которую технически невозможно обнаружить с помощью современных методов визуализации; (б) — первичная опухоль подверглась спонтанной регрессии; (в) — развитие метастаз по особому биологическому пути, отличному от канонического метастатического каскада; возможно, из клеток со свойствами стволовых.
[4], рисунок адаптирован
Термин «CUP-синдром» был впервые введен в употребление в 1970-х годах [5] и по сей день остается одной из самых сложных диагностических и терапевтических проблем в клинической онкологии. Существование рака неизвестной первичной локализации можно рассматривать как биологическую загадку. Отсутствие клинических проявлений первичной опухоли и развитие ранних, зачастую множественных метастазов характеризуют эту гетерогенную группу новообразований. Метастазы распространяются случайным образом и не следуют привычным маршрутам, характерным для «обычных» опухолей. Такое атипичное поведением метастазов при CUP-синдроме остается необъяснимым и может свидетельствовать о том, что рак неизвестной первичной локализации представляет собой уникальную сущность, действующую иначе, чем предполагаемая первичная опухоль. Современные исследования все чаще указывают на отличительные биологические характеристики CUP-опухолей по сравнению с опухолями известного происхождения [5]. За последние десятилетия было выдвинуто несколько гипотез, объясняющих патологические механизмы, лежащие в основе CUP-синдрома. Одной из наиболее обсуждаемых является гипотеза стволовых клеток (рис. 2).
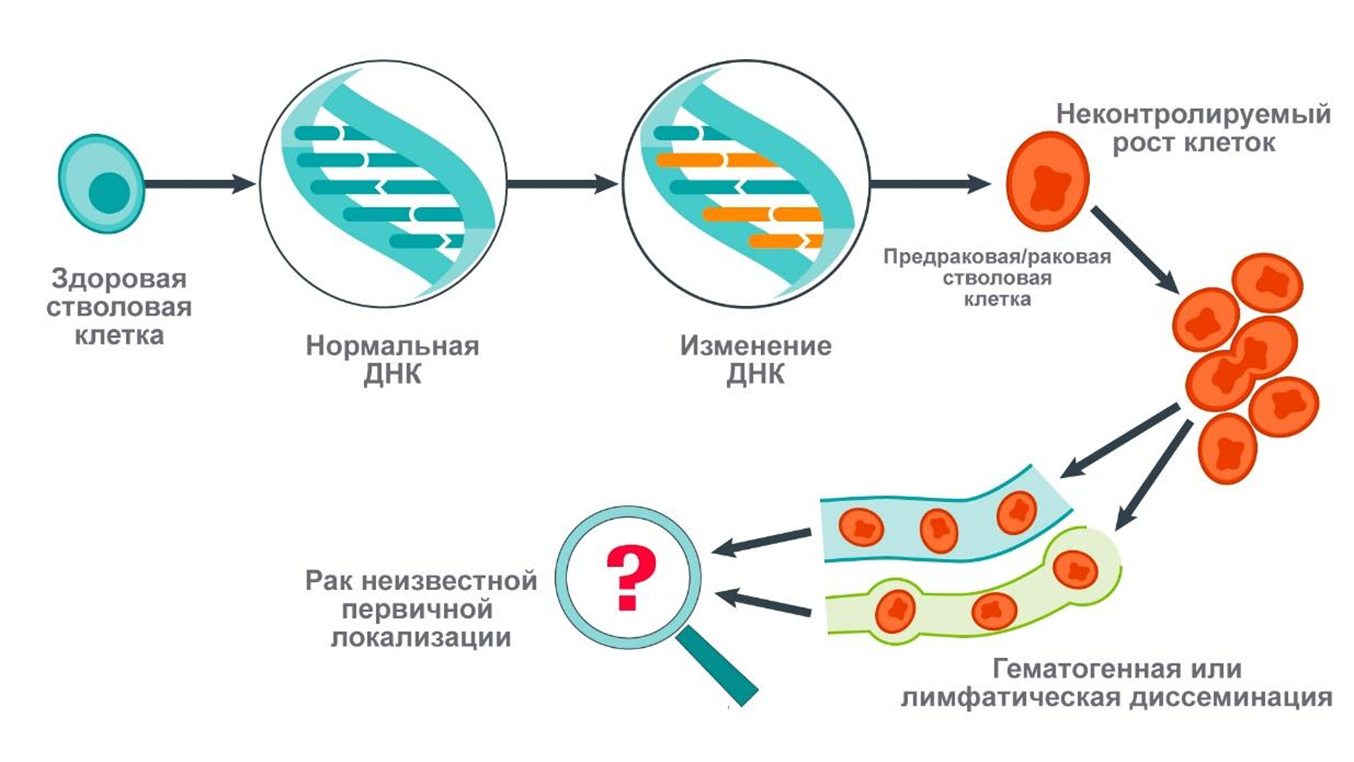
Рисунок 2. Гипотеза стволовых клеток. В 2015 году Лопес-Лазаро в своей статье предложил пересмотреть парадигму метастазирования [6]. Он предположил, что ключ к пониманию CUP-синдрома может заключаться в биологических свойствах стволовых клеток. Во время эмбрионального развития стволовые клетки обладают высокой миграционной способностью, преодолевая большие расстояния для формирования различных тканей и органов. У взрослых эта способность обычно подавлена, но может вновь активироваться при определенных условиях — например, при геномной нестабильности. Лопес-Лазаро выдвинул гипотезу, что CUP-синдром развивается, когда аномальная стволовая клетка мигрирует из исходной ткани и формирует опухоль в новом месте еще до того, как успевает образоваться обнаруживаемая первичная опухоль. При этом наличие первичной опухоли не является обязательным условием для миграции, что объясняет, почему первичный очаг при CUP-синдроме часто не выявляется, а возможно, просто и не формируется. Эта концепция ставит под сомнение традиционный взгляд на метастазирование, обычно рассматриваемое как распространение раковых клеток из уже сформировавшейся первичной опухоли.
Medically, рисунок адаптирован
До сих пор не удалось достичь единого понимания природы рака неизвестной первичной локализации. Научному сообществу все еще предстоит выяснить, представляют ли опухоли при CUP-синдроме классический метастатический рак с невидимым первичным очагом, или же они являются отдельной, ранее не распознанной нозологической формой рака с уникальным молекулярно-генетическим профилем.
В поисках невидимого
Самое важное в лечении рака — это знать, с каким типом опухоли мы имеем дело. Как только мы это узнаем, дополнительные исследования, такие как секвенирование нового поколения, могут помочь в дальнейшей стратификации подходов к лечению, но основная информация, с которой нам нужно начать, — это откуда берется опухоль.
Как вы уже наверняка смогли заметить, отсутствие точной идентификации первичного очага делает невозможным подбор оптимальных протоколов таргетной терапии. В итоге пациентам нередко назначают более общие схемы терапии, не адаптированные к биологии конкретного типа рака, что дополнительно снижает шансы на благоприятный исход. В настоящее время на долю CUP-синдрома приходится до 5% всех злокачественных новообразований во всем мире, и он остается четвертой по значимости причиной смертности от рака [7. Стандартный подход к ведению пациентов с раком неизвестной первичной локализации основан на разделении их на две прогностические группы. Около 20% пациентов относятся к категории с благоприятным прогнозом, тогда как для большинства прогноз остается неутешительным [8].
Первичную локализацию раковой опухоли обычно определяют с помощью радиологических и гистологических исследований. На сегодняшний день ключевым инструментом диагностики CUP-опухолей является иммуногистохимическое (ИГХ) исследование [9], которое позволяет выявлять специфические белки-маркеры в биопсийном материале [10]. Определяемый с помощью ИГХ иммунофенотип помогает уточнить тип опухоли, что играет важную роль при выборе оптимальной тактики лечения. В случаях рака неизвестной первичной локализации терапевтические решения нередко принимают, исходя из наиболее вероятного происхождения опухоли. Например, при выявлении колоректального иммунофенотипа предпочтение отдают схемам, применяемым при колоректальном раке. Однако такой подход может приводить к диагностическим ошибкам, если предположенная первичная локализация оказывается неверной.
В эпоху «геномной революции» появились новые способы диагностического поиска, которые помогают уточнить происхождение опухоли. Молекулярных исследований CUP-синдрома пока немного, и большинство основано на небольших сериях наблюдений. Несмотря на это, накопленные данные позволили создать коммерческие тесты, которые помогают определить вероятный первоисточник опухоли. Среди них особенно важны микрочипы для анализа экспрессии генов, дающие возможность одновременно сравнивать экспрессию тысячи генов, что помогает судить о наиболее вероятном первичном очаге.
Первым клинически доступны тестом на основе экспрессии генов стал CancerTYPE ID, разработанный компанией Biotheranostics. Как отмечает производитель, этот тест помогает установить диагноз при метастатическом раке неизвестного происхождения. CancerTYPE ID измеряет экспрессию 92 генов и сравнивает профиль образца с обширной базой данных, что позволяет различать около 50 типов опухолей. Вторым клиническим тестом, предложенным в США, стал Pathwork Tissue of Origin, который оценивает экспрессию 1550 генов и классифицирует образцы по 15 типам тканей, охватывая широкий спектр морфологических признаков. В Соединенных Штатах также применяется тест второго поколения miRview mets(2) от компании Rosetta Genomics, основанный на анализе микроРНК, что позволяет различать 42 варианта опухолей. В Европе получил распространение тест CupPrint, разработанный Agendia BV. Он основан на анализе экспрессии 1900 генов и использует базу данных, примененную ранее при разработке CancerTYPE ID. При этом вместо 92 генов CupPrint оценивает экспрессию 495 транскриптов мРНК и сопоставляет образец с наиболее похожими опухолевыми профилями из базы данных. Алгоритм формирует предположение о вероятном первоисточнике, учитывая биопсийный материал, пол пациента и степень молекулярного сходства с эталонными образцами [11]. Таким образом, существует множество коммерческих тестов, однако основными вопросами остаются их надежная клиническая валидация и высокая стоимость.
В настоящее время молекулярные методы диагностики остаются ограниченно доступными из-за сложности их применения в широкой клинической практике, однако их возможности, несомненно, выходят за рамки традиционных ИГХ-исследований. На протяжении многих десятилетий исследования CUP-синдрома продвигались медленно, и значительного прогресса в понимании биологии заболевания и улучшении результатов лечения почти не достигалось. Казалось, что любые попытки заходят в тупик, но ситуация начала меняться с ростом интереса к искусственному интеллекту . В 2023 году в СМИ появились заголовки: «Машинное обучение вскоре сможет помочь врачам определить источник рака неизвестного происхождения».
Машинное обучение — подраздел искусственного интеллекта, посвященный разработке математических моделей и алгоритмов, которые помогают эффективно выявлять закономерности в данных. К настоящему времени значительные усилия были направлены на совершенствование алгоритмов машинного обучения для диагностики, прогнозирования и лечения рака. «Биомолекула» предлагает подробно ознакомиться с этими концепциями в статье «История развития искусственного интеллекта и его пришествия в биологию» [12].
Как искусственный интеллект помогает раскрывать загадку CUP-синдрома
Каждый тип рака имеет уникальную молекулярную сигнатуру, определяемую специфическими генетическими нарушениями, включая хромосомные аберрации и мутации в онкогенах или генах-супрессорах. Кроме того, каждая опухоль демонстрирует преимущественное повреждение определенных генов. Следовательно, происхождение и природу опухоли можно определить по наличию этих характерных повреждений.
Появление секвенирования нового поколения (Next-generation sequencing, NGS; читайте: «12 методов в картинках: секвенирование нуклеиновых кислот» [13]), которое позволяет обнаруживать эти специфические для опухоли изменения, революционизировало подход к исследованию и лечению рака. Простыми словами, секвенирование позволяет «прочитать» молекулярную сигнатуру опухоли, тем самым облегчая классификацию рака. Однако объем данных, генерируемых NGS, может быть настолько огромным, что врачу трудно быстро ориентироваться в них во время первоначальной диагностики. Поэтому сегодня клиницисты часто используют NGS после определения предполагаемого типа рака, чтобы уточнить мутационный профиль и подобрать таргетную терапию. Ситуация с CUP-синдромом еще более сложна. Несмотря на свой потенциал, NGS остается трудоемким методом диагностики рака неизвестной первичной локализации из-за огромного количества данных, необходимых для анализа с целью прогнозирования первичного очага. Здесь могут быть полезны модели машинного обучения, способные обрабатывать большие объемы генетических данных.
OncoNPC
Особенность этой работы заключается в использовании данных, полученных в ходе рутинных тестов, которые применяются в клинической практике. Мы не понимаем, что делает эти опухоли атипичными, но мы знаем, что прогноз для этих пациентов, как правило, гораздо хуже. Таким образом, улучшение прогноза для значительной части пациентов является важным шагом вперед.
В 2023 году команда ученых из Института рака Даны-Фарбер и Массачусетского технологического института представила в журнале Nature Medicine молекулярный классификатор на основе машинного обучения под названием OncoNPC (Oncology NGS-based Primary cancer type Classifier) [14]. Для обучения модели искусственного интеллекта авторы использовали обширный массив генетических данных, полученных с помощью NGS, состоящий из более 36 000 образцов опухолей с известной первичной локализацией. По каждому пациенту был получен и загружен полный клинический профиль, а также данные генетического секвенирования 400 генов, которые, как известно, часто мутируют при раке. Фактически, OncoNPC был обучен связывать определенные соматические изменения (такие как изменение числа копий и мутационные сигнатуры), а также возраст и пол пациента с одним из 22 различных типов рака.
Чтобы оценить работу OncoNPC, исследователи сначала протестировали ее на большой выборке из 7289 опухолей с известным происхождением. Модель правильно определила первичную локализацию в 80% случаев, выдавая высокий уровень уверенности, то есть показывая, что выбранный вариант наиболее вероятен. После успешной проверки ученые перешли к более сложной задаче — анализу данных 962 пациентов с CUP-синдромом, что соответствовало 971 образцам опухолевой ткани. В этой выборке модель также показала высокий уровень уверенности в 41,2% случаев. Поскольку истинный первичный очаг у таких пациентов неизвестен, точность прогноза оценивали косвенно, сравнивая предсказания модели с генетическим профилем каждого пациента. Представьте, что у каждого человека есть своя унаследованная вероятность развития тех или иных заболеваний, включая разные типы рака. Эту вероятность называют полигенным индексом риска (PRS, от англ. Polygenic Risk Score). Это числовой показатель, который объединяет влияние сотен генетических вариаций и отражает степень наследственной предрасположенности к различным заболеваниям. При анализе данных ученые заметили важную закономерность. Тип рака, который OncoNPC считал наиболее вероятным, действительно совпадал с тем видом рака, к которому у пациента был повышенный генетический риск. Например, у пациентов с CUP-синдромом, для которых модель указывала на скрытый рак легких, PRS этого типа рака был выше, чем PRS других возможных вариантов.
Чтобы понять, может ли лечение, назначенное с учетом прогнозов OncoNPC, улучшить выживаемость пациентов, исследователи применили к исходной когорте из 962 человек серию критериев исключения. В результате была сформирована окончательная группа из 158 пациентов с CUP-синдромом, проходивших лечение в клинике Даны-Фарбер. Онколог вручную изучал их медицинские карты, чтобы определить, совпадали ли назначенные схемы лечения с типом рака, который предсказывала модель. Оказалось, что пациенты, чья терапия совпадала с прогнозами OncoNPC, жили значительно дольше, чем те, чье лечение не соответствовало предсказанию модели.
Тем не менее, полностью подтвердить эффективность OncoNPC в прогнозировании происхождения CUP-синдрома сложно, так как нет надежного способа определить первичную опухоль с помощью традиционных методов. Как отметил один из авторов статьи, Александр Гусев из Института рака Дана-Фарбер, валидация модели — это непростая задача, поскольку отсутствуют достоверные данные. Он подчеркнул, что прогноз OncoNPC следует рассматривать как подсказку, помогающую предложить возможное происхождения рака неизвестной первичной локализации и указать на соответствующее лечение, включая таргетную терапию.
Ученые отметили, что пока что проверяли инструмент только на ретроспективных данных. В дальнейшем модель необходимо протестировать в настоящих клинических испытаниях, чтобы убедиться, что она действительно может помогать врачам в постановке диагноза. Исследователи также планируют расширить модель и научить ее определять первичный очаг по более широкому спектру данных, включая не только NGS, но и гистологические или радиологические изображения. В будущем такая модель могла бы предсказывать не только тип опухоли, но и исход пациента, а также помогать подбирать оптимальные схемы лечения.
Важно учитывать ограничения модели. В классификацию включили только 22 наиболее распространенных типа рака, поэтому прогнозы для редких опухолей могут быть менее точными. Исследователи подчеркивают, что OncoNPC задуман как инструмент, который работает в тандеме с существующими методами диагностики, а не заменяет их. Он является дополнительным ресурсом, позволяющим врачам принимать более обоснованные решения и подбирать подходящую терапию для пациентов с CUP-синдромом (рис. 3). Тем не менее, OncoNPC представляет собой важный шаг вперед в борьбе с раком неизвестной первичной локализации и открывает перспективы для улучшения онкологической помощи, несмотря на необходимость дальнейших исследований.
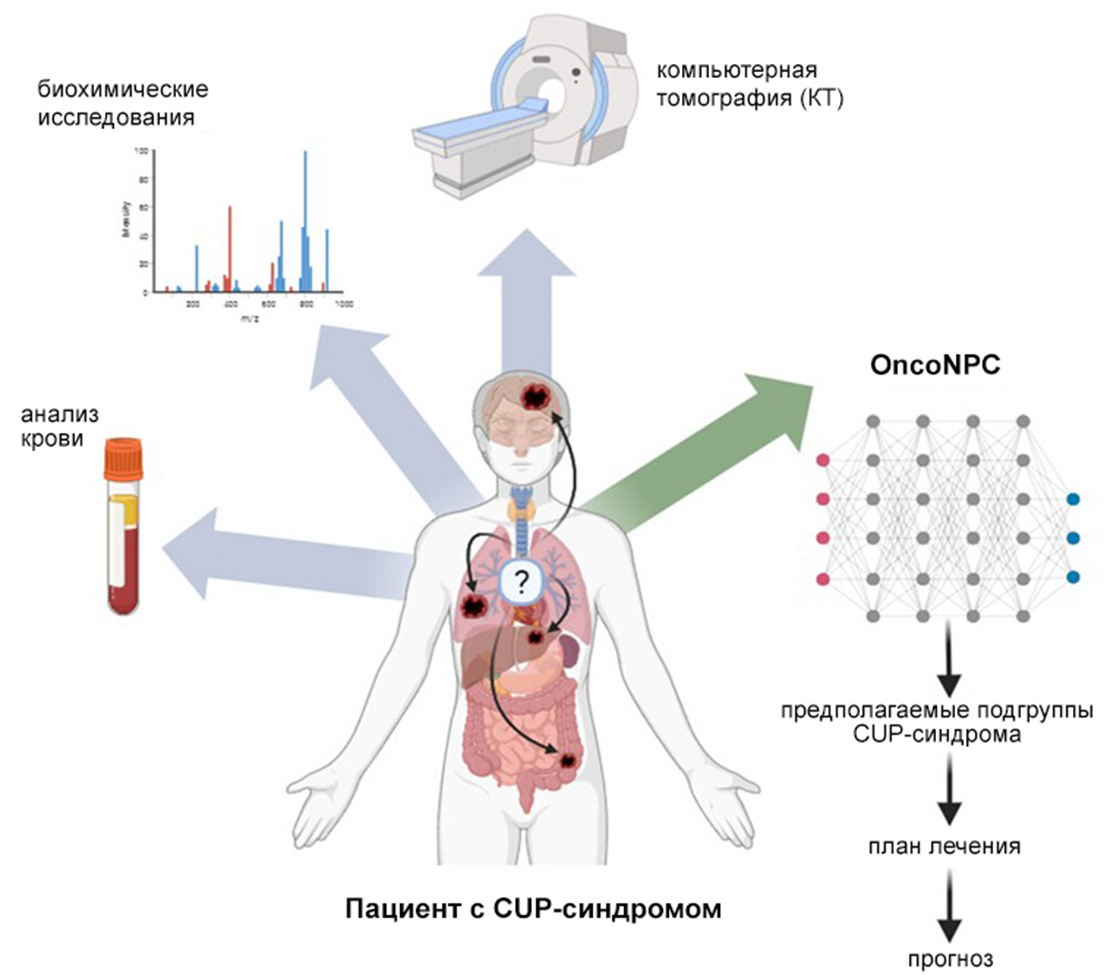
Рисунок 3. Диагностический алгоритм при CUP-синдроме. Стандартная диагностика пациентов с CUP-синдромом включает тщательный сбор анамнеза и осмотр, основные анализы крови и биохимические исследования, а также компьютерную томографию грудной клетки, брюшной полости и таза, чтобы попытаться определить источник первичной опухоли. Эти исследования составляют базовый набор рекомендуемых тестов, а дополнительные анализы назначаются в зависимости от клинической картины. Методы глубокого обучения, такие как OncoNPC, могут сократить необходимость в инвазивных процедурах и стать частью стандартного подхода к диагностике пациентов с CUP-синдромом.
[15], рисунок адаптирован
OncoOrigin
Нет сомнений, что новые знания, которые мы получаем благодаря генетическому анализу с использованием искусственного интеллекта, окажут значительное влияние на развитие диагностических и терапевтических подходов в онкологии.
В начале 2025 года в журнале International Journal of Molecular Sciences была опубликована статья хорватских исследователей, представивших новую модель — OncoOrigin [16]. Цель работы во многом совпадала с задачами проекта OncoNPC, а именно — создание алгоритма машинного обучения, способного предсказывать первичную локализацию рака по генетическим данным, полученным при секвенировании опухолевой ткани, но в более удобном формате благодаря понятному интерфейсу. На данный момент сведений о модели немного, однако сама концепция визуальной простоты уже привлекла внимания научного сообщества.
Модель OncoOrigin обучили на более чем 20 000 образцах метастатических опухолей с учетом клинических характеристик пациентов, включая пол и возраст, а также генетических вариантов в более чем 600 генах. Как отмечают сами авторы, главное отличие и ключевое преимущество OncoOrigin от аналогичных моделей заключается в ее простом и интуитивном интерфейсе (рис. 4). Благодаря этому модель функционирует как обычная программа, что делает ее гораздо ближе к реальной клинической практике, где большинство врачей не владеют навыками программирования.
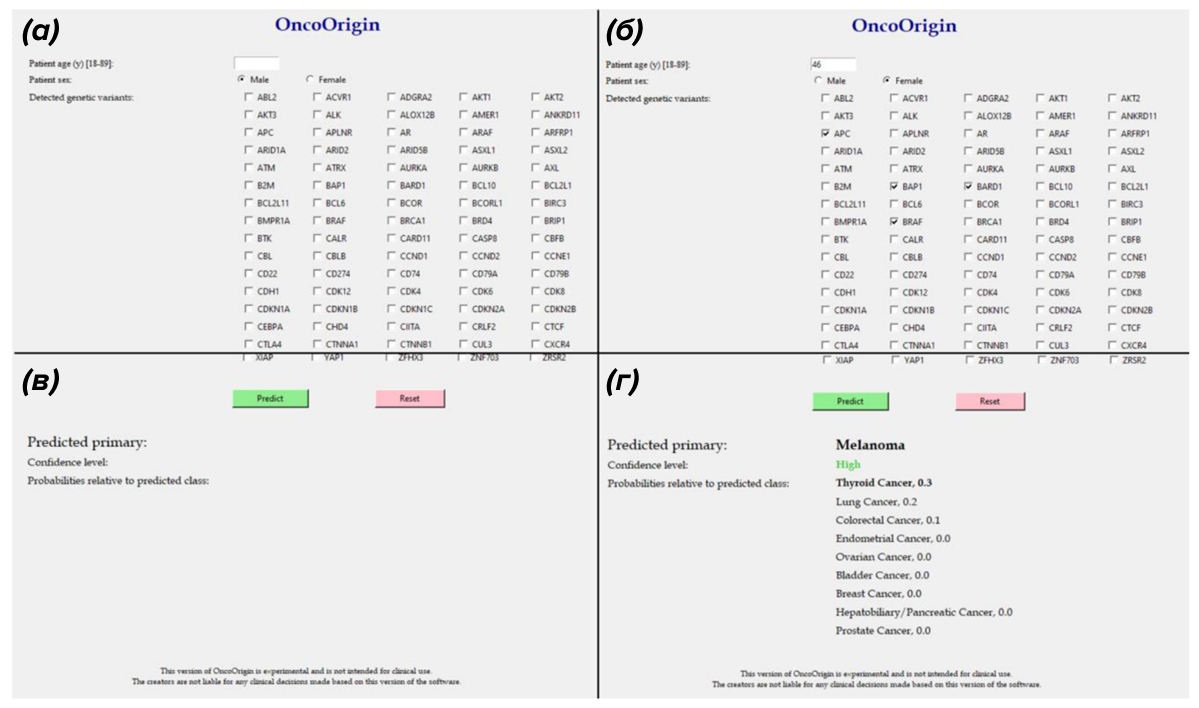
Рисунок 4. Графический интерфейс пользователя OncoOrigin представлен (а) начальным окном, (б) — полями для ввода возраста пациента, пола и генов с выявленными вариантами, (в) — нижней панелью с функцией прогнозирования и (г) отчетом о прогнозе, который отображает прогнозируемое место опухоли, достоверность предсказания и относительные вероятности для других возможных локализаций.
Стоит отметить, что OncoOrigin имеет несколько важных ограничений. Во-первых, для грамотной работы модели требуется секвенирование большого набора генов, что может быть технически непросто. Во-вторых, возраст пациентов, участвовавших в обучении OncoOrigin, ограничен 18 годами и старше, поэтому алгоритм корректно работает исключительно для взрослых пациентов и неприменим к детским ракам. Кроме того, модель способна прогнозировать первичный очаг только среди десяти наиболее распространенных типов рака, а ряд биологически отличающихся вариантов сведен в одну категорию, что также создает ограничения. Например, мелкоклеточный и немелкоклеточный рак легких объединены в один класс «Рак легкого», хотя биологически это два разных заболевания.
Тем не менее, авторы ставят перед собой амбициозные цели. Как отметил руководитель исследования, профессор Драган Приморац, команда продолжает совершенствовать модель, увеличивая число образцов метастатических опухолевых тканей и расширяя набор анализируемых генов. При положительном результате следующий этап будет сосредоточен на случаях CUP-синдрома, что позволит оценить клиническое влияние OncoOrigin на разработку стратегий персонализированной терапии.
Tumor Origin Assessment via Deep-learning (TOAD)
Наша работа позволяет использовать повсеместно полученные данные и возможности искусственного интеллекта для улучшения диагностики сложных случаев, которые обычно требуют обширных диагностических исследований. Это только первый шаг в использовании гистологических изображений для прогнозирования происхождения рака с помощью искусственного интеллекта, и это очень перспективная область с потенциалом для стандартизации и улучшения процесса диагностики.
Модель TOAD была представлена в 2021 году в журнале Nature, незадолго до появления алгоритмов OncoNPC и OncoOrigin. В отличие от более поздних моделей, которые обучались на данных NGS, TOAD училась распознавать происхождение первичной опухоли по гистологическим изображениям [17]. Практически у каждого пациента с диагнозом «рак» имеется гистологический препарат, окрашенный гематоксилином и эозином (H&E), который уже более ста лет остается стандартом диагностики. Его цифровое изображение позволяет алгоритмам определять вероятное расположение первичного очага, не прибегая к ИГХ-анализу, геномному профилированию или обширному клиническому скринингу.
В обучении TOAD использовали более 24 000 оцифрованных гистологических слайдов, каждый из которых рассматривался как отдельный клинический случай. Модель училась определять значимость отдельных участков ткани и объединять информацию по всему препарату, придавая больший вес тем зонам, которые несут наибольшую диагностическую ценность. Далее TOAD протестировали примерно на 6500 случаях с известным первичным очагом. Для таких опухолей модель правильно идентифицировала локализацию в 83% случаев, а в 96% случаев правильный диагноз попадал в тройку наиболее вероятных вариантов. Затем исследователи проверили модель на 317 случаях CUP-синдрома, для которых был установлен дифференциальный диагноз. Прогноз TOAD совпадал с заключениями патологоанатомов в 61% случаев. По словам Фейсала Махмуда, руководителя исследования, «три наиболее вероятных прогноза, полученные с помощью модели, могут ускорить диагностику и последующее лечение, сокращая количество дополнительных исследований и уменьшая общее время постановки диагноза, которое обычно бывает длительным и напряженным».
Таким образом, модель TOAD использует оцифрованные гистологические слайды, окрашенные H&E. Получаемое изображение имеет высокое разрешение, что позволяет модели сегментировать его на тысячи маленьких фрагментов и проанализировать каждый с помощью специальной нейросети для выявления ключевых патоморфологических признаков. Далее алгоритм взвешивает значимость каждого фрагмента, придавая большее значение тем областям, которые, по мнению модели, наиболее информативны для диагностики. Благодаря такому подходу TOAD одновременно определяет, откуда могла возникнуть опухоль, и является ли она первичной или метастатической. Алгоритм строит тепловые «карты внимания», которые демонстрируют, на какие области ткани модель обратила больше всего внимания, что делает прогноз более прозрачным и наглядным для врача (рис. 5).
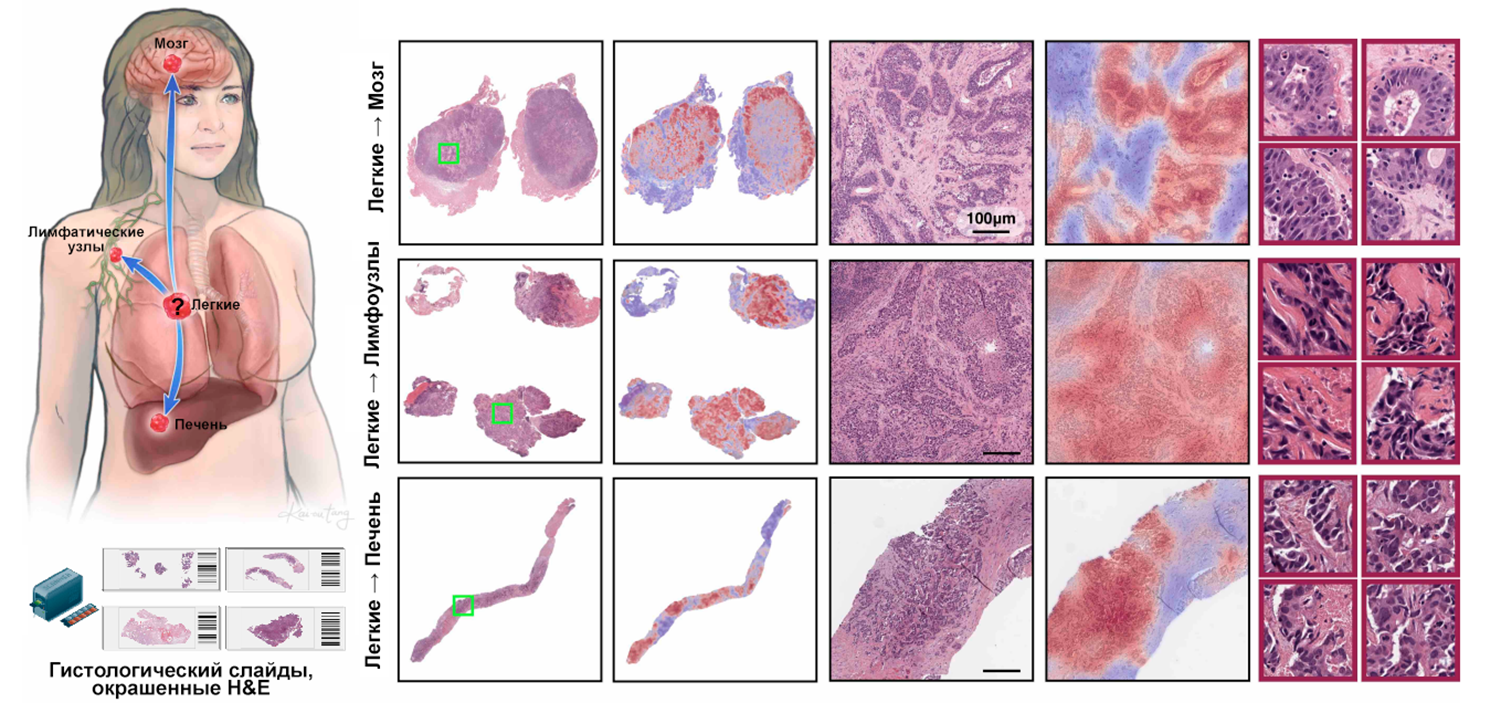
Рисунок 5. TOAD выделяет наиболее важные участки метастазов и определяет первичный очаг. На изображениях представлены гистологические препараты метастазов (из печени, лимфатических узлов и мозга), происхождение которых изначально неизвестно. Слева — ткани при малом увеличении с соответствующей тепловой картой внимания; посередине — более детальный взгляд на области внимания, отмеченные алгоритмом и также соответствующие им тепловые карты; а справа — фрагменты, которые модель сочла наиболее значимыми. На них можно разглядеть морфологические изменения, в частности, плотные пласты клеток, железистые структуры разного размера, низкое соотношение ядро-цитоплазма и ярко окрашенные крупные ядра. Все эти признаки типичны для метастатических карцином легких, тем самым TOAD отмечает, что на снимках представлены характерные черты карциномы легких. Эти зоны подсвечены на тепловых картах, что показывает, куда именно «смотрит» модель, когда делает прогноз. Такой подход помогает понять, какие морфологические признаки TOAD использовала для определения вероятного первоисточника. Тепловые карты высокого разрешения для всех первичных очагов доступны в интерактивной демоверсии.
[17], рисунок адаптирован
В отличие от ранее обсуждаемых подходов, где тип рака при CUP-синдроме определяли по геномным изменениям в опухоли, TOAD представляет собой первый алгоритм глубокого обучения на основе гистологических изображений. Такой подход потенциально имеет более широкое применение, особенно в условиях ограниченных ресурсов. Исследователи планируют продолжить расширение обучающей выборки и провести клинические испытания, чтобы определить, действительно ли использование гистологии в сочетании с алгоритмами машинного обучения улучшает точность диагностики и прогноз для пациентов с CUP-синдромом.
Заключение
В последние годы машинное обучение стало надежным инструментом в биомедицинских исследованиях благодаря своей способности эффективно обрабатывать большие объемы данных. Потенциал искусственного интеллекта распознавать то, что может ускользать от человеческого восприятия, открывает путь к развитию персонализированной таргетной терапии, повышая эффективность лечения и улучшая прогноз для пациентов с CUP-синдромом. Развитие искусственного интеллекта, в конечном итоге, приводит к изменению подхода к диагностике и лечению рака неизвестного первичного происхождения, тем самым превращая медицинскую загадку в управляемую клиническую задачу.
Литература
- От медицинской онкологии к молекулярной биологии рака;
- Jawad Fares, Mohamad Y. Fares, Hussein H. Khachfe, Hamza A. Salhab, Youssef Fares. (2020). Molecular principles of metastasis: a hallmark of cancer revisited. Sig Transduct Target Ther. 5;
- Онкодиагностика — вызовы и решения;
- Veronica Davalos, Manel Esteller. (2020). Insights from the genetic and transcriptional characterization of a cancer of unknown primary (
CUP ). EMBO Mol Med. 12; - Silvia Benvenuti, Melissa Milan, Elena Geuna, Alberto Pisacane, Rebecca Senetta, et. al.. (2020). Cancer of Unknown Primary (
CUP ): genetic evidence for a novel nosological entity? A case report. EMBO Mol Med. 12; - Miguel López-Lázaro. (2015). The migration ability of stem cells can explain the existence of cancer of unknown primary site. Rethinking metastasis.. Oncoscience. 2, 467-475;
- Laura Spurgeon, Claire Mitchell, Natalie Cook, Alicia-Marie Conway. (2025). Cancer of unknown primary: the hunt for its elusive tissue-of-origin – is it time to call off the search?. Br J Cancer. 133, 733-742;
- Richard J. Rebello, Atara Posner, Ruining Dong, Owen W. J. Prall, Tharani Sivakumaran, et. al.. (2025). Whole genome sequencing improves tissue-of-origin diagnosis and treatment options for cancer of unknown primary. Nat Commun. 16;
- 12 методов в картинках: иммунологические технологии;
- A. Krämer, T. Bochtler, C. Pauli, G. Baciarello, S. Delorme, et. al.. (2023). Cancer of unknown primary: ESMO Clinical Practice Guideline for diagnosis, treatment and follow-up. Annals of Oncology. 34, 228-246;
- Federico A. Monzon, Tracie J. Koen. (2010). Diagnosis of Metastatic Neoplasms: Molecular Approaches for Identification of Tissue of Origin. Archives of Pathology & Laboratory Medicine. 134, 216-224;
- История развития искусственного интеллекта и его пришествия в биологию;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Intae Moon, Jaclyn LoPiccolo, Sylvan C. Baca, Lynette M. Sholl, Kenneth L. Kehl, et. al.. (2023). Machine learning for genetics-based classification and treatment response prediction in cancer of unknown primary. Nat Med. 29, 2057-2067;
- Shuvam Sarkar, Daniel T. Baptista‐Hon. (2023). Application of machine learning to classify cancers of unknown primary. MedComm – Oncology. 2;
- Petar Brlek, Luka Bulić, Nidhi Shah, Parth Shah, Dragan Primorac. (2025). In Silico Validation of OncoOrigin: An Integrative AI Tool for Primary Cancer Site Prediction with Graphical User Interface to Facilitate Clinical Application. IJMS. 26, 2568;
- Ming Y. Lu, Tiffany Y. Chen, Drew F. K. Williamson, Melissa Zhao, Maha Shady, et. al.. (2021). AI-based pathology predicts origins for cancers of unknown primary. Nature. 594, 106-110.






