
История о том, как вирусы помогли разработать таргетную систему доставки лекарств
22 марта 2022
История о том, как вирусы помогли разработать таргетную систему доставки лекарств
- 1050
- 0
- 4
Внеклеточные везикулы спешат доставить свое содержимое к целевым клеткам.
На основе везикул командой MIPT_MSU была разработана система таргетной доставки веществ. Этот проект принес команде золотую медаль на международном конкурсе по синтетической биологии iGEM-2021.
иллюстрация Асташковой Ольги, специально для MIPT_MSU
-
Авторы
-
Редакторы
Темы
Статья на конкурс «Био/Мол/Текст»: Как бы это странно ни звучало, но XXI век стал веком доставки во всех смыслах этого слова. В том числе биологическом. Таргетная или адресная система доставки — это принципиально важный способ терапии, позволяющий прицельно воздействовать на конкретные клетки [1].
В чем же плюс такого воздействия? Давайте для примера рассмотрим классические варианты терапии при онкологических заболеваниях: химиотерапия, радиотерапия, гормональная терапия. Их можно объединить одной грубой, но вполне описывающей ситуацию поговоркой: одно лечит, другое калечит. В случае же использования системы таргетной доставки лекарств воздействие происходит точечно на пораженные клетки, а остальная часть организма не страдает.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Своя работа» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания Cytiva.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Перспективная система доставки без помощи популярных сервисов (привет, самоизоляция!)
Способов таргетной доставки существует несколько. Одними из них являются, например, наночастицы, липосомы [2] и прочие наноносители. Такие частицы накапливаются во многих органах [3] и с трудом выводятся из них. Кроме того, они не способны обходить эндосомальный путь при попадании в клетку: частицы после контакта с клеткой оказываются в лизосомах, внутри которых присутствуют различные ферменты, разрушающие доставляемые молекулы.
Стоит отметить, что существуют способы повышения специфичности и эффективности доставки для липосом. Для увеличения эффективности доставки могут быть использованы поверхностно-активные вещества. Но такой способ имеет существенный недостаток: вместе с увеличением способности к слиянию липосом, уменьшается их стабильность и возрастает вероятность их слияния с нецелевыми клетками, что может вызвать побочные реакции [4]. Так мы получаем увеличение эффективности доставки, но отсутствие специфичности.
Можно подойти к этому вопросу с другой стороны — попробовать повысить специфичность липосомной доставки молекул с помощью добавления антител. Но и здесь не все так гладко: липосомы прикрепляются к клеткам, на которые были нацелены антитела, и некоторое время остаются прикрепленными, но потом большинство из них отрываются от поверхности клеток током жидкости [5]. Хотя часть липосом действительно попадает в клетки, антитела не дают возможности обойти эндоцитоз (и, как говорилось выше, доставляемые молекулы могут разрушиться в лизосомах). В итоге, добавление антител к липосомам приведет к тому, что те смогут специфично прикрепляться к целевым клеткам, но это не повысит эффективности доставки.
Существует и другой способ решения задачи о таргетной доставке — использование внеклеточных везикул (мембранных пузырьков, продуцируемых клетками во внешнюю среду). Состав содержимого везикул весьма разнообразен: белки, липиды, кодирующие последовательности нуклеиновых кислот и различные малые некодирующие РНК. Зависит он от множества факторов, таких как тип клеток, производящих их, соотношение молекул в цитоплазме и, конечно, физиологическое состояние клетки, производящей везикулы [6]. Кстати говоря, везикулы уже используются нашим организмом для транспорта различных молекул как внутри клетки, так и между ними. Транспорт с помощью везикул, как нетрудно догадаться, называется везикулярным. Этот вид транспорта является основным в наших клетках. И за его открытие трем исследователям: Джеймсу Ротману, Рэнди Шекману и Томасу Зюдофу — в 2013 году вручили Нобелевскую премию. Подробнее об этом можете прочитать в статье, написанной для «Биомолекулы» в том же году [7].
Внеклеточные везикулы имеют ряд преимуществ: их малый размер позволяет достигать нужных органов и при этом они биологически безопасны [8]. Эти черты делают везикулы привлекательным объектом для исследований [9].
Мир не идеален и везикула тоже: проблемы таргетной доставки
Даже самые привлекательные для исследователей объекты могут иметь подводные камни. В гордом одиночестве, без каких-либо вспомогательных конструкций, везикула НЕ обладает всеми необходимыми свойствами потенциальной системы доставки молекул, среди которых:
- Селективность сортировки содержимого внутрь везикулы;
- Возможность обхода эндосомального пути попадания в клетку;
- Таргетность.
Чтобы сделать перспективную систему доставки, необходимо выполнить, как минимум, эти условия. Но обо всем по порядку.
Начнем решать проблемы с первого свойства. Естественно, сама клетка умеет упаковывать в везикулу необходимые молекулы. Вот только человек пока что не научился в совершенстве контролировать этот процесс. Контроль внутреннего содержимого внеклеточных везикул открыл бы огромные возможности в биоинженерии.
На данный момент нет единого мнения о том, каким образом формируется содержимое везикул: активно или пассивно, то есть существует ли алгоритм отбора. Стоит отметить, что разнообразие состава везикул делает их перспективным объектом изучения при диагностике различных заболеваний, но в случае системы доставки является скорее недостатком, чем достоинством. Для решения проблемы селективности упаковки можно обратиться к уже существующим в природе механизмам.
Как замаскироваться так, чтобы попасть в везикулы
Исследования показывают, что для ряда молекул теория активной сортировки в везикулы является приоритетной, так как содержание этих молекул внутри мембранных пузырьков оказывается непропорциональным содержанию в цитоплазме клетки, их производящей. Это приводит к тому, что молекулы, несмотря на отличающийся уровень экспрессии в клетках разных типов, могут быть в одинаковой концентрации в везикулах, продуцируемых этими клетками, или наоборот, в разной концентрации при одинаковой базовой экспрессии. В частности, при изучении микроРНК было показано, что ряд из них присутствует в везикулах в количествах бо́льших по отношению к другим микроРНК, чем можно было бы ожидать из пропорции их содержания внутри клеток. МикроРНК являются основными участниками РНК-интерференции, при этом молекулы закодированы в геноме в своей неактивной форме, при-микроРНК. Этот транскрипт в своем составе содержит структуру, по форме напоминающую стержень («остов») с петлей на конце. Далее, в ходе процессинга (последовательности преобразований молекулы), который схематично изображен на рисунке 1, при-микроРНК обрезается до пре-микроРНК, из которой уже получается функциональная молекула (голубая последовательность на рисунке 1). Но что если этот самый функциональный участок в тех пре-микроРНК, что охотнее остальных оказываются внутри везикул, заменить на интересующую ученых последовательность, чтобы процессинг у них происходил аналогично (см. рисунок 2а)? И пока мы не зашли слишком далеко, заметим, что на основе различных микроРНК уже зарегистрировано несколько препаратов, принцип работы которых освещался на «Биомолекуле» («Первый препарат на основе РНК-интерференции: смерть мРНК — жизнь пациенту!», «РНК-интерференция: повторный успех»). Так вот, проведенные эксперименты по замене «остова» отобранных пре-микроРНК на терапевтические последовательности показали селективность упаковки таких химерных молекул внутрь везикул [10]. Схематично эта замена показана на рисунке 2б. Как результат, использование «химер» позволило снизить концентрацию частиц, осуществляющих доставку, без потери эффективности РНК-интерференции. Успех? Определенно!
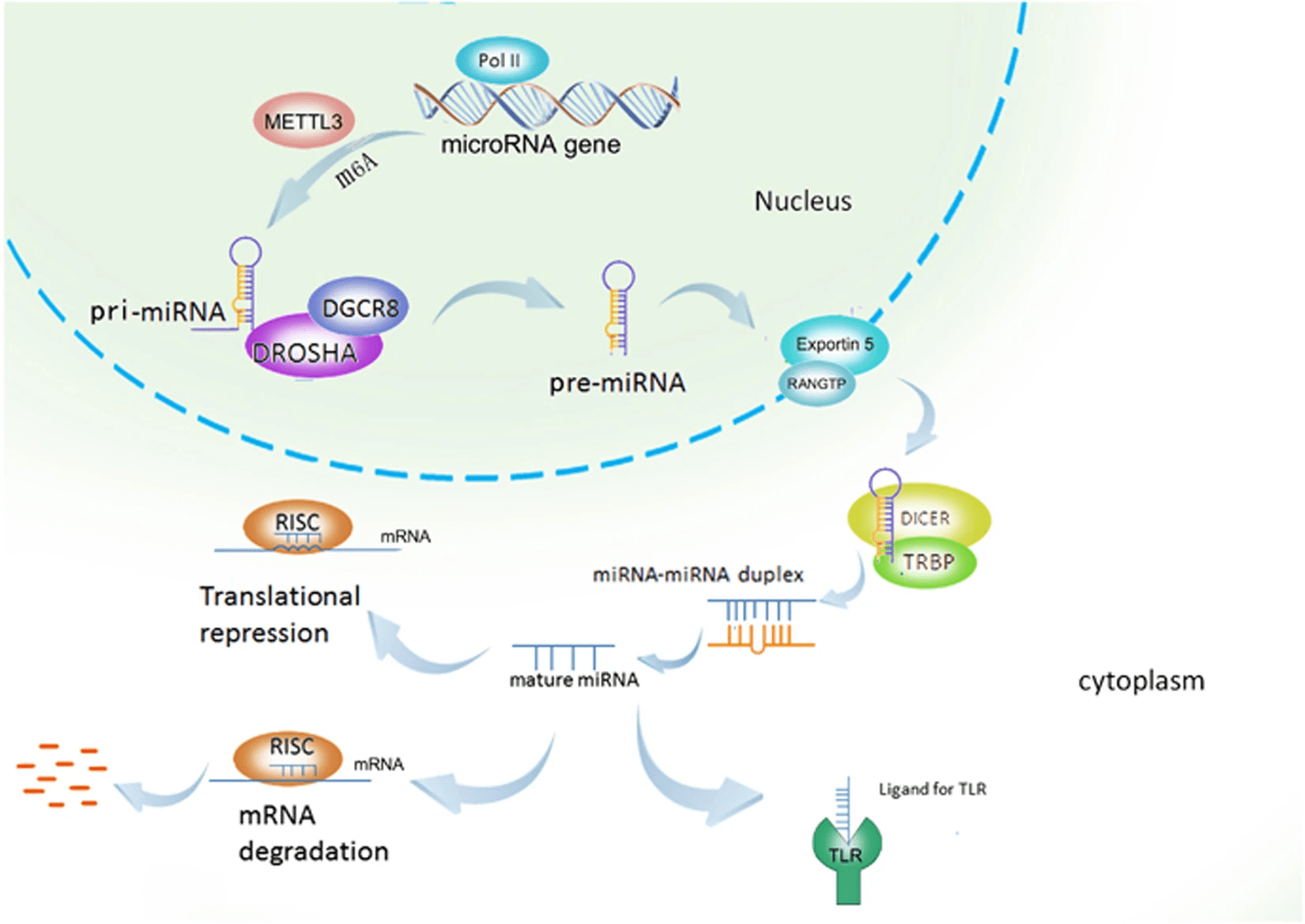
Рисунок 1. Процессинг микроРНК: от последовательности в геноме до функционального комплекса.
Детальное рассмотрение тех молекул, которые так любят отправляться в межклеточное путешествие в везикулах или, наоборот, оставаться в родной клетке, показало присутствие общих последовательностей, которые были определены как направляющие и названы авторами исследования EXOmotifs и CELLmotifs соответственно [12]. Включение или удаление этих небольших последовательностей длиной 4–7 нуклеотидов из 3’-концевой области интересующих молекул микроРНК определяло их дальнейшую судьбу: либо остаться внутри клетки (например, если добавить CELLmotif, удалив EXOmotifs), либо выйти за ее пределы в составе внеклеточных пузырьков. При этом исследование проводилось для широкого спектра клеточных типов, что указывает на наличие общих закономерностей при сортировке, а значит, найденные последовательности можно использовать при работе с везикулами, продуцируемыми разными типами клеток [12]. Но стоит отметить, что некоторые из мотивов сортировки находятся под защитой патентного права (как говорится, «перед употреблением проконсультируйтесь со специалистом») [13].
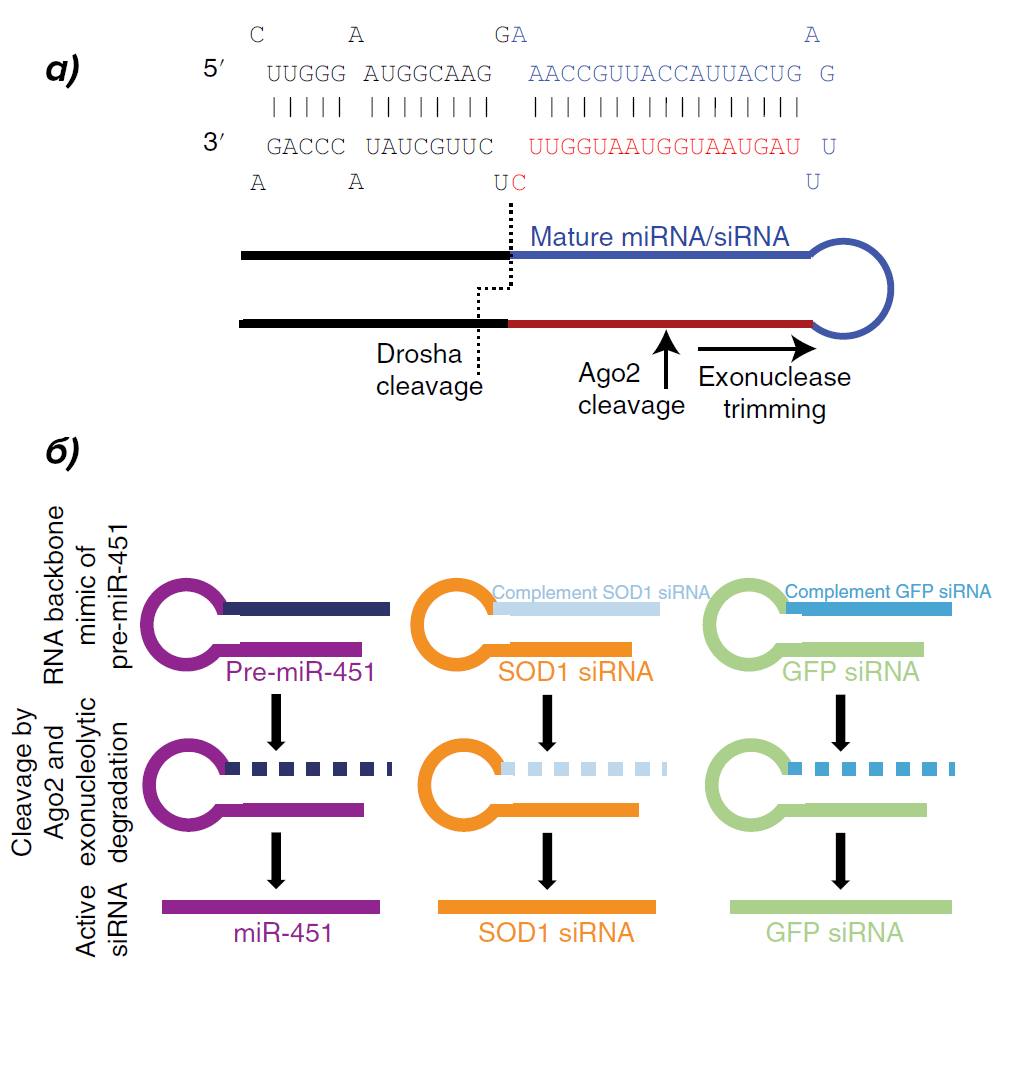
Рисунок 2. Использование остова pre-miRNA-451 для сортировки в везикулы микроРНК.
а) Разметка последовательности pre-microRNA в соответствии с изменениями молекулы в ходе процессинга;
б) Замена функциональной части pre-miRNA-451 на последовательности, воздействующие на экспрессию других молекул: SOD1 и GFP.
Таким образом, на данный момент существует ряд подходов, позволяющих сортировать в везикулы последовательности для осуществления РНК-интерференции в целевых клетках. Но что делать, если в качестве доставляемых молекул используются не малые, а матричные РНК, кодирующие белки? Они огромные и добровольно не залезут в везикулу. Тут на помощь исследователям приходят вирусы.
Пока все недолюбливают вирусы за устраивание эпидемий, исследователи подсматривают у них идеи для спасения мира
В мире существует большое разнообразие вирусов, которые отличаются в том числе и по признаку хранения генетической информации: некоторые, как большинство организмов, записывают необходимую информацию на языке ДНК, тогда как другие остановили свой выбор на РНК. И сейчас хотелось бы рассмотреть подробнее именно последние.
Но перед этим еще один интересный факт о вирусах: они не всегда переносятся из клетки в клетку в полностью собранном состоянии. Для ухода от иммунной системы и упрощения сборки вирусных частиц их геном может перемещаться во внеклеточных везикулах [14]. Такие вирусоподобные частицы нестабильны во внешней среде, но внутри организма позволяют перемещаться между клетками и заражать новые.
Итак, хочется обратить особое внимание на то, что вирусы за время своего существования научились из сотен тысяч РНК, содержащихся в зараженной клетке, находить именно свои копии генома. Так почему бы не использовать этот механизм вируса во благо человека? Каким образом они это осуществляют? Среди РНК-содержащих вирусов есть, например, ретровирусы, которые в своем геноме хранят так называемый Ψ-сигнал, или сигнал упаковки, — это небольшая последовательность на 5’-конце геномной РНК, которая, как правило, представляет собой набор шпилечных структур (а вирусы знают толк в моде, не так ли?). По этим шпилькам структурный белок вируса, Gag,с помощью одного из своих доменов узнает последовательности сортировки и упаковывает нужные (геномные) РНК в капсид — белковую оболочку вирусной частицы. Несмотря на общий механизм сортировки молекул для всех ретровирусов, консервативности последовательности между сигналами упаковки не было обнаружено [15]. Однако, независимо от порядка нуклеотидов в последовательности, структурные шпилечные мотивы, которые они образуют, тесно связаны с узнаванием геномной РНК и могут объяснить феномен перекрестной, а также совместной упаковки РНК среди различных ретровирусов [15], [16]. Перекрестная упаковка — это способность структурных белков одного вируса распознавать и упаковывать РНК другого вируса. Совместная упаковка представляет собой способность двух РНК из разных ретровирусов упаковываться вместе в одну вирусную частицу. Вот такие чудеса комбинаторики.
Но семейство ретровирусов обширно, а значит, и разнообразие сигналов упаковки велико. На каком остановить свой выбор? При этом ряд ретровирусов имеет важное значение для человека, например, вирус саркомы Рауса, который является первым из известных онкогенных вирусов и был открыт более 110 лет назад как причина онкологии у домашних птиц. Другой пример — вирус иммунодефицита человека (ВИЧ-1, -2), который может приводить к синдрому приобретенного иммунодефицита человека. Именно ввиду своего активного влияния на жизнь людей эти вирусы активно изучаются, и о системах упаковки их геномов известно больше, по сравнению с другими ретровирусами. Поэтому логично остановить свой выбор на их упаковочных последовательностях.
История о том, как вирусы сначала приручили человеческую систему, а потом исследователи использовали это в своих интересах
Использование вирусной системы сортировки РНК на основе Ψ-сигнала и Gag-белка имеет еще одно преимущество. В состав структурного белка ретровирусов входит несколько доменов, в том числе матриксный (MA) домен. К этому домену пришиваются (в процессе посттрансляционной модификации) миристильныегруппы (гидрофобная группа, включающая 14 атомов углерода), которые, взаимодействуя с определенными молекулами на клеточной мембране клетки-хозяина (а именно, с фосфатидилинозитол-(4,5)-бисфосфатом (PI(4,5)P2)), участвуют в прикреплении к ней вирусногобелка. А это уже является одним из важных этапов формирования некоторых вирусных частиц, отпочковывающихся от клетки и окружающих капсид частью ее мембраны [17]. Благодаря этому свойству Gag-белок может способствовать формированию везикул с целевыми РНК.
На С-конце белка находится p6-домен, который влияет на формирование ESCRT-комплекса (endosomal sorting complex required for transport). В естественных условиях этот комплекс направляет реорганизацию мембраны в широком спектре клеточных биологических процессов, включая разрыв мембраны при цитокинезе, биогенез внеклеточных пузырьков, восстановление повреждений мембран, преобразование ядерной оболочки и многие другие. Вирусы же используют эту клеточную машинерию для увеличения эффективности отпочковывания вирусных частиц от клетки-хозяина [18]. Подробнее процесс показан на рисунке 3 вместе со схемой доменов Gag-белка.
Не будем далее углубляться в подробности процесса сборки вирусных частиц, только отметим, что использование вирусной системы сортировки молекул нуклеиновых кислот в системе упаковки терапевтических молекул является потенциально перспективным, позволяющим создавать клетки, эффективно производящие везикулы с необходимым содержанием. Для каждой мишени будет свой снаряд, который не попадет «в молоко».

Рисунок 3. Процесс отпочковывания вирусных частиц от клетки на примере HIV при участии комплекса ESCRT.
Как убить двух зайцев сразу: решение проблемы таргетности и обхода эндосомального пути
Существует три пути попадания того, что находится внутри «снаряда», в клетку — диффузия, слияние мембран (везикулы и клетки) и эндосомальный путь. Последний из путей, как уже говорилось в начале статьи, нежелателен, но обходить его самостоятельно везикулы не могут. А вот наиболее эффективным является путь, лежащий через слияние мембран. Но и тут не все так однозначно. Просто так мембраны сливаться не могут. Только представьте: вы каждый день оказываете колоссальное давление на свою ступню, когда идете на работу/в университет/школу/куда-то еще, но клетки там все равно не сливаются! (Даже если вы будете прыгать, как балерина, все равно не сольются.) Другой пример: при сильном надавливании на любой участок кожи вы, вероятнее всего, получите синяк, а не группу клеток со слившимися мембранами.
Теперь разберемся, в чем же состоит сложность слияния двух мембран. Дело в том, что мембраны клеток, представляющие собой два липидных бислоя, гидратированы (покрыты молекулами воды). Между двумя гидратированными бислоями резко возрастает сила отталкивания при их сильном сближении [20]. Иными словами, двум мембранам мешают слиться молекулы воды, находящиеся между ними.
Но, как обычно бывает, в природе существуют организмы, которые сумели решить данные проблемы. Самое время вновь обратиться к вирусам.
Что еще мы можем подсмотреть у вирусов?
На самом деле, существует еще один способ таргетной доставки (о котором мы умолчали ранее) — это использование вирусных векторов (с помощью них можно доставлять генетические конструкции), но этот способ имеет два существенных недостатка: ограниченная емкость ввиду небольших размеров вирусных частиц и иммуногенность. А вот использование везикул позволяет избежать этих сложностей: их емкость значительно выше, а иммуногенность значительно ниже. Но еще лучше — объединить преимущества двух систем: биологическую безопасность везикул и способы нацеливания на мишень, используемые вирусами.
В ходе эволюции вирусы, имеющие липидную мембрану, научились преодолевать энергетический барьер и сливаться с целевыми клетками. Для этого у них существуют специальные белки — белки слияния, способные протыкать, деформировать и сближать мембрану клетки, с которой они хотят слиться. Эти белки собираются на оболочке вируса в группы по три тримера и объединяют две мембраны (см. рисунок 4). Примером такого белка может служить эндогенный ретровирусный белок слияния синтицин [21], рецепторы к которому, известные как ASCT2, чрезмерно экспрессируются на клетках некоторых опухолей. В частности, этих рецепторов много на поверхности клеток колоректального рака (линия HT-29) [22].
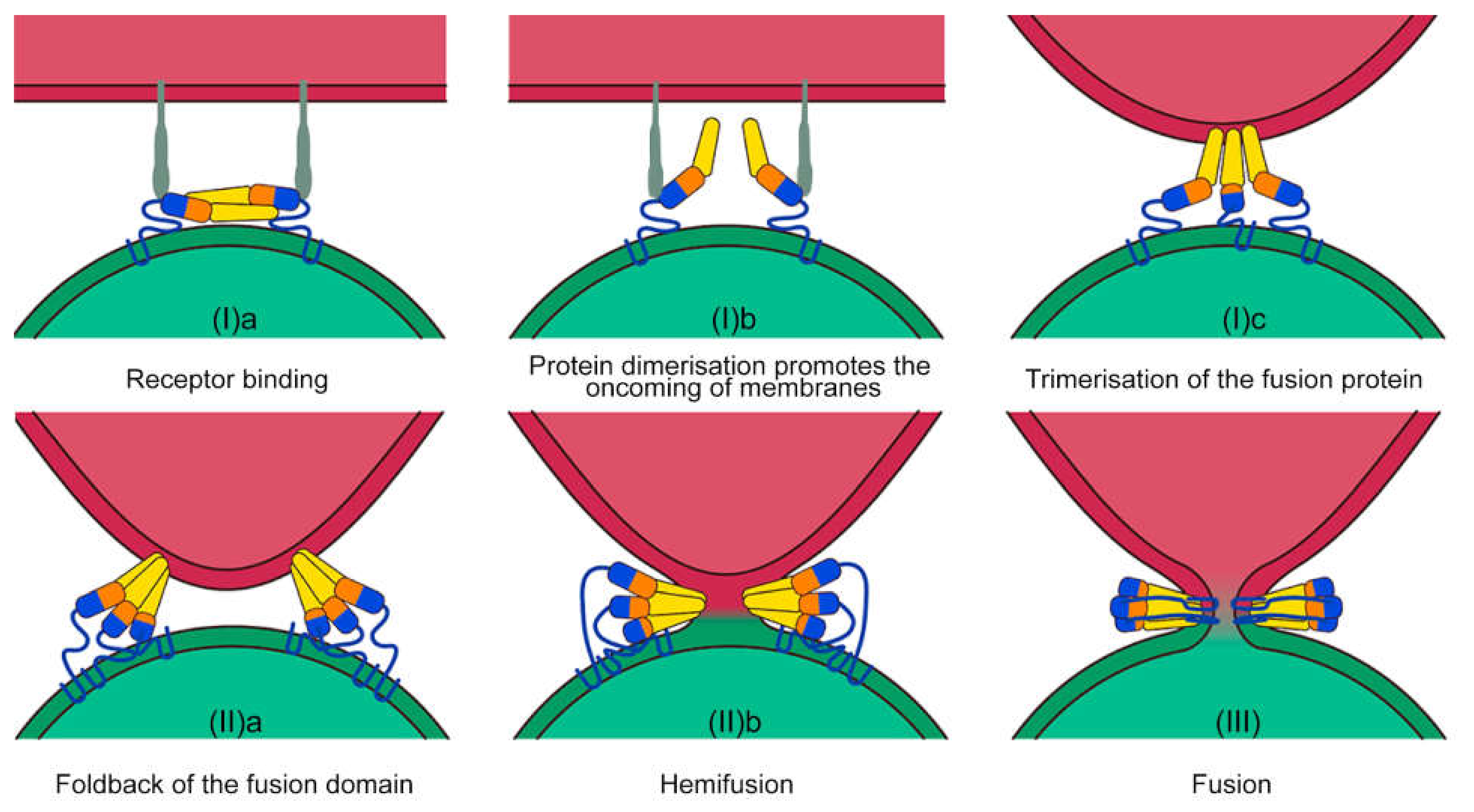
Рисунок 4. Механизм слияния мембран под действием специальных белков.
В любом органе есть особенные молекулы-маркеры, по которым можно нацелить систему доставки. Распространяясь по кровотоку, везикулы могут ориентироваться по тканеспецифичным молекулам эндотелия или клеток непосредственно целевого органа. Получается, что, используя белок слияния, рецептор к которому есть в основном только у выбранных клеток, можно повысить специфичность и эффективность доставки молекул [24].
«Мы строили-строили и наконец построили!» Золотоносная система команды MIPT_MSU
Вдохновленная исследованиями, описанными выше, команда студентов Московского физико-технического института (национального исследовательского университета), МФТИ, и Московского государственного университета, МГУ, под руководством Зубарева Ильи Владимировича, кандидата биологических наук, поставила перед собой задачу создать прототип таргетной системы доставки молекул на базе внеклеточных везикул. Эти везикулы должны обеспечивать таргетность действия благодаря модификации мембраны белком слияния синцитином, а также содержать внутри себя необходимые молекулы мРНК, имеющие сигнал упаковки генома ВИЧ-1 (более подробную информацию о проекте можно найти на сайте команды: https://2021.igem.org/Team:MIPT_MSU). Принципиальная схема работы предложенной нами системы изображена на рисунке 5.
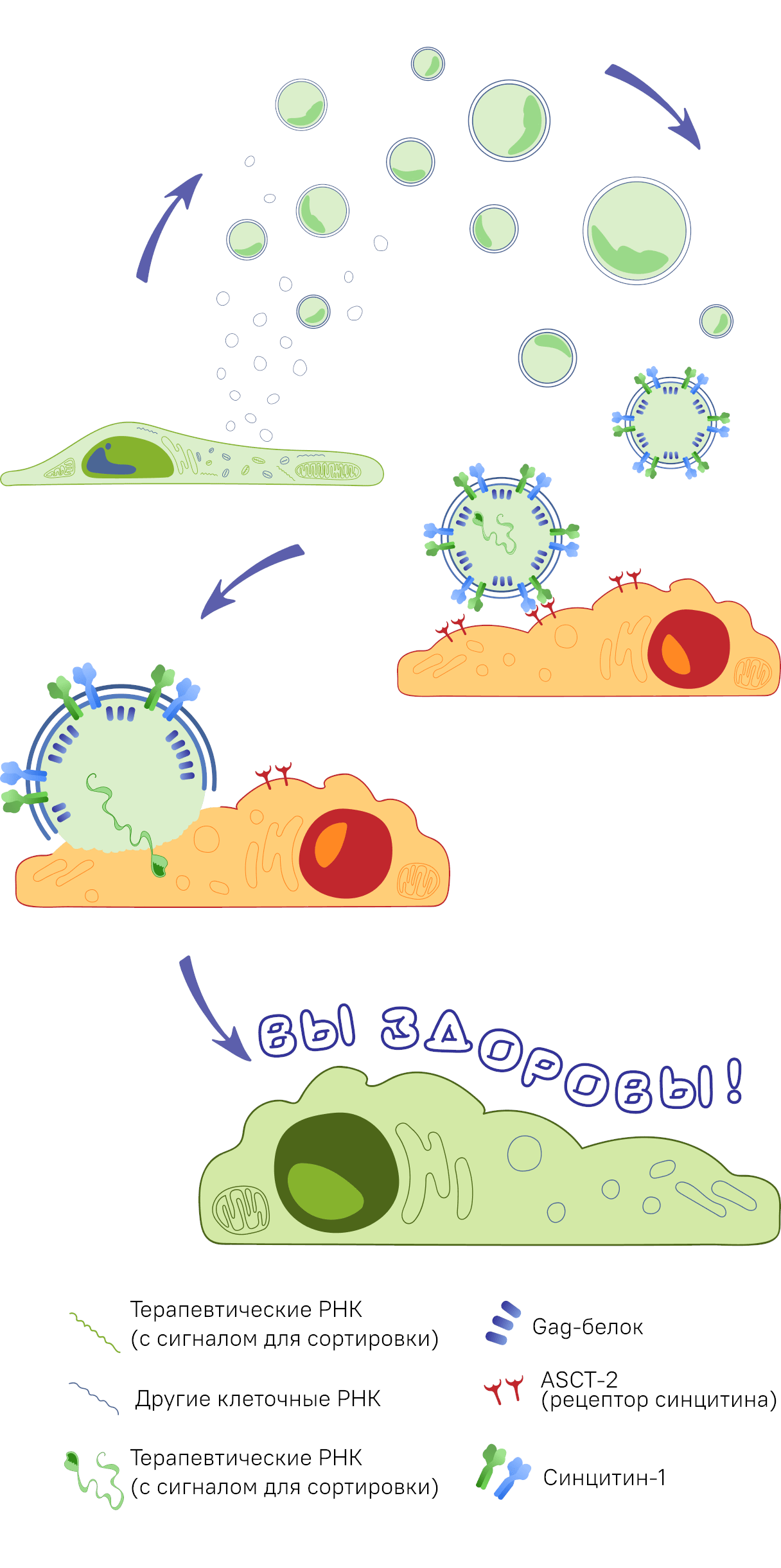
Рисунок 5. Принципиальная схема работы системы сортировки и доставки мРНК, разработанная командой MIPT_MSU.
Везикулы с синцитином на поверхности и терапевтической РНК внутри отпочковываются от клетки молочной железы (линия MCF7), затем синцитин соединяется со своим рецептором (ASCT2) на поверхности клетки рака толстой кишки (линии HT-29), в результате чего мембрана везикулы сливается с клеточной и терапевтическая РНК попадает в цитоплазму раковой клетки.
иллюстрация Асташковой Ольги, специально для MIPT_MSU
Для продукции везикул была выбрана клеточная линия рака молочной железы (линия MCF7), в которую были трансфецированы созданные командой плазмиды: с Gag-белком (для сортировки молекул РНК) и с синцитином. При трансфекции клеток молекулами РНК, модифицированными посредством добавления в последовательность на 5’-конец Ψ-сигнала, MCF7 начинали продуцировать везикулы, предположительно содержащие все необходимые компоненты системы доставки.
Полученные везикулы необходимо было протестировать. Для этого они были отфильтрованы из культуральной среды и добавлены к клеткам линии рака толстой кишки HT-29, которые на своей поверхности содержат рецепторы к синцитину, что позволяет обеспечить эффективное слияние везикулярной и клеточной мембран. Для тестирования системы наша команда использовала мРНК зеленого флуоресцентного белка и получила обнадеживающие результаты: после инкубации клеток HT-29 с везикулами часть из них получила доставляемую молекулу, что подтверждалось наличием сигнала флуоресценции. Мы не настолько наивны, чтобы после первых же успешных экспериментов заявлять о том, что нашли Клондайк, поэтому впереди нас и наши везикулы ждет еще много важных опытов, но…
Перспективы: как тебе такое, Илон Маск?
Если мы получили зеленое свечение, значит молекулы РНК доставляются в цитоплазму целевых клеток (HT-29), и начинается синтез белка. При доставке других молекул становится возможным влияние на клеточный метаболизм и репрограммирование клеток.
С помощью биологически безопасной и эффективной таргетной системы доставки лекарств появляются возможности для менее изнурительного лечения онкозаболеваний и патологий, связанных с изменением генетического материала и метаболизма, а это очень широкий спектр заболеваний [25]. Звучит как панацея от всех бед и фантастика. Но многие вещи, о которых писали когда-то фантасты, через некоторое время исследователи и изобретатели воплощали в жизнь.
Рассмотрим несколько примеров использования такой системы. Если доставить факторы одного из видов программируемой клеточной гибели (апоптоза) в «испорченные» клетки, то они погибнут, но при этом близлежащие ткани останутся нетронутыми [26]. Если отправить в клетку код для синтеза белков коварных (читай: патогенных для человека) вирусов или бактерий, иммунная система сумеет заранее подготовить «войска» перед наступлением врагов. Предупрежден — значит вооружен.
С другой стороны, система сортировки молекул РНК может стать новым полезным инструментом молекулярной биологии и генной инженерии. Возможность отбирать конкретные молекулы из некоторого множества открывает новые пути для развития фундаментальной биологической науки. С помощью данной системы возможно изучение свойств некоторых химических структур и их поведения внутри клеток, что может быть интересно не только для медицины.
Благодарности
Реализация проекта невозможна без поддержки. Авторы статьи от лица команды MIPT_MSU выражают благодарность биотехнологическим компаниям SkyGen, Dia-M, Thermo Fisher Scientific, EVOGEN, Lumiprobe, Helicon, Evrogen, SnapGene и Eppendorf за помощь с приобретением необходимых реактивов и расходников; дирекции физтех-школы биологической и медицинской физики МФТИ (НИУ), которая помогла со стартовым взносом на участие в конкурсе; лаборатории регуляции клеточной сигнализации МФТИ, на базе которой работала наша команда и сотрудники которой делились с нами опытом постановки экспериментов, а также дизайнеру Асташковой Ольге, благодаря которой наш проект заиграл яркими красками.
Литература
- Таргетная терапия — прицельный удар по болезни;
- Волшебные пузырьки — липосомы цифелина;
- David C. Litzinger, Antoinette M.J. Buiting, Nico van Rooijen, Leaf Huang. (1994). Effect of liposome size on the circulation time and intraorgan distribution of amphipathic poly(ethylene glycol)-containing liposomes. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1190, 99-107;
- Parisa Ghasemiyeh, Soliman Mohammadi-Samani. (2020).
Potential of Nanoparticles as Permeation Enhancers and Targeted Delivery Options for Skin: Advantages and Disadvantages
. DDDT. Volume 14, 3271-3289; - H Karanth, R S R Murthy. (2010). pH-Sensitive liposomes-principle and application in cancer therapy. Journal of Pharmacy and Pharmacology. 59, 469-483;
- Killian O’Brien, Koen Breyne, Stefano Ughetto, Louise C. Laurent, Xandra O. Breakefield. (2020). RNA delivery by extracellular vesicles in mammalian cells and its applications. Nat Rev Mol Cell Biol. 21, 585-606;
- Нобелевская премия по физиологии и медицине (2013): везикулярный транспорт;
- Audrey Fleury, Maria Carmen Martinez, Soazig Le Lay. (2014). Extracellular Vesicles as Therapeutic Tools in Cardiovascular Diseases. Front. Immunol.. 5;
- Huizhi Chen, Liyan Wang, Xinling Zeng, Herbert Schwarz, Himansu Sekhar Nanda, et. al.. (2021). Exosomes, a New Star for Targeted Delivery. Front. Cell Dev. Biol.. 9;
- Ryan Reshke, James A. Taylor, Alexandre Savard, Huishan Guo, Luke H. Rhym, et. al.. (2020). Reduction of the therapeutic dose of silencing RNA by packaging it in extracellular vesicles via a pre-microRNA backbone. Nat Biomed Eng. 4, 52-68;
- Yong Peng, Carlo M Croce. (2016). The role of MicroRNAs in human cancer. Sig Transduct Target Ther. 1;
- Romain Grangeon, Jun Jiang, Juan Wan, Maxime Agbeci, Huanquan Zheng, Jean-François Laliberté. (2013). 6K2-induced vesicles can move cell to cell during turnip mosaic virus infection. Front. Microbiol.. 4;
- Targeting Mirnas for Exosomal Delivery or Cellular Retention. (2021). PatentGuru;
- Romain Grangeon, Jun Jiang, Juan Wan, Maxime Agbeci, Huanquan Zheng, Jean-François Laliberté. (2013). 6K2-induced vesicles can move cell to cell during turnip mosaic virus infection. Front. Microbiol.. 4;
- Lizna Ali, Tahir Rizvi, Farah Mustafa. (2016). Cross- and Co-Packaging of Retroviral RNAs and Their Consequences. Viruses. 8, 276;
- Yasuyuki Miyazaki, Ariko Miyake, Masako Nomaguchi, Akio Adachi. (2011). Structural Dynamics of Retroviral Genome and the Packaging. Front. Microbio.. 2;
- Samantha Sarni, Banhi Biswas, Shuohui Liu, Erik D. Olson, Jonathan P. Kitzrow, et. al.. (2020). HIV-1 Gag protein with or without p6 specifically dimerizes on the viral RNA packaging signal. Journal of Biological Chemistry. 295, 14391-14401;
- Jun Arii, Mizuki Watanabe, Fumio Maeda, Noriko Tokai-Nishizumi, Takahiro Chihara, et. al.. (2018). ESCRT-III mediates budding across the inner nuclear membrane and regulates its integrity. Nat Commun. 9;
- Kevin M. Rose, Vanessa M. Hirsch, Fadila Bouamr. (2020). Budding of a Retrovirus: Some Assemblies Required. Viruses. 12, 1188;
- E A Evans, V A Parsegian. (1986). Thermal-mechanical fluctuations enhance repulsion between bimolecular layers.. Proc. Natl. Acad. Sci. U.S.A.. 83, 7132-7136;
- S. Angeletti, V. Rena, R. Nores, R. Fretes, G.M. Panzetta-Dutari, S. Genti-Raimondi. (2008). Expression and Localization of StarD7 in Trophoblast Cells. Placenta. 29, 396-404;
- Yuta Hara, Yushi Minami, Soshi Yoshimoto, Natsumi Hayashi, Akitaka Yamasaki, et. al.. (2020). Anti‐tumor effects of an antagonistic mAb against the ASCT2 amino acid transporter on KRAS ‐mutated human colorectal cancer cells. Cancer Med. 9, 302-312;
- Ilya Zubarev, Dmitry Vladimirtsev, Maria Vorontsova, Igor Blatov, Konstantin Shevchenko, et. al.. (2021). Viral Membrane Fusion Proteins and RNA Sorting Mechanisms for the Molecular Delivery by Exosomes. Cells. 10, 3043;
- Kristoffer Riecken, Dawid Głów, Boris Fehse. (2021). How to package and SEND mRNA: a novel “humanized” vector system based on endogenous retroviruses. Sig Transduct Target Ther. 6;
- Kalina Paunovska, David Loughrey, James E. Dahlman. (2022). Drug delivery systems for RNA therapeutics. Nat Rev Genet;
- Pooja Chandna, Maha Saad, Yang Wang, Elizabeth Ber, Jayant Khandare, et. al.. (2007). Targeted Proapoptotic Anticancer Drug Delivery System. Mol. Pharmaceutics. 4, 668-678.






