
Из пункта А в пункт Б за один ход
18 декабря 2009
Из пункта А в пункт Б за один ход
- 955
- 0
- 1
— По-моему, Зазеркалье страшно похоже на шахматную доску, — сказала наконец Алиса. — Только фигур почему-то не видно...
— Если хочешь, становись Белой Королевской Пешкой. <...> К тому же ты сейчас стоишь как раз на второй линии. Доберешься до восьмой, станешь Королевой...
-
Автор
-
Редакторы
Механизм фолдинга белкá — процесса сворачивания цепочки аминокислот в уникальную пространственную структуру — занимает умы множества биофизиков во всем мире, но до окончательного понимания этого вопроса ещё очень далеко. Известно, что равновесие между свёрнутой и денатурированной формами белкá можно сдвинуть, введя в молекулу точечные мутации, а строго определённый их набор может даже привести к появлению новой функции и изменить мотив упаковки полипептидной цепи в пространстве. Мы уже писали об эксперименте, в котором посредством многочисленных мутаций удалось последовательности двух изначально негомологичных белков сделать практически идентичными (88% остатков совпадали), сохранив при этом первоначальную структуру и функции. Теперь те же учёные довели эту пару до «совершенства»: различие в последовательности между двумя разными по строению и функциям белками составило всего один аминокислотный остаток.
Одним из основных явлений, находящихся в центре внимания структурной молекулярной биологии и биофизики, является самоупаковка полипептидной (белковой) цепочки в уникальную трёхмерную структуру, определяющую функцию и роль белков в жизненных процессах. Однако количественного понимания физико-химических основ этого процесса, называемого также фолдингом, до сих пор нет, и проблема предсказания строения белковой молекулы по аминокислотной последовательности, в принципе содержащей в себе всю необходимую для этого информацию, в общем случае пока не имеет решения.
Сейчас уже не вызывает споров тот факт, что белки возникли не каждый сам по себе, а являются продуктом эволюционного процесса, в результате которого их можно объединять в иерархические родственные группы. Так, два белкá, содержащиеся в разных организмах, но предположительно имеющие общего «предка», называют гомологичными. Во многих случаях гомологичные белки имеют сходное строение, потому что пространственная упаковка почти всегда более устойчива, нежели аминокислотная последовательность, подверженная в процессе эволюции постоянному «редактированию».
Но есть из этого правила и исключения, которые подвергают наше понимание принципов белковой организации суровой проверке, — и оно (понимание) пока что оставляет желать лучшего. Речь пойдёт о белкáх, гомологичных по формальным признакам (с почти идентичными аминокислотными последовательностями), но, тем не менее, не являющихся истинными гомологами и выполняющих различные функции, имея при этом совершенно разное строение. Особенно интересно в данном случае «притянуть» последовательности как можно ближе друг к другу (вводя «встречные» точечные замены), контролируя при этом, чтобы каждый белок продолжал оставаться самим собой, — тогда получившийся «сухой остаток» можно будет в полной мере считать «переключателем структуры». В новой работе американских учёных на суд публике представлены два белкá, имеющих разную функцию и совершенно непохожее строение, но различающихся при этом... всего одним остатком в аминокислотной последовательности [1].
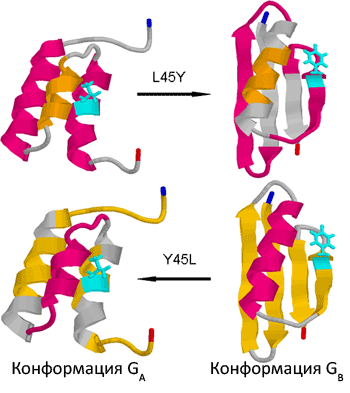
Рисунок 1. Варианты укладки белковой цепочки для двух последовательностей, различающихся лишь по позиции #45 (лейцин для белка GA и тирозин — для GB). Конформационные отличия, сопровождающие введение этой замены, настолько велики, что >80% остатков в молекуле меняют тип вторичной структуры (соответствующие сегменты показаны для каждой структуры тем же цветом).
Около года назад «биомолекула» уже писала о предыдущей работе этой же группы авторов [2]. Учёные в течение длительного времени работают над парой белков, нащупывая «тропинку» мутационного превращения одного в другой, стараясь сохранить при этом их «индивидуальность» максимально долго и избежать «промежутка», заполненного неструктурированными и нефункциональными формами. Работа продолжается на молекулах, первоначально представлявших собой два домена стрептококкового белкá G, один из которых (GA, состоящий из трёх α-спиралей) связывается с сывороточным альбумином из человеческой крови, а другой (GB, образованный четырьмя β-тяжами и одной α-спиралью) — с константной частью иммуноглобулина IgG. Будучи первоначально различной длины и практически не обладая гомологией по последовательности, белки GA и GB после многолетнего эксперимента были приведены к равным по длине вариантам GA88 и GB88, идентичным на 88% и отличающимся всего по семи позициям (подробности в статье «Непохожие „гомологичные“ белки» [2]). Напоследок авторы выдвинули предположение, что, возможно, и это различие удастся в будущем редуцировать, представив пытливому взору только самый костяк «переключателя структуры» [2].
На рисунке 1 показана суть проделанной работы — «прошлогодняя» пара GA88/GB88 доведена до индекса 98, что означает 98%-ную идентичность последовательностей. Другими словами, найдены варианты последовательностей обоих белков, различающиеся по единственной позиции, замена по которой превращает один белóк в другой — за один шаг, без промежуточных несворачивающихся и нефункциональных форм. Вариант GA98, как и его «предок» GA, связывает сывороточный альбумин и имеет строение типа 3α, а GB98 связывает иммуноглобулин и устроен по схеме 4β+α. С «обретением» этой пары, наконец протоптана «тропка» между двумя неродственными белкáми, и что особенно важно — на всем пути не встречается неструктурированных промежуточных форм.
Путь к паре GA98/GB98 пролегал через несколько промежуточных этапов, в которых пары становились всё более и более идентичными друг другу: в статье описаны варианты с 88%, 91%, 95% и, наконец, 98%-ной идентичностью последовательностей (рис. 2). «Переключателем структуры» оказался остаток #45: когда он «равен» тирозину, стабилизируется 4β+α укладка (белок GB), а когда лейцину — 3α (белок GA). Поскольку важным условием «метаморфозы» было отсутствие несвернутых и нефункциональных переходных форм, множество опробованных вариантов подвергали функциональному скринингу (белок должен был продолжать связываться с альбумином (GA) либо иммуноглобулином (GB)), а их стабильность оценивали с помощью гетероядерной ЯМР-спектроскопии 15N–1H. Для некоторых промежуточных и окончательного варианта методом ЯМР получены пространственные структуры.
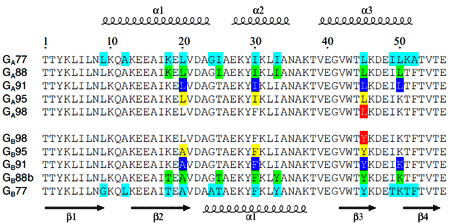
Рисунок 2. Последовательности вариантов белкá GA с типом укладки 3α (сверху) и GB с укладкой 4β+α (снизу); над и под последовательностями показана соответствующая вторичная структура. Цветной подложкой отмечены различающиеся остатки в парах белков с тем или иным уровнем идентичности последовательностей. (Так, единственное отличие в паре GA98/GB98 — остаток 45 на красном фоне, а GA77/GB77 отличаются по 13 позициям, показанным на голубом фоне.)
Вполне возможно, что описанный пример не является таким уж редким исключением из правила «близкие последовательности — близкие структуры», хотя его (пример) по праву можно назвать одной из первых ласточек в этой сфере. Мало того, существуют серьёзные основания считать явление «структурного переключения в один ход» весьма важным звеном эволюционного процесса — ведь оно позволяет приобретать молекуле не существовавшую ранее функцию без промежуточной бесполезной стадии, неминуемо отсеянной бы отбором! Кстати, в экспериментах по массовому мутагенезу библиотек белков со скринингом корректно свернутых форм установлено, что во многих случаях последовательность может быть изменена более чем на 50% без изменения структуры, функций и даже кинетических параметров фолдинга белка [3]. (Правда, в большинстве случаев такие «лёгкие для замены» остатки расположены на поверхности глобулы и не участвуют в специфических контактах.)
Примеры радикального изменения строения белка после введения всего нескольких замен были известны и ранее, но никогда ещё всего одна (!) замена не давала такой большой перестройки. В частности, иногда встречается явление «обмена доменами» [4], при котором особенно подвижные концы полипептидной цепи могут участвовать в образовании новых стабилизирующих контактов с участием двух мономеров. Кстати, в случае пары GA98/GB98 тоже следует подчеркнуть особую роль N- и C-концов белка: будучи неструктурированными в укладке GA, они образуют плотное упакованное «ядро» GB-формы (рис. 1). Мутации могут влиять и на четвертичную структуру белкá, — в частности, для того же белка GB, в норме мономерного, известен мутант, формирующий тетрамер [5].
Конформационная подвижность и масштабные структурные перестройки как их частный вариант составляют самую суть существования белковых молекул. Например, весьма существенные изменения происходят в белкé вируса гриппа гемагглютинине при проникновении через мембрану эритроцита: большáя неупорядоченная петля стабилизируется, «надстраивая» спираль 2 (гемагглютинин — α-спиральный тример), что лежит в основе механизма проникновения через мембрану. Недавно был также открыт пример обратимого спонтанного изменения конформации (причем, не меньшего масштаба, чем в случае пары GA/GB) — оказывается, небольшой хемокин лимфотактин «прыгает» между двумя различными (!) нативными конформациями, каждая из которых выполняет свою работу (см. «Одна последовательность—одна структура: был ли Анфинсен неправ?» [6]). Ещё один яркий пример — прионы и другие амилоидные белки, нормальная форма которых — глобулярная и нетоксичная, а патологическая (возникающая в результате конформационного превращения) — фибриллярная, разрушительная для клеток [7].
Ещё раз хотелось бы подчеркнуть возможное эволюционное значение «бесшовного» превращение одних белков в другие и «переключения» мотивов трехмерной упаковки «в один ход», ведь это — сильный аргумент в споре с противниками идеи эволюции, утверждающими, что появление новых признаков невозможно, поскольку скачком они образоваться не могут, а постепенное их появление не позволяется отбором. По-видимому, после «переключения» последовательности начального и изменённого белков должны быстро (в эволюционном масштабе, конечно) «разойтись», так что не исключено, что лимфотактин — как раз такой пример, «застигнутый» в процессе переключения на новый тип строения.
При написании статьи использовалась колонка «Комментарии» Докладов АН США [8].
Литература
- Patrick A. Alexander, Yanan He, Yihong Chen, John Orban, Philip N. Bryan. (2009). A minimal sequence code for switching protein structure and function. PNAS. 106, 21149-21154;
- Непохожие «гомологичные» белки;
- D. E. Kim, H. Gu, D. Baker. (1998). The sequences of small proteins are not extensively optimized for rapid folding by natural selection. Proceedings of the National Academy of Sciences. 95, 4982-4986;
- Yanshun Liu, David Eisenberg. (2002). 3D domain swapping: As domains continue to swap. Protein Sci.. 11, 1285-1299;
- M. Kirsten Frank, Fred Dyda, Anatoliy Dobrodumov, Angela M. Gronenborn. (2002). Core mutations switch monomeric protein GB1 into an intertwined tetramer. Nat Struct Biol;
- Одна последовательность — одна структура: был ли Анфинсен неправ?;
- Альцгеймеровский нейротоксин: ядовиты не только фибриллы;
- David Shortle. (2009). One sequence plus one mutation equals two folds: Fig. 1.. PNAS. 106, 21011-21012.





