
Как аэрофотосъемка связана с медицинскими снимками, большими данными и ИИ?
09 февраля 2026
Как аэрофотосъемка связана с медицинскими снимками, большими данными и ИИ?
- 82
- 0
- 1
Фантазия на тему того, как мозг генерирует новые методы и теории.
изображение сгенерировано автором с помощью Gemini Pro 3
-
Авторы
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Тема радиомики уже поднималась на «Биомолекуле» — в статье «Увидеть то, что неподвластно глазу» были заложены основы понимания этой технологии. Здесь мы идем дальше: подробно разбираем не только принципы, но и конкретные клинические применения, проблемы воспроизводимости и международные стандарты качества.
Конкурс «Био/Мол/Текст»-2025/2026
Эта работа опубликована в спецноминации «Искусственный интеллект в биологии» конкурса «Био/Мол/Текст»-2025/2026.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания Центральный университет в лице совместной с институтом AIRI Лаборатории ИИ, анализа данных и моделирования.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
От картинки к данным. Как врач принимает решение?
Процесс постановки диагноза любому пациенту невозможно представить без процедуры диагностики. В лучевой диагностике это исследования методами КТ (компьютерная томография), МРТ (магнитно-резонансная томография), ПЭТ (позитронно-эмиссионная томография) и так далее (рис. 1). Базовые принципы этих методов подробно разобраны в статьях «Увидеть то, что неподвластно глазу: как радиомика помогает врачам в диагностике опухолей» [1] и «12 методов в картинках: нейробиология» [2]. Необходимое диагностическое исследование выбирается в соответствии с исследуемой патологией. Например, если исследуются кости — то лучшим методом можно считать КТ, что обусловлено высоким атомным номером кальция, приводящим к значительному ослаблению рентгеновского излучения и создающему высокий контраст. Если мягкие ткани — МРТ, поскольку данный метод, основанный на явлении ядерного магнитного резонанса, позволяет визуализировать различия в времени релаксации T1 и T2 протонов воды в тканях организма. Однако пациента вне зависимости от проводимого исследования будет интересовать его результат. Болен или нет? А если болен, то насколько?
В диагностике любого заболевания врачу-рентгенологу принципиально важно корректно интерпретировать полученные изображения, отыскать пораженную область, обозначить ее границы и расположение, назначить дополнительное обследование или сказать, что пациент здоров. Здесь можно полагаться только на опытность вашего врача, его умение интерпретировать увиденное и сделать верное заключение. Тем не менее, каким бы опытным ни был профессионал — он тоже человек и склонен совершать разного рода ошибки [3]. Можно было бы парировать это и сказать, что такие проблемы решаются проверкой — аудитом — работы врача-рентгенолога. На практике, к сожалению, это не всегда возможно; более того, не гарантирует, что проверяющий специалист более компетентен, чем предыдущий. Врачебные разногласия при постановке диагноза также возможны при редких патологиях и спорных клинических случаях.
Исследования показывают, что такая субъективность может достигать 20–30% в сложных случаях, особенно в онкологии, где цена ошибки особенно высока. Например, в исследовании, проведенном в 2020 году, было показано, что разногласия между рентгенологами в интерпретации скрининговых исследований молочных желез — маммограм — достигают 25% [4], что приводит к ложноположительным или ложноотрицательным диагнозам. Можно ли как-то уменьшить такую субъективность?
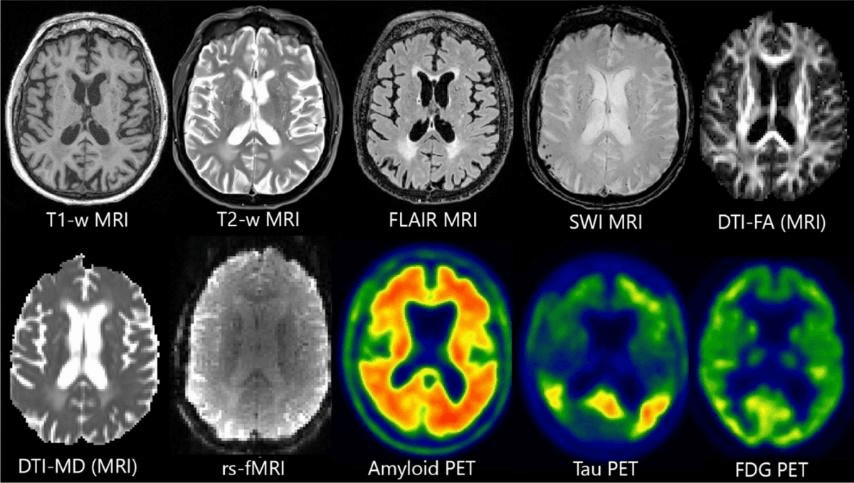
Рисунок 1. Примеры медицинских изображений: КТ, МРТ и ПЭТ-снимки мозга, демонстрирующие разные модальности визуализации. МРТ (Т1, Т2 FLAIR, SWI) оценивает структурные особенности мозга; DTI-FA MRI, DTI-MD MRI и rs-fMRI оценивают функционирование тканей и систем; ПЭТ используется для оценки метаболической активности мозга.
Загребущие руки, или как исследовать сразу все
Дело в том, что при описании патологических изменений врач в большей мере дает качественные характеристики, оценивает однородность, четкость контуров, геометрическую форму. Количественные характеристики в протоколе исследования фиксируются в виде линейных размеров, плотности, изредка — кривой накопления внутривенного контраста. Таким образом, количественные параметры гипотетического образования представлены в меньшинстве. Но ведь часть информации, необходимой для диагностики, может быть утеряна при таком подходе к описанию исследования! А что если из-за неточного описания опухоли хирург совершит ошибку?
Человеческий глаз — удивительный инструмент, но он имеет пределы. На снимке МРТ или КТ скрыто гораздо больше информации, чем мы видим. Каждый пиксель — наименьший логический элемент двумерного цифрового значения (или воксель в 3D) — несет данные об интенсивности сигнала, текстуре, форме и распределении. Например, опухоль может иметь микроскопические вариации в плотности, которые указывают на ее агрессивность, но врач не может измерить их «на глаз».
На данном этапе отсутствуют точные значения, какое точно количество оттенков серого может различить человеческий глаз: число колеблется от 30 и до 500; в то время как компьютер может анализировать тысячи параметров, таких как энтропия (мера хаотичности) или корреляция (связи между пикселями). Например, в текстуре опухоли могут скрываться признаки, указывающие на наличие мутаций, но без специальных инструментов их не увидеть. Это приводит к тому, что диагноз основывается на неполной картине, связанной с исторической практикой работы со снимком «на глаз». Как в таком случае получать больше данных?
Как извлечь скрытую информацию из медицинских изображений и использовать ее для точной диагностики?
Здесь нельзя не упомянуть, про компьютерное зрение — способность функционального блока принимать, обрабатывать и интерпретировать визуальные данные [ГОСТ 33707-2016]. С появлением компьютеров мы научились быстро и эффективно передавать информацию, а если мы можем ее передавать, то можем и исследовать. Диагностический снимок — это тоже информация, а значит она подлежит изучению. Анализ изображений производится с использованием библиотек различных языков программирования, таких как Python, R и так далее. Такое программное обеспечение с помощью математических алгоритмов обрабатывает привычные нам снимки и превращает их в матрицу числовых значений, соответствующих каждому пикселю или вокселю. В таком представлении компьютер «видит» и может интерпретировать изучаемые данные.
Это позволяет не просто «смотреть на картинку», а измерять ее свойства: насколько изображение неоднородно, как распределены яркие и темные участки, повторяются ли определенные узоры текстуры. Именно дополнение интерпретации изображений с преимущественно качественными показателями возможностями продвинутого количественного анализа и лежит в основе радиомики.
Что такое радиомика?
Начиная с этимологии слова, мы будем находиться на стыке эпох. От латинского radius (луч) до суффикса -omics (полный, всеобъемлющий), объединяющего целое семейство наук о больших данных — от геномики до метаболомики, прошло два столетия! Подробнее об этой «эпохе большой биологии» читайте в спецпроекте «Биомолекулы» «Мультиомиксные технологии» [6] и статье «“Омики”: эпоха большой биологии» [7].
Однако 50 лет назад эра больших данных еще не настала, и первым предзнаменованием возникновения радиомики можно считать термин «текстурный анализ», набравший популярность в 1960–70-х годах, неразрывно связанный с именем Р.М. Харалика. Текстурный анализ рассматривался как выявление и измерение признаков, характеризующих пространственную организацию элементов изображения. Он включает методы как повторения примитивов (структурный подход), так и статистические методы (вероятностный подход).
- Текстура —
- пространственная структура пикселей изображения, описывающая однородность, шероховатость, повторяемость узоров (рис. 2). Текстурный анализ — выявление и измерение текстурных признаков изображения, которые характеризуют пространственную организацию элементов.

Рисунок 2. Фрактал.
сгенерировано с помощью Gemini Flash
Вплоть до 2010-х годов текстурный анализ развивался в рамках цифровой обработки изображений, например, для дистанционного зондирования Земли [8]. Термин «радиомика» является логичным продолжением подходов текстурного анализа, умноженным на большие данные и машинное обучение. Сам термин «машинное обучение» появился в 1959 году. Его ввел исследователь искусственного интеллекта Артур Самуэль, который также разработал первую самообучающуюся программу — игру в шашки. Самуэль определял машинное обучение как способность компьютеров осваивать новое поведение без явного программирования для каждой задачи. История машинного зрения и его прихода в биологию описана в статьях «История развития искусственного интеллекта и его пришествия в биологию» [9] и «Глаза прогресса: как глубокое обучение помогает видеть невидимое для человека» [10].
Термин big data вызывает стойкие ассоциации:и: огромные дата-центры, вычислительные мощности, позволяющие рассчитывать и интерпретировать колоссальные наборы данных. Такой подход открыл новую эпоху для научного метода. Следует отметить, что впервые термин «радиомика» прозвучал в статье «Radiomics: extracting more information from medical images using advanced feature analysis» (2012) [11]. Теперь можем смело вводить определение радиомики:
- Радиомика —
- это направление в медицине, которое извлекает количественные характеристики (признаки) из медицинских изображений с помощью алгоритмов. В отличие от традиционной лучевой диагностики, где врач описывает снимок словами («очаговое образование округлой формы»), радиомика превращает изображение в тысячи чисел: форму, текстуру, интенсивность и т.д. Эти признаки затем анализируются для создания моделей, предсказывающих диагноз или прогноз.
Например, при КТ органов грудной клетки радиомика может превратить область с подозрительным образованием в набор измерений: насколько «серой» выглядит опухоль, насколько она однородная или «шероховатая», насколько четкие у нее границы. Эти числа помогают заметить различия, которые глаз не всегда улавливает, и иногда позволяют точнее отличить рак от воспаления.
Как и в любой области, научный успех нового направления нельзя представить без стандартизации. Это может быть создание общего протокола проведения исследований, единой метрики оценки качества экспериментальных данных. Огромное значение имеет воспроизводимость результатов исследования. Любой ученый, если захочет пойти вашим путем, должен иметь достаточно данных, чтобы понять «рецепт» и получить похожие результаты. Однако, когда речь идет о медицинских данных, все несколько сложнее. Как соединить огромный пласт клинических данных, ученых-теоретиков, врачей и предоставить общий доступ для всех, но при этом не нарушать медицинскую тайну?
Эта проблема породила целый ряд научных инициатив, направленных на создание универсальных экспериментальных и теоретических метрик. Одной из таких инициатив можно считать базу данных The Cancer Imaging Archive — TCIA. На сайте представлены анонимизированные снимки различных модальностей, собранных более чем в 180 коллекций с аннотациями и клиническими данными 45 000 пациентов. С таким набором данных два независимых исследователя смогут прийти к общему результату, усовершенствовать свои разработки, найти слабые места в высказанной теории и так далее. Также создан «золотой стандарт» для снимков, данных и их интерпретации — Quantitative Imaging Network (QIN).

Рисунок 3. Пайплайн радиомики: от получения диагностического снимка до извлечения признаков и анализа.
На рисунке 3 представлен подробный план радиомического анализа от снимка до модели. Основными этапами такого исследования являются получение изображений, выделение на них области интереса с патологической находкой, предобработка изображений, извлечение текстурных признаков и машинное обучение. Последнее включает отбор признаков, связанных с диагнозом, обучение модели и ее проверку. Действительно, big data и «машинное обучение» неразрывно связаны, но при этом сложно реально оценивать возможности ИИ. К примеру, использование моментального перевода видео (по сути ИИ) ощущается как технология будущего, прямая замена целого ряда профессий. Однако для видео с разговором носителей необычного диалекта или плохим произношением, ситуация может резко изменится. Слова уже не будут распознаваться с такой точностью, и придется проводить работу со словарем. Не говоря уже о возможной потере интонаций говорящих.
Значит, ИИ (в лице машинного обучения) не такой уж и всесильный, ему надо обеспечивать «хорошие» условия работы. В случае с медицинскими снимками система подготовки также будет требовать серьезных усилий. Начиная с разрешения снимка, заканчивая сегментацией области интереса. Для рентгенолога область интереса на снимке — это аномалия, которая мгновенно бросается в глаза. Опытный специалист распознает патологические изменения интуитивно, но чтобы передать эту экспертизу алгоритму, требуется сегментация — процесс точного выделения подозрительной зоны. Отдельные проблемы — артефакты на изображениях и стандартизация работы сканеров. Работа с ними требует глубокого понимания как медицинской визуализации, так и методов математического анализа. Специалист вручную настраивает параметры фильтров, используя специализированные библиотеки Python и R, чтобы алгоритм получил очищенные данные без потери биологических деталей. Завершающий этап — возврат к области интереса. Врач выделяет ключевые признаки патологии, создавая аннотации, которые позволяют искусственному интеллекту научиться различать здоровые ткани и аномальные образования с максимальной точностью.
Получается, что перед тем как подключать ИИ, человеку необходимо выполнить приличный объем работ вручную. Создается впечатление, что для работы ИИ чуть ли не должны сойтись звезды. Не хочется перекладывать лавры научного открытия на ИИ, неужели нельзя справиться самостоятельно?
Двигатель радиомики: Какую роль играет ИИ и машинное обучение?
В современном научном подходе к анализу медицинских изображений мы имеем в распоряжении множество математических методов, которые позволяют быстро и точно вычислять сотни и тысячи параметров снимков. Однако возникает важный вопрос: всегда ли есть смысл в такой грандиозной обработке? Чтобы понять это, можно провести аналогию с мешком, в котором лежит тысяча предметов. Каждый из них обладает определенной ценностью, но человеку практически невозможно одновременно оценить ее, а также найти сложные взаимосвязи и отличия между всеми этими объектами.
И тут, как усердный стажер, на помощь приходят алгоритмы машинного обучения. Им показывают тысячи снимков и «ответов» (например: норма или рак легкого). Сначала наш алгоритм «ничего не понимает», но постепенно начинает улавливать повторяющиеся признаки и закономерности: форму, контраст, текстуру, расположение очага. Этот процесс и называется обучением модели — она подстраивает свои внутренние параметры так, чтобы как можно точнее воспроизводить решения экспертов на новых примерах.
Когда обучение завершено, модель ждет экзамен: ей показывают уже незнакомые изображения, а она пытается по тем же признакам вынести заключение — есть патология или нет, к какому типу относится опухоль, насколько высок риск неблагоприятного исхода. В отличие от человека, модель не устает и не забывает редкие случаи, но при этом она целиком зависит от того, чему и как ее учили и работает по известному принципу Garbage in, garbage out (GIGO) — мусор на входе, мусор на выходе. Если в обучающих данных были «смещения» или ошибки разметки, она послушно унаследует и их — и именно поэтому к созданию и проверке таких моделей в медицине приходится относиться куда строже, чем к подготовке самого щепетильного стажера.
Представим, что почти все снимки рака легкого сделаны на одном и том же компьютерном томографе, а снимки здоровых людей — на другом. Если не уследить за этим, модель выучит не признаки опухоли, а технические особенности конкретного аппарата: шум, контраст, артефакты (так называемый батч-эффект).
- Батч-эффект —
- типичная ошибка, когда модель захватывает технические различия между наборами данных (датасетами) вместо реальных биологических признаков.
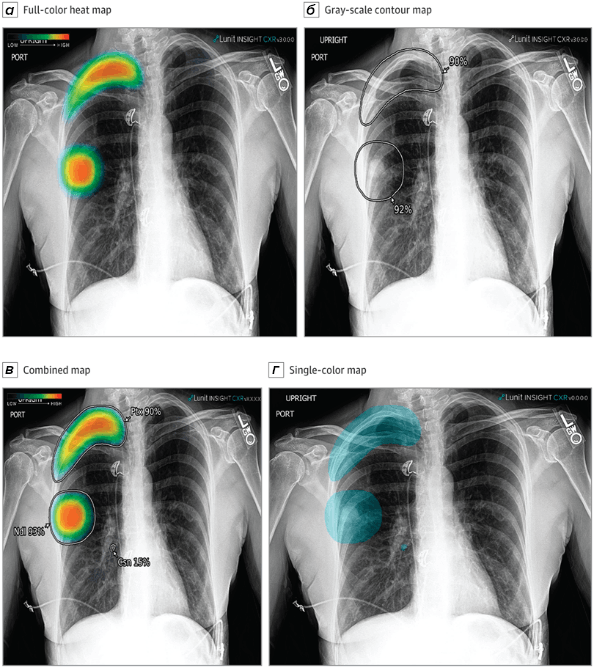
Рисунок 4. ИИ в медицинской визуализации: робот анализирует рентгеновский снимок легких. На панели (а) показана рентгенограмма грудной клетки с наложенной картой внимания (тепловой картой) — визуализацией того, на какие зоны модель обращает внимание при анализе. Цветовая шкала (от синего к красному) показывает степень важности каждого пикселя для принятия решения о диагнозе. Такие карты — это инструмент объяснимого ИИ (explainable AI), который позволяет врачу увидеть, почему алгоритм пришел к тому или иному выводу.
Отличной иллюстрацией батч-эффекта служит выступление Sameer Singh на Association for Computing Machinery (ACM). Там обсуждались границы того, насколько мы можем доверять ответам модели. На примере фотографий волков и хаски, алгоритм научился определять, кто изображен на фото, по наличию снега. Если снег есть — значит, на фото волк. Чтобы избежать подобных ошибок, в машинном обучении необходимо проверять работу алгоритма на независимом и максимально разнообразном датасете. Это дает нам слабую надежду на то, что модель научилась узнавать реальные биологические различия между изучаемыми состояниями.
Есть также дополнительная «мера борьбы» с батч-эффектом — аугментация. Суть в том, что каждый снимок во время обучения слегка меняют: поворачивают на несколько градусов, меняют контраст, добавляют шум, имитируя разные условия съемки. Это заставляет модель игнорировать несущественные детали — например, точное расположение пикселей или особенности конкретного томографа — и сосредоточиться на действительно важных признаках: форме опухоли, ее текстуре, распределении интенсивности. Если бы мы учили ребенка отличать кошек от собак, показывая только одну и ту же фотографию Мурки, он бы запомнил именно эту картинку. Но как жить без знания о том, что такое кошка? Аугментация — это как показать Мурку с разных ракурсов, в разном свете, с разными фонами, чтобы ребенок научился различать картинки Мурок и не-Мурок по их сути, как волков и хаски из прошлого примера.
Итак, наш алгоритм успешно находит область на изображении. А где здесь радиомика?
Дело в том, что в идеальном сценарии алгоритм не просто стандартизирует и выявляет на снимке подозрительную область. Он помогает подготовить данные для обучения — выбрать из тысяч радиомических признаков самые важные, которые действительно отражают биологию заболевания, а не технический шум. Алгоритмы вроде LASSO, случайных лесов, CatBoost «штрафуют» избыточные признаки, заставляя модель сосредоточиться только на нужных. Можно представить, что это как брать в сумку только действительно необходимые вещи, платя условную «цену» за каждый лишний предмет свыше заданного числа.
- LASSO (Least Absolute Shrinkage and Selection Operator) —
- алгоритм отбора признаков, который «штрафует» избыточные признаки, заставляя модель выбирать только самые релевантные.
- Случайный лес (Random Forest) —
- алгоритм машинного обучения, который создает множество решающих деревьев и объединяет их предсказания для повышения точности и снижения переобучения.
- CatBoost (Categorical Boosting) —
- библиотека для машинного обучения, разработанная компанией «Яндекс». Оптимизирована для работы с категориальными признаками. Между прочим, этот алгоритм вошел в топ самых используемых инструментов машинного обучения.
С помощью таких методов создаются разные типы моделей, подходящие для решения разных задач. Диагностические модели отвечают на вопрос «Что это?», позволяя классифицировать объекты на снимках: например, различать доброкачественные и злокачественные опухоли. Это уменьшает необходимость инвазивных процедур, таких как биопсия, и ускоряет постановку диагноза. Задачи сегментации (рис. 5) — когда модель должна выделить на снимке нужную область (опухоль, воспалительный очаг и т.д.). Это отличается от классификации тем, что мы не просто говорим «рак» или «нет», а показываем, где он находится, какова его форма и границы.Прогностические модели же помогают заглянуть в будущее — они оценивают, как заболевание будет развиваться, какой эффект даст выбранное лечение или какова вероятность рецидива. Например, используя статистические методы вроде регрессии Кокса, можно прогнозировать выживаемость пациентов без непосредственного проведения биопсии. Но как же научные статьи, в которых британские ученые доказали? Предлагаем рассмотреть некоторые из них.

Рисунок 5. Задача сегментации: схема поэтапного процесса решения.
адаптировано из [14]
А где радиомика может помочь нам в медицине?
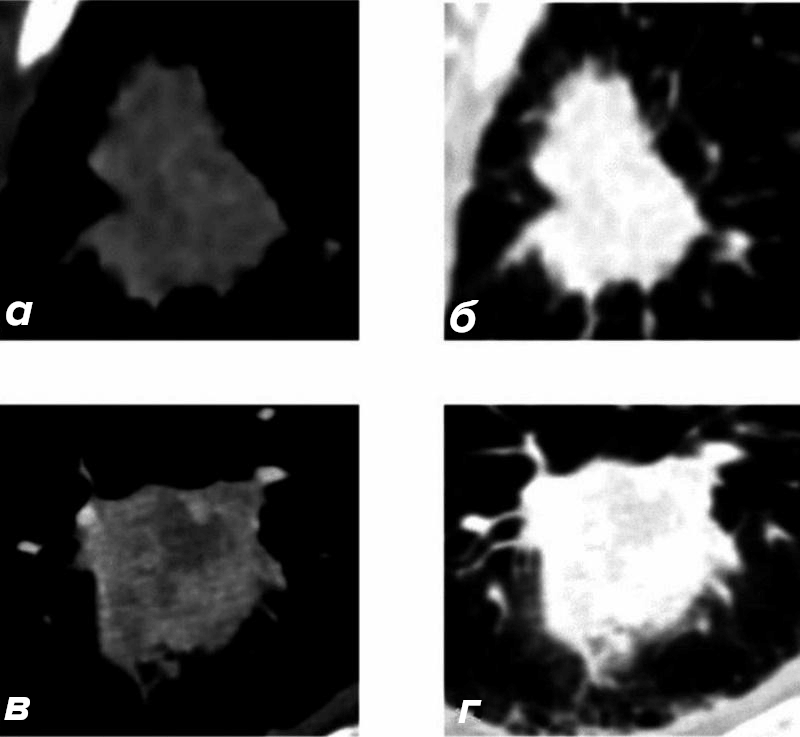
Рисунок 6. На практике радиомические модели работают с точностью выше 80–90% и могут решать задачи предсказания эффективности лечения. Это — огромное подспорье для онколога. Сверху: КТ грудной клетки 65‑летнего пациента с аденокарциномой легкого (снимки а и б). Снизу: КТ 73‑летнего пациента с плоскоклеточным раком (в и г). Для каждого снимка использованы две настройки контраста: чтобы лучше видеть мягкие ткани (а, в) и легочную ткань (б, г). Визуально оба образования крайне похожи, но радиомика улавливает скрытые различия, которые помогают определить диагноз без биопсии.
Почему именно онкология? По данным Cancer Today, заболеваемость раком любого типа в России в 2022 году составляет 248 случаев на 100 тысяч человек. Статистически пятилетняя выживаемость растет, но темпы роста скромные — всего 8% за пять лет. Таким образом, точная инструментальная диагностика смогла бы облегчить и ускорить процесс лечения для таких пациентов.
Технологии неинвазивных диагностических исследований дают возможность как можно быстрее определить статус образования и начать его лечение. В современной диагностике существует целый ряд молекулярных «маркеров», позволяющих оценивать профиль и потенциальное поведение опухолей мозга. Поиск маркеров базируется на современных методах молекулярно-генетического анализа ДНК и РНК опухолевой ткани или жидкостных биопсий (например, спинномозговой жидкости).
И вот тут использование радиомического анализа позволило бы улучшить диагностику и, как мы надеемся, прогнозы при этих заболеваниях. Когда радиомические алгоритмы начинают работать в полную силу, снимки перестают быть просто «картинками» и превращаются в источник точных подсказок для врача. Давайте уберем разберем несколько реальных историй, где это уже сработало.
Разумеется, не все так однозначно.
Радиомика в онкологии
Рак легкого —
один из самых частых типов злокачественных опухолей — имеет несколько гистологических подтипов (рис. 6). От правильной идентификации подтипа зависит выбор терапии, однако биопсия не всегда возможна или информативна. Радиомика позволяет различать эти подтипы уже на этапе КТ-сканирования.
Глиобластома —
одна из самых агрессивных опухолей головного мозга. Ее течение и ответ на лечение во многом зависят от молекулярных характеристик, например, статуса метилирования промотора гена MGMT (рис. 7). Традиционно эта информация доступна только после хирургического вмешательства и генетического анализа. Однако радиомика позволяет «заглянуть» в молекулярный профиль опухоли уже по стандартным МРТ-изображениям.

Рисунок 7. Четыре МРТ-снимка, два типа опухолей (неметилированные слева, метилированные справа) — на первый взгляд совершенно похожи. Но для нашего алгоритма неметилированные опухоли более «грубозернистые», метилированные — более «мелкозернистые». Такая «виртуальная биопсия» позволяет определить молекулярный статус гена MGMT — информацию, критически важную для выбора лечения.
Современные модели машинного обучения способны классифицировать молекулярные подтипы глиобластомы и прогнозировать выживаемость пациентов с высокой достоверностью. Эта информация достаточно необычная для врача-онколога, но важная для принятия этичных решений о дальнейшей тактике лечения и качества жизни.
Однако если есть столько позитивных примеров реализации радиомики в научных публикациях, почему не прибегнуть к ней повсеместно?
Основные проблемы и вызовы радиомики
Вот вы создали чудо-алгоритм, который идеально распознает болезнь на ваших снимках. Но отправляете его коллегам в другую клинику — и там он начинает ошибаться. Не потому, что коллеги неправильно его используют, а потому что радиомика оказывается капризнее, чем казалось.
Текстурные признаки — это как отпечатки пальцев на фотографии: один и тот же отпечаток будет выглядеть по-разному в зависимости от освещения, камеры, угла съемки. Снимите опухоль на томографе A — получите одни числа. На томографе B — совсем другие, хотя пациент и болезнь те же. Получается замкнутый круг: модель работает в лаборатории, но отказывает в реальном мире. Более того, когда мы начинаем собирать данные для обучения модели, возникает первая серьезная трудность — проблема экспертной разметки.
Для обучения нужны снимки, на которых мы точно знаем, с чем имеем дело. Но без предварительной оценки и разметки врачом мы не можем использовать эти данные. В начале этого материала упоминалась человеческая субъективность: разные врачи будут отмечать границы очага по-разному, один скажет «это воспаление», другой поспорит. Какому верить, если нет единого мнения, как выбрать «правильную» разметку? Как стандартизировать протоколы, если в каждой клинике свои аппараты, свои настройки, свои традиции? Это лишь малая часть вопросов, на которые пока нет четких ответов.
В случае решения проблем стандартизации и качества данных, исследователь столкнется со стеной. Точнее, с ящиком. Черным.
- Черный ящик (Black Box) —
- система, работа которой непрозрачна: известны вход и выход, но неясно, какие процессы происходят внутри. В контексте ИИ — модель, решения которой сложно объяснить. Как было показано в когнитивном эксперименте с «китайской комнатой», где человек, следуя четким инструкциям, как компьютер, может давать казалось бы осознанный ответ, но при этом не понимать его сути.
Чем сложнее архитектура такой сети, тем менее очевидно, на основании чего она приняла то или иное решение. В глубоких слоях сети идут сложные математические трансформации, которые даже их авторы не всегда могут объяснить.
Но есть свет в конце туннеля. Методы визуализации активации — например, карты внимания (attention maps), которые мы видели на рисунке 4 — позволяют частично «развеять туман». Такие карты показывают, на какие области снимка модель обратила внимание при принятии решения. Это не полная прозрачность, но уже возможность врачу увидеть логику алгоритма: «Ага, вот здесь сеть увидела подозрительное уплотнение, и вот здесь — еще одно». Вряд ли пациент согласится лечиться от болезни, диагностированной на основании полного мрака; но если модель хоть как-то может объяснить свои решения, доверие растет. Решение этой проблемы кроется в создании систем xAI. Объяснимый искусственный интеллект (Explainable AI, xAI) — это направление исследований и набор методов, целью которых является создание систем ИИ, способных предоставлять понятные для человека обоснования своих решений и действий. Такие системы уже существуют и тестируются — например, OpenAI o1, DeepSeek-R1 или российская T-pro 2.0.
Еще один вызов — количество данных. Да-да, иногда их может быть слишком много! Малая выборка действительно опасна: модель не получит достаточно информации и будет ошибаться. Однако большая выборка без правильной подготовки оборачивается другой бедой — переобучением.
Вспомните пример с батч-эффектом и волками и хаски на фоне снега: модель «выучила» снег как признак волка, потому что его просто было достаточно в тренировочных данных. Так же и здесь: если в большой выборке снимки рака сделаны на одном аппарате, а здоровые люди — на другом, модель не выучит признаки болезни. Вместо этого она разберется в технических особенностях каждого томографа и будет диагностировать не рак, а марку оборудования.
Получается замкнутый круг: мало данных — недообучена, много данных без должной проверки — переобучена. И в обоих случаях на реальных пациентах модель будет давать ошибки. Но история учит нас тому, что диагностика становится точнее.
Проблема внедрения: почему красивые результаты не спешат в клинику
Когда ученый публикует отличный результат в журнале, это одновременно и конец пути, и — его начало. История знает множество примеров, когда блестящее открытие ждало внедрения десятилетиями.
Возьмем коронарную ангиографию — метод визуализации сосудов сердца. Первый успешный тест провели в 1958 году, и метод сразу показал огромный потенциал. Но массово его начали применять только в 1970-х — через 15 лет. Почему? Потому что нужны были безопасные катетеры, лучшие рентгеновские системы, опыт врачей.
Компьютерная томография сосудов (КТ-КАГ) ждала еще дольше. Первые томографы были в 1971-м, но способные уловить «полет» сердца — только в конце 1990-х. Первые научные доказательства эффективности — начало 2000-х. А в официальные рекомендации врачей метод включили только к концу 2010-х — через 15–20 лет после научных доказательств! Все это время врачи ждали крупных клинических испытаний (PROMISE, SCOT-HEART), подтверждения безопасности, обучения персонала, одобрения регуляторов. Как пишут в Nature Reviews Cardiology [17]: в среднем от первых результатов до внедрения проходит 17 лет.
Радиомика окажется в той же ситуации. Врач не может использовать инструмент, пока его эффективность не доказана черным по белому, а применение — вопрос нажатия кнопки. Поэтому радиомике предстоит долгий путь: многолетние испытания, проверка в разных клиниках, подтверждение безопасности, развертывание и работа с целевой аудиторией.
Но хорошая новость: ученые уже работают над тем, чтобы ускорить этот путь. Созданы стандарты качества (RQS), методы нормализации данных (чтобы результаты работали везде, а не только в одной лаборатории) и международные инициативы (IBSI), которые помогают исследователям делать работу правильно с самого начала. Это не волшебство, но это помогает: вместо того чтобы ждать 17 лет, мы хотя бы можем сократить время и избежать тупиков.
Решение проблем радиомики: шаг за шагом
RQS — чек-лист качества
чтобы навести порядок в быстро растущем поле радиомики, нужен был единый критерий: как отличить добротное исследование от вклада в индекс хирша автора? в 2017 году филипп ламбин — бельгийский радиоонколог, который в свое время и ввел термин «радиомика», — предложил решение: radiomics quality score (rqs) [18].
Ламбин — профессор радиотерапии в Маастрихтском университете, один из пионеров количественного анализа медицинских изображений. Именно его статья 2012 года дала радиомике официальное определение и задала направление всей области. Теперь он решил дать ей еще и стандарт качества.
Как работает RQS? Это чек-лист из 16 пунктов, по которым оценивается методология исследования. Максимальный балл — 36. Чем выше балл, тем надежнее результаты:
-
Больше 20 баллов — отличное методологическое качество;
-
10–20 баллов — среднее, есть вопросы;
-
Меньше 10 баллов — неудовлетворительно, результатам доверять рискованно.
Например, RQS проверяет: была ли внешняя валидация модели? То есть тестировали ли ее на данных из другой клиники, а не только на «домашних» снимках. Если нет — минус баллы, потому что риск переобучения слишком высок.
А кто заставляет этим пользоваться? Формально RQS — добровольный инструмент. Никто не запрещает опубликовать статью без него. Но на практике ведущие журналы (Radiology, European Radiology, Radiomics и другие) все чаще требуют от авторов указывать RQS-балл или хотя бы следовать его логике. Рецензенты используют RQS как ориентир: если исследование набирает меньше 10 баллов, шансы на публикацию в топовом журнале резко падают. Это не жесткий барьер, но сильный фильтр: хочешь, чтобы тебя воспринимали серьезно — покажи, что методология в порядке.
RQS 2.0: что изменилось? К 2025 году радиомика накопила новый опыт и новые проблемы [19]. Вышла обновленная версия — RQS 2.0, которая добавила критерии, о которых раньше не задумывались:
-
Объяснимость — можно ли понять, на основании чего модель приняла решение?
-
Контроль смещений — учтены ли возможные искажения в выборке (например, по полу, возрасту, этнической принадлежности)?
-
Гармонизация — проводилась ли коррекция данных из разных клиник?
Цель остается прежней: перевести радиомику из «красивых результатов в журналах» в реальный клинический инструмент. Но теперь планка выше, а требования — строже. Хотелось бы остановиться чуть подробнее на коррекции данных при работе алгоритма в разных клиниках. В первую очередь это — нормализация изображения или признаков. Нормализация корректирует интенсивность изображений, делая их сравнимыми [20]. Из известных методов можно выбрать min-max и z-score. При min-max нормализации признаки переводятся в масштаб [0;1]. Z-score нормализация (стандартизация) преобразует данные к распределению с нулевым средним и единичным стандартным отклонением.
Процедуру нормализации данных можно сравнить с переводом единиц измерения к одной шкале, например, создание единой системы СИ в физике, чтобы любой ученый мог понять предоставляемый результат.
К нашему сожалению, биологические вариации слишком сложны и неоднородны для того, чтобы избавиться от артефактов и «выбросов» в данных только простой «подгонкой» в одну СИ. После нормализации снимков остается серьезная проблема: разные клиники используют разные аппараты и протоколы, поэтому наборы данных могут отличаться систематически. Специальные алгоритмы гармонизации, такие как ComBat [21], «выравнивают» эти различия, как бы приводя признаки к общему знаменателю в зависимости от того, где и как был сделан снимок. Это повышает шансы, что модель, обученная на данных одного центра, будет работать и в другом, а найденные закономерности отражают реальную биологию, а не особенности конкретного томографа. При этом важно не «пересолить»: чрезмерная корректировка способна стереть и часть настоящего биологического сигнала, поэтому гармонизация всегда требует осторожности и проверки. Однако же алгоритм гармонизации не может решить проблему вариативности без единого стандарта получения и обработки самих изображений. Значит, надо его создать!

Рисунок 8. Иллюстрация алгоритма ComBat: гармонизация радиомических признаков в МРТ.
рисунок автора
Инициатива IBSI
Инициатива по стандартизации изображений (Image Biomarker Standardisation Initiative, IBSI) представляет собой международный консорциум, созданный для обеспечения воспроизводимости количественных признаков, извлекаемых из медицинских изображений. Это независимая международная коллаборация, работающая по принципу open science (открытой науки). В консорциум входят более 20–25 стран (преимущественно Европа и Северная Америка). Это десятки ведущих исследовательских центров мира. Среди них — Гарвардская медицинская школа (США), Немецкий центр исследования рака (DKFZ), Университет Маастрихта (Нидерланды), Мемориальный онкологический центр им. Слоуна-Кеттеринга (США) и многие другие.
Если упростить, IBSI работает как «Палата мер и весов» для медицинских алгоритмов. Их работа строится на трех китах:
-
Единая математика (стандартизация определений). Раньше каждый программист мог по-своему написать формулу для расчета, например, «энтропии» изображения. IBSI выпустил огромный справочник (manual), где жестко прописал математику для сотен признаков.
-
Эталонные тесты (бенчмаркинг). Принципы мало прописать — их нужно проверить. IBSI создал специальные физические фантомы, изготовленные методами 3D-печати с контролируемой текстурой и используемые для оценки влияния аппаратных факторов (например, параметров сканирования КТ или МРТ). Помимо физических моделей для валидации существуют и цифровые. Это не настоящие снимки пациентов, а искусственно созданные цифровые объекты с заранее известными свойствами. Работает это так: разработчики софта «скармливают» этот фантом своей программе, и если программа выдает те же цифры, что и эталон IBSI — она получает знак качества (IBSI compliant). Если нет — нужно искать ошибку в коде.
-
Прозрачность отчетности. IBSI разработал строгие правила, как ученые должны описывать свои эксперименты в статьях. Нельзя просто написать «мы проанализировали снимки». Нужно указать десятки технических параметров (как фильтровали шумы, как форматировали изображение и т. д.), чтобы любой другой ученый мог повторить этот опыт. Помним про рецепты и воспроизводимость в науке!
Основу IBSI составляет последовательно обновляемый документ, в котором строго формализованы определения радиомических признаков. В версии 2.0 (2023) описаны математические выражения для более чем 100 признаков. На сайте также публикуются результаты независимой верификации популярных радиомических платформ (включая PyRadiomics и другие), что позволяет пользователям выбирать инструменты, совместимые со стандартами IBSI, и настраивать их в соответствии с рекомендованными протоколами.
Таким образом, сайт IBSI выполняет функцию не просто информационного репозитория, а инфраструктурного компонента радиомической экосистемы, обеспечивающего сопоставимость данных между центрами, воспроизводимость результатов.
Это все задает радиомике вектор для дальнейшего развития. А куда?
Будущее радиомики
Радиомика должна стать частью повседневной клинической практики — надежным инструментом поддержки врачебных решений, опирающимся на достоверные и стандартизованные данные. Для этого необходимы четыре ключевых шага:
-
Единые стандарты. Применение и дальнейшее развитие международных протоколов (например, IBSI и RQS) обеспечит сопоставимость и воспроизводимость результатов между центрами и исследованиями.
-
Улучшение обработки данных. Автоматическая сегментация, нормализация, гармонизация, отработка алгоритмов извлечения и валидации признаков позволят сократить техническую вариативность и повысить биологическую релевантность радиомических признаков.
-
Обучение кадров. Конечным пользователям нужны практические программы по радиомике и интерпретации моделей ИИ, чтобы результаты исследований были понятны, наглядны и полезны.
-
Междисциплинарное сотрудничество. Тесная кооперация исследователей, клиницистов и биомедицинских инженеров обеспечит разработку инструментов, полезных в реальной практике, и ускорит их внедрение.
История медицины показывает: смелые идеи часто требуют времени, прежде чем стать стандартом. Пример таргетного лечения рака иллюстрирует, как ранее недостижимые цели превращаются в рутинную клиническую опцию. В статье «Биомолекулы» «Прямая атака в центр опухоли» [22] подробно разбирается этот метод. По аналогичной траектории радиомика может из научной концепции превратиться в практический инструмент персонализированной медицины, раскрывающий скрытые слои биологии заболеваний.
В России уже есть примеры активного внедрения ИИ в клиническую практику. Московский эксперимент по компьютерному зрению на протяжении пяти лет предоставляет врачам-рентгенологам доступ к передовым алгоритмам — подробнее об этом можно прочитать в статье «Заглянем в окошко московской кибер-поликлиники» [23].
Литература
- Увидеть то, что неподвластно глазу: как радиомика помогает врачам в диагностике опухолей;
- 12 методов в картинках: нейробиология;
- A. A. Uchevatkin, A. L. Yudin, N. I. Afanas'yeva, E. A. Yumatova. (2020). Shades of grey: how and why we make mistakes. Medicinskaâ vizualizaciâ. 24, 123–145;
- Joann G. Elmore, Sara L. Jackson, Linn Abraham, Diana L. Miglioretti, Patricia A. Carney, et. al. (2009). Variability in Interpretive Performance at Screening Mammography and Radiologists’ Characteristics Associated with Accuracy. Radiology. 253, 641–651;
- Christopher G. Schwarz. (2021). Uses of Human MR and PET Imaging in Research of Neurodegenerative Brain Diseases. Neurotherapeutics. 18, 661–672;
- Мультиомиксные технологии;
- «Омики» — эпоха большой биологии;
- T. Blaschke. (2010). Object based image analysis for remote sensing. ISPRS Journal of Photogrammetry and Remote Sensing. 65, 2–16;
- История развития искусственного интеллекта и его пришествия в биологию;
- Глаза прогресса: как глубокое обучение помогает видеть невидимое для человека;
- Philippe Lambin, Emmanuel Rios-Velazquez, Ralph Leijenaar, Sara Carvalho, Ruud G.P.M. van Stiphout, et. al. (2012). Radiomics: Extracting more information from medical images using advanced feature analysis. European Journal of Cancer. 48, 441–446;
- Kapishnikov A.V. & Surovcev E.N. (2023). Magnetic resonance imaging for the differential diagnosis of primary extra-axial brain tumors: a review of radiomic studies. Digital Diagnostics. 4, 529–542;
- Jong Seok Ahn, Shadi Ebrahimian, Shaunagh McDermott, Sanghyup Lee, Laura Naccarato, et. al. (2022). Association of Artificial Intelligence–Aided Chest Radiograph Interpretation With Reader Performance and Efficiency. JAMA Netw Open. 5, e2229289;
- Ahmed Hosny, Chintan Parmar, John Quackenbush, Lawrence H. Schwartz, Hugo J. W. L. Aerts. (2018). Artificial intelligence in radiology. Nat Rev Cancer. 18, 500–510;
- Federica Palmeri, Marta Zerunian, Michela Polici, Stefano Nardacci, Chiara De Dominicis, et. al. (2025). Virtual biopsy through CT imaging: can radiomics differentiate between subtypes of non-small cell lung cancer?. Radiol med. 130, 1363–1372;
- Fabio M. Doniselli, Riccardo Pascuzzo, Massimiliano Agrò, Domenico Aquino, Elena Anghileri, et. al. (2023). Development of A Radiomic Model for MGMT Promoter Methylation Detection in Glioblastoma Using Conventional MRI. IJMS. 25, 138;
- Katie Linden, Jonathan Mailey, Aileen Kearney, Ian B. A. Menown. (2020). Advances in Clinical Cardiology 2019: A Summary of Key Clinical Trials. Adv Ther. 37, 2620–2645;
- Philippe Lambin, Ralph T.H. Leijenaar, Timo M. Deist, Jurgen Peerlings, Evelyn E.C. de Jong, et. al. (2017). Radiomics: the bridge between medical imaging and personalized medicine. Nat Rev Clin Oncol. 14, 749–762;
- Philippe Lambin, Henry C. Woodruff, Shruti Atul Mali, Xian Zhong, Sheng Kuang, et. al. (2025). Radiomics Quality Score 2.0: towards radiomics readiness levels and clinical translation for personalized medicine. Nat Rev Clin Oncol. 22, 831–846;
- Jovana Panic, Arianna Defeudis, Gabriella Balestra, Valentina Giannini, Samanta Rosati. (2023). Normalization Strategies in Multi-Center Radiomics Abdominal MRI: Systematic Review and Meta-Analyses. IEEE Open J. Eng. Med. Biol. 4, 67–76;
- Fanny Orlhac, Jakoba J. Eertink, Anne-Ségolène Cottereau, Josée M. Zijlstra, Catherine Thieblemont, et. al. (2022). A Guide to ComBat Harmonization of Imaging Biomarkers in Multicenter Studies. J Nucl Med. 63, 172–179;
- Прямая атака в центр опухоли;
- Заглянем в окошко московской кибер-поликлиники.







