Увидеть то, что неподвластно глазу: как радиомика помогает врачам в диагностике опухолей
02 июня 2020
Увидеть то, что неподвластно глазу: как радиомика помогает врачам в диагностике опухолей
- 1878
- 0
- 2
Врач-радиолог проводит обследование пациента с помощью магнитно-резонансной томографии (МРТ). На мониторах в режиме реального времени отображаются полученные снимки головного мозга пациента.
-
Автор
-
Редакторы
За последний век медицина совершила гигантский скачок, и теперь врачи успешно лечат нас от множества болезней, смертельных еще для наших прадедушек и прабабушек. Средняя продолжительность жизни в развитых странах за последние 100 лет выросла в полтора раза. Одна из причин — развитие неинвазивных средств диагностики, показывающих полную картину заболевания. В распоряжении современных врачей теперь есть не только методы биохимического анализа, но и самые передовые возможности визуализации: магнитно-резонансная томография, компьютерная томография, позитрон-эмиссионная томография и другие. В последние годы стимулом для развития медицины стали достижения в области искусственного интеллекта. Научный сотрудник лаборатории Philips Innovation Labs Rus Федор Мушенок рассказал «Биомолекуле» о радиомике — новом направлении, которое сочетает в себе преимущества методов экспертной визуализации и data science.
Немного теории
Магнитно-резонансная томография (МРТ) — метод получения диагностических медицинских изображений, основанный на явлении ядерного магнитного резонанса (ЯМР) . Исследуемый объект помещается в магнитное поле, которое превосходит поле Земли в десятки тысяч раз. Под его воздействием магнитные моменты ядер (спины) протонов в молекулах воды начинают прецессировать, то есть вращаться вокруг силовых линий этого магнитного поля с определенной частотой. Характер прецессии будет зависеть от того, в каких химических связях состоят молекулы воды. Воздействуя на прецессирующие протоны высокочастотным электромагнитным полем, можно оценить микроскопические свойства клеток и тканей, в которых находятся эти молекулы воды. Таким образом можно составить трехмерный «магнитно-резонансный портрет» исследуемого объекта. Этим методом лучше всего визуализируются ткани с высоким содержанием воды — например, головной мозг.
«Биомолекула» уже рассказывала о МРТ в статье «Нейробиология» [1] цикла «12 биологических методов в картинках». Там же можно почерпнуть базовую информацию и о КТ, и о ПЭТ.
В том же цикле мы рассказали, что ЯМР используют и для определения пространственной структуры биомолекул: «12 методов в картинках: структурная биология» [2].
Компьютерная томография (КТ) — другой популярный и широко распространенный метод медицинской визуализации, основанный на явлении поглощения рентгеновских лучей электронами атомов. Ткани организма могут различаться как удельной плотностью, так и химическим составом. В результате они будут по-разному поглощать проходящие через них рентгеновские лучи. Измеряя степень их поглощения каким-либо объектом с нескольких сторон, можно восстановить (то есть вычислить) внутреннее распределение коэффициента поглощения и тем самым создать трехмерную карту тканей.
Позитронно-эмиссионная томография (ПЭТ) — это метод диагностики, применяемый в ядерной медицине. Чаще всего его используют в онкологии для получения изображений опухолей и метастазов. Пациенту вводят внутривенно раствор, в котором содержится радиоактивный маркер в очень низкой концентрации. В опухолях обмен веществ проходит гораздо быстрее, чем в здоровых тканях, поэтому пораженные клетки захватывают больше радиоактивного маркера, чем все остальные. Сканер ПЭТ улавливает лучи, испускаемые радиоактивным препаратом в тканях, а компьютер формирует снимки. Таким образом можно с высокой точностью определить расположение скрытых в организме опухолей.
Оптическая томография (ОТ) — вид томографии, использующий для визуализации оптическое (лазерное) излучение инфракрасного и видимого диапазонов. Однако в отличие, например, от рентгеновского, взаимодействие оптического излучения со средой носит более сложный характер: кроме поглощения здесь присутствуют рассеяние, преломление, отражение и другие процессы. Это, с одной стороны, сильно усложняет задачу визуализации, а с другой — потенциально позволяет получить больше информации. Сегодня наиболее перспективные объекты для таких исследований — женская молочная железа, головной мозг новорожденного, конечности (пальцы и предплечье), отдельные клетки. Кстати, «Биомолекула» об этом методе уже писала: «Оптическая томография: проблемы и перспективы» [3].
В этом материале мы сконцентрируемся на применении радиомики в рамках первых двух методов исследований — МРТ и КТ.
С чего началась радиомика в медицине
В конце XIX века руководитель физического института Вюрцбургского университета Вильгельм Конрад Рентген сообщил об открытии ранее неизвестного вида излучения. Обнаруженные Х-лучи обладали интересными свойствами: вызывали свечение солей бария, легко проникали через многие материалы и засвечивали фотобумагу, завернутую в плотную светонепроницаемую упаковку. Одной из демонстраций этих удивительных свойств стал полученный в Х-лучах снимок руки одного из коллег Рентгена — Альберта фон Келликера (рис. 1). На этом снимке отчетливо видны кости ладони и кольцо на безымянном пальце, а мягкие ткани лишь отбрасывают слабые тени. Сегодня X-лучи известны нам как рентгеновское излучение — вид электромагнитных волн с частотами от 2×1015 до 6×1019 Гц. А идея использования этих лучей в диагностике оказалась настолько плодотворной, что вылилась в отдельную область — радиологию: раздел медицины, в котором различные виды излучения используются для диагностики заболеваний. Эта наука также изучает, каким образом излучение может быть использовано для лечения заболеваний (радиотерапия) и описывает способы устранения последствий облучения живых организмов.
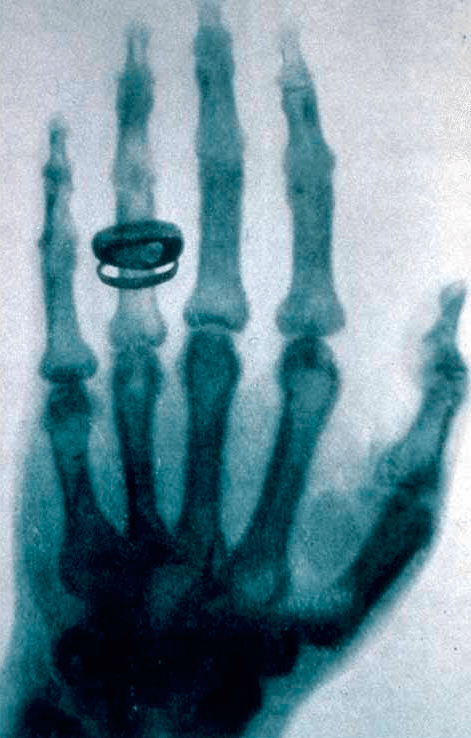
Рисунок 1. Снимок руки Альберта фон Кепликера, сделанный Рентгеном 23 января 1896 года
Каждое радиологическое обследование условно состоит из двух этапов. Первый этап — получение самого изображения — кардинально изменился со времен Рентгена в лучшую сторону. Сейчас врачи-радиологи располагают целым арсеналом различных методов исследований, что позволяет визуализировать практически все ткани в теле человека (рис. 2). Высокое разрешение снимков дает возможность рассматривать даже крошечные анатомические особенности и патологии.
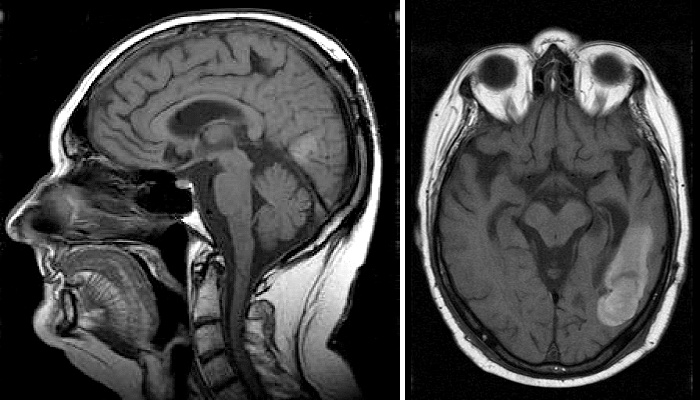
Рисунок 2. МРТ-снимки головного мозга человека, полученные в двух взаимно перпендикулярных плоскостях: сагиттальной (слева) и аксиальной (справа). На аксиальном изображении в правой нижней четверти видна светлая область неправильной вытянутой формы — патологическое новообразование. В данном случае это злокачественная опухоль — глиобластома.
открытый датасет The Cancer Genome Atlas Glioblastoma Multiforme (TCGA-GBM)
Второй этап радиологического обследования — анализ изображений — изменился не так сильно. На этом этапе специалисты–радиологи рассматривают полученные изображения и делают выводы о наличии заболеваний. Несмотря на то, что такой подход успешно используется с момента возникновения радиологии, он все же имеет некоторые недостатки. Во-первых, этот метод субъективен и основан на знаниях и опыте врача. Во-вторых, заключение специалиста содержит, по большей части, качественную оценку. В то же время переход к персонализированному лечению, о котором сегодня медицинское сообщество говорит все чаще, требует не только качественных, но и количественных характеристик.
В 2012 году был предложен новый подход к анализу МРТ и КТ изображений, способный кардинально изменить процесс диагностики по снимкам [4], [5]. Он лежит на стыке радиологии, компьютерных наук и математической статистики, а название ему — радиомика. Специалисты предположили, что медицинские изображения содержат недоступные для невооруженных глаз сведения. Эта «скрытая» информация может быть извлечена, если к полученным изображениям применить ряд математических преобразований. Результаты этих преобразований — так называемые «признаки» изображений (англ. features) — в свою очередь могут коррелировать с патофизиологическими свойствами (то есть с изменениями, указывающими на возможное развитие патологий), которые не видны на изображениях. Знание патофизиологических свойств позволяет лучше понять особенности заболевания в каждом конкретном случае и выбрать оптимальный способ лечения. Наиболее перспективна радиомика для диагностики и лечения онкологических заболеваний. К примеру, ее методы позволяют определить фенотип злокачественной опухоли, не прибегая к инвазивной процедуре биопсии, и выбрать лекарство, эффективное против именно такого типа опухолей [6]. По сути, радиомика предсказывает микроскопические параметры исследуемых тканей из макроскопических изображений исследуемого объекта. Этот процесс можно сравнить с предсказанием химического состава кучи песка по фотографии этой кучи.
На самом деле у врачей есть и другие способы узнать патофизиологические свойства ткани. Для этого необходимо взять ее небольшой образец и проанализировать его под микроскопом. Такой способ, несмотря его высокую информативность, имеет несколько существенных недостатков. Во-первых, процедура взятия образца ткани (биопсия) зачастую травматична, связана с риском осложнений и не всегда возможна. Во-вторых, этот способ дает лишь «точечную» оценку свойств тканей и не характеризует всю область целиком. Это может давать искаженные результаты, что снижает точность диагностики.
Как это устроено
Цель радиомики — создание математических моделей и компьютерных алгоритмов, которые принимают на вход медицинские изображения (например, МРТ- или КТ-снимки) и выдают патофизиологические особенности тканей. Чтобы создать такую модель, исследователи должны пройти несколько этапов.
Прежде всего, необходимо сформулировать клиническую задачу — что именно мы хотим предсказывать из получаемых изображений? На этом этапе ученые тесно сотрудничают с врачами и выясняют, какие характеристики необходимо прогнозировать. К примеру, это может быть определение фенотипа опухоли для выбора оптимальной тактики лечения, оценка восприимчивости к конкретному препарату или предсказание вероятности развития побочных эффектов от терапии.
На следующем этапе проводится подготовка данных — необходимо собрать базу медицинских изображений, релевантных для поставленной задачи. Например, это могут быть МРТ-снимки пациентов, которые получали определенный вид терапии, а для каждого из них должно быть известно, оказался ли человек восприимчив к этому лечению или нет.
Далее проводится разметка данных — на каждом отобранном изображении необходимо выделить и обвести контуром интересующую область, для которой будут рассчитаны признаки (рис. 3). Зачастую такая область — это опухоль, обнаруженная на изображениях. Этот этап чрезвычайно трудоемкий и времязатратный. Несмотря на развитие методов компьютерного зрения, которые уже способны распознавать лица людей, разметка медицинских изображений — по-прежнему сложная задача, которая до конца не решена.
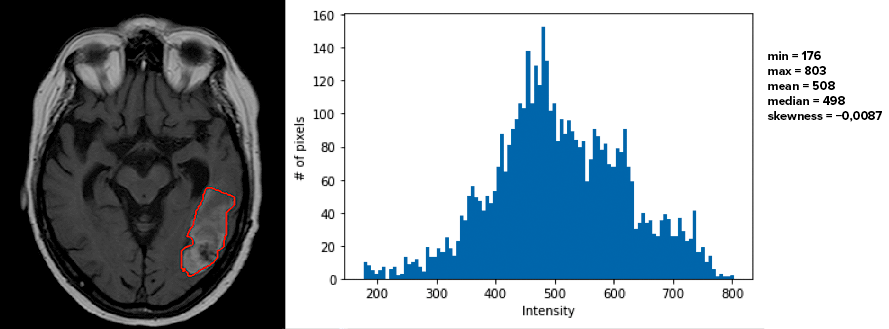
Рисунок 3. Разметка МРТ-изображений. Слева: МРТ-изображение головного мозга человека. Красным цветом выделена злокачественная опухоль. Справа: Гистограмма интенсивностей отдельных пикселей выделенной области. Значения гистограммных признаков: минимальное (min), максимальное (max), среднее (mean), медианное (median). Skewness — величина асимметрии распределения.
Затем для каждой выделенной области всех отобранных изображений рассчитываются всевозможные признаки изображений. К настоящему времени предложены десятки различных признаков. Их можно разделить на пять основных групп [7]:
- Признаки формы характеризуют геометрические особенности исследуемой области, например опухоли. К ним относятся объем, максимальный линейный размер, площадь, компактность и сферичность, а также отношения этих характеристик между собой.
- Признаки первого порядка, или гистограммные признаки, описывают статистические свойства пикселей выделенной области изображения. Такими признаками могут быть, например, максимальное, минимальное, среднее и медианное значения интенсивности в выделенной области, среднеквадратичное отклонение от среднего значения, асимметрия распределения.
- Признаки второго порядка, или текстурные признаки, описывают корреляцию значений соседних пикселей и однородность выделенной области. К примеру, высокая степень корреляции интенсивности соседних пикселей будет давать визуально «гладкую» текстуру, а их малая корреляция будет приводить к эффекту «шероховатости» выделенной области.
- Признаки более высоких порядков описывают статистические особенности изображений, полученных из исходных путем применения различных математических операций: преобразования Фурье, вейвлет-анализа, различных фильтров.
- Признаки, полученные методами машинного обучения, задаются не вручную, а подбираются автоматически алгоритмами. Полученные признаки используются для построения прогностических моделей, которые и будут предсказывать интересующую нас переменную величину. Наиболее популярные алгоритмы, используемые в радиомике, — это регрессии, различные виды решающих деревьев и нейронные сети.
Из всего множества рассчитанных признаков необходимо выбрать информативные, которые действительно коррелируют с искомой величиной, и отбросить неинформативные. Для этого используются методы математической статистики. Удаление неинформативных признаков делает результаты предсказаний более стабильными и не позволяет случайным шумам в данных оказывать влияние на принимаемое решение.
На полученных признаках строится («обучается») математическая модель, которая и будет предсказывать необходимый признак — фенотип опухоли, восприимчивость к выбранному способу лечения, вероятность развития побочных эффектов и т.д. Для этого используются методы машинного обучения — области искусственного интеллекта, изучающей методы построения параметрических алгоритмов, способных обучаться. Изначально исследователи выбирают одну из подходящих моделей (например, линейная регрессия или решающие деревья). Затем выбранная модель «обучается», то есть ее параметры варьируют так, чтобы выдаваемые предсказания были максимально точными. Процесс подбора параметров производится автоматически, с помощью специально разработанных алгоритмов. После окончания процесса обучения значения параметров модели фиксируются, и теперь она готова делать предсказания. Чтобы воспользоваться готовой моделью, необходимо провести исследования пациента и получить медицинские изображения, затем разметить интересующую область, посчитать признаки на этой области и загрузить их в уже обученную модель. Результатом этого процесса будет значение желаемой характеристики, которое может быть использовано в процессе лечения пациента.
Радиомика как новый способ обнаружить рак
Наиболее перспективное применение радиомики — это обнаружение и неинвазивная диагностика злокачественных опухолей. Именно в этой области для выбора правильной методики лечения важно знать, с каким именно типом опухоли пришлось столкнуться. Например, в работе [8] сотрудники научно-исследовательских лабораторий компании Philips совместно с врачами из крупных медицинских центров США предложили подход для диагностики рака легкого.
Лаборатория Philips Research — это глобальная сеть научно-исследовательских лабораторий, ее российское подразделение было открыто в 2017 году в Сколково. Применение искусственного интеллекта в радиологии — одно из профильных направлений деятельности лаборатории.
Рак легкого — это одно из самых часто встречающихся онкологических заболеваний. Его коварство, с одной стороны, в широкой распространенности, а с другой — в долгом периоде скрытого развития, когда заболевание никак себя не проявляет.
Оптимальное решение этой проблемы — программа скрининга граждан из групп риска (например, курильщиков) с помощью низкодозной компьютерной томографии (НДКТ) [9]. Введение такой программы увеличит количество рутинных обследований и объем работы, возлагаемой на врачей-радиологов. В работе [8] предложен подход, состоящий из двух последовательных шагов (рис. 4) и позволяющий автоматизировать процесс обработки НДКТ-изображений, получаемых в рамках скрининговых программ.
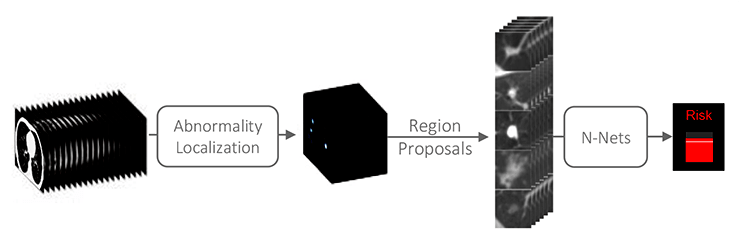
Рисунок 4. Двухэтапный процесс оценки степени злокачественности узлов, обнаруженных на низкодозных КТ-снимках. На вход поступают снимки пациентов, обследованных в рамках программы скрининга граждан из групп риска. На первом этапе (abnormality localization) алгоритм компьютерного зрения распознает специфические уплотнения («узлы»), которые потенциально могут быть первыми предшественниками злокачественного новообразования. Изображения обнаруженных уплотнений передаются на второй этап — в нейронную сеть (N-Nets), которая оценивает степень их злокачественности.
Цель первого шага — обнаружение «узлов», то есть специфических уплотнений, на НДКТ-снимках. Эти узлы могут быть как опухолями, так и складками кожи или тенью от одежды пациента.
На втором шаге обученная нейронная сеть анализирует каждый узел, обнаруженный у конкретного пациента, и выдает заключение с оценкой вероятности злокачественной или доброкачественной природы опухоли. Опухоли могут иметь различное происхождение — злокачественное или доброкачественное. Здесь необходимо концентрироваться именно на обнаружении злокачественных опухолей (это и есть тот самый рак), поскольку они наиболее опасны и требуют незамедлительной терапии или удаления. Доброкачественные опухоли, конечно, тоже нужно своевременно диагностировать. Однако их чаще можно не трогать, а лишь наблюдать у врача. Они легче поддаются лечению и достаточно медленно растут, в отличие от раковых новообразований, клетки которых способны делиться очень быстро, что часто приводит к летальному исходу, особенно если опухоль нашли на поздней стадии.
Для определения степени поражения раком отдельных узлов нейронная сеть использует сведения о размерах, текстуре и положении каждого из них. При этом набор признаков не задавался авторами, а был выведен нейронной сетью в процессе обучения на основе анализа массива разнообразных медицинских изображений. Авторы показали, что точность заключений предложенного подхода не хуже, чем у опытных врачей-радиологов.
Также радиомика может быть полезна для определения типа опухоли по медицинским изображениям (рис. 5). В работе [10] показано, что по КТ-снимкам можно выявить не только наличие опухоли, но и ее фенотип. Авторы воспользовались открытым датасетом медицинских изображений, из которого выбрали более 300 случаев немелкоклеточного рака легкого. Для каждого снимка рассчитали признаки формы, первого и второго порядков, также применили вейвлет-преобразование. Затем на основе полученных признаков и опорных векторов обучили классификатор, который предсказывал один из четырех рассмотренных диагнозов: «аденокарцинома», «крупноклеточный рак», «плоскоклеточный рак» и другие типы немелкоклеточного онкологического заболевания, объединенные в одну категорию.
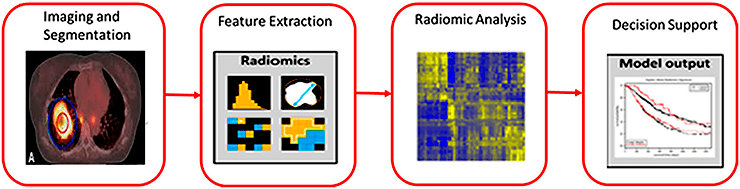
Рисунок 5. Процесс построения компьютерного алгоритма, использованный авторами. На первом этапе проводится процесс отбора изображений и выделение интересующей области (сегментация), на втором — по выделенной области рассчитываются ее признаки, на третьем — проводится статистический анализ полученных признаков, а на четвертом этапе выполняется обучение алгоритма машинного обучения и оценка его точности.
Предложенный подход показал высокую чувствительность (87%) и специфичность (89%). Это значит, что точность такого метода пока еще ниже, чем точность гистопатологического исследования (при котором образец ткани рассматривают через микроскоп). Но можно ожидать, что в ближайшем будущем эффективность этих методов сравняется.
Задел на будущее
Обнадеживающие результаты позволяют надеяться, что в скором времени радиомика станет важным диагностическим средством радиологии. На ее основе можно организовывать целые скрининговые программы: проводить КТ людям из групп риска и предоставлять алгоритмам анализ снимков. Таким образом, специалистам не придется оценивать все изображения вручную — а значит, на это будет уходить меньше времени, снизится вероятность врачебной ошибки, медики будут избавлены от возможного профессионального выгорания. Алгоритм разделит людей, прошедших скрининг, на потоки, позволит понять, у кого из них есть вероятность наличия рака, а у кого патологии нет. Разумеется, основная польза от таких программ — не столько для врачей, сколько для пациентов: с их помощью заболевание обнаруживается на ранней стадии, что в случае с раком часто становится залогом успеха лечения.
Радиомика — отличный пример того, как искусственный интеллект может дополнить работу врачей, не заменяя ее и не отменяя ее значимости. Государства и бизнес не зря вкладывают в R&D миллиарды долларов: новые достижения в области ИИ в будущем смогут вывести медицину на новый уровень. Такие технологии как радиомика позволят проводить диагностику социально значимых заболеваний раньше и точнее, а значит, сделают их менее опасными для жизни людей.
Литература
- 12 методов в картинках: нейробиология;
- 12 методов в картинках: структурная биология;
- Оптическая томография: проблемы и перспективы;
- Philippe Lambin, Emmanuel Rios-Velazquez, Ralph Leijenaar, Sara Carvalho, Ruud G.P.M. van Stiphout, et. al.. (2012). Radiomics: Extracting more information from medical images using advanced feature analysis. European Journal of Cancer. 48, 441-446;
- Virendra Kumar, Yuhua Gu, Satrajit Basu, Anders Berglund, Steven A. Eschrich, et. al.. (2012). Radiomics: the process and the challenges. Magnetic Resonance Imaging. 30, 1234-1248;
- Hugo J. W. L. Aerts, Emmanuel Rios Velazquez, Ralph T. H. Leijenaar, Chintan Parmar, Patrick Grossmann, et. al.. (2014). Decoding tumour phenotype by noninvasive imaging using a quantitative radiomics approach. Nat Commun. 5;
- Stefania Rizzo, Francesca Botta, Sara Raimondi, Daniela Origgi, Cristiana Fanciullo, et. al.. (2018). Radiomics: the facts and the challenges of image analysis. Eur Radiol Exp. 2;
- Trajanovski S., Mavroeidis D., Swisher C.L., Gebre B.G., Veeling B., Wiemker R. et al. (2019). Towards radiologist-level cancer risk assessment in CT lung screening using deep learning. arXiv;
- The National Lung Screening Trial Research Team. (2011). Reduced Lung-Cancer Mortality with Low-Dose Computed Tomographic Screening. N Engl J Med. 365, 395-409;
- Patil R., Mahadevaiah G., Dekker A. (2016). An Approach Toward Automatic Classification of Tumor Histopathology of Non–Small Cell Lung Cancer Based on Radiomic Features. Tomography. 2, 374-377.