«Бактериофаг-1 Бактериофагу-2, приём!»
13 февраля 2017
«Бактериофаг-1 Бактериофагу-2, приём!»
- 1814
- 0
- 9
рисунок Ольги Пташник
-
Автор
-
Редакторы
Темы
Как известно, вирусы — объекты странные: вроде, и не живые сами по себе, но стоит только попасть в клетку... Внутриклеточные подвиги бактериофагов описаны давно, однако эти вирусы сумели сохранить парочку секретов — настоящих жареных фактов, по меркам научной периодики. Например, в этом году мы узнали, что если фаги и не очень живые, то уж точно очень общительные: находясь в разных клетках, они методично высылают друг другу сигналы — маленькие, но судьбоносные для фагов пептиды.
Бактериофаги (или просто фаги) — это вирусы, поражающие бактерий . После впрыскивания генома фага в клетку события могут развиваться по одному из двух сценариев:
- литическому — когда фаг размножается, и армия новых его частиц бесцеремонно, нанося смертельные повреждения, покидает клетку;
- лизогенному — когда геном фага встраивается в клеточную ДНК и остается до поры до времени в неактивном состоянии, подспудно защищая клетку от вторжения конкурентов — фагов своего вида.
В зависимости от условий бактериофаг выбирает, какой сценарий в данный момент для него выгоднее. Выбор пути регулируется чрезвычайно сложными механизмами. Заподозрить это позволяет даже количество работ, посвященных этой тематике: не одна сотня статей написана об одном только фаге λ и его выборе между лизисом и лизогенией. И всё равно система принятия решения осталась непонятой [1].
Материал «Пожиратели бактерий: убийцы в роли спасителей» [2] предлагает не только разностороннее описание этих поразительных биоконструкций, но и целую галерею их электронных портретов.
Зато с принятием решений у по-настоящему живых существ, бактерий, микробиологам более-менее удалось разобраться. Оказалось, что «примитивные одноклеточные» очень даже склонны к коллективному поведению. Им они эффективно пользуются в том числе и для того, чтобы причинить неприятности «высоколобым многоклеточным». Чувство кворума, или quorum sensing — механизм, используемый бактериями для передачи от клетки к клетке сигналов, которые чаще всего несут информацию о размере популяции и регулируют его . Грамположительные бактерии для этой цели предпочитают секретировать во внешнюю среду маленький пептид (часто менее 10 аминокислотных остатков), который при попадании в клетки других членов сообщества стимулирует специфические изменения экспрессии генов [1].
До сих пор quorum sensing считался прерогативой бактерий, и молекулярную коммуникацию между вирусами, находящимися в разных клетках, не обнаруживали.
Подробнее о чувстве кворума и возможных способах подавления химических сигналов патогенов «биомолекула» рассказывала в статье «Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение» [3].
Удивительная случайность (как всегда)
Израильская ученая Зохар Эрез с коллегами изучала бактерий, зараженных фагами группы SPbeta: пыталась обнаружить, секретируют ли Bacillus subtilis какие-либо молекулы, подготавливающие собратьев к фаговой атаке. Через три часа после заражения исследователи начали ловить в бактериальной культуре молекулы, которые могли бы предотвратить дальнейшую инфекцию. К своему удивлению они выделили белок не бактериального, а фагового происхождения. Этот маленький пептид синтезировал вирус phi3T, блокируя тем самым лизис клеток и стимулируя лизогению [1], [4].
Эрез секвенировала геном бактериофага и идентифицировала ген, кодирующий нужный белок из 43-х аминокислотных остатков. Пептид получил название AimP. Он оказался поразительно похожим на сигнальные белки B. subtilis (в том числе вовлеченные в quorum sensing). Во время фаговой инфекции от синтезированного AimP ферментативно отрезался и секретировался во внешнюю среду пептид из шести аминокислот, который назвали арбитриумом (от лат. arbitrium — «решение») [1].
Бациллы обычно импортируют сигнальные пептиды в клетку с помощью олигопептидной пермеазы (OPP). Удалив ген одной из субъединиц OPP из генома бактерий (то есть «выключив» фермент), ученые установили, что арбитриум транспортируется в клетку именно таким путем [4]. Чем больше фагового сигнального пептида поступало в клетку, тем выше была вероятность, что инфекция phi3T разовьется по лизогенному сценарию. При высоких концентрациях арбитриума лизис в культуре бацилл подавлялся окончательно (рис. 1) [1].
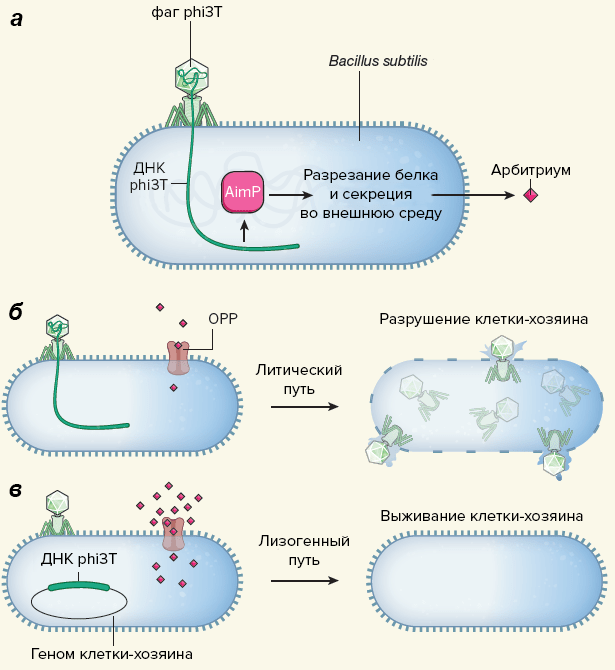
Рисунок 1. Фаги используют сигнальные пептиды для общения. а — После заражения бацилл фагом phi3T синтезируется вирусный белок AimP, от которого отрезается и секретируется из клетки маленький пептид арбитриум. б — Арбитриум попадает в другую клетку с помощью олигопептидной пермеазы, OPP. Если концентрация пептида мала, то развитие фага в этой клетке идет по литическому пути, и клетка разрушается. в — Высокая концентрация арбитриума способствует встраиванию вирусного генома в ДНК бациллы, клетка выживает, а другой phi3T уже не может ее инфицировать.
[1], рисунок адаптирован
Белки фагового кворума и их гены
Вирус phi3T изолировали 40 лет назад и отнесли к группе SPbeta-фагов. Зохар Эрез впервые изучила его геном и выяснила, что при размере 128 т.п.н. он содержит 201 ген. Ген aimP кодирует белок AimP — так называемый пре-про-пептид, который в качестве «пре-» содержит N-концевую сигнальную последовательность, распознаваемую системой секреции и во время этой сáмой секреции отрезаемую (рис. 2). Вышедший наружу про-пептид обрабатывается бактериальной протеазой, лишаясь своей «про-». В результате остается зрелый короткий пептид из шести аминокислотных остатков, которые у про-пептида располагались на C-конце: Ser-Ala-Ile-Arg-Gly-Ala (SAIRGA) [4].
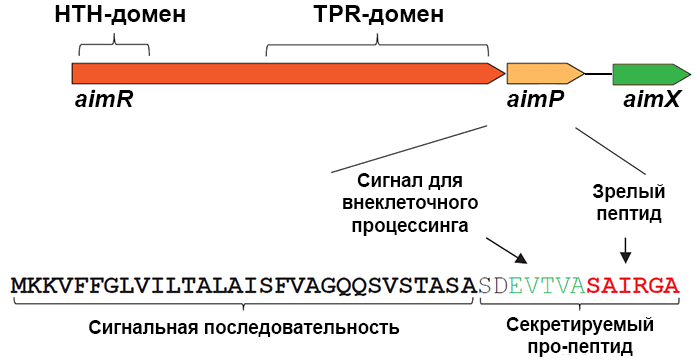
Рисунок 2. Гены кворума фага phi3T и структура белка AimP. Условные обозначения: HTH-домен — домен связывания с ДНК, TPR-домен — рецептор арбитриума.
[4], рисунок адаптирован
Чтобы показать, что SAIRGA — это и есть арбитриум, израильские ученые заражали культуру бацилл фагом phi3T при высокой концентрации SAIRGA и наблюдали явное снижение числа лизированных клеток. Эффекта не было при проведении эксперимента с более короткими версиями пептида (SAIRG или AIRGA) и с бациллярным пептидом PhrC, участвующим в бактериальном кворуме [4].
Перед aimP в геноме фага расположен ген aimR, кодирующий белок длиной 378 а.о. Выяснили, что белок AimR — это внутриклеточный рецептор арбитриума: его С-концевой домен взаимодействует с сигнальной молекулой. В то же время N-концевой домен AimR приспособлен для специфического связывания с ДНК бактериофага (рис. 2) [4].
После aimP находится ген aimX, который непосредственно участвует в выборе пути развития фага: его продукт длиной 51 а.о. каким-то образом активирует литический сценарий (рис. 2). На конце мРНК AimX находится добавочная некодирующая последовательность из 62 нуклеотидов, которая образует «шпильку» и, скорее всего, функционирует как регуляторная РНК [4].
Как работает система кворума бактериофагов?
На начальной стадии инфекции phi3T экспрессирует ранние гены — aimP и aimR. Белок AimR в виде гомодимера связывается со специфическим сайтом между aimP и aimX и активирует транскрипцию последнего (рис. 3а). В то время как новые порции AimP превращаются в арбитриум и выходят из клетки, AimX активирует литический цикл (а может, ингибирует лизогенный) — собираются фаговые частицы следующего поколения, разрушают клетку и заражают соседних бацилл [4].
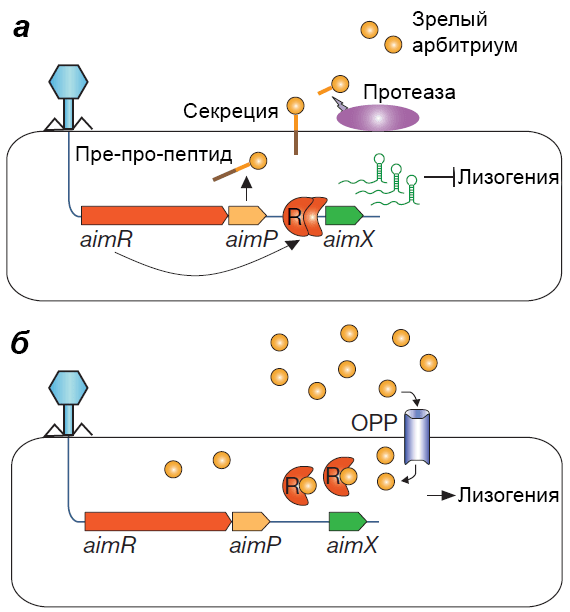
Рисунок 3. Модель работы системы quorum sensing фага phi3T. а — Развитие по литическому пути. б — Развитие по лизогенному пути. Подробные объяснения — в тексте.
[4], рисунок адаптирован
Так происходит, пока в среде не создастся достаточно высокая концентрация арбитриума. В этом случае в инфицированные phi3T клетки через транспортер ОРР будет поступать настолько много сигнального пептида, что он сможет связаться со всеми рецепторными молекулами AimR, разбить димер на мономеры и тем самым помешать ему активировать транскрипцию aimX (рис. 3б) [4].
Но зачем это нужно фагу? Логика проста. В начале фаговой атаки незараженных клеток очень много, а частиц фага мало — есть, где разгуляться. Поэтому вирусу незачем отсиживаться в клетке и бездействовать. Он активно размножается и инфицирует всё больше и больше бацилл. Наконец количество «свободных» клеток сокращается настолько, что это грозит полным уничтожением бактериальной популяции, а следовательно, и самих зарвавшихся паразитов. Именно о такой ситуации сообщает арбитриум (рис. 4). В результате вирусы «одумываются» — перестают размножаться и встраиваются в ДНК бактерий, чтобы дать возможность уцелевшим свободным клеткам нарастить популяцию. Позже цикл повторяется.
Рисунок 4. Демографическая ситуация — главный вопрос в беседах бактериофагов.
сайт www.nkj.ru и [4]
С обнаружением первой системы фаговой коммуникации пришло понимание того, что не только прокариоты, но и вирусы — не такие уж простачки. Геномы многих фагов еще не расшифрованы, и кто знает, какие новые сюрпризы преподнесут нам эти недоорганизмы? А что, если вирусы эукариот тоже общительны, и весь этот вирусный мир беседует не только о демографии?
Статья написана с участием Ольги Волковой.
Литература
- Davidson A.R. (2017). Phages make a group decision. Nature. 541, 466–467;
- Пожиратели бактерий: убийцы в роли спасителей;
- Бактерии, молчать! Как и зачем вносить помехи в межклеточное общение;
- Erez Z., Steinberger-Levy I., Shamir M., Doron S., Stokar-Avihail A., Peleg Y. et al. (2017). Communication between viruses guides lysis-lysogeny decisions. Nature. 541, 488–493.