Как исследовать клетку на уровне отдельных биомолекул
30 октября 2014
Как исследовать клетку на уровне отдельных биомолекул
- 1652
- 0
- 4
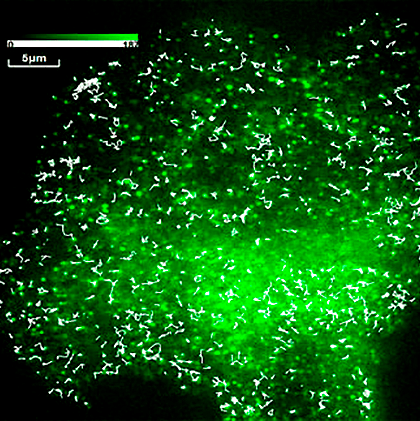
Одиночные молекулы миозина-6, помеченные GFP (зеленые пятна), на мембране живого фибробласта мыши. Белые линии — траектории движения молекул миозина-6 во время видеозаписи.
Статья на конкурс «био/мол/текст»: С развитием современных технологий идея изучать клетку на уровне отдельных молекул получила новые технические возможности. Современные методы микроскопии позволяют увидеть, как выглядят клетки, их органеллы (световая микроскопия) и даже отдельные молекулы внутри фиксированных клеток (электронная микроскопия). Использование флуоресцентных меток позволяет увидеть отдельные молекулы в живых клетках с помощью световой микроскопии, а использование сверхчувствительных видеокамер и компьютерных программ для обработки видеозаписей дает возможность судить о функциях конкретных молекул.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Своя работа».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Изучение функций биомолекул требует применения разнообразных биохимических, биофизических и генетических методов. Важнейшую роль в изучении функций клетки играют нанотехнология и микроскопия высокого разрешения. Для того, чтобы понять механизм функционирования биомолекул, недостаточно определить последовательность аминокислот в исследуемом белке. Необходимо знать, как биомолекулы взаимодействуют друг с другом, и лучше всего это увидеть.
В течение трех столетий световая микроскопия проделала огромный путь от светского развлечения до неотъемлемой части экспериментальной биологии и медицины. За это время кардинально усовершенствовалась не только оптика, но и методы подготовки и исследования препаратов. Современная микроскопия позволяет наблюдать за живыми клетками и их органеллами, а также исследовать отдельные биомолекулы внутри клеток. В настоящее время достигнут впечатляющий прогресс в области визуализации клеточных процессов с использованием флуоресцентных меток, прикрепленных к функциональным белковым молекулам. Важность микроскопии одиночных молекул была подчеркнута присуждением Нобелевской премии в 2014 году Штефану Хеллю (Stefan Hell), Эрику Бетцигу (Eric Betzig) и Уильяму Мернеру (William Moerner) «за развитие методов сверхточной флуоресцентной микроскопии», позволяющих визуализовать отдельные молекулы с помощью флуоресцентных меток, прикрепленных к изучаемым белковым молекулам в живых клетках [1], [2]. Разработанные ими методы позволяют определять положение молекул с точностью до нанометров. Следует заметить, что методики сверхточной микроскопии создают изображение пиксел за пикселом, молекула за молекулой — несколько секунд и даже минут требуется для того, чтобы сделать одну фотографию. Однако многие жизненно важные клеточные процессы происходят за доли секунды (например, полный цикл сокращения сердца занимает меньше секунды), что ограничивает применение этих методов для изучения биологической динамики в живых клетках.
Флуоресцентная микроскопия полного внутреннего отражения
Одним из альтернативных методов, позволяющих изучать не только распределение одиночных молекул, но и их «поведение», в том числе подвижность и взаимодействие с другими молекулами, является Флуоресцентная Микроскопия Полного Внутреннего Отражения (ФМПВО) [3].
Если луч лазера направить на границу раздела стекла и воды под острым углом (62–64°), то свет полностью отразится обратно в стекло, но в тонком слое воды, прилегающем к стеклу, возникнет так называемое «эванесцентное поле» — электромагнитное излучение с той же длиной волны, что и у используемого лазера. Если мы поместим изучаемую клетку на поверхность стекла, то участки мембраны и тонкий слой цитоплазмы клетки — толщиной около 100 нм — будет освещаться созданным «эванесцентным полем». Следовательно, меченые биомолекулы, прикрепленные к мембране, прилегающей к стеклу, или плавающие в цитоплазме около мембраны, будут излучать свет, а все остальные метки останутся «в темноте», позволяя в десятки раз улучшить соотношение сигнал-шум, критичное для визуализации одиночных молекул. Разрешение этого метода позволяет определять положение молекул с точностью до 10 нм. Для метода ФМПВО подходят культуры клеток, растущие на субстрате, свежевыделенные клетки (так называемые первичные культуры), а также срезы живой ткани, где молекулы на мембране клеток могут быть помечены специфичными флуоресцентными метками снаружи (рис. 1).
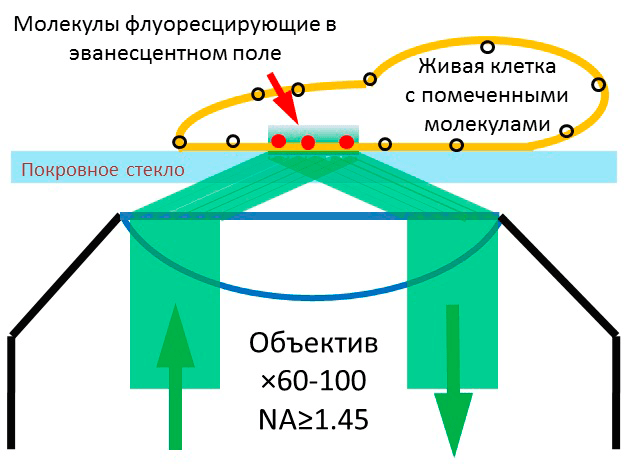
Рисунок 1. Флуоресцентная микроскопия полного внутреннего отражения (ФМПВО). Луч лазера, сфокусированный в обратной фокальной плоскости объектива, освещает покровное стекло под острым углом (≥62°), так что весь свет отражается обратно в объектив, создавая тонкий слой освещения на границе раздела вода—покровное стекло. Флуоресцентные молекулы у мембраны клетки, попавшие в эванесцентное поле, излучают свет, собираемый объективом.
Изучение функций одиночных биомолекул осложнено хаотичностью движений и вероятностной природой взаимодействий между отдельными молекулами. Кроме того, флуресцентные метки необратимо теряют способность генерировать флуоресценцию — «выцветают» под воздействием интенсивного лазерного освещения. Следовательно, необходимо собрать информацию о нескольких тысячах одиночных молекул для того, чтобы сделать статистически обоснованные выводы о поведении изучаемых молекул. Для этого необходимо применять автоматические алгоритмы регистрации и трассировки одиночных молекул, похожие на те, что используются методами сверхточной микроскопии.
В этой статье я приведу примеры своих исследований молекул молекулярного «мотора» миозина-6 и ацетилхолиновых мускариновых рецепторов (М2), отвечающих за регулировку сердечного ритма.
Исследование отдельных молекул миозина-6
Миозин-6 относится к многочисленному семейству немышечных миозинов, которые делятся на 17 подклассов. Все миозины являются молекулярными моторами и имеют схожее строение, но выполняют различные функции в клетках одноклеточных и многоклеточных растений и животных. Самый известный и изученный миозин — это мышечный миозин-2, ответственный за мышечное сокращение. Все миозины имеют моторный домен — головку, которая гидролизует АТФ и присоединяется к актиновым филаментам, выполняя механическую работу (например, перемещаясь по актиновому филаменту). Самое большое различие у миозинов разных классов имеет строение «хвоста», который позволяет выполнять специфичные функции. Так, например, миозин-1 отвечает за адаптационный ответ в стереоцилях, миозин-5 транспортирует везикулы, а миозин-7 необходим для формирования стереоцилей во внутреннем ухе у мышей. Миозин-10 локализуется в кончиках филоподий и необходим для роста нервных окончаний.
Я изучала миозин-6, который уникален тем, что, в отличие от большинства других миозинов, перемещается не к плюсовому, а к минусовому концу актинового филамента. Миозин-6 необходим для процесса эндоцитоза, который состоит в том, что небольшой участок клеточной мембраны втягивается в цитоплазму и образует пузырек (везикулу). Образованная везикула «отпочковывается» от основной мембраны и транспортируется в другие части клетки. Конкретный механизм действия миозина-6 не изучен.
Для изучения деталей функционирования миозина-6 я заражала культуру клеток фибробластов мыши и эндотелиальных клеток человека ДНК, кодирующей миозин-6, связанный с зеленым флуоресцентным белком (GFP) [5].
Одиночные молекулы миозина-6 были хорошо различимы на поверхности клеточной мембраны, освещенной методом ФМПВО (рис. 2). Полученные видеозаписи, сделанные при скорости 20–50 кадров в секунду, были обработаны с помощью специализированной программы GMimPro, предназначенной для автоматической регистрации и измерения траекторий движения одиночных молекул.
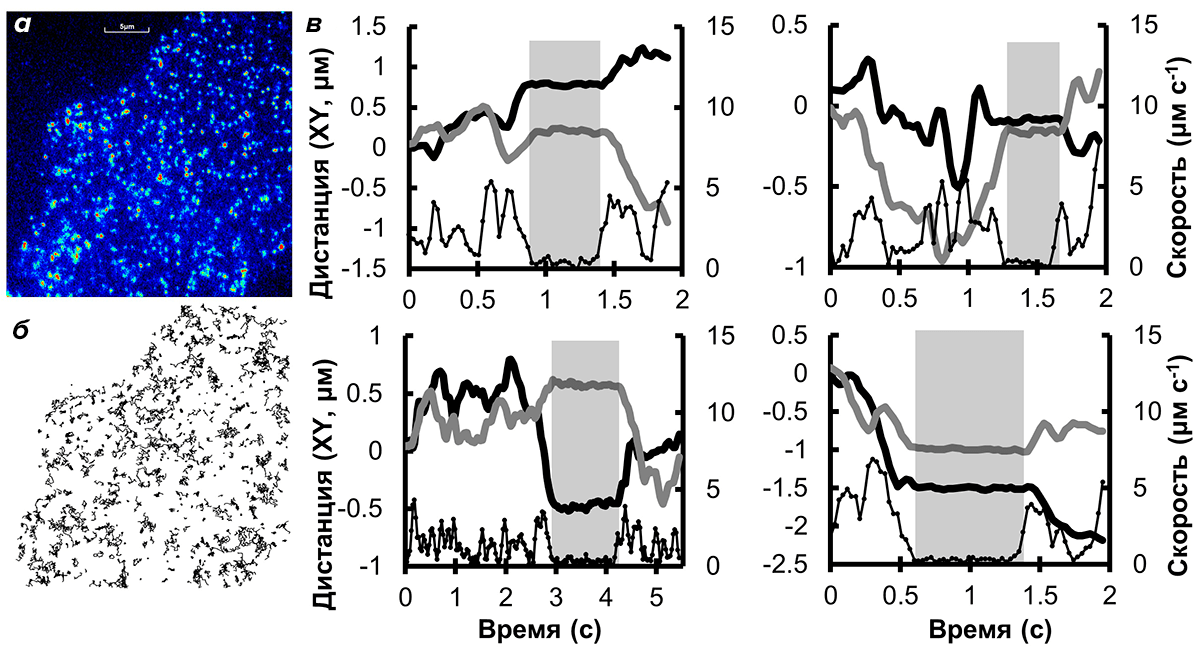
Рисунок 2. Поведение миозина-6 на клеточной мембране. а — Одиночные молекулы миозина-6 в эндотелиальной клетке. Один кадр из видеозаписи, сделанной методом ФМПВО. б — Траектории движения молекул миозина-6, сделанные по результатам анализа видеозаписи (а). в — Траектории движения четырех молекул миозина-6, двигающихся «с остановками». Левая ось — дистанция по координатам X и Y, правая ось — скорость движения. Периоды неподвижности помечены серыми прямоугольниками.
Было обнаружено, что подвижность миозина-6 на мембране эндотелиальных клеток отличается от простого хаотичного (броуновского) движения, которое характерно для многих молекул, ассоциированных с клеточной мембраной [4], [5]. Часть молекул миозина-6 на мембране эндотелиальных клеток во время записи двигалась хаотично (вытянутые траектории), другая часть была полностью неподвижна (см. траектории в виде белых пятен на рисунке в начале статьи), а часть молекул двигалась с небольшими остановками (рис. 2в), после которых молекулы возобновляли хаотичное движение по мембране клетки.
Подобное поведение миозина-6 может объясняться тем, что хаотично движущиеся молекулы находятся в «режиме поиска» мест эндоцитоза, а молекулы, двигающиеся с остановками, находятся около мест эндоцитоза, где увеличена концентрация актиновых филаментов, необходимых для этого процесса. Измеренная скорость диссоциации миозина-6 (2,7 с−1) [5] свидетельствует о циклическом взаимодействии миозина-6 с актиновыми филаментами. Неподвижные молекулы миозина-6, вероятнее всего, прочно связаны своей хвостовой частью с появившимися везикулами. В этом случае движение молекул миозина-6 ограничено размерами везикул (50–100 нм), поэтому молекулы выглядят неподвижными.
Мускариновые рецепторы М2 на мембране живых клеток в культуре и на поверхности срезов сердца мыши
Вторым примером использования ФМПВО является визуализация ацетилхолиновых мускариновых рецепторов второго типа (М2) на мембране живых клеток, находящихся в культуре и на поверхности срезов сердца мыши.
Мускариновые рецепторы относятся к самому распространенному классу белков — трансмембранным G-белоксопряженным рецепторам . Мускариновые рецепторы имеют одну полипептидную цепь (440–540 аминокислотных остатков), которая складывается в семь трансмембранных α-спиралей. Все мускариновые рецепторы активируются мускарином и блокируются атропином.
Наиболее «известным» GPCR-рецептором является родопсин [6] — зрительный пигмент нашей сетчатки, а за их открытие и исследование была вручена Нобелевская премия: «Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств» [7]. — Ред.
Известно пять типов мускариновых рецепторов, каждый из которых находится в определенном типе ткани. Так, например, М1-рецепторы находятся в вегетативных ганглиях центральной нервной системы (ЦНС), М2 — это основной тип мускариновых рецепторов в сердце; М3 обнаруживаются в гладких мышцах и в большинстве экзокринных желез; М4 — в стенке легочных альвеол и ЦНС, а М5 — в ЦНС, в слюнных железах, радужной оболочке, в мононуклеарных клетках крови. Мускариновые рецепторы М2 находятся на мембране миоцитов сердца, биение которого они и замедляют при активации.
Я изучала М2-рецепторы в нескольких клеточных культурах: клетки яичника китайского хомячка (CHO), культура клеток опухоли сердца мыши (HL1), первично изолированные клетки сердца мыши и в срезах ткани сердца мыши. Для визуализации рецепторы метили специфичным антагонистом мускариновых рецепторов — телензепином, ковалентно связанным с флуоресцентной меткой Cy3B (рис. 3).

Рисунок 3. Поведение мускариновых рецепторов М2 на мембране фибробластов мыши. а — Одиночные молекулы М2-рецепторов, помеченные флуоресцентным антагонистом, на клеточной мембране (первый кадр из видеозаписи). б — Траектории движения М2-рецепторов (1057 объектов). в — Распределение интенсивности свечения молекул М2 (7440 объектов). Интенсивность свечения большинства обнаруженных объектов соответствовала светимости одной молекулы флуорофора (~75 УЕ). Однако небольшая часть одиночных объектов была в два раза ярче, что соответствует светимости димеров (~150 УЕ).
В отличие от миозина-6, описанного в предыдущем разделе, во всех исследованных клетках молекулы М2-рецепторов двигались совершенно хаотично (броуновское движение). Это свидетельствует о том, что мускариновые рецепторы не взаимодействуют с мембранными структурами и цитоскелетом клетки. Подвижность рецепторов была приблизительно одинакова во всех типах клеток: 0,1 мкм2/с, за исключением клеток на поверхности срезов сердца (0,6 мкм2/c) [8] (рис. 4).

Рисунок 4. Мускариновые М2-рецепторы на мембране миоцита. а — Мускариновые М2-рецепторы, помеченные Су3В-телензепином, на мембране миоцита в ткани сердца. б — Траектории движения М2-рецепторов на мембране миоцита (381 объект).
Было обнаружено, что подвижность мускариновых рецепторов сердца не зависит от возраста животного — в первичных миоцитах мыши подвижность составила ~0.15 мкм2/с как до, так и после рождения (рис. 5а и видео). Однако было обнаружено, что в сердце новорожденных мышат в период родов плотность мускариновых рецепторов на мембране миоцитов была почти в три раза больше, чем у эмбрионов и взрослых мышей [8] (рис. 5б). Отсюда можно сделать вывод, что увеличение плотности М2 рецепторов необходимо для стабилизации сердцебиения во время родов для предотвращения гипоксии плода, поскольку уровень адреналина в крови матери увеличивается, а количество кислорода, доступного плоду, временно уменьшается.
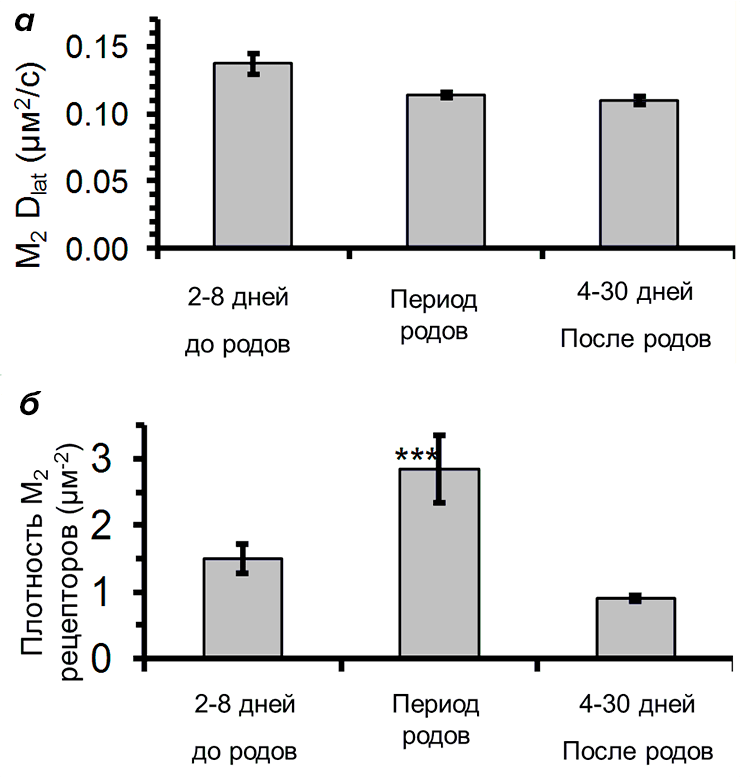
Рисунок 5. Мускариновые рецепторы М2 на мембране миоцитов сердца мышей. а — Изменение подвижности мускариновых рецепторов М2 в зависимости от возраста. б — Изменение плотности мускариновых рецепторов М2 в зависимости от возраста. Плотность рецепторов в период родов статистически отличалась от плотности до и после родов (P<0,001).
Видео 1. Движение отдельных молекул M2-рецепторов в мембране кардиомиоцитов в культуре клеток. Скорость съемки — 50 кадров/с.
Видео 2. Движение отдельных молекул M2-рецепторов в мембране кардиомиоцитов в срезе ткани. Скорость съемки — 50 кадров/с.
В отличие от мускариновых рецепторов М1, исследованных в том же типе клеток (CHO) [9], лишь незначительная фракция М2-рецепторов была димерами [8] (рис. 4б), а большинство молекул было мономерами. Димеризация М2 мускариновых рецепторов в культурах клеток наблюдалась лишь на короткий промежуток времени, хотя M1-рецеторы образуют более устойчивые димеры.
Следует особо отметить высокую чувствительность метода ФМПВО. Другие методы флуоресцентной микроскопии (например, конфокальная микроскопия) не позволяют надежно визуализировать флуоресцентные молекулы при такой низкой плотности (~1 молекула/мкм2). Было обнаружено что М2-рецепторы присутствуют не во всех клетках сердечной ткани, как это предполагалось ранее при использовании иммунофлуоресцентного окрашивания. Только часть кардиомиоцитов в сердечной ткани имела подвижные флуоресцентные метки (Cy3-B-телензепин), свидетельствующие о наличии этих рецепторов.
Выводы и перспективы
Изучение поведения одиночных молекул миозина-6 на мембране живых клеток выявило неоднородный тип подвижности этих молекул, который зависит от фазы процесса эндоцитоза. Остановки движения молекул миозина-6 на мембране клеток свидетельствуют о начале процесса эндоцитоза, а полная неподвижность — о завершении этого процесса. Такие детали механизма эндоцитоза могли быть изучены только с применеием методов микроскопии одиночных молекул.
Существует несколько мнений о стехиометрии мускариновых рецепторов. Одни исследователи считают, что рецепторы должны быть мономерами, а другие — что все мускариновые рецепторы М2 в клетках находятся в состоянии димеров. Наши результаты свидетельствуют о том, что только часть М2-рецепторов объединяется в димеры, и только на короткое время.
Исследования одиночных биомолекул с использованием флуоресцентной микроскопии важны для изучения распределения и функций биомолекул в клетке, помогают понять, как протекают жизненные процессы и могут помочь в разработке лекарств, как, например, в случае с мускариновыми рецепторами.
Литература
- По ту сторону дифракционного барьера: Нобелевская премия по химии 2014;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Ненашева Т.А., Машанов Г.И. (2006). Визуализация одиночных флуоресцирующих молекул в живых клетках. «Биофизика». 51, 454–465;
- G.I. Mashanov, T.A. Nenasheva, M. Peckham, J.E. Molloy. (2006). Cell biochemistry studied by single-molecule imaging. Biochemical Society Transactions. 34, 983-988;
- Tatiana A. Nenasheva, Gregory I. Mashanov, Michelle Peckham, Justin E. Molloy. (2011). Imaging Individual Myosin Molecules Within Living Cells. Single Molecule Enzymology. 123-142;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Нобелевская премия по химии (2012): за рецепторы наших первого, третьего и четвертого чувств;
- Tatiana A. Nenasheva, Marianne Neary, Gregory I. Mashanov, Nigel J.M. Birdsall, Ross A. Breckenridge, Justin E. Molloy. (2013). Abundance, distribution, mobility and oligomeric state of M2 muscarinic acetylcholine receptors in live cardiac muscle. Journal of Molecular and Cellular Cardiology. 57, 129-136;
- J. A. Hern, A. H. Baig, G. I. Mashanov, B. Birdsall, J. E. T. Corrie, et. al.. (2010). Formation and dissociation of M1 muscarinic receptor dimers seen by total internal reflection fluorescence imaging of single molecules. Proceedings of the National Academy of Sciences. 107, 2693-2698.