
Кальциевый имиджинг: как увидеть Ca2+ в живых системах и при чем тут медуза?
25 марта 2025
Кальциевый имиджинг: как увидеть Ca2+ в живых системах и при чем тут медуза?
- 391
- 0
- 4
Медуза Aequorea victoria является источником биолюминесцентного белка экворина, с помощью которого были проведены первые наблюдения за изменением концентрации Ca2+ в живых системах.
Рисунок в полном размере.
vichighmarine.ca, фотография D. Young
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Изменение количества Ca2+ в клетках в ответ на различные стимулы во многом определяет их дальнейшую судьбу. Но как это изменение увидеть и измерить? На помощь нам придут инструменты для визуализации Ca2+ в живых системах, о многообразии которых пойдет речь в этой статье.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Ca2+ называют катионом жизни и смерти благодаря его универсальной роли в клеточной сигнализации. Уникальная способность легко взаимодействовать с молекулами сложного строения, такими как белки, сделала его центральным «мессенджером» во всех типах живых клеток [1]. Ca2+ участвует в регуляции множества биологических процессов: транскрипции генов, сокращении мышц, работе нейронов, рождении и пролиферации клеток, выживании и смерти [2]. И это еще далеко не полный список клеточных функций, которые находятся под влиянием маленького, но могущественного катиона.
Стало быть, Ca2+ является главным специалистом по коммуникациям в живых системах, но остается непонятным, как он может переводить такое разнообразие стимулов в специфические ответы в различных типах клеток. На самом деле, всевозможные стимулы по-разному влияют на изменение концентрации Ca2+ в цитозоле, что приводит к запуску уникальных ответов [3]. Однако исследования последних десятилетий показали, что кальциевый сигналинг определяется не только изменением концентрации в клетке, но и ее пространственно-временным профилем [4], [5]. Уникальные четырехмерные параметры для каждого сигнала Ca2+ называются сигнатурами или кодами, которые создаются благодаря отлаженной работе клеточной машинерии [5].
Как мы могли заметить, кальциевый сигналинг играет решающее значение в регуляции множества клеточных функций и имеет сложный механизм исполнения, который до сих пор недостаточно хорошо изучен. Поэтому неутомимым исследователям биологической роли кальция необходимо вооружиться мощными инструментами для наблюдения за ним в живых системах. В этом обзоре мы познакомимся с некоторыми из них.
Как эволюционировал кальциевый имиджинг?
Первые наблюдения за изменением количества Ca2+ в живых клетках [6] были проведены с использованием биолюминесцентного белка экворина. Этот чудесный белок был выделен из медузы Aequorea, из которой, кстати, потом извлекли не менее чудесный зеленый флуоресцентный белок (green fluorescent protein, GFP), получивший широкое применение в молекулярной биологии [7].
Примерно в это же время начали использоваться металлохроматические красители, такие как мурексид и арсеназо III, для измерения внутриклеточной концентрации Ca2+. Хотя эти красители изначально были многообещающими, Ca2+-зависимые спектральные изменения были очень чувствительны к колебаниям pH, которые, как известно, происходят в клетках. С другой стороны, экворин не был легко доступен и требовал микроинъекций в отдельные клетки, поэтому его использование было ограничено [8].
С дизайна и разработки Ca2+-чувствительных флуоресцентных красителей всерьез началась новая эра исследований клеточной сигнализации, а следующим большим скачком в этой области стало появление генетически кодируемых индикаторов Ca2+ (genetically encoded Ca2+ indicators, GECI). Введению этой впечатляющей технологии предшествовали три важных шага: 1) открытие GFP; 2) создание различных цветовых вариантов GFP; 3) биохимическое исследование механизма работы таких индикаторов в живых системах [9].
Примерно в то же время был получен рекомбинантный экворин в эукариотических клетках и с тех пор начал использоваться в некоторых исследованиях кальциевого сигналинга [10], [11]. Однако тусклая хемилюминесценция ограничила его применение. Лишь после слияния экворина и флуоресцентных белков его использование расширилось [12], но к тому времени ему уже пришлось конкурировать с флуоресцентными индикаторами.
Раскрасим клетки, чтобы увидеть кальций
Ca2+-чувствительные красители представляют собой небольшие молекулы, которые могут связывать ионы кальция. Эти молекулы основаны на органическом соединении со сложным названием 1,2-бис(о-аминофенокси)этан-N,N,N',N'-тетрауксусной кислоте (1,2-bis(o-aminophenoxy)ethane-N,N,N′,N′-tetraacetic acid, BAPTA). Такие индикаторы весьма избирательны: они стремятся «схватить» именно Ca2+, а не любой другой катион [13]. Иначе говоря, они обладают весьма полезным свойством для исследователей — высокой селективностью. К этой группе индикаторов относятся fura-2, indo-1, fluo-3 и другие [14].
Как же работают эти красители? Дело в том, что у BAPTA есть «клешни» — четыре карбоксильные группы, которые за счет отрицательного заряда притягивают к себе катион кальция и захватывают его в свои крепкие объятия, образуя с ним комплекс (рис. 1) [13]. Такие соединения, как BAPTA, благодаря их способности связывать ионы металлов, еще называют хелатирующими агентами (греч. chela — клешня; лат. agens (agentis) — действующий). Хелатирование Ca2+ приводит либо к увеличению интенсивности флуоресценции индикатора, либо к смещению длины волны его излучения/возбуждения [14].
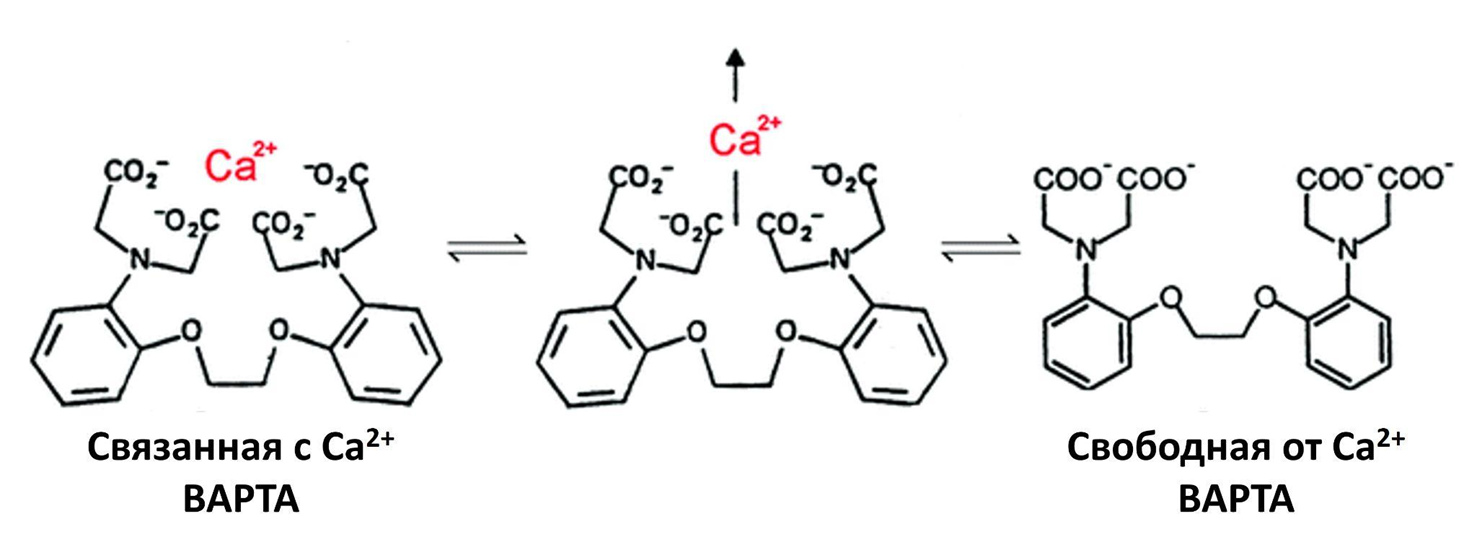
Рисунок 1. Механизм связывания катионов кальция соединением BAPTA. Наличие четырех карбоксильных групп делает это возможным.
адаптировано из [13]
Казалось бы, какие замечательные индикаторы — бери и крась клетки, и будет тебе счастье, но не тут-то было. Карбоксильные группы, которые так важны для связывания Ca2+, мешают проникнуть нашим индикаторам в живые системы [15]. Как мы знаем, цитоплазматическая мембрана клеток состоит из двух слоев фосфолипидов, гидрофильные «головки» которых направлены наружу, а гидрофобные «хвосты» прячутся внутри мембраны. Так вот, эти самые гидрофобные хвосты не желают пускать крупные полярные молекулы [16], поэтому и кислота BAPTA им совсем не нравится. Чтобы решить эту проблему, исследователи придумали, как можно обхитрить цитоплазматическую мембрану. Они замаскировали карбоксильные группы хелатора под сложные эфиры, тем самым сделав молекулу липофильной и облегчив ее проникновение в клетку. Как только эта форма индикатора окажется в клетке, на нее набросятся ферменты, умеющие расщеплять сложноэфирную связь. Они героически высвободят карбоксильные группы, и индикатор снова будет способен связывать кальций [15]. На самом деле, незамаскированная форма красителей также может быть введена в клетки с помощью микроэлектрода или микропипетки, но в этом случае появляются другие технические трудности [17].
Первая визуализация Ca2+ в режиме реального времени с использованием флуоресцентных красителей была проведена в 1986 году в клетках сердца [18]. С разработкой лазерных сканирующих конфокальных микроскопов удалось увидеть субклеточные сигналы Ca2+. А при использовании комбинации разных красителей получилось количественно оценить переходные процессы кальция в митохондриях [19].
Хотя химические индикаторы могут быть загружены в органеллы, сигнал в этом случае имеет низкую селективность, так как при обработке клеток краситель попадает в цитозоль. Чтобы поймать кальциевый сигнал в определенных органоидах, перед измерениями необходимо тщательно удалить индикатор из цитозоля, а это достаточно трудоемко [20]. Кроме того, при применении красителя в тканях он может попадать в клетки, не предназначенные для исследования. В этом отношении химические индикаторы уступают генетически кодируемым, которые можно нацелить на опредленные популяции клеток и/или субклеточные области при использовании клеточно-специфичных промоторов и целевых последовательностей [21].
Выбрасываем краски: теперь клетки умеют светиться сами
Перед тем, как погрузиться в мир GECI, будет полезным кратко вспомнить принципы получения рекомбинатной ДНК, так как именно эта технология лежит в основе работы таких сенсоров.
Заглянем в ателье генного инженера
Рекомбинантную ДНК получают путем объединения чужеродных фрагментов in vitro. Как правило, один из этих фрагментов представляет собой «кусочек» ДНК, содержащий нужный нам ген или его часть, а второй — вектор, который будет служить носителем для нашего гена (рис. 2в). В качестве вектора в большинстве случаев используют плазмиды или фаги [22]. А как же соединить вектор с необходимым нам фрагментом ДНК? Для этого ученые используют специальные генно-инженерные «ножницы» — эндонуклеазы рестрикции или, как их обычно называют на рабочем сленге, «рестриктазы». Такие ножницы узнают специфические сайты рестрикции в молекуле ДНК и разрезают ее в этих местах [23]. Существуют «липкие» и «тупые» рестриктазы. Липкие режут ДНК в форме ступеньки, образуя при этом одноцепочечный выступ (рис. 2а). Если обработать наш фрагмент и вектор такой рестриктазой, то они разрежутся с образованием липких концов, которые затем, благодаря их комплементарному спариванию, создают новую комбинацию генов — рекомбинантную ДНК. При обработке же тупыми рестриктазами никаких выступов не получается (рис. 2б). Но в случае образования и тупых, и липких концов, необходимо сшить фрагменты специальными ферментами — лигазами (рис. 2в) [24].
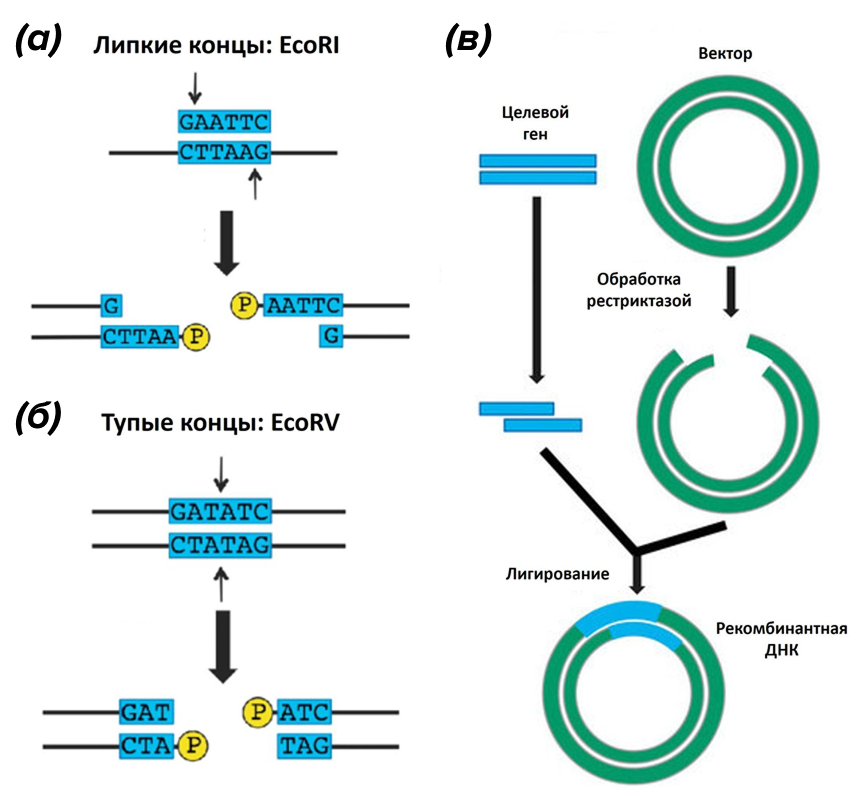
Рисунок 2. Рестрикция и лигирование. (а) — образование липких концов, показанное на примере использования широко известной рестриктазы EcoRI. (б) — образование тупых концов, показанное на примере работы фермента EcoRV. (в) — получение рекомбинантной ДНК: рестрикция фрагментов ДНК и их сшивание с помощью лигазы.
адаптировано из [24]
Когда рекомбинантный вектор получен, его необходимо размножить. Для этого используют метод молекулярного клонирования. Молекулярным клонированием в генной инженерии называют процесс многократного увеличения числа копий необходимого фрагмента ДНК за счет деления микроорганизмов [25]. Далее наработанный в результате молекулярного клонирования фрагмент нужно ввести в конечный организм, которому мы хотим придать новые свойства. Ими могут быть бактерии, а также эукариотические организмы — дрожжи, другие микроскопические грибы, клетки растений или животных. А сам процесс введения чужеродной ДНК в клетку-хозяина называется трансформацией.
В названии генетически кодируемых индикаторов Ca2+ уже есть словосочетание, которое нам раскрывает суть их работы. «Генетически кодируемый» означает, что продукция индикатора закодирована в геноме клетки. Этот процесс осуществляется как раз с помощью вышеописанной технологии получения рекомбинантной ДНК. Грубо говоря, исследователь берет фрагмент ДНК с геном, кодирующим наш кальциевый сенсор, и склеивает его с вектором. После чего трансформирует полученной рекомбинантной ДНК клетки, в которых нужно посмотреть кальций. Если трансформация пройдет успешно, клетки будут продуцировать индикатор в цитозоль или какую-нибудь органеллу, в зависимости от конструкции вектора и цели эксперимента. В таком случае мы сможем визуализировать динамику изменения количества кальция, не прибегая к постоянным обработкам красителями и последующими процедурами вымывания их из цитоплазмы. Разумеется, сложность использования таких индикаторов состоит в том, что исследователю надо владеть инструментами генной инженерии и затратить какое-то время на получение трансформантов, продуцирующих индикатор. Но в современном мире есть лаборатории, в которых квалифицированные генные инженеры смогут сделать это за вас.
Флуоресцентный свет пролился на кальциевый сигналинг
Мир флуоресцентных GECI велик и многообразен. Его можно поделить на две половины — интенсиометрическую и логометрическую. Как говорится, выбери свою половинку [26].
Интенсиометрические или нерациометрические индикаторы содержат один флуоресцентный белок. При их применении исследователь измеряет интенсивность свечения индикатора только на одной длине волны. Напротив, логометрические или рациометрические сенсоры меняют длину волны возбуждения и/или эмиссии при связывании с кальцием, что позволяет оценивать его концентрацию в клетках независимо от уровня продукции индикатора. Рациометрические индикаторы, как правило, содержат два флуоресцентных белка, но есть исключения [26].
Интенсиометрические GECI
GECI на основе одного флуоресцентного белка обычно разделяют общий принцип действия, включающий изменение интенсивности флуоресценции при связывании Ca2+. В большинстве индикаторов Ca2+-хелатирующие свойства обеспечиваются фрагментом кальмодулина (CaM) [26]. Здесь стоит сказать несколько слов об этом удивительном белке. Кальмодулин выполняет роль природного кальциевого сенсора во всех типах эукариотических клеток. Связывание с кальцием меняет его пространственную организацию, что является стимулом для запуска многих физиологических процессов, например, сокращения мышц, секреции гормонов, изменению подвижности клеток и т.д. Теперь снова возвращаемся к нашим индикаторам, которые состоят из CaM, слитого с флуоресцентным белком и CaM-связывающим пептидом M13 (рис. 3, рис. 4а). Важный элемент такой структуры — хромофор, являющийся частью светящегося белка [27]. Хромофор — это особая функциональная группа в молекуле, способная к поглощению света определенной длины волны и таким образом определяющая цвет соединения [28]. Связывание индикатора с Ca2+ способствует внутримолекулярной перегруппировке, которая меняет состояние протонирования хромофора и связанные с ним флуоресцентные свойства [27], [29].
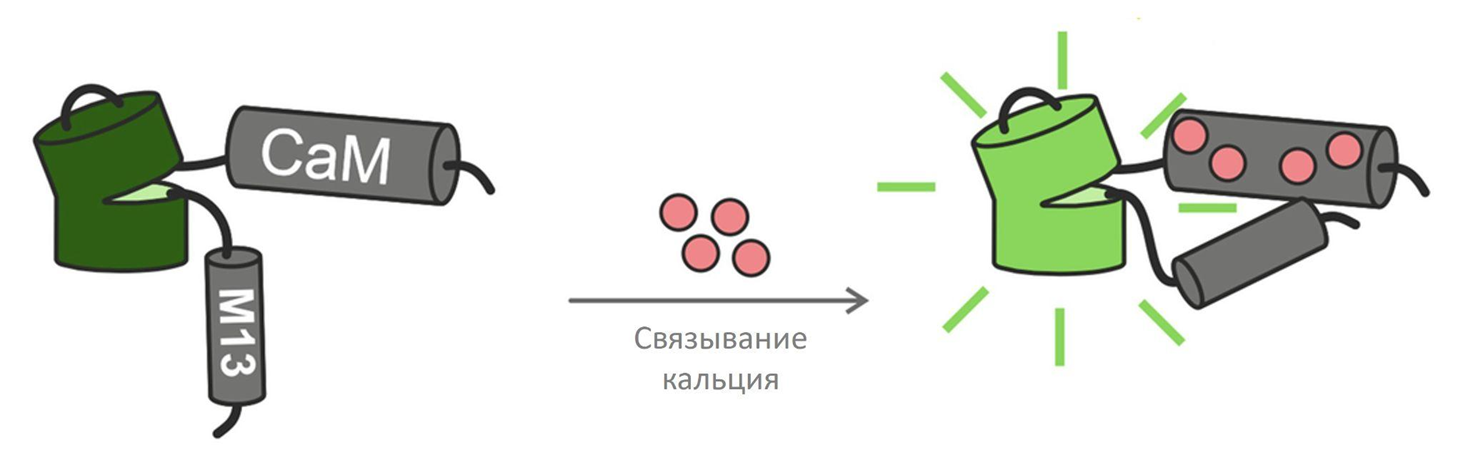
Рисунок 3. Схематическое изображение генетически кодируемых индикаторов Са2+. Индикаторы типа GCaMP включают флуоресцентный белок (изображен зеленым цветом), кальмодулин (CaM) и кальмодулин-связывающий пептид М13. Связывание Ca2+ с CaM–M13 увеличивает интенсивность флуоресценции индикатора.
адаптировано из [29]
Существуют GECI, у которых нет CaM-связывающего пептида. К ним относятся индикаторы семейства Camgaroo, фрагмент кальмодулина которых зажат между двумя половинами расщепленной молекулы GFP (рис. 4б) [30].
Есть и другие интересные интенсиометрические индикаторы, работающие по совершенно иному механизму. Например, сенсор CatchER имеет Ca2+-связывающую часть, модифицированную таким образом, что она приобрела довольно сильный отрицательный заряд, который влияет на распределение электронной плотности хромофора, уменьшая фоновую флуоресценцию белка. Связанный Ca2+ экранирует этот отрицательный заряд, позволяя восстановить интенсивность флуоресценции (рис. 4в) [31].
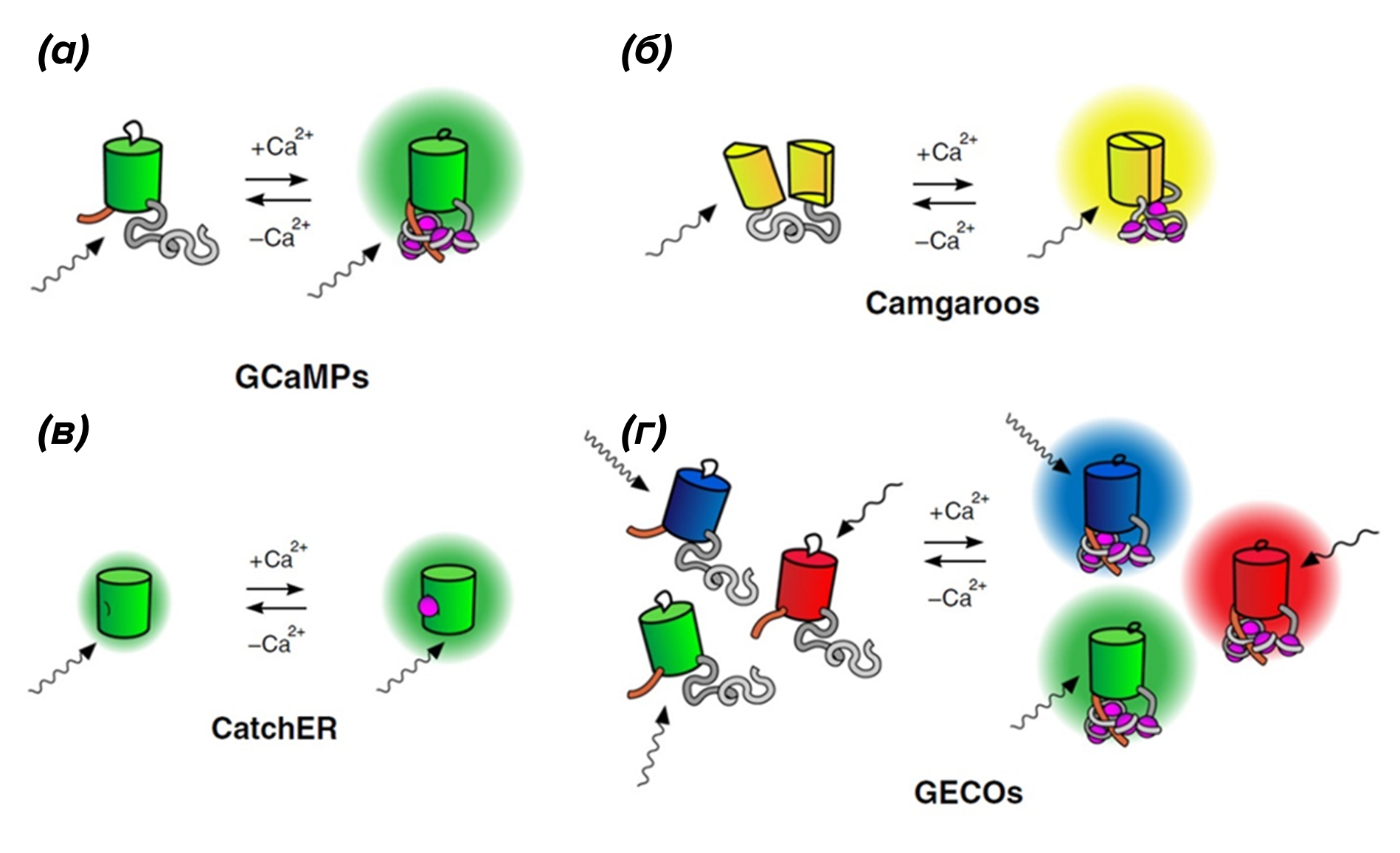
Рисунок 4. Семейства интенсиометрических генетически кодируемых индикаторов Са2+ (а) — GCaMPs. (б) — Camgaroos. (в) — CatchER и (г) — GECOs. Эти индикаторы на основе флуоресцентных белков требуют внешнего возбуждения светом разной частоты (волнистые стрелки). Цвета обозначают диапазон излучения флуоресценции, характерный для каждого семейства. Сродство к кальцию обеспечивается связывающими Ca2+ фрагментами, полученными из кальмодулина, или искусственно созданным сайтом связывания Ca2+ в случае CatchER.
адаптировано из [26]
Во всех этих случаях химическая структура хромофора не меняется во время пространственной перестройки индикатора, и, следовательно, изменение флуоресценции связано с увеличением или уменьшением спектров поглощения [32], что приводит к изменению интенсивности излучаемой флуоресценции.
Первые интенсиометрические индикаторы были разработаны на основе производных GFP, полученного из медузы Aequorea, но в более поздних разработках используются другие варианты окраски GFP или другие флуоресцентные белки [33], что дает возможность осуществить одновременную многоцветную визуализацию Ca2+ в различных внутриклеточных компартментах (рис. 4г).
Логометрические GECI
Работа индикаторов, содержащих два светящихся белка, основана на флуоресцентном резонансном переносе энергии (fluorescence resonance energy transfer, FRET) [26]. Во время работы FRET один из флуоресцентных белков действует как донор, передающий поглощенную энергию второму белку-акцептору (рис. 5). Эффективность передачи энергии зависит от нескольких факторов, включая перекрытие спектров излучения донора и спектров поглощения акцептора, расстояние между донором и акцептором, время жизни донора и др. [34].
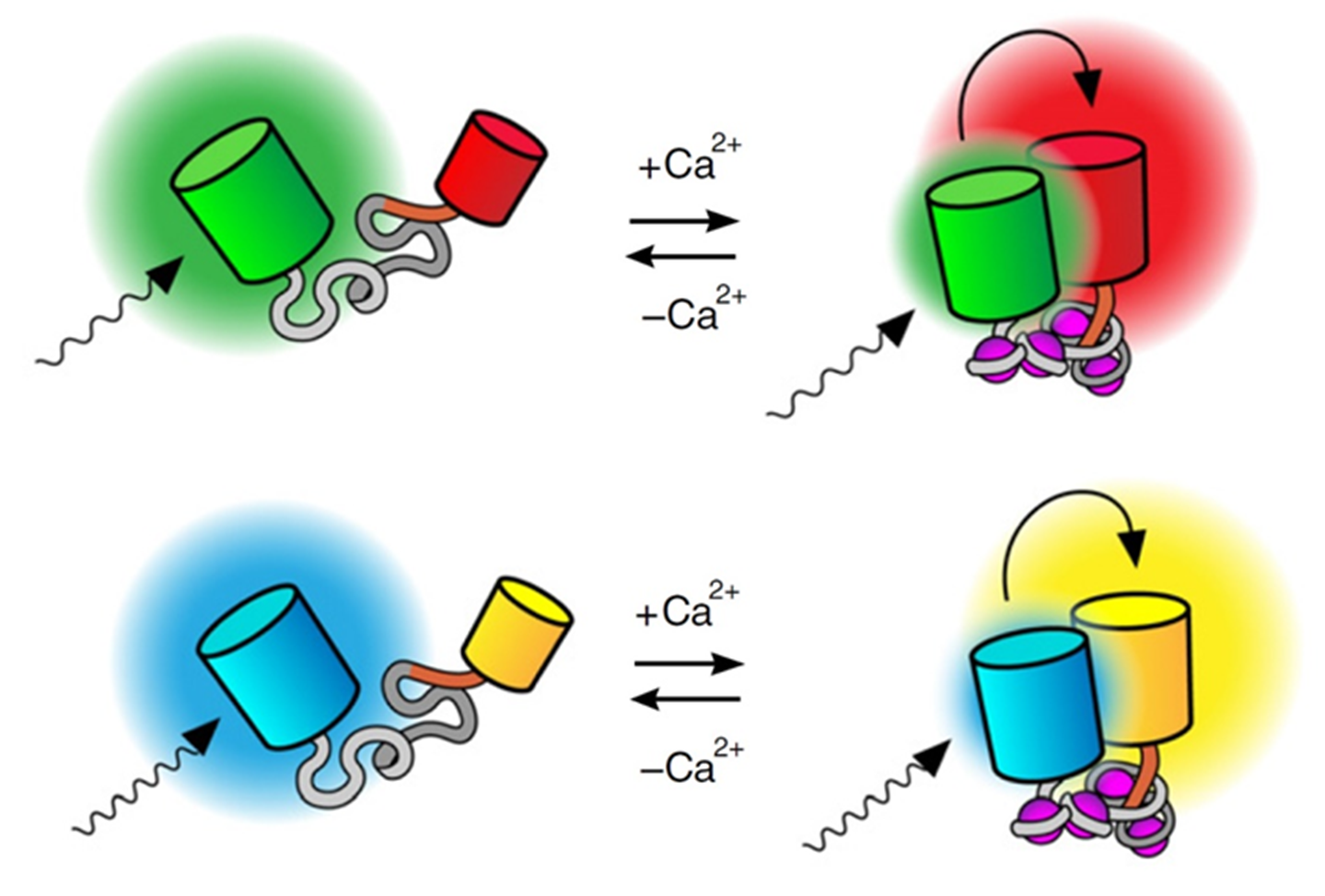
Рисунок 5. Логометрические генетически кодируемые индикаторы Са2+ с двумя флуоресцентными белками. Связывание Ca2+ способствует внутримолекулярным перестройкам, которые приводят к сближению донорных и акцепторных флуоресцентных белков, позволяя происходить FRET.
адаптировано из [26]
Эффективность FRET сильно зависит от расстояния между донорной и акцепторной частями, и поэтому его можно использовать только на расстояниях 1–10 нм [34]. Логометрические GECI сконструированы таким образом, что после связывания Ca2+ эффективность FRET увеличивается либо из-за сближения двух флуоресцентных белковых частей друг с другом, либо из-за изменения их относительной ориентации.
Методы на основе FRET могут быть использованы для оценки различных аспектов донорно-акцепторных взаимодействий [35], но для обнаружения Ca2+ обычно используется простое соотношение эмиссии донора и акцептора [26]:
R=IA/ID,
где R — отношение FRET, IA и ID — пиковые интенсивности излучения донора и акцептора, соответственно. Противоположно направленное изменение интенсивности излучения на двух длинах волн позволяет уменьшить колебания флуоресценции, связанные с изменяющейся концентрацией индикатора (чего нельзя сказать об интенсиометрических сенсорах).
Ученые исследовали эффективность работы индикаторов, содержащих различные комбинации флуоресцентных белков, например, таких, как синий-зеленый [36] или зеленый-оранжевый [37]. Однако самой удачной оказалась пара синего и желтого белков, которые обеспечивают наибольшее изменение соотношения R при связывании Ca2+ [26]. Другими словами, эта сладкая парочка оказалась самой чувствительной к кальцию, что облегчает его обнаружение. Таким образом, большинство доступных в настоящее время индикаторов, работа которых основана на FRET, используют комбинацию этих белков, а именно: голубого флуоресцентного белка ECFP в качестве донора и желтого флуоресцентного белка Venus или Citrine в качестве акцептора.
Несмотря на то, что большинство логометрических индикаторов содержат два флуоресцентных белка, есть среди них и только с одним белком. Ярким примером является химерный белок GEM-GECO (рис. 6). Его сконструировали, чтобы наблюдать за активностью нейронов [33], но также есть случай его применения в клетках почкующихся дрожжей [38]. Особенность этого индикатора состоит в том, что его свободная форма флуоресцирует зеленым, а связанная с Ca2+ — синим. По соотношению интенсивностей синего и зеленого свечений можно судить об изменении концентрации кальция в клетках.
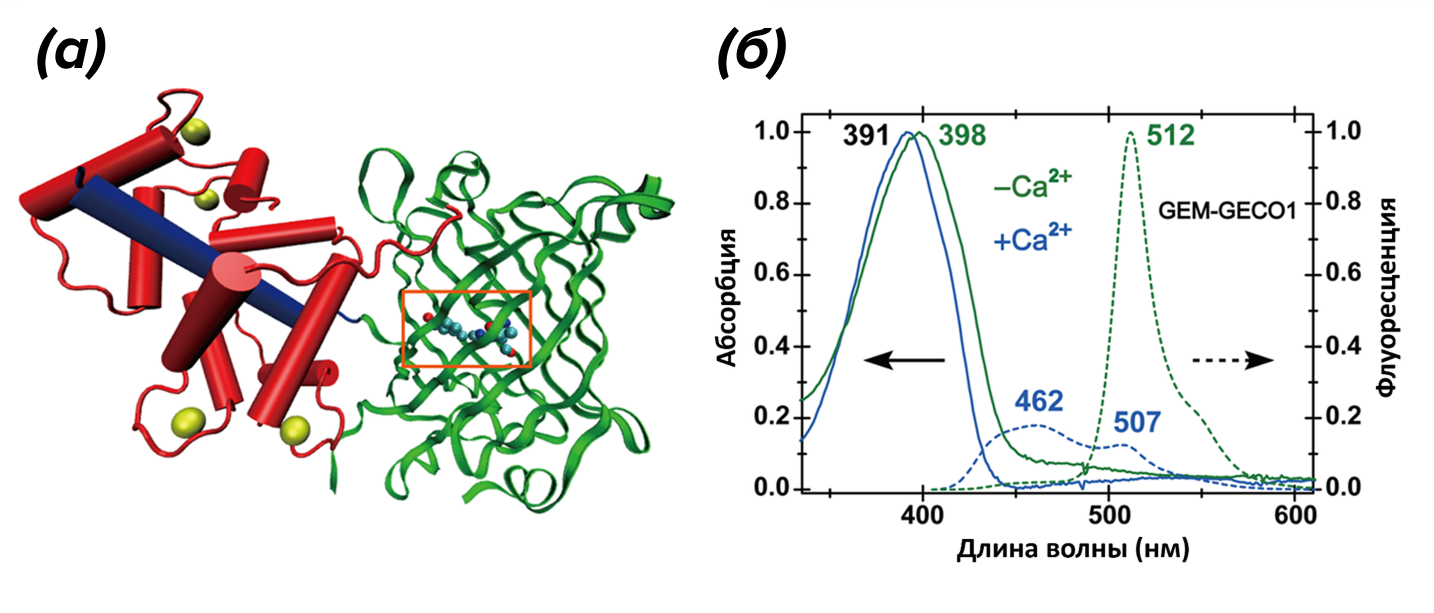
Рисунок 6. Логометрический индикатор Са2+ GEM-GECO. (а) — структура GEM-GECO в связанном с Ca2+ состоянии: белок GFP показан зеленым цветом, кальмодулин выделен красным, пептид M13 — синим, а ионы кальция, связанные с CaM, — желтым. Хромофор обозначен оранжевым прямоугольником. (б) — спектры поглощения в УФ/видимой области для GEM-GECO, не связанного с кальцием (зеленая сплошная кривая, левая ось) и связанного с ним (синяя сплошная кривая). Спектры эмиссии GEM-GECO в отсутствие (зеленая пунктирная кривая, правая ось) и в присутствии (синяя пунктирная кривая) кальция демонстрируют существенные различия.
адаптировано из pubs.acs.org
Волшебная медуза подарила нам экворин
Первая визуализация изменения количества Ca2+ в живых клетках была проведена с помощью биолюминесцентного белка экворина [6]. Эти и последующие эксперименты в течение многих лет проводили путем прямого введения очищенного белка из медузы Aequorea в исследуемые клетки. Интерес к изучению кальциевого сигналинга рос, а экворина не хватало. «Так никаких медуз не напасешься на этот научный прогресс!» — наверняка подумали тогда ученые. К тому же надо было устраивать неистовый шаманский обряд, чтобы выделить, очистить и ввести светящийся белок в малюсенькие клеточки. Через какое-то время произошло чудо: с расцветом генной инженерии исследователям удалось получить рекомбинантный экворин, который позволил без уничтожения бедных медуз и лишних мучений визуализировать Ca2+ в клетках [10], [11].
А теперь пришло время разобраться в механизме работы экворина (рис. 7). Экворин представляет собой сложный белок, в состав которого входит белковая часть (апопротеин, а в нашем случае мы можем его назвать апоэкворином) и компонент неаминокислотной природы — простетическая группа. Целентеразин является простетической группой экворина и относится к светоизлучающим веществам — люциферинам. Ранние исследования биолюминесценции медузы Aequorea выявили, что свечение выглядит как кольцо вокруг колокола и происходит даже при отсутствии воздуха. Это было необычно, поскольку для большинства реакций биолюминесценции требуется кислород. Уже позднее было обнаружено, что апопротеин может стабильно связывать только окисленную форму целентеразина, поэтому кислород необходим для регенерации активной формы экворина. При связывании трех катионов кальция пространственная организация апоэкворина претерпевает изменения и преобразует целентеразин в возбужденный целентерамид, который высвобождается вместе с CO2. Когда возбужденный целентерамид релаксирует в основное состояние, испускается синий свет [39]. Этот излучаемый свет можно легко обнаружить с помощью люминометра [40].
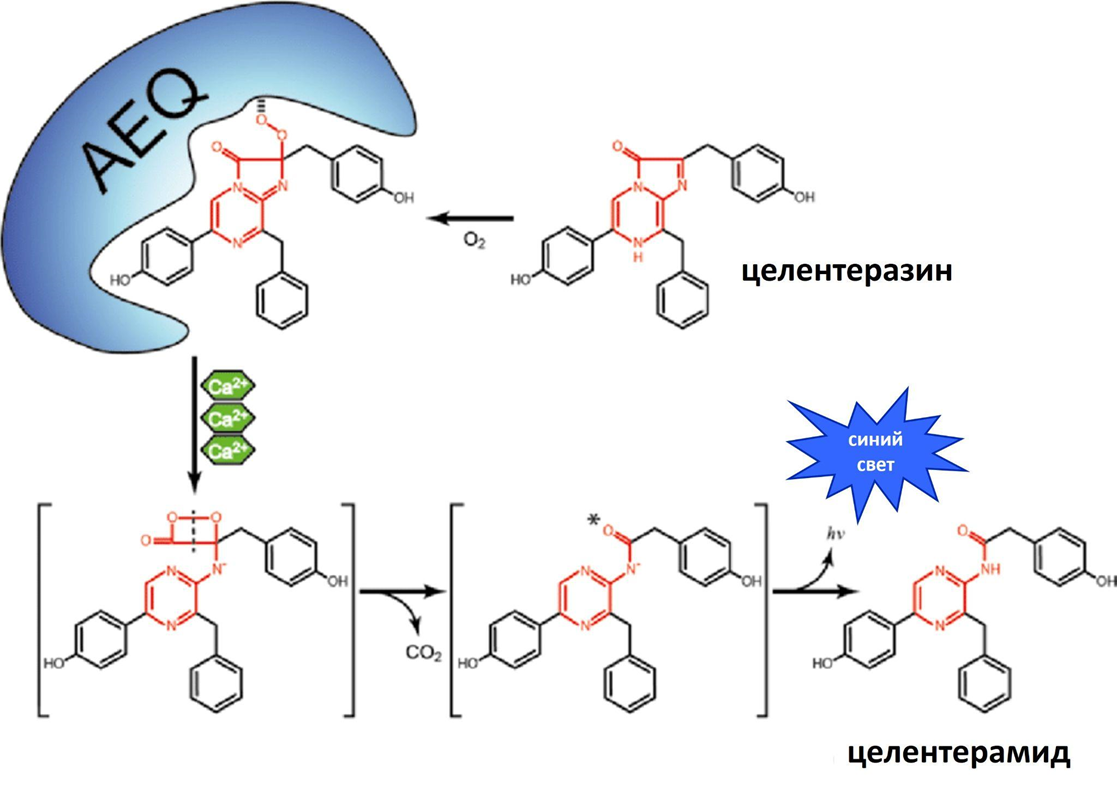
Рисунок 7. Механизм люминесценции экворина при связывании Са2+. Апоэкворин превращается в активную форму, экворин (AEQ), в присутствии кислорода (O2). При связывании трех ионов Ca2+ целентеразин окисляется и циклизуется с последующей пространственной перестройкой белка, сопровождающейся высвобождением диоксида углерода (CO2) при получении возбужденного целентерамида (звездочка), который излучает синий свет. Часть молекулы целентеразина, в которой происходят изменения, отмечена красным цветом.
адаптировано из [40]
Так как в состав экворина входит небелковая часть, клетки могут продуцировать только рекомбинантный апоэкворин, поэтому необходимо добавлять в культуральную среду целентеразин, чтобы получить функциональный белок и использовать его для мониторинга Ca2+. Целентеразин является гидрофобной молекулой и, следовательно, легко проникает через стенки клеток растений и грибов , а также через плазматическую мембрану высших эукариот, что делает экворин подходящим индикатором Ca2+ в этих живых организмах.
Прежде чем начать ругать уже родной нам экворин, стоит отметить его сильные стороны. Во-первых, он не токсичен, а во-вторых, экворин не взаимодействует с другими внутриклеточными молекулами, связывающими Ca2+, даже при микроинъекциях в высоких концентрациях в клетки млекопитающих. Кроме того, к настоящему времени накопилась большая база исследований с применением экворина в качестве биолюминесцентного датчика, начиная от измерения концентрации Ca2+ в различных типах клеток, заканчивая целыми организмами, включая трансгенных животных [20]. Однако низкая скорость люминесцентной реакции и низкий квантовый выход ограничивают применение экворина [41].
Новое поколение биолюминесцентных индикаторов
Ученые придумали, как можно решить проблему низкого уровня сигнала экворина: они соединили его с GFP, свечение которого обнаружить гораздо проще. В основе работы таких индикаторов лежит принцип биолюминесцентного резонансного переноса энергии (bioluminescence resonance energy transfer, BRET), суть которого похожа на FRET, но донором в этом случае будет экворин или другой хемилюминесцентный белок, а не флуоресцентный фрагмент (рис. 8) [42]. Несмотря на забавное название принципа работы таких индикаторов, идея их разработки оказалась противоположной бреду.
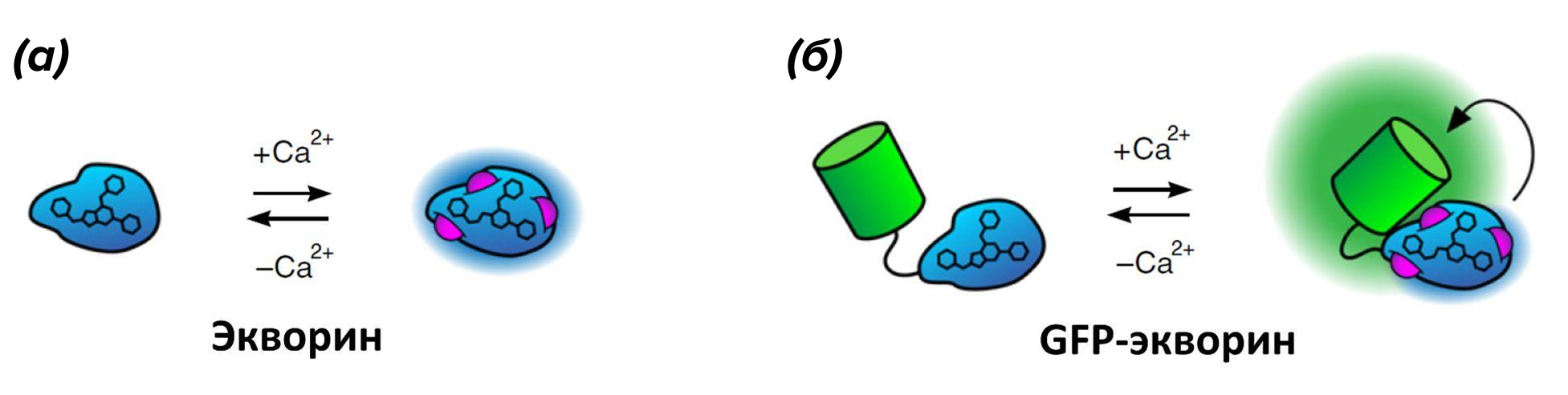
Рисунок 8. Биолюминесцентные индикаторы Са2+. (а) — хемилюминесцентный белок экворин. (б) — индикатор GFP-экворин. Эти индикаторы не требуют внешнего возбуждения светом, а вместо этого требуют добавления в культуральную среду целентеразина.
адаптировано из [26]
Помимо GFP, ученые пробовали пришить к экворину и другие флуоресцентные белки, например, желтый Venus [43] или белки, излучающие красный свет [44]. К настоящему времени накопилось большое разнообразие таких индикаторов, поэтому можно выбрать на любой вкус. А если ничего не понравится, это будет верным знаком к созданию новых!
GECI, зачем вы портите жизнь клеткам?!
Какими бы идеальными GECI не казались, увы, и у них есть свои недостатки. Оказывается, GECI могут ограничивать жизнедеятельность клеток и даже привести к их гибели. Сообщалось, что при длительном применении они могут оказывать вредное воздействие на гомеостаз кальция нервных клеток [45]. Другие исследования показывают, что длительная продукция индикатора может нарушать морфологическое развитие диссоциированных нейронов коры головного мозга [46] или приводить к эпизодам гипервозбудимости [47]. Накопление индикатора в ядрах нейронов может спровоцировать потерю динамической передачи сигналов кальция и, в конечном счете, привести к апоптозу [45].
Судя по всему, GECI ведут себя как кальциевые буферы в нейронах, поэтому они могут вносить изменения в сигнализацию Ca2+, что приводит к усложнению жизни клеток. Высокие уровни продукции GECI могут истощать пул цитозольного кальция в нейронах [47]. Вероятно, кальмодулин в составе индикатора каким-то образом начинает участвовать в этом процессе. Интересно, что применение GECI в дрожжах вызвало другой эффект: в этом случае продукция индикатора усиливала ответ на подъем концентрации Ca2+ в цитозоле, что, однако, тоже привело к ограничению роста клеток [38].
Заключение
Мы познакомились с удивительным миром кальциевого имиджинга, начиная от экворина, и по иронии судьбы, заканчивая им же, но в более совершенной форме. Эволюция методов визуализации Ca2+ впечатляет: сперва приходилось добывать и вводить светящийся белок в клетки, а теперь они могут производить его самостоятельно. Кроме того, генетически модифицированные клетки могут не только продуцировать светящиеся белки сами, но и направлять их в нужное нам местоположение. Однако новые разработки в области кальциевого имиджинга не лишены недостатков, с которыми ученым еще предстоит разобраться.
Остается лишь отметить, что теперь, после знакомства с этим обзором, вы знаете, при чем тут была медуза!
Литература
- Avishek Roy, Ajeet Kumar, Darshana Baruah, Ranjan Tamuli. (2021). Calcium signaling is involved in diverse cellular processes in fungi. Mycology. 12, 10-24;
- Michael J. Berridge, Peter Lipp, Martin D. Bootman. (2000). The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1, 11-21;
- Загадочный кальциевый язык;
- Anant B. Parekh. (2011). Decoding cytosolic Ca2+ oscillations. Trends in Biochemical Sciences. 36, 78-87;
- Sheng Luan, Chao Wang. (2021). Calcium Signaling Mechanisms Across Kingdoms. Annu. Rev. Cell Dev. Biol.. 37, 311-340;
- E.B. Ridgway, C.C. Ashley. (1967). Calcium transients in single muscle fibers. Biochemical and Biophysical Research Communications. 29, 229-234;
- Osamu Shimomura, Frank H. Johnson, Yo Saiga. (1962). Extraction, Purification and Properties of Aequorin, a Bioluminescent Protein from the Luminous Hydromedusan,Aequorea. J. Cell. Comp. Physiol.. 59, 223-239;
- James T Russell. (2011). Imaging calcium signals in vivo: a powerful tool in physiology and pharmacology. British J Pharmacology. 163, 1605-1625;
- Tudor Porumb, Patrick Yau, Timothy S. Harvey, Mitsuhiko Ikura. (1994). A calmodulin-target peptide hybrid molecule with unique calcium-binding properties. Protein Eng Des Sel. 7, 109-115;
- Douglas Prasher, Richard O. McCann, Milton J. Cormier. (1985). Cloning and expression of the cDNA coding for aequorin, a bioluminescent calcium-binding protein. Biochemical and Biophysical Research Communications. 126, 1259-1268;
- O Shimomura, S Inouye, B Musicki, Y Kishi. (1990). Recombinant aequorin and recombinant semi-synthetic aequorins. Cellular Ca2+ ion indicators. Biochemical Journal. 270, 309-312;
- Valérie Baubet, Hervé Le Mouellic, Anthony K. Campbell, Estelle Lucas-Meunier, Philippe Fossier, Philippe Brûlet. (2000). Chimeric green fluorescent protein-aequorin as bioluminescent Ca 2+ reporters at the single-cell level. Proc. Natl. Acad. Sci. U.S.A.. 97, 7260-7265;
- Fabio Mammano, Mario Bortolozzi. (2010). Ca2+ Imaging: Principles of Analysis and Enhancement. Neuromethods. 57-80;
- R. Madelaine Paredes, Julie C. Etzler, Lora Talley Watts, Wei Zheng, James D. Lechleiter. (2008). Chemical calcium indicators. Methods. 46, 143-151;
- R. Y. Tsien. (1981). A non-disruptive technique for loading calcium buffers and indicators into cells. Nature. 290, 527-528;
- Нельсон Д. Основы биохимии ленинджера: в 3 т. Т.1. Пер. с англ. — М.: «БИНОМ. Лаборатория знаний», 2011. — 694 с.;
- J. Stinnakre. (1981). Detection and measurement of intracellular calcium. Trends in Neurosciences. 4, 46-50;
- Cannell M., Berlin J., Lederer W. (1987). Intracellular calcium in cardiac myocytes: calcium transients measured using fluorescence imaging. Soc Gen Physiol Ser. 42, 201–214;
- Maxim V. Ivannikov, Gregory T. Macleod. (2013). Mitochondrial Free Ca2+ Levels and Their Effects on Energy Metabolism in Drosophila Motor Nerve Terminals. Biophysical Journal. 104, 2353-2361;
- Arancha Rodriguez-Garcia, Jonathan Rojo-Ruiz, Paloma Navas-Navarro, Francisco Javier Aulestia, Sonia Gallego-Sandin, et. al.. (2014). GAP, an aequorin-based fluorescent indicator for imaging Ca 2+ in organelles. Proc. Natl. Acad. Sci. U.S.A.. 111, 2584-2589;
- Jeffrey T. Lock, Ian Parker, Ian F. Smith. (2015). A comparison of fluorescent Ca2+ indicators for imaging local Ca2+ signals in cultured cells. Cell Calcium. 58, 638-648;
- Биотехнология. Генная инженерия;
- А не замахнуться ли нам на... изменение генома?;
- Alessandro Bertero, Stephanie Brown, Ludovic Vallier. (2017). Methods of Cloning. Basic Science Methods for Clinical Researchers. 19-39;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- Vadim Pérez Koldenkova, Takeharu Nagai. (2013). Genetically encoded Ca2+ indicators: Properties and evaluation. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1833, 1787-1797;
- Qi Wang, Bo Shui, Michael I. Kotlikoff, Holger Sondermann. (2008). Structural Basis for Calcium Sensing by GCaMP2. Structure. 16, 1817-1827;
- Hans-Georg Kuball, Tatiana Höfer, Stefan Kiesewalter. (1999). Chiroptical Spectroscopy, General Theory*. Encyclopedia of Spectroscopy and Spectrometry. 268-283;
- Irene Mollinedo-Gajate, Chenchen Song, Thomas Knöpfel. (2019). Genetically Encoded Fluorescent Calcium and Voltage Indicators. Handbook of Experimental Pharmacology. 209-229;
- Geoffrey S. Baird, David A. Zacharias, Roger Y. Tsien. (1999). Circular permutation and receptor insertion within green fluorescent proteins. Proc. Natl. Acad. Sci. U.S.A.. 96, 11241-11246;
- Shen Tang, Hing-Cheung Wong, Zhong-Min Wang, Yun Huang, Jin Zou, et. al.. (2011). Design and application of a class of sensors to monitor Ca 2+ dynamics in high Ca 2+ concentration cellular compartments. Proc. Natl. Acad. Sci. U.S.A.. 108, 16265-16270;
- Takeharu Nagai, Asako Sawano, Eun Sun Park, Atsushi Miyawaki. (2001). Circularly permuted green fluorescent proteins engineered to sense Ca 2+. Proc. Natl. Acad. Sci. U.S.A.. 98, 3197-3202;
- Yongxin Zhao, Satoko Araki, Jiahui Wu, Takayuki Teramoto, Yu-Fen Chang, et. al.. (2011). An Expanded Palette of Genetically Encoded Ca 2+ Indicators. Science. 333, 1888-1891;
- Joseph R. Lakowicz Principles of Fluorescence Spectroscopy — Springer US, 2006;
- Elizabeth A Jares-Erijman, Thomas M Jovin. (2003). FRET imaging. Nat Biotechnol. 21, 1387-1395;
- Valerie A. Romoser, Patricia M. Hinkle, Anthony Persechini. (1997). Detection in Living Cells of Ca2+-dependent Changes in the Fluorescence Emission of an Indicator Composed of Two Green Fluorescent Protein Variants Linked by a Calmodulin-binding Sequence. Journal of Biological Chemistry. 272, 13270-13274;
- Markus Waldeck-Weiermair, Muhammad Rizwan Alam, Muhammad Jadoon Khan, Andras T. Deak, Neelanjan Vishnu, et. al.. (2012). Spatiotemporal Correlations between Cytosolic and Mitochondrial Ca2+ Signals Using a Novel Red-Shifted Mitochondrial Targeted Cameleon. PLoS ONE. 7, e45917;
- Maria V. Kulakova, Azamat V. Karginov, Alexander I. Alexandrov, Michael O. Agaphonov. (2022). The GEM-GECO Calcium Indicator Is Useable in Ogataea parapolymorpha Yeast, but Aggravates Effects of Increased Cytosolic Calcium Levels. IJMS. 23, 10004;
- Jonathan M Kendall, Michael N Badminton. (1998). Aequorea victoria bioluminescence moves into an exciting new era. Trends in Biotechnology. 16, 216-224;
- Kiwamu Tanaka, Jeongmin Choi, Gary Stacey. (2013). Aequorin Luminescence-Based Functional Calcium Assay for Heterotrimeric G-Proteins in Arabidopsis. Methods in Molecular Biology. 45-54;
- Osamu Shimomura Bioluminescence — WORLD SCIENTIFIC, 2006;
- Andrey Yu. Gorokhovatsky, Victor V. Marchenkov, Natalia V. Rudenko, Tanya V. Ivashina, Vladimir N. Ksenzenko, et. al.. (2004). Fusion of Aequorea victoria GFP and aequorin provides their Ca2+-induced interaction that results in red shift of GFP absorption and efficient bioluminescence energy transfer. Biochemical and Biophysical Research Communications. 320, 703-711;
- Thomas Curie, Kelly L. Rogers, Cesare Colasante, Philippe BrûClet. (2007). Red-Shifted Aequorin-Based Bioluminescent Reporters for in Vivo Imaging of Ca2+ Signaling. Mol Imaging. 6;
- Adil Bakayan, Cecilia F. Vaquero, Fernando Picazo, Juan Llopis. (2011). Red Fluorescent Protein-Aequorin Fusions as Improved Bioluminescent Ca2+ Reporters in Single Cells and Mice. PLoS ONE. 6, e19520;
- Jasper Akerboom, Jonathan D.Vélez Rivera, María M.Rodríguez Guilbe, Elisa C.Alfaro Malavé, Hector H. Hernandez, et. al.. (2009). Crystal Structures of the GCaMP Calcium Sensor Reveal the Mechanism of Fluorescence Signal Change and Aid Rational Design. Journal of Biological Chemistry. 284, 6455-6464;
- Yaxiong Yang, Nan Liu, Yuanyuan He, Yuxia Liu, Lin Ge, et. al.. (2018). Improved calcium sensor GCaMP-X overcomes the calcium channel perturbations induced by the calmodulin in GCaMP. Nat Commun. 9;
- Nicholas A. Steinmetz, Christina Buetfering, Jerome Lecoq, Christian R. Lee, Andrew J. Peters, et. al.. (2017). Aberrant Cortical Activity in Multiple GCaMP6-Expressing Transgenic Mouse Lines. eNeuro. 4, ENEURO.0207-17.2017;
- Ina Gasterstädt, Alexander Jack, Tobias Stahlhut, Lisa-Marie Rennau, Steffen Gonda, Petra Wahle. (2020). Genetically Encoded Calcium Indicators Can Impair Dendrite Growth of Cortical Neurons. Front. Cell. Neurosci.. 14.






