12 методов в картинках: генная инженерия. Часть II: инструменты и техники
29 декабря 2017
12 методов в картинках: генная инженерия. Часть II: инструменты и техники
- 114240
- 2
- 103
рисунок Ольги Пташник
-
Авторы
-
Редакторы
-
Иллюстратор
Темы
О том, что генная инженерия изменила мир, знают почти все, а вот каким образом — только специалисты. Об этом редко рассказывают в школе, а непонятное всегда подозрительно. Этим умело пользуются «говорящие головы», транслируя с телеэкранов альтернативную реальность. Чтобы не пугаться ГМО и не демонизировать генных инженеров, достаточно хоть немного представлять их работу и знать, что будущее их творений регулируется даже слишком строго. В первой части статьи мы вспомнили историю этой отрасли и затронули этические и коммерческие вопросы, с нею связанные. А сейчас предлагаем заглянуть в мастерскую генного инженера — пройти краткий курс кройки и шитья ДНК и познакомиться с методами, расширившими границы фундаментальных исследований, биотехнологии и медицины.
12 биологических методов в картинках

Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Партнер этой статьи — SkyGen

5 причин выбрать SkyGen:
- Доступ к высококачественной продукции для молекулярной биологии
- Быстрая логистика и складская программа
- Удобное и взаимовыгодное сотрудничество
- Высококвалифицированная поддержка
- Адекватные цены
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь.
Поскольку генная инженерия появилась с первыми рекомбинантными ДНК, начнем наше повествование именно с них. Это вообще основа основ генной инженерии. Но вначале разберемся с терминологией.
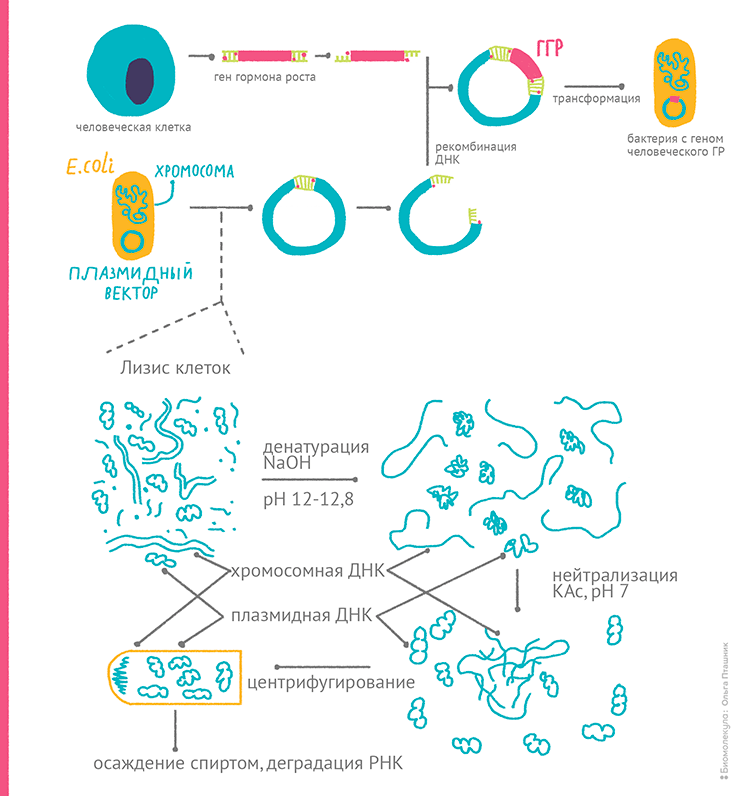
Понятие «рекомбинантная ДНК» тесно связано с понятием «клонирование». Если с первым термином всё понятно — это молекула, составленная из фрагментов ДНК разного происхождения, — то со вторым часто происходит путаница. Если речь, как в этой статье, идет о генной инженерии, то под клонированием обычно подразумевается молекулярное клонирование, то есть введение интересующего фрагмента ДНК в молекулу-вектор, которая вместе с собой размножит этот фрагмент в какой-то клетке. Иногда ген нужно не копировать в составе вектора, а встроить в хромосому клетки, и тогда он будет размножаться только вместе с ней, при клеточном делении, а значит, далеко не как на ксероксе. Поэтому в реальной лабораторной жизни молекулярщики говорят «Пойду-ка я клонировать ген Х», если собираются смастерить рекомбинантную ДНК — ввести ген Х в вектор Y.
Клонирование овцы Долли, резуховидки Таля и прочих организмов — совсем другие, клеточные и тканевые истории [1], [2]. Даже из этого определения ясно, что генно-инженерные организмы, частью которых стала рекомбинантная ДНК, не получаются так, как это любят изобразить анти-ГМО-лоббисты (рис. 1). И вообще, генетически модифицированные организмы (ГМО) получают далеко не только генно-инженерными манипуляциями (рис. 2), а генно-инженерными манипуляциями получают не только транс-, но и цисгенные и интрагенные организмы [155] — сбывшуюся мечту селекционера: встраиваемые в них гены происходят исключительно из них самих или родственников, способных с ними скрещиваться. Согласно опросам, такие плоды почему-то реже отбивают аппетит, чем трансгенные, полученные с применением «неродственных» фрагментов ДНК [3].

Рисунок 1. Это имеет отношение не к генной инженерии, а к фотошопу.
левое изображение из Think the anti-GMO movement is unscientific? Think again
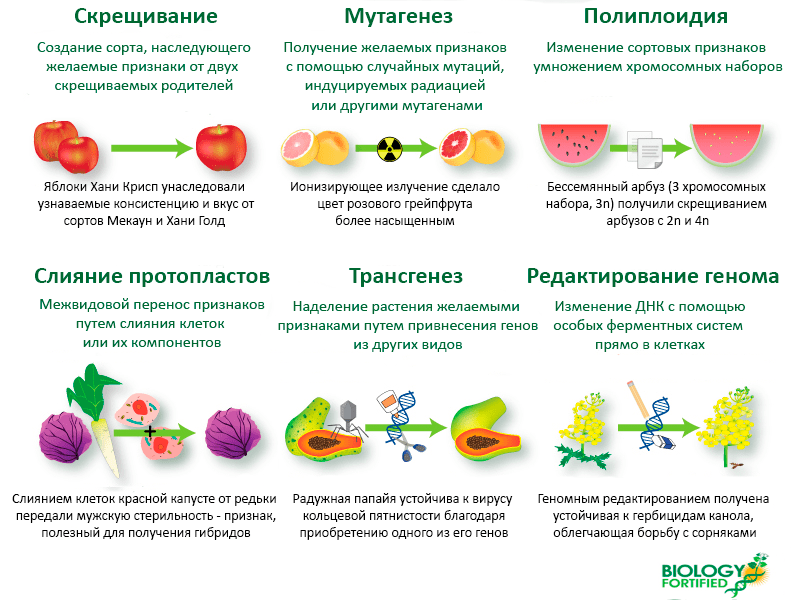
Рисунок 2. Основные способы генетической модификации сельхозкультур. К генной инженерии имеют отношение лишь два из них — трансгенез и геномное редактирование. Именно поэтому американский регулятор FDA обращает внимание на безопасность конечного продукта, а не на способ его получения — информацию несущественную, а значит, и не требующую указания на упаковке. Однако если в продукте по любой причине оказывается нетипичный для него белок, об этом следует упоминать — исключительно для аллергиков. Инфографика переведена на русский с небольшими изменениями.
Глава 1. Технологии рекомбинантных ДНК
Чтобы понять, как и почему действует генный инженер, не будет лишним освежить в памяти принципы работы нашего генома (см. врезку).
Мастерская генного инженера
Очевидно, что основной субстрат, с которым предстоит работать генному инженеру, — это ДНК. Но проверять, что получается на каждом этапе работы, и масштабно производить рекомбинантный продукт приходится с помощью живых организмов.
«Рабочие лошадки» генной инженерии
Живые организмы могут служить источниками полезных ферментов для биоинженерии — например, в ПЦР используют полимеразу, кодируемую геном термофильной бактерии Thermus aquaticus. Но сейчас нас больше интересуют живые объекты, способные служить «инкубаторами» рекомбинантных ДНК: те, что могут эффективно принимать, поддерживать, размножать или экспрессировать чужеродный генетический материал. Вернее, те, которые досконально изучены и с которыми научились всё это делать (рис. 5).
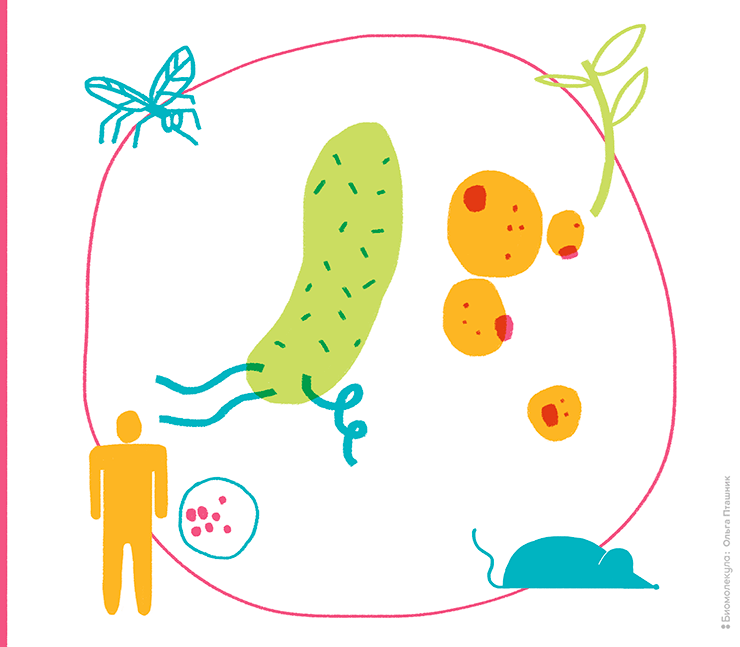
Рисунок 5. Инженерные миры: самые популярные объекты генетической модификации
рисунок Ольги Пташник
При создании/тестировании рекомбинантных ДНК сложно обойтись без кишечной палочки, и она же подходит для производства ряда биотехнологических продуктов. Если нужно изучать и экспрессировать эукариотические гены, часто прибегают к помощи пекарских дрожжей. Два этих микроорганизма стали универсальными моделями для изучения молекулярной организации и отработки генно-инженерных техник у про- и эукариот. Однако для масштабного производства многих продуктов больше подходят другие биосистемы.
1. Кишечная палочка (Escherichia coli) и другие бактерии. E. coli — грамотрицательная палочковидная γ-протеобактерия, исторически первый объект для тестирования почти всех типов векторов, большая часть которых была получена на основе плазмид и фагов этих же бактерий.
Для удобства и (в некоторых случаях) соблюдения техники безопасности работы с рекомбинантными ДНК созданы разнообразные мутанты кишечной палочки, например такие:
- с измененной мишенью какого-то антибиотика (мутанты gyrA96, rpsL), что полезно, например, для отбора этих штаммов среди всякой «грязи» на чашках Петри;
- с устойчивостью к бактериофагам;
- с повышенной чувствительностью к УФ-лучам (мутанты uvrA/B), чтобы уж наверняка уничтожить лабораторных «монстров» после экспериментов;
- неспособные передавать плазмиды другим клеткам;
- способные поддерживать векторы с мутациями, запрещающими их функционирование в других хозяевах (супрессорные штаммы);
- неспособные самостоятельно синтезировать какое-то жизненно важное вещество — ауксотрофы по аминокислоте (Cys−, Leu−) или витамину могут жить только на средах с соответствующей добавкой и потому, во-первых, подавляются нормальными микробами вне лаборатории, а во-вторых, легко отбраковываются, когда выполнят функцию доноров рекомбинантной ДНК при скрещиваниях с обычными штаммами;
- с мутациями, облегчающими выявление клеток с рекомбинантными ДНК — например, изменениями в lac-опероне для знаменитого сине-белого теста, о котором пойдет речь ниже;
- с релаксированным синтезом РНК — штаммы relA− могут продолжать транскрипцию, даже если у них заблокировать трансляцию;
- со сниженной способностью к рекомбинации (recA1−), разрезанию и метилированию чужеродной ДНК (endA−, dam−, dcm−), чтобы минуты жизни рекомбинантной ДНК в бактериальной клетке не были сочтены и чтобы эта ДНК после извлечения не отказывалась щепиться нужными ферментами.
Генные инженеры очень любят эту бактерию, потому что:
- она быстро наращивает клеточную массу (в самой быстрой фазе роста культуры период от появления новой клетки до ее разделения на две составляет около 20 минут);
- не нуждается в дорогих сложных средах и оборудовании;
- ее привычки, геном, биохимия и даже белковый профиль на электрофорезе прекрасно изучены [53];
- она чувствительна к большинству стандартных антибиотиков, что облегчает подбор селективных маркеров для клонирования;
- разработана уйма инструментов, «запчастей» и остроумных подходов для работы с этой биосистемой, а также ее мутантов на все случаи лабораторной жизни.
Но E. coli всё же не идеальна:
- она не обладает природной компетентностью, то есть для того чтобы она заглотила ДНК извне, нужно потрудиться;
- у нее совсем нет времени на обычные для любого эукариота операции с интронами и концами матричной РНК;
- она не умеет самостоятельно модифицировать, а иногда и сворачивать синтезированные белки так, как это нужно при экспрессии эукариотических генов: строить дисульфидные мостики, гликозилировать и т.п.;
- выход целевого продукта может снижаться из-за формирования неполноценных белков, накапливающихся в клетке в виде нерастворимых инклюзий;
- она способна секретировать целевой продукт в периплазму (зону между внутренней и внешней клеточными мембранами), но не в среду, если, конечно, не использовать в качестве векторов вирусы, лизирующие ее клеточную стенку, и иные ухищрения;
- продукты, полученные в E. coli, могут обладать пирогенными и токсическими свойствами, то есть нужны постоянный контроль и очистка.
Вывод таков: семь раз отмеряют почти всегда в E. coli, а вот масштабно синтезируют в ней немногие продукты, потому что сейчас есть альтернативные экспрессионные системы. В том числе и бактериальные.
2. Пекарские дрожжи (Saccharomyces cerevisiae) и их родственники. Всевозможные дрожжи хоть и микроскопические, но относятся к эукариотам — со всеми вытекающими: ядром, мембранными органеллами, особыми рибосомами, регуляцией экспрессии генов и путями транспорта белков. Правда, как и у прокариот, у пекарских дрожжей есть плазмиды — двухмикронные эгоисты, праздно сидящие в ядре и приносящие пользу разве что генным инженерам. Очевидно, что экспрессировать эукариотические гены S. cerevisiae и другие дрожжи умеют отлично. Но не любые гены. Потому что дрожжи одноклеточные, приспособленные эволюцией к быстрому размножению в меняющихся условиях среды, а значит, с неохотой совершающие «лишние» действия типа вырезания интронов и изобретательных модификаций белка. Да, они это делают, но не совсем так, как высшие эукариоты. В частности, они гликозилируют белки в тех же местах, но слишком скромно или, наоборот, «пышно» и аллергенно по сравнению с млекопитающими. Эту проблему иногда удается решить генетическим тюнингом, а именно — гуманизацией некоторых генов дрожжей.
Но главная особенность дрожжей — это потрясающая способность к гомологичной рекомбинации. Благодаря ей гены сахаромицетов можно легко заменять чужими и изучать их функции, если эти гены вводить в клетку в тесном соседстве с участком ДНК, (почти) идентичным какому-то участку дрожжевой хромосомы. Считается, что если бы мы походили по активности гомологичной рекомбинации на грибки, то давно бы заменили все свои бракованные детали и не страдали от генетических болезней.
S. cerevisiae со своими полностью секвенированными 16 хромосомами, безусловно, хорошие хозяева для рекомбинантных ДНК, однако и они не идеальны для промышленного получения рекомбинантных белков. Экономически выгоднее использовать некоторые другие дрожжи. Например, Pichia pastoris и Ogataea (Hansenula) polymorpha. Это метилотрофы, способные наращивать густую клеточную массу на дешевом и токсичном для других организмов метаноле. Гены продукта, который нужно получить (интерферона, инсулина, вакцинного белка и т.п.), «подставляются» под мощные промоторы, регулируемые простейшими веществами типа того же метанола или глицерола.
Итак, при производстве рекомбинантных белков дрожжи часто предпочитают кишечной палочке, несмотря на меньшую скорость роста и медленную индукцию синтеза, потому что:
- организовать экспрессию чужих эукариотических генов в них проще;
- их продукты лишены пирогенности и токсичности (но не аллергенности);
- они более-менее умеют редактировать матричную РНК, доводить до кондиции и секретировать в среду чужеродные белки;
- у некоторых видов выход продукта намного превышает бактериальный.
3. Культуры клеток насекомых. Известны сотни клеточных линий насекомых, полученных из разных бабочек, дрозофилы и других организмов. Для них разработаны бакуловирусные системы доставки генов, позволяющие производить более 500 белков млекопитающих и вирусов, 95% из которых имеют правильные посттрансляционные модификации. Паттерн гликозилирования у этой биосистемы слегка, но всё же отличается от человеческого, и если это считается недостатком при производстве терапевтических препаратов для людей, то при наработке вакцинных антигенов даже предпочтительно. Гуманизировать рекомбинантные гликопротеины позволяет замена генов гликозилтрансфераз насекомых на варианты, типичные для млекопитающих. Так создали, например, клеточную линию SfSWT-3.
Если экспрессия гетерологичных генов в клетках млекопитающих часто требует модификации их самих, то в случае клеток насекомых обычно обходятся подготовкой векторов, что сокращает время от клонирования гена до получения его продукта с месяцев до недель. Очень популярна клеточная линия Sf9, полученная из яичников гусеницы-вредителя Spodoptera frugiperda, а также линии Tn-368 и High Five из яичников гусеницы Trichoplusia ni. Эти клетки довольно неприхотливы, могут расти в суспензии и дают большой выход функционального рекомбинантного продукта. Различия этих линий и получение с их помощью чужеродных белков детально разобраны в обзоре [9]. Получение продукта в клетках насекомых обходится дороже, чем в дрожжевых системах, но всё же не настолько, как в клетках млекопитающих.
4. Культуры клеток млекопитающих. Они лишены несовершенств, связанных с посттрансляционной модификацией, но культивировать их сложнее и дороже, чем клетки насекомых и тем более микроорганизмов: контактное торможение роста, горы пластика, дорогие компоненты среды и оборудование. Однако контактное торможение мешает не всем культурам. Клеточные линии, полученные из опухолей, типа знаменитой HeLa [10], с ним не знакомы — они бессмертны. Клеточным культурам и технологиям «Биомолекула» посвятила отдельную статью [2].
5. Растения. О генетической модификации растений написано немало, знакомство с ней можно начать, например, обратившись к статье [11]. Отметим лишь, что растения как биофабрики довольно дешевы, при этом получаемые с их помощью продукты не содержат токсинов и пирогенов. Самое неприятное при работе с ними — толстые клеточные стенки, требующие для введения ДНК всяческих изощрений.
6. Человек и другие животные. Рекомбинантные ДНК в организме человека призваны выполнять терапевтические, диагностические или профилактические функции, а вот в прочих организмах спектр их задач очень широк — от исследований и защиты до лечения и производства ценных веществ (у всех на слуху «трансгенное» молоко) или даже органов [12], [13].
Итак, генный инженер может работать с любыми живыми системами, однако выбор системы для той или иной цели производится исходя из экономических, эргономических и в некоторых случаях этических соображений. Но ввести нужный ген в выбранную систему просто так, в гордом одиночестве, либо не получится, либо он долго в ней не протянет. Поэтому его помещают в специальные молекулы-носители — векторы. Они решают проблемы доставки клонированного гена в нужные клетки, его стабильного/временного поддержания там и эффективной экспрессии.
Векторы для клонирования и экспрессии генов
Идеальный вектор должен обладать:
- местами для удобного встраивания фрагментов ДНК;
- достаточной ёмкостью;
- селективными маркерами, позволяющими выявлять клетки с этим вектором — как «пустым», так и со «вставкой»;
- участками ДНК, обеспечивающими его поддержание в виде отдельного репликона либо интеграцию клонированного фрагмента в хозяйский геном;
- участками ДНК, обеспечивающими (если требуется) эффективную экспрессию встроенного гена в выбранном хозяине.
Классифицируют векторы в зависимости от хозяев, в которых им предстоит попасть (бактериальные, дрожжевые и т.п.), в зависимости от типа репликона (плазмидные, вирусные, комбинированные, челночные, искусственные хромосомы) и в зависимости от функционального назначения (интегративные, экспрессионные, векторы для клонирования, секвенирования или транскрипции). Подобрать и заказать подходящие векторы для своих экспериментов можно, обратившись к базе AddGene или каталогам коммерческих компаний, а если что-то в готовых векторах не устроит, их можно доработать самостоятельно.
1. Векторы для бактерии E. coli
В большинстве случаев для работы с бактериями выбирают плазмидные векторы — их разработано великое множество, для любых исследовательских и производственных капризов. Для специфических целей используют вирусные, а точнее — фаговые, векторы или искусственные хромосомы. Без ущерба для репликации и стабильности конструкции большинство векторов может «выдюжить» до 15 т.п.н. чужеродной ДНК. Но есть специальные системы типа космид и λ-векторов, подходящие для клонирования крупных фрагментов и создания так называемых геномных библиотек — коллекций векторов, несущих разные фрагменты чьего-то генома и поддерживающихся в разных бактериальных клонах. Каждый крупный библиотечный фрагмент можно делить на мелкие, помещая их в обычные векторы и создавая таким образом субгеномные библиотеки.
а) Плазмидные векторы
Это небольшие кольцевые молекулы ДНК (чаще до 10 т.п.н.), построенные на основе типичных для бактерий внехромосомных репликонов — плазмид, которые могут кодировать устойчивость к антибиотикам, тяжелым металлам, разные интересные метаболические пути и регуляторные белки. [14]. Правда, нередко на них лежит вина за поражение хозяина тем или иным фагом. Плазмиды могут независимо размножаться в каком-то определенном круге хозяев — узком или широком, — а многие из них умеют передавать свои копии другим бактериям или даже клеткам эукариот в процессе «спаривания», или конъюгации. В природном виде эти мобильные элементы для клонирования обычно не используют, а создают химеры, содержащие только самое необходимое:
- место начала репликации (origin, oriV);
- соответствующий ген белка — инициатора репликации (rep) и другие элементы контроля репликации (необходимость во всём этом определяется типом ori);
- последовательности, обеспечивающие стабильное поддержание вектора в бактериальном потомстве (это нужно только для низкокопийных плазмид, которые не могут полагаться на авось при распределении своих дефицитных копий по разделяющимся клеткам хозяина);
- селективный/детекционный маркер (чаще это ген устойчивости к антибиотику — ампициллину, тетрациклину, канамицину — и/или часть гена lacZ);
- полилинкер, или мультиклональный сайт (MCS) — компактный фрагмент ДНК, буквально напичканный последовательностями, распознаваемыми разными ферментами-ножницами — рестриктазами; в разрез, сделанный каким-то ферментом (или двумя) как раз и вставляется клонируемый ген, поэтому сайты рестриктаз из MCS не должны встречаться где-то еще в векторе, иначе он развалится.
Чаще всего коливекторы получают на основе репликона плазмид ColE1-семейства, интересного своей регуляцией контроля копийности [15]. Добавлением хлорамфеникола в культуральную среду число копий таких векторов можно увеличить с нескольких десятков до 3000 на клетку. Но если нужно размножать клонированный ген интенсивно, можно просто выбрать векторы pUC18/19 (рис. 6) из того же семейства, но с мутантным ori плазмиды pMB1: они могут выдавать больше 500 копий на клетку без каких бы то ни было ухищрений.
Очень часто бывает нужно ввести один и тот же ген и в E. coli, и в другую бактерию или эукариота. В таких случаях очень удобно использовать челночные (маятниковые, двудомные, шаттл-) векторы. Они содержат элементы, обеспечивающие их поддержание и детекцию в клетках нескольких типов. Здесь важно помнить, что селективные маркеры для отбора рекомбинантных клонов E. coli часто не подходят даже для других бактерий, не то что эукариот. Поэтому может потребоваться коррекция дозы антибиотика для селекции или введение в стандартные векторы новых деталей (рис. 6). К счастью, сейчас несложно добыть уже готовый челночный вектор с нужными свойствами.
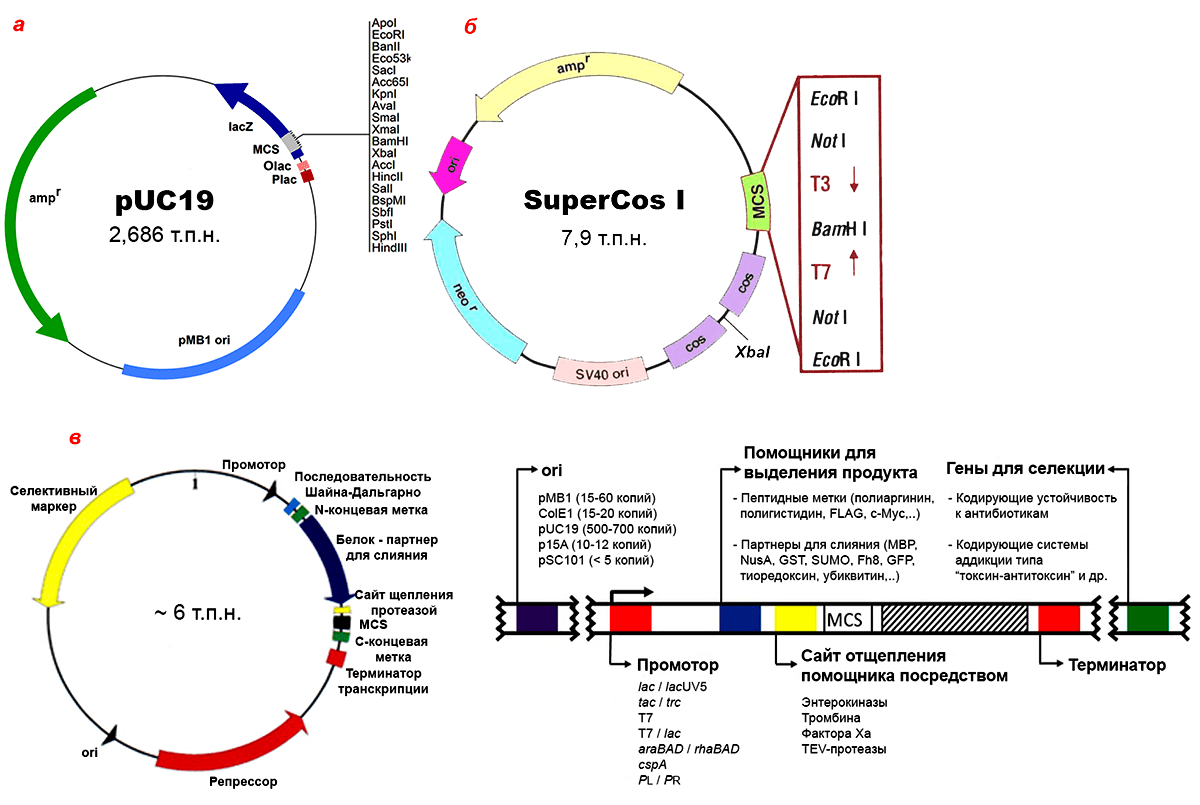
Рисунок 6. Примеры плазмидных векторов E. coli. а — Карта стандартного плазмидного высококопийного вектора pUC19. Кроме ori для репликации в E. coli, вектор содержит ген β-лактамазы, обеспечивающий устойчивость бактерии к ампициллину (ampr), а также полилинкер (MCS), встроенный прямо в α-фрагмент гена lacZ, необходимого для детекции рекомбинантных бактериальных клонов с помощью сине-белого теста. Olac и Plac — оператор (место связывания lac-репрессора) и промотор лактозного оперона соответственно, они нужны для работы lacZ. б — Карта SuperCos I, космидного шаттл-вектора: помимо бактериального ori и гена устойчивости к ампициллину у него есть ori вируса SV40, позволяющий космиде размножаться в клетках млекопитающих, и ген neor, обеспечивающий устойчивость бактерий к канамицину, а эукариотических клеток — к похожему антибиотику G418. Между фаговыми cos-сайтами находится место узнавания рестриктазы XbaI (для линеаризации вектора перед клонированием), в центре MCS — рестриктазы BamHI (для клонирования фрагмента размером 30–42 т.п.н.), по краям – других рестриктаз (для вырезания фрагмента). Т3 и Т7 — промоторы фаговых РНК-полимераз, которыми можно транскрибировать любую из двух цепей клонированного фрагмента (перед этим вектор надо линеаризовать!). в — Архитектура и анатомия типичного экспрессионного вектора. На схеме обозначены белковые продукты, но в векторе, разумеется, находятся их гены. N- и C-концевые метки, фьюжн-партнер и репрессор кодируются не всеми экспрессионными векторами. Некоторые векторы обеспечивают пришивание к целевому продукту сигнального пептида, транспортирующего его по нужному клеточному адресу, а некоторые содержат ori фага f1, что делает их фагмидами.
Среди челночных векторов особняком стоит группа плазмид для исследования промоторов (promoter-probe vectors). В их MCS клонируют не гены, а их предполагаемые промоторы. За MCS встроен беспромоторный репортерный ген. В случае шаттлов E. coli—Actinomycetales pEPR1 и pRAG5 это ген знаменитого зеленого флуоресцентного белка (GFP). Если под ультрафиолетом колонии бактерий с такой конструкцией светятся зеленым, значит, в MCS действительно встроен промотор, и чем он сильнее, тем интенсивнее флуоресценция. Устройство pRAG5 позволяет даже исключить влияние копийности вектора на силу свечения [16]. Однако нужно помнить, что в E. coli чужие промоторы работать не обязаны, поэтому их силу оценивают в исконных хозяевах (например, актиномицетах). Те тоже могут незазеленеть, если промотор окажется не конститутивным, а индуцибельным, но это повод не расстраиваться, а изучать по флуоресценции эффективность разных индукторов.
Одним из вариантов плазмидного вектора считают космиду (рис. 6). От обычной плазмиды она отличается лишь тем, что содержит когезивные концы ДНК фага λ (cos-последовательности). Благодаря их «слипанию» вектор может реплицироваться в клетке как обычная кольцевая плазмида, а в линеаризованном состоянии — упаковываться в головки фага λ in vitro (искусственно, в пробирке). «Одежда» стабилизирует рекомбинантную ДНК и повышает эффективность ее введения в другие клетки, поэтому чужеродная вставка может быть длиннее, чем в обычном плазмидном векторе. Тем не менее ее размер должен укладываться в интервал 30–45 т.п.н., что с учетом длины самогó вектора как раз приблизится к размеру ДНК фага λ и не вызовет проблем с упаковкой или инфекционностью (λ может втиснуть в головку 38–52 т.п.н. двухцепочечной ДНК с cos-сайтами). Повышенная векторная ёмкость позволяет составлять из космид геномные библиотеки, ведь при клонировании в них целого генома получается гораздо меньше «томов». Меньше, но не мало. Так, хромосому бактерии Streptomyces coelicolor A3(2) длиной 8 млн п.н. удалось разместить минимум в 319 космидах. Большей векторной ёмкостью обладают лишь искусственные хромосомы.
Самый сложный тип плазмидного вектора — экспрессионный. Он может быть и челночным, и даже комбинированным — сочетать плазмидное и фаговое поведение (см. раздел о фагмидах ниже). Эти векторы должны обеспечивать не только поддержание клонированного гена, но и эффективное производство его продукта в клетках хозяина. Для этого в вектор, содержащий MCS и селективные маркеры, встраивают еще и экспрессионную кассету (рис. 6). Она состоит как минимум из сильных промотора и терминатора транскрипции, а также эффективных последовательностей для инициации и прекращения трансляции: Шайна—Дальгарно на правильном расстоянии от старт-кодона ATG (реже — GТG) и парочки стоп-кодонов (ТАА — лучший) после встраиваемого гена — и всё это должно попасть в одну рамку считывания. Поскольку, как мы знаем, у E. coli часто возникают проблемы с правильным формированием и выведением чужеродных белков, ей всячески помогают биоинженеры. Еще на этапе создания вектора они предусматривают пришивание к концам целевого белка коротких пептидных меток (тэгов, эпитопов) и/или полноценных белков, которые повышают растворимость и термостабильность рекомбинантного продукта. Многие из них облегчают его детекцию и очистку (аффинные метки): например, с помощью гексагистидина, c-Myc или тиоредоксина можно отловить сшитый с ними белок на колонках с антителами или иными молекулами [17], а GFP своей зеленой флуоресценцией не даст целевому белку затеряться во время выделения и очистки. В конце концов отслуживших помощников отрезают какой-либо протеазой.
Устройство бактериальных экспрессионных векторов детально разобрано на сайте Европейской лаборатории молекулярной биологии (EMBL), там же приведен и список таких векторов. Отметим лишь, что при выборе экспрессионной системы полезно изучить матчасть, связанную с ее регуляцией, ведь чтобы система показала всё, на что способна, ее нужно строго контролировать — включать только в определенный момент роста бактериальной культуры. И здесь генным инженерам приходится соревноваться с природой в остроумии (см. врезку). Ну и еще одно затруднение возникает со способами селекции при промышленном производстве рекомбинантных белков: добавление антибиотиков в огромные культиваторы (ферментёры) — удовольствие дорогое, а иногда и просто неприемлемое. Поэтому в последнее время усиленно разрабатывают альтернативные системы стабилизации плазмид в бактериях и селекции рекомбинантных клонов. Например, вместо генов антибиотикорезистентности можно использовать гены систем зависимости от плазмид (plasmid addiction systems) [18]. Они работают по принципу «есть плазмида — будешь жить» (или «есть плазмида — будешь жить при таких-то условиях»), вытесняя из бактериальной популяции безвекторные клетки.
Вообще, большинство плазмидных векторов позволяет делать еще что-то, кроме клонирования. Иногда в них размещают промоторы, узнаваемые фаговыми, то есть самыми простыми, РНК-полимеразами: Т3, T7 или SP6. Обычно два разных промотора ограничивают клонируемый в MCS фрагмент ДНК (и это не обязательно целый ген). Если на другом векторе запустить в клетку ген одной из полимераз, начнется транскрипция соответствующей цепи клонированного фрагмента. А можно просто капнуть в реакционную смесь готовую полимеразу. Это недешево, то есть не для промышленных масштабов, зато легко. При добавлении в смесь чем-нибудь меченных нуклеотидов получившиеся транскрипты можно использовать в качестве зондов для гибридизации, чтобы найти комплементарные последовательности в геномных библиотеках или понять, экспрессируется ли соответствующий ген. Если MCS любого из векторов фланкирован последовательностями, на которые «садятся» стандартные коммерческие олигонуклеотиды (праймеры) M13F/M13R или SP6/T7, то прямо в этих векторах можно «читать» последовательность клонированного гена, то есть его секвенировать [20].
В некоторых ситуациях автономный высококопийный вектор может быть персоной нон грата. С другой стороны, E. coli, в отличие от некоторых грамположительных бактерий и тем более дрожжей, не склонна с легкостью «прописывать» чужую ДНК в своей хромосоме. Решается эта проблема с помощью интегративных векторов: они позволяют встраивать клонированные гены в ДНК хозяина по механизму гомологичной или фаговой сайт-специфической рекомбинации. Таким способом биологи хотят не запредельно размножить ген, а надолго закрепить его в хозяине и оптимизировать экспрессию, предупредив попытки бактерии сбросить с себя плазмидный груз. В бактериальную хромосому вполне реально интегрировать и несколько копий гена — чтобы увеличить выход продукта.
Если ставка делается на гомологичную рекомбинацию, нужно соблюсти следующие условия:
- интегративный вектор не должен автономно реплицироваться в выбранной бактерии (или низкокопийный условный ori потом удаляется);
- бактерия не должна быть дефектной по гену рекомбиназы RecA, или же рекомбиназную систему нужно вносить на вспомогательной плазмиде;
- в векторе должны быть участки (не менее 50 п.н.), гомологичные месту хозяйского генома, в которое планируется поместить интересующий ген с промотором; один такой участок обеспечит встраивание этого гена с целой плазмидой, два участка гомологии, фланкирующие клонированный ген, обеспечат встраивание только участка, находящегося между ними (рис. 7);
- место, куда планируется внедрять плазмиду/ген, должно быть неважным для клетки, и сама вставка не должна нарушать работу соседних генов.
Если интеграцию планируют осуществлять иначе, подобно фагам типа λ, то придерживаются тех же правил, кроме обеспечения RecA-активности и гомологии в векторе. Вместо этого в вектор помещают фаговый сайт интеграции attP, напарника хромосомного сайта attВ (рис. 7). В каждом из них находятся инвертированные повторы, с которыми связывается фаговая интеграза, чтобы провести рекомбинацию между хозяйской и векторной ДНК и вставить таким образом плазмиду в хромосому. Соответственно, на дополнительном векторе нужно вводить ген интегразы.
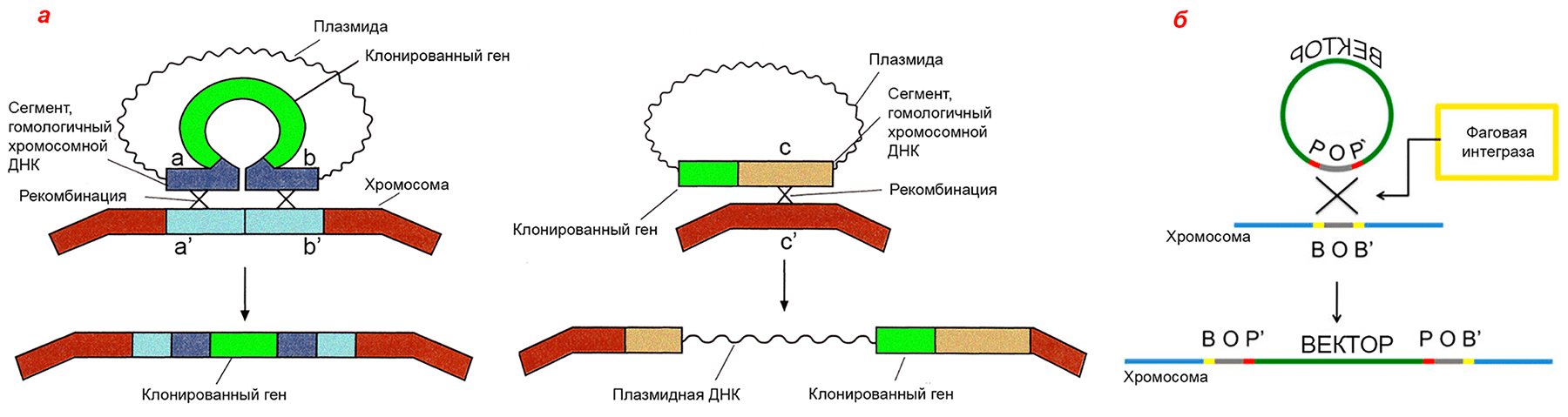
Рисунок 7. Механизмы интеграции клонированного гена в хромосому E. coli. а — Гомологичная рекомбинация. Слева — двойной кроссинговер, если в векторе два участка, гомологичных хромосомной ДНК, справа — одиночный кроссинговер, если такой участок один. Место интеграции при этом удваивается, образуя прямые повторы по фланкам встроившейся ДНК, что позже может привести к ее вырезанию путем той же самой гомологичной рекомбинации. б — Сайт-специфическая рекомбинация. Вектор содержит фаговый сайт attP (P-O-P′), бактериальная хромосома — его партнера, attB (B-O-B′). В центральной области эти сайты сходны, по краям — разные. Фаговая интеграза, кодируемая дополнительной плазмидой, внедряет вектор в хромосому рекомбинацией ДНК между сайтами. Вектор оказывается между химерными сайтами B-O-P′ и P-O-B′.
Независимо от выбранного подхода необходимо обеспечить удобную селекцию интегрантов. В промышленности стараются обходиться без антибиотиков или вырезать из ДНК штамма-продуцента отработавшие гены антибиотикорезистентности [21]: селективное давление в пользу интегрантов обеспечивать не нужно — введенный ген стал для бактерий «родным». «Готовый к интеграции» вектор BioBrick, например, позволяет вводить гены в хромосому E. coli любым из двух способов, с минимальными усилиями и возможностью одновременного вырезания условного ori и селективного маркера. Разумеется, есть и векторы, реплицирующиеся только в E. coli, а в другой бактерии встраивающиеся в хромосому, если в них предусмотрены участки гомологии. Метод интеграции хорош для фундаментальных исследований, изменения метаболических путей и стабильной наработки веществ, особенно цитотоксичных. А еще с помощью внедренной плазмиды можно вытаскивать для исследования прилегающие к ней куски хромосомы про- и эукариот — этот метод называется plasmid rescue (см. главу 4).
б) Фаговые (вирусные) векторы
Это перекроенные ДНК бактериофагов двух типов. Их разнообразие невелико, и используют их гораздо реже плазмид, но чужеродные гены с их помощью проникают в бактериальные клетки эффективнее: в конце концов, у эволюции было время отшлифовать паразитарные таланты вирусов.
Векторы на основе фага λ. Вирус лямбда представляет собой двухцепочечную линейную ДНК, упакованную в классический фаговый костюм — с головкой, отростком и прочими марсианскими деталями [23]. Однако при всей своей типичности этот фаг уже более полувека подогревает исследовательский интерес [24]. Встретившись с подходящей E. coli, лямбда «раздевается» и в виде ДНК с «липкими», то есть одноцепочечными и комплементарными друг другу, концами (cos-сайтами) проникает в цитоплазму. Там «липкие» концы замыкают ДНК в кольцо, она реплицируется, экспрессируется — в общем, делает всё, чтобы наплодить около сотни потомков, которые «оденутся» и дружным выходом лизируют (разрушат) клетку. Но фаг λ не зря называют умеренным — так агрессивно он поступает не всегда и вместо литического сценария действует по лизогенному: его ДНК встраивается в хромосому клетки и мирно путешествует в ней по бактериальным поколениям. Когда хозяин испытывает стресс, фаг спешит вырезаться из хромосомы и вовремя покинуть клетку, запустив литический цикл. Генному инженеру выгоднее использовать агрессивное поведение фага: если вырезать из фаговой ДНК крупный центральный кусок, отвечающий за никому не нужную лизогению, то вместо него можно встроить любую последовательность размером от 8 до 23 т.п.н. А это уже не мало и для создания библиотек, и для экспрессии чужеродных генов. Помимо векторов замещения (рис. 8) существуют и векторы внедрения (инсерционные). В носителях первого типа до клонирования нужно держать «заплатку», позволяющую им нормально упаковываться в требовательную к размеру ДНК головку λ. Во втором типе из фага почти ничего не вырезается (кроме ненужных рестрикционных мест, конечно), а чужеродная ДНК помещается, например, в ген репрессора CI. Этим заодно предупреждаются и попытки вектора зажить тихой жизнью умеренного фага. Но у такого клонирования есть огромный минус: к λ-ДНК можно добавить не более 11 т.п.н.
Каким бы ни был вектор на основе фага λ, он отличается от космиды тем, что распространяется по бактериальной культуре самостоятельно: биологи, единожды собственноручно упаковав векторную/рекомбинантную ДНК в фаговый «чехол», далее полагаются на природные процессы ее распространения. То есть фаговый вектор — это просто модифицированный вирус. Космида же не кодирует ничего фагового, кроме липких концов, а потому не может самостоятельно порождать фаговые частицы и заражать новые клетки. Такова цена повышенной векторной ёмкости.

Рисунок 8. Фаговые векторы. Слева — λ-Вектор замещения. Левое плечо (L) фаговой ДНК отвечает за синтез головки и отростка, правое (R) — за литический цикл, центральная область — за лизогенный (в составе хромосомы). Последнюю можно безболезненно заменить интересующей ДНК определенного размера и даже без селективных маркеров, так как только векторы со вставкой смогут образовать инфекционные частицы. Многие λ-векторы можно купить уже в виде двух плеч. Справа — M13mp18, одноцепочечный вектор на основе фага M13 (можно купить и двухцепочечный — M13mp18 RF). Зеленым обозначена ДНК фага, черным — полилинкер для клонирования, внедренный в lacZα (розовый), остальные элементы обеспечивают детекцию рекомбинантных ДНК с помощью lacZ (сине-белого теста).
сайты bio3400.nicerweb.com и wwnorton.com, рисунки адаптированы
Векторы на основе фага М13. Этот фаг совсем не похож на λ (рис. 8) и на образ фага вообще — он нитчатый, его ДНК кольцевая и одноцепочечная. Векторы на его основе не участвуют в ёмкостной гонке, а служат для других целей. Распознав подходящего хозяина по половым пилям на клетке, М13 «раздевается», и по матрице его ДНК синтезируется копия — формируется двухцепочечная, репликативная форма (RF) фага. Но в состав вириона потом войдет лишь одноцепочечная ДНК, причем в отношении ее размера М13 не капризен. Другой вопрос, что ему нужно абсолютно всё, что он кодирует, поэтому только небольшие вставки не нарушат репликацию этого фага. М13-векторы содержат типичные для плазмид системы селекции — например, lacZα со всем необходимым. От лямбды М13 отличается деликатностью в отношении хозяина: фаг немного замедляет его развитие, но «одевается» тихонько и уходит по-английски. Одноцепочечную рекомбинантную ДНК выделяют из фагов, которых находят в слабо выраженных бляшках на газоне E. coli, а двухцепочечную — как обычную плазмиду из расположенных там же клеток.
Одноцепочечные векторы удобны для приготовления меченых зондов, олигонуклеотид-направляемого мутагенеза (см. главу 2) и секвенирования дидезоксиметодом. Последняя цель уходит в историю, потому что и секвенировать сейчас стараются иначе [20], и приспособленных для этого плазмид уже немало. Сайт-специфический мутагенез с помощью олигонуклеотидов, напротив, набирает обороты: его быстрота и прецизионность немыслимы для классического, случайного мутагенеза. Он активно применяется в фундаментальных исследованиях, производстве ГМО и белковой инженерии. Другой вопрос, что олигонуклеотид-направляемый мутагенез сейчас реже опирается на М13-векторы и чаще сочетается с ПЦР и техниками редактирования генома in vivo [25], [26].
в) Комбинированные векторы (фагмиды)
У этих векторов есть фаговый ori одноцепочечной репликации, позволяющий им копироваться как нормальный M13, и если в клетку с ними запустить родственный фаг-помощник, то фагмиды присвоят его «одежду» и покинут клетку для заражения своей одноцепочечной ДНК новых хозяев. Если биологам не интересна вирусная ипостась фагмиды, с ней можно работать как с обычной двухцепочечной плазмидой. Такие векторы обычно снабжены транскрипционными и/или экспрессионными опциями [27]. Одна из самых популярных серий фагмидных векторов — pBluescript.
г) Искусственные хромосомы — бактериальные (BAC) и фаговые (PAC)
BAC — кольцевые ДНК, выстроенные на базе репликона F-плазмиды (полового фактора): они содержат ori, rep- и par-гены, обеспечивающие репликацию и стабильное поддержание в ряду бактериальных поколений этого 1–2-копийного вектора. В состав BAC также вводят сайты loxP из фага Р1 и cos — из λ. Расщепление вектора в этих сайтах соответствующими фаговыми ферментами позволяет метить его концы и картировать рекомбинантную ДНК. BAC может вместить 100–350 т.п.н. (изредка больше) чужеродной ДНК при собственном размере до 9 т.п.н. Но чтобы такая генетическая махина не перекроилась в клетке, хозяин должен быть RecA-дефектным. Некоторые BAC помимо ori F-фактора снабжены высококопийным условным ori pUC-типа: его можно «включать» добавлением индуктора буквально на пару часов, чтобы наработать побольше векторных молекул, не дестабилизировав их. Селективными маркерами служат стандартные гены антибиотикорезистентности и lacZα. Есть варианты BAC, уничтожающие своих хозяев, если в них оказывается вектор без клонированной вставки, «пустые». В векторе pSMART® BAC, например, изначально стои́т заплатка lacZ-sacB, которая при клонировании замещается нужной ДНК. Поскольку бациллярный ген sacB обеспечивает превращение сахарозы в леван, токсичный для E. coli, на среде с сахарозой смогут расти только клоны без этого гена, а значит, с нужной вставкой.
Векторы РАС созданы на основе репликона фага P1 (отсюда и первая буква в аббревиатуре). Этот вирус известен своим двуличием: он может поддерживаться в бактерии как обычная плазмида или развиваться как литический фаг. Известен он и уникальной системой рекомбинации, Cre–lox, замыкающей его линейную двухцепочечную ДНК в кольцо и решающую проблему распутывания плазмидных копий [28]. Эта система очень приглянулась генным инженерам, и они позаимствовали ее для геномного редактирования (см. главу 3). В РАС оставили лишь самое необходимое для упаковки ДНК в фаговую оболочку и дополнили конструкцию элементами F-плазмиды. PAC немного крупнее BAC (15–19 т.п.н.), но вмещают почти столько же ДНК, если их не заставляют упаковываться в головку P1: больше 110 т.п.н. туда не влезет. В РАС предусмотрели очень интересную систему селекции рекомбинантных молекул. Место для клонирования находится между промотором и orf гена sacB, но до клонирования оно занято ori вектора pUC. Это позволяет биологам хорошенько размножить вектор, а клетке не бедствовать на среде с сахарозой, потому что sacB «прерван». А вот после процедуры клонирования система селекции работает против бактерий с вектором, замкнувшимся на себя — без нужной вставки и без фрагмента pUC, — потому что на среде с сахарозой клоны с «восстановленным» sacB будут гибнуть. Чтобы получить только клетки с желаемой вставкой, нужно тщательно избавляться от фрагмента pUC перед клонированием.
Искусственные бактериальные хромосомы идеальны для построения библиотек геномов млекопитающих, их секвенирования и картирования, для клонирования отдельных крупных генов с регуляторными элементами или целых вирусных геномов для моделирования инфекций.
Подытожим коливекторную тему схемой, иллюстрирующей назначение разных типов конструкций (рис. 9). Но как бы ни были полезны векторы, немало ситуаций, когда бактериальные клетки от них приходится избавлять — излечивать. Еще совсем недавно плазмиды элиминировали преимущественно химическими мутагенами и не всегда успешно. В 2017 году новомодные инструменты редактирования геномов наконец добрались и до векторов. Теперь лечить бактерий от плазмид можно быстро и остроумно [29].
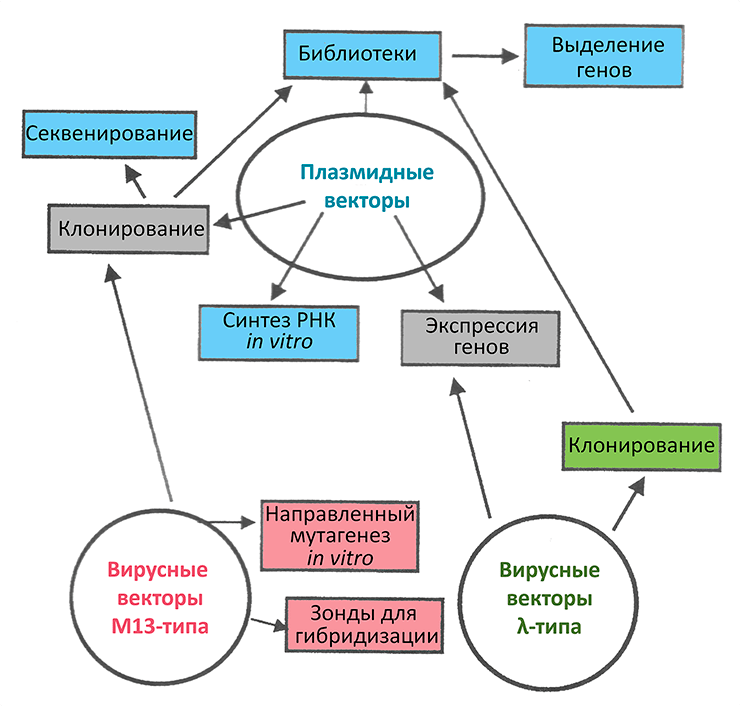
Рисунок 9. Применение основных типов векторов E. coli.
[30], рисунок адаптирован
2. Векторы для дрожжей S. cerevisiae
Как правило, под такими векторами подразумевают колийно-дрожжевые шаттлы (рис. 10), включая те, что ведут себя как репликативные в E. coli и интегративные в S. cerevisiae. Соответственно, клонирование и первоначальный отбор рекомбинантных конструкций проводят в бактериях, а затем переправляют их в грибы.
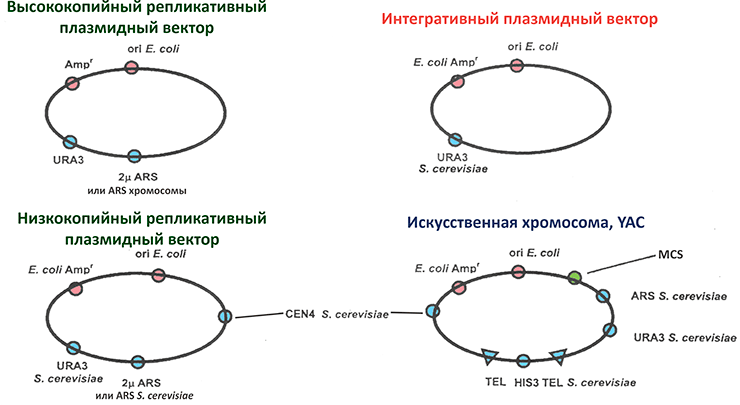
Рисунок 10. Сравнение архитектуры основных типов векторов S. cerevisiae. Заметим, что YAC — тоже шаттлы: если они замкнуты в кольцо, то могут поддерживаться и в E. coli. Розовым обозначены элементы, работающие в бактериях, голубым — в дрожжах. Ampr — устойчивость к ампициллину (пример селективного маркера), TEL — теломеры. Остальные сокращения приведены в тексте статьи.
Помимо MCS, бактериальных селективных маркеров и ori они содержат гены, обеспечивающие селекцию и поддержание рекомбинантных ДНК в дрожжах. Выбор детерминант антибиотикорезистентности, работающих в эукариотах, ограничен и сводится к генам устойчивости к генетицину, циклогексимиду, гигромицину, ионам меди. Предпочитают первый вариант — ген неомицинфосфотрансферазы (neoR), которая противостоит мономицину, неомицину и канамицину у прокариот и генетицину (G418) — у эукариот. Но чаще в дрожжевой инженерии пользуются свойством комплементации — компенсации какого-то дефекта посредством вводимой ДНК. Например, используют штаммы, ауксотрофные по какой-то аминокислоте (Trp−, Leu−) или неспособные синтезировать пиримидиновые азотистые основания (Ura−): они выживают только на средах с соответствующей добавкой, пока в них не попадет вектор с рабочим геном, компенсирующим ауксотрофность. Поэтому часто селективными маркерами становятся гены URA3, LEU2, HIS3, TRP1. В ряде векторов предусмотрена возможность оперативной замены маркеров с помощью систем сайт-специфической рекомбинации Cre-lox или Flp-FRT (см. главу 3). А техники типа CRISPR-Cas-редактирования вообще позволяют обходиться без маркеров, но, к сожалению, решают не все инженерные задачи [31].
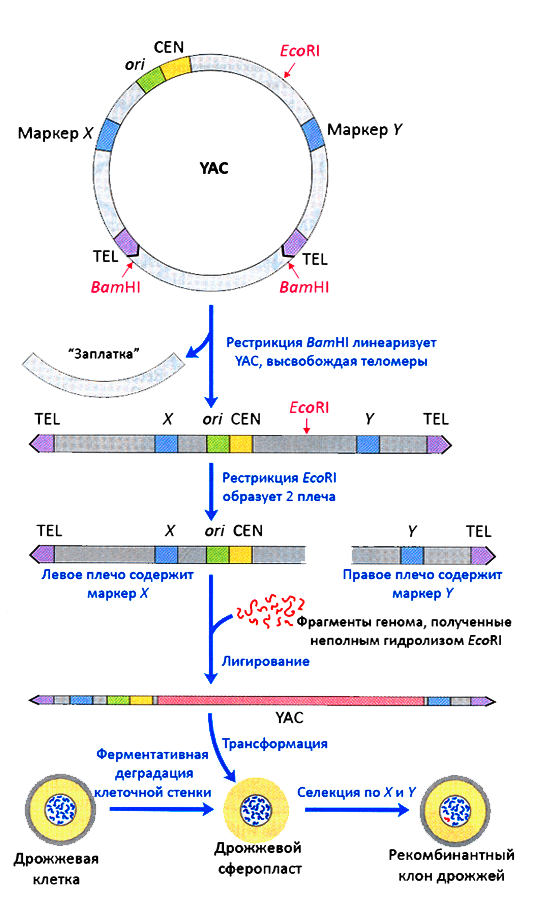
У неинтегративных векторов дрожжей независимая от хромосом репликация обеспечивается ARS-элементами (autonomously replicating sequences), взятыми из дрожжевых хромосом или 2-микронной плазмиды. Такие векторы можно разделить на простые и центромерные. Первые способны размножиться до нескольких десятков копий на клетку, вторые обладают центромерой (CEN) и поддерживаются подобно хромосомам, единичными экземплярами, равномерно распределяясь по дочерним клеткам. Существуют также векторы с условной (регулируемой) центромерой, линейные векторы с теломерами на концах и дрожжевые искусственные хромосомы (YAC), содержащие и теломеры, и центромеру. Весь этот арсенал собран для четкой настройки копийности клонированных генов [31]. Но далеко не все векторы могут похвастаться высокой стабильностью и ёмкостью. Исключение составляют YAC — их стабильность даже возрастает после достижения вставкой размера 90 т.п.н. — и другие CEN-векторы. Эти конструкции по ёмкости уступают лишь человеческим искусственным хромосомам: они способны нести более 2 млн п.н. и передавать клонированную ДНК в клетки млекопитающих, если последние заставить в нужный момент слиться с клетками S. cerevisiae [32].
В последнее время всё чаще применяют стабильные дрожжевые векторы нетрадиционно, без сшивания с клонируемыми фрагментами in vitro: недюжинный рекомбинационный талант дрожжей экономит время и деньги биоинженеров. Такой «лентяйский» подход назвали клонированием путем рекомбинации, ассоциированной с трансформацией (TAR) [33]. В клетки S. cerevisiae просто запускают векторы вместе с фрагментами для клонирования, и с высокой частотой получают желаемые конструкции. Векторы для этого линеаризуют — создают рекомбиногенные концы, гомологичные концам встраиваемого фрагмента. Если вектор содержит несколько разных сайтов, способных принять гомологичные им ДНК, то просто «вскрывают» нужный. В других случаях ферменты дрожжей in vivo сшивают огромные конструкции из вектора и нескольких клонируемых кусков ДНК с перекрывающимися концами. Так в дрожжах собирают, например, кластеры генов млекопитающих, целые геномы вирусов и даже бактерий [34]. Но у высокой рекомбиназной активности есть и оборотная сторона — химеризация (перетасовка) молекул ДНК, и это существенный минус создания геномных библиотек в YAC по сравнению с BAC и PAC.
Интегративные векторы содержат один или два участка гомологии с какими-то хромосомными последовательностями (длиной не менее 30, а лучше более 100 п.н.). Возле такого участка вектор с клонированным геном разрезают для повышения эффективности его встраивания в хромосому. Если гомологичный участок один, то встроится весь вектор, если два — только фрагмент, окруженный ими (так же, как показано на рис. 6). Клонированный ген далее будет стабильно наследоваться дрожжами. Если в качестве мишени встраивания выбрать повторяющиеся в дрожжевом геноме области, например гены рибосомной РНК или Ty1–транспозоны, то можно одномоментно закрепить в клетке много копий клонированной ДНК. А вообще, дрожжи так сильны в рекомбинации, что заменять какой-то нормальный аллель в их геноме мутантным или наоборот удается и без вектора, просто вводя в клетку фрагмент-заместитель с рекомбиногенными концами [30].
Любой тип вектора можно оснастить экспрессионной кассетой, а для повышения биотехнологической ценности конструкции несложно предусмотреть вырезание уже отработавшей бактерия-ориентированной начинки при попадании вектора в дрожжевую клетку [31]. Организовать экспрессию чужеродных эукариотических генов в дрожжах гораздо проще, чем в бактериях, но способ сплайсинга мРНК у них может не совпадать с типичным для источника гена, поэтому часто в дрожжевые векторы, подобно бактериальным, вставляют не ДНК, а кДНК (комплементарную ДНК — копию, построенную обратной транскрипцией по матрице готовой РНК, из которой природный хозяин уже удалил всё лишнее). Кассета содержит регулируемый промотор транскрипции (часто это GAL-промотор, активируемый галактозой и подавляемый глюкозой) перед MCS и терминатор (сигнал полиаденилирования, обычная опция для клонирования эукариотических генов) после. Она также может кодировать разные метки и обеспечивать секрецию продукта в среду.
3. Векторы для клеток растений
Это тот случай, когда лавры разработчика у человека отняла бактерия — Agrobacterium tumefaciens (сейчас — Rhizobium radiobacter). Природный вектор под названием Ti-плазмида этот фитопатоген создал для принуждения растительных клеток синтезировать его любимую пищу — вещества из класса опинов. Для того чтобы опина было побольше, бактерия стимулирует разрастание корневой ткани до образования уродливых, но очень продуктивных опухолей — корончатых галлов. Такая частная пищефабрика воздвигается с помощью фитогормонов — ауксина и цитокининов. Кодирует их Ti-плазмида, но производят сами растения. Ti-плазмида целиком не проникает в клетки растения, а делегирует для встраивания в их геном фрагмент 12–24 т.н. (на этапе инвазии он одноцепочечный), называемый T-ДНК (transferred DNA). Он-то и содержит гены фитогормонов и «перевариваемого» конкретным штаммом агробактерии опина, а также специфические концевые участки (L и R), один из которых необходим для сайт-специфического встраивания T-ДНК в растительный геном (рис. 11). За пределами Т-области лежат детерминанты вирулентности, мобилизующие Т-ДНК к переносу, и усвоения «своего» опина.
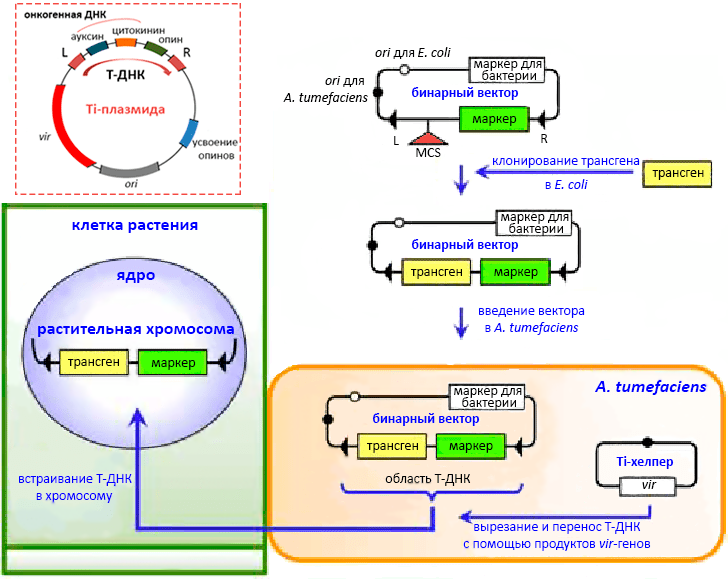
Рисунок 11. Бинарная векторная система агробактериальной трансформации растений. Бинарный вектор, или мини-Ti, «разоружен»: в Т-области (между L- и R-фланками) вместо генов опина и фитогормонов несет клонированную вставку (трансген) и селективный/репортерный ген для растений — GFP, β-глюкуронидазы, люциферазы, антибиотикорезистентности и т.п. Трансген помещен под промотор, который может работать всегда и во всех клетках растения или же в отдельных органах и только в нужное время. Вне Т-зоны вектор содержит ori репликации в E. coli и A. tumefaciens (два разных или один «широкого спектра») и селективный маркер для бактерий. Мини-Ti с клонированным геном запускают в клетки A. tumefaciens, содержащие вспомогательную Ti-плазмиду с поврежденной Т-ДНК, но рабочими генами вирулентности (vir). Продукты последних направляют векторную Т-зону с трансгеном в хромосому растения.
Генные инженеры просто не могли не воспользоваться этой естественной системой модификации растений. Оставалось всего лишь внедрить интересующий ген в Т-ДНК и полагаться на агробактериальные навыки. Тем не менее так не поступают: Ti-плазмида уж очень велика (более 200 т.п.н.), кодирует много ненужного и лишена нужного. Поэтому на ее основе создают небольшие агробактериальные векторы, работать с которыми можно и в E. coli. Другой вопрос, что все прелести обычной векторной антибиотической селекции нивелируются опасениями, что модифицированные сельхозрастения распространят гены устойчивости среди «диких» микробов или конечный продукт будет загрязнен аллергенными веществами. Поэтому стараются предусматривать своевременное вырезание подобных маркеров или использовать иные способы отбора. Одна из агробактериальных векторных систем, бинарная, описана на рисунке 11. Есть и другие схемы модификации растений с помощью этих бактерий, но нужно помнить, что A. tumefaciens легко атакует двудольные и лишь в специально созданных условиях — однодольные [36]. Активно применяют и принципиально другие способы доставки ДНК в растения (см. раздел о введении ДНК в клетки).
4. Векторы для клеток насекомых
Это, как правило, экспрессионные векторы, которые создают на основе ДНК бакуловирусов, инфицирующих кишку насекомых. Чаще модифицируют вирус ядерного полиэдроза бабочки Autographa californica (AcMNPV). До проглатывания новым хозяином конгломераты вирусных частиц защищаются от внешней среды обволакиванием белком полиэдрином, который закодирован в их же ДНК под очень сильным промотором polh. Поскольку полиэдрин для экспрессии рекомбинантных ДНК не нужен, его ген в векторе замещают экспрессионной кассетой, а вот промотор оставляют или заменяют другим, например цитомегаловирусным. В кассете находятся MCS, сигнал полиаденилирования и детерминанты аффинных меток — для облегчения очистки рекомбинантного белка. Вектор также несет последовательности, необходимые для репликации и селекции в E. coli. Селекция в насекомых не нужна, поскольку в них направят не этот вектор, называемый транспортным, а рекомбинантный бакуловирус, который, размножаясь в клетках насекомых, будет размножать и клонированный ген (рис. 12). Транспортные векторы (например, pOET, pPolh-MAT) и подходящие для гомологичной рекомбинации с ними вирусные ДНК (например, flashBAC) можно купить.
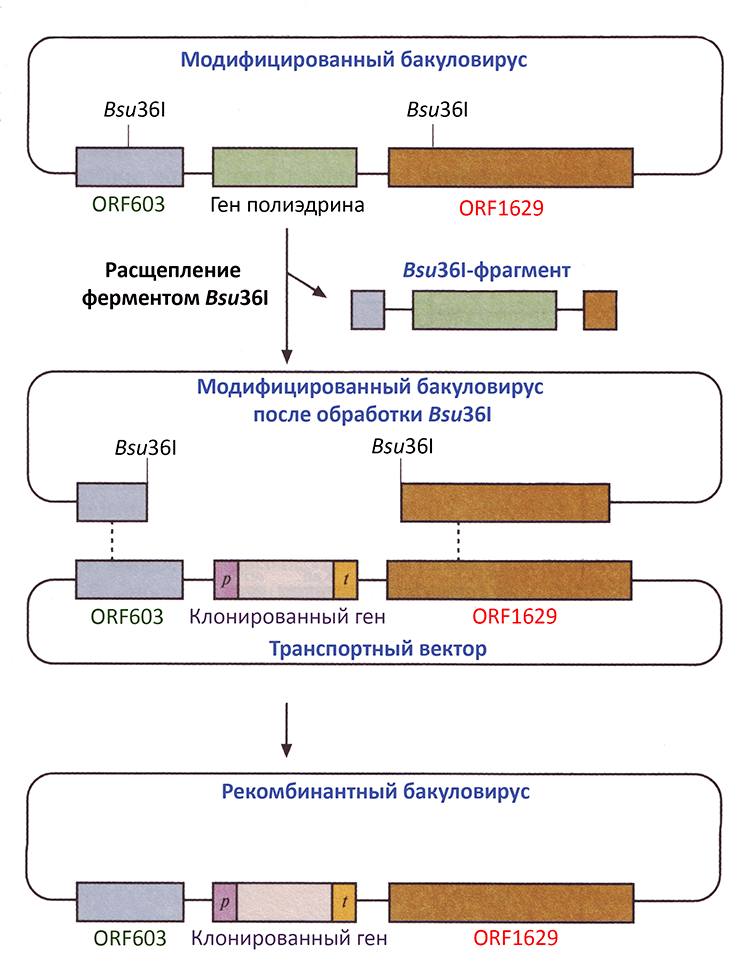
Рисунок 12. Получение рекомбинантного бакуловируса в клетках насекомых. Экспрессионная кассета в транспортном векторе окружена последовательностями, гомологичными ДНК AcMNPV в районе гена полиэдрина (в частности, ORF1629). Они нужны для переноса кассеты в вирусную ДНК. Из последней заранее удален с помощью рестриктазы Bsu36I ген полиэдрина и части соседних генов. Особенно важно «обрезание» ORF1629 — гена, критичного для размножения вируса. Если в одну и ту же клетку насекомого ввести такую неполноценную вирусную ДНК и транспортный вектор, в результате гомологичной рекомбинации в вирусную ДНК «переселятся» кассета с клонированным геном и недостающие части ORF1629 и ORF603. Только такой, рекомбинантный, бакуловирус сможет полноценно реплицироваться. Пунктирными линиями обозначен двойной кроссинговер; p и t — промотор и терминатор гена полиэдрина соответственно.
А еще существуют бакмиды — крупные челночные векторы на базе бакуловирусной ДНК, все манипуляции с которыми производят в E. coli и только для наработки продукта полностью готовую конструкцию отправляют в насекомых. В бакмиды экспрессионная кассета переносится из донорной плазмиды сайт-специфической рекомбинацией. Ее проводит Tn7-транспозаза, которую кодирует третья плазмида, хелперная.
5. Векторы для клеток млекопитающих
а) Наши естественные векторы — вирусы. Но генные инженеры хотят не вызывать, а лечить болезни, потому каждый из таких векторов серьезно модифицируют. О вирусных векторах и клонировании в них прекрасно и просто рассказано в статье [37]. Здесь лишь кратко упомянем их особенности.
Вирусы подбирают и стараются готовить так, чтобы они:
- не вернулись к своим диким, совершенно неприемлемым для приличного вектора болезнетворным привычкам;
- не вызывали активный иммунный ответ;
- следовали только в нужные клетки...
- ...и в них поддерживались стабильно (если надо);
- внедрялись в геном (если надо) только в «безопасные» для его работы места;
- перетаскивали побольше чужеродного генетического материала.
Но решение всегда получается компромиссным. Хотя бы потому, что векторная ёмкость у относительно пригодных по другим параметрам вирусов обычно невелика (в исключительных случаях — до 35 т.п.н.). И это при том, что вектору от вирусного генома (ДНК или РНК) и так достается только то, без чего никак нельзя «одеться» и внедриться. Прочие нужные, например оболочечные, гены помещают на вспомогательные векторы, а процесс «одевания» модифицированного вируса поручают особым клеткам-упаковщицам, в которые вводят оба вектора. Ряду носителей предоставляют больше самостоятельности, но в ущерб клонирующей ёмкости. Ведь, как и любой вектор, они должны нести стандартные элементы для решения генно-инженерных задач: маркеры, адресные метки, регуляторы экспрессии и т.п.
В зависимости от задач ученым чаще приходится выбирать между ретро- (лучшие из них — ленти-), адено-, герпес- и аденоассоциированными (AAV) вирусами. Недостатки векторов на их основе приведены в статьях [37–39]. Гамма-ретровирусы (например, MuLV) поражают только активно делящиеся клетки, а значит, для модификации, например, нейронов негодны. Зато без нейронов буквально жить не могут возбудители рекламной «простуды на губах» — вирусы простого герпеса. Остальные более-менее всеядны, но всё же по сумме показателей выигрывают деликатные AAV (рис. 13) с их безопасностью, низкой иммуногенностью и высокой избирательностью внедрения в хромосомы.
Конечно, в генной инженерии применяют не AAV, а rAAV — рекомбинантные вирусы девяти типов (rAAV1–rAAV9). Такие векторы можно поддерживать в клетке в виде эписом (плазмид), а можно «навечно» встроить в хромосому. Сами они не со 100-процентной гарантией попадают в нужное хромосомное место, поэтому генные инженеры помогают им — замысловато, но зато успешно. Практикуют и трюки с переодеванием: разные серотипы вируса обладают разной иммуногенностью и тропностью к тканям, поэтому иногда вектор на основе одного серотипа помещают в капсид другого. Всем неплох, например, rAAV8: он особо не тревожит иммунную систему и любит клетки печени, а этот богатырский орган славен очень сильным альбуминовым промотором, под контроль которого удобно помещать терапевтические гены. Более того, печень без труда снабдит терапевтическим продуктом весь организм. Этот подход сейчас очень популярен и тестируется, в частности, для компенсации дефицита факторов свёртывания крови [38]. Цены́ бы АА-вирусам не было, если бы не их маломерный «костюмчик» — больше 4,5 т.н. одноцепочечной ДНК в него не поместить...
б) Невирусные векторы лишены размерных ограничений капсидов и легко конструируются в самых изощренных формах, но тоже не идеальны:
- в делящихся клетках, если векторы не интегрированы в хромосому, их концентрация постепенно «размывается», и дефицит продукта клонированного гена нужно постоянно восполнять новыми порциями вектора;
- над их введением в клетки млекопитающих придется крепко поразмыслить [37].
В таких векторах нет ничего особенного по сравнению с прочими эукариотическими. Хотя, если речь идет об экспрессии, то описаны некоторые не вполне объясненные наблюдения. Например, биотехнологи отмечают бóльшую эффективность конструкций с интроном между промотором и orf целевого гена и с тесной транскрипционной связью между целевым и маркерным генами (рис. 13). В качестве селективных маркеров используют традиционный neoR и гены веществ, нивелирующих действие цитотоксичных агентов. Чаще всего выбирают селекционные системы дигидрофолатредуктаза—метотрексат и глутаминсинтаза—метионинсульфоксимин. Чем больше копий генов первых веществ из этих пар будет в клетках, тем более высокие концентрации вторых веществ переживут эти клетки. Так отбирают клетки с максимальным числом копий вектора. Эффективные промоторы и терминаторы берут из геномов млекопитающих или их вирусов.
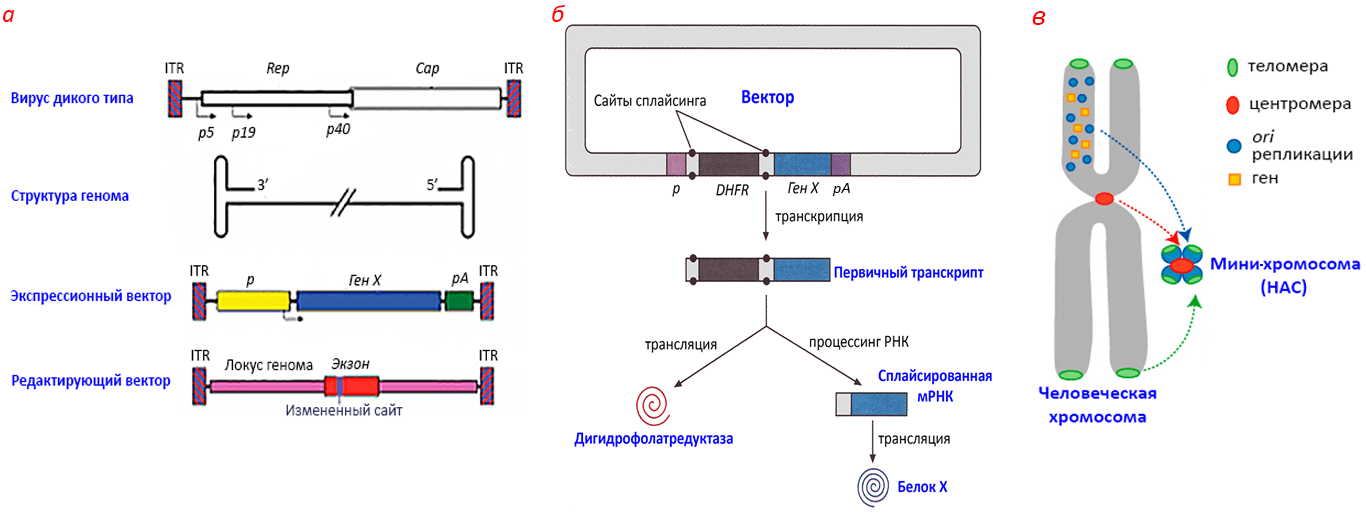
Рисунок 13. Векторы для клеток млекопитающих. а — Векторы на основе аденоассоциированного вируса (AAV). Такой экспрессионный вектор может существовать в клетке как эписома, а может внедриться в хромосому — туда, куда сам посчитает нужным. Редактирующий вектор направляют в строго определенный сайт хромосомы с помощью клонированного гомологичного участка, при этом в хромосоме произойдет замена ненужной последовательности на нужную (ту, что в векторе) — редактирование. б — Архитектурный «лайфхак»: совместная экспрессия маркерного и целевого генов. Первый транслируется прямо с первичного транскрипта, второй сплайсируется и только потом транслируется. в — Человеческая искусственная хромосома (HAC). От обычной хромосомы в HAC остается лишь центромера, теломеры и детерминанты репликации. ITR — инвертированные концевые повторы AAV; p и pA — промотор и сигнал полиаденилирования трансгена; p5–p40 — промоторы AAV; Rep и Cap — рамки считывания вирусных белков репликации и капсида; DHFR — ген дигидрофолатредуктазы.
Пожалуй, самый перспективный и ёмкий невирусный вектор млекопитающих — человеческая искусственная хромосома (HAC). Ее можно сконструировать из деталей с нуля, de novo, но это трудно, поэтому чаще прибегают к радикальной обрезке природных человеческих хромосом: оставляют лишь самое необходимое для стабильного независимого поддержания. Размер молекулы при этом может сократиться с 200 до 5 млн п.н. А дальше с помощью Cre-lox-рекомбинации на остов можно нанизывать крупные фрагменты генома — со всякими регуляторными областями, вариантами копийности генов и т.п. Когда технология достигнет совершенства, можно будет рутинно изучать работу самих хромосом, функции и мутации крупных человеческих генов в их натуральном виде, а не в форме «ущербных» кДНК, а также стабильно экспрессировать любые терапевтические гены. Уже удалось получить мини-версии хромосом 14 и 21, клонировать в HAC гигантский ген дистрофина (2,4 млн п.н.), мутации которого вызывают миодистрофию Дюшенна, и даже корректно его экспрессировать в мыши. О конструировании HAC и их потенциале подробно рассказывает статья [40].
Не так давно появились транспозонные векторы, лишенные недостатков вирусных носителей. Некоторые из них позволяют переправить в хромосому до 100 т.п.н. чужеродной ДНК, но поскольку их самих в клетку вводят плазмиды, проблема эффективной доставки in vivo остается.
Инструменты для молекулярного клонирования
Это, конечно же, ферменты. На первый взгляд кажется, что они ну о-очень разнообразны, и запомнить предназначение каждого из них просто невозможно. Однако общего у них гораздо больше, чем жилплощадь в морозильнике. Они делятся всего на несколько функциональных групп: полимеразы, нуклеазы, лигазы и еще парочку более экзотических (табл. 1). Рутинно в лаборатории применяют единичные ферменты из каждой группы, кроме нуклеаз (их может потребоваться больше десятка), и запомнить, что они делают, несложно. Конечно, нужно знать общие принципы работы основных подгрупп ферментов и иметь под рукой табличку, где будут указаны активности самых ходовых экземпляров и условия реакций с ними. А если табличку составлять лень, можно держать под рукой каталог какой-нибудь фирмы по продаже реактивов — там всё это есть. Особенно важно:
- соблюсти температурный режим реакции;
- выдержать положенные сроки;
- удовлетворить потребности ферментов в активаторах (катионах металлов) и донорах энергии (АТФ), что, как правило, связано с выбором буфера;
- если нужно, правильно окончить реакцию: инактивировать фермент теплом, добавлением ЭДТА или совсем от него избавиться (фенольной экстракцией, переосаждением ДНК спиртом, а лучше — с помощью коммерческой колонки);
- осознать, что если генный инженер представляет, как работают ферменты, то он может всё!
1. Нуклеазы (молекулярные ножницы) расщепляют, или деградируют, ДНК/РНК. Тех, что «откусывают» нуклеотиды с концов постепенно, называют экзонуклеазами, а тех, что вгрызаются во внутренние части молекулы, — эндонуклеазами (табл. 1). Генные инженеры нашли применение и тем, и другим. И даже нашли фермент, меняющий привычки в зависимости от субстрата (BAL-31). Но самым любимым инструментом генного инженера стала группа эндонуклеаз, в обиходе называемых рестриктазами. В природе они защищают бактерий от вторжения паразитических ДНК, расщепляя молекулы с нетипичным для этих бактерий паттерном метилирования.
Без рестриктаз (эндонуклеаз рестрикции) и генной инженерии не было бы. Выделяют несколько их типов, но для технологии рекомбинантных ДНК подходит только тип II. Эти ферменты узнают строго определенные палиндромные (зеркальные относительно центральной оси симметрии) последовательности двухцепочечной ДНК и разрезают обе цепи в строго определенных местах, оставляя либо тупые, либо «липкие» концы (рис. 14). Такая предсказуемость пленила биологов, и они начали вводить сайты узнавания рестриктаз в векторы. Одним и тем же ферментом можно разрезáть геномную ДНК и вектор и благодаря совпадающим концам «вшивать» фрагменты генома в этот вектор. А еще с помощью рестриктаз можно картировать молекулы ДНК, оценивать по профилям рестрикции их сходство (вид ДНК-фингерпринтинга) и, соответственно, родство организмов. Но важно помнить несколько вещей:
- все этапы клонирования лучше проводить в штаммах бактерий с неполноценной системой рестрикции-модификации: чтобы не лишиться с трудом добытой конструкции и чтобы потом не возникло проблем с разрезанием, потому что некоторые ферменты отказываются щепить метилированный субстрат;
- чем длиннее рестрикционный сайт, тем реже он встречается в природных ДНК, а значит, тем длиннее будут рестрикционные фрагменты; чаще всего пользуются ферментами, узнающими 4–8 п.н.;
- есть ферменты, которые узнают одинаковые последовательности, но щепить их могут в разных местах (то есть оставляют разные концы), а есть ферменты, которые узнают слегка различающиеся места, но оставляют одинаковые концы (рис. 14) — всё это дает дополнительные возможности для клонирования;
- рестриктазы требовательны к чистоте ДНК;
- если двум рестриктазам подходят одинаковые буферы и одинаковые условия реакции, то резать ими ДНК можно одновременно, в одной пробирке.
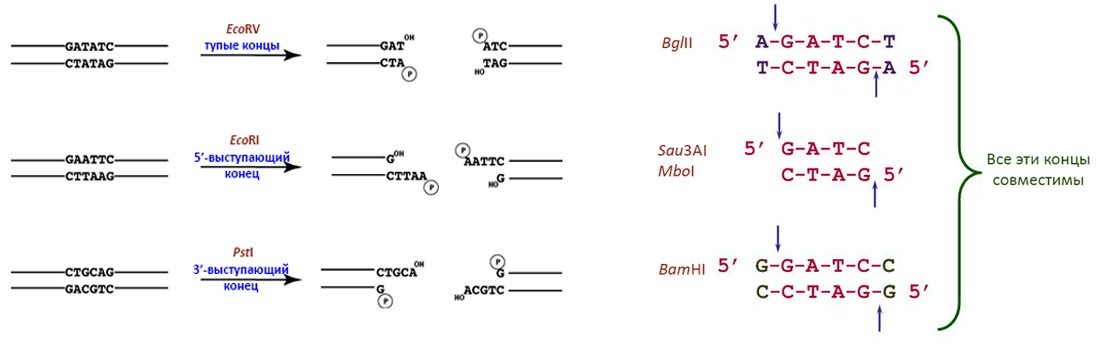
Рисунок 14. Варианты концов, образующихся после обработки рестриктазами. Справа приведены ферменты, оставляющие одинаковые «липкие» концы. Sau3AI и MboI — изошизомеры, потому что узнают одинаковые сайты и даже режут их одинаково. Концы, образуемые всеми этими ферментами, можно комбинировать при клонировании. Однако если «сшить» BglII- и BamHI-фрагменты, то возникнут гибридные сайты A-G-A-T-C-C или G-G-A-T-C-T, которые смогут порезаться только Sau3AI или MboI, но не исходными ферментами. Буквы в названиях рестриктаз — сокращения видовых названий организмов, из которых они были выделены: например, BamHI — фермент Bacillus amyloliquefaciens.
Природа, конечно, изобретательна, но она не смогла удовлетворить все желания генного инженера. Измученный нереализованными идеями, он решил помочь себе сам. Так генная инженерия пришла на помощь белковой, а та вернула долг инженерными нуклеазами (ИН). Все наслышаны о тех, что применяют для редактирования геномов, и мы тоже о них скоро поговорим. Но для рутинного клонирования in vitro они не слишком хороши, потому что не оставляют разнообразных «липких» концов и их накладно производить тоннами. В 2017 году сотрудники Института геномной биологии Карла Вёзе предложили универсальную программируемую рестрикционную платформу на основе белка Argonaute гипертермофильного архея Pyrococcus furiosus (PfAgo/ИН). Аргонавты — консервативные нуклеазы, найденные у всех живых организмов. Они направляются к цели небольшим фрагментом нуклеиновой кислоты (гидом) и разрезают молекулы, с которыми гид связывается по принципу комплементарности. У эукариот гидом и мишенью служат РНК, и вся эта затея нужна для посттранскрипционной регуляции экспрессии генов [41], [42]. У прокариот аргонавты уничтожают, подобно CRISPR-Cas, молекулярных паразитов, а мишенью и гидом могут быть как РНК, так и ДНК. PfAgo предпочитает сотрудничать и бороться именно с ДНК. Если этой нуклеазе при температуре около 100 °С «подгонять» ДНК-гидов с нужной биологу последовательностью, она будет разрезать комплементарную гиду цепь мишени — всегда в одной точке, между 10-м и 11-м нуклеотидами гида. Соответственно, чтобы разрезать обе цепи мишени, нужны два гида, а чтобы PfAgo оставила «липкие» концы нужной длины, гиды должны связываться с разными цепями ДНК на строго определенном расстоянии друг от друга (рис. 15). Многократно проверив систему PfAgo/ИН в действии, разработчики подтвердили, что:
- ей можно придать любую специфичность — нацелить на сайты, распознаваемые и даже не распознаваемые известными рестриктазами;
- она будет создавать любые «запрограммированные» концы;
- один белок может работать сразу с несколькими парами гидов (удобно для картирования и фингерпринтинга);
- система позволяет обходиться без предварительного разрезания вектора в стандартных сайтах для клонирования, а делает всё сама — с одинаковыми комплектами гидов и клонируемый фрагмент выщепляет из генома, и вектор готовит в любом запланированном месте.
И резюмировали:
- PfAgo-платформа может заменить уйму природных рестриктаз;
- ее себестоимость низка, а эксплуатация недорога:чистый PfAgo легко получать в больших количествах, а синтез комплектов ДНК-гидов уже не сильно бьет по лабораторному кошельку [43].
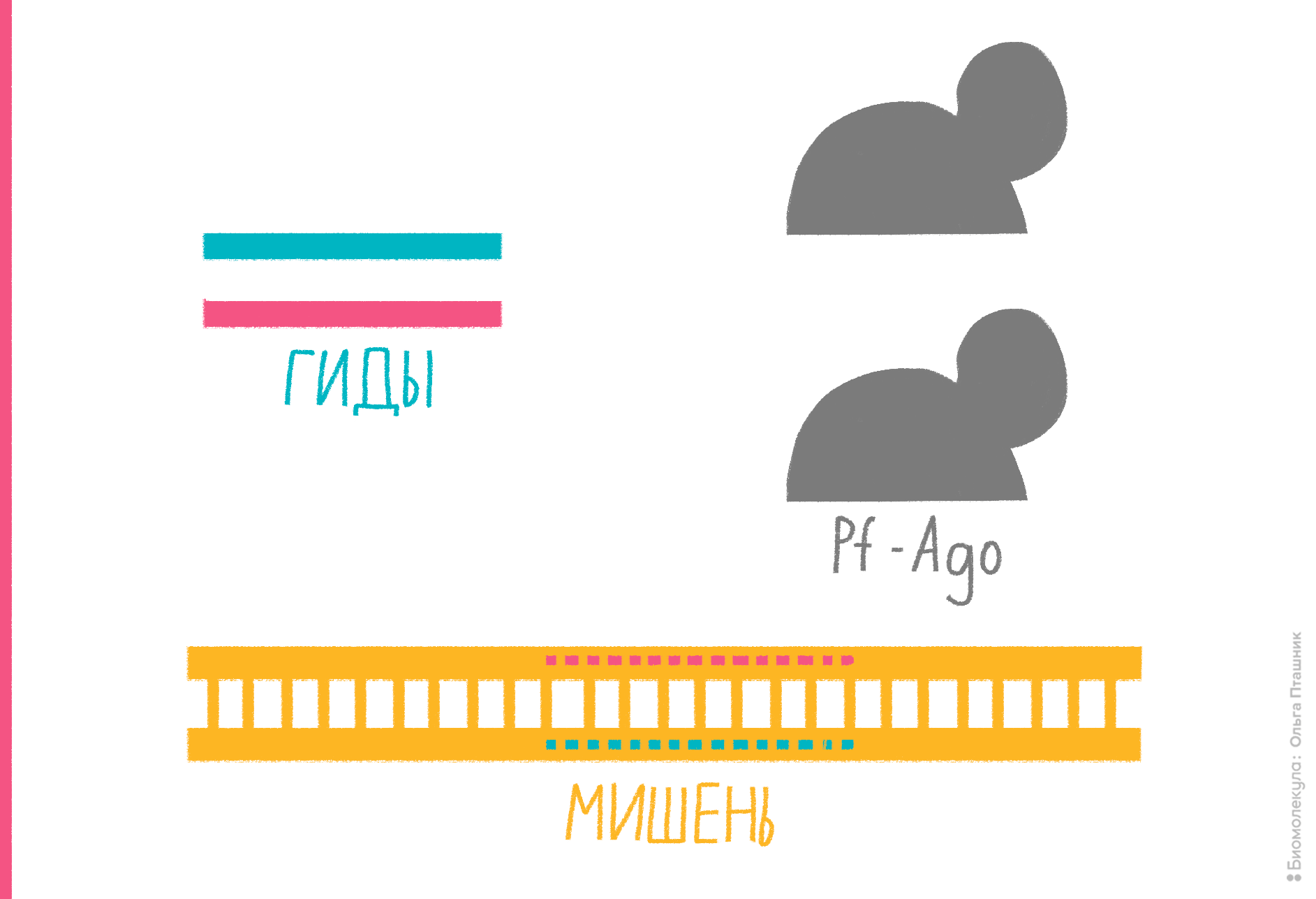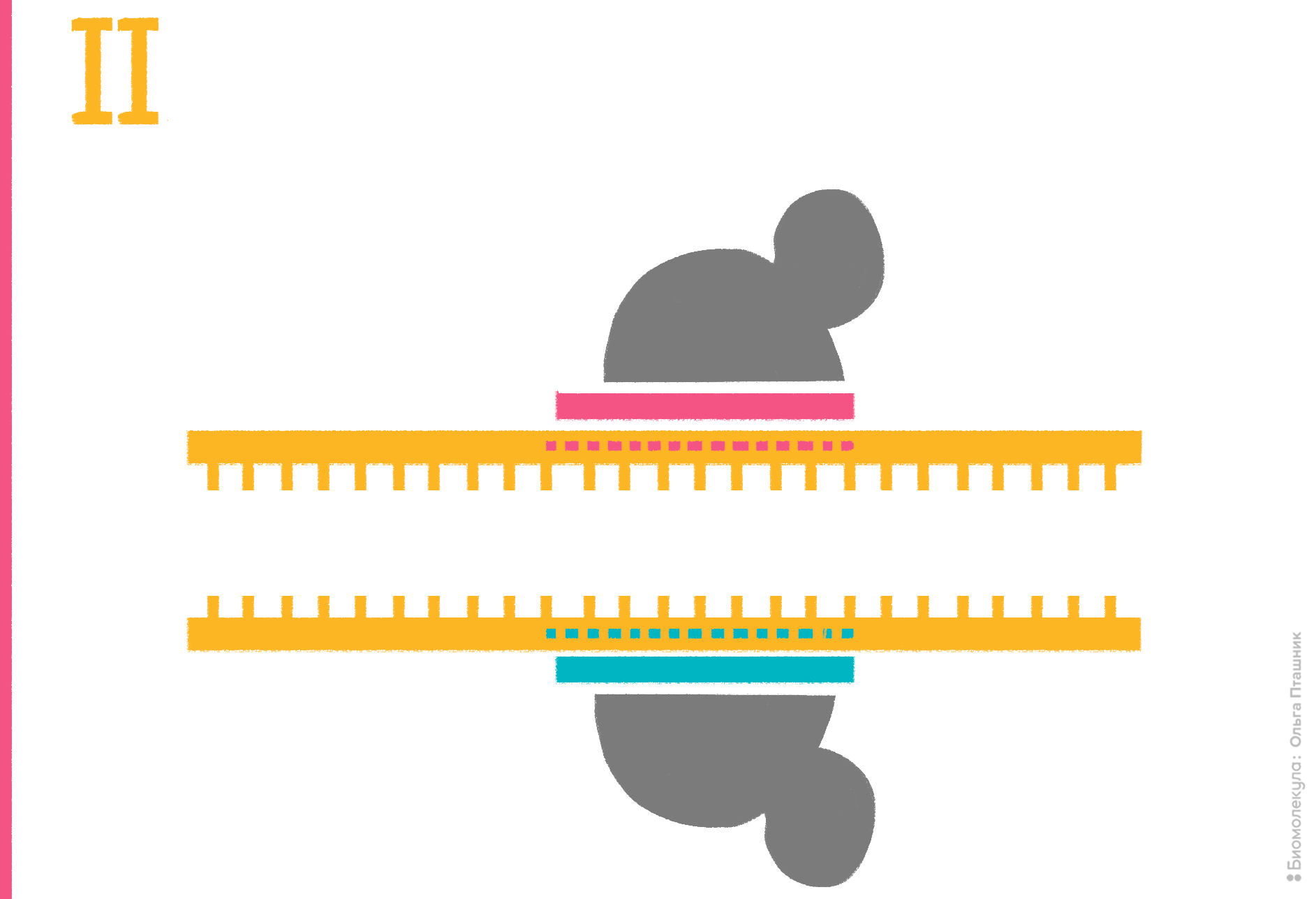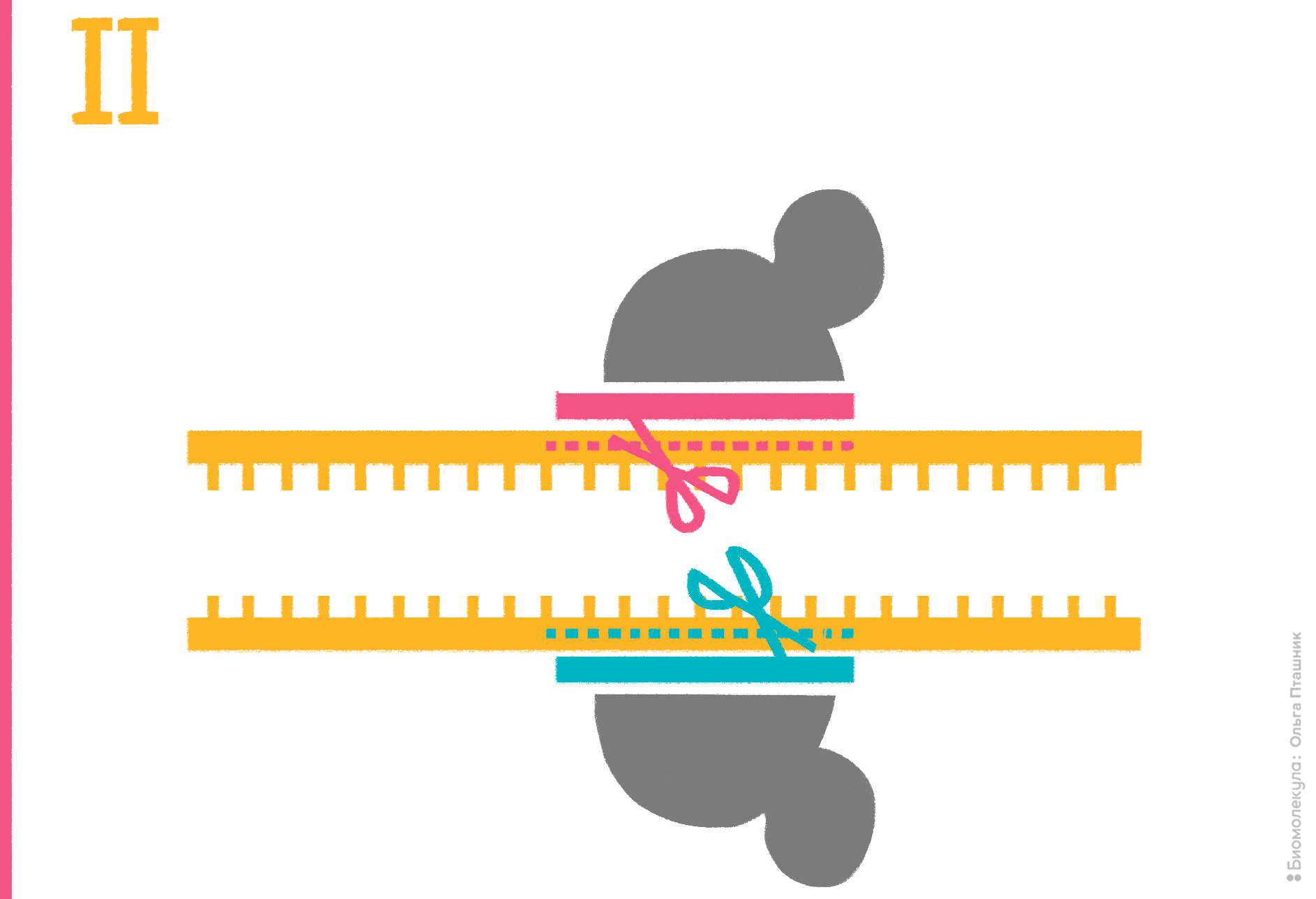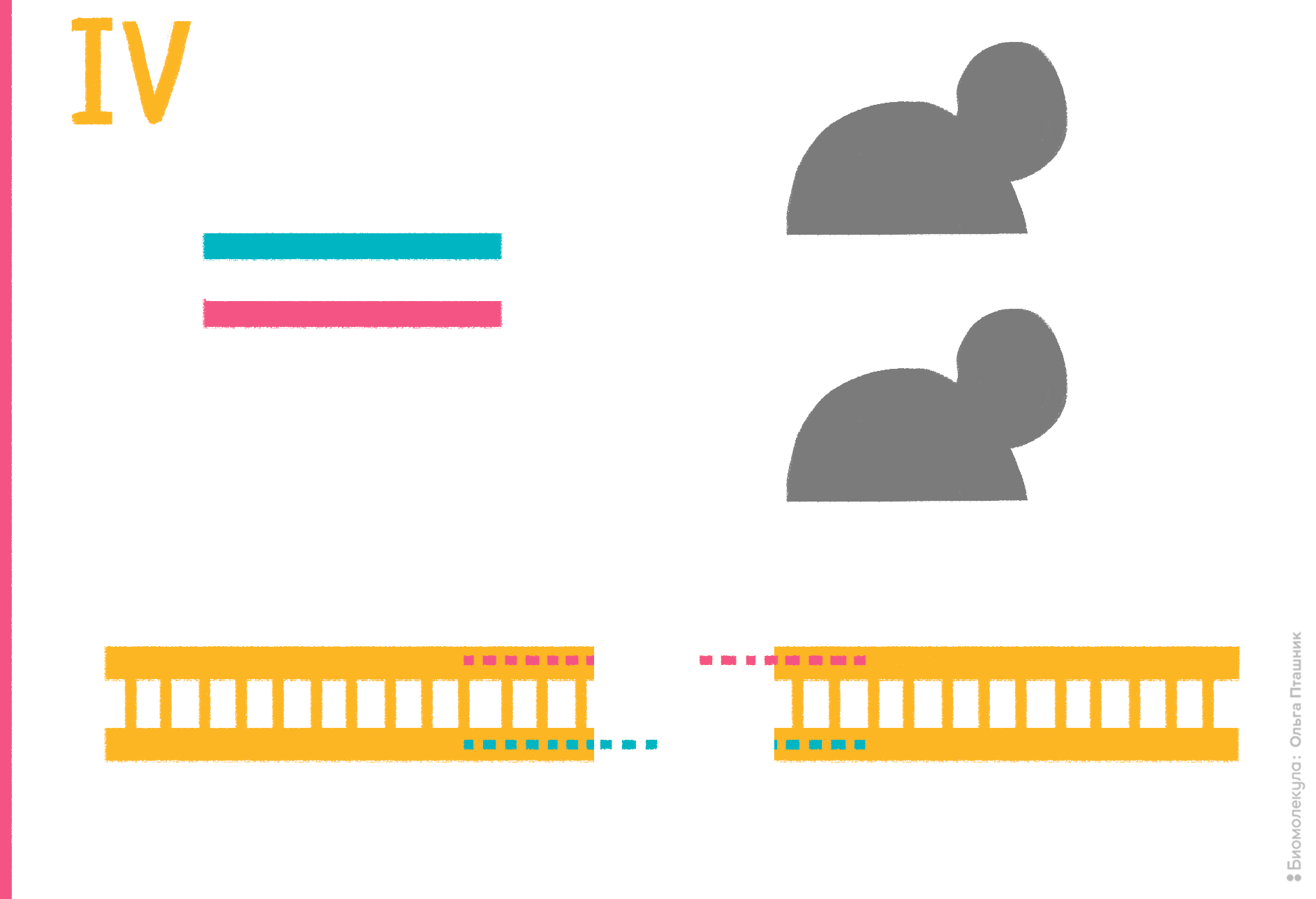
Рисунок 15. Работа программируемой инженерной рестрикционной системы на основе PfAgo. Серым обозначен слегка модифицированный белок Argonaute Pyrococcus furiosus, красным и синим — пара направляющих ДНК (гидов), желтым — ДНК-мишень с комплементарными гидам участками (обозначены «буквами» ДНК-алфавита) на каждой из цепей. На I этапе реакции при 87–98 °C «плавятся» (расходятся) цепи мишени, а молекулы аргонавта связываются с гидами. На II этапе аргонавты, доставленные гидами к одноцепочечным мишеням, разрезают эти мишени в одной точке. На III этапе нуклеазы покидают мишени, а на IV, после снижения температуры, цепи ДНК-мишени снова «спариваются», формируя «липкие» концы.
рисунок Ольги Пташник
2. Полимеразы (Pol) полимеризуют нуклеотиды — выстраивают их в цепочку по правилу комплементарности напротив нуклеотидов матрицы (шаблона). РНК-полимеразы строят цепи из рибонуклеотидов (NTP) по матрице ДНК или РНК, то есть бывают ДНК- или РНК-зависимыми. Точно такими же бывают и ДНК-полимеразы, но цепи они строят из дезоксирибонуклеотидов (dNTP) и их в генной инженерии используют чаще. РНК-зависимые ДНК-полимеразы называют ревертазами или обратными транскриптазами, потому что действуют они противно логике реализации наследственной информации в клетке. Но такое разделение довольно условно: ряд полимераз лояльно относится к любым матрицам. В одних условиях они проявляют ДНК-зависимую активность, в других — РНК-зависимую, просто категоризируют их исходя из главной функции в природном хозяине.
ДНК-полимеразы капризны — никогда не начинают синтез без затравки (праймера), потому что способны присоединить нуклеотид только к уже имеющейся свободной 3′-OH-группе. Им не важно, откуда праймер берется (загиб ли это матрицы или отдельная цепь) и какова его природа (NTP или dNTP). Первый новый нуклеотид присоединяется к гидроксильной группе своей фосфатной группой (5′), то есть праймер наращивается в направлении 5′→3′, превращаясь в новую цепь ДНК. При этом полимераза «ползет» от 3′-конца матричной цепи к ее 5′-концу. Но отметим сразу, что в арсенале генного инженера есть и ферменты-анархисты, отвергающие любые шаблоны.
Две важные характеристики полимеразы — процессивность (по сути, скорость работы или расторопность) и точность (грамотность). Здесь всё как у людей: или быстро, или качественно, — если, конечно, ферменты не инженерные. Дело в том, что некоторые полимеразы умеют откатываться на шаг назад и «на ощупь» перепроверять, правильная ли пара нуклеотидов только что образовалась. Если нет, то ошибочно включенный нуклеотид они вырезают и заменяют нужным, предупредив таким образом мутацию. Это означает, что такие полимеразы обладают 3′→5′-экзонуклеазной и, соответственно, 3′→5′-корректирующей (proofreading) активностью. Их-то и наградили эпитетом «высокоточные». Некоторые ферменты могут править и «наперед», в направлении 5′→3′, то есть отгрызать нуклеотиды с 5′-конца встреченной на своем пути цепи и заменять их новыми. Такие бесцеремонные полимеразы обладают 5′→3′-экзонуклеазной активностью и тоже бывают очень полезными.
Зачем биологу нужны полимеразы? Конечно, для синтеза ДНК или РНК in vitro. Но синтез этот преследует разные цели: амплификацию (умножение числа копий выбранного фрагмента ДНК/РНК в геометрической прогрессии), модификацию концов фрагментов, мечение, секвенирование. Полученные в пробирке молекулы РНК используют как матрицы для трансляции in vitro или, если в них при синтезе включили меченые NTP, как зонды для детекции комплементарных им последовательностей. Спектр применения молекул ДНК гораздо шире.
Амплифицируют молекулы нуклеиновых кислот посредством полимеразной цепной реакции (ПЦР). В качестве матрицы может выступать как ДНК, так и РНК, но последнюю нужно вначале «переписать» в кДНК, внеся фермент ревертазу. Весь процесс тогда будет называться ПЦР с обратной транскрипцией (ОТ-ПЦР, RT-PCR).
Тот фрагмент, что нужно размножить для дальнейшей работы или просто для лучшей «видимости», ограничивают с двух сторон парой химически синтезированных праймеров длиной 18–24 нуклеотида. Их подбирают в специальных программах типа PrimerSelect, исходя из того, что один из них должен быть комплементарен 3′-концу выбранного фрагмента по одной цепи матрицы, а второй — по другой цепи. Или проще: один праймер соответствует началу амплифицируемого участка, другой — его концу, но на противоположной цепи. Это означает, что нуклеотидные последовательности хотя бы этих участков матрицы должны быть известны. Тонкости подбора праймеров и проведения ПЦР, ее типы и применение исчерпывающе описаны в статье «12 методов в картинках: полимеразная цепная реакция» [44]. В реакционную смесь помимо матрицы и праймеров добавляют очищенную воду, буфер, все типы dNTP, ДНК-полимеразу и, если нужно, «присадки». А дальше в амплификаторе в циклически изменяющихся температурных условиях синтезируются всё новые и новые копии нужного фрагмента. Температура при этом может достигать 98 °С, поэтому полимеразы, используемые в ПЦР (табл. 1), должны быть термостабильными.
Чтобы увидеть результат, ПЦР-смесь запускают в агарозный (реже — в полиакриламидный) гель, разгоняют ее с помощью электрофореза и визуализируют ДНК с помощью флуоресцентных красителей. Но так делают не всегда. Те, у кого есть прибор для ПЦР в реальном времени (real-time PCR) и соответствующие реактивы, могут наблюдать всё на экране компьютера и даже рассчитать исходное число копий амплифицируемого фрагмента.
Для чего нужна амплификация генному инженеру?
- Для получения клонируемого фрагмента (вставки в вектор). Если в праймерах предусмотреть пару нуклеотидных замен, в этот фрагмент можно внести местá узнавания рестриктаз, и тогда будет очень удобно состыковывать вставку с вектором.
- Для массивного мечения ДНК, если в реакционную смесь заложить меченые dNTP.
- Для проверки эффективности клонирования. Это простой и достоверный способ, точнее может быть только секвенирование.
- Для оценки экспрессии генов — но лишь когда матрицей выступает кДНК: фрагмент гена амплифицируется только если он есть в мРНК (по которой строилась кДНК), а значит, ген экспрессируется. Можно смотреть, как меняется экспрессия в зависимости от условий и мутаций гена или его регуляторов.
К модификации концов фрагментов ДНК прибегают очень часто. Выделяют два ее типа: добавление/удаление нуклеотидов и добавление/удаление фосфатной группы концевого нуклеотида. Полимеразы осуществляют только первый вариант модификаций.
а) Добавление/удаление нуклеотидов решает проблему нестыковки концов клонируемой вставки и вектора (а заодно и концевого мечения фрагментов). Идеал, когда обе детали порезаны одной и той же рестриктазой и потому их концы прекрасно сочетаются, достижим не всегда. С другой стороны, это вовсе и не идеал, если необходимо определенным образом ориентировать вставку — тогда нужно, чтобы два ее конца были разными и вектор тоже был разрезан теми же двумя ферментами, а это не всегда реально. В общем, часто приходится из ДНК делать универсальную деталь — тупоконечную. Хорошо, если есть возможность воспользоваться сайтами фермента, режущего натупо. А если их нет?
Как мы помним, рестриктазы оставляют разные торчащие концы. Их, конечно, можно сровнять неспецифическими нуклеазами, но те могут не простить несовершенств в структуре ДНК и разрушить молекулу. Поэтому для ювелирной коррекции концов им чаще предпочитают полимеразы с экзонуклеазной активностью.
Если выступает 3′-конец, логично состричь его «под ноль» с помощью 3′→5′-экзонуклеазы. Это может быть знаменитый отпрыск Pol I, названный фрагментом Клёнова, но гораздо напористее работает T4-полимераза. Она даже может съесть на нуклеотид больше, а вместо него, если ей предложить, поместить меченый dNTP. Так получают деликатно меченный фрагмент ДНК. Если в смеси нет никаких dNTP, T4-Pol может сильно перестараться и превратить 3′-конец из выступающего в значительно уступающий. Привести полимеразу в чувство помогает добавление dNTP: она вспоминает свое главное предназначение, созидающее, и начинает застраивать съеденное до выравнивания концов обеих цепей. Так можно получить молекулы с бóльшим числом меток.
Если выступает 5′-конец, логично достроить до него уступающий 3′-конец. Это тоже может сделать T4-Pol, но гораздо популярнее фрагмент Клёнова. При достатке dNTP он прекрасно достроит уступающий конец (если нужно, введет и метки), а вот без dNTP переключится на нуклеазное поведение, подобно T4-Pol.
Рекомендации — это всегда прекрасно, но на практике любые концы чаще всего тупят фрагментом Клёнова. Просто проводят реакцию в два этапа — без нуклеотидов, а потом с ними.
Специфический тип добавления концевых нуклеотидов — безматричный — практикуют упомянутые выше анархические ферменты — концевые дезоксинуклеотидилтрансферазы (TdT). Они способны без всякого шаблона навесить на выступающие (с меньшей охотой — на уступающие и тупые) 3′-ОН-концы до тысячи dNTP. Это очень удобно для мечения концов и построения гомонуклеотидных «хвостов» — например, поли(А). Если не известна последовательность одного конца амплифицируемого фрагмента, например, кДНК, то ПЦР нормально пройдет с праймерами к известному концу и к такому «хвосту» (методика RACE). А можно комплементарные «хвостики» приделать к фрагменту и вектору, и тогда клонировать будет проще простого. Способность TdT метить разрывы двухцепочечной ДНК нашла применение в методике TUNEL, позволяющей отслеживать апоптоз. О том, как работает эта удивительная, до сих пор недопонятая полимераза и какое отношение она имеет к иммунитету и раку, рассказано в статье [45].
б) Фосфорилирование/дефосфорилирование производят не полимеразы, а полинуклеотидкиназа фага Т4 и щелочные фосфатазы (CIP, rSAP) соответственно. Удаление фосфата с 5′-концевых нуклеотидов вектора или вставки снижает вероятность самолигирования — смыкания вектора без вставки либо разных вставок друг с другом, а не с вектором: если нет партнера с фосфатом, не может образоваться фосфодиэфирная связь. Добавление фосфата иногда нужно для компенсации удаленного, а иногда — для замены обычного на меченый (для секвенирования и приготовления зондов).
Мечение ДНК/РНК может быть концевым или протяженным, по всей длине молекулы/фрагмента. Какие ферменты работают с концами, мы уже знаем. Некоторые из них метят и длинные цепи. Прокариотическая Pol I, в E. coli участвующая в репарации ДНК и процессинге фрагментов Оказаки, замечает одноцепочечный разрыв в ДНК и начинает нанизывать на освободившийся 3′-конец нуклеотиды по матрице второй цепи. Такое возможно благодаря «расчищающей путь» 5′→3′-экзонуклеазной активности Pol I: каждый встречаемый ей нуклеотид она замещает новым, перенося таким образом разрыв всё дальше и дальше. Это действие называется ник-трансляцией. Если добавить меченые нуклеотиды, то вся новая цепь получится меченой.
Фрагмент Клёнова лишен 5′→3′-нуклеазной активности своего родителя, а потому не может толкать разрыв перед собой. Зато он может честно продлять случайные гексануклеотидные (они продаются) или вполне специфические (подобранные к конкретному месту) праймеры. Специфический праймер может «садиться» на клонированный ген или — если он стандартный, коммерческий — на векторную последовательность возле MCS. Второй вариант используют при мечении ДНК с помощью М13-вектора. Полимераза продляет праймер по матрице одноцепочечной клонированной ДНК, а затем и векторной. Далее меченый фрагмент, комплементарный клонированному, можно вырезать, а можно использовать как зонд всю гибридную молекулу: больше меток — сильнее сигнал.
РНК-зонды, как уже упоминалось, делают фаговые РНК-полимеразы на матрицах ДНК, клонированных в транскрипционные векторы. С помощью обратной транскриптазы синтезируют ДНК-зонды по РНК-матрицам. Зонды используют для разных видов гибридизации с комплементарными молекулами.
Нуклеотиды часто метят 32P или нерадиоактивными молекулами типа биотина или дигоксигенина (DIG). Нерадиоактивные метки затем считывают с помощью стрептавидина (авидина) и антител к дигоксигенину соответственно. Стрептавидин и антитела к DIG, в свою очередь, помечены легко детектируемым веществом (репортером). Но чтобы разобраться в иммунодетекции и вообще иммунотехнологиях, лучше обратиться к обзору «12 методов в картинках: иммунологические технологии» [46].
Секвенирование здесь мы затрагивать не будем, потому что оно отлично описано в других «биомолекулярных» статьях [20], [47].
Итак, полимеразы предлагают очень много возможностей для синтеза и модификации нуклеиновых кислот, но для ряда задач куда эффективнее использовать синтез химический. Например, для получения олигонуклеотидов (праймеров, зондов, линкеров) с заданной последовательностью, а иногда и целых фрагментов для клонирования.
3. Лигазы (молекулярные иголки) «сшивают» концы ДНК, то есть образуют фосфодиэфирную связь между сблизившимися нуклеотидами (две связи на две цепи ДНК). Именно они объединяют вектор со вставкой и фрагменты ДНК друг с другом, а также замыкают разрезанный вектор в кольцо. Обычно используют ДНК-лигазу фага Т4. Она охотно соединяет «липкие» концы, а вот для лигирования тупых нужно добавлять ее гораздо больше и проводить реакцию дольше. Чтобы повысить активность Т4-лигазы в отношении тупых концов, биоинженеры конструируют химерные ферменты, сочетающие лигазу с другими ДНК-связывающими белками [48].
| Фермент | Активность | Субстрат | Особенности / Применение |
|---|---|---|---|
| ДНК-полимеразы термолабильные | |||
| Бактериальная Pol I (фермент Корнберга) | Полимераза, экзонуклеаза 3′→5′ и 5′→3′ | ДНК | Мечение ник-трансляцией, синтез II цепи кДНК |
| Фрагмент Клёнова Pol I, Т4 | Полимеразы, экзонуклеазы 3′→5′ | ДНК | Модификация концов, мечение, синтез II цепи кДНК, секвенирование, мутагенез in vitro |
| Т7 | Полимераза, экзонуклеаза 3′→5′ (↑) | ДНК | Чрезвычайно процессивна / Мечение ДНК, секвенирование |
| Cеквеназа (модификация Т7-Pol) | Полимераза | ДНК | «Мирное» производное Т7-полимеразы / Секвенирование |
| TdT | Безматричная полимераза | оцДНК, дцДНК | Мечение, создание посадочной платформы для праймеров, клонирование |
| M-MuLV | Полимераза, РНКаза H (↓) | РНК, ДНК | Обратная транскриптаза / Синтез кДНК, дидезоксисеквенирование (особенно GC-богатых областей) |
| ДНК-полимеразы термостабильные | |||
| Taq | Полимераза, экзонуклеаза 5′→3′, TdT (↓) | ДНК | Высокопроцессивна (пригодна для амплификации длинных матриц), добавляет на 3′-конец лишний нуклеотид (А), что запрещает клонирование «натупо», но позволяет ТА-клонирование / Идеальна, если нужна простая детекция ПЦР-продукта |
| Pfu, Pwo | Полимеразы, экзонуклеазы 3′→5′ | ДНК | В 6–18 раз точнее Taq / Больше подходят для ПЦР с целью клонирования (в т.ч. «натупо»), секвенирования, экспрессии, мутационного анализа |
| AMV | Полимераза, РНКаза H (↑) | РНК (в т.ч. богатая шпильками), ДНК, РНК:ДНК | Высокопроцессивная относительно термостабильная обратная транскриптаза / Синтез кДНК, дидезокси- и РНК-секвенирование, мечение ДНК |
| Tth | Полимераза, экзонуклеаза 5′→3′ (↓), TdT (↓) | ДНК, РНК (в т.ч. богатая шпильками) | В присутствии Mn2+ — обратная транскриптаза / ОТ-ПЦР, ПЦР в реальном времени, мечение ДНК |
| РНК-полимеразы (ДНК-зависимые) | |||
| Фаговые полимеразы Т7, T3, SP6 | Полимеразы | дцДНК | Каждая распознает только «свой» промотор, поэтому две цепи клонированной ДНК можно транскрибировать разными ферментами; в отличие от бактериальных аналогов, не ингибируются рифампицином / Создание РНК-зондов, РНК-вакцин, РНК-гидов, антисмысловых РНК для регуляции экспрессии генов; трансляция in vitro |
| Эстеразы | |||
| Щелочные фосфатазы | |||
| Рекомбинантная креветочная (rSAP) и телячья (CIP) фосфатазы | Отщепление фосфата с 3′- и 5′-концов | ДНК, РНК, dNTP, NTP | Клонирование, мечение, удаление неиспользованных dNTP из ПЦР-смеси перед секвенированием |
| Нуклеазы | |||
| ДНКаза I | Эндонуклеаза | оцДНК (при Mg2+), дцДНК (при Mn2+) | S1 и гораздо реже нуклеаза mung bean в высоких концентрациях замечают скрытые однонитевые разрывы (ники) или подплавившиеся АТ-богатые зоны дцДНК и атакуют их. BAL-31 — экзонуклеаза в случае дц-субстратов, эндонуклеаза в случае оц-субстратов (ники и денатурированные зоны дц-молекул) / Исследование функции генов, этап многих генно-инженерных методик |
| S1 и нуклеаза бобов мунг (mung bean) | Эндонуклеазы | оцДНК, оцРНК, иногда — дцДНК | |
| BAL-31 | Экзонуклеаза 3′→5′ и 5′→3′, эндонуклеаза | ДНК, РНК | |
| Эндонуклеазы рестрикции II типа (рестриктазы) | Сайт-специфические эндонуклеазы | дцДНК | Распознают короткие палиндромы и внутри/возле них разрезают по одной строго определенной фосфодиэфирной связи в каждой цепи ДНК; при несоблюдении условий реакции могут ошибаться (штриховая активность, star (*) activity) / Клонирование, картирование, типирование |
| РНКаза А | Эндорибонуклеазы | оцРНК | Анализ структуры РНК, очистка препаратов белка и ДНК от РНК |
| РНКаза H | РНК:ДНК | Расщепление нити РНК в РНК-ДНК-гибридах при синтезе кДНК и ОТ-ПЦР | |
| Полинуклеотидкиназа фага Т4 | 5′-Фосфорилирование — перенос (или обмен) фосфата с АТФ на 5′-OH-конец полинуклеотида и нуклеозид-3′-монофосфата (NMP). Отщепление фосфата с 3′-P-конца полинуклеотида, dNMP и dNDP | ДНК, РНК, dNMP, dNDP, NMP | Клонирование, мечение |
| EcoRI-метилаза | Метилирование — перенос метильной группы с S-аденозилметионина на второй аденин сайтов GAATTC | дцДНК | Маскировка сайтов рестрикции некоторых ферментов |
| T4-лигаза | Образование фосфодиэфирной связи между 3′-ОН-группой одного нуклеотида и 5′-PО4-группой другого | ДНК, РНК | Без АТФ не работает, предпочитает «липкие» концы тупым |
| Условные обозначения: ↑ и ↓ — высокая и низкая активности; оц — одноцепочечная молекула, дц — двухцепочечная | |||
Стандартное оборудование
Чтобы получать рекомбинантные ДНК и работать с ними, используя бактерий, понадобятся:
- бокс или ламинар (рис. 16) — места, защищенные стеклянной дверцей, которые можно без ущерба для окружающих привести в состояние относительной стерильности, если зажечь газовую горелку и УФ-лампу. Там удобно разливать среды в чашки Петри, сушить их и сеять на них бактерий (выключив УФ-лампу, охотно «сжигающую» роговицу глаз пофигистов). Вообще, генно-инженерные методики редко требуют особой стерильности: для молекулярных работ она, как правило, не нужна, а для манипуляций с живыми бактериями достаточно протертого спиртом стола и горящей горелки. Если на чашке Петри и вырастут какие-то посторонние колонии — не проблема, опытный глаз их отбракует. Проблема — это необеззараженный ростовой субстрат: вычленить рекомбинанта из «газона грязи» сложно;
- микроволновка для расплавления агаризованных сред;
- термостат (а то и целая комната) — для выращивания бактерий и проведения ферментативных реакций;
- качалка (шейкер-инкубатор) для пробирок и колб с растущими культурами (рис. 16);
- объемные морозильники (на −20 и −70 °С) — там хранят клетки, ферменты и нуклеиновые кислоты;
- генератор льда;
- вортекс — для взбалтывания содержимого пробирок;
- центрифуги — макро- (например, для осаждения клеток и выделения нуклеиновых кислот в больших объемах) и микро- (рис. 16), без которых вообще как без рук;
- термоциклер (амплификатор). В идеале не один, а парочка — для разных типов ПЦР (рис. 16);
- источник питания и ванночки для электрофореза (рис. 16);
- трансиллюминатор и гельдокументирующая система (рис. 16), чтобы проводить с ДНК-содержащими гелями все необходимые манипуляции в УФ-свете (визуально оценивать, фотографировать, препарировать);
- спектрофотометр (лучше два, обычный и «нано») — для определения концентрации молекул и клеток. В лабораторных протоколах эти процедуры встречаются гораздо чаще, чем в реальной практике. Но ими нельзя пренебречь при подготовке, например, компетентных клеток и зондов и в количественной оценке флуоресценции репортеров;
- (иногда) оборудование для блоттинга — чтобы переносить с электрофоретического геля на гибридизационную мембрану молекулярную «картинку»;
- (иногда) секвенатор.

Рисунок 16. Оснащение лаборатории, где занимаются генной инженерией бактерий. Не всё здесь обязательно, и не всё обязательное здесь есть. Верхний ряд: ламинар (БАВнп-01-1,5, «Ламинарные системы»), качалка орбитальная (GFL Orbital Shaker 3019), амплификатор для ПЦР в реальном времени (Agilent Technologies Stratagene Mx3005P QPCR System), система для автоматизированного выделения биополимеров (QIAcube, QIAGEN). Средний ряд: микроцентрифуга (MiniSpin, Eppendorf), оборудование для горизонтального электрофореза, трансиллюминатор и то, что на нём обычно видно, гельдокументирующая система (Doc-Print VX5). Нижний ряд: набор микропипеток, репликатор и плашка для него (при клонировании чаще используют круглый вариант, для чашек Петри), микропробирки в штативе, «микробиологический минимум» — чашки Петри, петли, горелка.
Избранные лаборатории могут позволить себе роботизированные решения (рис. 16), сберегающие время сотрудников автоматическим выделением биомолекул — ДНК, РНК, белков.
Помимо аппаратов генному инженеру нужны микропипетки, шпатели для растирания и петли для ресуспендирования («растворения») и штрихового посева микробных культур, репликаторы для их быстрого переноса на разные среды (рис. 16). И конечно, стекло и пластик: колбы, флаконы для растворов, чашки Петри, макро- и микропробирки («эппендорфы»), штативы для них, носики для пипеток, плашки для электрофорезных проб...
А вот без чего можно обойтись, так это, как ни странно, без микроскопа. Можно много лет делать рекомбинантных микробов и не видеть их «в лицо»: стандартная единица восприятия их биоинженером — колония на агаре.
Если же научная цель требует перехода на высший эукариотический уровень, то придется потратиться основательнее [22].
Итак, мы выбрали биосистему, вектор и купили (нашли у соседей) оборудование. Теперь можно приступать к клонированию.
Краткий курс «кройки и шитья»: типовой процесс молекулярного клонирования
Генетическая инженерия любых организмов редко минует бактериальный этап. Дабы не раздуть статью до масштабов «Войны и мира», мы не будем рассматривать манипуляции со всеми биосистемами, а сосредоточимся на основной, бактериальной, и лишь слегка затронем модельную эукариотическую — дрожжевую. Этапы клонирования гена в усредненный бактериальный вектор и фрагментов генома в дрожжевую искусственную хромосому представлены на рисунках 17 а и б.
Получение материала для клонирования: выделение ДНК и РНК
Поскольку нуклеиновая кислота (НК) хранится в клетках, добывать ее придется их безжалостным разрушением. Чтобы расправиться с клеточной стенкой E. coli хватает, как и в случае клеток млекопитающих, буфера с детергентом и хелатирующим агентом, хотя и лизоцим не противопоказан. Дрожжевые стенки разрушают ферментными комплексами или механически, подобно растительным клеткам. От фаговых капсидов легко избавляются смесью фенола и хлороформа.
Что за НК мы хотим выделить из клеточных лизатов? Во-первых, вектор. Во-вторых, фрагмент для клонирования.
С вектором всё просто. Благодаря топологическим различиям молекул хромосомной и плазмидной ДНК, их можно отделить друг от друга созданием особых условий:
- если хорошенько отцентрифугировать клеточный лизат, огромная хромосома порвется на куски, а с маленькой плазмидой ничего не случится;
- если при этом создать невыносимо щелочную среду, все молекулы ДНК денатурируют (их цепи разойдутся), но линейные куски хромосомы — навечно, а кольцевые суперскрученные плазмиды — временно, поскольку их цепям никуда друг от друга не деться (рис. 17а). После нейтрализации среды кислым ацетатом калия хромосомный дебрис отправится в осадок, а восстановленные плазмиды можно будет очистить от РНК и прочей ненужной мелочи.
Такой способ добычи плазмидной ДНК называют щелочным лизисом. Именно на этом принципе чаще всего строятся «ручные» протоколы выделения векторов и коммерческие системы (киты). Безусловно, генно-инженерная лаборатория без последних просто немыслима, ведь ДНК там выделяют не раз в год. Специальные наборы есть для выделения всех типов НК из разных источников — бактерий, крови, почвы и т.д. Причем указанные в инструкциях пределы возможностей кита могут занижаться, и лучше просто взять и попробовать. Например, если пишут, что набор предназначен для получения минипрепаратов колийных плазмид размером до 25 т.п.н., то это не значит, что он не справится с лизисом псевдомонад и плазмидами в два раза крупнее.
Редко, для особых целей, небольшие векторы получают «извращенным» способом — ПЦР-амплификацией.
Удалось ли добыть вектор, проверяют с помощью агарозного гель-электрофореза (рис. 18а) [49], [50].
Рисунок 18. Электрофореграммы плазмидной ДНК (а) и тотальной РНК (б), выделенных «вручную» из бактерий. М — маркер (ladder) для оценки примерных размеров и (при определенных условиях) концентраций молекул, «бежавших» в геле по соседним дорожкам. Верхняя полоска маркера соответствует 10 т.п.н. Оценить размер такой крупной псевдомонадной плазмиды, как Rms148, с помощью М невозможно, для этого нужны контроли той же весовой категории. Заметна разница в концентрациях образцов крупной низкокопийной плазмиды Rms148 и мелкого высококопийного вектора pUC19. Хромосомный дебрис в препаратах векторов из E. coli обычно незаметен, а вот при выделении крупных плазмид из других бактерий с ним приходится мириться. Электрофорез РНК ведут в геле с формальдегидом, предотвращающим образование РНК-шпилек. В случае тотальной РНК маркер бесполезен, потому что всё самое интересное (разноразмерные транскрипты) «размазано» по дорожкам, а индикаторами успешного выделения служат толстые полоски рибосомной РНК: у прокариот — 23S и 16S, у эукариот — 28S и 18S.
фото автора
Клонируемый фрагмент можно получать разными путями. Его откуда-то вырезают рестриктазами или амплифицируют по матрице чьего-то генома, проводя ПЦР либо прямо с суспензией клеток, либо с тотальной ДНК, выделенной из какого-то образца. Нередко хотят клонировать для изучения неизвестный ген, кодирующий белок с хотя бы частично известной аминокислотной последовательностью. Тогда, памятуя о вырожденности генетического кода, предсказывают возможную нуклеотидную последовательность части искомого гена и синтезируют вырожденные (допускающие вариации нуклеотидов в проблемных сайтах) зонды. Ими можно «выудить» фрагмент генома с интересующим геном и клонировать его. Вырожденные зонды/ПЦР-праймеры придут на помощь и тогда, когда ген «ищут» не по белку, а по похожим генам родственных организмов. Но в любом случае перед клонированием:
- планируют, какие получатся у фрагмента концы, в какой рестрикционный сайт (или пару сайтов) вектора его нужно ввести, в какой ориентации и как для этого модифицировать;
- просчитывают способ детекции фрагмента в рекомбинантном клоне бактерий — какие пары праймеров можно применить для ПЦР, какими рестриктазами вырезать из вектора;
- добиваются приемлемой чистоты фрагмента, для чего его пропускают через гель (электрофорез в негустой агарозе) или специальные колонки: для очистки раствора ДНК и выделения ее из геля есть замечательные, элементарнейшие киты.
При создании геномных библиотек (рис. 19) клонируют множество случайных фрагментов огромных молекул ДНК, и там не до изящных упражнений со стыковкой концов. Поэтому часто прибегают к неполной деградации исходной ДНК эндонуклеазой, оставляющей «винегрет» из разноразмерных и взаимно перекрывающихся фрагментов. Часто это делают с помощью рестриктазы Sau3A, потому что она щепит часто и оставляет концы, идеально стыкующиеся с вектором, разрезанным BamHI. Для библиотек в более ёмких векторах предпочитают крупнощепящие ферменты (рис. 17б). Бывает и так, что хромосому разрывают механически, разом тупят концы и сшивают с тупыми концами вектора, образованными рестриктазой типа SmaI.
Нередко приходится клонировать только то, что экспрессируется, то есть выделять из клеток не ДНК, а РНК, и затем транскрибировать ее в кДНК. При правильном подходе «вручную» (фенольной очисткой) можно получить даже больше РНК, чем китом. И выделять РНК было бы даже легче, чем ДНК, если бы не одно НО: она молниеносно разрушается вездесущими РНКазами. В отличие от ДНКаз, они не нуждаются в активирующих катионах, которые можно было бы отнять хелатирующим агентом, и, подобно Фениксу, восстанавливают работоспособность даже после мощных денатурирующих воздействий. Выход — охлаждение проб жидким азотом, тщательная стерилизация принадлежностей, ингибиторы РНКаз, безРНКазные пластик и растворы (но здесь главное — не попасть под чары продавцов и включить разум). Если электрофоретический гель в итоге выдаст типичную картинку (рис. 18б), РНК используют как матрицу для обратной транскрипции, затем по первой цепи кДНК синтезируют вторую (часто всё это происходит в рамках количественной ПЦР) и уже двухцепочечную молекулу встраивают в вектор.
На основе кДНК тоже создают библиотеки. Поскольку из нее исключены интроны (в случае эукариот) и размеры транскриптов варьируют, «тома» получаются разновеликие, но всё же тоньше, чем в геномных библиотеках. Все гены изучаемого организма туда попасть не обязаны: в условиях, предшествующих выделению мРНК, они просто могли не экспрессироваться. И это расценивается как большой плюс, потому что можно создавать «собрания сочинений» отдельных групп клеток или тканей, «написанных» под действием разных факторов.
Матричную РНК эукариот легко вытащить за поли(А)-хвост поли(Т)-ловушками (на хроматографической колонке [50] или магнитных шариках). Это повышает шансы добыть конкретную молекулу в достаточном количестве.
Подготовка вектора и вставки к клонированию
Это разрезание вектора одной или двумя рестриктазами (в зависимости от того, как нужно ориентировать фрагмент) и модификация концов вектора и/или фрагмента. Чаще всего дефосфорилируют вектор, но какое-то его количество устоит и всё равно самозамкнется. Концы фрагмента тупят, если не удалось его вырезать нужными рестриктазами или ввести подходящие рестрикционные сайты при ПЦР с полимеразой, оставляющей не тупые концы. Если же тупые концы противопоказаны, но получаются помимо воли, к ним просто пристраивают гомонуклеотидные «хвосты» (ферментом TdT) или коммерческие линкеры/адаптеры (рис. 19) [30].
Рисунок 19. «Лего» для клонирования. Линкеры — тупоконечные короткие фрагменты ДНК, содержащие один или несколько рестрикционных сайтов. Адаптеры (переходники) имеют один тупой конец, а другой — «липкий», оставляемый какой-то рестриктазой. Линкеры нельзя применять, если выбранное рестрикционное место есть (предполагается) и в клонируемом фрагменте: конструкцию «фрагмент—линкеры», в отличие от «фрагмент—адаптеры», еще нужно щепить, а значит, вся вставка развалится.
Лигирование
Тупые концы вектора и вставки Т4-ДНК-лигаза сшивает с меньшей охотой, чем «липкие», потому нужно затрачивать на их лигирование больше фермента и времени и добавлять ПЭГ [51]. Для оптимального результата в лигазную смесь рекомендуют вносить вставки раз в 10 больше, чем вектора. Чтобы смесь из-за этого не черпать половником, раствор фрагмента можно сгустить, подвыпарив из него воду в вакуумной центрифуге. Если же никакой вставки не предусмотрено, то есть нужно просто замкнуть вектор, смесь должна быть очень разбавленной — располагающей плазмиды к одиночеству, а не к спариванию с себе подобными. По истечении положенного срока лигазную смесь вносят в клетки (см. врезку). В особо параноидальных ответственных случаях ДНК предварительно осаждают этанолом.
Введение ДНК в клетки
Сшитые лигазой невирусные конструкции вводят в бактерий двумя способами:
- трансформацией компетентных клеток. Чтобы E. coli приняла чужую ДНК, ее нужно сделать сговорчивее — подрастить культуру до молодого и бодрого состояния, контролируя оптическую плотность, обработать растворами с хлоридом кальция и хранить в глицерине при −70 °С, оберегая от стрессов. Зато после добавления лигазной смеси компетентным клеткам устраивают отменный тепловой шок, чтобы сделать клеточную стенку проницаемой;
- электротрансформацией (электропорацией). Это эффективный способ введения даже довольно крупных НК. Но если перед процедурой не обессолить лигазную смесь на диализном фильтре, раздастся большой «бах», и благодарного клеточного потомства не получится. Прибор под названием электропоратор генерирует миллисекундные электрические импульсы, пробивающие в стенке клеток временные поры. Для трансформации E. coli и псевдомонад хватает напряжения 1,2–1,8 кВ, толстые стенки родококков пробиваются при 2,5 кВ. Для электропорации не нужны слишком ранимые компетентные клетки, свежую культуру можно просто соскрести с чашки Петри.
После обеих процедур клетки около часа приводят в чувство в питательном бульоне, а затем растирают по поверхности селективных сред — трансформированные бактерии уже готовы к противостоянию антибиотикам, и им предстоит делать это целую ночь.
В клетки дрожжей ДНК чаще вводят электропорацией, трансформацией сферопластов, трансформацией в присутствии LiAc или конъюгацией (из E. coli), иногда прибегают к слиянию протопластов. Вообще, у любых клеток с мощной стенкой (грибов, растений) ее нередко приходится лизировать ферментами или разрушать механически (хотя бы частично), создавать условия для того, чтобы сферо-/протопласты вначале не лопались, а после принятия НК восстанавливали стенку [30]. Электропорация — метод универсальный, но ценители экзотики дырявят оболочки лазером, ультразвуком и даже наноматериалами [37]. Клетки растений трансформируют Т-ДНК или биобаллистически (биолистически) — обстреливают из генной пушки частицами вольфрама или золота с адсорбированной НК. Если хорошенько прицелиться, можно попасть не только в ядро, но и в митохондрии или пластиды: это решает, например, вопрос защиты семян растения от модификации. В клетки млекопитающих, особенно яйцеклетки, НК часто вводят микроинъекциями либо вирусами, реже упаковывают в липосомы. Обнаруживают клетки с рекомбинантной ДНК по векторным маркерам или целевому продукту.
Идентификация рекомбинантных бактериальных клонов
Селективные среды подбирают исходя из характеристик бактериального штамма и использованных маркеров. Стандартный и самый удобный вариант — богатая среда с антибиотиком, X-Gal и IPTG. Аббревиатуры маскируют совершенно неприличные названия, нам же достаточно будет понять, какова роль их носителей в гениальном сине-белом тесте.
Этот тест строится на работе лактозного оперона. В своем природном варианте он постоянно выключен репрессором, но конформация последнего меняется добравшейся до него из ростовой среды лактозой, и репрессор, освобождая промоторно-операторную область, разрешает транскрибировать lac-гены. Среди последних есть явный функциональный лидер, вполне пригодный на роль репортерного гена — lacZ. Он кодирует β-галактозидазу, расщепляющую лактозу. Таким образом, лактоза в природной системе служит и индуктором lac-оперона, и субстратом для его продукта.
Для нужд генной инженерии систему перекроили: в хромосоме E. coli ген lacZ оставили без начального фрагмента (lacZΔM15), а этот фрагмент — lacZα — поместили в вектор. Соответственно, полноценная β-галактозидаза образуется только в клетке с вектором. Такой подход называют α-комплементацией: векторный α-пептид компенсирует дефект хромосомного гена. Функции лактозы в инженерной системе разделили между двумя ее синтетическими аналогами: IPTG индуцирует экспрессию lacZ, а X-Gal расщепляется продуктом lacZ с образованием синего пигмента. Так можно легко идентифицировать на чашке Петри колонии с вектором. А чтобы так же легко можно было найти клоны со встроенной в вектор ДНК, в lacZα ввели полилинкер. Если в него попадает приличная по размеру вставка, то рамка считывания lacZα чаще всего смещается. Результат — отсутствие функциональной β-галактозидазы и белые колонии на среде с X-Gal и IPTG (рис. 20). Других белых колоний, безвекторных, при правильно подобранной концентрации антибиотика на чашках быть не должно.
Рисунок 20. Сине-белый тест, или Как найти иголку в стоге сена. Объяснение дано в тексте. Синий и белый кружки символизируют цвет бактериальных колоний. AmpR/AmpS — устойчивый и чувствительный к действию ампициллина фенотип E. coli. LacZ+/LacZ− — позитивный или негативный по β-галактозидазе фенотип. Цветовые различия на чашке Петри становятся отчетливее после нескольких часов в холодильнике.
Помимо α-комплементации, отбирать трансформированные клоны можно просто по устойчивости/чувствительности к антибиотикам, восстановлению прототрофности, флуоресценции или же с помощью тонких молекулярных операций типа ПЦР или гибридизации (рис. 21) — всё с колониями. Эти способы более трудоемки, потому что невозможно сразу приметить колонии с клонированной ДНК и нужно наугад проверять любые выросшие — со вставкой они или только с вектором?
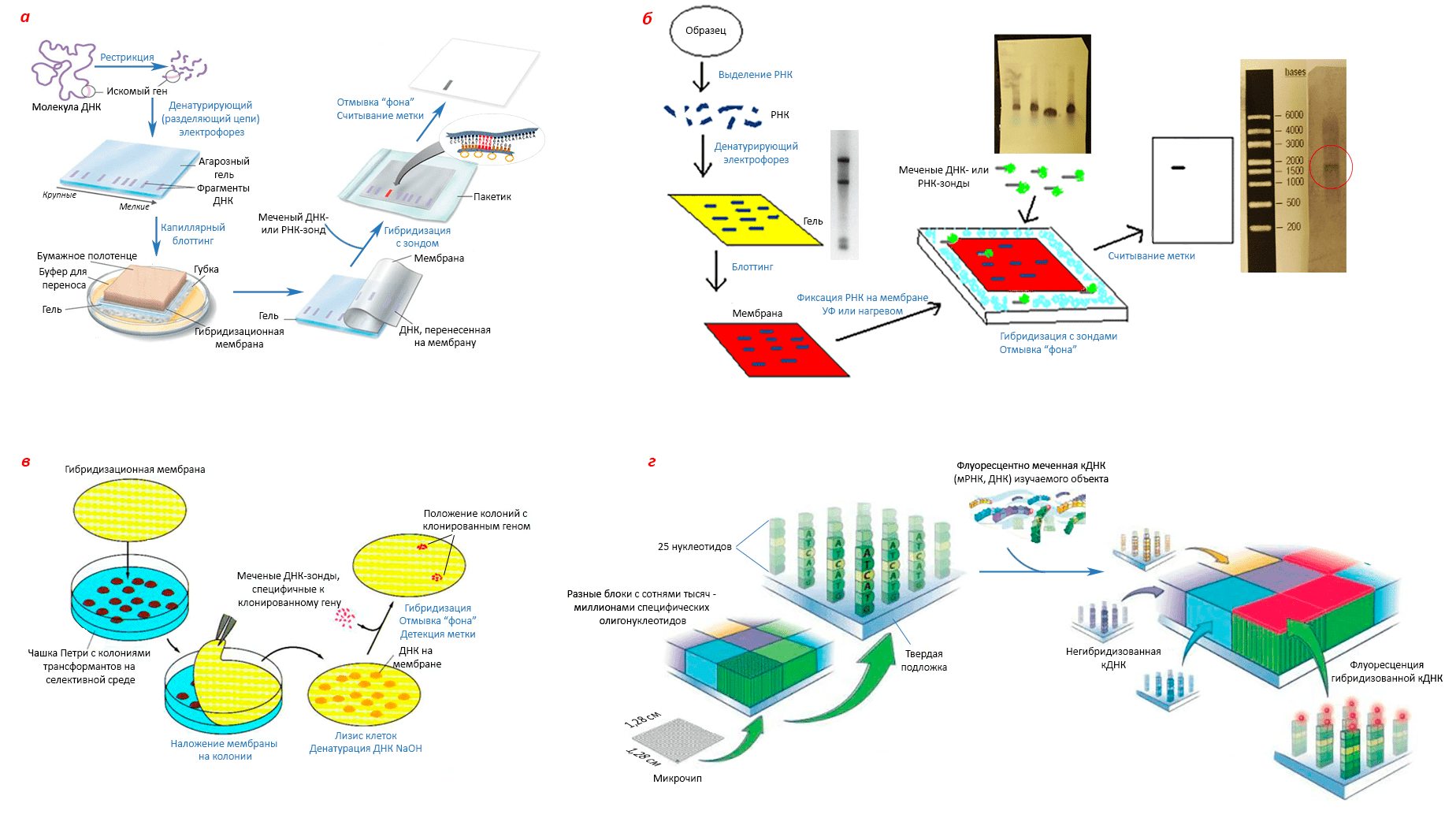
Рисунок 21. Лики гибридизации. а — Гибридизация по Саузерну. Тестируется ДНК. Перед процедурой ее фрагментируют. Блоттинг — перенос молекул из геля на мембрану. Может быть капиллярным, электрическим, вакуумным. Саузерн-блоттинг — перенос ДНК, нозерн — РНК. Если зонд подбирался на основе аминокислотной последовательности или сиквенсов родственных организмов, гибридизуют в более мягких условиях: чем меньше ожидаемое соответствие зонда мишени, тем меньше у них шансов спариться при высокой температуре. б — Нозерн-гибридизация. Тестируется РНК. Ее не режут — транскрипты и так коротки. Метод капризен, но специфичен (см. главу 4). На фото: тотальная РНК из клеток родококка в агарозном геле; РНК-зонды, меченные дигоксигенином и проявленные антителами к нему на нейлоновой мембране; мембрана с проявленным продуктом гибридизации (один из зондов «вытащил» единый транскрипт двух генов родококка). в — Гибридизация с колониями (аналог гибридизации in situ). Здесь удобно применить репликатор: растворить (ресуспендировать) в его лунках разные колонии и отпечатать их на чашку (обычно так переносят колонии сразу на несколько селективных сред, сохраняя одинаковую «картинку»). г — Гибридизация на микрочипе. Дорогá и имеет смысл для определения множества разных ДНК или РНК в образце (см. главу 4). Метят и капают на чип тотальную РНК/ДНК/кДНК образца. Заякоренные на подложке олигонуклеотиды комплементарны интересующим участкам тестируемого массива НК. Блоки, объединяющие одинаковые олигонуклеотиды, дают разную интенсивность сигнала при связывании разного количества молекул мишени, что при определенных условиях говорит о представленности мишени в образце (то есть, например, о силе экспрессии гена).
Подтверждение успешности клонирования
Чтобы удостовериться, что клон отобран правильно, из него чаще всего выделяют векторную ДНК, а далее возможны варианты. Если никого не интересует экспрессия клонированной ДНК, то выделенную конструкцию:
- обрабатывают теми же рестриктазами, которые использовали для клонирования (если их сайты не изменены), чтобы вырезать вставку и на электрофорезе проверить ее размер (рис. 22);
- используют как матрицу для ПЦР, чтобы посмотреть, амплифицируются ли фрагменты нужной длины (рис. 22);
- пытаются гибридизовать с зондом, комплементарным участку вставки, то есть проводят Саузерн-блоттинг (рис. 21);
- секвенируют с праймерами, комплементарными вставке или полилинкеру перед/за ней (рис. 22).
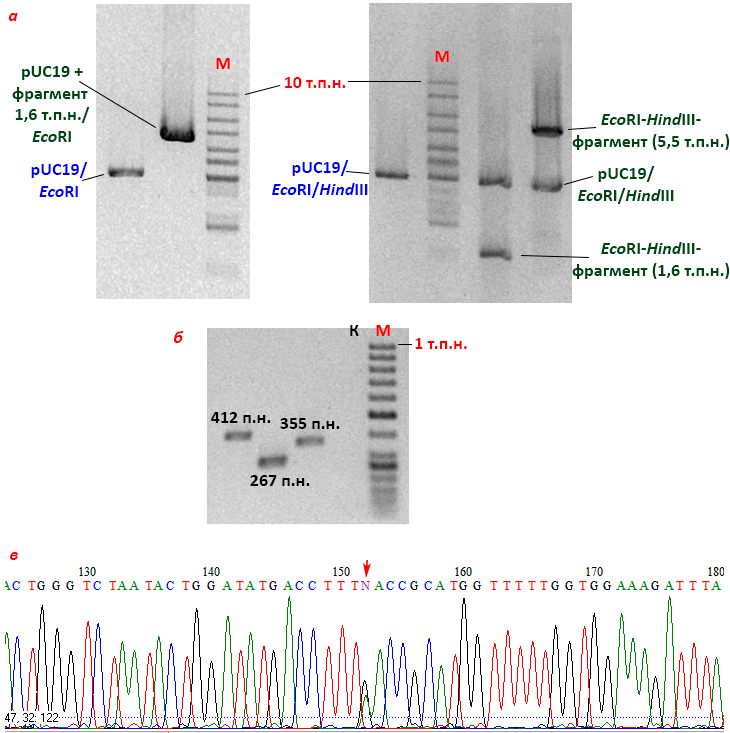
Рисунок 22. Молекулярные способы подтверждения клонирования. а — Рестрикционный анализ: слева — линеаризация одной рестриктазой вектора (контроль) и вектора со вставкой, выделенного из трансформанта (по маркеру можно судить, насколько увеличилась конструкция по сравнению с «пустым» вектором); справа — выщепление вставки из вектора двумя рестриктазами (здесь разрезаны две векторные конструкции с разными вставками). Все размеры должны соответствовать ожиданиям. б — Амплификация фрагментов клонированной ДНК по матрице плазмид, выделенных из трансформантов; К (чистая дорожка) — отрицательный контроль, когда в ПЦР-смеси есть всё, кроме нужной матрицы. Маркеры в а и б разные. в — Секвенирование вставки со специфическим праймером; N (под красной стрелкой) — неясный аппарату, но иногда ясный глазу, нуклеотид. Проблема N-ок решается многократным «чтением» с разных сторон одного и того же куска ДНК, но для простого подтверждения клонирования это избыточно.
фото автора
Если же рекомбинантная ДНК должна экспрессироваться, работу клонированного гена проверяют на уровне РНК и/или белка. В зависимости от ситуации для этого в разной степени пригодны:
- нозерн-блоттинг (рис. 21);
- транскрипция in vitro (извлечение из клетки «транскрипционных зачатков» — комплексов, где инициировалась транскрипция, — для завершения транскрипции в пробирке с добавлением подходящей РНК-полимеразы и меченых NTP; у эукариот вначале извлекают ядра);
- RT-qPCR [44];
- анализ транскриптома: секвенирование [20] или гибридизация на чипах (рис. 21);
- вестерн-блоттинг [46];
- анализ протеома: двумерный электрофорез и масс-спектрометрия [53].
Описанное выше относится и к анализу «библиотечных» трансформантов (библиотеки, кстати, бывают и экспрессионными). Просто бактериальных колоний придется отобрать и изучить уйму.
В конце концов заветные микропробирки с рекомбинантной ДНК и обремененными ею клонами отправятся по морозильникам. Но скоро их придется потревожить — мы ведь ломали мозги не просто так и хотим извлечь из клонированной ДНК какую то пользу. Может, мы будем изучать ее структуру или ее работу, а может, будем использовать для производства ценных продуктов, конструирования новых метаболических путей или генотерапевтических средств... Так или иначе, но нам, возможно, придется освоить набор инструментов, всегда занимавший видную полку в генно-инженерной мастерской, — мутагенез. Ну а чтобы процедура стандартного клонирования закрепилась в памяти, рекомендуем посмотреть коротенькую видеоиллюстрацию прочитанной главы:
Видео 1. Ключевые этапы молекулярного клонирования
Глава 2. Мутагенез
Это слово внушает сакральный страх. Да, с помощью мутагенеза можно
- калечить гены, но (!) чтобы понять, зачем они были нужны,
а можно творить самое что ни на есть богоугодное:
- улучшать свойства ценных белков,
- исправлять патологические гены.
Вначале он был случайным и in vivo. Настолько случайным, что доставалось и самим биологам. С помощью химических и ионизирующих мутагенов были получены, например, многие сорта растений, которые с аппетитом потребляют до сих пор. Однако отбор нужных мутаций длился вечность. Чуть позже на службу науке призвали биологических агентов — мобильные генетические элементы: научились нарушать работу случайных генов инсерцией (внедрением) фага Mu у E. coli и транспозона Ty у дрожжей. Развитие методов работы с ДНК in vitro ограничило случайность размером фрагмента, с которым манипулируют в этой самой пробирке. Например, гидроксиламин может устроить в нём транзицию пары C—G в T—A, а безалаберная обратная транскриптаза AMV — построить цепь ДНК с ошибками. Более-менее случайные делеции (выпадения) можно получать разными комбинациями нуклеаз: например, вскрывать одну или обе нити ДНК ДНКазой I или рестриктазой, а расширять разрыв S1 или BAL-31. Небольшую инсерцию можно устроить, введя какой-нибудь тупоконечный линкер в двухцепочечный разрез [30].
Но ничто не сравнится с мутагенезом целенаправленным. Сейчас возможны его варианты in vitro и in vivo.
Cайт-специфический мутагенез in vitro
Техники сайт-специфического мутагенеза произвели революцию не только в фундаментальной науке, но и в белковой инженерии: они позволили быстро и сравнительно просто изменять специфичность или повышать активность ферментов путем точечных замен аминокислот. Ну а чтобы поменять аминокислоту, нужно работать с кодирующими ее нуклеотидами. Для этого отлично подошел уже упоминавшийся мутагенез, направляемый олигонуклеотидами. Один из самых удобных классических вариантов метода [54] основан на использовании М13-векторов. Для него нужны: одноцепочечный фаговый вектор с клонированной последовательностью, в которой надо заменить 1–2 нуклеотида, и химически синтезированный олигонуклеотид (в среднем 20 дезоксирибонуклеотидов). Последний должен быть комплементарным участку клонированного гена в районе планируемой мутации, но в нужном месте содержать уже измененный нуклеотид. После смешивания в пробирке с вектором и необходимыми реактивами такой олигонуклеотид гибридизуется (слипается) с соответствующим участком вектора и служит затравкой для синтеза новой цепи ДНК по векторной матрице. Если запустить эту уже двухцепочечную ДНК в бактерии, то часть образованных там фагов захватит нить вектора с исходным геном, а часть — с мутантным (рис. 23).
Биоинженеры отлавливают и проверяют мутантные ДНК и поступают с ними в зависимости от задачи. Отлавливать их можно гибридизацией с тем же исходным мутагенным олигонуклеотидом (если он меченый), но обязательно в строгих условиях, не прощающих даже точечного неспаривания зонда и мишени. Такой подход ленивые биоинженеры невзлюбили и придумали вариант попроще. При синтезе цепи ДНК по М13-матрице в пробирку добавляют смесь нуклеотидов, в которой обычный dCTP заменен на модифицированный серой — dCTPαS. Затем получившуюся двухцепочечную молекулу обрабатывают рестриктазой, которая не умеет раскусывать нити ДНК с тионуклеотидом. Она честно распознает свой сайт, но щепит в нём только одну цепь, в нашем случае исходную, немутантную. Этот разрез радостно находит добавленная в пробирку экзонуклеаза и сгрызает всю исходную нить ДНК. По матрице оставшейся мутантной цепи тут же синтезируют комплементарную, то есть тоже мутантную цепь (рис. 23). Немного серы — и никакого отбора!
Обойтись обычными плазмидами позволяет ПЦР-вариант олигонуклеотид-направляемого мутагенеза, где мутация вносится праймерами (рис. 23).
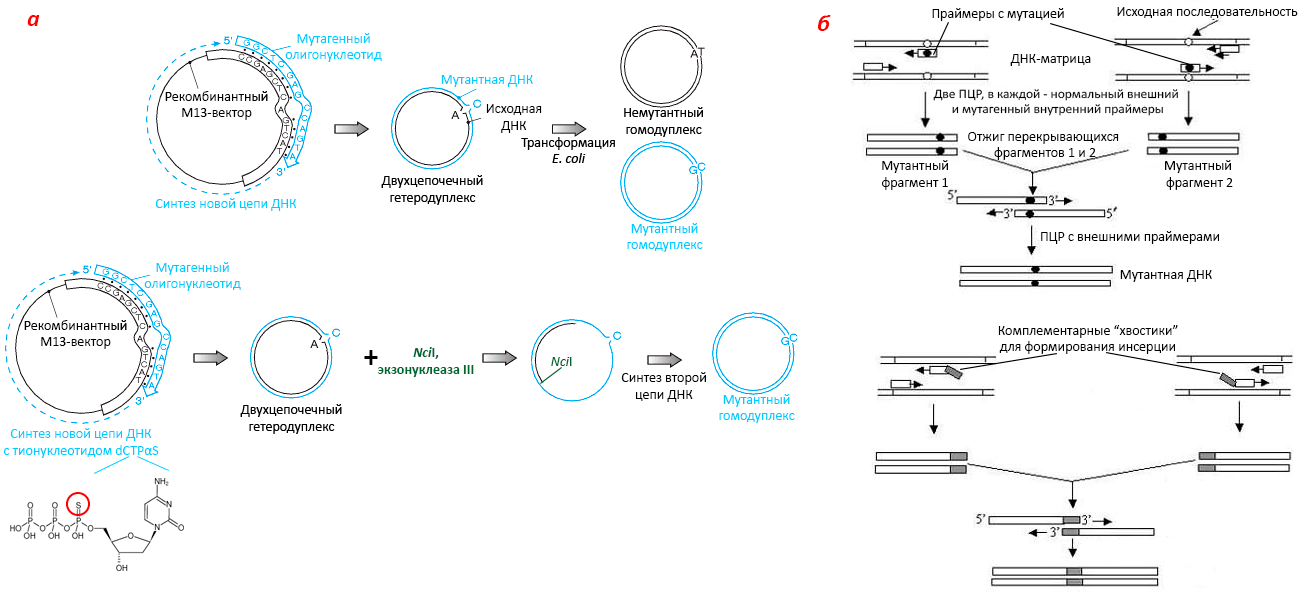
Рисунок 23. Мутагенез, направляемый олигонуклеотидами. а — Внесение точечной мутации с помощью одноцепочечного вектора. Объяснение приведено в тексе. б — Точечная замена (вверху) или инсерция (внизу) посредством ПЦР с перекрывающимися праймерами. Исходная последовательность слева и справа одна и та же, то есть внутренние праймеры комплементарны друг другу, а потому в ходе двух отдельных ПЦР образуются перекрывающиеся фрагменты. В случае инсерции у праймеров нет измененных нуклеотидов, зато есть мутагенные «хвосты», различий в процессе мутагенеза нет. При ином дизайне праймеров можно устраивать и небольшие делеции.
Cайт-специфический мутагенез in vivo
Он особенно удается у организмов типа дрожжей, активно практикующих гомологичную рекомбинацию. В простейшем случае, если в дрожжевой клетке нужно выключить какой-то ген, его можно просто заместить маркерным. Образцово-показательный ген neoR для этого амплифицируют с праймерами, на 5′-концах которых навешены участки, гомологичные «окрестностям» удаляемого из хромосомы гена. Тогда neoR заменит его путем двойного кроссинговера (рис. 7). Если же концы праймеров сделать комплементарными «внутренностям» выключаемого гена, то получится внушительная инсерция. В любом случае мутантов можно будет идентифицировать по устойчивости к неомицину. Однако маркер не всегда можно оставить в хромосоме, и в таких случаях в праймерах предусматривают дополнительные, идентичные друг другу участки, при спонтанной рекомбинации которых маркер сможет вырезаться из хромосомы, оставив целогенную делецию.
Для внесения точечных изменений используют интегративный вектор с мутантным фрагментом, гомологичным гену-мишени. В этом же векторе располагают маркерный ген (например, URA3), компенсирующий соответствующий дефект клетки-хозяина. Одиночный кроссинговер затянет целую плазмиду в хромосому, удвоив ген-мишень. Одна из копий мишени будет содержать мутацию. Интегрантов отбирают на среде без урацила, поскольку благодаря попавшему в них URA3 они сами могут производить это азотистое основание. Ну а дальше селективное давление в виде безурацильной среды убирают и ждут гомологичной рекомбинации между копиями мишени, при которой из хромосомы удалится вектор и в каких-то клонах из двух вариантов гена останется именно мутантный. Таких обратных рекомбинантов отбирают по утрате URA3. Для этого дрожжей заставляют расти на среде с 5-фтороротовой кислотой (5FOA), а поскольку продукт гена URA3 превращает 5FOA в токсичный 5-фторурацил, на такой среде выживают только клетки без URA3. А вот мутанты ли они, нужно проверять молекулярными методами — гибридизацией или ПЦР с секвенированием.
Появившиеся не так давно техники геномного редактирования — это частный случай направленного мутагенеза, который можно осуществлять как in vitro, так и in vivo. У этих «бесовских изобретений» почти божественные возможности, и потому за ними пристально следит глаз народа, а мы посвящаем им отдельную главу.
Глава 3. Операционная генного инженера: редактирование геномов
Перечисленные в этой главе системы относятся к инструментам целенаправленной модификации, или таргетинга, генов — подхода, дополнившего метод «генных ловушек», или трэппинга генов, при котором отслеживают повреждение генов случайными вставками беспромоторных репортеров.
О мышах и людях: революционные рекомбиназы
Когда-то Роберт Бёрнс сильно сокрушался по поводу человеческих невзгод, и из-под его пера вышло стихотворение «К мыши, гнездо которой разорил мой плуг». По поводу человеческих болезней не менее сильно сокрушались ученые, и в их лабораториях завелись модельные мыши, геномы которых разорили разными ферментами. Настоящую революцию в мышиной генетике, а значит, и в изучении/моделировании человеческих процессов, произвели сайт-специфические рекомбиназные системы (SSR). Позаимствовав три самых интересных у дрожжей и вирусов, человек приступил к их настройке и в конце концов научился с их помощью целенаправленно вносить мутации, быстро составлять огромные генетические конструкции и своевременно включать-выключать гены. Принципы работы этих систем схожи: белок-рекомбиназа узнает и рекомбинирует две «своих» последовательности ДНК. Последовательности в этой паре могут быть идентичными (у Cre-loxP и Flp-FRT), а могут и различаться (у ΦC31-att).
1. Cre-loxP — изобретение фага P1, ставшее самой популярной SSR-системой. Рекомбиназа Cre распознает два сайта loxP (locus of crossing-over of P1) длиной по 34 п.н. Рекомбинация между ними может закончиться по-разному в зависимости от того, на одной или разных молекулах ДНК они находятся, и от их взаимной ориентации (рис. 24, видео 2). В генной инженерии пользуются как природными lox-последовательностями (с буквой «P»), так и измененными.
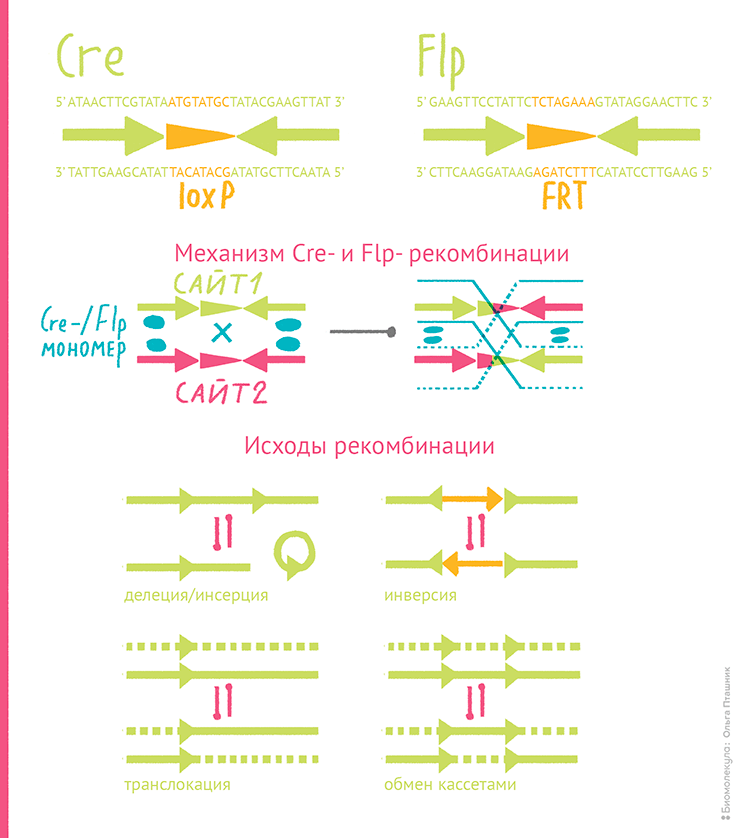
Рисунок 24. Системы сайт-специфической рекомбинации Cre-loxP и Flp-FRT. Сайты ДНК, узнаваемые рекомбиназами, состоят из концевых инвертированных палиндромов (по 13 п.н.) и центральной уникальной части (8 п.н.), задающей направление реакции. Расстояние между lox- и FRT-сайтами в паре должно быть не менее 82 и 74 п.н. соответственно. Фрагмент ДНК, находящийся между прямыми lox/FRT («нос к хвосту»), вырезается, а между инвертированными — переворачивается. Если сайты находятся на двух разных молекулах ДНК, возможна интеграция одной в другую (инсерция) или обмен участками.
рисунок Ольги Пташник
Видео 2. Cre-рекомбиназа
Чтобы «включить» экспрессию гена (допустим, трансгена) только в нужной ткани, обычно готовят две линии мышей, манипулируя с их эмбриональными стволовыми клетками. Одна должна содержать стоп-последовательность, разобщающую ген со своим промотором и потому блокирующую транскрипцию (рис. 25). Но главное, чтобы эта стоп-последовательность была «флоксированной», то есть окруженной парой прямых lox-сайтов. Другая линия мышей должна содержать ген Cre под контролем тканеспецифического промотора. Межлинейное скрещивание мышей (неоднократное, если нужно получить мутантную гомозиготу) должно привести к появлению потомков, у которых обе конструкции встретятся. Тогда рекомбиназа в нужной ткани вырежет флоксированную стоп-последовательность, разрешив тем самым экспрессию гена.
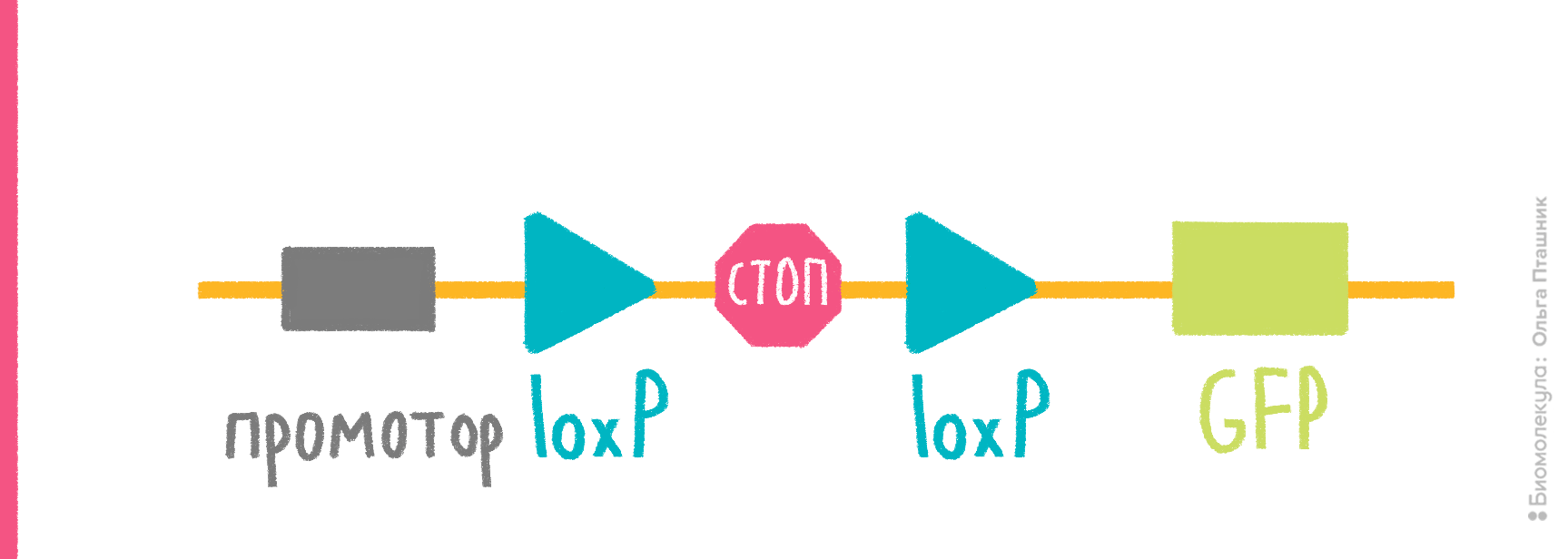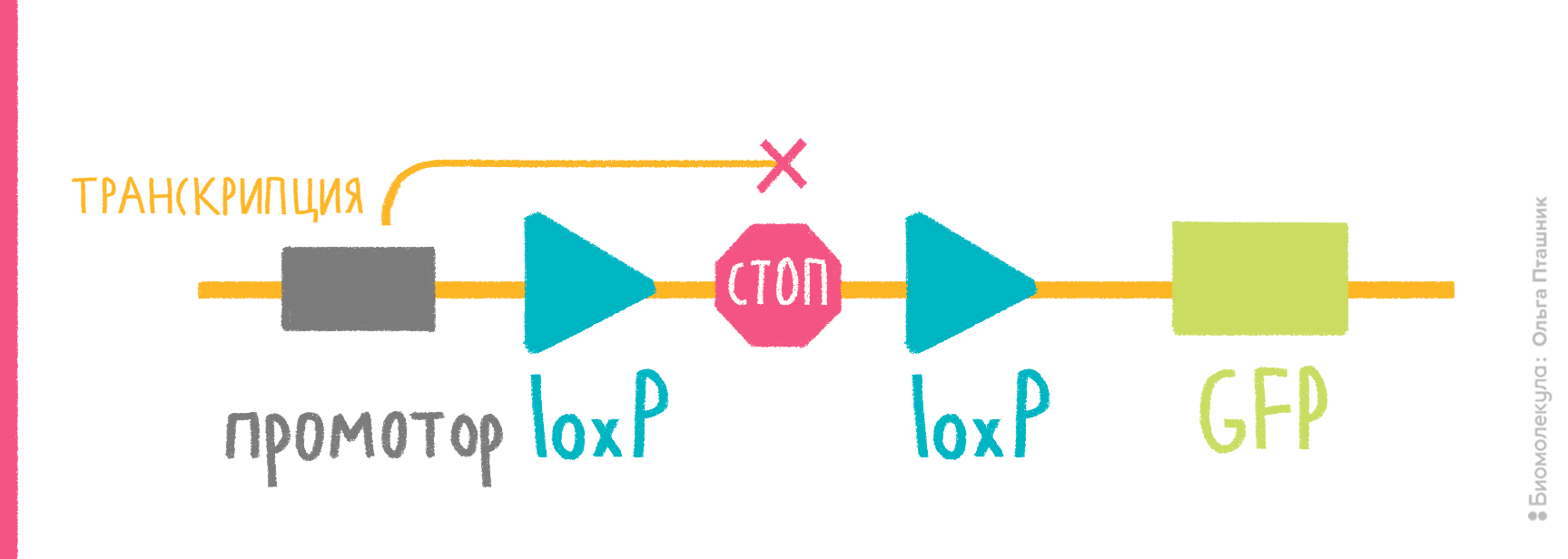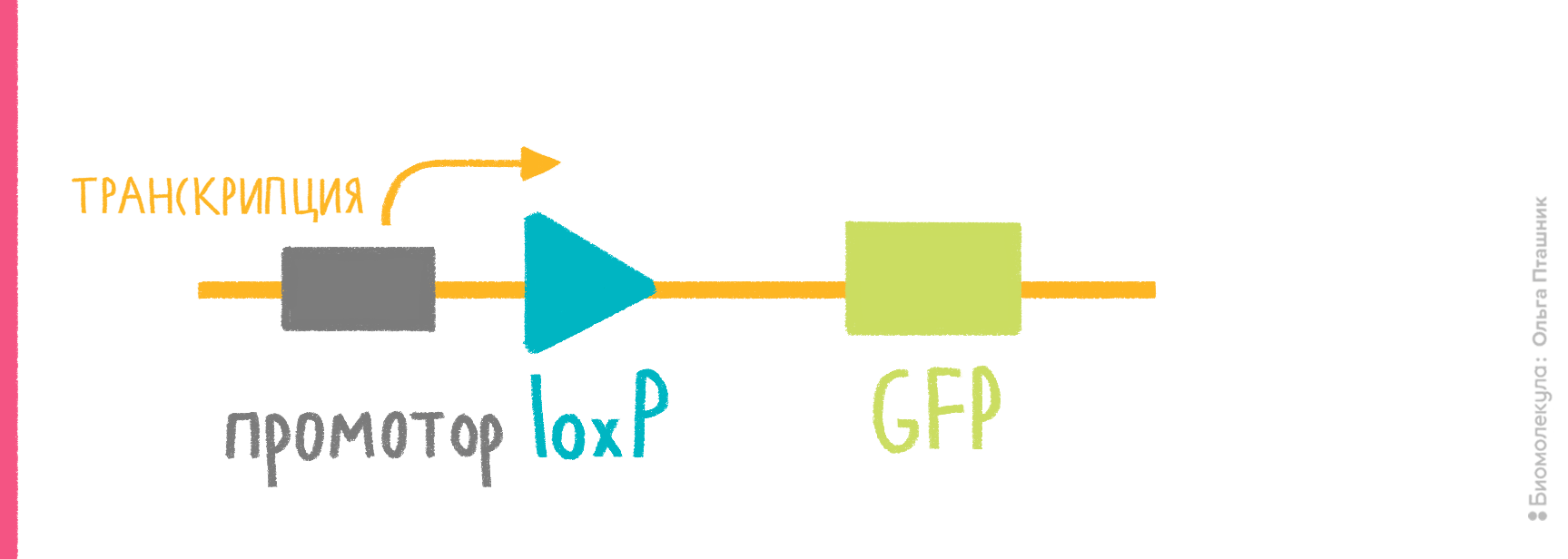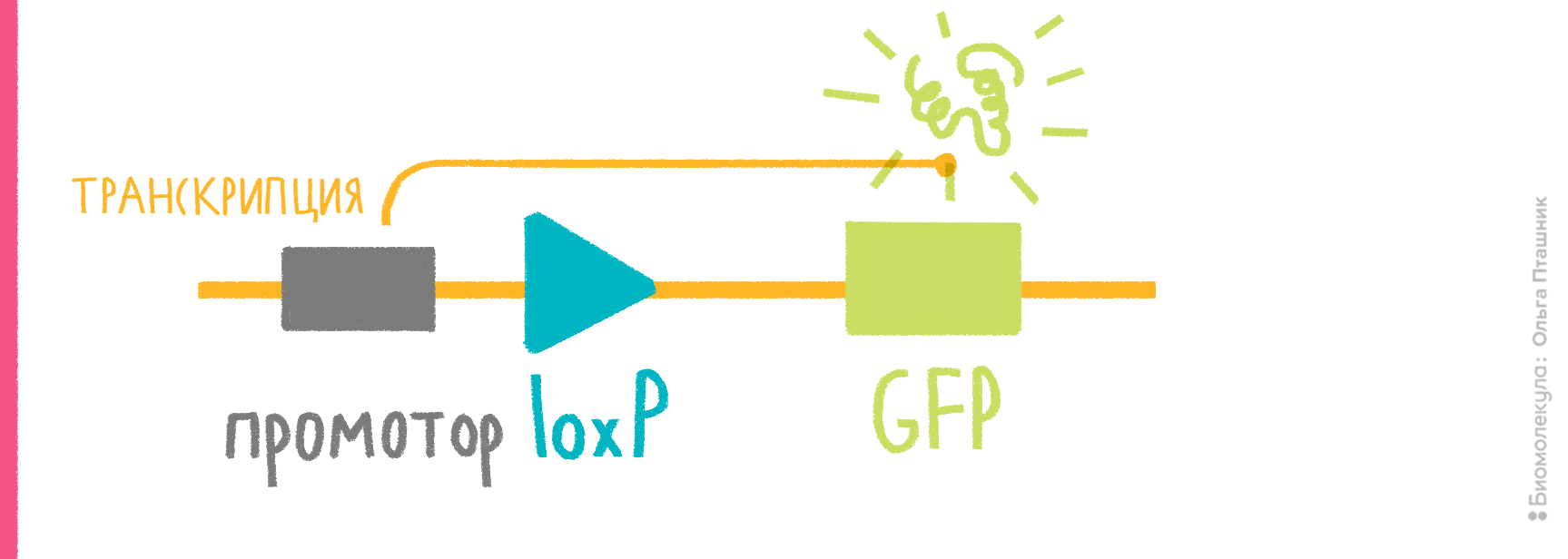
Рисунок 25. Регуляция экспрессии гена с помощью Cre-рекомбиназы. Ген gfp приведен в качестве репортерного.
рисунок Ольги Пташник
А чтобы делать это еще и в нужные моменты времени, необходимо ген самой Cre подставить под индуцируемый промотор. Например, активируемый введением тетрациклина. Еще интереснее использовать не простую Cre, а генетически сшитую с мутантным эстрогеновым рецептором (точнее — его лиганд-связывающим доменом). Такая химера спокойно плавает в цитоплазме в комплексе с белком теплового шока (БТШ). Если же ввести синтетический аналог эстрогена, тамоксифен, он свяжется с химерной рекомбиназой и обнажит на ней ядерный адрес, вытеснив БТШ. Тогда-то рекомбиназа спохватится и проследует в ядро, чтобы начать «оперировать» (видео 3) [55]. Однако длительная остаточная стимуляция рекомбинации тамоксифеном может мешать некоторым экспериментам [56].
Видео 3. Cre-LoxP-рекомбинация
Подобным образом можно инвертировать и вырезать фрагменты генома, но о нокаутировании — чуть позже. Схемы скрещивания Cre-lox-мышей для разных задач наглядно представлены в заметке их заводчиков: Cre/lox breeding for dummies.
2. Flp-FRT — аналог предыдущей системы, но только его «родиной» была 2-микронная плазмида дрожжей. Рекомбиназу Flp еще называют флиппазой, а аббревиатура FRT расшифровывается как flippase recognition target (рис. 24).
Обе эти SSR не мучают биологов низкой специфичностью, потому что сайты, распознаваемые Cre и Flp достаточно протяженные, чтобы многократно не повторяться в хромосоме. И при этом не настолько велики, чтобы препятствовать экспрессии гена. Есть только две неприятности: риск обратной реакции, если вовремя не «отключить» рекомбиназы или заранее не модифицировать узнаваемые ими сайты, и то, что эти сайты нужно как-то «предустанавливать» в геном. Но уж если они внесены в какое-нибудь безопасное место, то станут прекрасной платформой для быстрого и строго специфичного внедрения ДНК.
3. Система рекомбинации ΦC31-att заимствована у фага ΦC31, паразита стрептомицетов, и очень похожа на лямбда-фаговую (схема работы приведена на рис. 7). Интеграза ΦC31 катализирует рекомбинацию между сайтами attB (минимум 34 п.н.) и attP (минимум 39 п.н.), в результате которой образуются уже другие сайты — attL и attR. ΦC31 к ним теряет всяческий интерес, и потому можно не опасаться обратной реакции [55]. В геноме млекопитающих есть несколько псевдо-attP — сайтов, похожих на природный attP и расположенных относительно безопасно. Если запустить в клетки вектор с трансгеном и сайтом attB, то интеграза ΦC31 может встроить вектор в один из псевдо-attP, а не в специально подготовленный attP. Но для генной терапии это тоже может быть неплохим вариантом.
SRR-системы по отдельности и в разных комбинациях оказались рабочими не только в мышиных тельцах, но и в других про- и эукариотических организмах/клетках [57]. Единственное, что в некоторых из них белок Cre может быть токсичным и чуть менее эффективным, чем Flp [58].
SRR сейчас сильно облегчают жизнь генным инженерам. Они могут делать буквально всё: делеции, инверсии, инсерции, транслокации, быстро менять маркерные и другие гены [59], [60], регулировать экспрессию. С их помощью можно создавать рекомбинантные ДНК очень изощренно и точно. Например, лямбда-фаговая модель интеграции легла в основу знаменитого Gateway-клонирования, заменяющего обычное, когда надо, например, одну и ту же вставку быстро переместить в разные векторы с сохранением рамки считывания [61].
О волшебных ножницах: дизайнерские нуклеазы
Когда-то ученые сильно сокрушались: «Отчего люди не рекомбинируют гомологично так, как дрожжи?» Но вдруг они заметили, что двухцепочечные разрезы (DSB) ДНК повышают ничтожную частоту этой самой рекомбинации на несколько порядков. Но не только это. Они и сами по себе могут приносить пользу. Так зародилась новая прецизионно-хирургическая индустрия, подарившая миру умопомрачительные научные и терапевтические перспективы. Главными инструментами в ней стали высокоточные «программируемые» инженерные нуклеазы, детали которых человек, как обычно, заимствовал у природы.
Все они делают двухцепочечный разрез в специфических хромосомных сайтах-мишенях. Репарационные системы клеток замечают такой разрез и пытаются его отремонтировать (рис. 26). Обычно активируется система негомологичного соединения концов (NHEJ), которая после своей работы может оставлять «рубцы» — небольшие делеции или инсерции. Несмотря на варварское исполнение, такая репарация может быть полезна, если нужно сместить рамку считывания или вырезать кусок ДНК (так происходит, когда два и более DSB случились по соседству). То есть NHEJ — отличный способ навсегда «выключить» ген [62].
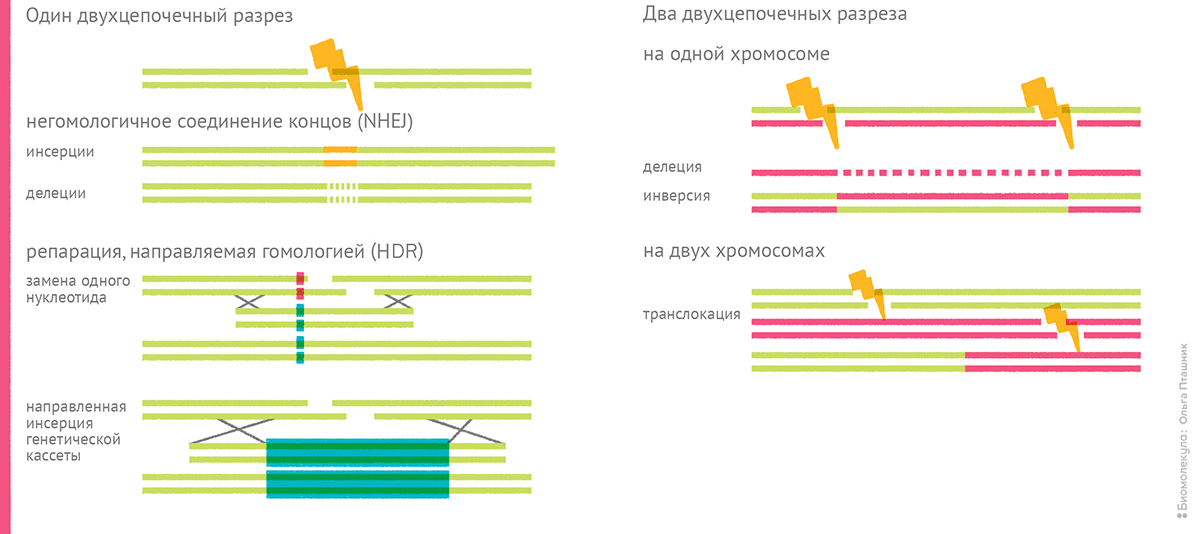
Рисунок 26. Исходы репарации двухцепочечных разрезов ДНК, или Что мы можем получить от инженерных нуклеаз и от их сочетания с молекулой-донором
рисунок Ольги Пташник
Если же нужно в место разреза ввести фрагмент ДНК, то активируют репарацию, направляемую гомологией (HDR). А для нее необходима какая-нибудь матрица (донор) с участками, гомологичными «торчащим» концам разрезанной хромосомы. В естественных условиях это может быть сестринская хроматида или гомологичная хромосома, а в экспериментальных — одноцепочечный дезоксирибоолигонуклеотид или вектор, в котором основное содержимое (например терапевтический ген) фланкировано подходящими участками гомологии. Ферменты HDR синтезируются на S/G2-стадиях клеточного цикла [63], то есть только при подготовке к делению, поэтому иногда прибегают к химической стимуляции гомологичной рекомбинации. Но даже в присутствии донора NHEJ так и норовит вмешаться, и если ей удастся оставить рубец, то та же самая нуклеаза не сможет второй раз «вскрыть» хромосому в той же точке. Приходится нуклеазу перепрограммировать. А это бывает ой как нелегко. Посмотрим, какие же системы геномного редактирования точнее и пластичнее в дизайне.
1. Мегануклеазы — это хоуминг-эндонуклеазы, удивительные ферменты, обеспечивающие распространение собственных генов горизонтально, а именно — оккупацией еще свободных от них аллелей. Это пионеры эры геномного редактирования. Они встречаются у про- и эукариот, могут быть гомодимерами (I-CreI) или симметричными мономерами (I-SceI) и напоминают обычные рестриктазы, которые распознают необычно длинные последовательности (рис. 27, табл. 2). Поскольку такие сайты больше одного раза на человеческий геном (а то и на несколько) обычно не встречаются, мегануклеазы уверенно обходят по специфичности все эндонуклеазы. Порезать ими гигантские растительные геномы вероятнее, чем человеческий, но природного разнообразия в любом случае не хватает. Поэтому биологи в муках создают инженерные ферменты с гибридной или измененной специфичностью. Преимуществом мегануклеаз, помимо высокой точности, считают образование при разрезе высокорекомбиногенных 3′-OH-выступающих концов. Однако при всей уникальности узнаваемых сайтов мегануклеазы могут стерпеть парочку «не своих» нуклеотидов, поэтому точно предсказать специфичность конкретного фермента сложно.
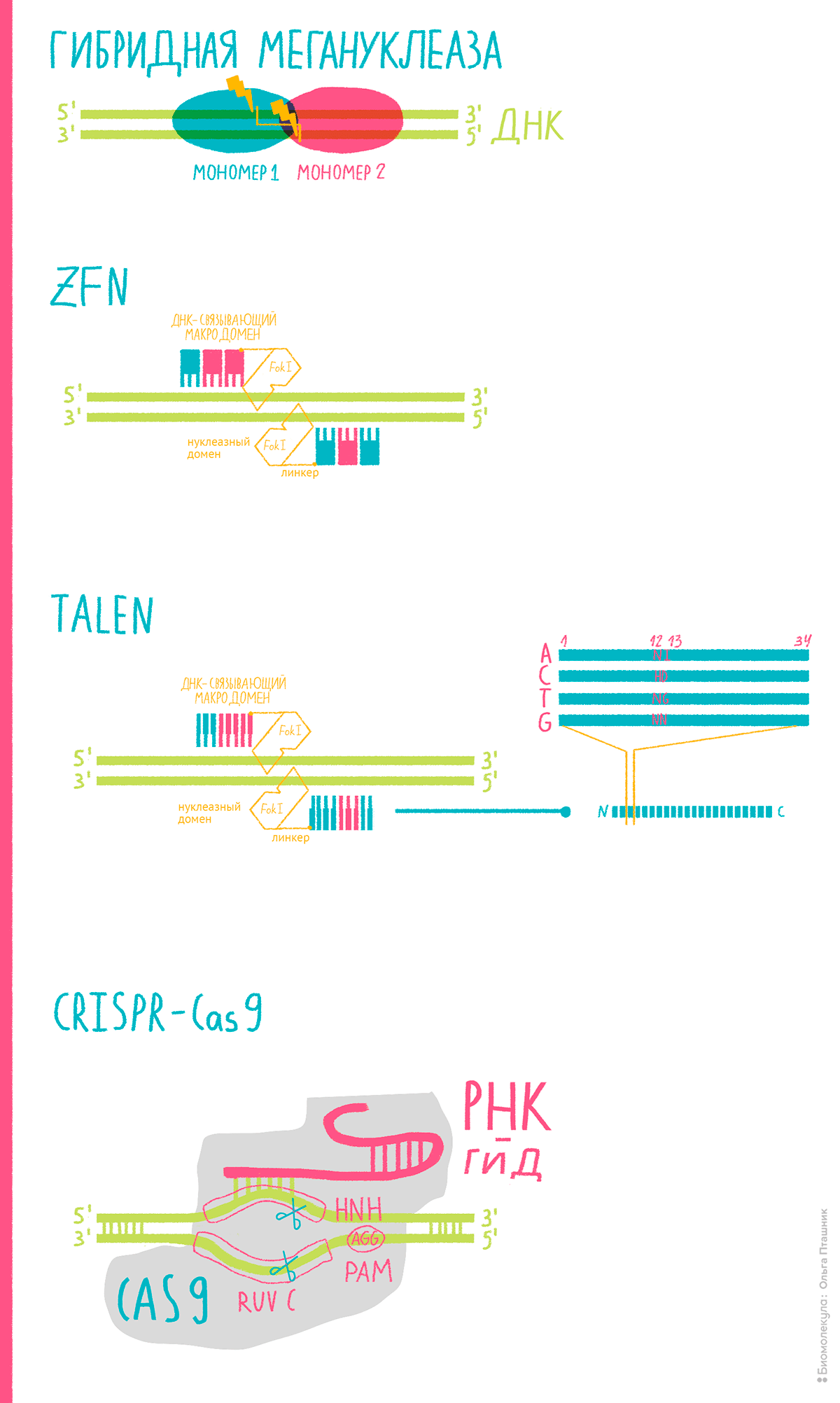
Рисунок 27. Анатомия систем геномного редактирования. Эти молекулярные хирурги могут работать in vitro и in vivo, распознавая и разрезая нуклеотидные последовательности (мишени), на которые их нацелил человек. Мегануклеаза узнает участок ДНК длиной 14–40 п.н. и режет, оставляя выступающие 3′-концы. Изображен гибрид, мономеры которого распознают разные половинки мишени. ДНК-связывающий макродомен ZFN — череда «цинковых пальцев», распознающая 9–18 п.н. (по 3–4 на каждый «палец»). ДНК-связывающий макродомен TALEN — тандемные повторы аминокислотных модулей (микродоменов), суммарно распознающие 18–20 п.н. (по одной на модуль). Модуль состоит из 33–35 аминокислот, но только две из них — 12-я и 13-я — обеспечивают специфичность связывания с мишенью. Нуклеазный компонент ZFN и TALEN требует димеризации. Ко второму его мономеру пришивают второй ДНК-связывающий домен, для противоположной цепи, что удваивает общее количество узнаваемых нуклеотидов (до 18–36 у ZFN и 30–40 у TALEN). Нуклеаза режет между сайтами узнавания — в спейсере (5–7 п.н. у ZFN, 12–21 п.н. у TALEN), обычно оставляя 5′-выступающие концы. Белок Cas9 из S. pyogenes — ДНК-связывающий мономер с двумя собственными нуклеазными доменами, HNH и RuvC, каждый из которых режет одну цепь. Сам белок распознает в мишени три нуклеотида, PAM (чаще — 5′-NGG), прилегающие с 3′-«стороны» к другим 20, узнаваемым РНК-гидом. Разрез «натупо» происходит за 3 п.н. до PAM.
рисунок Ольги Пташник
| Мегануклеазы | ZFN | TALEN | CRISPR-Cas9 из S. pyogenes | |
|---|---|---|---|---|
| Первое применение в клетках человека, год | 1994 | 2003 | 2011 | 2013 |
| Компоненты | Мономерный/димерный белок | Химерный белок из двух доменов — ДНК-связывающего и нуклеазного | Химерный белок из двух доменов — ДНК-связывающего и нуклеазного | Мономерный белок Cas9 и РНК-гид |
| Специфическое связывание с ДНК | Симметричное относительно разреза (2 полусайта) | ZF-домен: 3–6 тандемных «цинковых пальцев», каждый узнает 3–4 п.н. | TALE-домен: 14–20 сходных тандемных модулей, каждый узнает 1 п.н. | РНК-гид (20 н.), Cas9 (дополнительно) |
| Разрезание ДНК | Нуклеазный и «узнающий» домены не разделены | Неспецифический нуклеазный домен рестриктазы FokI | Неспецифический нуклеазный домен рестриктазы FokI | Два нуклеазных домена: HNH и RuvC |
| Механизм узнавания | Белок—ДНК | Белок—ДНК | Белок—ДНК | РНК—ДНК, Cas9 — PAM-мотив ДНК |
| Количество компонентов на одну мишень | Один белок | Два белка (гетеродимер) | Два белка (гетеродимер) | Один белок, один РНК-гид |
| Размер сайта-мишени | 14–40 п.н. | 18–36 (9–18 × 2) | 28–40 (14–20 × 2) | 22 п.н. (20 п.н. — РНК-гид; 2 п.н. — Cas9) |
| Ограничения выбора мишени | Низкая встречаемость (уникальность) | G-богатые сайты | T на 5′-конце | PAM-мотив: NGG (хуже — NAG) на 3′-конце |
| Тип разреза | 3′-выступающие концы | 5′-выступающие концы | 5′-выступающие концы | Тупые концы |
| Частота on-target-событий (успешность) | Низкая | Низкая | Высокая | Высокая |
| Частота off-target-событий | Сложно предсказать | Высокая | Низкая | Разная, иногда высокая |
| Размер кодирующих
последовательностей | ~0,6–1 т.п.н. | ~1,2 т.п.н. / мономер | 2,5–3 т.п.н. / мономер | ~4,2 т.п.н. / Cas9 (~3,3 т.п.н. у S. aureus),
~0,1 т.п.н. / РНК-гид |
| Ограничения по доставке | Нет | Нет | Размер (димер не войдет в rAAV), ДНК-повторы (рекомбинация в лентивирусах) | Размер (в rAAV войдет только система из S. aureus) |
| Цитотоксичность | Нет | Бывает | Нет | Нет |
| Дизайн | Очень сложный | Сложный | Умеренно сложный | Простой |
| Возможность мультиплексирования | Нет | Нет | Нет | Есть (один Cas9 — несколько РНК-гидов) |
| * Литературные данные нередко разнятся, поэтому приведены чаще встречающиеся «мнения» | ||||
2. ZFN (нуклеазы на основе белков с доменом «цинковые пальцы») получают сшиванием двух разнородных доменов — ДНК-связывающего и нуклеазного. Первый состоит из тандемных микродоменов — «цинковых пальцев» (zinc fingers Cys2-His2, около 30 аминокислот), структуру которых стабилизируют ионы цинка, отсюда и название. Эти «пальцы» широко распространены у эукариот и обеспечивают специфическое взаимодействие несущих их белков с ДНК и другими молекулами. Чаще всего такие белки регулируют транскрипцию. ZF-белок для геномного редактирования собирают, как конструктор, из 3–6 микродоменов с известной специфичностью, распознающих по 3–4 п.н. Для приемлемой специфичности разреза таких микродоменных комплексов нужно два (для двух цепей ДНК). Каждый из них сшит с неспецифически режущим нуклеазным доменом рестриктазы FokI, то есть специфичность разреза определяют две последовательности «цинковых пальцев» (рис. 27). Такие белки конструировать легче, чем мегануклеазы, но сложно подобрать «пальцы» для всех нужных комбинаций нуклеотидов и обеспечить правильное взаимное расположение двух ZFN.
3. TALEN (нуклеазы на основе эффекторов, подобных активаторам транскрипции) — тоже химеры, работающие в паре и состоящие из нуклеазного домена FokI и ДНК-связывающего домена, но только не ZF, а TALE. Природные TALE тоже участвуют в регуляции экспрессии генов, но только относятся к факторам вирулентности фитопатогенов из рода Xanthomonas. Секретируемые ксантомонадами TALE связываются с промоторами в растительных клетках и меняют работу генов так, чтобы подавить сопротивляемость инфекции. TALE состоят из тандемных повторов аминокислотных модулей, каждый из которых распознает 1 п.н. За специфичность узнавания в каждом модуле отвечают лишь две аминокислоты, поэтому было несложно расшифровать «TALE-код» и составить табличку, по которой можно комбинировать модули для нацеливания нуклеазы на любую мишень (рис. 27). TALEN легко собирать, а в экспериментах они реже «мажут мимо цели» и менее цитотоксичны, чем ZFN. Но множество ДНК-повторов в кодирующих TALEN векторах может создавать проблемы при вирусной доставке системы в клетки [62].
4. CRISPR-Cas9 — редактирующая система из одного единственного мономерного белка, Cas9. Это нуклеаза, ведомая к цели молекулой РНК (нечто подобное мы уже видели у программируемой рестриктазы PfAgo). Природные Cas-белки работают киллерами в CRISPR-системах адаптивного иммунитета прокариот. Как эти системы функционируют, наглядно показано в инфографике «Просто о сложном: CRISPR/Cas» [64], а драматическая история их превращения в генно-инженерный инструмент изложена в статье «CRISPR-эпопея и ее герои» [65].
Первой инженерной системой стала CRISPR-Cas9 из Streptococcus pyogenes. Она более громоздкая, чем ZFN и TALEN, в виде кодирующих ее элементов: ДНК-последовательности белка Cas и РНК-гида. Это затрудняет ее доставку в клетки млекопитающих с помощью безопасных и удобных, но слишком малоёмких rAAV. Зато всё, что нужно для разрезания нового участка ДНК, — это быстренько синтезировать новую 20-нуклеотидную РНК. Никакой белковой инженерии! Фантазию здесь ограничивает лишь необходимость 2–6-нуклеотидной последовательности PAM по соседству с мишенью. Именно ее ищет в геноме Cas9, чтобы расплести ДНК и «примерить» к ее цепям своего РНК-гида. Если уровень комплементарности нуклеазу устроит, то она поймет, что таки нашла мишень и ее нужно резать. В сложных случаях, конечно, можно сконструировать белок, распознающий нужный PAM, но природная частотность PAM-ов обычно позволяет обойтись без этого.
Проблему доставки системы можно решать применением Cas-белков меньшего размера, из других прокарит, или введением в клетку уже готового рибонуклеопротеина (Cas + РНК-гид) [63], [66].
Более важная проблема CRISPR-Cas9 — ощутимый процент off-target-событий (промазываний), так как Cas9 может терпеть малые несоответствия РНК-гида и мишени. Вычислить многие из ложных мишеней помогают специальные сервисы. Помимо этого предлагают укорачивать гид до 17–18 нуклеотидов, сокращать время работы нуклеазы и использовать ее никазный вариант (nCas9) — тот, что будет резать только одну цепь мишени, потому что у него отключат один из нуклеазных доменов. Тогда обеспечивать специфичность разреза будут сразу два белка со своими гидами — ну прямо РНК-аналог PfAgo! Альтернативный вариант — сшивание «мертвого», то есть безнуклеазного, Cas9 (dCas9) с нуклеазным доменом FokI — dCas9-FokI [62].
В 2015 году возможности генной инженерии расширились за счет «кузины» CRISPR-Cas9, CRISPR-Cpf1 из Francisella novicida. Она распознает другой, расположенный с противоположной стороны мишени, PAM, и режет с образованием «липких» концов, более располагающих к инсерциям.
Области применения CRISPR-Cas-системы перечислены в вышеупомянутой «биомолекулярной» статье [64] и в целом совпадают с точками приложения других дизайнерских нуклеаз. Помимо научных изысканий, эти системы обещают сильно продвинуть вперед биотехнологию и терапию инфекционных и неинфекционных заболеваний с хоть каким-то генетическим компонентом.
Итак, каждая инженерная нуклеазная система имеет свои недостатки и достоинства. CRISPR-Cas9 выделяется пластичностью и простотой дизайна, возможностью мультиплексирования реакции (один белок — несколько РНК-гидов — несколько мишеней) и, что очень важно, невысокой стоимостью. Не удивительно, что именно эта система вызвала взрыв интереса к редактированию геномов: потрясающих результатов стали добиваться чуть ли не на коленке. Однако и другие системы находят достойное применение в умелых руках. Компания Sangamo довела до клинических исследований даже такой сложный инструмент, как ZFN.
Было бы удивительно, если бы биологи в борьбе с индивидуальными недостатками систем не додумались их комбинировать. Так появилась, например, мегаTAL — химера мегануклеазы и TAL-эффектора, объединившая нуклеазные достоинства первой с высокой эффективностью специфического связывания и легкостью дизайна второго. МегаTAL работает как мономер и кодируется более компактной конструкцией, чем TALEN [63].
Но и этим разум человеческий не удовлетворился. На основе высокоспецифичных ДНК-связывающих компонентов инженерных нуклеаз он придумал конструировать системы с совершенно разными ненуклеазными функциями [67].
- Сшитые с доменами — активаторами/репрессорами транскрипции и ядерным «адресом», они превращаются в искусственные транскрипционные факторы (ATF), регулирующие экспрессию избранных генов. Такие химеры отлично показали себя в подавлении вирусных генов и активации генов с ленивыми собственными промоторами. Вероятно, и в сшивке с доменами — модификаторами хроматина они тоже не подведут [68].
- Плодотворен их союз и с транспозазами транспозонов, используемых для интеграции трансгенов в хромосомы: транспозоны Спящая красавица и PiggyBac, ведомые к цели таким гибридом, внедряются в ДНК куда менее случайно.
- Из них получаются отличные рекомбиназы с заданной специфичностью и — в случае соединения с модифицированной аденозиндезаминазой — редакторы азотистых оснований ДНК/РНК.
- Благодаря суммарному положительному заряду «цинковых пальцев», ZF-домены способны эффективно протаскивать в клетки млекопитающих белки, генетически сшитые с «пальцами».
Рассмотренные в начале этой главы рекомбиназные системы формально не относят к инструментам геномного редактирования: механизм их работы радикально отличается от «истинных» редакторов — нуклеаз. Но по сути обе системы целенаправленно модифицируют (то есть редактируют) геном. Они могут решать как разные, так и идентичные задачи — например, вносить одинаковые мутации. Но самое главное, что они прекрасно дополняют друг друга. Например, с помощью CRISPR-Cas9 удобно вводить lox-сайты в хромосому, а с помощью Cre включать синтез Cas9.
Глава 4. Важнейшие задачи генной инженерии
Здесь нужно заметить, что задач этих множество, но часть из них решается для удовлетворения потребностей и развития самóй генной инженерии: «Освобождение рабочих должно быть делом рук самих рабочих» (принцип Интернационала, К. Маркс).
Создание синтетических генов и геномов
По мере совершенствования методик химического синтеза нуклеиновых кислот длинные полинуклеотиды с заданной последовательностью дешевеют. Из них уже научились составлять целые хромосомы с подкорректированными по желанию ученых участками [69], [70]. Например, у всех на слуху «киборг» по имени Синтия: синтетический геном Mycoplasma mycoides в натуральном теле Mycoplasma capricolum [164]. А недавно и вовсе удалось создать бактерию с расширенным генетическим кодом — с неприродной парой нуклеотидов [71]. Собирать и перекраивать синтетические геномы помогают упомянутые в главе 3 сайт-специфические рекомбиназные системы. При создании хромосом «флоксирование» может достигать совершенно невообразимых масштабов (техника SCRaMbLE), позволяя оценивать связь «генотип—фенотип» чуть не для каждого гена [70].
Всем этим занимается целая отрасль под названием синтетическая биология. На одном ее полюсе находятся эпические геномные упражнения из разряда «проба пера», а на другом — рутинный коммерческий синтез. Уже появились весьма гибкие сервисы, предлагающие синтетические продукты разной степени готовности к использованию — всё упирается только в положение коллектива относительно черты бедности. Можно, например, разжиться набором «сделай сам» и собрать самостоятельно фрагмент ДНК размером с небольшой ген. А можно просто предоставить фирме желаемый сиквенс (в виде букв) и за 1–3 недели получить готовый ген в стандартном или эксклюзивном векторе, собранный в векторе метаболический путь с оптимизированными кодонами, а то и готовый очищенный продукт синтетического гена, наработанный в клетках млекопитающих. В принципе, уже любой обеспеченный желающий, не будучи сотрудником Института Крейга Вентера, может материализовать придуманный сиквенс из нескольких миллионов пар оснований.
Более того, синтезированные de novo полинуклеотиды можно на заказ калечить и составлять целые библиотеки генов с разными мутациями или вырожденными участками. Это существенно облегчает адский труд по направленной эволюции белков, творимой белковыми инженерами.
Анализ структуры генома, экспрессии генов, взаимодействия регуляторных белков с ДНК и белков друг с другом
1. Методы изучения структуры ДНК нам уже знакомы.
- Рестрикционный анализ. Оценка полиморфизма длин рестрикционных фрагментов (RFLP) позволяет обнаружить мутации и различить аллельные варианты. В таких исследованиях рестрикционное картирование часто сочетают с гибридизацией. Метод старый и трудозатратный. Без гибридизации он хорош для сравнения целых плазмид или других ДНК относительно небольшого размера, а также ампликонов 16S рДНК при оценке родства бактерий (ARDRA).
- ПЦР и ПЦР в реальном времени (qPCR) [44]. Методы имеют бессчетное число научных приложений и активно применяются для выявления патогенов, биологических загрязнений и генетического разнообразия, в том числе «болезнетворных» мутаций, ГМО и объектов интереса криминалистов.
- Гибридизация: по Саузерну (рис. 21) игенотипирование с помощью аллель-специфичных олигонуклеотидных зондов (ASO) — на микрочипах и мембранах (дот-блоттинг). В последнем случае геномную ДНК индивида (индивидов) наносят на мембрану в виде пятна (пятен), без предварительного разделения электрофорезом, денатурируют и фиксируют. На эту ДНК капают раствор с меченым ASO, и гибридизация в строжайших условиях позволяет различить аллели с однонуклеотидным разрешением, гомо- и гетерозигот (рис. 28). «Обратный» дот-блоттинг предполагает фиксацию на мембране разных немеченых ASO, а на них капают меченую геномную ДНК индивида — так оценивают сразу несколько биомаркеров.
- Секвенирование [20]. Метод — точнее не придумаешь, но до сих пор не у всех есть возможность секвенировать много и быстро, то есть не по Сенгеру. Однако секвенирование нового поколения постепенно дешевеет и распространяется [47], включая его «одноклеточные» варианты [72].
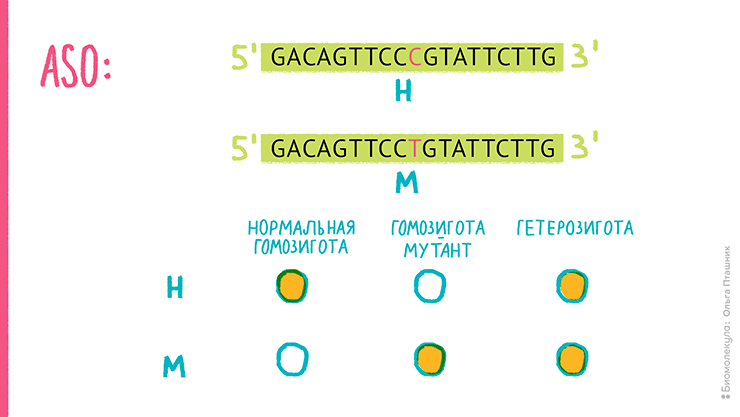
Рисунок 28. Дискриминация аллелей с помощью дот-блоттинга. ASO — аллель-специфичные олигонуклеотиды, зонды длиной примерно 20 н. Гибридизацию проводили сразу с двумя мечеными зондами: Н – комплементарным нормальной последовательности, М— мутантной.
рисунок Ольги Пташник
Иногда бывает так, что в клонированную конструкцию или какой-то клон геномной библиотеки не попал ген целиком, или его промотор, или соседний ген, а их край как нужно изучить. Или же мы получили трансгенную кукурузу и хотим посмотреть, куда именно наша конструкция встроилась [73]. Все эти частные случаи объединяются в одну ситуацию «у нас есть известный фрагмент генома, но нам нужно выделить и изучить соседние с ним области, о которых мы не знаем ничего». Выходы из этой ситуации есть, но не все они элегантны и универсальны (рис. 29).
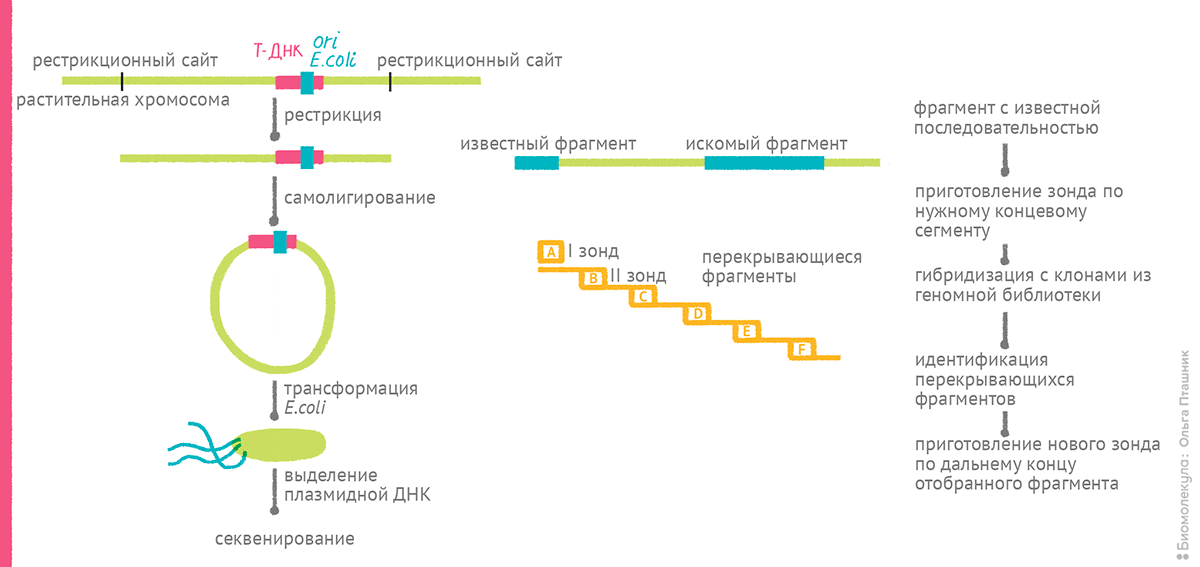
Рисунок 29. Способы извлечения соседних последовательностей из хромосомы. Слева — Метод «спасения», или восстановления, плазмиды (plasmid-rescue). В случае использования Т-ДНК, то есть у растений и некоторых грибов, в ее состав входят трансген с промотором, селективный маркер и ori репликации в E. coli. Т-ДНК встраивается в хромосому случайным образом. Чтобы узнать, куда именно попал трансген, выделяют хромосомную ДНК, режут ее крупнощепящими рестриктазами, лигируют (закольцовывают) фрагменты, трансформируют их смесью клетки бактерий, изучают плазмидную ДНК из отобранных по маркерным признакам клонов [74]. Если же нужно изучить какой-то локус хромосомы другого организма, в плазмиду внедряют участок, гомологичный известной части этого локуса. Чтобы встроиться в хромосому путем гомологичной рекомбинации, такой вектор не должен реплицироваться в этом организме. Интегрантов отбирают по маркерным признакам, а далее поступают, как описано выше. Метод несколько напоминает инвертированную ПЦР [44], которую тоже часто используют для локализации трансгенов. Справа — Прогулка по хромосоме (chromosome walking). Метод часто комбинирует гибридизацию с колониями (чтобы отобрать клоны с перекрывающимися фрагментами) и Саузерн-блоттинг (чтобы выбрать на основе рестрикционной карты нужные сегменты для нового зонда). Сейчас появились и менее трудоемкие варианты, основанные на ПЦР и секвенировании нового поколения.
рисунок Ольги Пташник
И наконец, каждый молекулярщик сейчас должен быть немножко биоинформатиком: иметь перед глазами заветную картинку сиквенса мало — без специальных программ вообще нельзя понять, на каком ты свете. Простейший способ узнать, что таки получилось — «пробластить» свой сиквенс (рис. 30), то есть сравнить со всеми известными последовательностями ДНК из GenBank (и потом не забыть представить туда свою — на пользу науке). О программе BLAST и возможностях других «сухих» методов рассказывает статья «12 методов в картинках: “сухая” биология» [75].
Рисунок 30. Один из результатов сравнения полученной нуклеотидной последовательности (query) с известными в онлайн-сервисе BLAST. Так можно получить представление, что за фрагмент вы прочитали и насколько он идентичен (identities, %) другим похожим. Иногда полезнее сравнивать транслированные (переведенные программой в аминокислотные) последовательности.
2. Представление об экспрессии генов, как уже говорилось, можно получить изучением отдельных транскриптов/белков и целых транскриптомов/протеомов.
Транскрипцию генов оценивают, чтобы понять, в какие периоды развития и под действием каких факторов активируются или «замолкают» гены, как меняется их работа при изменениях в регуляторных элементах и любых патологических состояниях. Способов изучения транскриптов очень много, поэтому пробежимся только по основным и в иллюстративном режиме.
- Нозерн-блоттинг (рис. 21). Когда-то этим методом продемонстрировали экспрессию онкогенов в раковых клетках [76]. Его пионерские подвиги успели присыпаться прахом десятилетий, но молодые и высокотехнологичные методы окончательно вытеснить его не смогли. «Нозерн» уступает RT-qPCR по чувствительности, зато может выигрывать по специфичности. А главное, есть разовые задачи, которые удобно решать именно «нозерном». Например, если нужно узнать, сколько бактериальных генов регулируется одним промотором, то есть какие из генов транскрибируются единой цепочкой мРНК и где примерно искать промоторы. Для этого нужно знать сиквенс изучаемого кластера генов и синтезировать зонды к каждому из них (рис. 21). По гибридизационной картине можно установить размеры искомых транскриптов и сравнить их с последовательностью ДНК. При определенных условиях можно оценить и примерное количество РНК-мишени. Но если представить возню с блоттингом в научной лаборатории еще как-то можно, то в медицинских центрах — точно нет. Самый ходовой инструмент там — циклер для qPCR.
- РНК-гибридизация in situ (RNA ISH) служит для локализации и измерения количества различных РНК прямо в биологических образцах — срезах тканей, клетках, опухолях и мелких организмах [77]. В зависимости от типа детекции гибридов различают хромогенный (CISH) и флуоресцентный (FISH) варианты метода. Постановка RNA ISH на примере системы RNAscope® представлена в видео 4.
- Тест защиты от нуклеазы S1 или РНКаз (S1-nuclease/RNase protection assay) основан на способности некоторых нуклеаз расщеплять исключительно одноцепочечные НК, в том числе несовершенства гибридов (рис. 31). Тип зонда (РНК или ДНК) зависит от выбранной нуклеазы, а его размер должен быть точно известен. По размерам зонда, защищенного от нуклеаз гибридизацией с РНК-мишенью, можно судить и о количестве мишени в образце, и о структуре этой мишени — точном положении концов транскрипта и стыков экзон/интрон, а также о мутациях [78]. Можно анализировать сразу несколько транскриптов, причем даже генов-близнецов с точечными различиями. Но условия реакции должны быть самыми суровыми. Гибридизация проводится не на подложке, а в растворе, что здорово повышает чувствительность метода. Он еще более специфичен, чем «нозерн», при меньшей чувствительности к частичной деградации РНК. А электрофорез в густом полиакриламидном геле позволяет добиться разрешения в один нуклеотид. Именно этим методом обнаружили точечные мутации гена опухолевого супрессора p53 в образце карциномы легкого [76].
Картировать транскрипты можно и другими способами:продлением праймера(primer extension, рис. 31)и ПЦР-техникой RACE с ее новейшими модификациями типа RACE-Seq. - Количественная ПЦР с обратной транскрипцией (RT-qPCR) эксплуатирует флуоресцентные репортеры для отслеживания кинетики амплификации кДНК на протяжении всей ПЦР. Это нужно для расчета исходного количества конкретной мРНК в образце, а значит, и для оценки силы экспрессии гена. Занимательные детали и вариации метода можно найти в статье [44]. Основные преимущества этого подхода — высочайшие чувствительность и «количественность», быстрота, наработка большого количества продукта при одновременной его детекции: никакого электрофореза — только монитор. Помимо чисто научных и биотехнологических приложений, метод хорош для детекции биомаркеров, говорящих о развитии какого-то состояния/заболевания или активности патогена.
- Секвенирование РНК (RNA-seq) в настоящее время чаще представляет собой секвенирование кДНК. Оно удовлетворяет любопытство ученых по полной программе: дает информацию не только о представленности в образце разных мРНК, но и о всевозможных малых РНК [41], альтернативных сплайс-вариантах, границах экзонов, концах транскриптов, посттранскрипционном редактировании, мутациях типа сшивания генов (характерных для рака). Сиквенсы транскриптомов, полученных в разных условиях или из разных тканей, дают сравнительную информацию. Это качественный и количественный стандарт, с помощью которого можно контролировать результаты других подходов. Ничего другого и желать бы не надо, если бы не ограниченная доступность метода и не необходимость перевода мРНК в кДНК, которая без ошибок не обходится. Техники прямого секвенирования мРНК пока не могут предоставить сравнимый пул информации, хотя и стремятся к этому [79], [80].
Относительно недавно появились тончайшие разновидностиRNA-seq: секвенирование транскриптома отдельной клетки [81] и флуоресцентное секвенирование in situ (FISSEQ). Последний метод позволяет оценивать экспрессию генов одной клетки, ткани, эмбриона и т.п. в фиксированном биообразце, сочетая возможности RNA ISH и RNA-seq. По мРНК с помощью случайных гексамерных праймеров строят кДНК, размножают ее репликацией по типу катящегося кольца с помощью замечательной во всех отношениях Phi29-ДНК-полимеразы и химически сшивают получившийся «рулон» с белковым матриксом. «Рулоны» затем секвенируют с помощью флуоресцентных меток четырех цветов (каждому типу нуклеотида — своя метка), считывая результат конфокальным микроскопом [82], [83]. Как это выглядит, показано в мини-видео 5, а как работают подобные и все остальные микроскопы — в статье «12 методов в картинках: микроскопия» [84]. На FISSEQ возлагают особенно большие надежды в плане изучения дифференцировки клеток и работы мозга. Какие еще техники пригодны для исследования нервной системы, рассказывает статья «12 методов в картинках: нейробиология» [85].
Видео 4. Технология РНК-гибридизации in situ RNAscope®
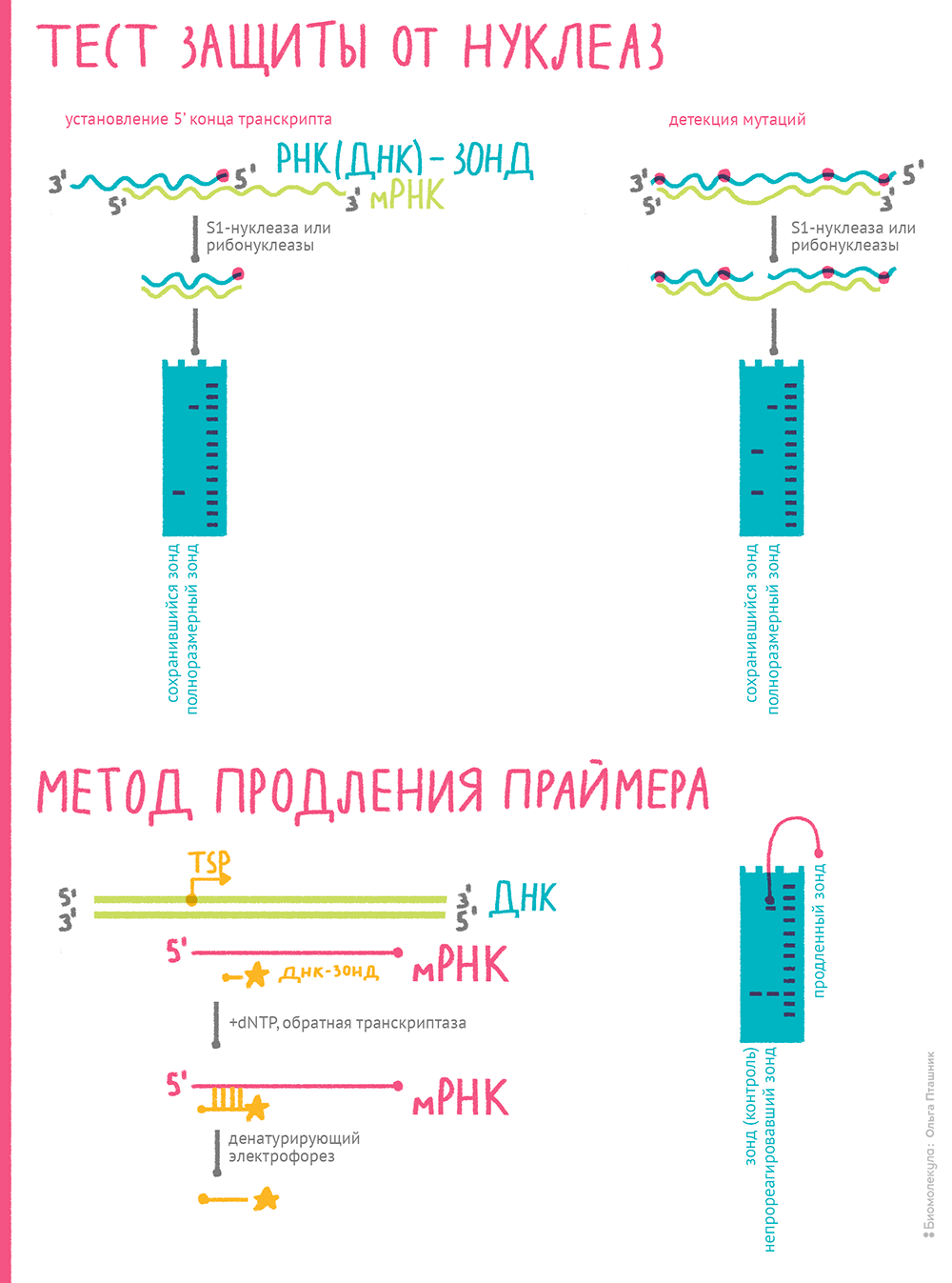
Рисунок 31. Методы картирования РНК. а — Тест защиты от нуклеаз. Зонды метят на конце или на всём протяжении (несколько сотен нуклеотидов). Слева — Установление 5′-конца транскрипта. Зонд подбирают по геномной ДНК так, чтобы охватить 5′-нетранскрибируемую область и первый экзон. Если метка концевая, то должна быть на 5′-конце зонда. Если картируют 3′-конец транскрипта, то метка должна быть на 3′-конце зонда. После гибридизации зонда с РНК добавляют нуклеазы, которые съедают все одноцепочечные (выступающие) части гибрида. РНКазы едят только РНК, S1-нуклеаза — всё. После денатурирующего электрофореза и детекции метки вычитают размер защищенного от нуклеаз («выжившего») зонда из его изначального размера. Результат — точное расстояние в нуклеотидах от 3′-конца зонда до точки старта транскрипции (TSP). Справа — Детекция мутаций. В местах неспаривания зонда и мишени нуклеаза расщепляет одноцепочечные выпетливания. Здесь уместнее РНК-зонд и РНКазы, потому что S1-нуклеаза не распознает точечные неспаривания. Протяженное мечение «проявляет» защищенные фрагменты зонда. Сравнивая размеры фрагментов с сиквенсом генома картируют мутации. По сходному принципу картируют стыки экзонов с интронами. б — Метод продления праймера (ДНК-зонда), комплементарного внутренней части картируемого транскрипта. При установлении 5′-конца ревертаза достраивает зонд прямо до него. После электрофореза и детекции вычисляют разницу в длинах исходного и достроенного зондов. TSP картируют, отсчитав полученное число нуклеотидов от исходного 3′-конца зонда в сторону промотора. Похожим способом (RACE) картируют концы транскриптов с помощью ПЦР, только там нужно позаботиться о встречном праймере.
рисунок Ольги Пташник
Видео 5. FISSEQ — флуоресцентное секвенирование in situ
Очень часто приходится сравнивать экспрессию если не всех, то очень многих генов в разных образцах. Например, в нормальных и патологически измененных тканях. Постоянно секвенировать целые транскриптомы как-то ни с руки, и чаще прибегают к альтернативным подходам — например, SAGE и гибридизации на чипах.
- Представление о чипах мы уже получили (рис. 21). В случае оценки дифференциальной экспрессии генов чиповые олигонуклеотиды гибридизуют с кДНК сразу из двух сравниваемых образцов. Например, нормальных и опухолевых клеток, эмбриона и взрослого, образцов до и после лечения. Каждый из пулов молекул предварительно метится своей флуоресцентной молекулой (рис. 32). По интенсивности свечения гибридов с разными метками судят о различиях в экспрессии, однако возможны артефакты, да и «количественность» метода не идеальна. Тем не менее чипы помогли преодолеть зацикленность исследований на единичных генах, позволив оценивать изменения целых генетических сетей. А это открыло новые горизонты для изучения клеточных цикла и дифференцировки, классификации новообразований, ответа на терапию и т.п.
- Серийный анализ экспрессии генов (SAGE). Это то же секвенирование, но только фрагментарное: каждый экспрессирующийся ген в матрицах для «чтения» представлен короткимиметками (рис. 32). Каждая кДНК-матрица, клонированная в обычный вектор, представляет собой серию из нескольких десятков таких меток — чтобы их можно было прочитать в один заход. Полученные сиквенсы сравнивают с известными последовательностями в базах данных, чтобы понять, какой ген они представляют, и подсчитывают количество одинаковых меток, чтобы оценить уровень экспрессии соответствующих генов. У метода SAGE есть модификации, позволяющие увеличить размер секвенируемых меток. По похожему принципу секвенируют и регуляторные молекулы — микроРНК.
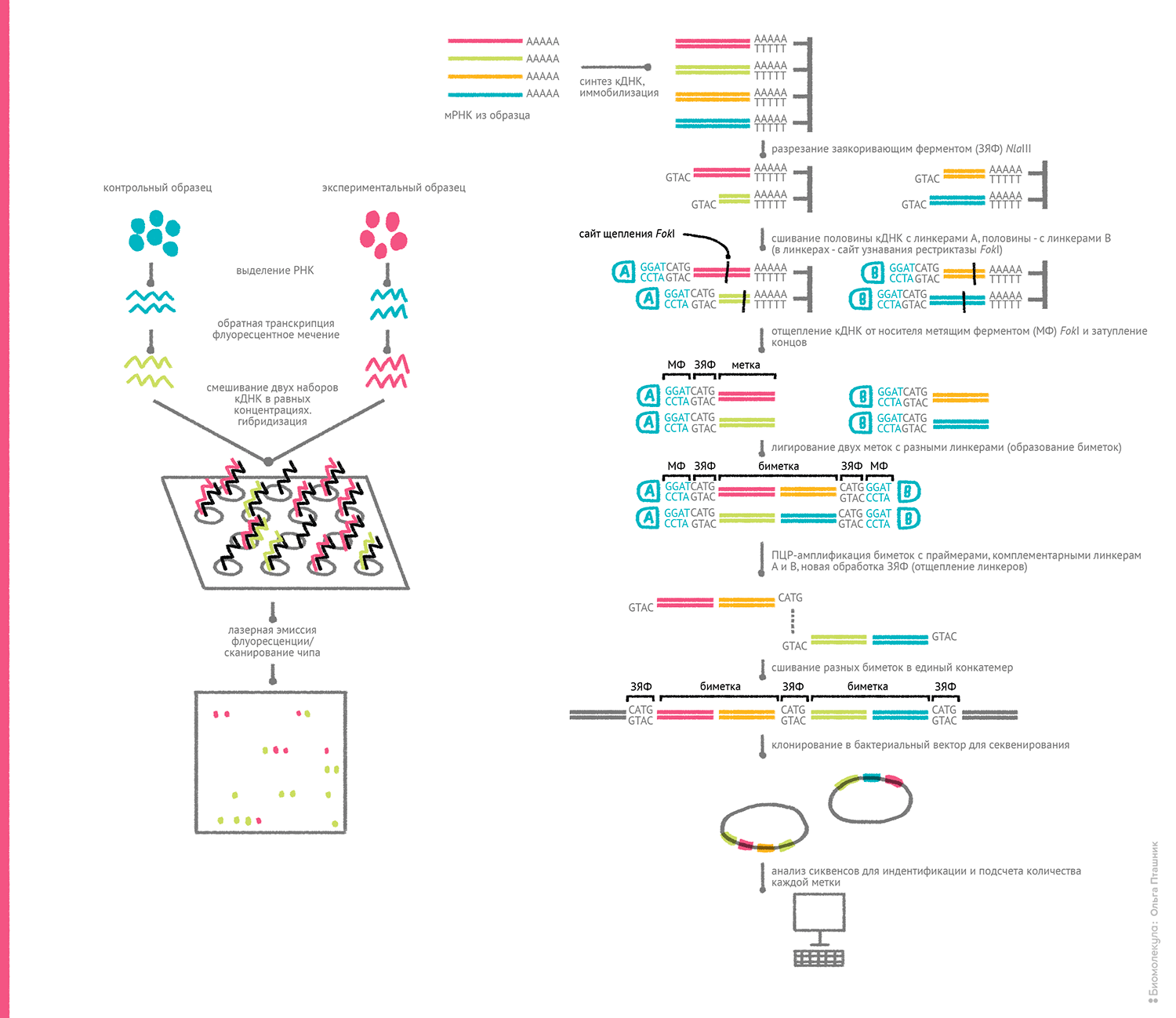
Рисунок 32. Методы анализа транскриптомов: гибридизация на экспрессионном микрочипе (слева) и серийный анализ экспрессии генов, SAGE (справа). В методе SAGE по мРНК образца синтезируют массив кДНК, закрепляя молекулы 3′-концами на магнитных шариках (обычно с помощью пары биотин—стрептавидин). Главные инструменты SAGE — рестриктазы. Заякоривающая — мелкощепящая, узнающая 4 п.н. Обычно это NlaIII. При анализе сиквенса всей серии меток (каждая по 10–11 п.н.) сайты ее связывания служат «знаками препинания» между биметками. Метящая — щепящая на определенном расстоянии от узнаваемого ею сайта (например, через 9–10 н. по одной цепи и 13–14 — по другой) и не интересующаяся тем, какие нуклеотиды в этом промежутке. Чаще всего используют FokI и BsmFI
рисунок Ольги Пташник
Один из родственных методов, массовый анализ концов кДНК (MACE), предполагает секвенирование 50–100 нуклеотидов, расположенных вблизи 3′-поли(А)-хвостов кДНК [86]. Эти участки особенно полиморфны и предоставляют прекрасные возможности для генотипирования: у изменений, «переписанных» из ДНК в РНК, больше шансов проявиться в фенотипе. С диагностикой 3′-концевых однонуклеотидных полиморфизмов (SNP, снипов) [87–89] MACE справляется даже лучше, чем более дорогое RNA-seq, которое для достижения той же глубины секвенирования требует бóльшего числа прочтений. То есть MACE как бы концентрируется на важном, не растекаясь по всему транскрипту. Более того, в этой методике специальный софт позволяет отличать реальные снипы от технических ошибок полимераз. За способность одновременно анализировать экспрессию и снипы MACE окрестили методом трансСНИПтомики [90]. Сейчас с помощью этого метода собирают базы генетических маркеров всевозможных организмов и состояний — от гороха [91] до сердечно-сосудистых болезней человека [86].
Чем выигрышнее любое SAGE-подобное профилирование транскриптомов по сравнению с чиповым, так это чувствительностью и максимальным охватом молекул мРНК без какого-либо знания о них. Для гибридизации на микрочипах нужно заранее знать хотя бы частичные последовательности мишеней, то есть искать что-то конкретное, сужая тем самым охват транскриптов.
3. Работу регуляторных элементов исследуют по-разному. Например, промоторы — с помощью упомянутых ранее promoter-probe-векторов. В них тестируемый или еще потенциальный промотор подставляют к гену репортерного белка (например, CAT или GFP), по легко читаемой активности которого судят о силе промотора. Много информации можно получить с помощью активаторов/репрессоров транскрипции, пришитых к безнуклеазным Cas9, ZF и TALE [92]. И, конечно, никуда без мутагенеза и оценки статуса метилирования [93].
Для изучения микроРНК подходят некоторые из методов транскриптомики и эпигеномики (например, «гашение» активности хроматина в местах синтеза микроРНК). Для анализа других регуляторных элементов и факторов — техники, нацеленные на фиксацию взаимодействий «ДНК—белок». Классические подходы сравнивали, например, подвижность в электрофоретическом геле одних и тех же фрагментов ДНК, но только связанных/свободных или защищенных/не защищенных от нуклеаз белками. Сейчас в рутинную практику вошли куда более совершенные методы. Иммунологические подходы ChIP-сhip и ChIP-seq предельно понятно описаны в статье [46]. А вот типичная технология рекомбинантных ДНК пригодилась для «разногибридных» анализов: одногибридного — для изучения контактов «ДНК—белок», дву- и трехгибридного — для оценки межбелковых и более сложных взаимодействий. Но белки мы здесь анализировать не будем, потому что это уже сделали авторы статей [46], [50], [53].
Единственное, что хотелось бы выделить особо, так это фаговый дисплей. В его основе часто лежит конструирование экспрессионных фагмид [27], а белки, соответственно, выставляются на нитчатых фагах. Однако фаги — не единственная пригодная для дисплея система. Есть еще и дрожжи, а недавно предложили создавать высококлассные «иммунные библиотеки» в кишечной палочке [94]. Иммунобиотехнология — одно из важнейших применений дисплея [46]. Но это универсальная и давно любимая биоинженерами платформа для изучения разных белок-белковых и ДНК-белковых взаимодействий: она решает задачи детекции веществ в среде, скрининга лигандов, дизайна и доставки лекарств.
Итак, методология, применяемая сейчас генными инженерами и молекулярными биологами, в тех или иных вариациях проникает в кабинеты диагностов, а главное — снабжает медиков небывалым массивом информации. Очевидно, что без знаний о генетических полиморфизмах и экспрессии генов в тех или иных условиях медицина не сможет стать действительно персонализированной [95]. Например, эти знания должны лежать в основе подбора индивидуальной терапии злокачественных опухолей, а изменения экспрессии маркерных генов могли бы вовремя сообщать о малигнизации, степени эффективности лечения и развитии рецидивов. И так — почти с каждой болезнью.
О мышах, людях и боксе: анализ функций генов в развитии организмов и заболеваний
Прочитав человеческий геном, биологи столкнулись с проблемой его аннотирования: да, мы видим много букв, но только начинаем понимать, что означает каждое слово, особенно в патофизиологическом контексте. Как мы знаем, на помощь в установлении функций генов и их роли в развитии патологий призвали и микроорганизмов, и беспозвоночных, и особенно генетически на нас очень похожих мышей. Похожих, но не во всём. Например, некоторые вопросы, связанные со старением и онкогенезом было бы куда правильнее решать с помощью других моделей [96]. Но пока есть мыши. Много мутантных мышей.
Существует два основных способа установить функцию гена: посмотреть, что будет, если отключить его совсем или просто изменить его активность — например, заставить бешено трудиться, «переэкспрессироваться». Для этого гены отправляют в нокаут (knock out) и нокдаун (knock down) или устраивают им нокин (knock in) [97], [98].
1. Нокаут и нокин. Нокаут — отключение гена. Этого добиваются, нарушая его целостность удалением экзонов, смещением рамки считывания, разобщением с промотором. Для решения ряда задач планируют условные нокауты — срабатывающие только в определенных клетках и в определенный момент времени. Нокин — изменение функции гена путем замещения или инсерции каких-то фрагментов либо целого гена. Нокин иногда становится «антиподом» нокаута — ведет к повышению экспрессии гена. Так бывает, например, когда к нему подставляют более активный промотор. В других случаях нормальный аллель заменяют мутантным, сшивают ген с репортером или даже вставляют в геном целую кассету. К нокину относят и гуманизацию — замену мышиного гена человеческим вариантом. По технике осуществления нокаут и нокин не различаются.
В конце 1980-х научились худо-бедно вносить целенаправленные мутации в мышиные эмбриональные стволовые клетки, а те — в бластоцисты, то есть модифицировать мышей со всем их потомством в нужном локусе [97], [99]. Для этого применяли векторы, уже неоднократно упомянутые, — с селективными маркерами и участками гомологии для интеграции в нужный сайт. Но часто преследуемой цели — моделирования заболевания или отслеживания роли гена в развитии организма — так и не добивались: либо эмбрионы дохли, либо вся мышь (а не избранная ткань) вырастала уродливой, либо экспрессия маркерного гена мешала работе соседних. Дело в том, что нокаут сразу двух аллелей гена в таких юных эмбрионах может оказаться летальным, и тогда узнать его функции на последующих стадиях онтогенеза не получится. Отключение гена во всём организме тоже не всегда желательно, но бластоциста большого выбора не дает. Вырезания селективного маркера, конечно, можно добиться вторичной рекомбинацией, но хоть мыши и умеют это делать в своих стволовых клетках лучше людей, они всё же не дрожжи [100].
Спасти положение смогли только SSR. Именно они позволили отключать/включать гены на любых этапах онтогенеза и только в нужных тканях, отслеживать «родословную» разных клеточных линий, изучать болезни с хромосомными транслокациями в патогенезе и легко вырезать всё лишнее между lox/FRT-фланками. Эту технологию сразу же облюбовали иммунологи и особенно нейробиологи: она позволяет наблюдать за взаимоотношениями клеток в сложных сетях. Например, видеть, куда тянется аксон конкретного нейрона. Как именно это происходит, рассказано и показано в статье [85]. Национальный институт здоровья (США) даже собрал специально для нейробиологов внушительную коллекцию мышей (NIH Blueprint Cre Driver mice) с условным включением синтеза рекомбиназы Cre. Похожих мышей использовали для уточнения механизма развития синдрома Ретта [101] и в эпопее по вычислению источника возобновления пула β-клеток поджелудочной железы — выбирали между стволовыми и уже зрелыми клетками (видео 3).
Еще больше возможностей дало сочетание этих рекомбиназ с инженерными нуклеазами. Сейчас есть мыши, которые под контролем Cre-lox-включателя экспрессируют ген Cas9. Введи только вектор, кодирующий Cre-рекомбиназу и нужный РНК-гид, — и получи отредактированного зверька. А еще есть те, что Cas9 (но не РНК-гид) синтезируют постоянно. Подобные «полуфабрикаты» позволяют редактировать гены быстро и мультилокусно. Более того, сейчас с помощью мышей не сложно получать модели конкретных пациентских мутаций. Крупнейшую базу нокаутных мышей и линий эмбриональных стволовых клеток создал Международный консорциум нокаутных мышей (IKMC). Ученые теперь могут воспользоваться коллекцией из более чем 20 000 нокаутированных генов. А если захотят постараться сами — вооружиться инженерными нуклеазами и поколдовать над стволовыми клетками и бластоцистами, — то смогут утереть нос создателям мышиных эмбрионов с крысиными глазами, сердцами и т.п. [102]. Но не повинуясь извращенному чувству юмора, а исключительно ради светлого будущего трансплантологии... Приступить к изучению функции выбранного гена на мышиной модели должна помочь статья [55].
Благодаря развитию технологий таргетинга генов стало массовым создание не только мышиных моделей, но и изогенных моделей человеческих болезней (ИМЧБ). Такие системы представляют собой линии нормальных клеток, геном которых нужным образом модифицируют. В результате можно легко сравнить мутантный и исходный фенотипы. Эти модели называют «пациент в пробирке», потому что они воспроизводят in vitro конкретные мутации конкретных генов при конкретном заболевании у конкретного пациента (группы пациентов). ИМЧБ позволят отчетливее связать генотип с фенотипом [103], а затем перейти к индивидуальному подбору терапии и, возможно, преодолеть стагнацию в разработке новых лекарств против тяжелых хронических заболеваний типа рака. Фармкомпании несколько охладели к этому занятию: они осознали тщетность собственных усилий в рамках традиционных технологий, потеряв огромные деньги на разработке и испытаниях провальных продуктов. Однако новый, дискретный подход обещает оптимизировать затраты, потому что каждый препарат можно ориентировать только на группу пациентов с определенным генотипом и, соответственно, ожидаемой реакцией на лечение. Компания Horizon Discovery, например, построила редактирующие платформы на основе rAAV, CRISPR-Cas9 и ZFN и с их помощью создает изогенные нокаут/нокин-линии. Они уже не раз помогали разобраться, пациенты с какими мутациями ответят на противоопухолевые препараты, а какие — нет.
2. Нокдаун (сайленсинг) гена — подавление его экспрессии на уровне транскрипции или трансляции. В первом случае чаще используют «мертвый» Cas9 или другие сиквенс-специфические безнуклеазные белки: они могут и сами мешать собираться транскрипционному аппарату, а могут работать в сшивке с репрессорами. Во втором случае обычно полагаются на блокирование связывания трансляционного аппарата с мРНК или на разрушение этой мРНК (либо микроРНК). То есть, в отличие от нокаута, нокдаун не предполагает внесения изменений в ДНК. А потому экспрессия гена практически никогда не подавляется на 100%. Эта особенность даже породила одно из основных правил генотерапии: если с болезнью помогает справляться нокдаун какого-то гена, нужно обязательно искать пути его нокаута. С другой стороны, с помощью нокдауна можно изучать функции генов, нокаут которых был бы летальным. Вторая проблема посттранскрипционного нокдауна — высокий процент off-target-событий.
Для подавления функции гена на посттранскрипцонном уровне чаще всего используют два механизма:
- антисмысловой (antisens) — комплементарное связывание РНК-мишени синтетическим антисмысловым олигонуклеотидом. Исходы такого контакта зависят от типа антисенс-молекулы (рис. 33). Последняя представляет собой не обычную последовательность нуклеотидов, а полностью или частично модифицированную химически — для защиты от нуклеаз и повышения сродства к мишени [104], [105]. Один из представителей таких олигонуклеотидов — морфолино. Морфолиновые олигонуклеотиды широко используют, например, для изучения эмбриогенеза животных;
- РНК-интерференцию (РНКи) — подавление функции гена с помощью нуклеазы Argonaut и ее РНК-гида, который комплементарно взаимодействует с участком мишени (рис. 34). Обычно речь идет о блокировании трансляции с РНК-мишени либо ее разрушении аргонавтом (видео 6). В этом случае нуклеаза и РНК-гид работают в составе комплекса RISC. Однако сайленсинг возможен и за счет локальной компактизации хроматина в области гена-мишени. Для этого аргонавт с РНК-гидом внедряются в другой молекулярный комплекс, RITS, и направляют к ДНК-мишени ферменты модификации хроматина [42]. РНК-гидом служит микроРНК, если речь идет о естественной РНКи у животных, или короткая интерферирующая РНК (киРНК, siRNA), если гид синтезировали и ввели извне. (Вообще, микроРНК-аналоги растений тоже называют киРНК, а отличаются они исключительно биогенезом.) С помощью РНКи изучают функции генов многих организмов, включая растительные [106]. Как подступиться к РНКи в клетках млекопитающих, рассказано в кратком руководстве для начинающих [107].
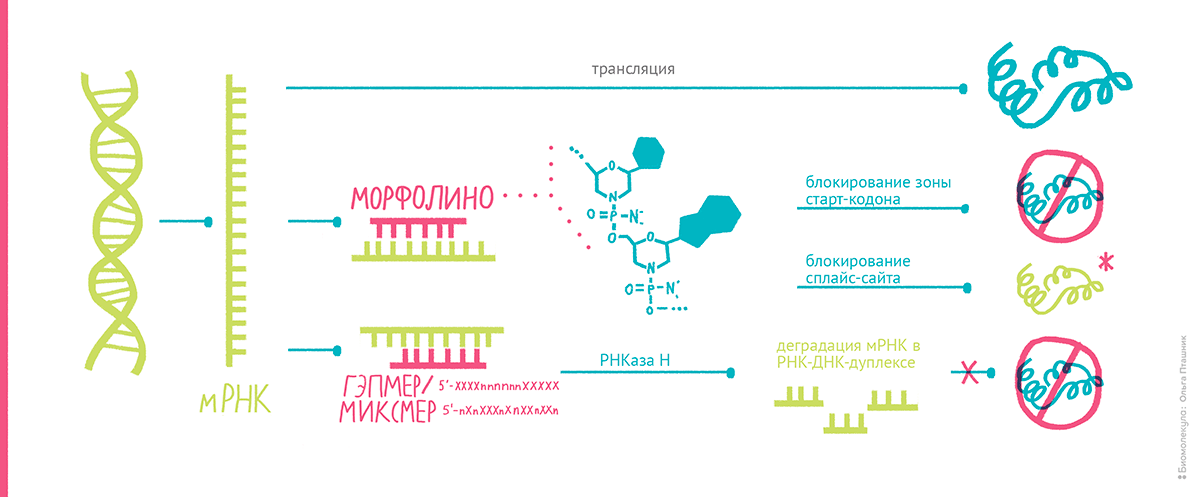
Рисунок 33. Нокдаун гена с помощью антисмысловых олигонуклеотидов. Синтетические антисенс-олигонуклеотиды состоят из 15–25 звеньев. «Гэпмеры» и «миксмеры» — химерные ДНК-цепочки из обычных (n) dNTP и химически модифицированных (Х) нуклеотидов. Благодаря ДНК-природе олигонуклеотида активируется деградация РНК-мишени РНКазой Н. В случае морфолино и прочих «запредельно синтетических» молекул этот путь не работает.
рисунок Ольги Пташник
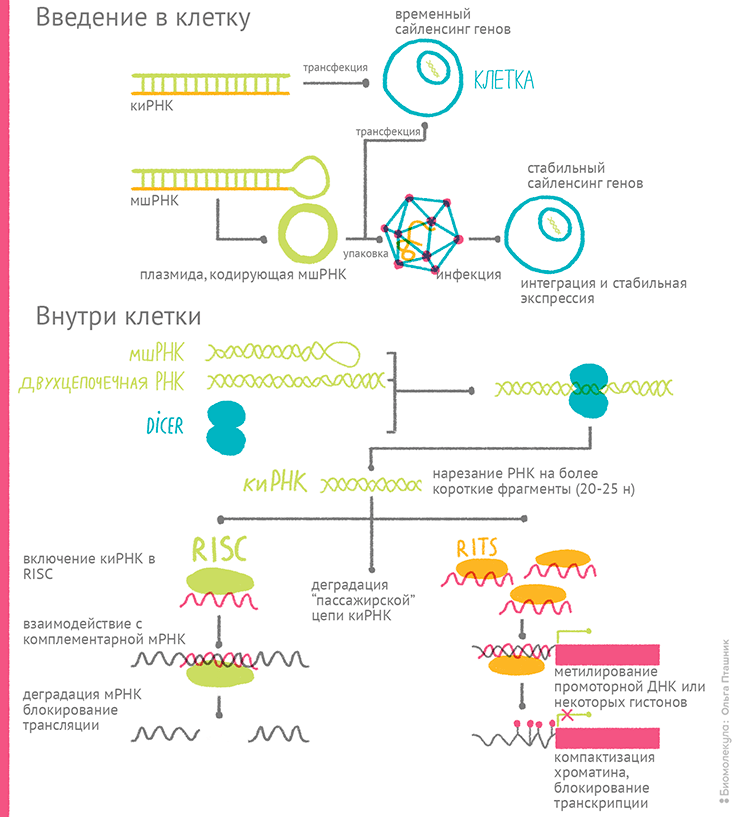
Рисунок 34. Нокдаун гена с помощью РНК-интерференции. В клетку РНК-гид (короткую интерферирующую РНК, киРНК) можно вводить как в готовом виде, так и в виде предшественника, мшРНК (малой шпилечной РНК), или же кодирующих их генов. Экспрессия их может быть постоянной, а может включаться, например, рекомбиназой Cre и навечно выключаться ее коллегой, Flp. Именно так построена GRIM, экспрессионная платформа «для чайников». Чтобы уж не обижать третью SSR, для вставки генов разных киРНК в GRIM предусмотрели лямбда-фаговые att-сайты. В общем случае киРНК может образовываться разрезанием рибоэндонуклеазой Dicer как одноцепочечной шпилечной РНК (синтезируемой с вектора, содержащего нужные инвертированные повторы), так и простой двухцепочечной РНК. Далее киРНК может включиться в два разных молекулярных комплекса, RISC или RITS, и направлять их к подавляемой цели. Каталитической единицей в двух комплексах служит эндонуклеаза Argonaut. Левый путь, блокирующий трансляцию РНК-мишени, изучен гораздо лучше правого, подавляющего транскрипцию с помощью рекрутирования модификаторов хроматина.
рисунок Ольги Пташник
Видео 6. РНК-имнтерференция
Эти механизмы различаются тем, что киРНК изначально двухцепочечные и работают в в комплексе с белками, а антисенс-олигонуклеотиды одноцепочечные и действуют единолично. РНКи — естественный способ регуляции экспрессии генов и защиты эукариот от патогенов, и его считают более эффективным инструментом нокдауна. Помимо исследований, РНКи используют для создания интересных растительных форм: например, картофеля, убивающего колорадского жука [108] или гипоаллергенных помидоров [109].
Существуют и более экзотические (пока) способы сайленсинга генов:
- расщепление специфических РНК их же «сородичами» — знаменитыми каталитически активными РНК, природными или инженерными рибозимами,которые при соответствующей структуре могут прибегать и к саморазрезанию;
- воздействие на рибопереключатели (riboswitch) — 5′-некодирующие концевые фрагменты мРНК, которые реагируют на взаимодействие со своими лигандами (разными малыми молекулами) резким изменением конформации, чем препятствуют либо трансляции, либо сплайсингу, либо даже продолжению транскрипции собственного гена;
- контроль экспрессии с помощью аптазимов — синтетических гибридов рибозимов с рибопереключателями, которые саморазрезаются при связывании с лигандом. Если кодирующую их ДНК (всего около 100 п.н.) встроить в интересующий ген (например, вирусный), то транскрипт образовавшейся химеры «по команде» должен будет самоуничтожиться [110].
Все эти РНК очень интересны фундаментальной науке и потенциально пригодны для конструирования биосенсоров и терапевтических манипуляций [111], [112]. Судя по всему, РНК-убийцы способны работать точнее РНК-наводчиков.
Коррекция работы генов в терапевтических целях
Разумеется, исправлять работу генов можно у любых организмов, но, руководствуясь эгоистическими побуждениями, затронем здесь только человека и только общие принципы, проиллюстрировав их несколькими примерами: как-никак более 2000 раз, начиная с 1989 года, генно-терапевтические препараты добирались до клинических испытаний, а уж сколько их еще лечит культуры клеток и грызунов, никто не считал.
На первый взгляд кажется странным, что из тысяч разработок на рынок вышли единицы [164]. Но генная терапия до сих пор рассматривается как технология экспериментальная и потому требующая особого контроля и бдительности. Первые неудачи, связанные с развитием серьезных, иногда смертельных, иммунных реакций и новообразований, многому научили и разработчиков, и регуляторов. Сейчас гораздо тщательнее подходят к вопросу безопасности, и самые сомнительные препараты редко доходят до тестов на человеке. Кроме того, изменились векторы и способы их конструирования, появилась возможность редактировать геном прямо в клетках. В общем, у новых препаратов при правильном дизайне терапии гораздо больше шансов добраться до потребителя.
Итак, как же можно исправлять структуру и/или экспрессию генов в клетках человека?
1. Делать это можно как в самом человеке (in vivo), так и вне его тела (ex vivo), с последующим введением модифицированных клеток в организм (рис. 35). В первом случае эффективность всей затеи сильно зависит от успешности доставки терапевтической конструкции (ТК) в нужные клетки. Несложно доставлять ТК с током крови в печень и инъекциями — в стекловидное тело глаза, клетки кожи, мышц и опухолей.
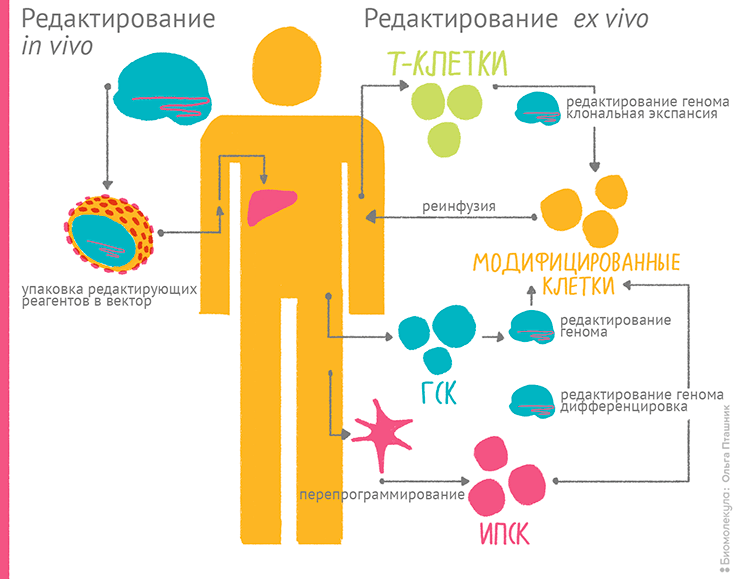
Рисунок 35. Альтернативные подходы к редактированию человеческого генома и генетической терапии в целом. ГСК — гемопоэтические стволовые клетки; ИПСК — индуцированные плюрипотентные стволовые клетки.
рисунок Ольги Пташник
Во втором случае ограничен выбор подходящих клеток, и есть определенные сложности/риски манипуляций с ними, потому что бóльшая их часть принадлежит к стволовой братии [113–116]. T-клетки больше подходят для иммунотерапии: борьбы с инфекциями, аутоиммунными реакциями, злокачественными заболеваниями крови. Модифицируют ex vivo как «свои», так и «чужие» клетки. «Свои» не провоцируют иммунный конфликт, но трудно реализовать полный терапевтический цикл, особенно если у пациента нужные клетки убиты химиотерапией или живет он на Камчатке, а клетки редактируют в Британии. Поэтому удобнее было бы использовать «обезличенные» генно-инженерным путем донорские клетки [117], [118]. Так случилось, что оба одобренных FDA генно-терапевтических подхода [164] предполагают именно ex vivo модификацию. Они предназначены для лечения B-клеточных лейкозов/лимфом натравливанием измененных Т-лимфоцитов пациента на его же вышедшие из-под контроля B-клетки (CAR-технология, [2]). Этот подход уже успел спасти человеческие жизни [119–121].
2. Вносить изменения в структуру генома сейчас можно классическим способом и геномным редактированием.
- «Классика» — это когда вектор с ТК какое-то время поддерживается в клетке, экпрессируя эту ТК, или обеспечивает ее встраивание в геном по механизму, характерному для векторного вируса/транспозона, или же гомологичной рекомбинацией. Такой подход при правильном выборе болезни и вектора может давать обнадеживающие результаты. Например, компания uniQure довела до завершения II фазы клинических испытаний rAAV-конструкцию, экспрессирующую ген фактора IX свертывания крови, то есть предназначенную для лечения гемофилии В [122], [123]. В видео 7 показано, как в идеале должна работать такая система. Но всегда есть риск «провалиться» уже на финише или даже в конкретной стране. Таких примеров масса, а один из самых нашумевших — противораковый Advexin, аденовирусный вектор со «здоровым» геном опухолевого супрессора p53 [124]. Одобрения выведения на рынок он не получил ни в США, ни в Европе [125], [126], зато в Китае его аналог Gendicine еще в 2003 году разрешили применять в дополнение к стандартной терапии плоскоклеточных карцином.
- Геномное редактирование — это когда роль ТК выполняют программируемые нуклеазы или нуклеазы вкупе с донорной ДНК, предназначенной для встраивания в геном в точке разреза. Примеры терапевтического использования репараций NHEJ и HDR in vivo и ex vivo можно найти в обзоре [127]. Нуклеазы вносят в клетки в виде встроенного в вектор гена, мРНК или готового белка. Два последних способа сами по себе ограничивают время работы фермента, а значит, и нецелевое кромсание ДНК. Если говорить об интеграции ТК в геном, то редактирование — более прецизионный подход, чем «классика». О процентах непопаданий, омрачающих применение нуклеаз, при классическом подходе можно было только мечтать. С помощью ZFN, TALEN и CRISPR-Cas9 уже пробовали редактировать геном человека и ex vivo, и in vivo [128]. Однако активность гомологичной рекомбинации остается «на совести» клетки, и влиять на нее можно в очень ограниченных пределах.
Видео 7. Как работает AAV-доставка генов
3. Для доставки ТК к месту работы нужно выбрать одну из множества векторных систем (табл. 3). Для терапии in vivo больше подходят вирусные векторы, для ex vivo — разные, потому что можно использовать электропорацию. Особенности векторов для млекопитающих и требования к ним мы приводили в главе 1. Подробнее плюсы и минусы этих векторов как носителей ТК описаны в обзоре [129]. Добавим только, что несколько лет назад для этих же целей начали тестировать бакуловирусы. В отличие от клеток своих природных хозяев, насекомых, они не повреждают клетки человеческие. Правда, в последних не работает главный бакуловирусный промотор polh, и вообще не всё пока ясно в общении этих разнородных биосистем. Зато показано, что инъекции бакуловирусных векторов в неделящиеся клетки (например, мозга или мышц) — вполне эффективный способ доставки трансгенов в организм позвоночных [9].
| Векторная система | Число испытаний | % |
|---|---|---|
| Аденовирусы | 505 | 21 |
| AAV | 173 | 7,2 |
| Ретровирусы | 449 | 18,6 |
| «Голая»/плазмидная ДНК | 414 | 17,2 |
| Лентивирусы | 144 | 6 |
| Вирус осповакцины | 125 | 5,2 |
| Вирус простого герпеса | 89 | 3,7 |
| Поксвирусы | 70 | 2,9 |
| Другие | 440 | 18 |
| Всего (к марту 2017) | 2409 |
Если же говорить об укрощении неконтролируемо делящихся клеток, то есть о борьбе с опухолями, то сам вектор может быть эффективной ТК (рис. 36). К такому векторному спецназу, избирательно уничтожающему изнутри только раковые клетки, относятся онколитические рекомбинантные адено- и герпесвирусы [129], [130]. Первым одобренным FDA вирусным онколитическим препаратом стал Imlygic, созданный на основе рекомбинантного герпесвируса и предназначенный для введения в клетки меланомы.
Рисунок 36. Принцип избирательного уничтожения раковых клеток рекомбинантным онколитическим вирусом
рисунок Ольги Пташник
Еще одно завоевание последних лет — терапевтические транспозонные системы типа Спящей красавицы (Sleeping Beauty, SB), обеспечивающие высокую эффективность интеграции и стабильную экспрессию ТК. Пока они лучше проявили себя в модификации изолированных стволовых клеток и в CAR-инженерии Т-клеток. К этой системе еще много вопросов [131], но она постоянно совершенствуется и в отношении некоторых патологий уже добралась до клинических исследований [132]. В частности, европейский консорциум TargetAMD в 2017 году объявил о старте Ia/IIб фаз испытаний SB-конструкции, экспрессирующей ген фактора пигментного эпителия (PEDF), для лечения неоваскулярной макулярной дегенерации (влажной макулодистрофии). Это часто встречающееся после 50 лет заболевание связано с нарушением баланса про- и антиангиогенных стимулов. Гиперпродукция VEGF вызывает рост неполноценных сосудов под сетчаткой, которые нарушают ее нормальную архитектуру и вызывают дегенерацию клеток пигментного эпителия (КПЭ), а это ведет к необратимой потере центрального зрения. PEDF, секретируемый КПЭ, противодействует ангиогенезу, но после инъекции долго в глазу не живет. Простое замещение нерабочих КПЭ здоровыми эффекта не дает: видимо, они не обеспечивают нужный для компенсации развитой патологии уровень PEDF. Поэтому TargetAMD решил попробовать отобрать у пациента живые КПЭ, трансфицировать их SB-вектором, который организует гиперэкспрессию фактора, и вернуть в сетчатку [132].
4. Интегрировать ТК можно непосредственно в поврежденный (мутантный) сайт или в неспецифическую безопасную платформу (genomic safe harbor) — удаленное от онкогенов и генов опухолевых супрессоров место, где трансген точно ничего не нарушит, а возможно, и попадет под контроль сильного промотора. О подборе безопасных посадочных площадок для трансгенов в хромосомах человека рассказывает статья [133].
5. Изменять экспрессию генов без вмешательства в структуру ДНК можно с помощью транскрипционных и хроматиновых регуляторов и малых РНК (антисмысловых/интерферирующий). Компания Sangamo Terapeutics, например, пытается контролировать синтез человеческих белков, участвующих в развитии нейродегенеративных заболеваний, с помощью химерных ZF-транскрипционных факторов (ZFP-TF). Дальше всего, на доклинический этап, продвинулись пока только в отношении болезни Хантингтона.
ТК на основе малых РНК уже многократно тестировали на животных и человеке. Сотни молекул — в основном одноцепочечные антисенсы — потерпели фиаско из-за проблем с эффективностью или безопасностью, две из трех вышедших на рынок балансируют на грани, и только нусинерсен, первый препарат для лечения спинальных мышечных атрофий, пока благосклонно принимается регуляторами разных стран. Правда, широту его применения ограничивает совершенно неадекватная цена. Неплохие перпективы прорисовываются и для некоторых киРНК от амилоидоза. Но анализ клинических испытаний малых РНК уже провел автор работы [105], поэтому не будем повторяться.
Интересные платформы для терапевтической РНК-интерференции разрабатывает компания RXi Pharmaceuticals. Один из ее основателей, Крейг Мелло, пополнил ряды нобелиатов как раз за открытие этого процесса [164]. В декабре 2017 г. компания аннонсировала успешное завершение II фазы клинических исследований эффективности молекулы RXI-109 в подавлении кожного рубцевания. RXI-109 — антифибротическая молекула из класса «самодоставляемых интерферирующих РНК» (sd-rxRNA), гибрид антисенс-олигонуклеотида и киРНК с разными химическими «присадками» в структуре. Идея совместить два типа малых РНК в одной структуре возникла не случайно: одноцепочечные антисенсы легче проникают в клетку, а вот киРНК эффективнее подавляют мишень. RXI-109 должна интерферировать с мРНК CTGF — фактора роста соединительной ткани, участвующего в заживлении ран. Гиперэкспрессия его гена отмечена при фиброзах разных тканей, включая кожу и сетчатку, поэтому его сайленсинг может снизить интенсивность рубцевания после хирургических вмешательств и при неоваскулярной макулярной дегенерации. В отношении последней тестируют инъекции RXI-109 в стекловидное тело.
Другие коллективы направляют усилия на борьбу с неугодными микроРНК, участвующими в патогенезе сердечно-сосудистых, онкологических и даже инфекционных заболеваний [134]. Но здесь всё еще сложнее. Вроде бы синтезировать подходящий «антимир» (anti-miR) несложно, но даже точное попадание в цель может повлечь плохо предсказуемые последствия, потому что одна микроРНК может регулировать сразу несколько сигнальных каскадов. И без достаточного багажа знаний о сетях человеческой РНКи новая технология непременно даст старый результат — «одно лечим, другое калечим» [135]. Более того, организм — настолько тонкая система, что на эффективность сайленсинга может влиять множество факторов. Пример «кардиологического» anti-miR-208a, испываемого на животных моделях, показал, что терапевтический исход заметно зависит, например, от силы и вида испытываемого организмом стресса (заболевания) [136].
Интересными мишенями терапии считают рибопереключатели, а инструментами — рибозимы. Идеальными мишенями рибозимов могли бы стать, например, транкрипты онкогенов в раковых клетках и РНК-вирусы. Конечно, чтобы продлить жизнь рибозимов в организме, их, как и прочие РНК, химически модифицируют [137], [138].
6. Контролировать трансмиссивные болезни можно генотерапией... членистоногих. С помощью генной инженерии можно запретить им передавать инфекционных агентов людям. Один из потенциально пригодных для этого подходов — gene drive («продвижение гена»), основанный на грубом нарушении законов наследования мутагенной цепной реакцией (МЦР) [139]. Ее принцип таков: в эмбрион животного вводят вектор с кассетой, кодирующей CRISPR-Cas9 и РНК-гид, и «плечами гомологии» — чтобы заставить саму кассету встроиться в нужное место хромосомы. То есть, в отличие от обычного редактирования, при МЦР в геноме остается не терапевтический ген, а сам хирургический инструмент. Он продолжает оперировать и оккупирует в том же месте гомологичную хромосому (второй аллель), а передаваясь последующим поколениям, продолжает экспансию. Простое отключение гена можно заменять инсерцией трансгена. Так самораспространяться могут, например, детерминанты устойчивости к возбудителю болезни или гены популяционного контроля. МЦР теоретически пригодна для борьбы с массовыми «комариными» инфекциями типа малярии, лихорадки Денге и лихорадки Зика [140]. Другой, менее радикальный подход, основан на РНК-интерференции. Эффекторные РНК против возбудителя лихорадки Рифтовой долины, закодированные в бакуловирусных векторах, успешно опробовали в клетках насекомых кенийские биологи [141].
7. Предупреждать развитие тяжелых генетических и мультифакторных болезней и их распространение в популяциях можно исправлением ошибок в ДНК клеток зародышевой линии. Вернее, пока почти везде нельзя. А где можно, то ненадолго — модифицированному эмбриону больше 1–2 недель развиваться не дадут [142], [164]. Как утверждают авторы одной из первых работ, проведенных с человеческими эмбрионами, такой инструмент, как CRISPR-Cas9, при своевременной доставке может вполне сносно ликвидировать гетерозиготные мутации, потому что в клетках зародышевой линии HDR-путь залечивания разреза преобладает над NHEJ [143].
8. Производить генно-терапевтические средства можно только в специально сертифицированных заведениях, где исключено поедание бутербродов над эппендорфами. Некоторое представление о фабрике генно-терапевтических препаратов дает, например, рекламное видео одного из лидеров отрасли, uniQure.
Получение промышленно важных организмов
Это уже чистейшей воды биотехнология. Конечной целью здесь могут быть сами организмы с заданными свойствами или же биопрепараты, полученные с их помощью. Модифицировать можно привнесением чужеродных генов, коррекцией собственных либо сочетанием этих подходов. Практически все организмы или их изолированные клетки могут служить экспрессионными системами для наработки рекомбинантных белков и других ценных веществ, и такое производство обычно выгоднее химического синтеза. Фармацевтические биопрепараты чаще получают в клетках млекопитающих (рис. 37). Лидеры продаж среди рекомбинантных препаратов приведены в статье о клеточных технологиях [2]. В этом списке преобладают моноклональные антитела, за ними следуют гормоны и факторы роста.
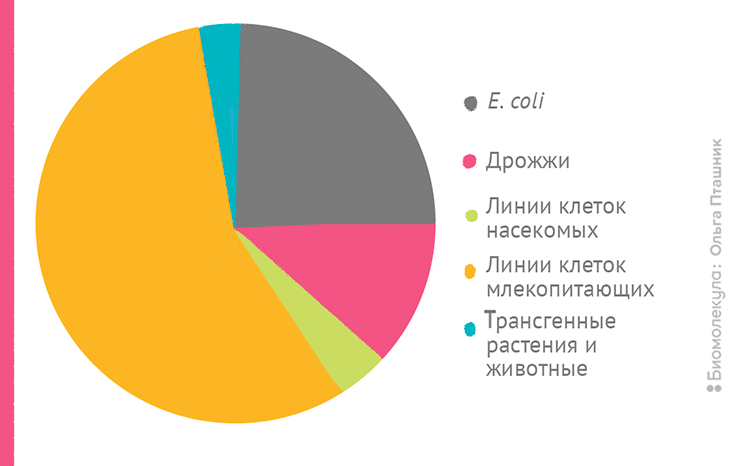
Рисунок 37. Процент фармпрепаратов, производимых в разных биосистемах.
рисунок Ольги Пташник
Особенности биосистем, с которыми работают биотехнологи, мы уже рассмотрели в разделе «”Рабочие лошадки” генной инженерии». Поэтому просто приведем примеры их использования.
- E. coli открыла эру генно-инженерной промышленности, но поскольку возможности бактерий ограничены, в ней производят не особо сложные белки и низкомолекулярные вещества: ферменты, гормоны, интерфероны, аминокислоты, терпеноиды, неприродные спирты, препараты «Луцентис», «Кинерет» и некоторые другие [144]. Отлично подходит она для наработки эндонуклеаз рестрикции и полимераз: чем создавать условия для выращивания разнообразных «-филов», гораздо легче клонировать и экспрессировать ген их уникального фермента в понятной и неприхотливой E. coli. Но среди бактерий есть продуценты и получше, правда, их специализация обычно у́же [145]. Например, эффективным производителем аминокислот считают Corynebacterium glutamicum, а антибиотиков — Streptomyces spp. Грамположительные организмы перспективны для синтеза и других фармбелков, поскольку умеют выводить их в среду [146]. Зато грамотрицательные Pseudomonas spp. с модифицированными метаболическими путями могут деградировать нефтепродукты и другие загрязнители [147–150]. E. coli тоже еще может удивить: метаболические инженеры сумели биоинформатически просчитать ее синтетический потенциал и уже строят планы, как его реализовывать [151]. А некоторые проблемы с синтезом чужеродных белков уже научились решать оптимизацией кодонов или вообще «в индивидуальном порядке» — подстраивать штамм под конкретный белок [144].
- Дрожжи в производстве некоторых веществ конкурируют с кишечной палочкой. Но инсулина, например, мало не бывает, и потребность в нём, к сожалению, постоянно растет. Инсулин и аналоги составляют основную нагрузку на дрожжевую биофабрику. Также на ней синтезируют человеческий сывороточный альбумин, гирудин, трансферрин и некоторые вакцины [152].
- В клетках насекомых чаще всего производят компоненты диагностических реактивов, человеческих и ветеринарных вакцин [153]. В системе «клетки насекомых — бакуловирусы», в частности, получают вакцину «Церварикс» против высокоонкогенных папилломавирусов человека. Возможно, система сможет вплотную приблизиться к стандартам формирования белков, заданным млекопитающими, если удастся подавить в ней всего одну биохимическую реакцию [154]. Тщательно проработаны и давно выведены на рынок бакуловирусные «зеленые инсектициды» — вирусные биопрепараты для борьбы с садово-огородными вредителями. Вирусы в них могут быть природными или инженерными. Первые более устойчивы к факторам среды, потому что не лишены гена полиэдрина, но крайне избирательны и работают медленнее, чем их рекомбинантные собратья, снабженные генами более смертоносных биотоксинов. По сравнению с химическими пестицидами бакуловирусные более чувствительны к природным влияниям, но более селективны и безопасны для человека и среды [9].
- Генная инженерия растений преследует цели повышения их устойчивости к вредителям, болезням и неблагоприятным факторам среды, а также улучшения их потребительских свойств — пищевой ценности, вкуса, сохранности плодов. Модифицированных растений и продуктов из них полным полно на мировом рынке, их выращивают в десятках стран мира. Больше всего культур с приобретенной устойчивостью к гербицидам, болезням и вредителям: картофель, соя, кукуруза, томаты, канола, тыква, папайя, табак... Самые интересные разработки уже упоминались в части I этой статьи (врезка «Генная инженерия и рынок: найти ключ к монетизации научных достижений») [164] и множестве других статей на «Биомолекуле». Вопросы регуляции производства ГМ-растений и способы ее обойти затронуты в работе [155]. Исчерпывающая информация о способах модификации культур, разнообразии вышедших на рынок и перспективных продуктов, а также о регуляции этой сферы в США, собрана в относительно свежей книге [156].
Растения можно использовать и как фабрики по производству антител, вакцин и лекарств. Пожалуй, основательнее всего эта тема освещена в обзоре «Растения-биофабрики» [9]. Пионером отрасли стала морковь, вернее, культура ее клеток. Вырабатываемую в ней рекомбинантную глюкоцереброзидазу израильская компания Protalix превратила в препарат Elelyso для компенсации наследственного дефицита этого фермента при болезни Гоше. С 2012 года препарат начали допускать к применению в разных странах. Несколько похожих молекул Protalix проходят II или III фазу клинических исследований. Среди их целей — болезнь Фабри, муковисцидоз и аутоиммунные патологии, в том числе кишечные. - Генная инженерия животных решает задачи совершенствования биолого-медицинских исследований, повышения устойчивости сельскохозяйственных животных к болезням (например, прионным инфекциям и маститам), улучшения их продуктивных и репродуктивных качеств, синтеза биопрепаратов и даже защиты окружающей среды [157]. С крупными животными так вольно, как с растениями или микробами, не обращаются. Сюда вмешивается множество административных, технических и этических факторов [158], особенно если животное готовят к донорству [102]. Этические препятствия могут быть разными: одни волнуются, что свиней и других интеллектуальных животных придется выращивать на убой, другие брезгуют, третьи боятся стать немножко свиньей.
В научных лабораториях за человека отдуваются в основном мелкие животные, обезличенные названием «модель» [159]. Червей, дрозофил, грызунов модифицируют, как угодно, но они не покидают лабораторию. Если говорить о сельскохозяйственных животных, то пока самый безопасный и принимаемый регуляторами генно-инженерный подход — использование трансгенных молочных желез в качестве биофабрик по производству лекарств. ATryn — первый препарат, полученный с помощью генетически-модифицированного животного и доступный в Европе с 2006 года, а в США — с 2009. Производят его rEVO Biologics и коза. Без видимого ущерба для здоровья в ней экспрессируется человеческий ген антитромбина, потому в ее молоке появляется антикоагулянт, необходимый для предупреждения тромбоэмболий у людей с наследственным дефицитом антитромбина. Из молока кроликов сейчас выделяют рекомбинантный С1-ингибитор протеаз (Ruconest, Pharming) для борьбы с приступами наследственного ангионевротического отека — состояния, обусловленного дефицитом этого белка и грозящего смертью от удушья [160].
Заключение
Полвека назад появились первые рекомбинантные ДНК, разделившие биологическую методологию на «до» и «после», а общественное мнение на «за» и «против». Без генной инженерии, сформировавшейся вокруг технологий рекомбинантных ДНК, не было бы ни современной биологии, ни современной медицины. Ее появление было абсолютно закономерным, потому что человек хотел и хочет познавать мир, делать его лучше и жить здоровым, пока не надоест. Просто в тот момент объем знаний и технологий достиг критического значения. С тех пор в отрасли случались большие и маленькие революции, и чем эффективнее становились технологии, тем активнее заметная часть общества им сопротивлялась. Но это не удивительно: ученые сами решили обсуждать их с населением, в большинстве своем одновременно узнавшим о рождении генной инженерии и существовании генов — всё со слов СМИ разного уровня компетентности.
До этого вряд ли кто-то страдал от первобытного страха перед изменением ДНК, хотя мутагенез давно был в ходу: модифицированная еда в горле не застревала, сеансы рентгенотерапии, косметика с радием и солнечные ванны настроения не портили. Случайный мутагенез — случайные последствия. Парадоксально, но испуг вызвало как раз изобретение инструментов, способных свести случайность к минимуму. Истерия по поводу самых избирательных и эффективных из них — инженерных нуклеаз — особенно показательна. И здесь, наверное, во многом виноваты СМИ и система образования, не способная дать представление о принципах, на которых основана жизнь. Знать формулы цветков — это прекрасно, но если человек понятия не имеет, как работает его организм и что гены он глотает с пищей постоянно, он беззащитен перед манипуляторами. Давно известно, что разные типы клеток живых организмов, несмотря на одинаковые ДНК-инструкции, работают по-разному, и виной тому разные эпигенетические настройки. Но оказалось, что и сами инструкции в процессе жизни меняются, причем как в стволовых, так и в зрелых, постмитотических клетках, благодаря чему наши геномы мозаичны. Это происходит даже без участия внешних или внутренних мутагенов. Мутации возникают постоянно в ходе репликации и транскрипции, то есть при делении клетки и активном «считывании инструкций» [161], [162]. Например, подсчитано, что при каждом делении клетка, помимо прочих поломок, должна ремонтировать 20–40 двухцепочечных разрывов [127], а индивидуальные нейроны коры человеческого мозга могут различаться примерно 1 500 нуклеотидами [162].
Везде обсуждается неидеальная специфичность инженерных нуклеаз, но далеко не все в курсе, что бывает сложно установить, а нуклеаза ли это напортачила, секвенирование или сама жизнь? Однако кто бы это ни сделал, вероятность неблагоприятных последствий всё-таки мала. Это очевидно, потому что при такой-то мутационной нагрузке мы иногда умудряемся справлять вековой юбилей. Конечно, если говорить о генотерапии, любой дополнительный риск не нужен, поэтому сейчас главное — продолжать настраивать инструменты, совершенствовать контроль их работы и разбираться в сложных схемах молекулярных взаимодействий. Но даже благодаря не самым новым техникам геномной модификации мы имеем множество модельных систем, продуцентов биопрепаратов, устойчивых растений и несколько генно-терапевтических средств. Иными словами, мы сильно продвинулись в фундаментальных исследованиях, уже едим ГМ-продукты, лечимся рекомбинантными белками и потихоньку вползаем в эпоху медицины, способной сражаться не с симптомами, а причинами болезней.
Автор заранее приносит извинения за возможные неточности и упрощения и понимает, что методов генной инженерии гораздо больше, а их модификаций и подавно. Но основной целью этой и, наверное, других статей спецпроекта «12 биологических методов в картинках» было показать невероятную изобретательность разума человеческого, хитроумие и красоту решений совершенно разных задач.
Календарь
На основе статей спецпроекта мы решили сделать календарь «12 методов биологии» на 2019 год. Эта статья представляет октябрь.

Литература
- Получены стволовые клетки клонированной обезьяны;
- 12 методов в картинках: клеточные технологии;
- Цисгеномика: новое слово в селекции растений;
- Трое в лодке: о легализации замены митохондрий;
- Как составлялся геном эукариот: эндосимбиоз VS. непрерывный горизонтальный перенос;
- От сложного к простому: трудности симбиогенеза;
- Мода на ретро. Где встречается обратная транскрипция, и как она эволюционировала;
- Эпигенетика: невидимый командир генома;
- Jean-Christophe Drugmand, Yves-Jacques Schneider, Spiros N. Agathos. (2012). Insect cells as factories for biomanufacturing. Biotechnology Advances. 30, 1140-1157;
- Бессмертные клетки Генриетты Лакс;
- Растения-биофабрики;
- Еще раз про ГМО;
- Свинолюди, крысомыши и другие биотехнологические истории;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Manel Camps. (2010). Modulation of ColE1-Like Plasmid Replication for Recombinant Gene Expression. DNAG. 4, 58-73;
- Monika Knoppová, Mongkol Phensaijai, Martin Veselý, Martina Zemanová, Jan Nešvera, Miroslav Pátek. (2007). Plasmid Vectors for Testing In Vivo Promoter Activities in Corynebacterium glutamicum and Rhodococcus erythropolis. Curr Microbiol. 55, 234-239;
- Michelle E. Kimple, Allison L. Brill, Renee L. Pasker. (2013) Overview of Affinity Tags for Protein Purification;
- Jens Kroll, Stefan Klinter, Cornelia Schneider, Isabella Voß, Alexander Steinbüchel. (2010). Plasmid addiction systems: perspectives and applications in biotechnology. Microbial Biotechnology. 3, 634-657;
- Germán L. Rosano, Eduardo A. Ceccarelli. (2014). Recombinant protein expression in Escherichia coli: advances and challenges. Front. Microbiol.. 5;
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Susanna Zucca, Lorenzo Pasotti, Nicolò Politi, Maria Cusella De Angelis, Paolo Magni. (2013). A standard vector for the chromosomal integration and characterization of BioBrick™ parts in Escherichia coli. J Biol Eng. 7, 12;
- Глик Б. и Пастернак Дж. Молекулярная биотехнология. М.: «Мир», 2002. — 589 с.;
- Пожиратели бактерий: убийцы в роли спасителей;
- Sherwood R. Casjens, Roger W. Hendrix. (2015). Bacteriophage lambda: Early pioneer and still relevant. Virology. 479-480, 310-330;
- L W Chiang, I Kovari, M M Howe. (1993). Mutagenic oligonucleotide-directed PCR amplification (Mod-PCR): an efficient method for generating random base substitution mutations in a DNA sequence element.. Genome Research. 2, 210-217;
- Noel J. Sauer, Javier Narváez-Vásquez, Jerry Mozoruk, Ryan B. Miller, Zachary J. Warburg, et. al.. (2016). Oligonucleotide-Mediated Genome Editing Provides Precision and Function to Engineered Nucleases and Antibiotics in Plants. Plant Physiol.. 170, 1917-1928;
- Huan Qi, Haiqin Lu, Hua-Ji Qiu, Valery Petrenko, Aihua Liu. (2012). Phagemid Vectors for Phage Display: Properties, Characteristics and Construction. Journal of Molecular Biology. 417, 129-143;
- Michael Yarmolinsky, Ronald Hoess. (2015). The Legacy of Nat Sternberg: The Genesis of Cre-loxTechnology. Annu. Rev. Virol.. 2, 25-40;
- Ida Lauritsen, Andreas Porse, Morten O. A. Sommer, Morten H. H. Nørholm. (2017). A versatile one-step CRISPR-Cas9 based approach to plasmid-curing. Microb Cell Fact. 16;
- Vondrejs V. a Storchová Z. Genové inženýrsrví. Praha: Nakladatelství University Karlovy, 1997–2003;
- Robert Gnügge, Fabian Rudolf. (2017). Saccharomyces cerevisiae Shuttle vectors. Yeast. 34, 205-221;
- David M. Brown, Yujia A. Chan, Prashant J. Desai, Peter Grzesik, Lauren M. Oldfield, et. al.. (2016). Efficient size-independent chromosome delivery from yeast to cultured cell lines. Nucleic Acids Res. gkw1252;
- Natalay Kouprina, Vladimir Larionov. (2016). Transformation-associated recombination (TAR) cloning for genomics studies and synthetic biology. Chromosoma. 125, 621-632;
- D. G. Gibson, G. A. Benders, K. C. Axelrod, J. Zaveri, M. A. Algire, et. al.. (2008). One-step assembly in yeast of 25 overlapping DNA fragments to form a complete synthetic Mycoplasma genitalium genome. Proceedings of the National Academy of Sciences. 105, 20404-20409;
- Yuji Tanaka, Tetsuya Kimura, Kazumi Hikino, Shino Goto, Mikio Nishimura, et. al.. (2012). Gateway Vectors for Plant Genetic Engineering: Overview of Plant Vectors, Application for Bimolecular Fluorescence Complementation (BiFC) and Multigene Construction. Genetic Engineering - Basics, New Applications and Responsibilities;
- Готовим ГМ-рис вместе;
- Молекулярное клонирование, или как засунуть в клетку чужеродный генетический материал;
- Сводка с генотерапевтических фронтов. Новая стратегия нейтрализации гемофилии;
- Супотницкий М.В. (2011). Генотерапевтические векторные системы на основе вирусов. Биопрепараты. 3, 15–26;
- Natalay Kouprina, William C. Earnshaw, Hiroshi Masumoto, Vladimir Larionov. (2013). A new generation of human artificial chromosomes for functional genomics and gene therapy. Cell. Mol. Life Sci.. 70, 1135-1148;
- Обо всех РНК на свете, больших и малых;
- Эпигенетика псориаза: молекулярные отметины судьбы;
- Behnam Enghiad, Huimin Zhao. (2017). Programmable DNA-Guided Artificial Restriction Enzymes. ACS Synth. Biol.. 6, 752-757;
- 12 методов в картинках: полимеразная цепная реакция;
- Edward A. Motea, Anthony J. Berdis. (2010). Terminal deoxynucleotidyl transferase: The story of a misguided DNA polymerase. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1804, 1151-1166;
- 12 методов в картинках: иммунологические технологии;
- 454-секвенирование (высокопроизводительное пиросеквенирование ДНК);
- R. H. Wilson, S. K. Morton, H. Deiderick, M. L. Gerth, H. A. Paul, et. al.. (2013). Engineered DNA ligases with improved activities in vitro. Protein Engineering Design and Selection. 26, 471-478;
- Важнейшие методы молекулярной биологии и генной инженерии;
- 12 методов в картинках: очистка молекул и разделение смесей;
- Ruml T., Rumlová M., Pačes V. Genové inženýrsrví. Praha: Nakladatelství VŠCHT, 2002–2007. — 270 p.;
- Benoît Lacroix, Vitaly Citovsky. (2016). Transfer of DNA from Bacteria to Eukaryotes. mBio. 7, e00863-16;
- 12 методов в картинках: протеомика;
- Carter P. (1986). Site-directed mutagenesis. Biochem. J. 237 (1): 1–7;
- Jian Zhang, Jing Zhao, Wen-jie Jiang, Xi-wei Shan, Xiao-mei Yang, Jian-gang Gao. (2012). Conditional gene manipulation: Cre-ating a new biological era. J. Zhejiang Univ. Sci. B. 13, 511-524;
- Rachel B. Reinert, Jeannelle Kantz, Amanda Ackermann Misfeldt, Greg Poffenberger, Maureen Gannon, et. al.. (2012). Tamoxifen-Induced Cre-loxP Recombination Is Prolonged in Pancreatic Islets of Adult Mice. PLoS ONE. 7, e33529;
- Yuan Yu, Yongsheng Wang, Qi Tong, Xu Liu, Feng Su, et. al.. (2013). A Site-Specific Recombinase-Based Method to Produce Antibiotic Selectable Marker Free Transgenic Cattle. PLoS ONE. 8, e62457;
- Marie Frickenhaus, Marina Wagner, Moushami Mallik, Marica Catinozzi, Erik Storkebaum. (2015). Highly efficient cell-type-specific gene inactivation reveals a key function for the Drosophila FUS homolog cabeza in neurons. Sci Rep. 5;
- J. R. Bateman. (2006). Site-Specific Transformation of Drosophila via C31 Integrase-Mediated Cassette Exchange. Genetics. 173, 769-777;
- Soeren Turan, Christoph Zehe, Johannes Kuehle, Junhua Qiao, Juergen Bode. (2013). Recombinase-mediated cassette exchange (RMCE) — A rapidly-expanding toolbox for targeted genomic modifications. Gene. 515, 1-27;
- J. L. Hartley. (2000). DNA Cloning Using In Vitro Site-Specific Recombination. Genome Research. 10, 1788-1795;
- Junwon Lee, Jae-Hee Chung, Ho Min Kim, Dong-Wook Kim, Hyongbum Kim. (2016). Designed nucleases for targeted genome editing. Plant Biotechnol J. 14, 448-462;
- M. D. Hoban, D. E. Bauer. (2016). A genome editing primer for the hematologist. Blood. 127, 2525-2535;
- Просто о сложном: CRISPR/Cas;
- CRISPR-эпопея и ее герои;
- Evguenia Kouranova, Kevin Forbes, Guojun Zhao, Joe Warren, Angela Bartels, et. al.. (2016). CRISPRs for Optimal Targeting: Delivery of CRISPR Components as DNA, RNA, and Protein into Cultured Cells and Single-Cell Embryos. Human Gene Therapy. 27, 464-475;
- Moon-Soo Kim, Anu Ganesh Kini. (2017). Engineering and Application of Zinc Finger Proteins and TALEs for Biomedical Research. Molecules and Cells. 40, 533-541;
- Tomasz P Jurkowski, Mirunalini Ravichandran, Peter Stepper. (2015). Synthetic epigenetics—towards intelligent control of epigenetic states and cell identity. Clin Epigenetics. 7, 18;
- D. G. Gibson, J. I. Glass, C. Lartigue, V. N. Noskov, R.-Y. Chuang, et. al.. (2010). Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome. Science. 329, 52-56;
- Синтетическая хромосома;
- Yorke Zhang, Brian M. Lamb, Aaron W. Feldman, Anne Xiaozhou Zhou, Thomas Lavergne, et. al.. (2017). A semisynthetic organism engineered for the stable expansion of the genetic alphabet. Proc Natl Acad Sci USA. 114, 1317-1322;
- Секвенирование единичных клеток (версия — Metazoa);
- Guo-Ling Nan, Virginia Walbot. (2009). Plasmid Rescue: Recovery of Flanking Genomic Sequences from Transgenic Transposon Insertion Sites. Methods in Molecular Biology. 101-109;
- Friedrich J. Behringer, June I. Medford. (1992). A plasmid rescue technique for the recovery of plant DNA disrupted by T-DNA insertion. Plant Mol Biol Rep. 10, 190-198;
- 12 методов в картинках: «сухая» биология;
- mRNA transcript analysis. Сайт www.gene-quantification.de;
- Martyna Urbanek, Anna Nawrocka, Wlodzimierz Krzyzosiak. (2015). Small RNA Detection by in Situ Hybridization Methods. IJMS. 16, 13259-13286;
- Marianna Goldrick, Donald Kessler. (2003) RNA Analysis by Nuclease Protection;
- Fatih Ozsolak, Patrice M. Milos. (2011). Single-molecule direct RNA sequencing without cDNA synthesis. WIREs RNA. 2, 565-570;
- Andrew M Smith, Miten Jain, Logan Mulroney, Daniel R Garalde, Mark Akeson Reading canonical and modified nucleotides in 16S ribosomal RNA using nanopore direct RNA sequencing — Cold Spring Harbor Laboratory;
- Разработан метод анализа экспрессии генов на уровне индивидуальных клеток;
- J. H. Lee, E. R. Daugharthy, J. Scheiman, R. Kalhor, J. L. Yang, et. al.. (2014). Highly Multiplexed Subcellular RNA Sequencing in Situ. Science. 343, 1360-1363;
- Je Hyuk Lee, Evan R Daugharthy, Jonathan Scheiman, Reza Kalhor, Thomas C Ferrante, et. al.. (2015). Fluorescent in situ sequencing (FISSEQ) of RNA for gene expression profiling in intact cells and tissues. Nat Protoc. 10, 442-458;
- 12 методов в картинках: микроскопия;
- 12 методов в картинках: нейробиология;
- Adam M Zawada, Kyrill S Rogacev, Sören Müller, Björn Rotter, Peter Winter, et. al.. (2014). Massive analysis of cDNA Ends (MACE) and miRNA expression profiling identifies proatherogenic pathways in chronic kidney disease. Epigenetics. 9, 161-172;
- Мы все такие разные;
- За генный полиморфизм приходится платить;
- GWAS и психогенетика: консорциумы в поисках ассоциаций;
- Rotter B. (2012). High resolution tranSNiPtomics: gene expression and SNP detection in high throughput and high resolution by "Massive Analysis of cDNA Ends" (MACE). International Plant & Animal Genome XX;
- Aleksandr Zhernakov, Björn Rotter, Peter Winter, Alexey Borisov, Igor Tikhonovich, Vladimir Zhukov. (2017). Massive Analysis of cDNA Ends (MACE) for transcript-based marker design in pea ( Pisum sativum L.). Genomics Data. 11, 75-76;
- Luke A. Gilbert, Max A. Horlbeck, Britt Adamson, Jacqueline E. Villalta, Yuwen Chen, et. al.. (2014). Genome-Scale CRISPR-Mediated Control of Gene Repression and Activation. Cell. 159, 647-661;
- Sergey Kurdyukov, Martyn Bullock. (2016). DNA Methylation Analysis: Choosing the Right Method. Biology. 5, 3;
- Valencio Salema, Luis Ángel Fernández. (2017). Escherichia coli surface display for the selection of nanobodies. Microb. Biotechnol.. 10, 1468-1484;
- От медицины для всех — к медицине для каждого!;
- Преодолевшие старение. Часть II. Дети подземелья;
- John P. Manis. (2007). Knock Out, Knock In, Knock Down — Genetically Manipulated Mice and the Nobel Prize. N Engl J Med. 357, 2426-2429;
- Matt Carter, Jennifer Shieh. (2015). Manipulating Endogenous Genes. Guide to Research Techniques in Neuroscience. 273-293;
- Catherine S. Branda, Susan M. Dymecki. (2004). Talking about a Revolution. Developmental Cell. 6, 7-28;
- Perkel J.M. (2013). Genome editing with CRISPRs, TALENs and ZFNs. Biocompare;
- Элементы: Для предотвращения синдрома Ретта надо постоянно поддерживать экспрессию белка MeCP2;
- Свинолюди, крысомыши и другие биотехнологические истории;
- Peters D.T. (2016). Isogenic human pluripotent stem cell models of cardiovascular disease-associated genetic variation. Doctoral dissertation. Harvard University, Graduate School of Arts & Sciences;
- C. Wahlestedt, P. Salmi, L. Good, J. Kela, T. Johnsson, et. al.. (2000). Potent and nontoxic antisense oligonucleotides containing locked nucleic acids. Proceedings of the National Academy of Sciences. 97, 5633-5638;
- Есть ли смысл в антисенсах?;
- Peter M. Waterhouse, Christopher A. Helliwell. (2003). Exploring plant genomes by RNA-induced gene silencing. Nat Rev Genet. 4, 29-38;
- Storrs C. (2013). Gene silencing is golden. The Scientist;
- Двухцепочечная РНК защищает трансгенные растения только от нежелательных насекомых;
- Lien Quynh Le, Yvonne Lorenz, Stephan Scheurer, Kay Fotisch, Ernesto Enrique, et. al.. (2006). Design of tomato fruits with reduced allergenicity by dsRNAi-mediated inhibition of ns-LTP (Lyc e 3) expression. Plant Biotechnology Journal. 4, 231-242;
- Patrick Ketzer, Johanna K. Kaufmann, Sarah Engelhardt, Sascha Bossow, Christof von Kalle, et. al.. (2014). Artificial riboswitches for gene expression and replication control of DNA and RNA viruses. Proc Natl Acad Sci USA. 111, E554-E562;
- Элементы: Сложные РНК-переключатели — новый механизм регуляции генов;
- Jérôme Mulhbacher, Patrick St-Pierre, Daniel A Lafontaine. (2010). Therapeutic applications of ribozymes and riboswitches. Current Opinion in Pharmacology. 10, 551-556;
- Ствол и ветки: стволовые клетки;
- Кем быть? Как гемопоэтическая стволовая клетка выбирает профессию;
- Предохранитель ИПСК;
- В поисках клеток для ИПСК — шаг за шагом к медицине будущего;
- Laurent Poirot, Brian Philip, Cécile Schiffer-Mannioui, Diane Le Clerre, Isabelle Chion-Sotinel, et. al.. (2015). Multiplex Genome-Edited T-cell Manufacturing Platform for “Off-the-Shelf” Adoptive T-cell Immunotherapies. Cancer Res. 75, 3853-3864;
- Qasim W., Jal Amrolia P., Samarashinghe S., Ghorashian S., Zhan H., Stafford S. et al. (2015). First clinical application of Talen engineered universal CAR19 T cells in B-ALL. Blood. 126, 23;
- Успех в борьбе с лейкозом: на шаг ближе к клиническому применению геномного редактирования;
- Grady D. (2017). F.D.A. panel recommends approval for gene-altering leukemia treatment. The New York Times;
- KYMRIAH (tisagenlecleucel): Summary basis for regulatory action. Сайт U.S. Food and Drug Administration (2017);
- A. C. Nathwani. (2006). Self-complementary adeno-associated virus vectors containing a novel liver-specific human factor IX expression cassette enable highly efficient transduction of murine and nonhuman primate liver. Blood. 107, 2653-2661;
- Amit C. Nathwani, Ulreke M. Reiss, Edward G.D. Tuddenham, Cecilia Rosales, Pratima Chowdary, et. al.. (2014). Long-Term Safety and Efficacy of Factor IX Gene Therapy in Hemophilia B. N Engl J Med. 371, 1994-2004;
- Jackie Nemunaitis, John Nemunaitis. (2011). Head and neck cancer: Response to p53-based therapeutics. Head Neck. 33, 131-134;
- Randy Osborne. (2008). Ark floats gene therapy's boat, for now. Nat Biotechnol. 26, 1057-1059;
- Natsumi Watanabe, Kazuo Yano, Kenichiro Tsuyuki, Teruo Okano, Masayuki Yamato. (2015). Re-examination of regulatory opinions in Europe: possible contribution for the approval of the first gene therapy product Glybera. Molecular Therapy - Methods & Clinical Development. 2, 14066;
- Matthew H. Porteus. (2015). Towards a new era in medicine: therapeutic genome editing. Genome Biol. 16;
- Jang Y.Y., Cai L., Ye Z. (2016). Genome editing systems in novel therapies. Discov. Med. 21 (113), 57–64;
- Cody S. Lee, Elliot S. Bishop, Ruyi Zhang, Xinyi Yu, Evan M. Farina, et. al.. (2017). Adenovirus-mediated gene delivery: Potential applications for gene and cell-based therapies in the new era of personalized medicine. Genes & Diseases. 4, 43-63;
- Генная терапия против рака;
- E. L. Aronovich, R. S. McIvor, P. B. Hackett. (2011). The Sleeping Beauty transposon system: a non-viral vector for gene therapy. Human Molecular Genetics. 20, R14-R20;
- Michael Hudecek, Zsuzsanna Izsvák, Sandra Johnen, Matthias Renner, Gabriele Thumann, Zoltán Ivics. (2017). Going non-viral: the Sleeping Beauty transposon system breaks on through to the clinical side. Critical Reviews in Biochemistry and Molecular Biology. 52, 355-380;
- Eirini P Papapetrou, Axel Schambach. (2016). Gene Insertion Into Genomic Safe Harbors for Human Gene Therapy. Molecular Therapy. 24, 678-684;
- Søren Ottosen, Todd B. Parsley, Lu Yang, Karin Zeh, Leen-Jan van Doorn, et. al.. (2015). In VitroAntiviral Activity and Preclinical and Clinical Resistance Profile of Miravirsen, a Novel Anti-Hepatitis C Virus Therapeutic Targeting the Human Factor miR-122. Antimicrob. Agents Chemother.. 59, 599-608;
- Jan Stenvang, Andreas Petri, Morten Lindow, Susanna Obad, Sakari Kauppinen. (2012). Inhibition of microRNA function by antimiR oligonucleotides. Silence. 3, 1;
- Joep E.C. Eding, Charlotte J. Demkes, Joshua M. Lynch, Anita G. Seto, Rusty L. Montgomery, et. al.. (2017). The Efficacy of Cardiac Anti-miR-208a Therapy Is Stress Dependent. Molecular Therapy. 25, 694-704;
- Asad U. Khan. (2006). Ribozyme: A clinical tool. Clinica Chimica Acta. 367, 20-27;
- Jérôme Mulhbacher, Patrick St-Pierre, Daniel A Lafontaine. (2010). Therapeutic applications of ribozymes and riboswitches. Current Opinion in Pharmacology. 10, 551-556;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Вирус Зика — глобальная угроза?;
- Rose Ongus Juliette, Kiplangat Rono Evans, Alexander Wafula Wamunyokoli Fred. (2017). Silencing of the rift valley fever virus s-genome segment transcripts using RNA interference in Sf21 insect cells. Afr. J. Biotechnol.. 16, 1016-1031;
- Человек генно-модифицированный / Homo genere mutatio;
- Hong Ma, Nuria Marti-Gutierrez, Sang-Wook Park, Jun Wu, Yeonmi Lee, et. al.. (2017). Correction of a pathogenic gene mutation in human embryos. Nature. 548, 413-419;
- Mohammed N. Baeshen, Ahmed M. Al-Hejin, Roop S. Bora, Mohamed M. M. Ahmed, Hassan A. I. Ramadan, et. al.. (2015). Production of Biopharmaceuticals in E. coli: Current Scenario and Future Perspectives. Journal of Microbiology and Biotechnology. 25, 953-962;
- Jose-Luis Adrio, Arnold L. Demain. (2010). Recombinant organisms for production of industrial products. Bioengineered Bugs. 1, 116-131;
- Jozef Anné, Kristof Vrancken, Lieve Van Mellaert, Jan Van Impe, Kristel Bernaerts. (2014). Protein secretion biotechnology in Gram-positive bacteria with special emphasis on Streptomyces lividans. Biochimica et Biophysica Acta (BBA) - Molecular Cell Research. 1843, 1750-1761;
- Бактерии-нефтедеструкторы для биоремедиации супесчаных почв Воронежской области;
- Пределы биодоступности углеводородов в грунтах;
- Биодеградация белого фосфора: как яд стал удобрением;
- Биодеградация ксенобиотиков как самозащита природы;
- Xiaolin Zhang, Christopher J. Tervo, Jennifer L. Reed. (2016). Metabolic assessment of E. coli as a Biofactory for commercial products. Metabolic Engineering. 35, 64-74;
- Jens Nielsen. (2013). Production of biopharmaceutical proteins by yeast. Bioengineered. 4, 207-211;
- Manon M.J. Cox. (2012). Recombinant protein vaccines produced in insect cells. Vaccine. 30, 1759-1766;
- Sachi Minagawa, Satoshi Sekiguchi, Yuzuru Nakaso, Masahiro Tomita, Manabu Takahisa, Hideyo Yasuda. (2015). Identification of Core Alpha 1,3-Fucosyltransferase Gene From Silkworm: An Insect Popularly Used to Express Mammalian Proteins. J Insect Sci. 15, 110;
- От ГМО к растениям будущего. Всё самое интересное о сложной работе современного селекционера;
- Committee on Genetically Engineered Crops: Past Experience and Future Prospects, Board on Agriculture and Natural Resources, Division on Earth and Life Studies, National Academies of Sciences, Engineering, and Medicine Genetically Engineered Crops — National Academies Press, 2016;
- Wheeler M. B. (2013). Transgenic animals in agriculture. Nature Education Knowledge. 4 (11), 1;
- Maksimenko O.G., Deykin A.V., Khodarovich Y.M., Georgiev P.G. (2013). Use of transgenic animals in biotechnology: prospects and problems. Acta Naturae. 5 (1), 33–46;
- Грызун особого назначения;
- James W. Baker, Avner Reshef, Dumitru Moldovan, Joseph R. Harper, Anurag Relan, Marc A. Riedl. (2017). Recombinant Human C1-Esterase Inhibitor to Treat Acute Hereditary Angioedema Attacks in Adolescents. The Journal of Allergy and Clinical Immunology: In Practice. 5, 1091-1097;
- Вероятность возникновения рака зависит от количества делений стволовых клеток;
- Родословная нейронов: как носить в себе множество мутаций и выглядеть совершенно здоровым;
- Nabih A Baeshen, Mohammed N Baeshen, Abdullah Sheikh, Roop S Bora, Mohamed Morsi M Ahmed, et. al.. (2014). Cell factories for insulin production. Microb Cell Fact. 13;
- 12 методов в картинках: генная инженерия. Часть I, историческая.