Загадочный кальциевый язык
23 ноября 2021
Загадочный кальциевый язык
- 5665
- 0
- 13
Ассоциативный ряд, связанный с явлением кальциевого сигналинга.
Рисунок в полном размере.
авторский коллаж с использованием рисунка из журнала «Как и почему»
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В нашем организме существует элегантная сигнальная система, основанная на изменении концентраций ионов кальция. Клетки нашего тела каждый день сталкиваются с сотнями различных внешних стимулов: от гормонов, нейромедиаторов и цитокинов до температурных колебаний и механических воздействий. Все эти изменения клетки переводят на язык внутреннего общения, где кодом является концентрация ионов Ca2+ в цитозоле. Кальциевый сигналинг — настолько широко распространенный механизм, что он управляет одновременно и сокращением мышц, и работой нейронов, и дифференциацией клеток во время эмбрионального развития. Основные проблемные вопросы, которые ставятся в этой статье: каким образом для кальциевых сигнальных путей сочетаются свойства исключительной универсальности и специфичности? И как клетки умудряются не запутаться в сложной информационной паутине, сплетенной помощью этого простого неорганического иона?
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Биофизика» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания «БиоЛайн».

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Информационная роль других ионов (не Ca2+)
Описание удивительной «кальциевой» жизни клеток стоит начать, посмотрев на проблему «с высоты птичьего полета». Как вообще ионы неорганических солей могут выполнять какую-либо сигнальную роль в живых организмах? Пожалуй, важнейшей реализацией этой функции служит игра ионов Na+, K+ и Сl− в «кошки-мышки» на цитоплазматических мембранах, что позволяет животным клеткам генерировать и распространять электрические импульсы. Без этого было бы невозможно сокращение мышц, функционирование желез, а также вся сложная работа нервной системы.
Бислойные липидные мембраны, которые отделяют все живые клетки от внешней среды, непроницаемы для заряженных ионов, окруженных вдобавок массивными «шубами» из молекул воды [1]. Это происходит примерно по тем же термодинамическим законам, что не дают капелькам масла раствориться в воде [2]. В силу эволюционных причин [3], содержание различных ионов в цитоплазме клеток и внеклеточной среде сильно разнится (табл. 1), [4].
| Ион | Цитоплазматическая концентрация (мМ) | Внеклеточная концентрация (мМ) |
|---|---|---|
| Катионы | ||
| Na+ | 5–15 | 145 |
| K+ | 140 | 5 |
| Mg2+ | 0,5 | 1–2 |
| Ca2+ | 10-4 | 1–2 |
| H+ | 7*10-5 (pH 7,2) | 4*10-5 (pH 7,4) |
| Анионы | ||
| Cl- | 5–15 | 110 |
| *Клетки содержат одинаковые количества положительных и отрицательных зарядов (другими словами, электрически нейтральны). Так, помимо Cl-, в цитоплазме клеток содержится множество других анионов, не перечисленных в таблице, как-то: HCO3-, PO43-, кислые группировки нуклеиновых кислот и белков. Концентрации Ca2+ и Mg2+ указаны для свободных ионов. Хотя в цитоплазме суммарно содержится около 20 мМ Mg2+ и 1–2 мМ Ca2+, большинство этих ионов находятся в связанном состоянии (с белками, свободными нуклеотидами, РНК и др.). | ||
Известно, что в цитоплазме клеток, по сравнению с внеклеточной средой, на порядок выше концентрация K+ (140 мМ); а Na+ и Cl−, напротив, в цитоплазме мало (5–15 мМ) — на порядок меньше, чем во внеклеточной среде. Этот градиент ионов создается и тонко поддерживается работой Na+/K+-обменника — белкового насоса, который с затратой энергии АТФ (универсальной энергетической валюты клетки) перекачивает внутрь два иона калия и выкачивает три иона натрия. Ассиметричная работа Na+/K+-АТФазы, как легко видеть, приводит суммарно к перекачке одного положительного заряда наружу. Однако с учетом того, что натрий запускается внутрь клетки в ходе различных обменных механизмов, разница электрических потенциалов на мембране невозбудимых клеток составляет всего ничего: в среднем −5..−10 мВ [4]. То есть можно считать, что цитоплазма и внеклеточная среда практически электронейтральны (содержат одинаковое количество положительных и отрицательных зарядов).
Однако если встроить в такую мембрану постоянно открытые каналы, избирательно проницаемые для K+, то эти ионы в силу законов диффузии начнут утекать из клетки, вынося с собой положительные заряды и оставляя неспаренные отрицательные заряды внутри цитоплазмы. Чем больше будет разница этих электрических зарядов, тем сложнее ионам K+ будет «убегать» из клетки. Снаружи они будут отталкиваться положительными зарядами и, наоборот, притягиваться отрицательно заряженной цитоплазмой внутрь. Утечка калия будет происходить до тех пор, пока на мембране не установится такая разница электрических потенциалов, которая сравняется с разницей потенциалов диффузионных. В этот момент суммарный ток K+ через мембрану станет равным 0 (то есть, сколько калия утекает за единицу времени, столько же возвращается обратно). Именно такие процессы происходят на мембране возбудимых клеток (рис. 1б).
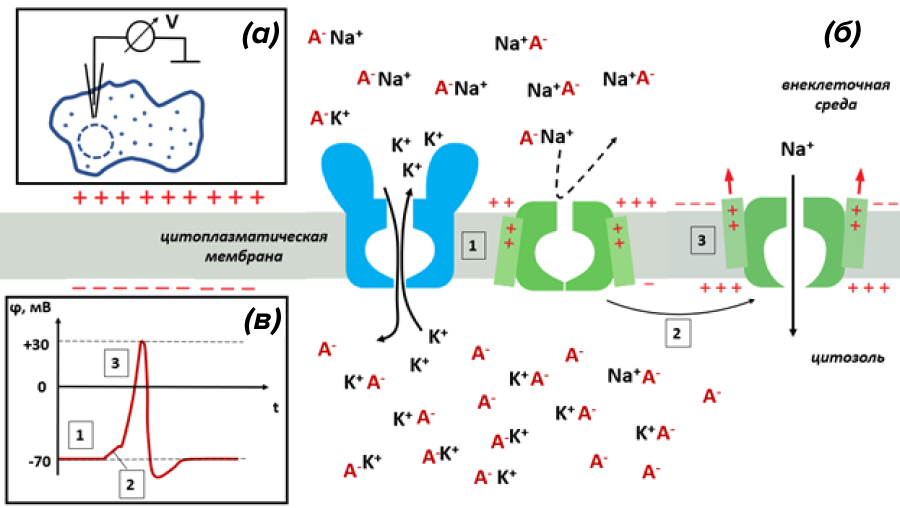
Рисунок 1. Электрический мембранный потенциал покоя и потенциал действия в возбудимых клетках создается благодаря растворимым носителям заряда — ионам Na+ и K+:
а — схема измерения мембранного потенциала методом внутренней регистрации. В клетку вводят тончайший регистрирующий электрод, держа электрод сравнения во внеклеточной среде, и измеряют разность электрических потенциалов между ними. Подробнее об этой методике и других операциях на нервных клетках читайте в статье «12 методов в картинках: нейробиология» [5].
б — в возбудимых клетках диффузия ионов K+ из цитозоля во внеклеточную среду через каналы утечки (голубые) заряжает мембрану. Разница электрических потенциалов, при которой устанавливается равновесие между разнонаправленными токами K+, именуют мембранным потенциалом покоя (состояние 1 на рисунке). При потенциале покоя потенциал-чувствительные натриевые каналы (зеленые) закрыты. Возбуждающие факторы вызывают небольшую локальную «разрядку» (состояние 2). Падение потенциала до критического уровня открывает натриевые каналы (состояние 3) и обеспечивает ток Na+ в цитоплазму, что приводит к развитию мощного электрического сигнала — потенциала действия (ПД).
в — ПД типичного нейрона, полученный с помощью метода внутренней регистрации. Обозначенные фазы изменения мембранного потенциала соответствуют стадиям на панели б.
рисунок автора статьи с использованными элементами из [4]
Установившуюся разницу электрических потенциалов физиологи называют мембранным потенциалом покоя (для максимально детального разъяснения этого понятия отправляем читателей к статье «Формирование мембранного потенциала покоя» [6]). Он разнится среди возбудимых клеток (у скелетных мышц около −80 мВ; у нейронов, в зависимости от их степени возбуждения, −70..−90 мВ [4]). Если быть совсем точным, то в формировании потенциала покоя, помимо главенствующий роли калия, небольшой вклад вносит «подтекание» мембраны для Na+ и Cl−. Именно поэтому реальный мембранный потенциал (а его измеряют, прокалывая клетку тончайшим стеклянным электродом — см. рис. 1а) очень близок к расчетному равновесному потенциалу только для K+, но не равен ему.
Теперь, сформировав потенциал покоя, возбудимые клетки могут сбрасывать его, что будет проявляться в виде электрических сигналов на мембранах. «Унифицированный» мощный электрический импульс (физиологи называют его потенциал действия, сокращенно — ПД) формируется в животных клетках запуском внутрь ионов натрия [5]. Все дело в том, что для ионов Na+, как говорят физхимики, электрохимический потенциал снаружи клетки гораздо выше, чем внутри. Во-первых, ионов гораздо больше во внеклеточной среде. Во-вторых, их притягивает отрицательно заряженная утечкой калия цитоплазма. Проще говоря, есть суммарная сила, толкающая ионы Na+ внутрь клетки, был бы только вход! Однако в покое большинство натриевых каналов закрыты.
Активирующие клетку факторы понемногу запускают внутрь положительные ионы, то есть делают электрический потенциал чуть менее отрицательным. При достижении потенциалом пороговых значений на это реагируют потенциал-чувствительные Na+-каналы. Они претерпевают конформационную перестройку, открывая ворота для ионов натрия, и Na+ устремляется в цитоплазму, меняя потенциал на мембране на противоположный (теперь уже положительно заряжена внутренняя сторона мембраны). На графике (рис. 1в) это выглядит как резкий скачок мембранного электрического потенциала. Подробно ПД разобран на рис. 6 в статье «12 методов в картинках: нейробиология» [5], а здесь скажем только, что из-за инактивации натриевых каналов и временного открытия потенциал-чувствительных калиевых каналов электрический потенциал вновь опускается до отрицательных значений (иногда даже с перехлестом). Развивающийся ПД способен распространяться по цитоплазме клеток, и его могут воспринимать различные белковые сенсоры.
Генеральный план кальциевого сигнала
Мы несколько увлеклись рассказом про другие ионы, однако теперь нам будет легче воспринять общие закономерности, а также уникальные черты в передаче сигнала с помощью ионов кальция.
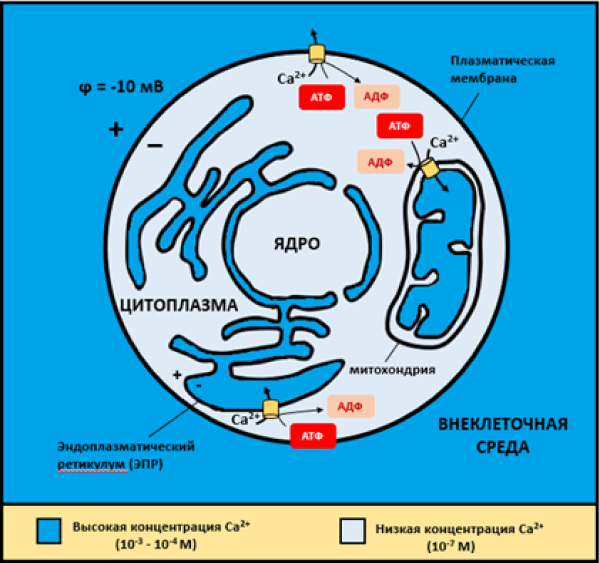
Рисунок 2. Поддержание концентраций ионов кальция в животной клетке с помощью кальциевых насосов. Видно, что высокие концентрации кальция (порядка 10−3—10−4 M) приходятся на внеклеточную среду, люмен ЭПР и матрикс митохондрий. Напротив, содержание Ca2+ в цитозоле и ядерном матриксе гораздо ниже (порядка 10−7 M). Обратите внимание, что на мембранах самой клетки и мембране ЭПР существует электрический потенциал. В частности, потенциал на цитоплазматической мембране для невозбудимых клеток составляет в среднем −5..−10 мВ. Потенциалы возбудимых клеток (нервных и мышечных) существенно выше — порядка −70 мВ.
[7], с изменениями
Давно известно, что концентрация Ca2+ в цитозоле клеток в норме чрезвычайно мала (~10−7 M), тогда как содержание во внеклеточной среде (~10−3 M) и люмене эндоплазматического ретикулума (ЭПР) (~10−4 M) значительно выше [4]. Такое неравномерное распределение кальция дается недешево: клетка тратит много энергии, чтобы выкачивать с помощью специальных насосов избытки Ca2+ из цитоплазмы во внеклеточную среду и в ЭПР, который выполняет функции внутреннего «депо» кальция (рис. 2) [7].
Разница в концентрациях на 3–4 порядка, а также «подстегивающий» кальций заряд на мембранах создают большой электрохимический потенциал для кальция как в люмене ЭПР, так и во внеклеточной среде по сравнению с потенциалом в цитозоле. Получается ситуация, очень напоминающая натриевую историю, и даже лучше — если принять во внимание бóльший перепад в концентрациях для Ca2+. Клетка в покое как бы заряжена («потенциирована») по ионам Ca2+: только открой шлюзы на мембране, и кальций сам потечет в цитоплазму!
Но работают ли ионы Ca2+ так же, как и Na+? Для некоторых возбудимых клеток, действительно, ток Ca2+ значительно влияет на электрический потенциал на мембране. Так, в сердечных мышечных клетках кальциевый ток удерживает мембранный потенциал на возбужденном уровне, соперничая с током утечки K+ [8]. В гладкомышечных клетках кальциевый, а не натриевый, ток формирует сам ПД [8]. Однако за этими исключениями именно ионы Na+ используются для электрического возбуждения клеток. Даже при одинаковой плотности натриевых и кальциевых каналов на мембране (а это не так), Na+-ток мощнее Сa2+-тока. Это происходит потому, что ток пропорционален как разнице электрохимических потенциалов, так и концентрации иона в компартменте утечки. Второй фактор играет не в пользу кальция в этом соперничестве, так как свободная концентрация кальциевых ионов во внешней среде значительно меньше концентрации Na+. Поэтому ставить знак равенства между функциями этих ионов никак нельзя.
Еще одним подтверждением служит тот факт, что кальциевые сигналы широко используются и в невозбудимых клетках, для которых формирование ПД невозможно. Сегодня мы понимаем, что существуют внутриклеточные белки, которые могут связывать ионы кальция в определенной концентрации, изменять свою конформацию и тем самым опосредовать клеточный ответ. Получается, что, в отличие от «безликих» в некотором отношении носителей заряда — ионов Na+, K+ и Сl−, используемых в электрическом сигналинге, — кальций следует скорее рассматривать как специфический «мессенджер», который, как ключик к замку, подходит к определенным белкам внутри клетки. Информационную функцию при этом выполняет концентрация ионов кальция в данном участке цитоплазмы.
На первый взгляд, схема работы кальциевого сигналинга до смешного проста [9]. Стимул открывает кальциевые каналы на цитоплазматической мембране или мембране ЭПР, и через эти открытые «шлюзы» ионы кальция устремляются в цитоплазму. Повышение цитозольной концентрации кальция в 10 раз (с 100 нМ в покое до 1000 нМ) запускает различные кальций-чувствительные процессы. После этого инактивирующие механизмы (насосы и ионные обменники) выкачивают Ca2+ из цитозоля, возвращая концентрации кальция к уровню покоя.
Биохимический набор для кальциевого общения
Разберем схему генерации кальциевого сигнала в клетке более подробно, учитывая основных «действующих лиц». Обратимся к простейшему регистрируемому профилю кальциевого ответа клетки — одиночному всплеску цитозольной концентрации Ca2+. Заметим, что ионы кальция могут попасть в цитоплазму из двух основных источников: внеклеточной среды или внутреннего кальциевого депо — ЭПР (рис. 3).
«Включаем» Ca2+-сигнальный путь
Какие же механизмы запускают ионы Ca2+ извне? Нетрудно догадаться, что такими «шлюзами», встроенными в цитоплазматическую мембранную «плотину», являются различные кальциевые каналы. Воспринимая раздражитель, они изменяют свою конформацию, открывая путь стремящемуся внутрь кальцию. Механизм активации ионных каналов бывает совершенно разным. В случае возбудимых клеток «воротами» для кальциевого тока часто служат высокоспецифичные потенциал-чувствительные кальциевые каналы (рис. 3, 1). Они воспринимают скачок электрического потенциала на мембране, что приводит к их открытию. Потенциал-чувствительные каналы обеспечивают выброс нейромедиатора в синапсах, сокращение мышц и секрецию гормонов [9].
Существуют также необычные механочувствительные каналы (рис. 3, 2). Они реагируют на механическое воздействие: растяжение и сжатие мембраны, давление на клетку. Как правило, эти белки являются неселективными катионными каналами, пропускающими и Na+, и K+, и Ca2+. Предполагается, что кальциевый впуск через механочувствительные каналы играет важную роль в работе механочувствительных нейронов [10], а также влияет на восприятие некоторыми клетками жесткости среды, в которой они развиваются [11], [12].
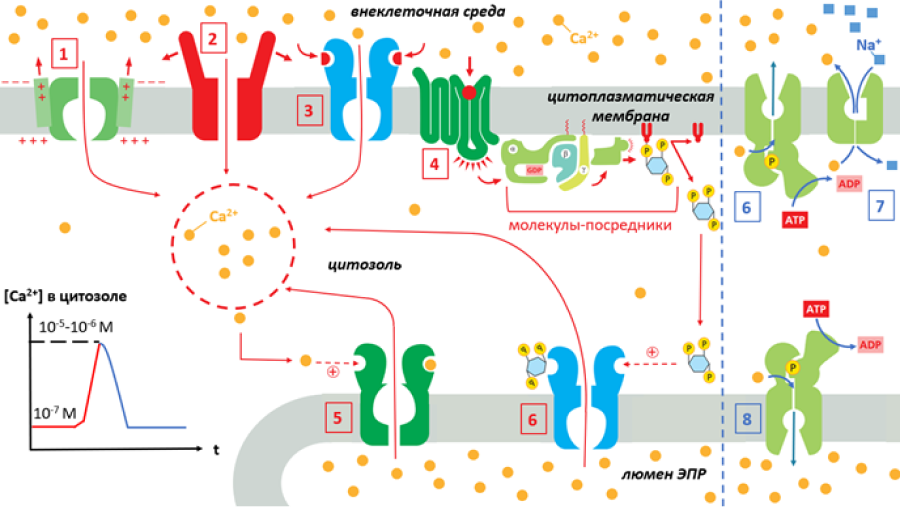
Рисунок 3. Биохимический инструментарий для управления кальциевым сигналом. Различные белки используются клеткой для повышения цитозольной концентрации Ca2+ (обозначено красным цветом). Потенциал-чувствительные (1) и механочувствительные (2) каналы, а также ионотропные рецепторы (3) запускают ионы кальция из внеклеточной среды. Метаботропные рецепторы (4) воспринимают свой лиганд на цитоплазматической мембране и передают возбуждение внутрь клетки через цепочку молекул-посредников на каналы, функционально связанные с этими рецепторами. В случае ионов Ca2+, такие IP3-активируемые каналы (5) находятся на мембране ЭПР. Кальций проникает в цитозоль из люмена ЭПР также через особые рианодиновые рецепторы (6). Они активируются повышением концентрации Ca2+ в цитозоле и могут таким образом многократно усиливать действие других кальций-впускающих механизмов. Когда концентрация Ca2+ достигает достаточно высоких значений (10−5–10−6 M), происходит инактивация механизмов прироста. В это же время работают механизмы понижения цитозольной концентрации Ca2+: кальциевая АТФаза цитоплазматической мембраны (6) или Na+/Ca2+-обменник (7) выкачивают ионы кальция наружу, а АТФаза мембраны ЭПР (8 закачивает Ca2+ внутрь клеточного «депо».
Наконец, широко распространены лиганд-управляемые белковые каналы, которые, подобно замку, открываются при связывании своего ключика — некоторой активирующей молекулы, называемой лигандом. Это может быть что угодно: гормон, нейромедиатор или какой-нибудь фактор роста. В зависимости от взаимного расположения рецепторной и собственно канальной части лиганд-управляемого белка, принято выделять ионотропные и метаботропные рецепторы. Ионотропные рецепторы непосредственно слиты с ионными каналами в единую химерную молекулу (рис. 3, 3). Для таких белков конформационное изменение рецепторной части при связывании своего лиганда передается механически на канал, открывая его. Среди ионотропных рецепторов ионы Ca2+ из внеклеточной среды пропускают неселективные катионные каналы [12]: NMDA и AMPA-рецепторы к глутамату, а также P2X-рецепторы, которые активирует АТФ [13].
У метаботропных белков рецепторная и канальная часть значительно разнесены в пространстве, и активирующее воздействие от первой ко второй передается через молекулы-посредники. Для ионов Ca2+ существует специальный фосфоинозитидный сигнальный путь, завязанный на метаботропные рецепторы. Что существенно, рецепторная часть такого сигнального пути располагается на цитоплазматической мембране (рис. 3, 4), а специфические кальциевые каналы, управляемые рецепторами, — на мембране ЭПР (рис. 3, 5). В отличие от всех вышеописанных примеров, в этом случае Ca2+ попадает в цитоплазму не из внешней среды, а из внутреннего «склада» — пространства эндоплазматического ретикулума. Молекулой-посредником в данном случае выступает инозитол-1,4,5-трисфосфат (IP3), открытие которого еще в 1983 году вызвало бурное изучение информационной роли кальция в целом.
Остановимся на фосфоинозитидном сигнальном пути более детально, в силу его исключительной важности в кальциевом сигналинге, в особенности в невозбудимых клетках, где он часто является преобладающим механизмом поступления Ca2+ [14].
Ключевую роль тут играет связанный с клеточной мембраной фермент фосфолипаза С-β. Он действует на фосфатидилинозитол-4,5-бисфосфат (PI(4,5)P2). Столь пугающее название носит минорный фосфолипид, компонент внутреннего слоя цитоплазматической мембраны. Запускают же сигнальный путь метаботропные рецепторы, которые, как правило, относятся к классу G-белоксопряженных. Трансмембранная часть такого рецептора связывает свой лиганд, что приводит к разваливанию комплекса G-белков. Одна из G-субъединиц (α), собственно, и приводит в действие фосфолипазу, «прилипая» к ней. Фосфолипаза С связывает свой субстрат, PI(4,5)P2, «разгрызая» одну из фосфоэфирных связей в молекуле. В результате совершенно нейтральный с точки зрения клетки фосфолипид распадается на две составляющие, каждая из которых обладает сигнальной активностью. Таким образом, в этот момент фосфоинозитидный путь разделяется на две сигнальные ветви [4].
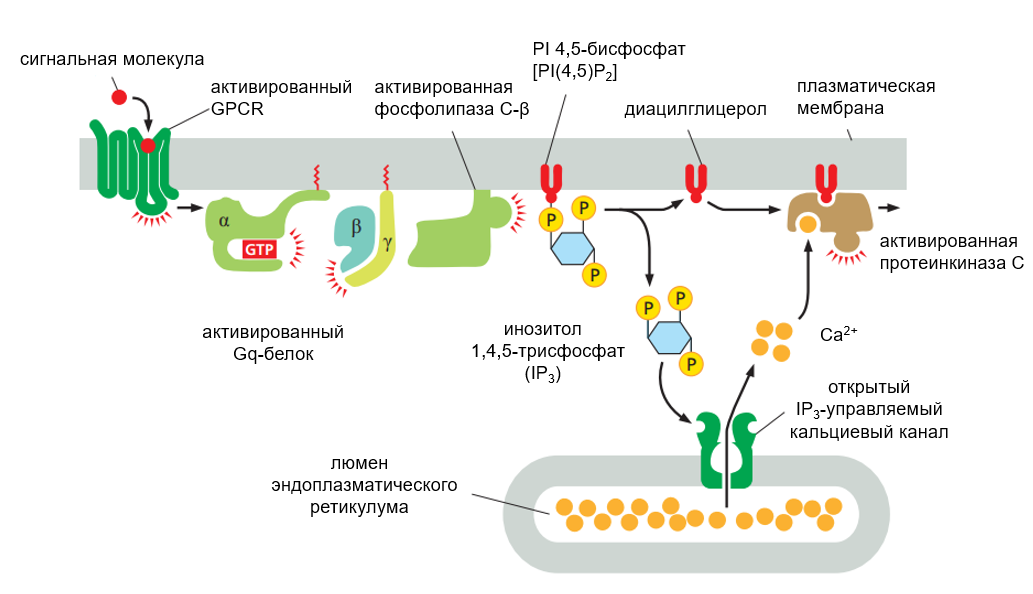
Рисунок 4. Схема фосфоинозитидного сигнального пути.
[4], с изменениями
Одна из новообразованных молекул — инозитол-1,4,5-трисфосфат (IP3) — хорошо растворима в воде, поэтому может диффундировать внутрь цитоплазмы клетки, где «открывает» IP3-управляемые каналы кальциевого выброса (далее будем именовать IP3-рецепторами), расположенными как раз на мембране ЭПР.
Другая часть бывшего фосфоинозитида — диацилглицерол — в силу своих гидрофобных свойств остается в плазматической мембране, где вместе с ионами Ca2+ и другим фосфолипидом — фосфатидилсерином — активирует фермент протеинкиназу С, которая фосфорилирует различные белковые молекулы, меняя их активность. В дальнейшем в контексте кальциевых колебаний нас будет интересовать по большей части первая ветвь фосфоинозитидного сигнального пути.
Наконец, рассмотрим еще один путь поступления Ca2+ из люмена ЭПР в цитоплазму. Его обеспечивают специфические каналы, встроенные в эндоплазматическую мембрану, названные рианодиновыми рецепторами из-за своего сродства к растительному алкалоиду рианодину (сокращенно — RyR-рецепторы). Они активируются повышенными концентрациями Ca2+ в цитоплазме, и, открываясь, выпускают еще больше кальция в цитозоль. RyR-рецепторы, таким образом, работают по принципу положительной обратной связи, вызывая Сa2+-зависимый выброс Сa2+, многократно усиливая кальциевый всплеск [12]. Считается, что именно рианодиновые рецепторы обеспечивают фазу резкого повышения концентрации кальция (рис. 3), фиксируемую в экспериментах.
«Выключаем» Ca2+-сигнальный путь
Мы рассмотрели различные белковые механизмы, которые обеспечивают повышение концентрации Ca2+ в цитозоле, что активирует в дальнейшем многочисленные кальций-чувствительные процессы. Однако после прекращения действия сигнала требуется вернуть клетку в состояние покоя, понизив концентрацию Ca2+ к исходному значению. Например, сокращенная под действием кальция мышечная клетка должна в конечном счете расслабиться.
Во-первых, необходимо остановить ток Ca2+ в цитозоль. Известно, что предельно высокие цитозольные концентрации Ca2+ (порядка 10−5—10−6 M) приводят к связыванию ионов Ca2+ низкоспецифичными ингибиторными сайтами, которые не чувствительны к более низким концентрациям кальция. Такие ингибиторные сайты есть на поверхности IP3-чувствительных каналов и RyR-рецепторов, что приводит к их отключению. Таким образом клетки «проводят» условную верхнюю границу возможных концентраций кальция [12].
Для возвращения содержания Ca2+ к базальному уровню в клетке имеется целая машинерия белков. В отличие от активационных каналов, работающих пассивно, «выключающим» белкам требуется выкачивать кальций из цитозоля обратно из клетки и в люмен ЭПР, где его значительно больше. Для того, чтобы противостоять градиенту электрохимических потенциалов, этим кальциевым насосам, расположенным как на клеточной мембране, так и на мембране ЭПР, требуется энергетическая «подпитка» в виде гидролиза молекул АТФ. Возбудимые клетки (например, нервные и мышечные), которые активно используют кальциевый сигналинг, обладают дополнительным Ca2+-транспортным механизмом (Na+-движимый Ca2+-обменник) на их плазматической мембране, который сопрягает энергетически «невыгодный» выход кальция с самопроизвольным входом натрия в клетку [4]. Мы помним, что градиент Na+, которым пользуются эти обменники, дается клетке не «бесплатно»: его создает АТФ-зависимая работа Na+/K+-АТФазы. Таким образом, эти обменные механизмы точно так же требуют гидролиза АТФ, но в неявном виде.
И швец, и жнец, и на дуде игрец: многоликий кальциевый сигналинг
Мы рассмотрели целый биохимический набор белков и других молекул, полезных для генерации кальциевого сигнала. Посмотрим, как клетки разных тканей по-разному пользуются этим инструментарием. Обратим внимание, что один и тот же сигнал (повышение концентрации Ca2+ в цитоплазме) применяется для решения совершенно разных функциональных задач.
Мышечные клетки
Пожалуй, наиболее специализированный механизм использования кальциевого сигнала встречается в клетках скелетной мускулатуры. Давно известно, что повышенная концентрация Ca2+ в их цитоплазме снимает ингибирующий эффект тропонина C, который мешает взаимодействию главных сократительных белков — актина и миозина [4]. Получается, что каждый раз, когда мы ходим, поднимаем гирю или просто моргаем, в наших мышцах происходит всплеск цитоплазматической концентрации кальция, который и запускает сокращение мышц.
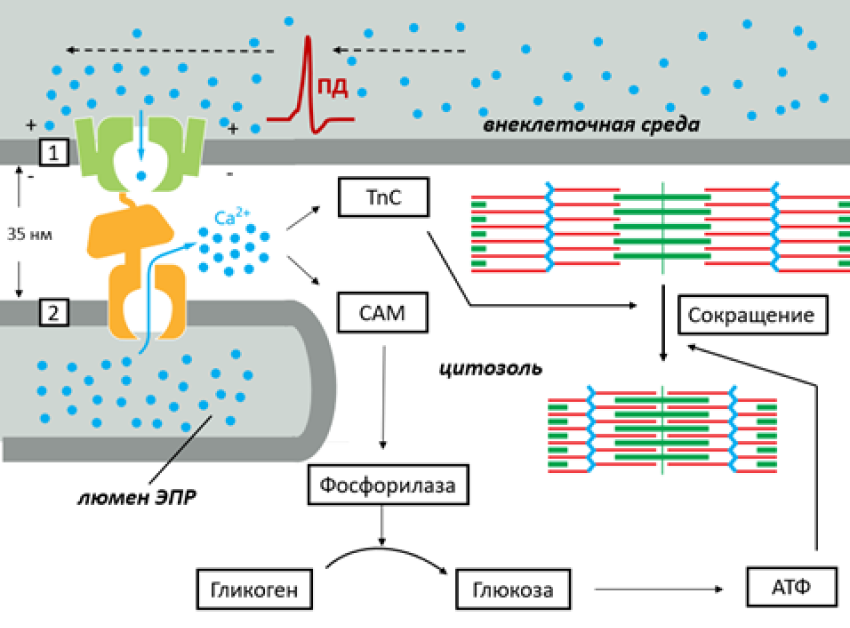
Рисунок 5. Схема электромеханического сопряжения в скелетных мышцах с помощью ионов Ca2+. В скелетных мышцах потенциал-чувствительные Ca2+-каналы (1) воспринимают перезарядку мембраны (приход ПД от управляющего нейрона) и претерпевают конформационную перестройку, которая механически передается на рианодиновые рецепторы (2) на мембране особого «мышечного» ЭПР. Таким образом, Ca2+ проникает в цитозоль одновременно из внешней среды и люмена ЭПР. Ионы кальция в высокой концентрации взаимодействуют в цитозоле с двумя сенсорами: тропонином С, что запускает сокращение мышцы, а также с кальмодулином (CAM), который запускает расщепление гликогена, дающее необходимую для работы мышцы энергию в виде молекул АТФ.
Клетки скелетной мускулатуры, подобно рабочим лошадкам, без промедления и собственной воли, должны подчиняться приказам управляющих нейронов. Для этого они обзавелись особыми потенциал-чувствительными каналами, которые физически (через белковую петлю) взаимодействуют с рианодиновыми рецепторами (RyR) на мембране ЭПР [9]. Пришедшая команда от нейрона в виде ПД открывает потенциал-чувствительные каналы для Ca2+. Однако одновременно с этим механическое изменение в каналах передается и на RyR на мембране ЭПР, что тоже приводит к их открытию. Так как RyR чувствительны к концентрации Ca2+, процесс развивается лавинообразно. Механизм использования кальция как промежуточного звена между электрическими процессами на мембране мышечной клетки и сократительной активности белков называется электромеханическим сопряжением.
Поджелудочная железа
Как было отмечено ранее, метаботропные рецепторы активно используются различными невозбудимыми клетками для генерации кальциевого сигнала. В качестве примера рассмотрим клетку поджелудочной железы, где подобный механизм обеспечивает секрецию воды и ферментов — главных компонентов панкреатического сока (рис. 6).
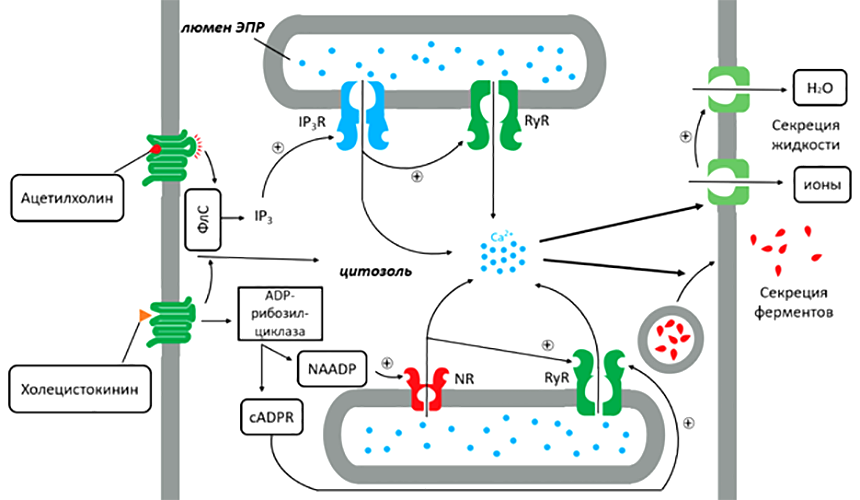
Рисунок 6. Ca2+-сигналинг в поджелудочной железе приводит к секреции панкреатического сока. Поджелудочная железа использует две сигнальные системы, действующие через различные рецепторы. Ацетилхолин приводит к высвобождению внутреннего Ca2+ через фосфоинозитидный сигнальный путь. Холецистокинин также работает одновременно и с помощью IP3-пути, и через активацию фермента АДP-рибозил-циклазы (cADPR), что приводит к образованию циклической ADP-рибозы, а также динуклеотидфосфата никотиновой кислоты (NAADP). Последняя молекула высвобождает небольшое количество «затравочного» кальция через NAADP-рецепторы (NR); этот триггерный Ca2+ вместе с cADPR в дальнейшем приводит к высвобождению основных порций Ca2+ через RyR. Повышенное содержание кальция в цитозоле активирует различные ионные каналы и секрецию ферментов. Выброс ионов из клеток поджелудочной железы сопровождается осмотическим током воды.
Как работает кальциевый сигналинг применительно к клеткам поджелудочной железы? Представьте себе, что вы вкусно пообедали. Для переваривания пищи в кишечнике требуется выделение поджелудочной железой своего секрета, содержащего все необходимые ферменты. Пищевое поведение запускает активацию парасимпатической нервной системы, в частности, блуждающего нерва, который иннервирует поджелудочную железу. Блуждающий нерв выделяет в место контактов с клетками поджелудочной железы свое сигнальное вещество — ацетилхолин. С другой стороны, в ответ на растяжение, двенадцатиперстная кишка выделяет в кровь гормон холецистокинин. Оба этих сигнальных вещества действуют на метаботропные рецепторы цитоплазматической мембраны панкреатических клеток и вызывают выброс ионов Ca2+ из люмена ЭПР в цитозоль. Повышение цитоплазматических концентраций кальция приводит к выделению клеткой пищеварительных ферментов, а также экскреции различных ионов, за которыми по законам осмоса следует вода.
Нейроны
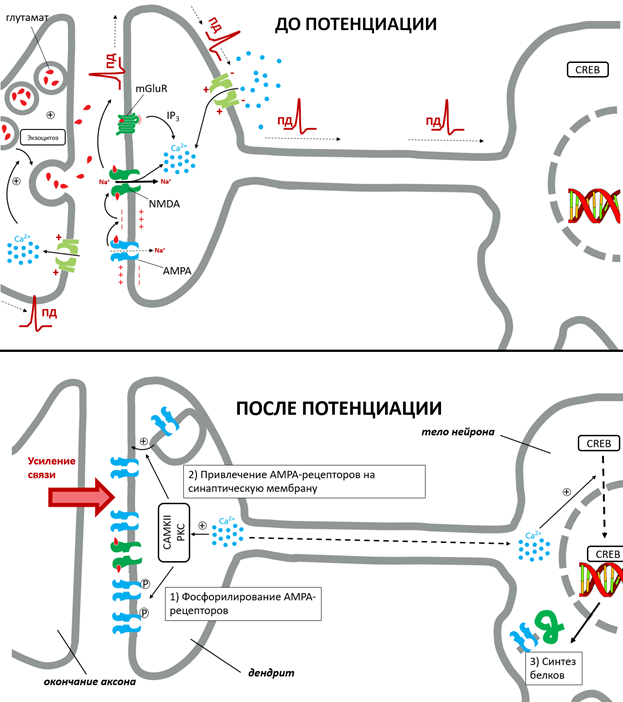
Пожалуй, самый сложный кальциевый сигналинг можно встретить в нервных клетках. Потенциал-чувствительные кальциевые каналы в окончаниях аксона открываются в ответ на приход ПД (рис. 7), что запускает экзоцитоз нейромедиаторов [15] — небольших молекул, которые передают воздействие (возбуждение или торможение) на соседний нейрон в местах специализированных нервных контактов — синапсов.
В дендритах (воспринимающих окончаниях нейрона) ионы Ca2+ обеспечивают удивительное свойство нервных клеток — долговременную потенциацию, — лежащее в основе таких фундаментальных свойств нервной системы, как память и обучение (рис. 7). Процесс долговременной потенциации хорошо изучен на примере основного класса нейронов головного мозга, общающихся при помощи нейромедиатора глутамата.
На мембране непотенциированного нейрона глутамат возбуждает лишь низкочувствительные AMPA-рецепторы, в то время как хорошо проводящие NMDA-рецепторы заблокированы «пробкой» из иона Mg2+. AMPA ионотропные рецепторы обеспечивают слабенький ток Na+ в цитоплазму, что приводит к небольшой локальной разрядке мембраны. Для возбуждения такого «необученного» нейрона требуется мощный или высокочастотный сигнал с аксона пресинаптической нервной клетки — только тогда ПД разовьется и в постсинаптическом нервном окончании. Однако если такое событие произошло, то на некоторое время прошедший ПД активирует NMDA-рецепторы, выбивая магниевую «пробку». В результате такой нейрон становится чувствительным и к низким концентрациям глутамата в синаптической щели, и теперь способен воспринимать более слабые и редкие стимулы.
NMDA-рецепторы обеспечивают неселективный катионный ток в клетку, пропуская вместе с Na+ и Ca2+. Через NMDA-рецепторы, а также через метаботропные глутаматные рецепторы (обозначены на рис. 7 как mGluR) и потенциал-чувствительные кальциевые каналы (отмечены светло-зеленым на рис. 7) по мере последовательных возбуждений, в нейрон попадают новые порции ионов кальция [9]. Повышение концентрации Ca2+ в дендритах приводит к ранней потенциации за счет возбуждения кальциевых сенсоров таких, как CaMKII (Ca2+-кальмодулин-зависимая киназа 2 типа) и PKC (протеинкиназа C). Эти киназы навешивают фосфатные метки на AMPA-рецепторы, что увеличивает их чувствительность, а также способствуют встраиванию дополнительных AMPA-рецепторов в синаптическую мембрану из клеточных запасов. Все это еще больше усиливает нейронную связь, «облегчая» возбуждение потенциированного нейрона.
Поздняя потенциация [9] заключается в том, что высокие концентрации Ca2+ достигают тела нейрона, где взаимодействуют со своими белковыми мишенями. В частности, кальциевый сигнал приводит к перемещению транскрипционного белкового фактора CREB в ядро нейрона, что запускает синтез различных белков. Обученный нейрон экспрессирует еще больше AMPA-рецепторов, а также других белков, которые обеспечивают рост нейрона и создание все большего количества новых синаптических контактов.
Описанные выше схемы демонстрировали понятные и линейные сигнальные пути. Однако есть куча куда менее изученных клеточных процессов, которые регулируются концентрацией Ca2+. В частности, показано, что многие транскрипционные факторы, запускающие экспрессию тех или иных генов, чувствительны к кальциевому сигналу. Предполагается, что таким образом кальций играет роль в пролиферации и дифференциации клеток, оплодотворении, формировании эмбриональных структур, а также может запускать клеточную смерть [9].
Кальций как вторичный мессенджер: паутина сигнальных путей
Мы убедились, что стимулы совершенно разной природы могут приводить к повышению цитозольной концентрации Ca2+. Разные типы клеток используют отличающиеся комбинации «инструментов» из биохимического «набора», описанного выше, для генерации кальциевого сигнала. Мы также показали, что вход Ca2+ в цитоплазму применяется для активации целого спектра функциональных клеточных процессов, столь непохожих друг на друга — таких как сокращение мышц или нейронная память. В чем причина такого широкого применения информационной функции ионов кальция? Для этого взглянем на уже привычные сигнальные схемы максимально абстрактно, убрав все биохимические подробности (рис. 8).
Из этих схем, напоминающих причудливые паутины, видно, что ионы Ca2+ служат промежуточным звеном между первичными раздражителями на мембране и ответом клетки [16]. В этом свойстве ионы кальция не одиноки. Ученые открыли целый перечень таких посредников, которые называют вторичными мессенджерами (по аналогии с первичными мессенджерами, воспринимаемыми цитоплазматической мембраной).
Очевидно, что изображенные на рис. 8 сигнальные сети содержат этот центральный узелок в виде Ca2+-мессенджера как свое самое узкое место. У такого «подхода» клеток к информационной передаче есть очевидные эволюционные основы. Дело в том, что естественный отбор редко придумывает новые структуры из ничего; скорее, он видоизменяет уже созданное ранее, приспосабливая к новым условиям. Универсальность использования кальция свидетельствует о древнем происхождении этого сигнального пути. Можно предположить, что существовал некий базисный кальциевый сигналинг, который был адаптирован в разных типах клеток к разным задачам по мере их дифференцировки в ходе эволюции.
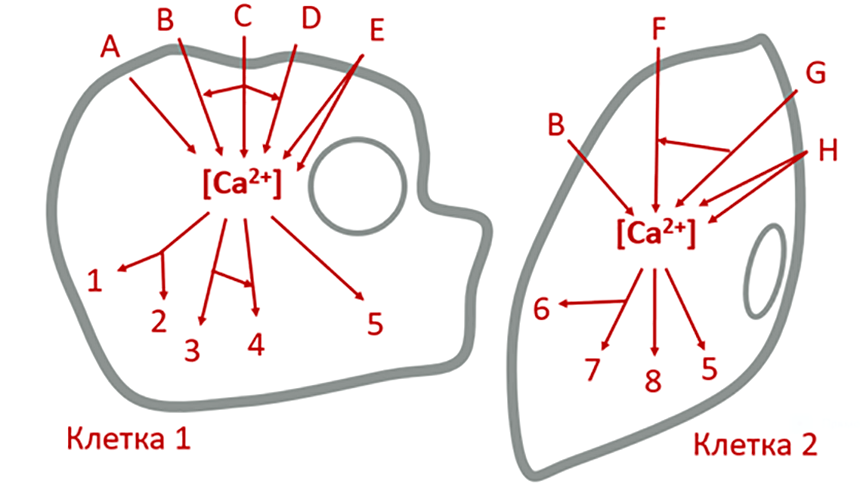
Рисунок 8. Принципиальные схемы Ca2+-сигналинга представляют из себя целые «паутины». Если рассмотреть кальциевые сигнальные пути максимально абстрактно, то существует множество стимулов (обозначены латинскими буквами), отличных для разных типов клеток, приводящих к изменению концентрации Ca2+. Высокие цитоплазматические концентрации кальция как универсальный вторичный мессенджер, в свою очередь, могут запускать целую сеть клеточных ответов (обозначены цифрами), опять-таки разных среди множества клеточных типов.
рисунок автора статьи
Таким образом, вторичные мессенджеры представляют собой универсальные клеточные адаптеры между различными возбудителями и клеточными ответами на них. Такая унификация позволяет клеткам значительно экономить на «молекулах-переходниках». Один и тот же белок внутри клетки можно возбудить, скажем, тройкой-четверкой внешних стимулов совершенно разной природы, используя универсальный адаптер наподобие ионов Ca2+.
Рисунок 8 отражает еще одно замечательное свойство сигнального каскада с участием вторичного мессенджера. Читатели, знакомые с устройством электросхем, могут предположить у такого промежуточного звена простейшие интегративные свойства — способность суммировать входные сигналы и передавать информацию дальше только при достижении определенного порога возбуждения. Например, в разобранном примере с клеткой поджелудочной железы (см. рис. 6) предполагается эффективная секреция панкреатического сока при одновременном действии и ацетилхолина, и холецистокинина. Другой пример: в экспериментах по индуцированной активации кальциевого сигнала в фибробластах требуется разрядка мембраны с помощью грамицидина одновременно с воздействием вазопрессина [17]; по отдельности же эти стимулы не вызывают кальциевого ответа в фибробластах. Тонко настраивая работу своих интеграторных систем, клетка может как глушить информационные потоки, так и увеличивать свою чувствительность к внешним раздражителям, что описано выше для потенциации нервных клеток.
Хорошо. Преимущества сигнальных схем с участием универсальных вторичных мессенджеров нам понятны. Однако представим теперь, что сотни гормонов, нейромедиаторов, паракринных, аутокринных и физических стимулов бомбардируют мембраны наших клеток каждый день, и все это разнообразие возбуждений «схлопывается» на ограниченном числе вторичных мессенджеров, таких как ионы Ca2+. Вырисовывается одна фундаментальная проблема обеспечения специфичности ответа. Как клетка сама не запутывается в той информационной «паутине», которую она сплетает? В частности, можно сформулировать следующие вопросы:
- Каким образом клетки умеют отличать сильные стимулы от слабых и соразмерно им отвечать?
- Каким образом клетки выбирают сигнальные пути правильным образом, то есть на стимул А отвечают реакцией 3, а не 4?
- Наконец, каким образом в разных клетках существуют различные ответы на один и тот же вторичный мессенджер?
Кальциевые колебания: клеточное радио
За последнее время ученые значительно продвинулись в поисках ответов на проблемные вопросы клеточного сигналинга (некоторые из них мы сформулировали в предыдущем разделе). В частности, стал понятен принцип, что клетки считывают не столько повышение в цитозоле средней концентрации вторичного мессенджера, сколько его тонкое пространственно-временное распределение [16].
Временной профиль кальциевого ответа может быть весьма разным. Во многих случаях Ca2+-сигнал представляет собой одиночные короткие всплески концентрации в цитозоле вроде тех, что запускают сокращение мышц или выброс нейронами медиатора. Когда требуются длительные периоды стимуляции, чаще всего вспышки Ca2+ многократно повторяются, порождая колебания различной частоты с периодом от 1–60 сек (в клетках печени и поджелудочной железы) до 24 часов (кальциевый осциллятор, который запускает клеточное деление митозом) [9].
Важно заметить, что такие колебания инициируются и поддерживаются самой клеткой до тех пор, пока действует стимул. Колебания могут инициировать различные ионные каналы, но главный способ их генерации, по-видимому, связан с фосфоинозитидным сигнальным путем [15]. Предполагается, что важным условием для порождения колебаний является система положительной и отрицательной обратной связи, которую демонстрируют IP3- и рианодиновые рецепторы [12]. Оба типа рецепторов активируются при повышении цитозольного уровня Ca2+, однако предельно высокие концентрации Ca2+, напротив, «выключают» эти каналы. Так обеспечивается восходящая и нисходящая фазы кальциевых колебаний.
Почему же, однако, при длительном возбуждении клетки пользуются чаще именно колебаниями, а не держат концентрацию Ca2+ на стабильно высоком уровне? По всей видимости, такое колебательное поведение обладает рядом существенных преимуществ.
Во-первых, увеличивая Ca2+ до высоких содержаний лишь на короткий промежуток времени, клетка избегает опасных последствий стабильно высоких концентраций Ca2+, которые могут запускать клеточную гибель путем как апоптоза, так и некроза [18], [19]. Во-вторых, кальциевые осцилляции могут регулировать длительные клеточные процессы вроде экспрессии генов, так как обходят проблему десенситизации Ca2+-зависимых процессов в ответ на длительный Ca2+-сигнал [16]. В-третьих, было показано — как методами математического моделирования [20], так и экспериментально [21] — что периодические Ca2±вспышки более эффективно запускают клеточный ответ, чем стабильно повышенный уровень кальция такой же амплитуды и длительности. Видимо, это связано с увеличением отношения сигнала к шуму в случае колебаний [16].
Существует, вероятно, еще одна причина такой «популярности» колебаний кальция среди клеток. Величина X, изменяющаяся по закону гармонического осциллятора, описывается уравнением:
X = A sin2π ft,
где A — амплитуда, а f — частота (Гц). Таким образом, колебания могут нести информацию одновременно в величине их амплитуды и частоты, в отличие от константной концентрации кальция. Предполагается, что именно в этих двух характеристиках колебаний Ca2+ клетки кодируют информацию о силе стимула и его природе. Амплитудная модуляция (АМ) предполагает, что кодируемая величина (например, сила стимула) отражается в амплитуде колебаний (см. рис. 9) [22]. В случае частотной модуляции (ЧМ) частота осцилляции тем выше, чем сильнее исходный стимул. Наконец, встречается частотно-амплитудная модуляция — их комбинация.
Удивительно, что все эти варианты кодирования активно применяются человеком в технических устройствах, основанных на радиоволнах! Получается, что задолго до Попова и Маркони эволюция создала своеобразное клеточное радио, которое позволяет передавать сигнал с периферии (клеточной мембраны) вглубь цитоплазмы, в царство белковых машин.
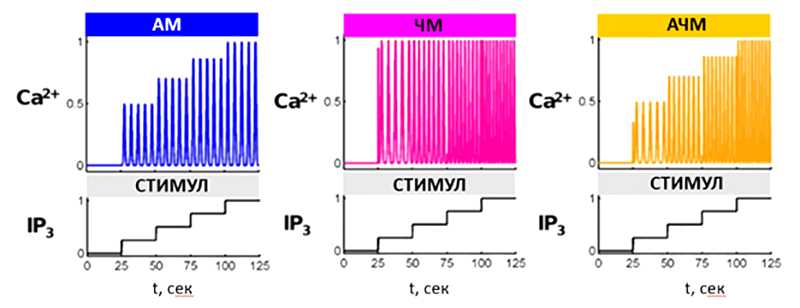
Рисунок 9. Моделирование трех принципиальных типов кодирования информации при помощи колебательного сигнала на примере кальциевых колебаний. В качестве кодируемого сообщения (силы стимула) используется ступенчатая концентрация IP3. В случае амплитудной модуляции (AM) сила стимула отражена в амплитуде колебаний, в случае частотной модуляции (ЧМ) — в их периоде. Амплитудно-частотная модуляция (АЧМ) использует оба принципа.
[22], с изменениями
Амплитудная модуляция (AM)
Закодированный кальциевый сигнал необходимо расшифровать. Как и большинство других молекулярных «профессий», работу переводчика в клетке выполняют белки. Связывание ионов Ca2+ инициирует конформационную перестройку этих сенсоров, активируя их.
Шифрование силы сигнала с помощью AM привлекает понятным механизмом декодирования. При базальных концентрациях Ca2+ белковые сенсоры находятся в свободном от кальция состоянии и, соответственно, неактивны. При возникновении колебаний определенной амплитуды устанавливается равновесие, при котором определенная доля сенсоров связывают кальций и активируются. При увеличении амплитуды таких колебаний равновесие устанавливается при большей доле связавших кальций (активных) молекул. Таким образом, сила стимула переводится на язык белковой активности.
С помощью амплитудной модуляции можно отчасти решить проблему специфичности сигнальных путей. Для каждого белка-декодера существует свой диапазон чувствительности к концентрации Ca2+ (рис.10). Если декодер обладает высокоаффинным сайтом связывания Ca2+ (с высоким сродством к этому иону), тогда он будет легко отвечать даже на небольшие всплески концентрации кальция в цитозоле. Напротив, низкоаффинный декодер для своей активации будет требовать гораздо более амплитудного входного сигнала. Многие кальций-чувствительные белки обладают несколькими сайтами связывания Ca2+ [16]. Интересно, что белки, содержащие различное количество одинаковых Ca2+-связывающих сайтов, могут сильно отличаться по своим кривым связывания кальция. Так клетка может прочитать довольно широкий диапазон амплитуд кальциевых колебаний [16].
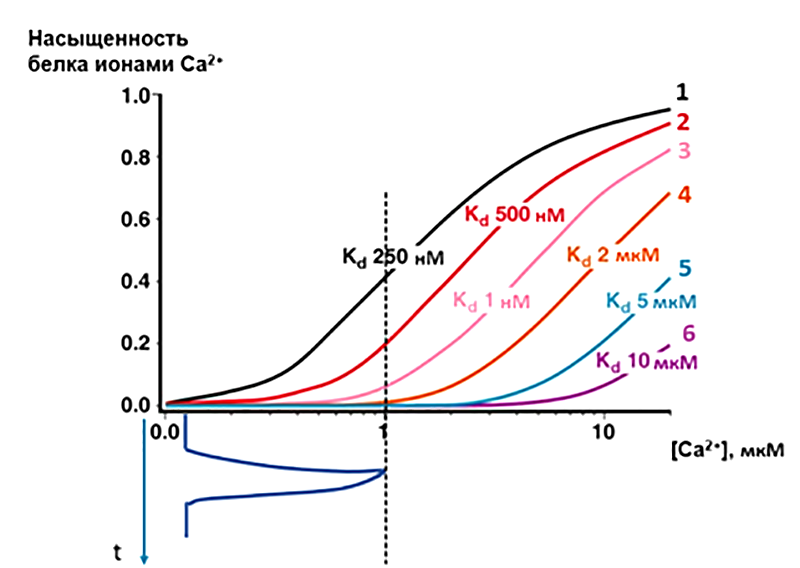
Рисунок 10. Принцип специфичности ответа при амплитудной модуляции (AM) колебаний Ca2+. На рисунке изображены кривые насыщения различных белковых сенсоров (1–6), содержащих по 4 идентичных кальций-связывающих сайта, но с разными константами диссоциации (KD) для Ca2+. Примем, что активность сенсора пропорциональна насыщению его сайтов ионами Ca2+. Тогда колебание Ca2+ определенной амплитуды (например, до конечной цитозольной концентрации в 1 мкM, отмечено синим цветом внизу) вызовет сильную активацию сенсора 1, в меньшей степени — белка 2, и совсем слабо активирует декодер 3. Сенсоры 4, 5 и 6 при данной амплитуде остаются неактивными.
[16], с изменениями
Механизм АМ, однако, обладает одним существенным недостатком в плане специфичности ответа. Так, при возбуждении низкочувствительного белкового сенсора колебанием высокой амплитуды в качестве побочного процесса клетка активирует целое море более чувствительных сенсоров. Как избавиться от этой неспецифики? Одно из решений проблемы лежит в возможности пространственного разграничения белковых сенсоров (например, в разных компартментах клетки). Экспериментальные данные свидетельствуют, однако, что AM используется значительно реже ЧM в кальциевом сигналинге и хороша в основном для триггерных процессов, работающих по принципу «всё или ничего». Например, показано, что колебания кальция очень высокой амплитуды могут переходить в стабильно высокие концентрации Ca2+ — и тем самым вызывать гибель клеток путем апоптоза [23].
Частотная модуляция (ЧM)
Компьютерная симуляция моделей кальциевых колебаний (рис. 11а), а также многочисленные экспериментальные данные [24] говорят, что клетка чаще использует-таки ЧМ. Так, Ca2+-осцилляции в клетках печени индуцируются гормоном вазопрессином, который выделяется в кровь для повышения ее осмолярности. Эти колебания запускают в гепатоцитах расщепление гликогена и выброс глюкозы в кровь. Показано, что увеличение действующих концентраций вазопрессина приводит к повышению частоты колебаний Ca2+ (рис. 11б), что, в свою очередь, может влиять на величину гликогенолитического ответа [25].
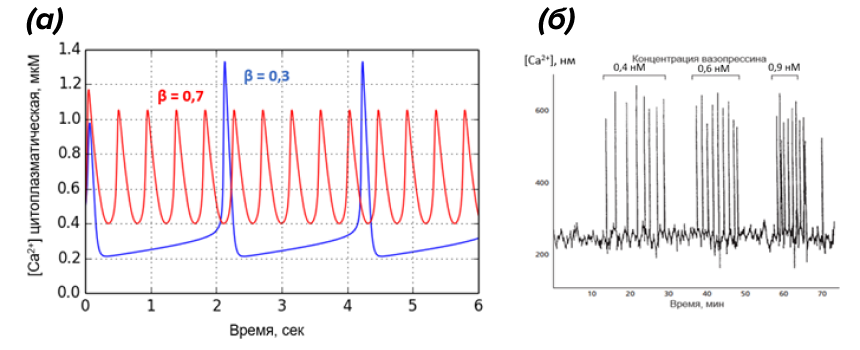
Рисунок 11. Использование частотной модуляции (ЧM) для кодирования силы стимула.
а — симуляция модели колебаний Ca2+ в программе PyTrax. Параметр β (степень активации IP3-рецепторов) в данной модели косвенно отражает силу внешнего раздражителя, действующего на клетку. Видно, что при увеличении β амплитуда кальциевых колебаний снижается, но увеличивается частота.
б — экспериментальные свидетельства использования ЧМ-осцилляций Ca2+ клетками печени. В цитоплазму гепатоцитов внедряли Ca2+-чувствительный краситель экворин (люминесцирует в присутствии Ca2+), а затем воздействовали возрастающими концентрациями сигнального пептида вазопрессина. Обратим внимание, что частота кальциевых всплесков возрастает с увеличением концентрации стимулирующего вещества, в то время как их амплитуда остается практически неизменной.
а — рисунок автора статьи, получен в программе PyTrax; б — [25], с изменениями
Каким образом происходит «чтение» сигнала в случае ЧM? Во-первых, колебания цитозольного уровня Ca2+ может вызывать аналогичные колебания активности своего сенсора; так частота кальциевых осцилляций может быть прямо «переписана» в частоту активности белков.
Во-вторых, следует учитывать особое явление, которое можно назвать кальциевым резонансом. Каждый тип белковых сенсоров обладает своей собственной кинетикой связывания-диссоциации кальция. Если характерное время связывания Ca2+ данной молекулой близко к периоду колебаний Ca2+, то молекула сенсора не успевает инактивироваться между отдельными кальциевыми всплесками, и ее активность начинает сигмоидально возрастать вплоть до максимально возможных уровней (рис. 12б) [26].
Селективность здесь состоит в том, что для сенсоров с гораздо более быстрой кинетикой связывания кальция суммация наблюдаться не будет, и сигнал будет просто декодирован как совокупность одиночных ответов на каждый кальциевый пик (рис. 12а). В то же время, для очень медленно связывающих кальций белков при коротких высокочастотных стимулах резонанс также будет работать плохо (рис. 12в): для таких белков более эффективны низкочастотные, но длительно действующие кальциевые колебания.
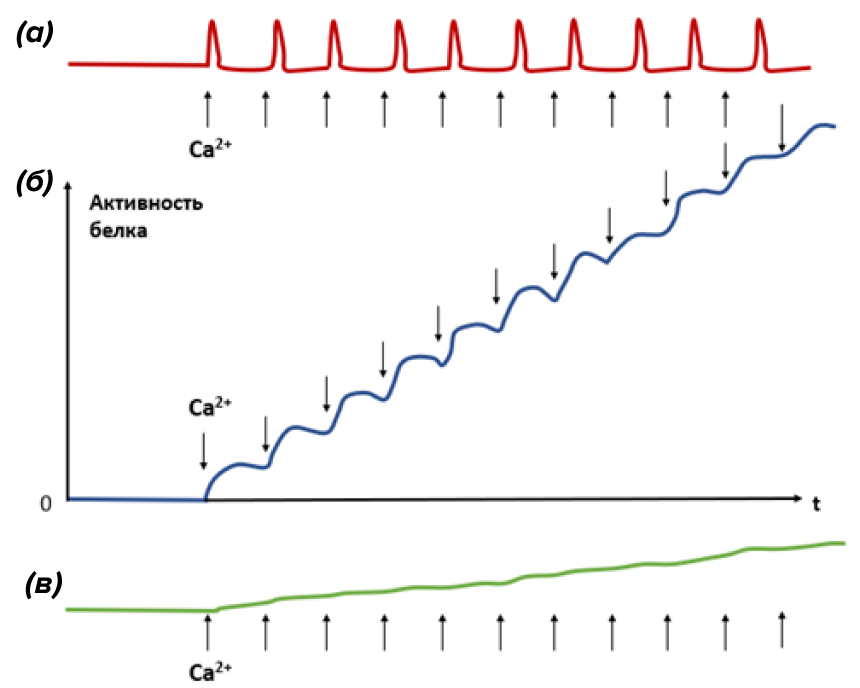
Рисунок 12. Принцип резонанса, наблюдаемый для частотной модуляции (ЧМ) колебаний Ca2+. Стрелочками обозначены пики колебаний Ca2+. Если связывание и диссоциация ионов Ca2+ данным сенсором происходит за время меньшее, чем период кальциевых колебаний (а), то наблюдаем одиночные слабые всплески активности такого белка. Если характерное время кинетики связывания Ca2+ сопоставимо с периодом кальциевых осцилляций (б), то декодер не успевает инактивироваться между отдельными вспышками Ca2+, и его активность начинает суммироваться — наблюдается явление резонанса. В случае, если сенсор связывает Ca2+ очень-очень медленно (в), то его активность между соседними кальциевыми всплесками возрастает слабо. Если при этом высокочастотный импульс действует на такой медлительный белок короткое время, то серьезного возрастания в активности белка произойти не успеет. Таким образом, для каждого сенсора существует диапазон резонансных частот, к которым такой белок особенно чувствителен.
К настоящему времени ученым известна обширная сеть белков, способных воспринимать колебательный кальциевый сигнал и активировать целые клеточные «программы» (например, через транскрипционные факторы). Как показывает один из недавних обзоров [24], различные белки-расшифровщики имеют разные диапазоны чувствительности к частоте кальциевых колебаний. Это может быть обусловлено, например, явлением резонанса, описанным выше. Примечательно, что интервалы «рабочих частот» важнейших кальциевых декодеров, отложенные на логарифмической шкале, слабо перекрываются между собой, что может свидетельствовать о разделении клеточных программ, запускаемых этими белками (рис. 13).
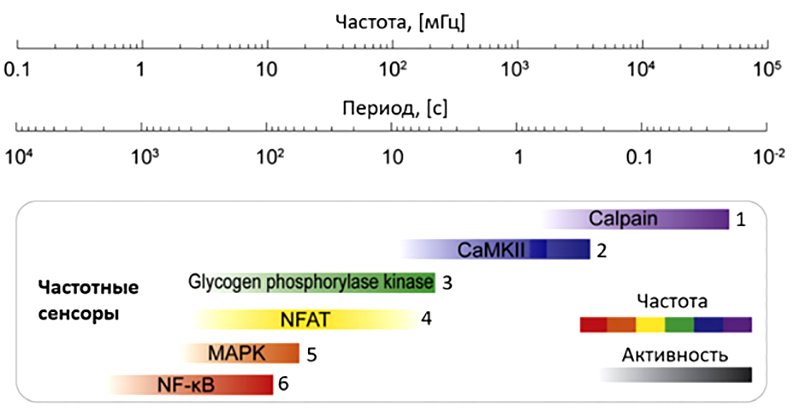
Рисунок 13. Различие в рабочих частотах кальциевых декодеров может обеспечивать специфичность ответа на колебания Ca2+ в разных типах клеток. Разные декодеры кальциевых колебаний обладают различными диапазонами рабочих частот, слабо перекрывающимся между собой. Учитывая широкое поле действия данных белковых сенсоров, это дает возможность селективно включать целые клеточные программы с помощью кальциевых колебаний определенной частоты. Внутри диапазонов рабочих частот с увеличением частоты колебаний активность белков возрастает (ЧМ для кодирования силы стимула).
Цифрами для каждого белка обозначены источники данных о рабочих частотах данного сенсора.
1 — эксперименты in vitro;
2 — нейроны спинального ганглия, эксперименты in vitro;
3 — компьютерное моделирование;
4 — Т-лимфоциты, базофильные гранулоциты, фибробласты, кардиомиоциты;
5 — эпителиальные клетки;
6 — Т-лимфоциты, эпителиальные клетки, эндотелиоциты.
[24], c изменениями
Благодаря наличию целого набора сенсоров клетка может решать проблему «запутанности» сигнальных путей. Например, стимул А вызывает колебания определенной частоты, и их воспринимает определенный сенсор, чувствительный в этой области, что запускает ответ 1, не затрагивая другие кальций-опосредованные процессы. Точно так же стимул Б приводит к ответу 3 и никак не влияет на ответ 4. Уникальные профили экспрессии этих декодирующих молекул позволяют различным типам клеток отвечать на один и тот же сигнал отличным образом, что может, в свою очередь, влиять на дифференциацию клеток в процессе эмбриогенеза.
Всем киназам киназа
Обратим внимание, что среди кальциевых сенсоров довольно много киназ, что вряд ли можно считать простым совпадением. Киназы — это ферменты, которые фосфорилируют свои белковые мишени, то есть вешают на определенные остатки аминокислот фосфат-анион. Такая метка зачастую драматически влияет на жизнь своего «хозяина», меняя его конформацию: одни белки она активирует, другие подавляет, третьи — заставляет сменить локализацию в клетке (рис. 14).
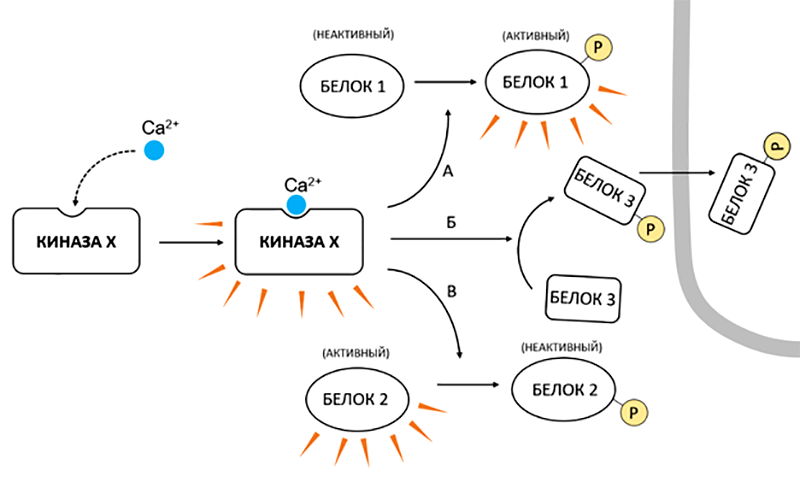
Рисунок 14. Активное использование киназ в кальциевом сигналинге существенно расширяет его регуляторные возможности. Активация обобщенной «киназы X» ионами Ca2+ реализуется в разнообразных воздействиях на внутриклеточные белки. Фосфорилирование такой киназой активирует одни белки (А), подавляет действия других (В) и приводит к перераспределению между клеточными структурами третьих (Б).
рисунок автора статьи
Многие киназы обладают целым спектром молекул-мишеней. Таким образом, воздействуя на ключевые узлы в виде киназ, кальциевый сигналинг может управлять целым оркестром клеточных процессов.
У киназ есть еще одно удивительное свойство: они могут фосфорилировать сами себя. Например, так работает кальций-кальмодулин-зависимая киназа II (СaMKII). Она представляет из себя 12-субъединичный белковый комплекс [4], каждая из которых может претерпевать редкую случайную перестройку из неактивного в активное состояние, и обратно. Кальций-кальмодулиновый комплекс при повышенных концентрациях Ca2+ закрепляет субъединицы в активном состоянии, связываясь с ним. Так Ca2+ включает работу CaMKII, и фермент начинает фосфорилировать белки-мишени. Однако две соседние активные субъединицы могут профосфорилировать друг друга. Держатся фосфатные метки до тех пор, пока ферменты фосфатазы не снимут ее с поверхности белка. Фосфатная метка закрепляет активную конфигурацию на длительное время, даже после того, как Ca2+-сигнал утихнет, и кальмодулин, утративший кальций, «отвалится» от СaMKII.
Эти замечательные особенности CaMKII могут предложить объяснение проблемы, казавшейся долгое время загадкой для ученых. Было показано, что в нейронах гиппокампа стимуляция частотой 100 Гц и длительностью в 1 секунду вызывает ранние фазы долговременной потенциации; при этом никаких свидетельств запуска поздней фазы (которая включает транскрипцию генов и синтез новых белков) не происходило. Долговременные эффекты, однако, подключаются, если трижды повторить эту секундную стимуляцию с интервалами в 10 минут [27], [28]. Огромные промежутки между стимулами свидетельствуют о наличии у нейрона какого-то запоминающего механизма, обладающего свойствами простейшего интегратора. Небольшие возбуждения должны накапливаться в таком «устройстве» — и только в своей сумме вызывать ответ, индуцирующий экспрессию генов.
Такому описанию соответствует CaM-киназа II. Как мы уже знаем, возбуждение нейрона приводит к запуску в цитозоль Ca2+, который действует и на наш фермент. Увеличивая с каждой новой стимуляцией количество проактивированных доменов, киназа может проявлять широкий диапазон активностей. При этом каждая новая стимуляция будет суммироваться с предыдущими из-за памятного механизма, завязанного на аутофосфорилировании. То есть даже между очень отдаленными друг от друга кальциевыми вспышками киназа не будет успевать инактивироваться, что очень напоминает механизм резонанса, описанный выше.
Интересно, что мутантные мыши, у которых «выключена» форма CaMKII, специфичная для головного мозга, испытывают определенные трудности в запоминании объектов, что тоже является свидетельством в активном участии CaM-киназы II в процессах долговременной памяти [4].
Пространственный фактор
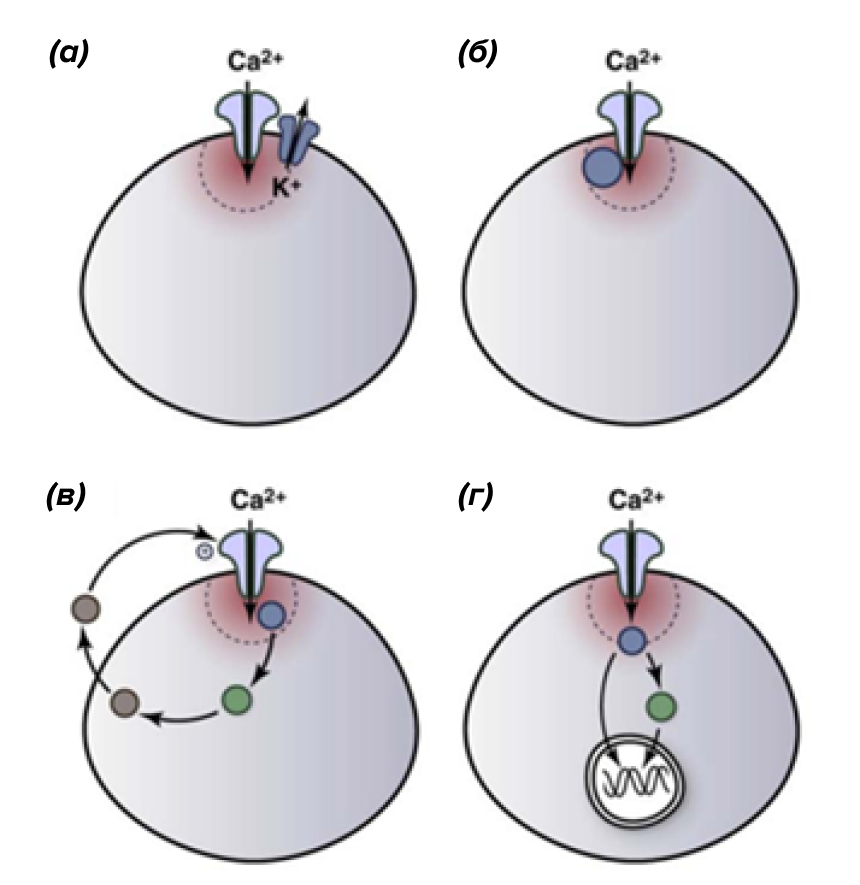
Рисунок 15. Стратегии совмещения Сa2+-микродоменов с белками клеточного ответа. Например, Ca2+-домен может быть совмещен с ионными каналами (а) или ферментами, связанными с плазматической мембраной (б). Сa2+-сигнал также может активировать внутриклеточные ферменты, которые запускают паракринный сигнал, который, в свою очередь, влияет на кальциевые каналы (в) или влияет на экспрессию генов (г).
рисунок автора статьи
Помимо изменения кальциевого сигнала во времени, очень важную роль играет его пространственное распределение в клетке. Дело в том, что неверно представлять цитозоль как некий однородный раствор ионов Ca2+. Из-за того, что в цитоплазме клеток содержится большое число кальций-связывающих белков (парвалбумин, кальбиндин, кальретинин), рассмотрение средней концентрации Ca2+ в цитозоле зачастую не имеет смысла. Наличие у внутриклеточной среды буферных свойств сильно ограничивает диффузию ионов кальция, формируя отдельные микродомены возле каждого кальциевого канала. Ток Сa2+ через кальциевый канал будет значительно повышать концентрацию кальция в этом микродомене, однако по мере отдаления от канала сигнал будет значительно ослабевать.
В качестве яркого примера того, как пространственное распределение кальциевого сигнала определяет молекулярный ответ, можно привести клетки гладких мышц. Для них показано, что один и тот же кальциевый сигнал может вызвать два противоположных физиологических ответа [29]. Так, выделение Сa2+ из ЭПР под плазматической мембраной открывает на плазмалемме Сa2+-зависимые K+-каналы, что приводит к понижению электрического потенциала этих клеток и, как следствие, расслабляет мышцы. Впуск кальция через потенциал-чувствительные ионные каналы, напротив, активирует мышечное сокращение. Таким образом, привязывая к кальциевым микродоменам определенные ферменты, ионные каналы или транскрипционные факторы, клетки могут обеспечивать специфичность ответа (рис.15).
Заключение
Ионы кальция широко используются в наших клетках для решения многообразных физиологических задач. Благодаря Ca2+-сигналингу происходит сокращение мышц, работа нервных клеток и желез, осуществляется регуляция целых биологических программ, таких как деление, дифференцировка, клеточная смерть. Даже в одной-единственной взятой клетке разные стимулы могут запускать свои уникальные молекулярные ответы через единый общий «узел» в виде изменения концентрации ионов Ca2+ в цитозоле. Перед исследователями сегодня стоит фундаментальная проблема — понять, как небольшая когорта сигнальных молекул, называемых вторичными мессенджерами (к ним относят и Ca2+), избирательно управляет целой кучей непересекающихся сигнальных путей. Становится ясно, что различия в белковых сенсорах, считывающих кальциевый сигнал, делают ответ на этот вторичный мессенджер у разных типов клеток столь непохожим друг на друга. Все больше фактов свидетельствуют, что для Ca2+-сигнала информационную роль исполняет не просто повышение средней концентрации этого иона в цитозоле, сколько ее тонкий пространственно-временной профиль. Например, в случае длительных сигналов, клетки часто генерируют колебания Ca2+. Применяя те же кодирующие принципы, что и радиомеханики (амплитудную и частотную модуляцию), клетки могут зашифровывать информацию о силе и природе стимула и отвечать на него соразмерно и селективно. Некоторые белковые молекулы сохраняют свою активность какое-то время и после затухания кальциевого сигнала, тем самым демонстрируя свойства элементарного «запоминающего устройства». Из-за наличия у цитоплазмы буферных свойств и ее высокой гетерогенности многие кальциевые эффекты проявляются локально. В таких участках цитоплазмы, именуемых микродоменами, клетки имеют возможность точно совмещать рецепторную часть кальциевого сигналинга с эффекторными белками, тем самым обеспечивая селективность ответа.
Литература
- Липидный фундамент жизни;
- Физическая водобоязнь;
- Никитин М. Происхождение жизни. От туманности до клетки. М.: «Альпина нон-фикшн», 2016. С. 139–157;
- Stephen Bustin. (2015). Molecular Biology of the Cell, Sixth Edition; ISBN: 9780815344643; and Molecular Biology of the Cell, Sixth Edition, The Problems Book; ISBN 9780815344537. IJMS. 16, 28123-28125;
- 12 методов в картинках: нейробиология;
- Формирование мембранного потенциала покоя;
- Gangxu Shen. (2020). Campbell biology (edited by Lisa Urry, Michael Cain, Steven Wasserman, Peter Minorsky and Jane Reece). J of Biol Res-Thessaloniki. 27;
- Шмидт Р., Тевс Г. Физиология человека, Т. 2. М.: «Мир», 2005. — 457 с.;
- Michael J. Berridge, Peter Lipp, Martin D. Bootman. (2000). The versatility and universality of calcium signalling. Nat Rev Mol Cell Biol. 1, 11-21;
- D. Usoskin, M. Zilberter, S. Linnarsson, J. Hjerling-Leffler, P. Uhlen, et. al.. (2010). En masse in vitro functional profiling of the axonal mechanosensitivity of sensory neurons. Proceedings of the National Academy of Sciences. 107, 16336-16341;
- Sisi Liu, Xiaohui Gao, Xiaoan Wu, Yang Yu, Zhang Yu, et. al.. (2019). BK channels regulate calcium oscillations in ventricular myocytes on different substrate stiffness. Life Sciences. 235, 116802;
- Per Uhlén, Nicolas Fritz. (2010). Biochemistry of calcium oscillations. Biochemical and Biophysical Research Communications. 396, 28-32;
- Вторая жизнь АТФ: от главной батарейки до нейромедиатора;
- M J Berridge. (1990). Calcium oscillations.. Journal of Biological Chemistry. 265, 9583-9586;
- Как происходит выделение нейромедиатора;
- Anant B. Parekh. (2011). Decoding cytosolic Ca2+ oscillations. Trends in Biochemical Sciences. 36, 78-87;
- A.T. Harootunian, J.P.Y. Kao, R.Y. Tsien. (1988). Agonist-induced Calcium Oscillations in Depolarized Fibroblasts and Their Manipulation by Photoreleased Ins(l,4,5)P3, and Ca++, and Ca++ Buffer. Cold Spring Harbor Symposia on Quantitative Biology. 53, 935-943;
- Michael J. Berridge, Martin D. Bootman, Peter Lipp. (1998). Calcium - a life and death signal. Nature. 395, 645-648;
- Sten Orrenius, Boris Zhivotovsky, Pierluigi Nicotera. (2003). Regulation of cell death: the calcium–apoptosis link. Nat Rev Mol Cell Biol. 4, 552-565;
- Carlos Salazar, Antonio Zaccaria Politi, Thomas Höfer. (2008). Decoding of Calcium Oscillations by Phosphorylation Cycles: Analytic Results. Biophysical Journal. 94, 1203-1215;
- Wen-hong Li, Juan Llopis, Michael Whitney, Gregor Zlokarnik, Roger Y. Tsien. (1998). Cell-permeant caged InsP3 ester shows that Ca2+ spike frequency can optimize gene expression. Nature. 392, 936-941;
- Maurizio De Pittà, Vladislav Volman, Herbert Levine, Giovanni Pioggia, Danilo De Rossi, Eshel Ben-Jacob. (2008). Coexistence of amplitude and frequency modulations in intracellular calcium dynamics. Phys. Rev. E. 77;
- Hong Qi, Xiang Li, Zhen Jin, Thomas Simmen, Jianwei Shuai. (2020). The Oscillation Amplitude, Not the Frequency of Cytosolic Calcium, Regulates Apoptosis Induction. iScience. 23, 101671;
- Erik Smedler, Per Uhlén. (2014). Frequency decoding of calcium oscillations. Biochimica et Biophysica Acta (BBA) - General Subjects. 1840, 964-969;
- Niall M. Woods, K. S. Roy Cuthbertson, Peter H. Cobbold. (1986). Repetitive transient rises in cytoplasmic free calcium in hormone-stimulated hepatocytes. Nature. 319, 600-602;
- Phyllis I. Hanson, Tobias Meyer, Lubert Stryer, Howard Schulman. (1994). Dual role of calmodulin in autophosphorylation of multifunctional cam kinase may underlie decoding of calcium signals. Neuron. 12, 943-956;
- U. Frey, Y.-Y. Huang, E. R. Kandel. (1993). Effects of cAMP Simulate a Late Stage of LTP in Hippocampal CA1 Neurons. Science. 260, 1661-1664;
- Peter V. Nguyen, Ted Abel, Eric R. Kandel. (1994). Requirement of a Critical Period of Transcription for Induction of a Late Phase of LTP. Science. 265, 1104-1107;
- M. T. Nelson, H. Cheng, M. Rubart, L. F. Santana, A. D. Bonev, et. al.. (1995). Relaxation of Arterial Smooth Muscle by Calcium Sparks. Science. 270, 633-637.