Корь: война с детской чумой продолжается
19 января 2019
Корь: война с детской чумой продолжается
- 21889
- 36
- 8
Характерные признаки кори. Пятна Филатова—Бельского—Коплика на слизистой оболочке рта и типичная коревая сыпь появляются уже после того, как пациент становится заразным. Остановить вспышку кори крайне тяжело: всех, кто контактировал с новым пациентом, следует отправлять в карантин. Рисунок в полном размере можно посмотреть здесь.
рисунок Ирины Ефремовой
-
Автор
-
Редакторы
-
Иллюстратор
Благодаря плановой иммунизации мы успели забыть о множестве невероятно заразных и опасных заболеваний. Тем не менее расслабляться рано: если групповой иммунитет снизится из-за отказа от вакцинации, страшные эпидемии могут вернуться, и это не просто слова. В 2018 году СМИ тревожно сообщали об участившихся случаях кори, или «детской чумы», как ее называют. В этой статье спецпроекта «Вакцинация» мы расскажем, чем корь опасна, как с ней бороться и почему она всё еще не побеждена.
Вакцинация

Генеральный партнер спецпроекта — Zimin Foundation.
Изобретение вакцин кардинально изменило жизнь человечества. Многие болезни, уносившие тысячи, а то и миллионы жизней ежегодно, теперь практически не встречаются. В этом спецпроекте мы не только рассказываем об истории возникновения вакцин, общих принципах их разработки и роли вакцинопрофилактики в современном здравоохранении (этому посвящены первые три статьи), но и подробно говорим о каждой вакцине, включенной в Национальный календарь прививок, а также вакцинах против гриппа и вируса папилломы человека. Вы узнаете о том, что собой представляет каждый из возбудителей болезней, какие существуют варианты вакцин и чем они различаются между собой, затронем тему поствакцинальных осложнений и эффективности вакцин.
Для соблюдения объективности мы пригласили стать кураторами спецпроекта Александра Соломоновича Апта — доктора биологических наук, профессора МГУ, заведующего лабораторией иммуногенетики Института туберкулеза (Москва), — а также Сусанну Михайловну Харит — доктора медицинских наук, профессора, руководителя отдела профилактики НИИ детских инфекций (Санкт-Петербург).
Корь — невероятно заразная болезнь
Корь — очень заразное вирусное заболевание. Это утверждение ярко иллюстрирует случай, произошедший в Индиане (США) в 2005 году. Тогда непривитая семнадцатилетняя девушка вернулась домой из Румынии, где свирепствовали вспышки кори. Еще в дороге у нее поднялась температура, начались кашель и насморк, покраснели глаза. Однако, несмотря на недомогание, на следующий день она отправилась на церковный пикник, где было 500 человек.
Следует отметить, что в США к тому времени корь считалась редкостью, а уровень вакцинации населения был очень высок. Всего 35 гостей на пикнике никогда не прививались от кори, и из них 31 человек (89%) заразился от девушки. Из оставшихся 465 человек оказались инфицированными только трое (0,6%). Девушка, заболевшая в Румынии, провела в толпе из пятисот человек всего несколько часов, при этом практически все восприимчивые к этой болезни люди подхватили вирус [1], [2]. История эта показывает, насколько заразен вирус кори — он циркулирует даже там, где большинство людей привиты. Поучительно здесь и то, что защищенное вакциной общество оказалось под угрозой болезни, которая мигрировала из другой страны.
К сожалению, вспышки кори, такие как в Индиане или даже гораздо более серьезные (в 2008 году новая эпидемия кори в Америке затронула не один штат, а целых 13 [3]), производят на общественность недостаточный эффект. При этом вокруг опасности самих коревых вакцин сконцентрировано множество мифов, укоренившихся глубоко в умах людей. В результате корь продолжает атаки по всему миру до сих пор, а родители всё чаще отказываются от вакцинации своих детей, ослабляя защиту не только своей семьи, но и целых городов и даже стран.
Здесь важно понимать, что чем заразнее болезнь, тем больший процент людей нужно вакцинировать, чтобы предотвратить новые эпидемии. Для защиты от такой заразной болезни, как корь, уровень иммунизации должен быть около 95% [4]. Эта цифра не случайна: она базируется на изучении темпов развития вируса в зависимости от уровня иммунитета в популяции. Значимость повсеместного распространения вакцин против кори легко оценить, взглянув на визуализацию (видео 1), созданную с помощью компьютерной системы моделирования FRED (Framework for Reconstructing Epidemiological Dynamics). Эту систему придумала и реализовала лаборатория динамики общественного здоровья Университета Питтсбурга (Pitt Public Health Dynamics Laboratory) в сотрудничестве с Центром суперкомпьютеров Питтсбурга и Школой компьютерных наук Университета Карнеги-Меллона. FRED имитирует распространение инфекционного заболевания, учитывая возможности для передачи вируса в том или ином городе или округе США, а также в некоторых других странах. Виртуальная эпидемия кори начинается с одного заболевшего ребенка школьного возраста и продолжается семь месяцев. События могут развиваться по двум сценариям. В первом случае против кори привито 80% детей в возрасте от полугода до 15 лет, во втором — 95%. Для большинства городов разница в развитии эпидемий по двум сценариям колоссальна. На видео ниже представлены модели FRED для Нью-Йорка.
Видео 1а. Визуализация распространения вируса кори в городе Нью-Йорк в течение семи месяцев, начиная с одного заболевшего (FRED, Framework for Reconstructing Epidemiological Dynamics). Красные точки показывают местоположение новых заразившихся, синие — перенесших корь. Против кори привито 80% детей в возрасте от 6 мес. до 15 лет.
Видео 1б. Визуализация распространения вируса кори в городе Нью-Йорк в течение семи месяцев, начиная с одного заболевшего (FRED, Framework for Reconstructing Epidemiological Dynamics). Красные точки показывают местоположение новых заразившихся, синие — перенесших корь. Против кори привито 95% детей.
Модель FRED показывает, насколько важно поддерживать высокий уровень вакцинации даже там, где кори уже нет, чтобы она не вернулась. Однако никакие модели не нужны, чтобы увидеть, как рост числа людей, отказывающихся от прививок в Европе, становится причиной новой опасности, грозящей теперь и России: 17 августа 2018 года в Чите с подозрением на корь госпитализировали 18 человек. В июне 2018 года Роспотребнадзор предупредил о распространении кори в 28 странах Европы, возросла заболеваемость в Украине: в первые три недели 2018 года корь там диагностировали у 2084 человек. В 2016 году Роспотребнадзор отмечал распространение кори в Армении, Грузии, Белоруссии, Бельгии, Италии и ряде других стран. Добралась корь и до Англии: крупная вспышка кори в Бристоле в июне (минимум 56 больных на конец июня) согласуется с общим ростом зарегистрированных случаев в стране.
Всё это говорит о том, что в России новой атаки коревой инфекции ждать осталось недолго. Эксперты связывают нависшую над страной угрозу болезни со снижением числа вакцинированных людей. И это действительно так. Где бы корь ни появилась, ее приходу всегда предшествует снижение охвата популяции вакцинацией. Страх людей перед вакцинами постепенно вытесняет страх перед болезнью, и вирус этим успешно пользуется.
Что мы знаем о вирусе кори
Корь встречается во всех климатических зонах и у представителей всех рас. Это одно из самых заразных инфекционных заболеваний: оно поражает почти каждого человека в популяции до достижения им зрелого возраста [6]. По оценкам эпидемиологов, до широкомасштабного введения вакцин к 10-летнему возрасту успевали переболеть более 90% людей [7].
Корь не зря называют «детской чумой»: ее вспышки затрагивают в основном детей. При этом чем выше плотность населения, тем ниже возраст заражения. Во многих развивающихся странах средний возраст заражения значительно ниже, чем в США и Европе [8]. Разумеется, попадание вируса в столь молодой организм повышает риск серьезных осложнений и даже смерти.
Заболеваемость корью носит сезонный характер. В Соединенных Штатах до введения вакцинации крупные эпидемии происходили примерно каждые два-три года [9], а небольшие вспышки отмечались ежегодно в конце зимы и ранней весной. На территории бывшего СССР, как и во многих европейских странах, независимо от климатических условий максимальное число случаев кори регистрируется в январе, минимальное — в августе [10]. В тропиках корь чаще свирепствует в течение сухого сезона. Островные или изолированные населенные пункты могут оставаться свободными от инфекции, пока вирус туда не доберется извне [11]. Если это происходит, там заболевают все — и дети, и взрослые. История эпидемиологии кори сохранила примеры таких эпидемий: они поражают своим размахом и последствиями. Например, на островах Фиджи в 1875 году завезенная из Австралии корь выкосила примерно 25% островного населения [12], а в Южной Гренландии в 1951 году корью заболело 4 320 человек (что соответствовало 999 случаям кори на 1000 человек).
«Детская чума» передается воздушно-капельным путем и при прямом контакте. В зоне риска всегда находятся те, кто активно участвует в социальной жизни, — школьники и студенты. Если школьник не привит и не болел корью, вероятность заразиться после контакта с больным одноклассником для него составляет от 90 до 100% [13]. Избежать болезни удается очень немногим.
Возбудитель болезни — вирус
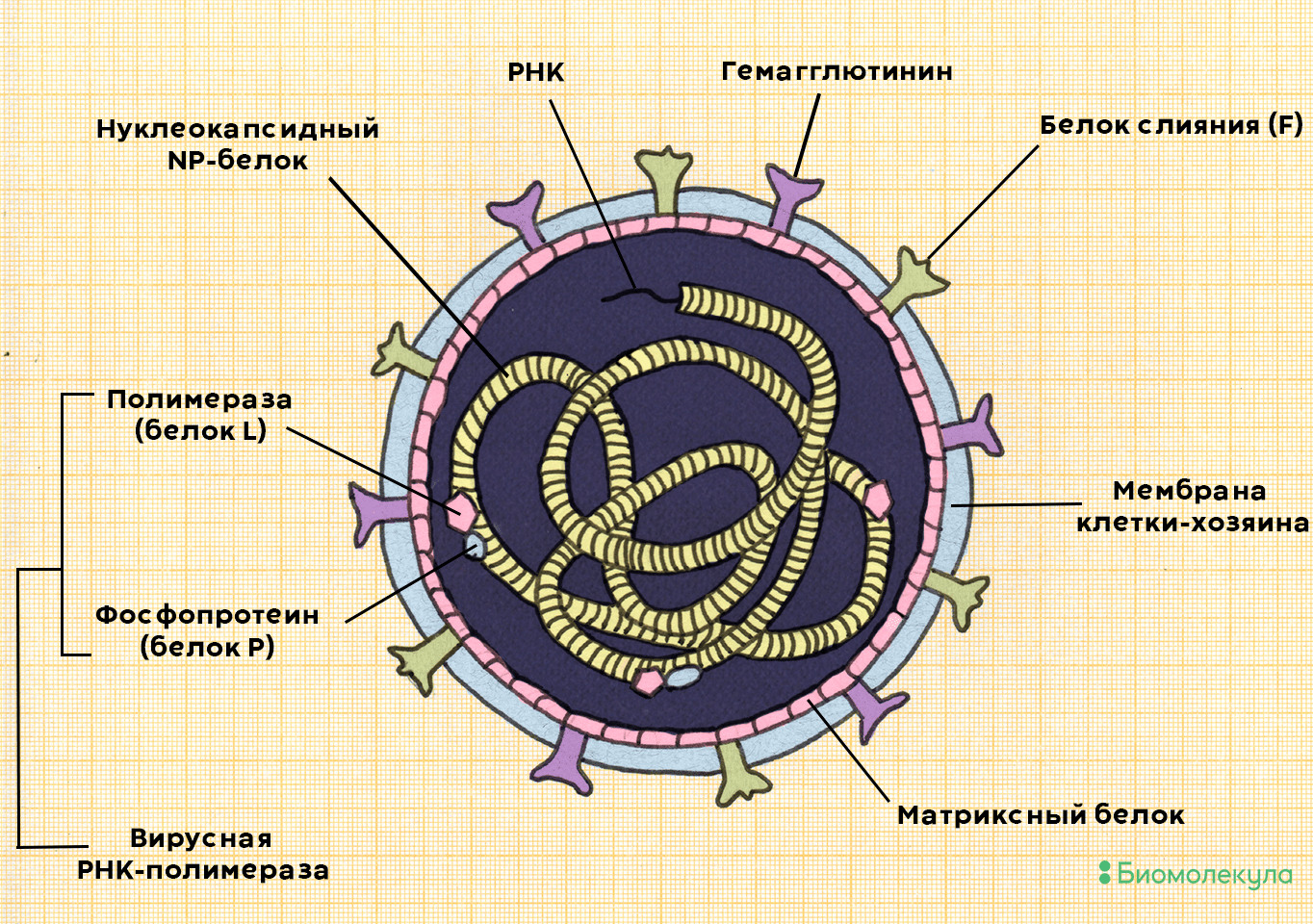
Возбудитель кори — Measles morbillivirus, содержащий одноцепочечную РНК (рис. 3). Его вирионы, как правило, имеют округлую или овальную форму, реже неправильную. Размер вирионов колеблется от 120 до 250 нм, гигантские формы могут достигать 600 нм. Вирус кори относится к роду Morbillivirus семейства парамиксовирусов (Paramyxoviridae). Единственный естественный хозяин этого вируса — человек.
Геномы вакцинных вирусов кори, а также многих диких штаммов были полностью секвенированы, и последовательный анализ генов белков NP, H, P и М показал, что существует несколько разных линий вирусов дикого типа [23]. Биологическое значение различий в геномах диких штаммов неизвестно, и нет никаких доказательств, что они как-то влияют на механизмы передачи вирусов или вирулентность (способность заражать организм человека). Иными словами, иммунитет, выработанный с помощью вакцинации от кори или в результате перенесения заболевания, защищает от всех штаммов вируса, независимо от их происхождения.
Информация о распространении разных штаммов вируса в мировом масштабе (рис. 4) очень помогает контролю за вакцинацией против кори и прогнозированию, где может произойти следующая эпидемия. Сегодня корь постоянно находится под наблюдением. Всемирная организация здравоохранения (ВОЗ) создала глобальную базу данных, где представлены 24 генотипа вируса [24], а в 2000 году появилась глобальная сеть лабораторий по борьбе с корью и краснухой, построенная на базе сети по ликвидации полиомиелита. В настоящее время сеть включает более 730 лабораторий во всех шести регионах ВОЗ. Благодаря этой программе появилась возможность контролировать распределение генотипов вируса кори по всему миру и делать выводы о том, насколько широки границы миграции отдельных вирусов.
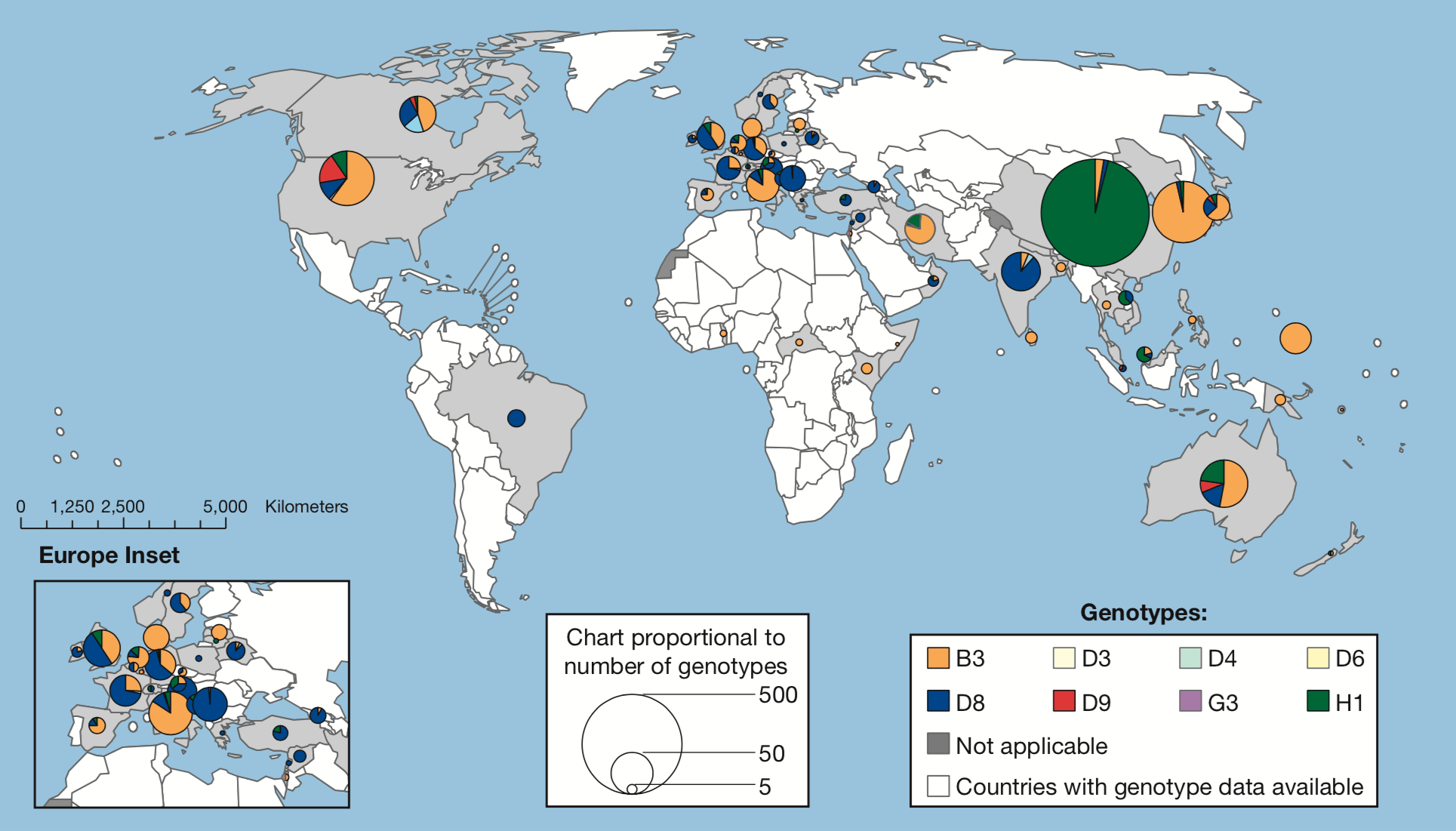
Рисунок 4. Всемирное распространение генотипов вируса кори (2014–2015 гг.)
С введением такого контроля циркуляция вирусов дикого типа уменьшилась: из 24 известных генотипов лишь 13 были зарегистрированы в течение 2005–2014 годов.
Распространение вирусов кори в России контролируется с помощью единой сети по надзору за корью и краснухой в странах СНГ и РФ. Так, в лаборатории Национального научно-методического центра по надзору за корью и краснухой на базе ФГУН МНИИЭМ им. Г.Н. Габричевского проводят генотипирование диких штаммов вируса кори в рамках мониторинга их циркуляции. В 2017 году генотипировали вирусы от 200 больных из 24 субъектов РФ. Тогда зарегистрировали разные генетические варианты генотипов D8, H1 и B3, включая и ранее не циркулировавшие на территории РФ геноварианты, что указывает на импортирование этих возбудителей.
Стратегия атаки
Вирус кори попадает в организм человека через слизистую оболочку верхних дыхательных путей — нос, рот или глаза — и распространяется по нему, атакуя иммунную систему [25], [26]. Он с легкостью поражает макрофаги, дендритные клетки, Т- и В-лимфоциты и моноциты. С их помощью вирус перемещается к органам: легким, селезенке, печени, кишечнику и даже к мозгу. Подробнее об этом рассказывает видео Measles explained (видео 2). Коварство вируса кори в том, что наша собственная армия становится мишенью болезни и, словно троянский конь, разносит вирус по всему нашему телу.
Видео 2. Measles explained — vaccinate or not? Что корь делает с нашим телом и стоит ли против неё прививаться
Чтобы заразить больше людей, вирус кори заставляет нас кашлять. С третьего дня инкубационного периода в лимфоузлах и миндалинах можно обнаружить типичные для развития кори гигантские многоядерные пораженные клетки Уортина-Финкельдея с внутриклеточными включениями. Они провоцируют отек инфицированной ткани в верхних дыхательных путях, что вызывает кашель и чихание, знаменующие начало инфекционного периода. Кашель облегчает «выживание» вируса кори, обеспечивая передачу от человека к человеку [27]. Инфекционный период длится около девяти дней, обычно он начинается за четыре дня до появления коревой сыпи.
Насколько опасно заболеть корью?
Когда вирус проникает в наш организм, незащищенный специфическим иммунитетом, мы заболеваем. Однако первые симптомы кори появляются только через 10–14 дней. У заразившегося поднимается температура (до 40,6 °С), возникает сильное недомогание (снижение аппетита, вялость, нарушение сна), воспаляются слизистые оболочки верхних дыхательных путей, появляется кашель. Такое состояние длится от 2 до 4 дней, причем понять, что это корь, достаточно сложно: все перечисленные симптомы свойственны и множеству других болезней.
На третий-четвертый день после возникновения первых симптомов на слизистой оболочке щек и языка появляются пятна Филатова–Бельского–Коплика. Выглядят они как множественные голубовато-белые бляшки диаметром 2–4 мм [31]. Пятна наблюдаются более чем у 70% заболевших корью, и поскольку они появляются раньше других характерных симптомов, их обнаружение ценно для ранней диагностики и своевременного назначения лечения — например, постконтактной вакцинации.
После пятен Филатова–Бельского–Коплика приходит черед типичной коревой сыпи — похожих на эритему пятнисто-папулёзных высыпаний, которые распространяются от головы по всему телу, доходя до конечностей за 3–4 дня (рис. 6). После этого сыпь темнеет, шелушится и постепенно исчезает в порядке ее появления.
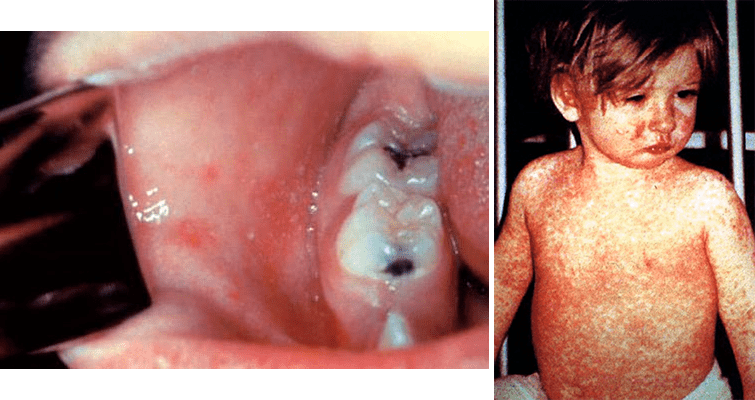
Рисунок 6. Основные признаки кори. Слева — Пятна Филатова–Бельского–Коплика. Справа — Типичная коревая сыпь.
«Википедия»
Инфицирование вирусом кори приводит одновременно к активации и к подавлению иммунной системы [32]. Воздействие вируса на организм включает уменьшение количества Т-лимфоцитов, которое начинается до появления сыпи и длится около месяца [33]. Исследование пациентов с корью в Гамбии выявило значительное подавление производства интерлейкина-12, известного регулятора клеточного иммунитета [34]. Снижение местного и общего иммунитета из-за кори имеет большое значение, потому что при этом создаются благоприятные условия для активации как патогенной, так и условно-патогенной микробиоты. Именно поэтому течение кори нередко осложняется другими патологиями, преимущественно дыхательной системы. Но иногда осложнения вызывают не сторонние микроорганизмы, а сам вирус. Из осложнений кори чаще всего упоминаются средний отит (7–9%), диарея (8%), пневмония (1–6%), постинфекционный энцефалит (0,1–0,4%), подострый склерозирующий панэнцефалит, или SSPE (0,01–0,04%) [35].
Разумеется, это далеко не все возможные осложнения, с которыми вы можете столкнуться, если вирус кори вас настигнет. Так, корь во время беременности связана с повышенным риском осложнений у матери, плода и новорожденного, включая выкидыши, преждевременные роды, низкий вес новорожденных и материнскую смертность [36]. Серьезные осложнения или даже смерть от кори встречаются чаще у детей младше пяти лет и у взрослых старше 20 лет. Уровень смертности от кори в развитых странах сегодня составляет 1–3 случая на 1000 случаев заболевания [37].
Корь и пневмония
Развитие пневмонии из-за кори — случай не такой уж редкий: ее диагностируют у 5–10% больных корью детей. Пневмония очень опасна и становится причиной около 60% связанных с корью смертей [38].
Энцефалит
Неврологические осложнения, в том числе острый вирусный или бактериальный энцефалит, часто приводят к стойкому повреждению головного мозга и встречаются в 1–4 случаях на 1000 случаев кори [39].
Коревый энцефалит — одно из самых тяжелых осложнений. Заболеть им могут как дети, так и взрослые. В основе его развития лежит не только поражение клеток мозга самим вирусом, но и запуск иммунопатологических реакций, ведущих к образованию антител к тканям головного мозга. Эти антитела взаимодействуют с миелином, микроглией и разрушают их. Степень неврологических расстройств при этом может быть разная. Поражаются мозговые оболочки, головной и спинной мозг, периферические нервы. Коревый энцефалит характеризуется высоким уровнем смертности (до 25%) и нередко оставляет стойкий след в виде двигательных расстройств, судорожных припадков и снижения интеллекта.
Страшный диагноз — SSPE
Уже после перенесения кори могут появиться признаки поражения центральной нервной системы, свидетельствующие о развитии подострого склерозирующего панэнцефалита (SSPE). Это тяжелая дегенеративная болезнь, выражающаяся в поведенческих изменениях, ухудшении интеллектуальных функций, психических и моторных нарушениях, судорогах. Часто SSPE заканчивается смертью [40].
Механизм развития связанного с корью SSPE до сих пор изучен не полностью. Считается, что вирус попадает в мозг, вероятно, во время острой первичной инфекции, а затем сохраняется в нервной системе. У пациентов с SSPE обнаруживают высокие титры коревых антител в сыворотке и спинномозговой жидкости и сам вирус в пораженной ткани головного мозга [41]. Интересно, что выделенные из такой ткани вирусы имеют критические мутации в генах белков M, H или F, препятствующие нормальному размножению вируса. Это значит, что вирусы кори, сохранившиеся в организме и приведшие впоследствии к SSPE, не играют роли в передаче вируса и возникновении новых вспышек [42].
Симптомы SSPE появляются в среднем лишь через семь лет (!) после того, как пациент перенес корь, и признаки заболевания неспецифичны, поэтому его сложно диагностировать, а ущерб от SSPE как от осложнения кори сложно оценить. Во время череды новых эпидемий кори в США в период 1989–1991 годов SSPE наблюдали в 22 случаях на 100 000 зарегистрированных случаев заболевания.
И всё же, несмотря на все опасности, которые несет корь, наш иммунитет чаще всего побеждает вирус. А что самое замечательное — каждый переболевший корью человек получает от нее пожизненную защиту: его иммунитет уже научился бороться с болезнью, и теперь она ему не страшна. Такую же защиту мы приобретаем и благодаря вакцинации. Если ты привит, у твоего организма уже есть щит, который выручит тебя при встрече с вирусом дикого типа.
Главный профилактический подход — иммунизация!
В лечении кори противовирусные средства обычно не используют, и вся медицинская помощь заключается преимущественно в поддерживающей терапии. Больным дают препараты для облегчения кашля и противовоспалительные аэрозоли. В случае развития осложнений или вторичных инфекций проводят лечение с целью снижения рисков инвалидности и смертности. Большую роль в успешном лечении кори играет ранняя диагностика и своевременная помощь. Например, высокие дозы витамина А снижают смертность детей раннего возраста, госпитализированных с корью, и рекомендованы ВОЗ для введения острым больным [43].
Так как эффективного лечения кори нет, единственным способом борьбы с ее последствиями считается профилактика, которая сегодня заключается в применении вакцин. Коревые вакцины содержат специальные, ослабленные вирусы кори, которые работают как тренеры: они готовят наш иммунитет к встрече с вирусом дикого типа. В будущем, когда такой вирус атакует привитый организм, тот легко отразит нападение.
Вакцинация против кори признана во всём мире наиболее мощным, безопасным и эффективным методом борьбы с болезнью. Широкомасштабная вакцинация детей в развитых странах оказала огромное влияние на распространение кори и коревых осложнений. Сокращение смертности от кори было настолько велико, что в конце концов даже признали возможность ее глобального искоренения. Это стало бы справедливым финалом болезни, которую когда-то путали с оспой — первым полностью истребленным инфекционным заболеванием [44].
Благодаря массовым кампаниям по вакцинации оценочное число смертей от кори во всём мире сократилось с начала нового тысячелетия на 79%: с 546 800 смертей в 2000 году до 114 900 — в 2014. Согласно оценкам, в этот период удалось предотвратить 17,1 млн смертей от кори [45]. В Соединенных Штатах в довакцинную эру ежегодно сообщалось приблизительно о 500 000 случаев кори, но есть основания полагать, что это число занижено, а ежегодное количество инфицируемых в то время приближалось к четырем миллионам [46]. Сейчас дело обстоит куда лучше: в 2011 году в США подтвердили всего 107 случаев кори [47]. В России вакцинация также дала свои плоды: с достижением 97-процентного уровня охвата населения вакцинацией частота заболеваемости корью снизилась более чем в 60 раз в сравнении с довакцинной эпохой (рис. 7).
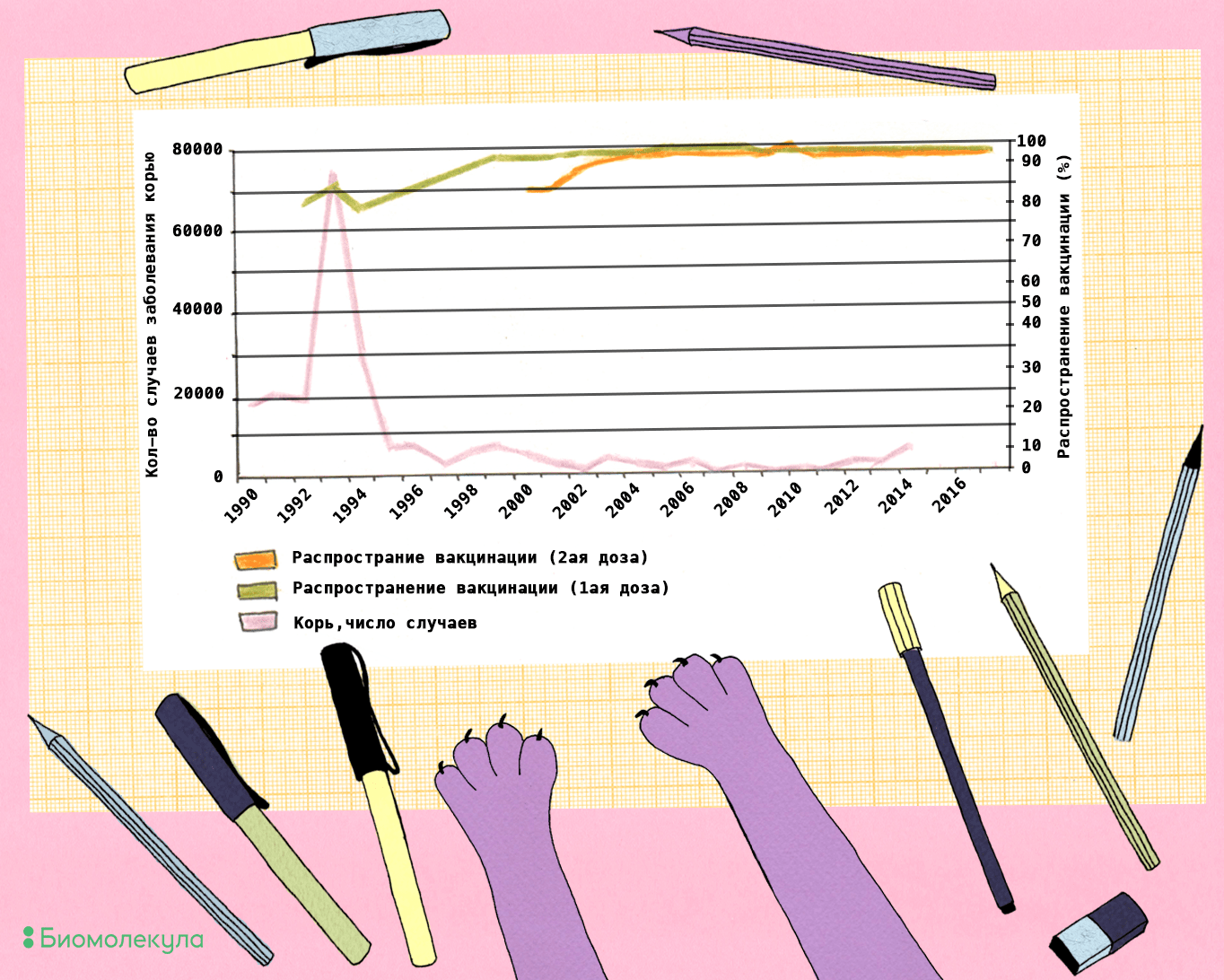
Рисунок 7. Зарегистрированные случаи кори в России и распространение вакцинации в 1990–2017 годах.
рисунок Ирины Ефремовой по данным WHO
Российский национальный календарь прививок (Приказ Минздрава России от 21.03.2014 № 125н) не имеет принципиальных отличий от календарей наиболее развитых стран мира и помимо двукратной вакцинации против кори, краснухи и свинки предусматривает «подчищающую» вакцинацию против кори для взрослых, ранее не привитых или не обладающих данными о вакцинации.
Тем не менее полностью победить корь пока не удалось ни в одной стране. Несмотря на то, что в некоторых районах мира контроль заболеваемости достаточно эффективен, корь по-прежнему остается пятой причиной всех смертей детей младше 5 лет. Основные помощники кори на поле боя — растущее число непривитых граждан, отказы от вакцинации и активная миграция вирусов из одного региона в другой.
Грозит ли миру новая эпидемия кори?
В последнее время ситуация усугубилась. Если раньше считалось, что корь удастся истребить к 2015 году, то сейчас уже никто не уверен в победе. С конца 2013 года в большинстве регионов мира наблюдается рост заболеваемости. Его фиксируют даже в тех странах, в которых длительное время случаи кори либо не выявлялись вовсе, либо были единичными, — в США, Канаде, большинстве европейских государств. В 2013 году в Европейском регионе было зарегистрировано более 30 тыс. случаев кори. Крупная вспышка наблюдалась в Грузии — 7 830 случаев. Во время вспышки в Болгарии умерли 24 человека, во Франции — 10 человек. В 2014 году в Европейском регионе в целом от кори умерли 7 пациентов. Рост заболеваемости наблюдался и в отдельных регионах России. В 2014 году заболеваемость возросла практически вдвое по сравнению с предыдущим годом — с 1,65 до 3,23 случаев на 100 тыс. населения. Всего в 2014 году зарегистрировали 4 711 случаев кори, 88,9% из которых приходилось на Москву, Московскую область и субъекты Северо-Кавказского и Южного федеральных округов. Заболеваемость регистрировали в 70 из 85 регионов страны.
Сдерживать корь становится всё труднее. В Европе количество заболевших в 2018 году с января по июнь перевалило за 40 тыс. (рис. 8). В нашей стране за последний год корью заразилось больше людей, чем за 2016 и 2017 вместе взятые. Как и раньше, от кори в основном страдают дети: в 2017 году 64,4% заболевших в России входили в возрастную категорию до 17 лет. Среди регионов страны самые высокие показатели заболеваемости зарегистрированы в Республике Дагестан (3,3 случая на 100 тыс. населения), Москве (2,7) и Московской области (2,1), Чеченской Республике (2,3) и Республике Адыгея (1,6).
Врачи в России и Европе бьют тревогу, призывая к массовой вакцинации. Ведь главная причина новых вспышек кори — это отказ большой массы людей от прививок. И если программы вакцинации потерпят новую неудачу, эпидемии никак не избежать.
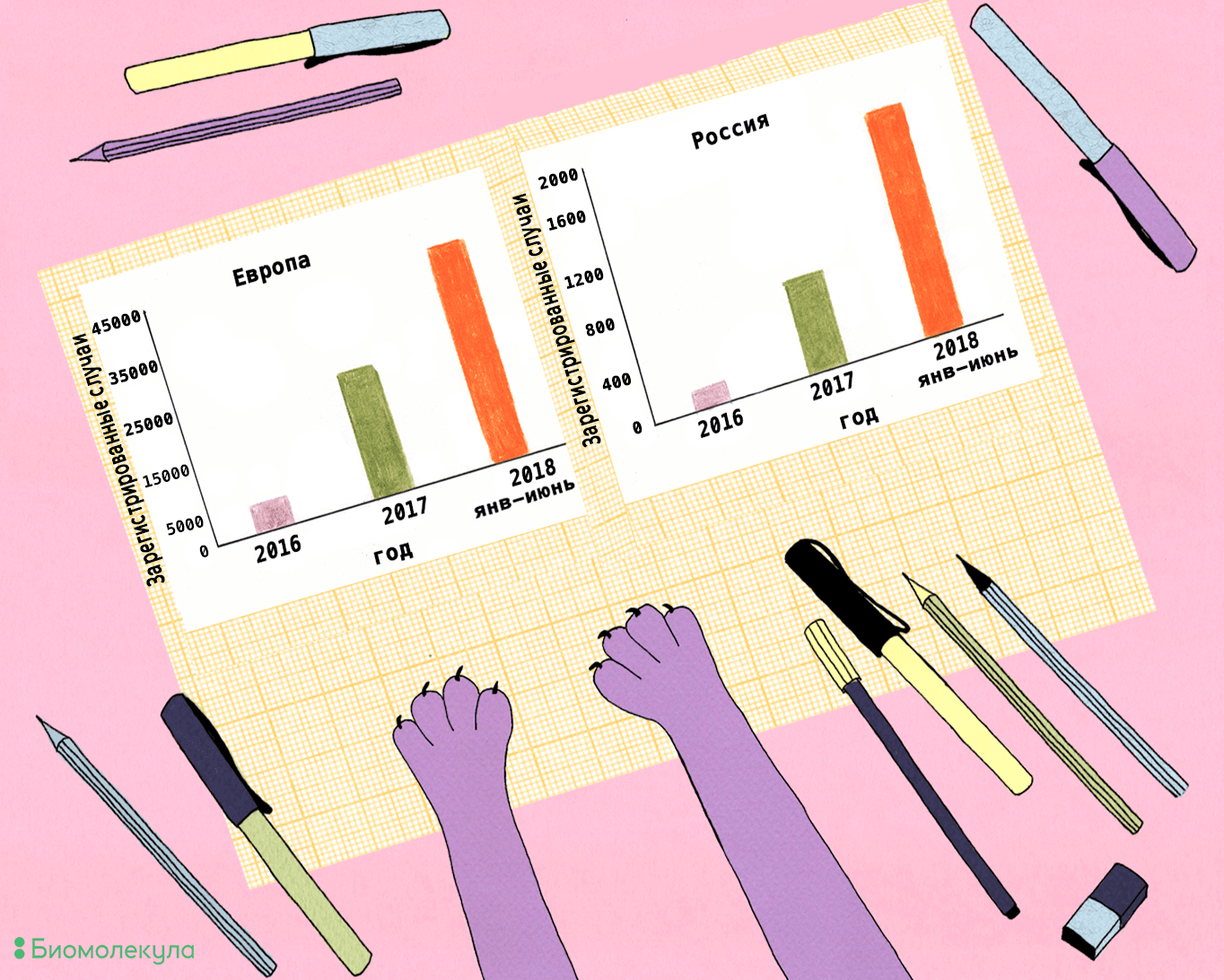
Рисунок 8. Число зарегистрированных случаев кори за последние три года в Европе и России.
рисунок Ирины Ефремовой по Measles cases hit record high in Europe и данным Роспотребнадзора
Коревые вакцины. А есть ли разница?
После того как в 1954 году Эндерс и Пиблс выделили и размножили вирус кори в культуре клеток , начался процесс разработки, тестирования и лицензирования вакцин от кори [48]. Штамм Эдмонстон, названный так в честь юноши, из организма которого его выделили, в дальнейшем использовали для создания множества вакцин по всему миру [49].
О современных клеточных технологиях рассказывает статья «12 методов в картинках: клеточные технологии» [50].
Сегодня для профилактики кори применяют живые аттенуированные вакцины. При их изготовлении используют штаммы вируса кори, полученные из диких штаммов пассажами через разные биологические системы: организмы животных, куриные эмбрионы, культуры клеток. Благодаря мутациям в ходе такой селекции вирусы постепенно теряют свою вирулентность и становятся безопасными для человека, сохраняя при этом способность вызывать иммунный ответ, который защищает привитых людей от вирусов дикого типа.
Первой живой коревой вакциной стала вакцина Edmonston B. Для ее создания Эндерс и коллеги проводили пассажи штамма Эдмонстон в пробирках с культурами клеток почек и амниона человека , после чего адаптировали вирус к куриным эмбриональным клеткам [51]. Вакцина Edmonston B была лицензирована в США в марте 1963 года, одновременно с другим штаммом вируса, который был адаптирован к почечным клеткам собак [52]. Хотя введение Edmonston B пациентам сопровождалось быстро развивающейся лихорадкой (до 39,4 °C и выше у 20–40% вакцинированных) и сыпью (приблизительно у 50% вакцинированных), эффект от вакцины был положительным, а побочные реакции — преходящими. Кроме того, одновременное введение небольшой дозы иммуноглобулина G против кори вместе с вакциной уменьшало лихорадочные проявления и высыпания примерно на 50% [53]. В период с 1963 по 1975 год в США использовали 18,9 млн доз вакцины Edmonston B. На основе штамма Эдмонстон была получена и инактивированная (убитая) вакцина, которую применяли в США с 1963 года по 1967. Эта вакцина также была распространена в некоторых провинциях Канады. Как правило, три дозы убитой вакцины или две дозы убитой плюс одна доза живой вакцины вводились пациентам с месячными интервалами и вызывали относительно небольшое количество нежелательных реакций. Однако от использования убитой вакцины пришлось отказаться, когда установили, что она обеспечивает лишь краткосрочный иммунитет.
Для получения клеточных линий живые клетки выделяют из организмов различными способами: из крови (лейкоциты) или из мягких тканей с помощью ферментов, разрушающих внеклеточный матрикс. В питательную среду можно также поместить кусочки тканей и материалов. Клетки выращивают в специальных питательных средах при постоянной температуре. Массовое культивирование клеток — основа для промышленного производства вирусных вакцин и разнообразных продуктов биотехнологии. Подробнее о культивировании клеток можно прочитать в «Википедии». — Ред.
Большинство современных вакцинных штаммов тоже были получены из штамма Эдмонстон. Конечно, они отличаются друг от друга происхождением, числом и условиями пассажей, субстратом и наличием у вирусов гемолитической активности. Но важно то, что у современных ослабленных вакцин, по сравнению с Edmonston B, частота и тяжесть побочных эффектов значительно ниже. В США были лицензированы вакцинные штаммы Schwarz и Moraten. В Японии применяют собственные ослабленные вакцины против кори: AIK-C, Schwarz F88, CAM-70 и TD97. Штаммы CAM-70 и TD97 входят в число немногих, полученных не на основе Edmonston: их «прародитель» — штамм Tanabe. В Китае с 1965 года применяют местные вакцины на основе штаммов Shanghai-191 и Changchun-47. Штамм Ленинград-16, полученный Смородинцевым, начали использовать в России с 1967 года, и он стал основным вакцинным штаммом вируса кори в Восточной Европе [54].
Современные живые аттенуированные вакцины от кори часто входят в состав комбинированных препаратов: паротитно-коревых, краснушно-коревых или трехкомпонентных (корь, паротит и краснуха). Все эти болезни — вирусные, и каждая их них поражает людей в детском возрасте, потому объединение вакцин против кори, паротита и краснухи в один препарат очень удобно. Такие комбинированные вакцины не уступают по эффективности однокомпонентным, безопасны и позволяют сократить количество инъекций. Самая известная трехкомпонентная вакцина против кори, паротита и краснухи — MMR американской компании Merk.
Вакцина — тренер нашего иммунитета
Иммунный ответ на вакцину во многом похож на тот, который сопровождает естественную коревую инфекцию. Хотя после прививки он развивается на несколько дней раньше, чем в случае заражения вирусом дикого типа, иммунизация затрагивает как гуморальный, так и клеточный иммунитет, вызывает синтез интерферона.
Развился ли иммунный ответ на вакцину, можно понять по накоплению специфических антител в крови. Однако результаты такого анализа крови могут варьировать в зависимости от чувствительности используемых методов. Поствакцинальные титры антител обычно ниже наблюдаемых после естественной инфекции, но со временем снижаются и те, и другие, а иммунологическая память может сохраняться и пожизненно. Иммунитет, выработанный благодаря вакцинам, можно усилить либо повторной вакцинацией, либо заражением вирусом дикого типа. Исследование, проведенное в 2007 году, показало, что антитела к вирусу кори сохраняются в крови пациентов после повторной вакцинации на протяжении 10 лет [55].
Мало изобрести вакцину — нужен план!
Возможность искоренения кори начали обсуждать очень давно. Тем не менее корь всё еще не побеждена, несмотря на разработку эффективных вакцин. Это значит, что недостаточно иметь вакцину, нужно уметь правильно ее применять. Для того чтобы вакцинация была эффективной, ее нужно планировать, разрабатывая действенные стратегии в войне с болезнью, и придерживаться намеченного плана.
Двукратная вакцинация
Опыт борьбы с корью в промышленно развитых странах показал, что для пресечения передачи вируса внутри страны необходима стратегия, подразумевающая введение двух доз вакцины [56]. Многие страны вначале экспериментировали с однократной дозой и только потом, из-за возникновения новых вспышек кори, пришли к ревакцинации. Оказалось, что расходы на уход за заболевшими и контроль над вспышками перевешивают стоимость введения второй дозы вакцины [57].
Благодаря введению двукратной иммунизации были одержаны славные победы над инфекцией. В 2009 году ВОЗ рекомендовала внедрение двухфазного плана иммунизации против кори во всех странах. В настоящее время все развитые и многие развивающиеся страны следуют этой рекомендации.
Возраст, идеальный для вакцинации
Своевременное введение первой дозы вакцины против кори детям младшего возраста — очень важная задача любой программы вакцинации. Вводить первую дозу нужно тогда, когда младенец уже утратил пассивный иммунитет, переданный ему от матери, но сделать это необходимо как можно раньше, чтобы снизить риск заражения ребенка корью.
Если привить ребенка слишком рано, когда его еще защищает пассивный иммунитет, материнские антитела будут мешать организму реагировать на вакцину [58]. В таком случае даже привитые дети рискуют заразиться корью. Однако если промедлить с вакцинацией в регионах, где риск заражения очень велик, многие младенцы могут инфицироваться до получения первой дозы вакцины.
Баланс, учитывающий оба фактора риска, очень важен и во многом определяет результативность программ иммунизации. Например, в США сразу после введения широкомасштабной вакцинации детей два года прививали в 9-месячном возрасте, а потом оказалось, что материнские антитела сохраняются в крови младенцев до 11 месяцев, и многим привитым детям всё еще угрожало заражение. В 1965 году подходящим для вакцинации возрастом сочли 1 год, а всех привитых слишком рано пришлось вакцинировать заново. В 1976 году нормативы снова изменилиь: детей в США стали прививать в 15 месяцев.
Интересно, что на сроки иммунизации детей влияет сам факт вакцинации матерей. Дело в том, что антитела от матерей, переболевших корью, дольше защищают младенцев, чем антитела от привитых матерей. Теперь, когда вакцинация стала рутиной, большинство матерей корью не болеет, время работы пассивного иммунитета сокращается, и из-за этого повышается эффективность первого этапа вакцинации.
Сегодня ВОЗ рекомендует вводить вакцину против кори 9-месячным детям в странах, где высок риск младенческой смертности от кори и существует угроза новых эпидемий. В странах с низким уровнем передачи кори ВОЗ рекомендует вводить первую дозу вакцины в 12 месяцев. К сожалению, уровень иммунизации в России в последние годы падает: более 20% женщин детородного возраста в России не имеют иммунитета к кори [59], заболеваемость детей младше года растет. Подобная ситуация складывается во многих регионах Европы, и рекомендуемый для введения первой коревой вакцины возраст постепенно снижается с 12 до 9 месяцев. Такую тактику борьбы с болезнью уже избрали Австрия и Германия, где первую дозу вакцины предпочитают вводить в 9 и 11 месяцев соответственно. Вторую дозу Национальный календарь прививок РФ рекомендует вводить 6-летним детям.
Группы риска
При планировании обороны необходимо знать свои слабые места. Любой план вакцинации должен учитывать, в каких условиях наиболее вероятны новые вспышки болезни.
Например, люди, которые работают в медицинских учреждениях, подвергаются большему риску заражения корью, чем остальное население. Во время 120 вспышек кори, произошедших в США в период с 1993 по 2001 год, медицинские учреждения становились местами распространения заболевания чаще прочих (24 вспышки) [60]. Защита от кори также важна и для людей, планирующих международные поездки. Особого внимания заслуживают лица с некоторыми хроническими патологиями. Например, онкобольные и ВИЧ-инфицированные люди, заразившись корью, подвергаются повышенному риску серьезных осложнений. Вакцинация от кори, паротита и краснухи рекомендуется всем бессимптомным ВИЧ-инфицированным лицам, у которых нет признаков тяжелой иммуносупрессии (в противном случае им была бы рекомендована вакцинация против кори).
Экстренная вакцинация
Обычно вакцинация, проводимая до контакта с больным корью, обеспечивает лучшую защиту. Однако некоторую степень защиты против болезни можно получить и путем вакцинации после предполагаемого контакта с вирусом.
Живая вакцина против кори, если ввести ее пациенту в течение 72 часов после воздействия на него вируса дикого типа, может предотвратить болезнь или повлиять на тяжесть ее течения. В России, помимо Национального календаря прививок, куда входит двукратная вакцинация от кори, существуют санитарно-эпидемиологические правила СП 3.1.2952-11 «Профилактика кори, краснухи и эпидемического паротита». Они описывают методы борьбы с новыми вспышками болезни, включая и иммунизацию по эпидемическим показателям — вакцинацию непривитых людей в очаге заражения, а также людей, контактировавших с больным (или предположительно больным). Соблюдение СП помогает обеспечивать защиту населения от новых эпидемий.
Международные стратегии сокращения смертности
Очевидно, что для каждой из стран недостаточно истребить корь лишь на своей территории: она непременно придет из другой страны, где вакцинация проводится неэффективно. Это значит, что корь можно победить только объединившись. К концу 2008 года международные усилия по контролю кори уже привели к сокращению предполагаемого количества смертей от кори в мире на 78% [61].
Я боюсь вакцинации
В последние годы здравоохранению становится всё тяжелее бороться с нежеланием родителей вакцинировать детей по личным или религиозным убеждениям. Если раньше люди боялись мора и эпидемий , то теперь источником страха стали прививки, которые продолжают спасать миллионы жизней.
О том, как человечество противостояло болезням до появления вакцин, можно прочесть в двух первых статьях спецпроекта «Вакцинация»: «История вакцинации» [62] и «Мир до и после изобретения вакцин» [63].
Коревым вакцинам тоже не удалось избежать этой участи. Из-за того, что в развитых странах многие уже забыли, что такое корь и к каким последствиям она может привести, число отказов от вакцинации постоянно растет. В обществе, где большинство людей привито от кори, родители начинают считать риск заражения минимальным, а побочные эффекты вакцин — весьма вероятными и опасными. Однако корь крайне заразна и способна найти восприимчивых людей даже в популяции с высоким уровнем иммунизации (см. видео 1). Кроме того, как мы уже знаем, вакцины эффективны не в 100% случаев, и при росте сообществ, отказавшихся от прививок, в условиях активной миграции населения новые вспышки кори там, где она уже была почти побеждена, практически неизбежны.
Мы предлагаем вам разобраться, какие из вероятных побочных эффектов коревых вакцин страшнее самой кори и стόит ли полагаться на удачу, сознательно отказываясь от вакцинации и подвергая опасности заражения не только себя и своих детей, но и множество других людей.
Коревые вакцины относятся к очень эффективным и в то же время безопасным препаратам. Они подходят даже для вакцинации больных людей, если их заболевание протекает не в острой форме. Если же человек серьезно болен, вакцинацию лучше отложить из-за возможного риска ухудшения состояния. В списке противопоказаний к вакцинации от кори также фигурируют беременность, первичные иммунодефициты, серьезные аллергии на неомицин или другие компоненты препарата. Вакцинация должна быть отложена после введения пациенту иммуноглобулинов или других продуктов крови, так как пассивные антитела снижают эффективность вакцины.
Конечно, нежелательные реакции после введения пациентам живых аттенуированных коревых вакцин не исключены, но, как правило, слабо выражены [64]. Разумеется, это не касается реакций, вызванных гиперчувствительностью к компонентам вакцинных препаратов. Обо всех возможных побочных эффектах той или иной вакцины вы можете узнать у производителя.
Некоторые наиболее известные побочные эффекты коревых вакцин перечислены в таблице 2.
| Побочный эффект | Вероятность возникновения вследствие вакцинации от кори, % |
|---|---|
| Высокая температура | 4 |
| Судороги | 0,025–0,3 |
| Аллергическая реакция | 0,0001–0,00035 |
| Тромбоцитопения | 0,0026 |
Повышение температуры тела
Самый распространенный побочный эффект коревых вакцин, лихорадка, обычно появляется через 6–12 дней после прививки, когда репликация вакцинного вируса достигает пика [52]. Вероятность поствакцинального подъема температуры выше 39,4 °C для большинства коревых иммунологических препаратов составляет не более 2–4%. Температура обычно снижается через 1–2 дня.
Судороги
Судороги относят к частым побочным эффектам вакцинации против кори [65]. При этом они не являются признаком инфекции или заболевания центральной нервной системы.
Риск возникновения фебрильных судорог составляет примерно один случай на три–четыре тысячи введенных доз MMR-вакцины, содержащей живые вирусы кори, краснухи и паротита [65]. Этот риск обычно можно исключить уже через 6–14 дней после введения MMR. Вероятность появления судорог у детей несколько повышается после введения четырехкомпонентной вакцины MMRV (лицензирована в 2005 году), дополнительно содержащей вирус ветряной оспы. Сегодня в США обе рекомендуемые дозы коревой вакцины можно вводить в виде MMRV. Однако, учитывая повышенное число судорожных случаев после получения первой дозы MMRV, можно предположить, что более популярной останется вакцина MMR [66]. Повышение температуры тела и появление сыпи также более вероятны при использовании вакцины MMRV.
Аллергия
Реакции гиперчувствительности на коревые вакцины, включая аллергическую сыпь и анафилаксию (острую реакцию организма на аллерген), встречаются редко [67]. Частота анафилаксии колеблется от 1 до 3,5 случаев на миллион доз. Вероятность других реакций гиперчувствительности оценивается приблизительно в 10 случаев на миллион [68]. Для большинства коревых вакцин вирусы выращивают в культурах тканей куриного эмбриона, и долгие годы врачи проявляли озабоченность по поводу безопасности введения этих вакцин детям с аллергией на куриные яйца. При этом, хотя у таких детей и наблюдались редкие случаи анафилаксии, ответственный за эти реакции аллерген в вакцине не был идентифицирован [69]. Большинство детей с гиперчувствительностью к коревой вакцине проявляют признаки аллергии на желатин или неомицин [70].
Тромбоцитопения
В течение нескольких дней после вакцинации может наблюдаться умеренное снижение концентрации тромбоцитов в крови, в редких случаях может развиться идиопатическая тромбоцитопеническая пурпура (ITP). Средняя частота возникновения ITP после вакцинации составляет 2,6 случая на 100 000 детей, получивших первую дозу вакцины против кори. Для вакцины MMR риск этого побочного эффекта оценивается в 1 случай на 40 000 доз вакцины [71]. Как правило, регистрируется легкая форма болезни, которая полностью проходит у 93% детей в течение шести месяцев.
Неподтвержденные страхи
Как уже упоминалось, коревые вакцины относятся к наиболее безопасным и эффективным. Они хорошо переносятся даже в составе многокомпонентных препаратов, их можно вводить ВИЧ-инфицированным без выраженного угнетения иммунитета и пациентам с хроническими заболеваниями вне периода обострения. При этом, как ни странно, большинство мифов о вреде прививок затрагивает именно вакцины против кори. Давайте разберемся, справедливо ли демонизируют коревые вакцины и почему люди до сих пор связывают с ними такие страшные диагнозы, как энцефалит или аутизм.
Энцефалит
Постинфекционный энцефалит — признанное осложнение кори, однако способность ослабленных коревых вакцин вызывать это серьезное заболевание остается не доказанной. Энцефалит у привитых от кори людей регистрируется с частотой примерно один случай на миллион [72]. В то же время ни одно исследование, направленное на выявление рисков развития энцефалита после вакцинации от кори, не дало положительных результатов.
При оценке риска развития энцефалита после введения коревой вакцины важно понимать, что показатели выявления болезни среди привитых людей значительно ниже, чем фоновое распространение энцефалита неизвестной этиологии у невакцинированных детей в популяции. А значит, нельзя утверждать, что вакцина как-то влияет на заболеваемость энцефалитом. Но даже если вакцины против кори и вызывают острый энцефалит (чему нет доказательств), этот показатель по меньшей мере в 1 000 раз ниже, чем после естественной коревой инфекции [73].
SSPE
Уже давно существует озабоченность, что вакцинный вирус кори может вызывать постоянную инфекцию ЦНС. Корни этого страха следует искать в сообщениях об обнаружении SSPE у некоторых вакцинированных людей, ранее корью не болевших. Однако тщательный разбор подобных случаев выявил, что в большинстве своем эти люди ранее переболели кореподобными заболеваниями либо контактировали с вирусом, после чего им ввели пассивные иммуноглобулины [74]. Секвенирование геномов вирусов, изолированных из головного мозга пациентов с SSPE, включая тех, что корью ранее не болели, выявило только вирусы дикого типа [75]. Исследования по контролю SSPE продемонстрировали снижение заболеваемости этим недугом по мере сокращения числа случаев кори, обусловленного вакцинацией. Иными словами, вакцина не провоцирует болезнь, а защищает от нее (рис. 9).

Рисунок 9. Снижение заболеваемости корью и уменьшение количества выявляемых в США случаев SSPE после широкого распространения коревых вакцин.
рисунок Ирины Ефремовой по [86]
В то же время ученые нашли связь между энцефалитами и вакциной, введенной людям с угнетенным иммунитетом. У одного пациента с неопределенным иммунным расстройством в ткани мозга был обнаружен вакцинный вирус кори [76]. Это значит, что у людей с сильным иммунодефицитом возможна прогрессирующая репликация вакцинного штамма и, соответственно, повышен риск серьезных осложнений.
Аутизм
Гипотеза о том, что вакцина MMR против кори, паротита и краснухи может вызывать воспалительные заболевания кишечника и аутизм, была поддержана Эндрю Уэйкфилдом и опубликована в авторитетном медицинском журнале The Lancet [77]. В дальнейшем это не удалось подтвердить ни в одном крупном исследовании, но злополучная статья уже стала причиной снижения охвата вакцинацией населения Великобритании до 83% в 2005 году (при необходимом уровне в 95%). Результат оказался плачевным: если в 1998 году в Великобритании было зарегистрировано 56 случаев кори, то спустя 10 лет это число возросло до 1 348 случаев, два из которых закончились смертью [78].
Подробнее эту историю изложила вторая статья спецпроекта «Вакцинация» — «Мир до и после изобретения вакцин» [63].
Если вы всё еще боитесь вакцин от кори, попробуйте сравнить риски осложнений после самогό заболевания с рисками побочных эффектов живых аттенуированных вакцин. Вероятно, возможность повышения температуры и даже судорог после вакцинации не покажется вам такой ужасной, как раньше. Тем более теперь вы знаете, что некоторые из широко обсуждаемых побочных эффектов вакцин — всего лишь неподтвержденные опасения или даже намеренная ложь. При выборе вакцины внимательно изучите все противопоказания к ее применению. Ваш выбор должен быть осознанным.
Есть куда расти. Коревые вакцины будущего
Сегодня вакцины против кори — это безопасные, высокоэффективные и недорогие препараты. Но они всё еще не идеальны. Несмотря на высокую иммуногенность, эффективность современных коревых вакцин ограничивается в случае их введения младенцам, которые еще не избавились от пассивно приобретенных материнских антител.
Доработки требует и форма выпуска вакцин. Сейчас коревые вакцины представляют собой лиофилизированный порошок, требующий хранения при пониженных температурах (2–8 °C), а восстановленные (переведенные в жидкую форму) и готовые к использованию вакцины можно хранить максимум шесть часов из-за риска бактериального заражения и потери эффективности, вызванной воздействием света и повышенных температур.
Кроме того, дискомфорт в ходе процедуры может быть сдерживающим фактором для пациентов при принятии решения о необходимости вакцинации. Но самое главное, ошибки, допускаемые медицинским персоналом при подготовке инъекций, а также несоблюдение правил хранения и транспортировки препаратов иногда провоцируют нежелательные реакции, которых можно было бы избежать. Безопасное использование имеющихся коревых вакцин требует значительных ресурсов и хорошо обученного медицинского персонала. Хочется надеяться, что разработчики избавят вакцины будущего от подобных обременений.
Альтернативные способы введения коревых вакцин
Возможность внутрикожного (интрадермального) введения вакцин против кори изучали довольно долго и пришли к выводу, что это, вероятно, оптимальная альтернатива принятой сегодня подкожной инъекции. Активная работа ведется над механизмами доставки вакцин в организм с помощью микроигольных пластырей [79]. Растворимые в воде микроигольные пластыри, содержащие вакцину в сухом виде, позволяют препарату быстро проникнуть в кожу. Микроиглы в худшем случае могут причинить лишь небольшой дискомфорт, пластыри легко использовать и перевозить, они не требуют много места для хранения и не создают опасных отходов. Микропластыри уже показали высокий уровень безопасности и иммуногенности в экспериментах с животными.
Другой альтернативой нынешним уколам может стать доставка вакцин через легкие. Исследования, направленные на изучение этого вопроса, ведутся уже более 30 лет и ориентированы на препараты в форме сухого порошка или жидких аэрозолей. Признавая, что применение аэрозоля способно упростить введение коревой вакцины большому числу детей, ВОЗ и Американский Красный Крест совместно с CDC учредили проект, направленный на лицензирование аэрозольного пути введения коревой вакцины [80].
ДНК-вакцины и другие вакцины, не содержащие живого вируса
Поиски возможностей эффективной иммунизации младенцев в более раннем возрасте привели к разработке ДНК-вакцин против кори , обладающих высоким уровнем иммуногенности у младенцев с пассивным иммунитетом. Такие вакцины представляют собой плазмиды, способные проникать в клетки человека и обеспечивать в них синтез того или иного антигена. В ряде исследований было показано, что ДНК-вакцины, кодирующие гемагглютинин и/или F-белок, могут индуцировать выработку продолжительного иммунитета, защищающего человекообразных обезьян или хлопковых крыс от заражения вирусом кори [81]. ДНК-вакцина, кодирующая гемагглютинин вируса кори и гибридные гликопротеины, вызывала длительную и высокоэффективную выработку нейтрализующих антител у потомков иммунизированных против кори мышей, несмотря на высокий уровень пассивных антител в их крови [82].
О ДНК-вакцинах можно прочесть в статье «Что такое ДНК-вакцины и с чем их едят?» [83].
Отдельное направление разработок — рекомбинантные коревые вакцины, которые представляют собой ДНК- или РНК-последовательности, кодирующие H- или F-белок вируса кори и вводимые экспериментальным животным в составе «сторонних» вирусных или бактериальных геномов. Среди носителей ДНК — вирусы осповакцины, вирус парагриппа, аденовирус и различные энтеробактерии. Интересный пример рекомбинантной коревой вакцины — иммуногенные последовательности ДНК, включенные в геном моркови [84]. Экстракт измельченных листьев такой рекомбинантной моркови при внутрибрюшинном введении способен вызывать у мышей образование антител против кори.
Не так давно интерес исследователей привлекла возможность создания пептидных вакцин, содержащих эпитопы известных протективных коревых антигенов — H и F. В результате исследований было установлено, что фрагменты H- и F-белков вируса кори могут действовать как самостоятельные вакцины. Применение подобных вакцин может решить проблему вакцинации детей, еще не потерявших пассивный материнский иммунитет [85].
Что вы выберете: коревую вакцину или корь?
Итак, теперь вы знаете, что корь — это не шутка, а действительно очень серьезное заболевание. Известно вам и то, что лекарств от кори сегодня не существует. Единственное эффективное оружие в борьбе с ней — живые аттенуированные вакцины, а главный пособник кори — отказ от вакцинации. Конечно, только вы можете решать, нужна ли вам прививка от кори. Однако мы просим вас помнить: от вашего выбора зависит здоровье не только ваших детей, но и множества других ваших соседей по планете.
Литература
- Amy A. Parker, Wayne Staggs, Gustavo H. Dayan, Ismael R. Ortega-Sánchez, Paul A. Rota, et. al.. (2006). Implications of a 2005 Measles Outbreak in Indiana for Sustained Elimination of Measles in the United States. N Engl J Med. 355, 447-455;
- Оффит П. Смертельно опасный выбор. Чем борьба с прививками грозит нам всем. М.: АСТ—CORPUS, 2017. С. 17–18;
- Update: measles — United States. (2008). Morbidity and Mortality Weekly Report. 57, 893–896;
- Fine P.E.M. and Mulholland K. Community immunity. In: Vaccines (5th Edition) / ed. by Plotkin S.A., Orenstein W.A., Offit P.A. London: Elsevier/Saunders, 2008;
- Walter A Orenstein, Alan R Hinman. (1999). The immunization system in the United States — The role of school immunization laws. Vaccine. 17, S19-S24;
- ALEXANDER D. LANGMUIR. (1962). Medical Importance of Measles. Arch Pediatr Adolesc Med. 103, 224;
- Коревые вакцины: документ по позиции ВОЗ. (2009). ВОЗ;
- Scheifele D.W. and Forbes C.E. (1973). The biology of measles in African children. East Afr. Med. J. 50, 169–173;
- A. W. HEDRICH. (1930). THE CORRECTED AVERAGE ATTACK RATE FROM MEASLES AMONG CITY CHILDREN*. American Journal of Epidemiology. 11, 576-600;
- Measles in 1992. (1993). WHO Weekly Epidemiol. Rec. 68, 241–243;
- Viggo Bech. (1965). The measles epidemic in Greenland in 1962. Archiv f Virusforschung. 16, 53-56;
- Alpay Azap, Filiz Pehlivanoglu. (2014). Measles. Emerging Infectious Diseases. 347-357;
- J. STOKES, G. M. REILLY, E. B. BUYNAK, M. R. HILLEMAN. (1961). IMMUNOLOGIC STUDIES OF MEASLES1. American Journal of Epidemiology. 74, 293-303;
- Temuri Sh. Morgoshiia. (2017). The contribution of N.F. Filatov the national pediatrics (to the 170 anniversary from the birthday of N.F. Filatov) (1847-1902). Pediatr (SPb). 8, 117-120;
- Black F.L. Measles. In: Evans AS, ed. Viral infections of humans: epidemiology and control (3th Edition). NY: Plenum, 1989. P. 451–465;
- Enders J.F. (1964). Francis Home and his experimental approach to medicine. Bull. Hist. Med. 38, 101–112;
- Panum P.L. (1939). Observation made during the epidemic of measles on the Faroe Islands in the year 1846. Med. Classics. 3, 839–886;
- Васильев В.С. «Пятна Бельского-Филатова-Коплика» — патогномичный симптом кори: история описания, особенности текстуального изложения и оценка ситуации с соавторством. ГрГМУ, 2006;
- JOSEPH GOLDBERGER. (1911). AN EXPERIMENTAL DEMONSTRATION OF THE PRESENCE OF THE VIRUS OF MEASLES IN THE MIXED BUCCAL AND NASAL SECRETIONS. JAMA. LVII, 476;
- J. F. Enders, T. C. Peebles. (1954). Propagation in Tissue Cultures of Cytopathogenic Agents from Patients with Measles.. Experimental Biology and Medicine. 86, 277-286;
- S. L. Katz, M. V. Milovanovic, J. F. Enders. (1958). Propagation of Measles Virus in Cultures of Chick Embryo Cells.. Experimental Biology and Medicine. 97, 23-29;
- Griffin D. Measles virus. In: Fields virology (4th Edition) / ed. by Knipe D.M. and Howley P.M. Philadelphia, PA: Lippincott–Raven, 2001. Р. 1401–1441;
- M. J. Taylor, E. Godfrey, K. Baczko, V. ter Meulen, T. F. Wild, B. K. Rima. (1991). Identification of Several Different Lineages of Measles Virus. Journal of General Virology. 72, 83-88;
- Measles virus nomenclature update. (2012). WHO Wkly. Epidemiol. Rec. 87, 73–80;
- Paul A. Rota, William J. Moss, Makoto Takeda, Rik L. de Swart, Kimberly M. Thompson, James L. Goodson. (2016). Measles. Nat. Rev. Dis. Primers. 2, 16049;
- M. Ludlow, K. Lemon, R. D. de Vries, S. McQuaid, E. L. Millar, et. al.. (2013). Measles Virus Infection of Epithelial Cells in the Macaque Upper Respiratory Tract Is Mediated by Subepithelial Immune Cells. Journal of Virology. 87, 4033-4042;
- Brajesh K. Singh, Andrew L. Hornick, Sateesh Krishnamurthy, Anna C. Locke, Crystal A. Mendoza, et. al.. (2015). The Nectin-4/Afadin Protein Complex and Intercellular Membrane Pores Contribute to Rapid Spread of Measles Virus in Primary Human Airway Epithelia. J. Virol.. 89, 7089-7096;
- Benjamin G. Cocks, Chia-Chun J. Chang, José M. Carballido, Hans Yssel, Jan E. de Vries, Gregorio Aversa. (1995). A novel receptor involved in T-cell activation. Nature. 376, 260-263;
- A. Watanabe, M. Yoneda, F. Ikeda, Y. Terao-Muto, H. Sato, C. Kai. (2010). CD147/EMMPRIN Acts as a Functional Entry Receptor for Measles Virus on Epithelial Cells. Journal of Virology. 84, 4183-4193;
- Подножка для вируса СПИДа;
- Koplik H. (1896). The diagnosis of the invasion of measles from a study of the exanthema as it appears on the buccal mucous membrane. Arch. Pediatr. 13, 918–922;
- William J. Moss, Fernando P. Polack. (2001). Immune Responses to Measles and Measles Vaccine: Challenges for Measles Control. Viral Immunology. 14, 297-309;
- H. Okada, F. Kobune, T. A. Sato, T. Kohama, Y. Takeuchi, et. al.. (2000). Extensive lymphopenia due to apoptosis of uninfected lymphocytes in acute measles patients. Arch. Virol.. 145, 905-920;
- Sowsan F. Atabani, Adriana A. Byrnes, Assan Jaye, I. Michael Kidd, Albert F. Magnusen, et. al.. (2001). Natural Measles Causes Prolonged Suppression of Interleukin‐12 Production. J INFECT DIS. 184, 1-9;
- Katharina Schönberger, Maria-Sabine Ludwig, Manfred Wildner, Benedikt Weissbrich. (2013). Epidemiology of Subacute Sclerosing Panencephalitis (SSPE) in Germany from 2003 to 2009: A Risk Estimation. PLoS ONE. 8, e68909;
- Sonja A. Rasmussen, Denise J. Jamieson. (2015). What Obstetric Health Care Providers Need to Know About Measles and Pregnancy. Obstetrics & Gynecology. 126, 163-170;
- Johan Christiaan Bester. (2016). Measles and Measles Vaccination. JAMA Pediatr. 170, 1209;
- Atkinson W.L. and Markowitz L.E. (1991). Measles and measles vaccine. Semin. Pediatr. Infect. Dis. 2, 100–107;
- G. S. WILSON. (1962). Measles as a Universal Disease. Arch Pediatr Adolesc Med. 103, 219;
- William J. Bellini, Jennifer S. Rota, Luis E. Lowe, Russell S. Katz, Paul R. Dyken, et. al.. (2005). Subacute Sclerosing Panencephalitis: More Cases of This Fatal Disease Are Prevented by Measles Immunization than Was Previously Recognized. J INFECT DIS. 192, 1686-1693;
- LUIZ HORTA-BARBOSA, DAVID A. FUCCILLO, JOHN L. SEVER, WOLFGANG ZEMAN. (1969). Subacute Sclerosing Panencephalitis: Isolation of Measles Virus from a Brain Biopsy. Nature. 221, 974-974;
- B. K. Rima. (1994). The pathogenesis of subacute sclerosing panencephalitis. Rev. Med. Virol.. 4, 81-90;
- Measles. In: Pocket book of hospital care for children: guidelines for the management of common childhood illnesses (2th Edition). Geneva: WHO, 2013. Р. 175–176;
- . (2000). Measles eradication: is it in our future?. Am J Public Health. 90, 1521-1525;
- Robert T. Perry, Jillian S. Murray, Marta Gacic-Dobo, Alya Dabbagh, Mick N. Mulders, et. al.. (2015). Progress Toward Regional Measles Elimination — Worldwide, 2000–2014. MMWR Morb. Mortal. Wkly. Rep.. 64, 1246-1251;
- Bloch A.B., Orenstein W.A., Stetler H.C., Wassilak S.G., Amler R.W., Bart K.J. et al. (1985). Health impact of measles vaccination in the United States. Pediatrics. 76, 524–532;
- Ismael R. Ortega-Sanchez, Maya Vijayaraghavan, Albert E. Barskey, Gregory S. Wallace. (2014). The economic burden of sixteen measles outbreaks on United States public health departments in 2011. Vaccine. 32, 1311-1317;
- John F. Enders, Samuel L. Katz, Milan V. Milovanovic, Ann Holloway. (1960). Studies on an Attenuated Measles-Virus Vaccine. N Engl J Med. 263, 153-159;
- Measles vaccines: report of a WHO Scientific Group. (1963). WHO Tech. Rep. Ser. 263, 5–37;
- 12 методов в картинках: клеточные технологии;
- JOHN F. ENDERS. (1962). Measles Virus. Am J Dis Child. 103, 282;
- FRED R. McCRUMB. (1961). Studies with Live Attenuated Measles-Virus Vaccine. Am J Dis Child. 101, 689;
- Krugman S., Giles J.P., Jacobs A.M., Friedman H. (1963). Studies with a further attenuated live measles-virus vaccine. Pediatrics. 31, 919–928;
- Peradze T.V. and Smorodintsev A.A. (1983). Epidemiology and specific prophylaxis of measles. Rev. Infect. Dis. 5, 487–490;
- Charles W. LeBaron, Judith Beeler, Bradley J. Sullivan, Bagher Forghani, Daoling Bi, et. al.. (2007). Persistence of Measles Antibodies After 2 Doses of Measles Vaccine in a Postelimination Environment. Arch Pediatr Adolesc Med. 161, 294;
- Measles: United States, 1996 and the interruption of indigenous transmission. (1997). MMWR Morb. Mortal. Wkly. Rep. 46, 242–246;
- L PELLETIER. (1998). A benefit-cost analysis of two-dose measles immunization in Canada. Vaccine. 16, 989-996;
- Orenstein W.A., Markowitz L., Preblud S.R., Hinman A.R., Tomasi A., Bart K.J. (1986). Appropriate age for measles vaccination in the United States. Dev. Biol. Stand. 65, 13–21;
- Костинов М.П., Шмитько А.Д., Бочарова И.И., Черданцев А.П., Сависько А.А., Полищук В.Б. (2014). Уровень IgG-антител к вирусу кори в пуповинной крови новорожденных с учетом возраста матерей. «Эпидемиология и инфекционные болезни». 3, 30–34;
- Fuyuen Y. Yip, Mark J. Papania, Susan B. Redd. (2004). Measles Outbreak Epidemiology in the United States, 1993–2001. J INFECT DIS. 189, S54-S60;
- Lara J Wolfson, Peter M Strebel, Marta Gacic-Dobo, Edward J Hoekstra, Jeffrey W McFarland, Bradley S Hersh. (2007). Has the 2005 measles mortality reduction goal been achieved? A natural history modelling study. The Lancet. 369, 191-200;
- История вакцинации;
- Мир до и после изобретения вакцин;
- McLean H., Fiebelkorn A., Temte J., Wallace G.S. (2013). Prevention of measles, rubella, congenital rubella syndrome, and mumps, 2013: summary recommendations of the Advisory Committee on Immunization Practices (ACIP). MMWR Recomm. Rep. 62, 1–34;
- Griffin M.R., Ray W.A., Mortimer E.A., Fenichel G.M., Schaffner W. (1991). Risk of seizures after measles-mumps-rubella immunization. Pediatrics. 88, 881–885;
- Steven J. Jacobsen, Bradley K. Ackerson, Lina S. Sy, Trung N. Tran, Tonia L. Jones, et. al.. (2009). Observational safety study of febrile convulsion following first dose MMRV vaccination in a managed care setting. Vaccine. 27, 4656-4661;
- Carapetis J.R., Curtis N., Royle J. (2001). MMR immunisation: true anaphylaxis to MMR vaccine is extremely rare. BMJ. 323, 869;
- Bohlke K., Davis R.L., Marcy S.M., Braun M.M., DeStefano F., Black S.B. et al. (2003). Risk of anaphylaxis after vaccination of children and adolescents. Pediatrics. 112, 815–820;
- Suleyman Tolga Yavuz, Umit Murat Sahiner, Bulent Enis Sekerel, Ayfer Tuncer, Omer Kalayci, Cansin Sackesen. (2011). Anaphylactic reactions to measles-mumps-rubella vaccine in three children with allergies to hen’s egg and cow’s milk. Acta Paediatrica. 100, e94-e96;
- John M. James, A. Wesley Burks, Paula K. Roberson, Hugh A. Sampson. (1995). Safe Administration of the Measles Vaccine to Children Allergic to Eggs. N Engl J Med. 332, 1262-1266;
- E. K. France, J. Glanz, S. Xu, S. Hambidge, K. Yamasaki, et. al.. (2008). Risk of Immune Thrombocytopenic Purpura After Measles-Mumps-Rubella Immunization in Children. PEDIATRICS. 121, e687-e692;
- Philippe Duclos, Brian J. Ward. (1998). Measles Vaccines. Drug Safety. 19, 435-454;
- Weibel R.E., Caserta V., Benor D.E., Evans G. (1998). Acute encephalopathy followed by permanent brain injury or death associated with further attenuated measles vaccines: a review of claims submitted to the National Vaccine Injury Compensation Program. Pediatrics. 101, 383–387;
- Elpis Mantadakis, Evangelia Farmaki, George R. Buchanan. (2010). Thrombocytopenic Purpura after Measles-Mumps-Rubella Vaccination: A Systematic Review of the Literature and Guidance for Management. The Journal of Pediatrics. 156, 623-628;
- Kenji Miki, Katsuhiro Komase, Charles S. Mgone, Ryuta Kawanishi, Masumi Iijima, et. al.. (2002). Molecular analysis of measles virus genome derived from SSPE and acute measles patients in Papua, New Guinea. J. Med. Virol.. 68, 105-112;
- Ari Bitnun, Patrick Shannon, Andrew Durward, Paul A. Rota, William J. Bellini, et. al.. (1999). Measles Inclusion‐Body Encephalitis Caused by the Vaccine Strain of Measles Virus. CLIN INFECT DIS. 29, 855-861;
- AJ Wakefield, SH Murch, A Anthony, J Linnell, DM Casson, et. al.. (1998). RETRACTED: Ileal-lymphoid-nodular hyperplasia, non-specific colitis, and pervasive developmental disorder in children. The Lancet. 351, 637-641;
- Thomas J. (2010). Paranoia strikes deep: MMR vaccine and autism. Psychiatric Times. 27, 1–6;
- Chris Edens, Marcus L. Collins, James L. Goodson, Paul A. Rota, Mark R. Prausnitz. (2015). A microneedle patch containing measles vaccine is immunogenic in non-human primates. Vaccine. 33, 4712-4718;
- Ana Maria Henao-Restrepo, Michel Greco, Ximena Laurie, Oommen John, Teresa Aguado. (2010). Measles Aerosol Vaccine Project. Procedia in Vaccinology. 2, 147-150;
- Ляшенко В.А. (2007). Экспериментальные коревые вакцины как инструмент исследования вакцинального процесса. «Медицинская иммунология». 1, 7–14;
- A. V. E. Capozzo, K. Ramirez, J. M. Polo, J. Ulmer, E. M. Barry, et. al.. (2006). Neonatal Immunization with a Sindbis Virus-DNA Measles Vaccine Induces Adult-Like Neutralizing Antibodies and Cell-Mediated Immunity in the Presence of Maternal Antibodies. The Journal of Immunology. 176, 5671-5681;
- Что такое ДНК-вакцины и с чем их едят?;
- F BOUCHE, A STEINMETZ, Y YANAGI, C MULLER. (2005). Induction of broadly neutralizing antibodies against measles virus mutants using a polyepitope vaccine strategy. Vaccine. 23, 2074-2077;
- A. V. E. Capozzo, K. Ramirez, J. M. Polo, J. Ulmer, E. M. Barry, et. al.. (2006). Neonatal Immunization with a Sindbis Virus-DNA Measles Vaccine Induces Adult-Like Neutralizing Antibodies and Cell-Mediated Immunity in the Presence of Maternal Antibodies. The Journal of Immunology. 176, 5671-5681;
- Peter M. Strebel, Mark J. Papania, Paul A. Gastañaduy, James L. Goodson. (2018). Measles Vaccines. Plotkin's Vaccines. 579-618.e21.