
Лечение псориаза: иммуносупрессоры, антитела и ультрафиолет
14 сентября 2018
Лечение псориаза: иммуносупрессоры, антитела и ультрафиолет
- 78839
- 12
- 8
И по времени князь Петр иде в баню мытися и повелением девици помазанием помазая язвы и струпы своя и един струп остави непомазан по повелению девицы. Изыде же из бани, ничто же болезни чюяше. На утрии же узрев си все тело здраво и гладко, развие единого струпа, еже бе непомазан по повелению девичю. И дивляшеся скорому исцелению. (Ермолай-Еразм, «Повесть о Петре и Февронии Муромских»)
-
Автор
-
Редакторы
-
Рецензент
Эта статья завершает наш спецпроект по псориазу. Теперь, когда мы уже знакомы с особенностями развития этой патологии, пришло время разобраться с ее лечением. Поиски лекарства для полной и безоговорочной победы над этой болезнью пока не увенчались успехом, но привели к появлению множества терапевтических подходов, позволяющих держать ее в узде. Познакомимся с преимуществами и недостатками основных способов лечения псориаза и попытаемся разобраться, как они работают.
Псориаз
Спецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Предыдущие статьи нашего цикла о псориазе («Псориаз: на войне с собственной кожей» [1], «Псориаз: Т-хелперы, цитокины и молекулярные шрамы» [2], «Генетика псориаза: иммунитет, барьерная функция кожи и GWAS» [3], «Эпигенетика псориаза: молекулярные отметины судьбы» [4]) очень подробно объяснили, насколько сложна этиология этого заболевания: она связана и с особенностями генома, и с эпигенетическими модификациями, и с провоцирующими факторами внешней среды. Вычленить из этого коктейля конкретные причины заболевания еще не удалось, поэтому и его лечение до сих пор не этиотропное (позволяющее повлиять на причину болезни), а патогенетическое — направленное на то или иное звено патогенеза псориаза. К сожалению, о полном излечении пока речи нет, но современные терапевтические подходы позволяют приостановить развитие заболевания и достичь ремиссии.
Чаще всего псориаз контролируют с помощью следующих подходов (рис. 1):
- лекарственной терапии (глюкокортикоиды, аналоги витаминов D и А, цитостатики, антитела к цитокинам, ингибиторы провоспалительных ферментов);
- фототерапии (УФ-лучи самостоятельно или в сочетании с молекулами, повышающими их эффективность).
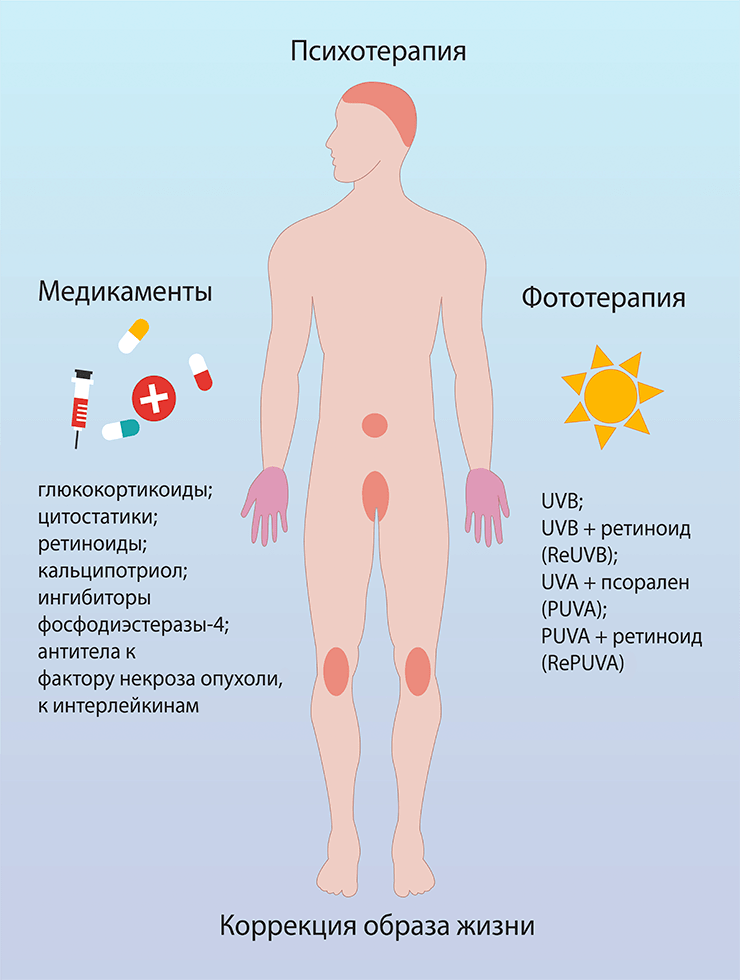
Рисунок 1. Лечение псориаза
рисунок Алёны Золотаренко
Глюкокортикоиды
Гормоны из группы глюкокортикостероидов входят в число антипсориатических препаратов первой линии, то есть тех, с которых лечение начинают. Эти гормоны сокращенно называют глюкокортикоидами, кортикостероидами или даже просто стероидами, хотя последнее не совсем корректно. Название этой группы гормонов отражает их принадлежность к стероидам — веществам, главной и системообразующей молекулой которых является циклопентанопергидрофенантрен. Знаменитые «стероиды» бодибилдеров тоже содержат эту молекулу. К глюкокортикоидам относят лишь те стероиды, что способны повышать уровень глюкозы в крови. Термин же «кортикостероиды» очерчивает круг стероидов, происходящих исключительно из коркового слоя, или кортекса, надпочечников.
Природные гормоны из надпочечников животных — кортизон и гидрокортизон (кортизол) — были выделены еще в первой половине XX века. Благодаря широкому спектру действия на разные процессы в организме (общий обмен веществ, водно-электролитный обмен и др.) их применяли для лечения различных заболеваний. Затем появилась возможность усовершенствовать их путем химического синтеза — чтобы они действовали сильнее и прицельнее. Так появились:
- преднизолон, в четыре раза превосходящий кортизол по глюкокортикоидной (влияющей на обмен глюкозы) активности;
- флудрокортизон, превосходящий кортизол не только по глюкокортикоидной, но и по минералокортикоидной активности;
- бетаметазон, в 25 раз превосходящий кортизол по глюкокортикоидной активности и не влияющий на водно-солевой обмен; структура вещества позволяет применять его местно на коже и слизистых.
Хотя эти гормоны давно известны, ученые лишь приоткрыли завесу тайны над молекулярными основами их действия. Известно, что они проникают внутрь клетки и соединяются со специальными внутриклеточными глюкокортикоидными рецепторами. Комплекс гормон—рецептор транспортируется в ядро, где взаимодействует с участками ДНК GRE (glucocorticoid response elements) в промоторах ряда генов, регулируя таким образом их активность. Стероиды, в частности, контролируют экспрессию генов таких факторов транскрипции, как активаторный белок 1 (AP-1) и ядерный фактор каппа-би (NF-kB). А они, в свою очередь, регулируют работу генов цитокинов, молекул адгезии, протеиназ и других веществ, участвующих в иммунном ответе и воспалении [5].
Глюкокортикоиды — мощные иммуносупрессоры и регуляторы воспаления. На иммунную систему они действуют неизбирательно, вмешиваясь в работу чуть ли не всех ее звеньев. В частности, они влияют на дифференцировку и/или функции макрофагов, нейтрофилов, моноцитов, Т- и В-лимфоцитов. При псориазе глюкокортикоиды оказывают противовоспалительное действие за счет угнетения синтеза простагландинов, лейкотриенов и цитокинов, уменьшения проницаемости кровеносных сосудов для клеток и жидкости, снижения хемотаксиса иммунокомпетентных клеток и их активности, а также подавления активности фибробластов.
Для лечения псориаза кортикостероиды назначают как наружно (мази, кремы, лосьоны, крело — что-то среднее между кремом и лосьоном), так и внутрь (таблетки, растворы и суспензии для инъекций); выбор препарата и его лекарственной формы зависит от стадии и степени тяжести заболевания. Из-за побочных действий этих препаратов их назначение внутрь стараются отложить настолько, насколько это возможно.
Парацельс, известный врач эпохи Ренессанса, утверждал, что лекарство и яд различает лишь доза. Справедливо это и для глюкокортикоидов: при длительном и/или неадекватном их применении повышается риск побочных эффектов. В связи с тем, что эти гормоны влияют на все виды обмена — углеводный, белковый, жировой и минеральный, — злоупотребление ими серьезно нарушает множество процессов в организме. Например, они стимулируют глюконеогенез (образование глюкозы из неуглеводных веществ) в печени, увеличивают концентрацию глюкозы в крови, что может вести к «стероидному» сахарному диабету. По симптомам он схож с сахарным диабетом II типа: постепенное развитие мышечной слабости и зуда кожи, нарушение зрения, изменения нервов и сосудов. Влияние на белковый обмен характеризуется угнетением синтеза и ускорением распада белков, что особенно выражено в коже, мышцах и костях и ведет к атрофии кожи и мышц, замедлению заживления ран. Влияние на обмен жиров заключается в расщеплении жира в тканях конечностей и его накоплении в туловище и лице: формируется так называемое лунообразное лицо.
Однако перечисленные нежелательные эффекты проявляются при применении глюкокортикоидов внутрь. Их нанесение на небольшие участки кожи позволяет избежать системных реакций, хотя и не делает местное применение абсолютно безопасным. Чаще всего при длительном наружном использовании сильных глюкокортикоидов могут наблюдаться телеангиэктазии (расширенные мелкие сосуды), атрофия (истончение) кожи, стероидное акне (прыщи на лице и теле), стрии (растяжки кожи) и кожные инфекции. Если переусердствовать с нанесением сильных гормональных мазей на большие участки кожи, то можно получить и системные побочные эффекты [6].
При всех несомненных преимуществах глюкокортикоидов перед другими лекарствами по части эффективности и доступности, их можно сравнить с дубиной, которой мы лупим по иммунной системе и обмену веществ. Ниже мы обсудим лекарства, более тонко регулирующие иммунные механизмы.
Производные витаминов
Витамины А и D, включая их синтетические варианты, способны подавлять проявления псориаза. Эти вещества связываются с ядерными рецепторами (и по совместительству транскрипционными факторами) RARγ/RXR и VDR/RXR, активируя экспрессию ряда генов, ответственных за дифференцировку и пролиферацию клеток. Один из таких генов кодирует особый цитокин — тимический стромальный лимфопоэтин (TSLP, thymic stromal lymphopoietin), который заставляет антигенпредставляющие дендритные клетки воспитывать Th2- и регуляторные (Treg) клетки в ущерб Th1-клеткам. Мы помним из статьи [2], что для псориаза характерна повышенная активность Th1 и Th17 при сниженной активности Th2 и Treg. Соответственно, предполагалось, что А/D-витаминные средства, активируя синтез TSLP в кератиноцитах и других клетках, могут корректировать этот дисбаланс и уменьшать Th1/Th17-опосредованное аутоиммунное воспаление. Но всё оказалось сложнее: TSLP модулирует иммунные реакции по-разному в зависимости от условий. Гомеостатическую и, вероятно, терапевтическую роли играет короткая изоформа TSLP, в то время как длинная образуется в патологических условиях, включая псориатические бляшки. Активный синтез TSLP с последующим «иммунным перекосом» в сторону Th2-звена провоцирует аллергическое воспаление, характерное для атопического дерматита и астмы. А в воспалительной среде, характерной для псориаза, TSLP (по косвенным данным, длинная форма) с помощью CD40L запускает патологическую IL-23/IL-17-сигнализацию [7], [8]. Поэтому в лечении можно было бы использовать ингибиторы длинной формы TSLP и стимуляторы синтеза короткой (либо ее саму).
Роль TSLP в патогенезе и терапии псориаза еще предстоит уточнить, но в то же время очевидно, что антипсориатические эффекты витаминов A и D обусловлены изменением транскрипции многих других генов — регуляторов дифференцировки и пролиферации клеток [1]. (Здесь я должен принести извинения читателю за весьма скудное понимание исследователями как причин, так и механизмов действия лекарств от некоторых кожных болезней.)
Ретиноиды
К ретиноидам в широком смысле слова причисляют витамин А (ретинол) и его биологически активные производные. Но в медицине так принято называть группу синтетических производных витамина А, служащих для лечения определенных болезней, а не восполнения витаминодефицита. Кожные заболевания с их помощью успешно лечат уже более 40 лет.
Чаще других для лечения псориаза используют ацитретин — ретиноид второго поколения. Как и любой другой препарат этой группы, он подавляет избыточный клеточный рост и кератинизацию — главные характеристики псориатической кожи.
Точный механизм действия ацитретина неизвестен. Судя по всему, ацитретин связывается с рецепторами ретиноевой кислоты — активного метаболита витамина А, образующегося в кератиноцитах, — и запускает характерную для нее сигнализацию [9]. Как это происходит, и почему влияет на течение псориаза, показано на рисунке 2.
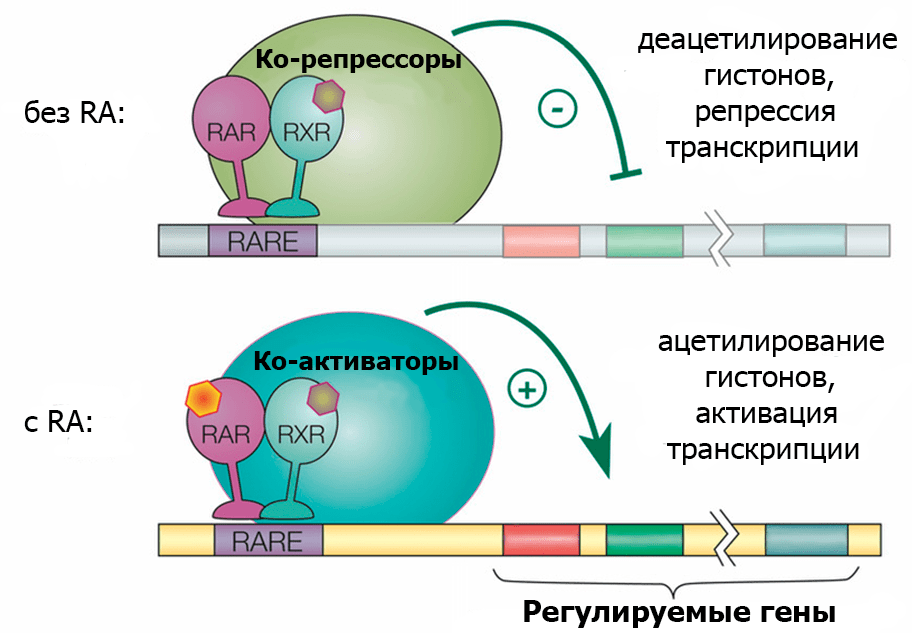
Рисунок 2. Принцип работы ретиноидных рецепторов (на примере связывания ретиноевой кислоты). За восприятие ретиноидных сигналов в клетке отвечают ядерные рецепторы семейства RAR (retinoic acid receptors, RARα–γ). RAR образует пару с другой рецепторной молекулой, RXR (retinoid X receptors, RXRα–γ), и этот комплекс взаимодействует с особыми нуклеотидными последовательностями — RARE (RA response elements) — в регуляторных областях ряда генов. Это взаимодействие модулирует активность многих генов, контролирующих рост, деление и дифференцировку клеток. Несвязанная с ретиноевой кислотой (RA) или другим лигандом пара RAR—RXR, взаимодействуя с RARE, чаще всего подавляет экспрессию близлежащих генов, потому что привлекает ко-репрессоры: они конденсируют хроматин так, что считывание наследственной информации в этом участке становится невозможным. Если же с RAR связана RA, то к такому RARE устремляются активаторы экспрессии генов, «расслабляющие» хроматин для посадки компонентов транскрипционной машины. Ретиноидная сигнализация нормализует структуру эпидермиса путем стимуляции клеточной дифференцировки и эксфолиации.
Хотя ацитретин демонстрирует высокую эффективность при псориазе, заранее сложно сказать, как долго пациенту нужно будет принимать препарат и насколько стойкую ремиссию он даст. Прием ацитретина может сопровождаться нежелательными реакциями, порой непереносимыми: фоточувствительностью, истончением и шелушением кожи по всему телу, хрупкостью ногтей, болями в костях и мышцах, тошнотой и др. Препарат противопоказан при нарушениях работы почек и печени, а из-за тератогенного эффекта — и при беременности. Более того, планировать беременность или становиться донором крови можно не менее чем через три года после завершения терапии. Из-за всех этих ограничений вопрос о назначении системных ретиноидов и их преимуществах перед другими лечебными подходами решается строго индивидуально [10].
Кальципотриол (кальципотриен)
Под таким мудреным названием скрывается синтетический аналог витамина D, а именно — его активной формы, кальцитриола. Эффективность кальципотриола была случайно обнаружена при лечении больных остеопорозом, которые также страдали и от псориаза [11]. Точный механизм действия препарата при псориазе не установлен. Известно, что благодаря своему химическому строению кальципотриол взаимодействует с рецепторами витамина D (VDR), но, в отличие от последнего, на обмен кальция влияет незначительно. Рецептор витамина D представлен в различных клетках, включая лимфоциты и кератиноциты; он относится к семейству стероидных рецепторов и работает чаще в виде гетеродимера с уже знакомым нам RXR. Одна часть VDR взаимодействует с лигандом, другая — с участками VDRE (vitamin D response elements) в промоторах регулируемых генов [12]. Далее события развиваются по аналогичному с ретиноидной регуляцией сценарию. Некоторые мутации VDR связаны с предрасположенностью к псориазу, да и дефицит VDR-сигнализации любой природы может иметь патогенетическое значение при этом заболевании.
При местном использовании кальципотриола у мышей и людей выявили дозозависимое повышение секреции кератиноцитами иммуномодулятора TSLP, причем у людей — его короткой формы (у мышей она не синтезируется) [8], [13].
Вообще, эффекты витамина D множественны, связаны не только с TSLP-сигнализацией и не до конца объяснены. При псориазе же важнее всего то, что в терапевтических дозах он:
- смещает баланс Th1+Th17/Th2-влияний в пользу последних, подавляя синтез Th1/Th17- и ряда других провоспалительных цитокинов, в числе которых IL-2, IFN-γ, TNF, IL-17, IL1β. В то же время активнее размножаются и вырабатывают цитокины клетки Th2, повышается уровень противовоспалительного IL-10, который подавляет активность Th1 и дендритных клеток;
- способствует дифференцировке и иммуносупрессивной активности регуляторных Т-клеток. Витамин D здесь может действовать через посредников — дендритные клетки;
- ограничивает избыточную пролиферацию Т-клеток и кератиноцитов, провоцируя их дифференцировку и апоптоз, а также снижает избыточную продукцию псориазина, которая нарушает дифференцировку кератиноцитов [14], [15];
- предохраняет от вторичных инфекций, стимулируя макрофагальный фагоцитоз [16].
При использовании мази, крема или раствора кальципотриола лечебный эффект появляется в течение двух недель. Существуют препараты, содержащие и кальципотриол, и глюкокортикоид: такая комбинация действует сильнее. Несмотря на все положительные стороны кальципотриола, его не стόит наносить на обширные участки пораженной кожи (более 30%), так как через нее в кровь может проникнуть избыточное количество лекарства, а это грозит повышением содержания кальция в крови и отложением его солей в почках [17].
Цитостатические препараты
Или просто цитостатики. Это противоопухолевые препараты, нарушающие процессы роста и размножения клеток, особенно быстро делящихся. Очевидно, что чаще всего их применяют для уничтожения злокачественных опухолей. Но поскольку при псориазе кератиноциты, подстегиваемые большим количеством иммунных клеток и цитокинов, делятся как угорелые, для его лечения тоже предложили использовать цитостатики, а точнее — метотрексат, циклоспорин и такролимус. Последние два препарата к этой группе относят не всегда, так как они всё же больше влияют на функции, чем на деление чувствительных клеток. Зато все три препарата можно назвать иммуносупрессорами.
Метотрексат относится к группе антиметаболитов — молекул, которые похожи по химической структуре на вещества, родные для нашего организма, и потому могут занять их место в биохимических процессах и привести к нарушению клеточных функций. Это всё равно что заменить одно из автомобильных колес колесом того же диаметра, но от велосипеда: вроде, всё то же, но далеко не уедешь.
Метотрексат активен в отношении быстро пролиферирующих клеток (в том числе клеток кожи), находящихся в S-фазе клеточного цикла (рис. 3). Но с этим связано и его губительное действие на костный мозг, слизистые оболочки желудочно-кишечного тракта и мочевыводящих путей [6], [18]. Универсальный механизм его работы таков. Для синтеза ДНК организму необходима тетрагидрофолиевая кислота, которая образуется с помощью фермента дигидрофолатредуктазы. Метотрексат блокирует работу этого фермента, притворяясь его субстратом, дигидрофолатом. Кроме того, он ингибирует и другие ферменты, необходимые для синтеза нуклеотидов. В результате подавляются синтез и репарация ДНК, нарушается митоз. Описаны и более специфические механизмы влияния метотрексата на активность лимфоцитов [19].
Деликатнее работает иммуносупрессор циклоспорин. Более 40 лет назад его выделили из почвенных грибков и чуть позже дали на вооружение врачам, которые начали его применять для лечения псориаза. Циклоспорин избирательно блокирует фосфатазную активность кальциневрина в фазах G0 или G1 клеточного цикла T-лимфоцитов. Этот фермент активирует (дефосфорилирует) транскрипционные факторы NFAT, необходимые для синтеза IL-2, IFN-γ и других цитокинов — факторов роста и созревания Т-лимфоцитов [20]. Циклоспорин также мешает экспрессии генов IL-3, IL-4, IL-5, гранулоцитарно-макрофагального колониестимулирующего фактора и TNF. Говоря проще, этот препарат борется с воспалением, обусловленным активацией Т-клеток. Но важно отметить, что он не блокирует синтез цитокинов лимфоцитами раз и навсегда. При снижении его концентрации всё возвращается на круги своя. Более того, в отличие от метотрексата, циклоспорин не подавляет гемопоэз, а в отличие от глюкокортикоидов, не парализует сразу большинство иммунных процессов. Тем не менее его иммуносупрессивного действия хватает для повышения у пациентов риска развития инфекций, паразитарных инвазий и опухолей (особенно лимфом и злокачественных новообразований кожи).
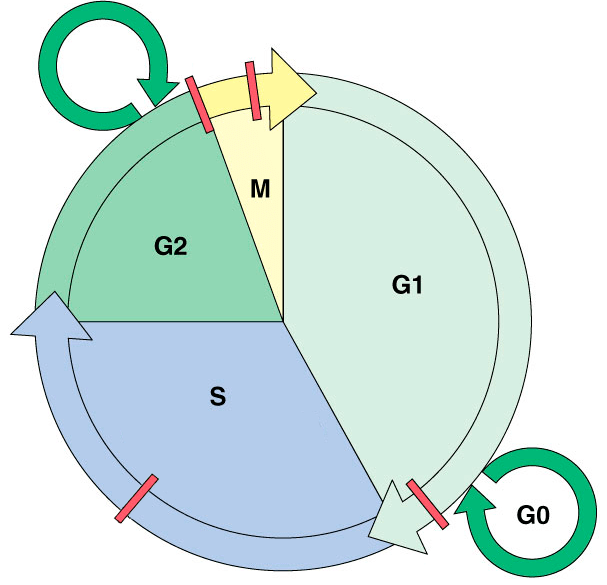
Рисунок 3. Клеточный цикл. M — митоз (деление клетки); S — синтетическая фаза (репликация ДНК); G1 и G2 (Gap 1/2) — пре- и постсинтетическая фазы; G0 — выход из клеточного цикла (временный/постоянный). Красные прямоугольники — контрольные точки (checkpoints) клеточного цикла.
The cell cycle: DNA replication and mitosis, с дополнением из [43]
Другой ингибитор кальциневрина — такролимус — можно применять местно. Этот макролид, производимый стрептомицетами, подавляет активность Т-лимфоцитов так же, как и циклоспорин. Помимо этого такролимус тормозит высвобождение медиаторов воспаления из эозинофилов, базофилов и тучных клеток (тканевых базофилов). Клетки Лангерганса под его влиянием меньше экспрессируют FcεRI (высокоаффинный поверхностный рецептор иммуноглобулина Е), что подавляет их активность и презентацию антигенов Т-лимфоцитам. Такролимус — хорошая альтернатива местным глюкокортикоидам, поскольку он не нарушает синтез коллагена и не вызывает атрофии кожи. К побочным эффектам препарата можно отнести повышение вероятности возникновения кожных инфекций, зуд, отеки и фоточувствительность. Однозначных данных о повышении риска злокачественных новообразований кожи на фоне применения такролимуса пока нет [21], [22].
Ингибиторы фактора некроза опухоли
Фактор некроза опухоли альфа (TNF-α, или просто TNF) считают главным инициатором воспаления. В пораженной псориазом коже TNF секретируют Т-клетки и дендритные клетки. Он стимулирует синтез провоспалительных цитокинов IL-1, IL-2, IL-6, IL-8 и IFN-γ, вызывает экспрессию молекул адгезии на стенках кровеносных сосудов, способствуя привлечению иммуноцитов из кровяного русла в кожу, стимулирует производство кератиноцитами других медиаторов воспаления, активирует макрофаги, дендритные и Т-клетки.
Для ингибирования TNF применяют моноклональные антитела (инфликсимаб, адалимумаб) и гибридные белки (этанерцепт) [5], [23].
Моноклональные антитела — антитела, произведенные одним клоном клеток, берущим свое начало от одной плазматической клетки. Соединяясь с белком или другим антигеном, к которому они имеют сродство, антитела мешают ему выполнять свои функции. Лекарства из этой группы носят очень странные названия, оканчивающиеся на «-маб» (monoclonal antibody). А буквы перед «-маб» позволяют понять происхождение этих молекул: «-омабы» — полностью мышиные, «-ксимабы» — химерные, «-зумабы» — гуманизированные, «-умабы» — полностью человеческие антитела . Моноклональные антитела к TNF (рис. 4) влияют на иммунные реакции, которые изменяют уровень молекул адгезии, ответственных за миграцию лейкоцитов к очагам воспаления. Инфликсимаб вводится внутривенно, адалимумаб — подкожно.
Для препаратов, зарегистрированных после июня 2017 года, этот принцип упразднили, потому что с развитием биотехнологии появилось много комбинированных вариантов антител и возникла проблема выбора более подходящего названия [45]. — Ред.
Среди новых (применительно к обыкновенному псориазу) молекул можно выделить цертолизумаб пэгол. Это гуманизированный ПЭГилированный Fab-фрагмент антитела к TNF. Связывание с ПЭГ снижает иммуногенность, улучшает распределение в пораженных тканях и продляет жизнь молекулы в кровяном русле, а отсутствие Fc-фрагмента человеческого IgG1 меняет ее профиль цитотоксичности и затрудняет проникновение через плаценту, что может дать цертолизумабу преимущество перед одногруппниками в лечении беременных [24]. В фазе III клинических исследований препарат в дозировке 200 мг не уступил по эффективности этанерцепту, а в дозировке 400 мг — превзошел его, причем без ухудшения переносимости [25].
Гибридный белок этанерцепт действует немного иначе — как ловушка для TNF. Дело в том, что существуют два типа рецепторов TNF: рецепторы на лейкоцитах, соединение TNF с которыми запускает иммунный ответ, и растворимые рецепторы, циркулирующие в кровяном русле, которые оттягивают на себя TNF и тем самым уменьшают иммунный ответ. Как раз под последние и «подделывается» этанерцепт (рис. 4), но, благодаря Fc-фрагменту человеческого IgG1, он может дольше находиться в кровяном русле и дольше оставаться эффективным.
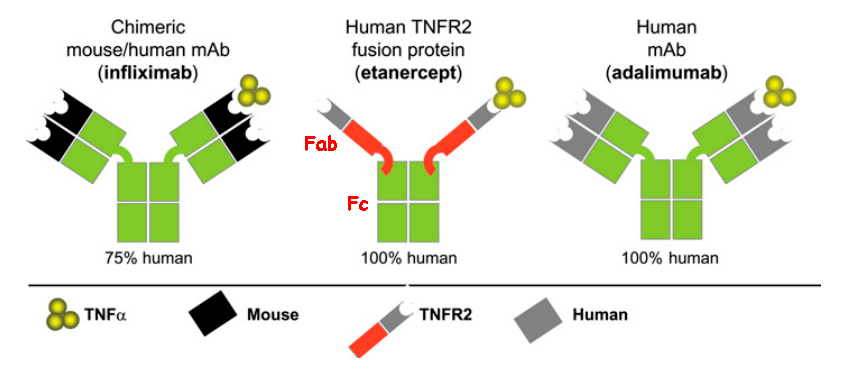
Рисунок 4. Примеры блокаторов TNF. Инфликсимаб — химерное (мышино-человеческое) моноклональное антитело к TNF. Адалимумаб — полностью человеческое моноклональное антитело. Этанерцепт — гибрид, состоящий из двух растворимых рецепторов TNF (p75) и Fc-фрагмента человеческого IgG1. Fab — антигенсвязывающий фрагмент антитела.
Одним из молекулярных механизмов терапевтического действия TNF-ингибиторов может быть перестройка эпигенетических процессов. Например, в ходе лечения этанерцептом или адалимумабом в крови частично корректируются метильные профили ДНК, меняется продукция десятков типов микроРНК [4].
Поскольку TNF участвует во множестве биологических процессов, подавление его сигнализации не может быть безобидным. Ингибиторы TNF иммуногенны (их эффективность со временем падает из-за выработки антител к ним), противопоказаны в случае тяжелых инфекций (например, туберкулеза) и могут провоцировать частые инфекции кожи и слизистых, хотя по этому пункту ученые ведут споры, ежегодно публикуя обширные статистические работы как в поддержку [26], так и в опровержение этого [27].
Ингибиторы интерлейкинов
Ингибиторы интерлейкинов фактически действуют так же, как и ингибиторы TNF, и тоже представляют собой моноклональные антитела, но связываются они уже с интерлейкинами. Поскольку популяция клеток Тh17 играет ключевую роль в возникновении псориаза, а цитокин IL-17 специфичен для иммуноопосредованных воспалительных заболеваний (псориаза, болезни Крона, ревматоидного артрита и др.), моноклональные антитела к IL-17 бьют по цели точнее, чем ингибиторы TNF. С IL-17А взаимодействуют секукинумаб и иксекизумаб, а с рецептором IL-17 — бродалумаб.
Моноклональные антитела к субъединицам IL-12 и/или IL-23 тоже эффективно подавляют деятельность Тh17 и Тh1. В эту группу препаратов входят широко известный устекинумаб и относительно недавно одобренная к применению в США и Евросоюзе молекула гуселькумаб [28].
Поскольку ингибиторов интерлейкинов появляется всё больше, приходится регулярно сравнивать их эффективность. Так, одно из исследований 2018 года выстроило препараты по мере снижения эффективности в таком порядке: иксекизумаб и бродалумаб → секукинумаб → устекинумаб [29]. Однако препараты могут проявлять разную эффективность при разных исходных данных, таких как возраст, форма и тяжесть псориаза, сопутствующие болезни и др. А эти исследования им только предстоит пройти.
Моноклональные антитела к интерлейкинам произвели революцию в лечении псориаза, но, к сожалению, эти лекарства отличает очень высокая цена. Поэтому, несмотря на высокую эффективность в клинических исследованиях, они пока остаются малодоступными для широкого круга больных. Нежелательные реакции при применении этой группы препаратов и ингибиторов TNF схожи [27], [30].
Исследователи не ограничились существующим набором молекул и продолжают поиск более эффективных и при этом не менее безопасных. Или не менее эффективных, но более безопасных и/или экономически выгодных. Недавно завершилась фаза 2b клинических исследований новой гуманизированной молекулы — бимекизумаба [31]. Она блокирует сразу две разновидности интерлейкина-17 — IL-17A и IL-17F. Если сравнивать с традиционной блокировкой IL-17A, такая двойная нейтрализация сильнее подавляет экспрессию провоспалительных генов и миграцию иммунных клеток. К 2020 году должна завершиться III фаза клинических исследований бимекизумаба, с бóльшим числом участников, продленным сроком лечения и секукинумабом в качестве контрольного препарата.
Ингибиторы фосфодиэстеразы-4
Фосфодиэстераза-4 (PDE4) — это основная фосфодиэстераза, регулирующая обмен циклического аденозинмонофосфата (цАМФ) в иммунных клетках. Высокая концентрация цАМФ в клетках приводит к депонированию кальция, направлению активности ферментов и цитокиновой сигнализации в сторону подавления воспаления: выработка TNF, IL-23, IL-17 снижается, а IL-10 — повышается. PDE4 разрушает цАМФ, чем стимулирует воспаление, а потому служит одной из терапевтических мишеней при псориазе.
Показано, что апремиласт ингибирует PDE4, что в конечном счете ведет к ослаблению воспалительной реакции. Преимуществом апремиласта считают то, что он подавляет воспаление на более раннем этапе, чем моноклональные антитела к TNF (инфликсимаб, адалимумаб), IL-12/23 (устекинумаб) или IL-17A (секукинумаб, иксекизумаб) [32].
Из нежелательных реакций при приеме апремиласта чаще всего фиксируют расстройства пищеварения и инфекции дыхательных путей [33]. Эффективность апремиласта оценивают лишь к концу первого полугодия лечения, что в сочетании с его высокой стоимостью и доступностью более дешевых противопсориатических препаратов говорит не в пользу его назначения.
Сводная схема таргетированных терапевтических воздействий на основные звенья патогенеза псориаза приведена на рисунке 5. Если говорить о сравнительной эффективности ингибиторов TNF, интерлейкинов и PDE4, то крупное исследование 2018 года показало, что с помощью ингибиторов интерлейкинов или инфликсимаба можно избавиться от псориатических бляшек быстрее, чем с помощью этанерцепта, адалимумаба или апремиласта. Инфликсимаб проигрывает ингибиторам интерлейкинов по двум параметрам: его нужно вводить внутривенно, и на фоне его применения чаще развиваются инфекционные заболевания [29].
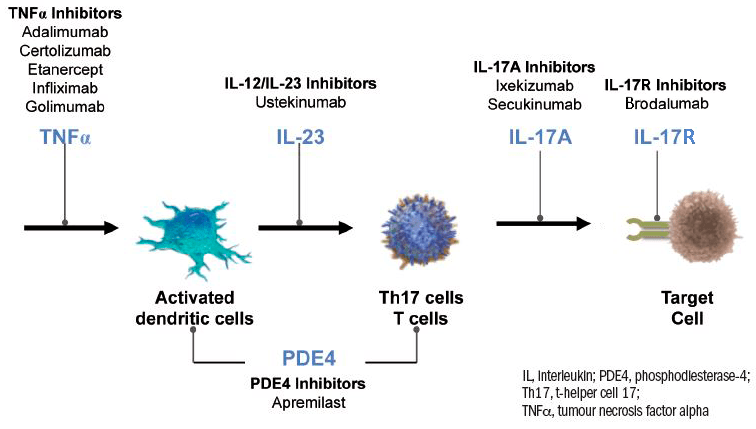
Рисунок 5. Патогенетическая терапия псориаза. Объяснения даны в тексте.
сайт keyopinions.info, рисунок с изменениями
Фототерапия
В борьбе с псориазом часто задействуют и физические факторы, а именно — ультрафиолетовое (УФ) излучение. Облучение пораженных участков кожи УФ определенной длины волны (UVА, UVB) называют фототерапией. UVB-терапия может быть широкополосной (280–320 нм) и узкополосной средневолновой (NB-UVB, 311 нм). Второму варианту практически идентична UVB-терапия, проводимая эксимерным лазером (308 нм). Эта группа методов не требует применения каких-либо специальных медикаментов и не противопоказана даже детям.
UVА-терапию чаще используют в виде модификации PUVA — облучения длинноволновым УФ (320–400 нм) с применением фотосенсибилизаторов из группы псораленов. Фотосенсибилизаторы — это вещества, повышающие чувствительность клеток к воздействию УФ. Они могут применяться перорально или наружно, в том числе в виде псораленовых ванн. Из-за повышенной (относительно UVB-терапии) канцерогенности к PUVA прибегают при тяжелых формах псориаза, его прогрессии и в случае неэффективности других средств.
Фототерапия может действовать на течение псориаза несколькими способами, которые обычно делят на четыре категории: индукция апоптоза, изменение цитокиновой сигнализации, иммуносупрессия, прочие механизмы (см. врезку) [34]. Однако эти эффекты во многом взаимосвязаны и взаимообусловлены.
Выбор лечебного подхода
Любой лечебный подход преследует три главных цели: уменьшение баллов PASI (индекса охвата и тяжести псориаза), повышение качества жизни и максимальная продолжительность ремиссии. Достичь этих целей можно только под руководством грамотного врача, который обязан учитывать многообразие эффектов лечебного агента, особенности его метаболизма [3] и возможное взаимодействие с другими лекарственными средствами.
В лечении псориаза, как и большинства заболеваний, всё очень и очень индивидуально. То, что работает у одного, другому может абсолютно не подойти. Тем не менее врачи разработали общую стратегию ведения пациентов с псориазом (рис. 7).
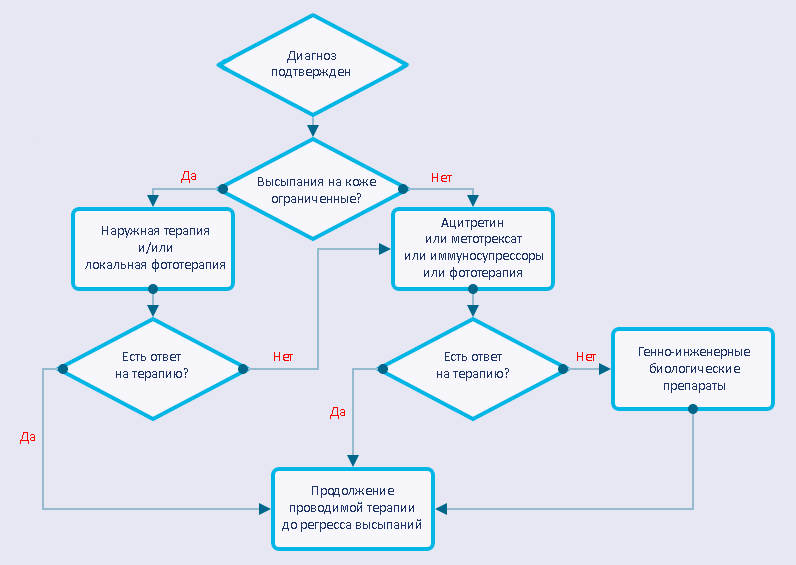
Рисунок 7. Стандартный алгоритм ведения пациента с подтвержденным диагнозом «псориаз»
Рубрикатор клинических рекомендаций Минздрава РФ, рисунок с изменениями
Выбор того или иного лечебного подхода определяется степенью тяжести псориаза. А объективным критерием тяжести псориаза, принятым в большинстве стран мира, служит PASI. При значении индекса до 10 псориаз считается легким, от 10 до 20 — средней тяжести, более 20 — тяжелым. У большинства пациентов PASI не превышает 10, и в таких случаях ограничиваются наружным лечением. Превышение 10 баллов служит показанием для назначения метотрексата, циклоспорина и ацитретина [40]. В некоторых случаях целесообразно комбинировать метотрексат или ацитретин с фототерапией (UVВ, PUVA), что позволяет одновременно снизить дозировку препаратов, частоту побочных эффектов и канцерогенный потенциал фототерапии [41], [42]. В случае неэффективности, непереносимости побочных эффектов или при противопоказаниях к применению перечисленных подходов прибегают к биологическим препаратам (моноклональным антителам).
Вносить свою лепту в тяжесть болезни и длительность ремиссии могут и вспомогательные, немедикаментозные подходы. Обычно врачи рекомендуют снижение уровня стресса, соблюдение диеты, климатотерапию (курорты с сероводородными, кремнистыми и радоновыми водами) и применение увлажняющих средств.
Заключение
Даже если просто просмотреть заголовки в этой статье, станет ясно: разнообразие видов терапии псориаза настолько велико, что позволяет более-менее индивидуализировать лечение. Но ни один из существующих подходов не лишен недостатков, порой весьма серьезных.
Псориаз — одна из самых распространенных кожных болезней, которая до сих пор окружена множеством загадок и сильно влияет на жизнь больных. Поэтому пациенты с этим диагнозом больше, чем многие другие страдающие хроническими воспалительными заболеваниями, могут рассчитывать на изобретение той самой «волшебной таблетки» (а скорее, нескольких), которая наконец заставит забыть о недуге навсегда. В последние годы новая информация о патогенезе, генетике и эпигенетике псориаза появляется особенно быстро. Это позволяет постепенно переходить от неизбирательной «тяжелой артиллерии» к специфичным средствам, бьющим по конкретным звеньям патогенеза. Каждый год в мире синтезируются новые молекулы, но лишь единицы из них, пройдя длинный путь проверок безопасности и эффективности, достигают организма больного. При этом каждый новый одобренный препарат хоть в чём-то превосходит старые, приближая нас к моменту, когда псориаз станет очередной побежденной болезнью в истории медицины.
Литература
- Псориаз: на войне с собственной кожей;
- Псориаз: Т-хелперы, цитокины и молекулярные шрамы;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Эпигенетика псориаза: молекулярные отметины судьбы;
- Karow T. Allgemeine und Spezielle Pharmakologie und Toxikologie. Verlag: Dr. med. Thomas Karow, 2012. — 1275 p.;
- Кубанова А.А., Кисина В.И., Блатун Л.А., Вавилов А.М. и др. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей / под общ. ред. Кубановой А.А., Кисиной В.И. М.: «ЛитТерра», 2005. — 890 с.;
- Elisabetta Volpe, Lucia Pattarini, Carolina Martinez-Cingolani, Stephan Meller, Marie-Helene Donnadieu, et. al.. (2014). Thymic stromal lymphopoietin links keratinocytes and dendritic cell–derived IL-23 in patients with psoriasis. Journal of Allergy and Clinical Immunology. 134, 373-381.e4;
- Katerina Tsilingiri, Giulia Fornasa, Maria Rescigno. (2017). Thymic Stromal Lymphopoietin: To Cut a Long Story Short. Cellular and Molecular Gastroenterology and Hepatology. 3, 174-182;
- Ferdinand Marlétaz, Linda Z. Holland, Vincent Laudet, Michael Schubert. (2006). Retinoic acid signaling and the evolution of chordates. Int. J. Biol. Sci.. 38-47;
- United States pharmacopeia dispensing information. Drug information for the health care professional. 24th ed. V. 1.plus updates. Thomson/Micromedex. Greenwood Village, CO, 2004. — p. 21;
- Morimoto S. and Kumahara Y. (1985). A patient with psoriasis cured by 1-α-hydroxyvitamin D3. Med. J. Osaka Univ. 35 (3–4), 51–54;
- Igor Orlov, Natacha Rochel, Dino Moras, Bruno P Klaholz. (2012). Structure of the full human RXR/VDR nuclear receptor heterodimer complex with its DR3 target DNA. The EMBO Journal. 31, 291-300;
- M. Li, P. Hener, Z. Zhang, S. Kato, D. Metzger, P. Chambon. (2006). Topical vitamin D3 and low-calcemic analogs induce thymic stromal lymphopoietin in mouse keratinocytes and trigger an atopic dermatitis. Proceedings of the National Academy of Sciences. 103, 11736-11741;
- Ananya Datta-Mitra, Suravi Raychaudhuri, Anupam Mitra. (2014). Immunomodulatory mechanisms of action of calcitriol in psoriasis. Indian J Dermatol. 59, 116;
- A Ekman, J Vegfors, C Eding, C Enerbäck. (2017). Overexpression of Psoriasin (S100A7) Contributes to Dysregulated Differentiation in Psoriasis. Acta Derm Venerol. 97, 441-448;
- Luigi Barrea, Maria Cristina Savanelli, Carolina Di Somma, Maddalena Napolitano, Matteo Megna, et. al.. (2017). Vitamin D and its role in psoriasis: An overview of the dermatologist and nutritionist. Rev Endocr Metab Disord. 18, 195-205;
- Дерматовенерология. Клинические рекомендации / под ред. Кубановой А.А. М.: «ДЭКС-Пресс», 2010. — 428 с.;
- Биохимия: Учеб. для вузов / под ред. Северина Е.С. М.: «ГЭОТАР-Медиа», 2003. — 779 с.;
- J. A. M. Wessels, T. W. J. Huizinga, H.-J. Guchelaar. (2007). Recent insights in the pharmacological actions of methotrexate in the treatment of rheumatoid arthritis. Rheumatology. 47, 249-255;
- Satoshi Matsuda, Shigeo Koyasu. (2000). Mechanisms of action of cyclosporine. Immunopharmacology. 47, 119-125;
- T.C. Lucka, D. Pathirana, A. Sammain, F. Bachmann, S. Rosumeck, et. al.. (2012). Efficacy of systemic therapies for moderate-to-severe psoriasis: a systematic review and meta-analysis of long-term treatment. Journal of the European Academy of Dermatology and Venereology. 26, 1331-1344;
- Alan Menter, Neil J. Korman, Craig A. Elmets, Steven R. Feldman, Joel M. Gelfand, et. al.. (2009). Guidelines of care for the management of psoriasis and psoriatic arthritis. Journal of the American Academy of Dermatology. 61, 451-485;
- Róbert Kui, Brigitta Gál, Magdolna Gaál, Mária Kiss, Lajos Kemény, Rolland Gyulai. (2016). Presence of antidrug antibodies correlates inversely with the plasma tumor necrosis factor (TNF)-α level and the efficacy of TNF-inhibitor therapy in psoriasis. J Dermatol. 43, 1018-1023;
- Enrique Soriano, Maria Laura Acosta Felquer, Javier Rosa. (2016). An evidence-based review of certolizumab pegol in the treatment of active psoriatic arthritis: place in therapy. OARRR. 37;
- Mark Lebwohl, Andrew Blauvelt, Carle Paul, Howard Sofen, Jolanta Węgłowska, et. al.. (2018). Certolizumab pegol for the treatment of chronic plaque psoriasis: Results through 48 weeks of a phase 3, multicenter, randomized, double-blind, etanercept- and placebo-controlled study (CIMPACT). Journal of the American Academy of Dermatology. 79, 266-276.e5;
- Allison S. Dobry, Charles P. Quesenberry, G. Thomas Ray, Jamie L. Geier, Maryam M. Asgari. (2017). Serious infections among a large cohort of subjects with systemically treated psoriasis. Journal of the American Academy of Dermatology. 77, 838-844;
- André Vicente Esteves de Carvalho, Rodrigo Pereira Duquia, Bernardo Lessa Horta, Renan Rangel Bonamigo. (2017). Efficacy of Immunobiologic and Small Molecule Inhibitor Drugs for Psoriasis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Drugs R D. 17, 29-51;
- Kristian Reich, April W. Armstrong, Peter Foley, Michael Song, Yasmine Wasfi, et. al.. (2017). Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: Results from the phase III, double-blind, placebo- and active comparator–controlled VOYAGE 2 trial. Journal of the American Academy of Dermatology. 76, 418-431;
- Anne M. Loos, Shanshan Liu, Celia Segel, Daniel A. Ollendorf, Steven D. Pearson, Jeffrey A. Linder. (2018). Comparative effectiveness of targeted immunomodulators for the treatment of moderate-to-severe plaque psoriasis: A systematic review and network meta-analysis. Journal of the American Academy of Dermatology. 79, 135-144.e7;
- Agnieszka Wasilewska, Marta Winiarska, Małgorzata Olszewska, Lidia Rudnicka. (2016). Interleukin-17 inhibitors. A new era in treatment of psoriasis and other skin diseases. pdia. 4, 247-252;
- Kim A. Papp, Joseph F. Merola, Alice B. Gottlieb, Christopher E.M. Griffiths, Nancy Cross, et. al.. (2018). Dual neutralization of both interleukin 17A and interleukin 17F with bimekizumab in patients with psoriasis: Results from BE ABLE 1, a 12-week randomized, double-blinded, placebo-controlled phase 2b trial. Journal of the American Academy of Dermatology. 79, 277-286.e10;
- Stacy L. Haber, Sarah Hamilton, Mark Bank, Shi Yun Leong, Evelyn Pierce. (2016). Apremilast. Ann Pharmacother. 50, 282-290;
- Kim Papp, Jennifer C Cather, Les Rosoph, Howard Sofen, Richard G Langley, et. al.. (2012). Efficacy of apremilast in the treatment of moderate to severe psoriasis: a randomised controlled trial. The Lancet. 380, 738-746;
- Tami Wong, Leon Hsu, Wilson Liao. (2013). Phototherapy in Psoriasis: A Review of Mechanisms of Action. J Cutan Med Surg. 17, 6-12;
- S. Haupt. (2003). Apoptosis - the p53 network. Journal of Cell Science. 116, 4077-4085;
- Terrence C. Keaney, Robert S. Kirsner. (2010). New Insights into the Mechanism of Narrow-Band UVB Therapy for Psoriasis. Journal of Investigative Dermatology. 130, 2534;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- Olga María Palomino. (2015). Current knowledge in Polypodium leucotomos effect on skin protection. Arch Dermatol Res. 307, 199-209;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- U. Mrowietz, E.M.G.J. de Jong, K. Kragballe, R. Langley, A. Nast, et. al.. (2014). A consensus report on appropriate treatment optimization and transitioning in the management of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 28, 438-453;
- John Koo, Mio Nakamura. (2017). Combing Phototherapy with Acitretin: Re-PUVA and Re-UVB. Clinical Cases in Phototherapy. 113-118;
- Heba M. Mashaly, Marwa F. Hussein, Shaimaa Hamdy, Olfat Shaker. (2017). Evaluation of carcinogenic risk of PUVA versus Re-PUVA in psoriatic patients. Journal of the Egyptian Womenʼs Dermatologic Society. 14, 106-110;
- Jacquelyn J. Bower, Leah D. Vance, Matthew Psioda, Stephanie L. Smith-Roe, Dennis A. Simpson, et. al.. (2017). Patterns of cell cycle checkpoint deregulation associated with intrinsic molecular subtypes of human breast cancer cells. npj Breast Cancer. 3;
- Cristina Russo, Riccardo Polosa. (2005). TNF-α as a promising therapeutic target in chronic asthma: a lesson from rheumatoid arthritis. Clin. Sci.. 109, 135-142;
- Paul W. H. I. Parren, Paul J. Carter, Andreas Plückthun. (2017). Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. mAbs. 9, 898-906.







