
Эпигенетика псориаза: молекулярные отметины судьбы
30 июня 2017
Эпигенетика псориаза: молекулярные отметины судьбы
- 4274
- 0
- 4
Так что же такое лицо человека?
Портрет, на котором отметины века,
Зарубки судьбы и следы проживанья,
Что требует стойкости, сил и страданья...
-
Автор
-
Редакторы
-
Рецензенты
В возникновении и течении псориаза причудливо переплетаются генетическая предрасположенность и влияния среды. Но мы до сих пор очень мало знали о том, как именно складываются воедино все предпосылки. Может, громко заявившей о себе науке эпигенетике удастся наконец выстроить полную цепь патологических событий? Предлагаем вспомнить основные механизмы, регулирующие «считывание» наследственной информации в зависимости от актуальных условий, и узнать, как меняется их настройка при псориазе. Поговорим о «черных метках», расставленных на хроматине больных, и миниатюрных РНК-убийцах, плавающих в их клетках в поисках своих молекулярных жертв.
Псориаз
Cпецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Читателям «биомолекулы» уже наверняка известно, что псориаз — это хроническое воспалительное иммуноопосредованное заболевание, поражающее кожу и иногда суставы [1]. Патогенез заболевания сложен: в нём нарушение дифференцировки кератиноцитов переплетается с неадекватными действиями врожденной и адаптивной систем иммунитета, и всё это замешано на генетической предрасположенности и множестве изменчивых факторов. В этом отношении псориаз очень напоминает аутоиммунные заболевания [2], [3]. Детальный разбор псориатических клеточно-молекулярных хитросплетений можно найти в материале «Псориаз: Т-хелперы, цитокины и молекулярные шрамы» [4], а современные представления о наследовании заболевания — в статье «Генетика псориаза: иммунитет, барьерная функция кожи и GWAS» [5]. Но раз псориаз относится к типичным мультифакторным заболеваниям, разобраться в причинах и механизмах его развития не так-то просто. И еще более загадочной на первый взгляд кажется его очевидная связь с другими хроническими состояниями: воспалительными заболеваниями кишечника, депрессией, сосудистыми патологиями, метаболическим синдромом и диабетом II типа [6].
Конкордантность монозиготных близнецов по этой патологии достигает 40–73%, дизиготных — в два—четыре раза ниже. Не удивительно, что крупномасштабные сравнения геномов страдающих псориазом людей/семей и здоровой популяции выявили ряд участков, связанных с развитием псориаза и псориатического артрита [5], [7]. Однако даже комбинированный эффект этих локусов полностью не объясняет характер наследования псориаза [8]. Нестопроцентная конкордантность и очевидное влияние множества внешних и внутренних переменных на развитие заболевания (рис. 1) не позволяют причислить его к сугубо генетическим недугам. В поисках «недостающей наследственности» биологи обратились к эпигенетике — науке, изучающей изменения экспрессии генов, не связанные с изменениями генома.
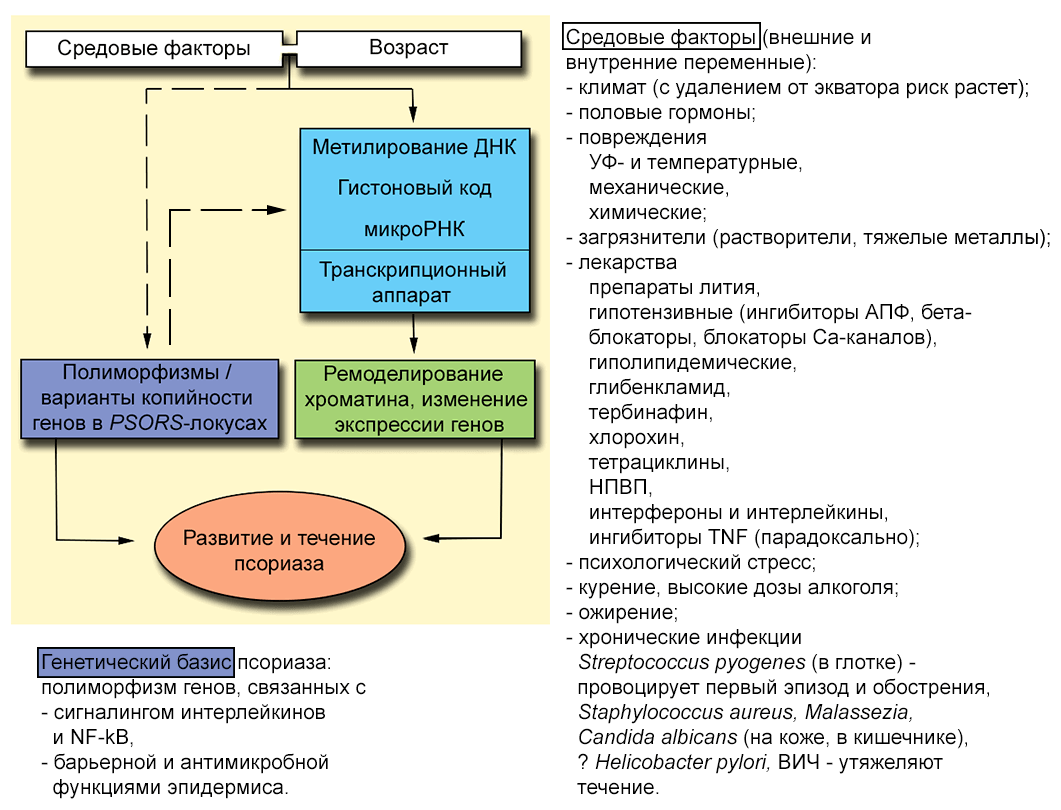
Рисунок 1. Возможная схема взаимодействия разных факторов в развитии псориаза. По традиции ассоциированные с псориазом участки хромосом называют локусами предрасположенности к псориазу (PSORS 1–15...), хотя в новейших работах речь обычно идет уже о конкретных генах. Распределение некоторых PSORS этнически неоднородно. Пунктиром показано, что факторы среды могут провоцировать мутагенез, то есть появление аллельных вариантов, предрасполагающих к псориазу. Среди последних обнаружены и однонуклеотидные полиморфизмы генов микроРНК — важного эпигенетического инструмента [5]. Кроме того, разные аллели могут по-разному подвергаться эпигенетическим модификациям, а полиморфизмы промоторов — менять работу транскрипционного аппарата. В патогенезе псориаза эпигенетические модификации (голубой прямоугольник) могут быть связующим звеном между генетической предрасположенностью, патологическим фенотипом и влиянием среды. АПФ — ангиотензинпревращающий фермент; НПВП — нестероидные противовоспалительные препараты. Чтобы увидеть рисунок в полном размере, нажмите на него.
К сфере интересов эпигенетики относятся митотически или мейотически наследуемые изменения экспрессии генов, происходящие без изменения нуклеотидной последовательности ДНК. Такие изменения обусловлены либо ковалентными модификациями и укладкой хроматина (ДНК с гистонами), либо деятельностью малых РНК. На экспрессии генов могут сказаться и любые изменения белков, осуществляющих, регулирующих и интерпретирующих эпигенетические модификации. Эпигеном — это совокупность всех эпигенетических меток клетки. Изменившись однажды под действием факторов внешней или внутренней среды, он может наследоваться потомством соматической клетки после ее деления и даже сохраняться в череде поколений людей, если изменения произошли в половых клетках [9], [10].
Эпигенетические процессы начали изучать относительно недавно, но практически сразу вскрылась их ключевая роль в развитии организма: в дифференцировке клеток (как из зиготы получается организм со множеством разных тканей и как одна и та же генетическая программа так по-разному в них реализуется?), инактивации X-хромосомы (почему у женщин, обладательниц двух Х-хромосом, не удваивается по сравнению с мужчинами уровень экспрессии Х-хромосомных генов?), геномном импринтинге (почему аллель по-разному экспрессируется в зависимости от того, кто из родителей его передал — отец или мать?) и т.д. Оказалось, что сотни эпигеномов определяют уникальные транскрипционные программы клеток в процессе нашего развития и старения [11]. Именно благодаря эпигенетическим дирижерам генетическая программа реализуется очень пластично и с учетом меняющихся условий среды. И этих же дирижеров — в случае их бунта — гораздо проще привести к порядку, чем отремонтировать «поломки» в первичной структуре ДНК: эпигенетические модификации фармакологически обратимы [14]. Собственно, существующий уровень знаний о некоторых патологиях уже позволяет переходить от лабораторных разработок к коммерческому производству лекарств для коррекции эпигенома [15].
Исследователи псориаза начали штурмовать эпигенетические высоты лишь в последние годы, существенно отстав от ученых-онкологов, в том числе и в масштабах работ. Какие же факты подтолкнули их к этому? Во-первых, свидетельства о предпочтительной передаче псориатического артрита с отцовской стороны и повышенном весе новорожденных, чьи отцы страдали псориазом [16]. Во-вторых, понимание того, что дифференцировка клеток и поддержание тканевого фенотипа — феномен эпигенетический, а именно с этим в псориатической коже большие проблемы [4]. Нарушенная дифференцировка и усиленная пролиферация кератиноцитов сопровождаются глобальными изменениями эпигенетического профиля и экспрессии генов [16]. В-третьих, обнаружение связи между терапевтическим эффектом антипсориатических средств и изменениями эпигенома, причем иногда это была не просто связь, а конкретное действие на тот или иной эпигенетический процесс [16–18].
К основным эпигенетическим процессам, связь которых с патогенезом псориаза удалось установить, относятся: метилирование ДНК, модификации (как минимум ацетилирование-деацетилирование) гистонов и работа микроРНК (рис. 2).
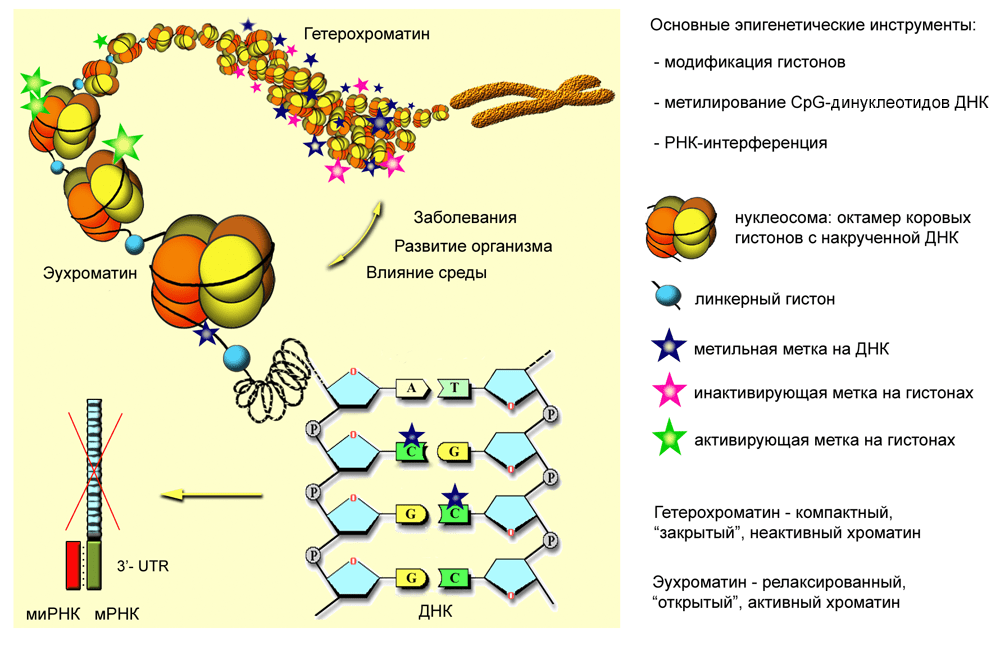
Рисунок 2. Инструменты настройки эпигенома, задействованные в развитии псориаза. Хромосома эукариот (длина во время митоза — 5–6 мкм) — это многократно компактизированный хроматин: молекула ДНК длиной около 2 м, намотанная на октамерные «бусины» — белки-гистоны. Определенные химические модификации гистонов (инактивирующие) и, как правило, метилирование цитозина ДНК «сковывают» хроматин: заставляют его конденсироваться, «выключая» экспрессию генов на этом участке — в первую очередь из-за невозможности взаимодействия транскрипционной машины с ДНК. Активирующие метки гистонов и деметилирование ДНК, наоборот, способствуют образованию «открытой» структуры хроматина и активации генов. Перераспределение меток, а значит, и изменение локальной плотности укладки хроматина происходят под влиянием внешних факторов, в процессе развития организма или болезней. Еще один инструмент регуляции экспрессии генов — микроРНК (миРНК), блокирующие трансляцию комплементарных мРНК-мишеней. Чтобы увидеть рисунок в полном размере, нажмите на него.
рисунок автора статьи
Изменения метилома ДНК, ассоциированные с псориазом
Изучение метиломов, то есть глобальных профилей метилирования, ДНК — наиболее проработанное направление в эпигенетике псориаза. Еще совсем недавно биологи могли изучать лишь промоторные области конкретных генов, но быстрое развитие эпигенетических методов (в частности, основанных на секвенировании нового поколения) вывело исследования на уровень целых геномов [22].
Объектами одного из таких полногеномных исследований метилирования ДНК стали пары монозиготных близнецов, в которых один близнец страдал псориазом, а другой — нет. Оказалось, что у больных отличался профиль метилирования ДНК CD4+ Т-лимфоцитов, и локальные расхождения в метилировании сопровождались изменениями активности генов, ответственных за иммунные реакции, включая синтез цитокинов [8]. Похожие результаты получил и другой коллектив: в наивных CD4+ Т-клетках больных псориазом он обнаружил 26 крупных гипометилированных участков, которые характеризовались обилием гистоновых модификаций и мест связывания транскрипционных факторов. Однако промоторы 124 генов (121 из них локализован на Х-хромосоме, и многие связаны с иммунными функциями), наоборот, у больных были гиперметилированы. Авторы работы предположили, что подобные изменения могут сказываться на поляризации CD4+ Т-клеток, то есть создавать перевес в пользу той или иной лимфоцитарной «профессии» и этим провоцировать патологические иммунные события. Общее гиперметилирование было обнаружено в мононуклеарных клетках периферической крови (МКПК) и конкретно в CD4+ Т-клетках больных псориазом, причем в последнем случае избытком метильных меток отличались промоторы [18], [23].
В одном крупном исследовании сравнили метиломы ДНК поврежденной и неповрежденной кожи больных псориазом и кожи здоровых людей. Метилом поврежденной кожи отличался от «здорового» в 1108 CpG-сайтах. При этом 12 гипометилированных сайтов были локализованы в области комплекса эпидермальной дифференцировки (КЭД), перед генами, экспрессия которых повышена при псориазе, или прямо в них. Этот комплекс отвечает за конечную дифференцировку кератиноцитов и рассматривается в качестве потенциальной цели для эпигенетической коррекции псориаза и некоторых опухолей [24]. Один из гипометилированных генов КЭД — LCE3A — привлек внимание и других ученых, обнаруживших, что его экспрессия сильно повышена у больных псориазом индийцев, несущих известный аллель риска HLA-Cw6 одновременно с мутацией возле LCE3A [25]. За пределами КЭД, рядом с генами, экспрессия которых значительно меняется при псориазе, тоже обнаружили сайты с необычным характером метилирования (табл. 1). Однако ситуация, когда изменения метилирования сопровождаются нарушением экспрессии близлежащих генов, складывается при псориазе не всегда [26].
На это указывают и авторы другой работы, выявившей общее гипометилирование и 3665 конкретных CpG-сайтов, которые отличают эпидермальные клетки больных псориазом от клеток здоровых людей [27]. Интересно, что в этом исследовании CpG-сайты с измененным метилированием редко находили в составе промоторов, зато очень часто — в областях энхансеров. Это свидетельствует о тканеспецифичной модуляции работы транскрипционной машины при псориазе. В обеих работах отмечена частичная коррекция метильных профилей после месячного лечения ингибиторами TNF или фототерапии [18]. Однако вопрос о происхождении выявленных в псориатической коже метильных изменений остается нерешенным: они могут быть первичными и влечь за собой дальнейший каскад патологических событий, а могут возникать уже вследствие воспаления. Например, было показано, что активно продуцируемые при псориазе провоспалительные цитокины типа IL-6 могут индуцировать синтез метилтрансферазы DNMT1 [28]. И наоборот, деметилирование одного CpG-сайта в промоторе гена IL-2 через цепь событий активировало его транскрипцию и иммунный ответ в целом [26]. Но даже при своей вторичности уникальные наборы метильных меток могут служить прекрасными маркерами для постановки диагноза или оценки эффективности терапии псориаза.
Конечно, без некоторых противоречий в исследованиях не обходится. Если в одной работе показано, что среди отличных по метильным меткам сайтов в псориатической коже по сравнению со здоровой больше гипометилированных, то в другой, наоборот, наблюдали больше гиперметилированных. Аномально метилированные сайты чаще встречались в «теле» (и особенно интронах) генов, ответственных за иммунные реакции, клеточный цикл и апоптоз [29]. В другом исследовании обратили внимание на аномальное метилирование именно промоторов, но в мезенхимальных стволовых клетках дермы, которые, вероятно, тоже вовлечены в патогенез псориаза [30].
Конкретные гены, метилирование которых меняется при псориазе, собраны в таблице 1. Заметно, что изменениям в уровне метилирования часто подвергаются области, ответственные за регуляцию клеточного цикла.
Что касается изменений, которые претерпевает «метильная канцелярия», то в лимфоцитах и моноцитах больных псориазом показано повышение экспрессии гена DNMT1 и снижение экспрессии генов белков MECP2 и MBD2, содержащих метил-связывающий домен и выполняющих функции «считывателей» метильных меток, а возможно, и их «стирателей». В роли первых они часто репрессируют транскрипцию с метилированных промоторов, а в роли вторых могли бы высвобождать промоторы из метильных «уз» и позволять экспрессироваться ряду генов [23].
| Ген | Тип ткани/клеток | Продукт и возможные последствия изменений в метилировании его гена |
|---|---|---|
| Метилирование повышено | ||
| Промотор CDKN2A (транскрипт p16INK4a INK4b-ARF-INK4a-локуса) | Поврежденный эпителий | Опухолевый супрессор, участвующий в Rb-опосредованном контроле клеточного цикла. Метилирование промотора → снижение продукции p16INK4a → избыточная пролиферация клеток. Промотор метилирован у 30% больных псориазом, для которых характерен более высокий индекс охвата и тяжести псориаза (PASI) |
| Промотор CDKN2A (транскрипт p14ARF INK4b-ARF-INK4a-локуса) | Поврежденная кожа и МКПК* | Опухолевый супрессор, участвующий в p53-опосредованном контроле клеточного цикла и в регуляции биогенеза рибосом. Снижение продукции p14ARF → избыточная пролиферация клеток, избегание «ареста» клеточного цикла и апоптоза, а также повышение синтеза белка и увеличение размеров клеток |
| Промотор ID4 | Верхние слои поврежденного эпителия | Транскрипционный фактор, ингибирующий дифференцировку клеток. Снижение экспрессии → паракератоз |
| PDCD5 | Поврежденная и неповрежденная кожа | Белок, ускоряющий апоптоз и поддерживающий работу регуляторных Т-лимфоцитов. Снижение продукции PDCD5 → избегание апоптоза и избыточная активность иммунной системы (воспаление). Уровень метилирования гена положительно коррелирует с PASI [29] |
| Промоторы или «тела» генов CCL27, DDAH2, TNS1, TRIM2 | Поврежденная кожа | Продукты этих генов участвуют в кожных воспалительных реакциях, регуляции сосудистого тонуса, клеточной адгезии и удалении дефектных белков. При псориазе экспрессия снижена |
| Метилирование снижено | ||
| Промотор CDKN2A (транскрипт p16INK4a INK4b-ARF-INK4a-локуса) | Гемопоэтические клетки костного мозга | Опухолевый супрессор, участвующий в Rb-опосредованном контроле клеточного цикла. Неметилированный промотор (при псориазе такие встречаются чаще) → продукция p16INK4a → запрещение деления и поддержание сенесцентного состояния гемопоэтических клеток (клетки не делятся и секретируют особый спектр молекул, включая провоспалительные) |
| Промотор CDKN2A (транскрипт p15INK4b INK4b-ARF-INK4a-локуса) | Гемопоэтические клетки костного мозга | То же, что и у p16INK4a |
| Промотор CDKN1A | Гемопоэтические клетки костного мозга | Опухолевый супрессор p21, участвующий в p53-опосредованном контроле клеточного цикла. Неметилированный промотор → продукция p21 → подавление пролиферации гемопоэтических клеток (вероятно, способствующее их дифференцировке) |
| Промотор 2 гена SHP1 (PTPN6) | Поврежденный эпителий | Фосфатаза SHP1, регулирующая процессы деления и дифференцировки эпителиальных и гемопоэтических клеток. Гипометилирование промотора 2 в коже → повышение продукции изоформы 2 белка SHP1, которая может как-то участвовать в развитии псориаза |
| Промотор HLA-DRB1 | Поврежденный эпителий | Субъединица рецептора из главного комплекса гистосовместимости II класса. Однонуклеотидные полиморфизмы гена DRB1 связаны с повышенным риском развития псориаза. Гипометилирование промотора → повышение продукции DRB1 → утяжеление течения псориаза: уровень метилирования отрицательно коррелирует с PASI [31] |
| Область гена LCE3A | Поврежденный эпителий | Входит в комплекс эпидермальной дифференцировки; локализован в роговом слое эпидермиса, участвует в поддержании барьерной функции кожи. При псориазе экспрессия повышена |
| Промоторы или «тела» генов IFI27, KYNU, OAS2, S100A9, SERPINB3, TNIP3 | Поврежденная кожа | Продукты этих генов участвуют в стимулированной цитокинами пролиферации кератиноцитов, метаболизме аминокислот, реакциях врожденного иммунитета, развитии/подавлении воспаления, клеточной дифференцировке. При псориазе экспрессия повышена |
| Промоторная область FCGBP | Поврежденная кожа | Белок, связывающий Fc-фрагмент иммуноглобулина G. Участвует в регуляции иммунных реакций и, вероятно, в поддержании структуры слизистых оболочек; сильнее всего ген экспрессируется в эпителии ЖКТ и клетках иммунной системы; изменения экспрессии характерны для некоторых опухолей, хронических воспалительных заболеваний ЖКТ и аутоиммунных состояний. При псориазе экспрессия снижена |
| * МКПК (англ. PBMC) — мононуклеарные клетки периферической крови (лимфоциты и моноциты) | ||
Модификации гистонов, ассоциированные с псориазом
Роль модификаций гистонов в патогенезе псориаза вряд ли так же скромна, как список посвященных ей исследований. Определенно можно сказать лишь то, что в МКПК — моноцитах и лимфоцитах — больных псориазом заметно снижен уровень ацетилирования гистона H4, и это снижение отрицательно коррелирует с PASI, то есть чем меньше ацетильных меток на этом гистоне, тем активнее болезнь [14].
В пораженной псориазом и атопическим дерматитом коже замечали повышение продукции транскрипционного фактора Grainyhead-like 2 (GRHL2). GRHL2 ускоряет пролиферацию и нарушает дифференцировку кератиноцитов, подавляя транскрипцию генов упомянутого выше КЭД: он просто не дает гистоновым деметилазам освободить промоторы этих генов от репрессирующих метильных «оков» [34].
Что касается уровня экспрессии генов «ацетильных» ферментов — HAT и HDAC — при псориазе, то два коллектива показали увеличение количества мРНК деацетилазы HDAC1 в МКПК либо в пораженной коже. Повышение количества HDAC наблюдали в некоторых клетках больных ревматоидным артритом, патогенез которого имеет много общего с псориатическим. И хотя возрастание активности HDAC при псориазе так и не описали, предложили ее снижать ингибиторами гистоновых деацетилаз, изначально разработанными для противораковой терапии и обладающими антипролиферативным и противовоспалительным действием [35]. Однако небольшое исследование 2016 года поставило эту идею под сомнение: оно не выявило достоверных изменений ни в активности, ни в продукции HDAC I класса в МКПК и поврежденной коже больных псориазом [36].
Ну и наконец, в одном из исследований в МКПК больных псориазом наблюдали повышенную экспрессию генов метилтрансфераз SUV39H1 и EZH2 и пониженную — ацетилтрансфераз P300 и CBP (коактиваторов транскрипции ряда генов), а также деацетилазы SIRT1. Последняя подавляет размножение и стимулирует дифференцировку клеток (кератиноцитов в том числе), и, значит, снижение ее количества может вести к клеточной гиперпролиферации [14].
Изменения профиля микроРНК, ассоциированные с псориазом
Как мы уже выяснили в предыдущих статьях спецпроекта, в патогенезе псориаза задействованы кератиноциты, иммунные клетки и химические медиаторы воспаления. Так вот, обнаружены признаки причастности миРНК к управлению всеми этими патогенетическими звеньями: миРНК регулируют активацию и выживание Т-клеток, дифференцировку и пролиферацию кератиноцитов, их ответ на цитокиновые сигналы. Неоднократно показано, что экспрессионные профили миРНК псориатической кожи кардинально отличаются от профилей кожи здоровой.
Несмотря на то, что уже насчитали более 250 миРНК, аберрантно экспрессирующихся при псориазе, не для всех из них удалось найти «кожные» мишени и описать их возможную связь с заболеванием. Различия миРНК-профилей наиболее значительны в случае сравнения периферической крови и пораженной кожи больных псориазом и здоровых людей, в то время как в исследованиях разницы профилей пораженной и непораженной кожи одних и тех же пациентов воспроизводимость результатов крайне низка. Да и в целом работ, посвященных изучению роли миРНК в развитии псориаза, пока не достаточно для формулировки окончательных выводов — это новое направление, для которого еще не стандартизирован дизайн экспериментов, методы получения материала и его анализа. Но уже сейчас очевидно, что изучение некоторых миРНК может принести интересные плоды сразу в нескольких плоскостях (табл. 2).
1. МикроРНК могут регулировать экспрессию генов в клетках кожи и иммунной системы, вмешиваясь тем самым в работу их сигнальных систем, что причисляет эти малые РНК к возможным патогенетическим инструментам. Более того, генетический полиморфизм самих миРНК либо их мишеней из локусов PSORS может олицетворять «недостающую наследственность», связывающую генетическую предрасположенность к псориазу с фенотипом болезни, ведь замены нуклеотидов могут уничтожать, модифицировать либо порождать сайты взаимодействия миРНК с их мишенями.
В тканях больных псориазом уровни многих миРНК могут как повышаться, так и снижаться относительно показателей здоровой популяции (табл. 2). Необычный профиль этих молекул в коже может смещать баланс между пролиферацией и дифференцировкой кератиноцитов, а также вызывать колебания уровня различных цитокинов, что ведет к привлечению и активации иммунных клеток и стойкому воспалению либо же, наоборот, к подавлению синтеза провоспалительных цитокинов и снижению напряженности иммунных реакций в коже (как в случае miR-203 и miR-138) [41].
Что касается конкретных сигнальных схем, в которых задействованы «псориатические» миРНК, то здесь пока непочатый край для исследований. Но кое-что уже известно: некоторые миРНК (например, miR-21 и miR-31) косвенно активируют транскрипционные факторы NF-kB или STAT3, что выливается в стремление клеток эпидермиса неуемно делиться [5]. Возможные сигнальные схемы для miR-21 и miR-31 предложены в работе [41]. Очень часто миРНК модулируют активность пути одного из основных провоспалительных цитокинов — фактора некроза опухоли, TNF: чаще повышают ее, но иногда и снижают (miR-203, miR-125b). Вовлеченность микроРНК в схемы TNF-сигнализации подтверждается изменениями продукции десятков типов миРНК в ответ на терапию ингибиторами TNF типа этанерцепта или адалимумаба [40], [41].
2. МикроРНК могут служить прекрасными маркерами для диагностики, оценки активности заболевания и эффективности терапии. По сравнению с мРНК, миРНК менее подвержены деградации, поскольку лишены поли(А)-хвоста, а значит лучше сохраняются в биоматериале. Оценивать уровни маркерных миРНК можно в образцах крови (не исключено, что и других жидкостей), волос и кожи. В качестве предполагаемых маркеров псориаза рассматривают повышенные уровни в крови следующих молекул: miR-143, miR-146а, miR-223 и miR-369-3р (прямая корреляция с интенсивностью заболевания — баллами PASI); miR-1266 (обратная корреляция с PASI); miR-33 (прямая корреляция с уровнем инсулина и рассчитанной инсулинорезистентностью); miR-424. Сывороточные уровни ряда миРНК разнонаправленно меняются после лечения проявлений псориаза метотрексатом, этанерцептом и фототерапией [40–42].
Чтобы действительно продвинуться в понимании как патогенетической, так и диагностической ролей миРНК в псориазе, необходимо преодолеть следующие проблемы: малочисленность экспериментальных выборок, концентрацию внимания исключительно на вульгарном псориазе и тенденцию к поиску ассоциаций без углубления в механизмы [40].
Вполне возможно, что каким-то специфичным для псориаза и патогенетически значимым миРНК суждено стать мишенями для местной или системной терапии. По крайней мере на мышах уже был продемонстрирован положительный эффект от блокирования miR-21 [43]. По сравнению с другими эпигенетическими механизмами, миРНК работают более целенаправленно, поэтому и ориентированное на них терапевтическое воздействие будет более избирательным [44].
| миРНК | Тип ткани/клеток | Ген-мишень | Биологическая и возможная диагностическая роли |
|---|---|---|---|
| Экспрессия повышается | |||
| miR-19a | Корни волос | — | Значительная обратная корреляция с длительностью периода между появлением первых симптомов и визитом к врачу. Возможный диагностический маркер |
| miR-21 | Поврежденный эпидермис и дермальные Т-клетки; МКПК* | TIMP3, TPM1, PDCD4, PTEN, IL12A, RECK, RTN4, NFIB | Активация Т-клеток и ингибирование их апоптоза → поддержание воспаления кожи. Регуляция пролиферации кератиноцитов и ангиогенеза. Эта молекула — потенциальная терапевтическая мишень [43] |
| miR-22/24-1 | Поврежденная и неповрежденная кожа | — | — |
| miR-31 | Кератиноциты | FIH1, STK40 | Подавление активности пути Notch → нарушение дифференцировки кератиноцитов. Индукция активности NF-kB и синтеза хемокинов → ангиогенез, миграция лейкоцитов в кожу и поддержание воспаления. Потенциальная терапевтическая мишень |
| miR-33 | Кровь | — | Прямая корреляция с уровнем инсулина и риском диабета и сердечно-сосудистых заболеваний у больных псориазом |
| miR-128a | Сыворотка крови | — | — |
| miR-135b | Поврежденный эпидермис | COL4A3 | Регуляция пролиферации и дифференцировки кератиноцитов. Ингибирование miR-135b, видимо, усиливает пролиферацию |
| miR-136 | Кератиноциты | PPP2R2A | Регуляция индуцированного TGF-β1 ареста деления кератиноцитов |
| miR-138 | МКПК | RUNX3 | Регуляция (снижение) Th1/Th2-соотношения в CD4+ Т-клетках, подавление экспрессии гена предрасположенности к псориазу RUNX3 → предупреждение избыточной пролиферации эпителиальных клеток. Потенциальный терапевтический (защитный) инструмент |
| miR-142-3p | Эпидермальные инфильтраты | — | Гемопоэз-специфичная миРНК. Уровень в сыворотке не повышен, однако значительно снижается при терапии ингибиторами TNF |
| miR-143 | МКПК | — | Прямая корреляция с величиной PASI; сывороточный уровень снижается метотрексатом. Возможный сывороточный маркер активности псориаза |
| miR-146a | Поврежденные эпидермис и дерма; МКПК | IRAK1, TRAF6, EGFR | Подавление синтеза провоспалительных цитокинов, аутоиммунных и врожденных иммунных реакций. Прямая корреляция с величиной PASI и уровнем IL-17, важного игрока в патогенезе псориаза. Повышение риска псориаза при некоторых аллельных вариантах (см. ниже). Возможный сывороточный маркер для диагностики псориаза (совместно с miR-203) |
| miR-155 | Кожа | CTLA4 | Регуляция гемопоэза и воспаления |
| miR-184 | Линия кератиноцитов, стимулированная IL-22 | AGO2 | Регуляция посттранскрипционной модификации мРНК и биогенеза миРНК на этапе RISC (рис. 5) |
| miR-193b | Th17-клетки; дермальные инфильтраты; МКПК | — | — |
| miR-203 | Псориатические бляшки и нормальные кератиноциты, стимулированные провоспалительными цитокинами | SOCS3, SOCS6, TP63, TNFA, IL8, IL24 | Кератиноцит-специфичная миРНК. Регуляция эпителиальной дифференцировки и цитокиновой сигнализации → подавление воспаления кожи. Возможный сывороточный маркер для диагностики псориаза (в комплексе с miR-146a) |
| miR-210 | МКПК (CD4+ Т-клетки) | FOXP3 | Нарушение иммуносупрессорной функции регуляторных Т-клеток. Потенциальная терапевтическая мишень |
| miR-221/222 | Поврежденный эпидермис | TIMP3, c-KIT, P57 | Подавление синтеза тканевого ингибитора матриксной металлопротеиназы 3 → активация матриксных металлопротеиназ → ремоделирование внеклеточного матрикса, воспаление и пролиферация эпидермиса |
| miR-223 | Th17-клетки; дермальные инфильтраты; МКПК | RC3H1 (roquin) | Гемопоэз-специфичная миРНК. Прямая корреляция с величиной PASI; сывороточный уровень снижается метотрексатом и этанерцептом. Вероятное блокирование синтеза Roquin → повышение уровня IL-17 → воспаление [45]. Возможный сывороточный маркер активности псориаза |
| miR-369-3p | Кожа и сыворотка крови | — | В коже — прямая корреляция с величиной PASI |
| miR-424 | Стержни волос и кровь | MEK1, CCNE1 | По данным одного исследования, для кожи больных псориазом характерно, наоборот, снижение экспрессии miR-424 → пролиферация кератиноцитов. Возможный диагностический маркер (по волосам) |
| miR-498/551a | Поврежденная и неповрежденная кожа | — | — |
| miR-1266 | Кровь | — | Слабая обратная корреляция сывороточного уровня с величиной PASI; прямая корреляция с уровнем IL-17. Возможный маркер псориаза |
| Экспрессия снижается | |||
| miR-99a | Кератиноциты верхнего слоя эпидермиса | IGF1R | Подавление пролиферации и стимуляция дифференцировки кератиноцитов |
| miR-125b | Поврежденный эпидермис и сыворотка крови | FGFR2, TNFA | Подавление пролиферации и стимуляция дифференцировки кератиноцитов. Снижение количества miR-125b → усиление TNF-сигнализации → пролиферация кератиноцитов. Фототерапия существенно повышает уровень miR-125b в коже |
| miR-150 | Кератиноциты верхнего слоя эпидермиса | — | Уровень в неповрежденной коже больных ниже, чем в поврежденной или коже здоровых людей |
| miR-197 | Кератиноциты | — | Уровень в поврежденной коже больных ниже, чем в неповрежденной или коже здоровых людей |
| miR-423 | Кератиноциты | — | Едва определяется в коже больных псориазом (поврежденной и неповрежденной) |
| Связь с генетическими полиморфизмами | |||
| miR-146a: однонуклеотидный полиморфизм rs2910164 повышает предрасположенность к псориазу. Показано, что вариант rs2910164G мешает этой миРНК блокировать мишень — мРНК рецептора эпидермального фактора роста (EGFR), который в избытке синтезируется в псориатической коже и способствует пролиферации кератиноцитов. Полиморфизм не самой miR-146a, а ее второй мишени, IRAK1, тоже мешает интерференции и может поддерживать воспаление. Полиморфизм rs3027898 IRAK1 связан с предрасположенностью к псориатическому артриту [41] | |||
| miR-148a связывается с мРНК HLA-C из PSORS1, влияя на выставление рецептора HLA-C на поверхности клеток. Характер влияния на псориатический фенотип еще предстоит установить, но уже показана связь с ВИЧ-контролем и предрасположенностью к болезни Крона [40] | |||
| miR-492: полиморфизм rs8259 не самой миРНК, а ее цели — гена BSG из локуса PSORS6 — делает РНК-интерференцию невозможной. Пока не ясен механизм, но это ассоциируется со снижением экспрессии BSG и риска развития псориаза [40] | |||
| * МКПК — мононуклеарные клетки периферической крови (лимфоциты и моноциты) | |||
Изменится ли что-то в обозримом будущем?
Вероятно, да. И как ни странно, огромную помощь страдающим псориазом могут оказать не только врачи и ученые, но и обычные, здоровые люди. Дело в том, что эпигенетический профиль варьирует от индивидуума к индивидууму и в зависимости от типа клеток и их функционального состояния. Поэтому ученым нужно собрать огромную коллекцию эпигеномов: не только патологических, но и референсных — чтобы статистически достоверно установить, что и когда «нормально», а что — нет. International Human Epigenome Consortium (IHEC) задался целью в течение 10 лет создать карты более 1000 референсных эпигеномов. Входящие в консорциум организации уже составили полногеномные карты метильных меток ДНК, модификаций гистонов, мест связывания транскрипционных факторов и активности хроматина минимум для 200 типов клеток. Быстрое развитие биоинформатических подходов и эпигенетических техник способствует быстрому накоплению данных, и, вероятно, уже в ближайшем будущем станет понятно, как же переплетаются генетические, эпигенетические и средовые влияния в процессе развития многофакторных заболеваний [46]. А тогда уж и рукой подать до создания эффективных диагностических и терапевтических инструментов. При этом не исключено, что с лучшей стороны себя покажут и уже зарегистрированные для других целей средства. Однако существующим и перспективным подходам к лечению псориаза будет посвящена следующая статья нашего цикла.
И еще. Как мы выяснили, псориаз ассоциируется с рядом генетических и эпигенетических особенностей. И те, и другие можно получить «в наследство». Ничьей вины в этом нет. Мутации возникают по множеству причин и без них тоже — просто любые биологические процессы, включая репликацию и репарацию, не совершенны. Ну а эпигеном... И сам человек, и его родители, и их родители приобретали свой уникальный опыт, адаптировались к своей нише, что нашло отражение в определенном эпигенетическом профиле. Но ведь он не статичен. Препараты, уничтожающие некоторые псориатические «черные метки» уже применяют, но ученые бьются над созданием более таргетированных, а значит, эффективных и безопасных средств. Более того, эпигенетический пейзаж меняется под влиянием множества факторов, включая пищевые [15]. А вдруг в наших силах добавить в него жизнерадостные цвета — даже без эпигенетических пилюль? За эту идею всерьез ухватились... продвинутые психотерапевты, полагая, что выработка у пациента нового, позитивного мировоззрения поможет изменить и профиль экспрессии генов, связанных со стрессоустойчивостью, то есть в итоге скорректировать неадекватный ответ на напряжение [33]. Визиты к психотерапевту для многих больных псориазом и иными хроническими недугами стали необходимостью. Кто знает, может, на этих сеансах исподволь подлечивается и наш эпигеном? Вдруг да и удастся — нет, не совсем с псориазом распрощаться, — но хотя бы связь обострений с психологическими стрессами разорвать?..
Литература
- Псориаз: на войне с собственной кожей;
- Javierre B.M., Hernando H., Ballestar E. (2011). Environmental triggers and epigenetic deregulation in autoimmune disease. Discov. Med. 12 (67), 535–545;
- Ayala-Fontánez N., Soler D.C., McCormick T.S. (2016). Current knowledge on psoriasis and autoimmune diseases. Psoriasis: Targets and Therapy. 6, 7–32;
- Псориаз: Т-хелперы, цитокины и молекулярные шрамы;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Handbook of psoriasis and psoriatic arthritis / Eds: Warren R., Menter A. Switzerland: Springer International Publishing, 2016;
- Jamie L. Harden, James G. Krueger, Anne M. Bowcock. (2015). The immunogenetics of Psoriasis: A comprehensive review. Journal of Autoimmunity. 64, 66-73;
- Kristina Gervin, Magnus D. Vigeland, Morten Mattingsdal, Martin Hammerø, Heidi Nygård, et. al.. (2012). DNA Methylation and Gene Expression Changes in Monozygotic Twins Discordant for Psoriasis: Identification of Epigenetically Dysregulated Genes. PLoS Genet. 8, e1002454;
- Эпигенетика поведения: как бабушкин опыт отражается на ваших генах?;
- Эпигенетика: невидимый командир генома;
- Yan H., Tian S., Slager S.L., Sun Z., Ordog T. (2016). Genome-wide epigenetic studies in human disease: A primer on -omic technologies. Am. J. Epidemiol. 183 (2), 96–109;
- Xu Y.Z., Kanagaratham C., Radzioch D. Chromatin remodelling during host-bacterial pathogen interaction / In: Chromatin Remodelling. InTech, 2013. — 234 p.;
- Anna Portela, Manel Esteller. (2010). Epigenetic modifications and human disease. Nat Biotechnol. 28, 1057-1068;
- Zhang P., Su Y., Lu Q. (2012). Epigenetics and psoriasis. J. Eur. Acad. Dermatol. Venereol. 26 (4), 399–403;
- Пилюли для эпигенома;
- Johann E. Gudjonsson, Gerald Krueger. (2012). A Role for Epigenetics in Psoriasis: Methylated Cytosine–Guanine Sites Differentiate Lesional from Nonlesional Skin and from Normal Skin. Journal of Investigative Dermatology. 132, 506-508;
- Jason E. Hawkes, Giang Huong Nguyen, Mayumi Fujita, Scott R. Florell, Kristina Callis Duffin, et. al.. (2016). microRNAs in Psoriasis. Journal of Investigative Dermatology. 136, 365-371;
- Darren D. O’Rielly, Proton Rahman. (2015). Genetic, Epigenetic and Pharmacogenetic Aspects of Psoriasis and Psoriatic Arthritis. Rheumatic Disease Clinics of North America. 41, 623-642;
- Alika K. Maunakea, Raman P. Nagarajan, Mikhail Bilenky, Tracy J. Ballinger, Cletus D’Souza, et. al.. (2010). Conserved role of intragenic DNA methylation in regulating alternative promoters. Nature. 466, 253-257;
- Courtney A. Miller, J. David Sweatt. (2007). Covalent Modification of DNA Regulates Memory Formation. Neuron. 53, 857-869;
- Эпигеном: параллельная реальность внутри клетки;
- Jeffrey B. Cheng, Raymond J. Cho. (2012). Genetics and Epigenetics of the Skin Meet Deep Sequence. Journal of Investigative Dermatology. 132, 923-932;
- Aditi Chandra, Aditi Ray, Swapan Senapati, Raghunath Chatterjee. (2015). Genetic and epigenetic basis of psoriasis pathogenesis. Molecular Immunology. 64, 313-323;
- Abhishek S. and Palamadai Krishnan S. (2016). Epidermal differentiation complex: a review on its epigenetic regulation and potential drug targets. Cell J. 18 (1), 1–6;
- Chandra A., Lahiri A., Senapati S., Basu B., Ghosh S., Mukhopadhyay I. et al. (2016). Increased risk of psoriasis due to combined effect of HLA-Cw6 and LCE3 risk alleles in Indian population. Sci. Rep. 6, 24059;
- Elisha D.O. Roberson, Ying Liu, Caitriona Ryan, Cailin E. Joyce, Shenghui Duan, et. al.. (2012). A Subset of Methylated CpG Sites Differentiate Psoriatic from Normal Skin. Journal of Investigative Dermatology. 132, 583-592;
- Xiaolian Gu, Elisabet Nylander, Philip J. Coates, Robin Fahraeus, Karin Nylander. (2015). Correlation between Reversal of DNA Methylation and Clinical Symptoms in Psoriatic Epidermis Following Narrow-Band UVB Phototherapy. Journal of Investigative Dermatology. 135, 2077-2083;
- Johann E. Gudjonsson, Gerald Krueger. (2012). A Role for Epigenetics in Psoriasis: Methylated Cytosine–Guanine Sites Differentiate Lesional from Nonlesional Skin and from Normal Skin. Journal of Investigative Dermatology. 132, 506-508;
- Peng Zhang, Ming Zhao, Gongping Liang, Guangliang Yin, Dan Huang, et. al.. (2013). Whole-genome DNA methylation in skin lesions from patients with psoriasis vulgaris. Journal of Autoimmunity. 41, 17-24;
- Ruixia Hou, Guohua Yin, Peng An, Chunfang Wang, Ruifeng Liu, et. al.. (2013). DNA methylation of dermal MSCs in psoriasis: Identification of epigenetically dysregulated genes. Journal of Dermatological Science. 72, 103-109;
- Zong W., Ge Y., Han Y., Yang X., Li Q., Chen M. (2016). Hypomethylation of HLA-DRB1 and its clinical significance in psoriasis. Oncotarget. 8, 12323–12332;
- Histone modification table. Сайт Cell Signaling Technology;
- Haley Peckham. (2013). Epigenetics: The Dogma-defying Discovery That Genes Learn From Experience. IJNPT. 1, 9-20;
- W Chen, Z Xiao Liu, J-E Oh, K-H Shin, R H Kim, et. al.. (2012). Grainyhead-like 2 (GRHL2) inhibits keratinocyte differentiation through epigenetic mechanism. Cell Death Dis. 3, e450;
- Fiona McLaughlin, Nicholas Thangue. (2004). Histone Deacetylase Inhibitors in Psoriasis Therapy. CDTIA. 3, 213-219;
- A.K. Ekman, C. Enerbäck. (2016). Lack of preclinical support for the efficacy of histone deacetylase inhibitors in the treatment of psoriasis. Br J Dermatol. 174, 424-426;
- Обо всех РНК на свете, больших и малых;
- МикроРНК уменьшают шум экспрессии генов;
- МикроРНК — чем дальше в лес, тем больше дров;
- Jason E. Hawkes, Giang Huong Nguyen, Mayumi Fujita, Scott R. Florell, Kristina Callis Duffin, et. al.. (2016). microRNAs in Psoriasis. Journal of Investigative Dermatology. 136, 365-371;
- Run-Yue Huang, Li Li, Mao-Jie Wang, Xiu-Min Chen, Qing-Chun Huang, Chuan-Jian Lu. (2015). An Exploration of the Role of MicroRNAs in Psoriasis. Medicine. 94, e2030;
- Marianne B. Løvendorf, John R. Zibert, Mette Gyldenløve, Mads A. Røpke, Lone Skov. (2014). MicroRNA-223 and miR-143 are important systemic biomarkers for disease activity in psoriasis. Journal of Dermatological Science. 75, 133-139;
- J. Guinea-Viniegra, M. Jimenez, H. B. Schonthaler, R. Navarro, Y. Delgado, et. al.. (2014). Targeting miR-21 to Treat Psoriasis. Science Translational Medicine. 6, 225re1-225re1;
- George WM Millington. (2008). Epigenetics and dermatological disease. Pharmacogenomics. 9, 1835-1850;
- J. S. Schaefer, D. Montufar-Solis, N. Vigneswaran, J. R. Klein. (2011). Selective Upregulation of microRNA Expression in Peripheral Blood Leukocytes in IL-10-/- Mice Precedes Expression in the Colon. The Journal of Immunology. 187, 5834-5841;
- Yan H., Tian S., Slager S.L., Sun Z., Ordog T. (2016). Genome-wide epigenetic studies in human disease: A primer on -omic technologies. Am. J. Epidemiol. 183 (2), 96–109.






