Лечение рефрактерной депрессии: с чем ее «едят» и при чем здесь кетамин?
21 марта 2025
Лечение рефрактерной депрессии: с чем ее «едят» и при чем здесь кетамин?
- 683
- 0
- 4
Вокруг человека, страдающего депрессией, в свободном порядке расположены кетамин, его производные и декстрометорфан — вещества, рассматриваемые в данной статье.
Рисунок в полном размере.
коллаж автора с использованием плашки победы над Боссом из Elden Ring
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Депрессия отрицательно влияет на качество и срок жизни и часто сопровождает другие расстройства. В современной практике она, и так вызывая большие опасения, может не поддаваться лечению, становясь резистентной депрессией.
В этой статье мы расскажем об альтернативных подходах к ее лечению.
Конкурс «Био/Мол/Текст»-2024/2025
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2024/2025.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое рекуррентная депрессия?
Обычно под ней понимается расстройство с повторяющимися депрессивными эпизодами. Заметим, что это не одно и то же, что смешанная депрессия, которая бывает при биполярном расстройстве и лечится иначе [1].
По МКБ-10 [2] к типичной симптоматике депрессивного расстройства относятся:
- подавленное настроение;
- ухудшение способности испытывать удовольствие;
- повышенная утомляемость.
Также часто встречаются снижение концентрации внимания, нарушения аппетита и сна, суицидальные мысли и т.д.
К сожалению, людей с этим расстройством много: депрессию испытывает 3,8% населения (5% взрослых), т.е. в общей сложности 280 миллионов человек. Помимо этого, существует еще и феномен устойчивости к психофармакотерапии, из которого исходит понятие терапевтически резистентной депрессии (ТРД). Ее мы будем рассматривать дальше.
Что же такое рефрактерная депрессия?
На самом деле, это то же самое, что и резистентная депрессия, или ТРД. Под рефрактерной депрессией подразумевают рекуррентное расстройство, которое не реагирует на два адекватных курса антидепрессантов разных групп [3].
Хотя обычно антидепрессанты эффективны у пациентов с депрессией, до 30% среди них не достигают ремиссии [4], т.е. устойчивого уменьшения депрессивной симптоматики. Резистентная депрессия часто сопровождается низким качеством жизни, суицидальными мыслями и деструктивным поведением [5].
Это приводит к тому, что ТРД требует особого внимания, контроля и рассмотрения других, более быстрых методов лечения.
Какие есть взгляды на происхождение депрессии?
Так, с определениями разобрались. Но что является нейробиологической основой депрессии? Ведь если ответить на этот вопрос, можно понять, как ее можно вылечить.
На этот счет есть много теорий. Подробнее о них и об истории антидепрессантов можно почитать в статьях «Биомолекулы» [6–8]. А мы рассмотрим теории именно с точки зрения уже установленной резистентности депрессии.
Моноаминовая теория
Модель предсказывает, что основой депрессии является изменение уровней серотонина, норадреналина и дофамина в центральной нервной системе. Несмотря на то, что агенты, повышающие уровни нейротрансмиттеров в мозге, могут действительно облегчать депрессивные состояния, эта теория не объясняет ограничения антидепрессантов и медленное наступление лечебного эффекта от них.
Нейропластическая теория
Эта концепция не перечеркивает моноаминовую, но эволюционно развивает ее. Она предполагает, что лекарственный эффект антидепрессантов достигается за счет их влияния на процессы синаптической пластичности и роста нейрональных окончаний.
Такое объяснение убедительнее моноаминовой теории, причем известно, что при депрессии уменьшается количество дендритных шипиков, а кетамин, один из антагонистов NMDA-рецепторов, о котором позже пойдет речь, увеличивает их количество, с чем в том числе связывают его антидепрессивный эффект [9].
Глутаматная теория
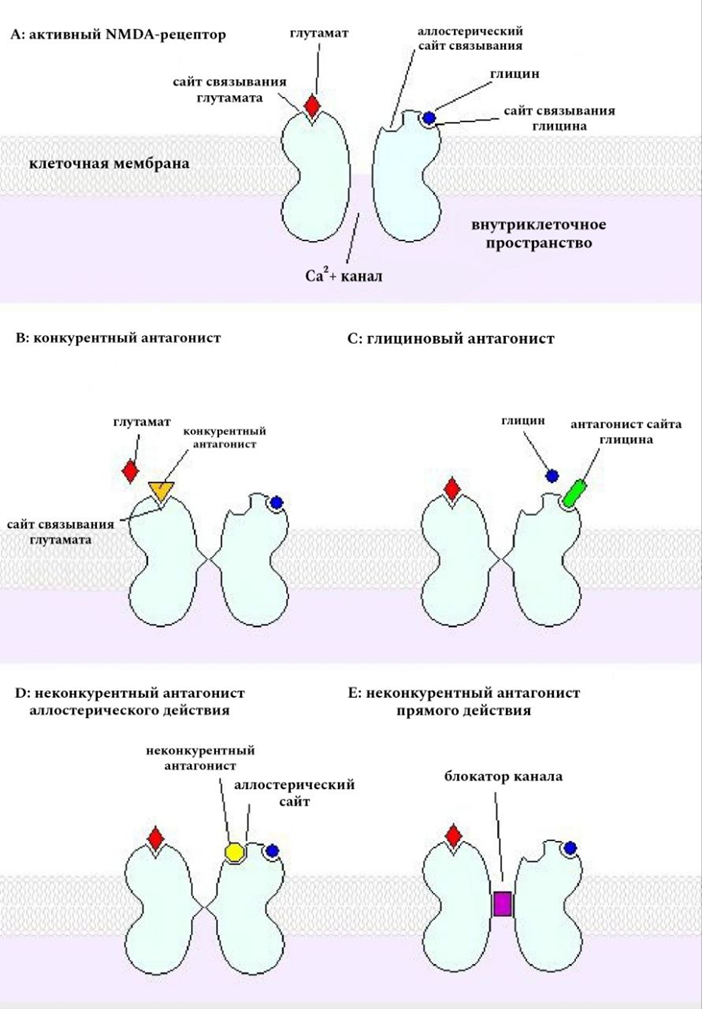
Рисунок 1. Упрощенная модель активации и блокировки NMDA-рецептора.
Согласно этой теории, на депрессивное состояние влияют уровни глутамата [10]: его содержание в таком случае понижено в префронтальной коре [11]. Глутамат регулирует нейропластичность мозга, а его высвобождение может усиливать способность нейронов образовывать синапсы.
Здесь замешаны NMDA-рецепторы, реагирующие на глутамат. Они не только генерируют электрический сигнал, но и опосредуют приток кальция, который, в свою очередь, играет ключевую роль в синаптической передаче и нейропластичности, влияющей на обучение и память [12].
Чтобы рецепторы обеспечивали прохождение электрического сигнала по нервному волокну, их каналы должны быть открыты, и для этого требуются лиганды: глутамат и глицин. Антагонисты, в свою очередь, разными путями ингибируют действие NMDA-рецепторов (рис. 1) [13]. Кетамин и его производные, например, относятся к неконкурентным антагонистам прямого действия, т.е. они блокируют сам ионный канал [14].
Какие NMDA-антагонисты могут помочь в лечении депрессии?
Мы рассмотрим некоторые вещества, в разной степени эффективные при лечении ТРД: кетамин, эскетамин, аркетамин и декстрометорфан. Все они не введены в практику лечения депрессии в России, и мы настоятельно просим воздержаться от самостоятельных экспериментов.
Кетамин
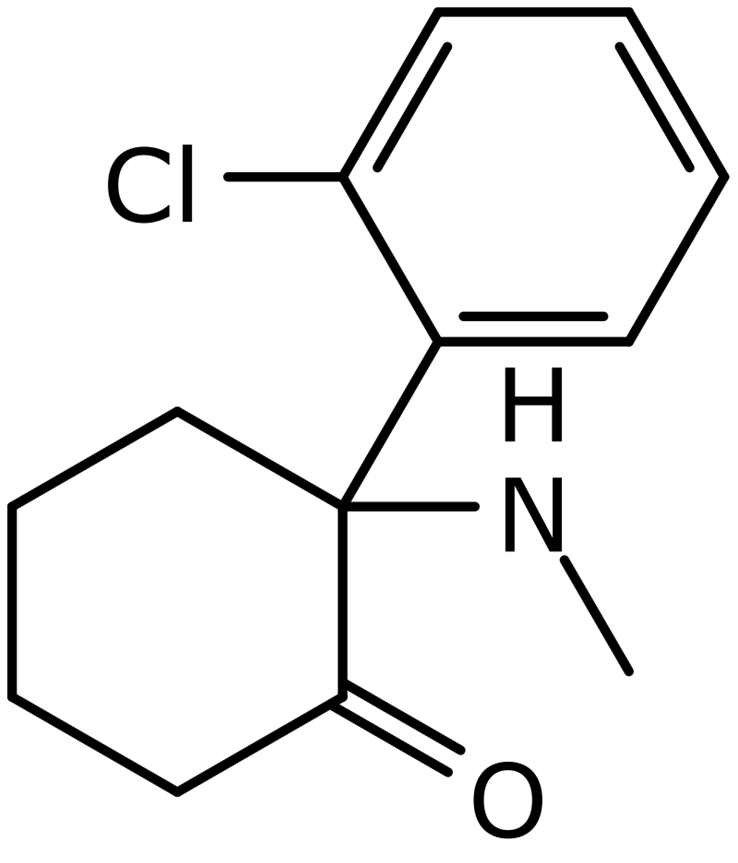
Рисунок 2. Структурная формула рацемического кетамина.
Изображенное соединение, как рацемат, состоит из двух стереоизомеров: R-кетамина (или аркетамина) и S-кетамина (или эскетамина). Известно, что кетамин уменьшает симптомы ТРД и снижает суицидальность больных депрессией [15]. Так, его однократная инфузия вызывает заметный антидепрессивный эффект в течение 4 часов, который достигает пика через 24 часа, а затем постепенно снижается [4].
Такая терапия может быть альтернативой электросудорожной, которая обычно используется при рефракторной депрессии [16]. Стоит заметить, что для стабильного улучшения состояния требуются повторные инфузии кетамина, и существует риск злоупотребления и диссоциативных побочных эффектов [17].
Эскетамин
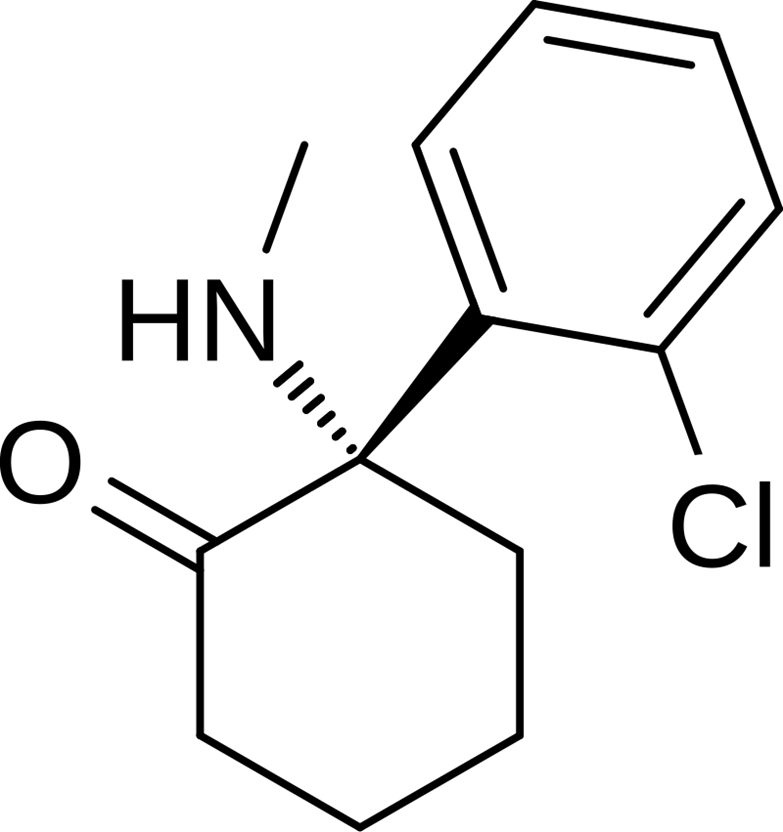
Рисунок 3. Структурная формула эскетамина.
Эскетамин на данный момент считается наиболее важным изомером кетамина для лечения ТРД из-за его более высокого сродства к NMDA-рецепторам [18]. Назальный спрей эскетамина получил одобрение в США и Европейском союзе для лечения ТРД в 2019 году. По сравнению с кетамином, эскетамин обладает более быстрым антидепрессивным эффектом и может использоваться в качестве поддерживающего препарата [18].
Тем не менее, вызывают беспокойство диссоциативное действие и проблема употребления препарата в немедицинских целях, что требует дополнительного контроля при лечении [19].
Aркетамин
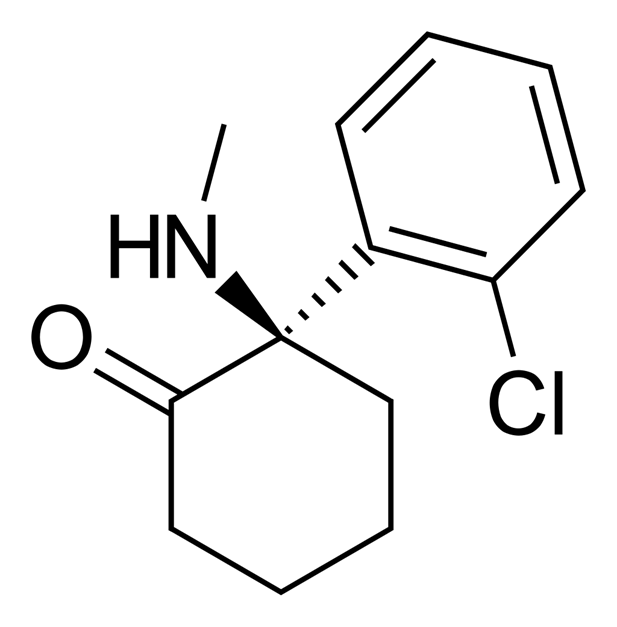
Рисунок 4. Структурная формула аркетамина.
Аркетамин изучен гораздо меньше кетамина, но все больше экспериментальных данных говорят о его более сильном и продолжительном действии по сравнению с эскетамином [20], [21]. Его антидепрессивное действие может быть независимым от ингибирования NMDA-рецепторов и, возможно, связано с активацией другого рецептора — AMPA, тоже реагирующего на глутамат [22].
В доклинических исследованиях на животных аркетамин демонстрирует более высокую антидепрессивную активность при ТРД, чем эскетамин [23], имеет меньший потенциал злоупотребления и менее выраженные побочные эффекты [23]. Начальные испытания на людях показали, что однократная инфузия аркетамина может значительно облегчить симптомы депрессии в течение 24 часов [23].
В целом, аркетамин в перспективе имеет более безопасный профиль по сравнению с эскетамином [24], но, к сожалению, на текущий момент нельзя сделать однозначный вывод об его эффективности, т.к. необходимо больше исследований.
Декстрометорфан

Рисунок 5. Структурная формула декстрометорфана.
Декстрометорфан был впервые предложен в качестве быстродействующего антидепрессанта в 2011 году [25], а испытания на животных и людях подтвердили его антидепрессивный эффект [26]. Это вещество имеет схожие с кетамином фармакологические свойства, из-за чего существует гипотеза, что пациенты с ТРД, реагирующие на лечение кетамином, также будут иметь клинический отклик при терапии декстрометорфаном [4].
При приеме внутрь дектрометорфан быстро разрушается ферментом цитохрома 2D6 (CYP2D6) [27], поэтому его сочетают с ингибиторами этого фермента — например, хинидином [28]. Комбинация декстрометорфана с хинидином используется для лечения неврологических синдромов, но она потенциально эффективна и при лечении ТРД [29], [30].
В отличие от кетамина, декстрометорфан не обладает галлюциногенным потенциалом и не имеет такого риска злоупотребления [31], поэтому перспектива применения его для лечения рефракторной депрессии выглядит многообещающе.
Заключение
Резистентная депрессия оказывает устойчивое негативное влияние на жизнь и встречается у трети больных депрессией [32]. Применение антагонистов NMDA-рецепторов для ее лечения является перспективным и отчасти введенным в практику в других странах решением.
Несмотря на положительный терапевтический эффект эскетамина, у него есть серьезные ограничения, требующие дополнительных исследований безопасности и эффективности других антагонистов — например, рассмотренных нами аркетамина и декстрометорфана.
В России эти препараты для лечения депрессии официально не используются, но дальнейшие исследования об их безопасности могли бы помочь ввести новые методы лечения ТРД в практику и облегчить жизнь людям, страдающим от депрессии.
Литература
- Stephen M. Stahl, Debbi A. Morrissette, Gianni Faedda, Maurizio Fava, Joseph F. Goldberg, et. al.. (2017). Guidelines for the recognition and management of mixed depression. CNS Spectr.. 22, 203-219;
- От МКБ-10 к МКБ-11: что было, что будет, чем сердце успокоится;
- Souery D., Papakostas G., Trivedi M. (2006). Treatment-resistant depression. Journal of Clinical Psychiatry. 67, 16–22;
- Mu-Hong Chen, Shih-Jen Tsai. (2024). Maintenance of antidepressant effect by dextromethorphan in patients with treatment-resistant depression who respond to ketamine intervention. Medical Hypotheses. 182, 111242;
- Koen Demyttenaere, Zeno Van Duppen. (2019). The Impact of (the Concept of) Treatment-Resistant Depression: An Opinion Review. International Journal of Neuropsychopharmacology. 22, 85-92;
- Краткая история антидепрессантов;
- https://biomolecula.ru/articles/chem-zaedat-tosku-mekhanizmy-antidepressivnogo-deistviia-sredizemnomorskoi-i-ketogennoi-die;
- Фармакофоры нейропластичности;
- David E Olson. (2018). Psychoplastogens: A Promising Class of Plasticity-Promoting Neurotherapeutics. J Exp Neurosci. 12, 117906951880050;
- Marc S. Lener, Mark J. Niciu, Elizabeth D. Ballard, Minkyung Park, Lawrence T. Park, et. al.. (2017). Glutamate and Gamma-Aminobutyric Acid Systems in the Pathophysiology of Major Depression and Antidepressant Response to Ketamine. Biological Psychiatry. 81, 886-897;
- Gregor Hasler, Stephen Fromm, Paul J. Carlson, David A. Luckenbaugh, Tracy Waldeck, et. al.. (2008). Neural Response to Catecholamine Depletion in Unmedicated Subjects With Major Depressive Disorder in Remission and Healthy Subjects. Arch Gen Psychiatry. 65, 521;
- Shujia Zhu, Richard A. Stein, Craig Yoshioka, Chia-Hsueh Lee, April Goehring, et. al.. (2016). Mechanism of NMDA Receptor Inhibition and Activation. Cell. 165, 704-714;
- Kim A., Kerchner G., Choi D. Blocking Excitotoxicity. In CNS Neuroproteciton. Springer, New York. P. 3–36;
- Neil L. Harrison, Michael A. Simmonds. (1985). Quantitative studies on some antagonists of N‐methyl D‐aspartate in slices of rat cerebral cortex. British J Pharmacology. 84, 381-391;
- Roger S. McIntyre, Mohammad Alsuwaidan, Bernhard T. Baune, Michael Berk, Koen Demyttenaere, et. al.. (2023). Treatment‐resistant depression: definition, prevalence, detection, management, and investigational interventions. World Psychiatry. 22, 394-412;
- Sanne Y Smith-Apeldoorn, Jolien KE Veraart, Jan Spijker, Jeanine Kamphuis, Robert A Schoevers. (2022). Maintenance ketamine treatment for depression: a systematic review of efficacy, safety, and tolerability. The Lancet Psychiatry. 9, 907-921;
- Jennifer L. Phillips, Sandhaya Norris, Jeanne Talbot, Meagan Birmingham, Taylor Hatchard, et. al.. (2019). Single, Repeated, and Maintenance Ketamine Infusions for Treatment-Resistant Depression: A Randomized Controlled Trial. AJP. 176, 401-409;
- Tiago Gil, Tatiana CS Bonetti. (2024). Efficacy of intravenous esketamine in reducing suicidal ideation and major depressive symptoms: A real-world evidence study. Journal of Affective Disorders Reports. 17, 100809;
- Ella J. Daly, Jaskaran B. Singh, Maggie Fedgchin, Kimberly Cooper, Pilar Lim, et. al.. (2018). Efficacy and Safety of Intranasal Esketamine Adjunctive to Oral Antidepressant Therapy in Treatment-Resistant Depression. JAMA Psychiatry. 75, 139;
- Lijia Chang, Kai Zhang, Yaoyu Pu, Youge Qu, Si-ming Wang, et. al.. (2019). Comparison of antidepressant and side effects in mice after intranasal administration of (R,S)-ketamine, (R)-ketamine, and (S)-ketamine. Pharmacology Biochemistry and Behavior. 181, 53-59;
- . (2017). Correction to “Antidepressant Potential of (R)-Ketamine in Rodent Models: Comparison with (S)-Ketamine”. The Journal of Pharmacology and Experimental Therapeutics. 362, 1;
- Panos Zanos, Ruin Moaddel, Patrick J. Morris, Polymnia Georgiou, Jonathan Fischell, et. al.. (2016). NMDAR inhibition-independent antidepressant actions of ketamine metabolites. Nature. 533, 481-486;
- Gustavo C. Leal, Breno Souza-Marques, Rodrigo P. Mello, Igor D. Bandeira, Ana Teresa Caliman-Fontes, et. al.. (2023). Arketamine as adjunctive therapy for treatment-resistant depression: A placebo-controlled pilot study. Journal of Affective Disorders. 330, 7-15;
- Adam Włodarczyk, Jakub Słupski, Joanna Szarmach, Wiesław J. Cubała. (2024). Single arketamine in treatment resistant depression: Presentation of 3 cases with regard to sick-leave duration. Asian Journal of Psychiatry. 96, 104016;
- Edward C. Lauterbach. (2011). Dextromethorphan as a potential rapid-acting antidepressant. Medical Hypotheses. 76, 717-719;
- Amna Majeed, Jiaqi Xiong, Kayla M. Teopiz, Jason Ng, Roger Ho, et. al.. (2021). Efficacy of dextromethorphan for the treatment of depression: a systematic review of preclinical and clinical trials. Expert Opinion on Emerging Drugs. 26, 63-74;
- Laura E. Pope, M. H. Khalil, James E. Berg, Mark Stiles, Gerald J. Yakatan, Edward M. Sellers. (2004). Pharmacokinetics of Dextromethorphan After Single or Multiple Dosing in Combination With Quinidine in Extensive and Poor Metabolizers. The Journal of Clinical Pharma. 44, 1132-1142;
- Ying Zhang, Margaret R Britto, Kristen L Valderhaug, Peter J Wedlund, Richard A Smith. (1992). Dextromethorphan: Enhancing its systemic availability by way of low-dose quinidine-mediated inhibition of cytochrome P4502D6. Clin Pharmacol Ther. 51, 647-655;
- James W. Murrough, Elizabeth Stade, Sehrish Sayed, Gabriella Ahle, Drew D. Kiraly, et. al.. (2017). Dextromethorphan/quinidine pharmacotherapy in patients with treatment resistant depression: A proof of concept clinical trial. Journal of Affective Disorders. 218, 277-283;
- Philip R. Wang, Mani Yavi, Holim Lee, Yasmine Kotb, Lorie Shora, et. al.. (2023). An Open-Label Study of Adjunctive Dextromethorphan/Quinidine in Treatment-Resistant Depression. J Clin Psychopharmacol. 43, 422-427;
- David C. Spangler, Catherine M. Loyd, Emily E. Skor. (2016). Dextromethorphan: a case study on addressing abuse of a safe and effective drug. Subst Abuse Treat Prev Policy. 11;
- A. John Rush, Madhukar H. Trivedi, Stephen R. Wisniewski, Andrew A. Nierenberg, Jonathan W. Stewart, et. al.. (2006). Acute and Longer-Term Outcomes in Depressed Outpatients Requiring One or Several Treatment Steps: A STAR*D Report. AJP. 163, 1905-1917.