Фармакофоры нейропластичности
10 февраля 2022
Фармакофоры нейропластичности
- 1874
- 0
- 10
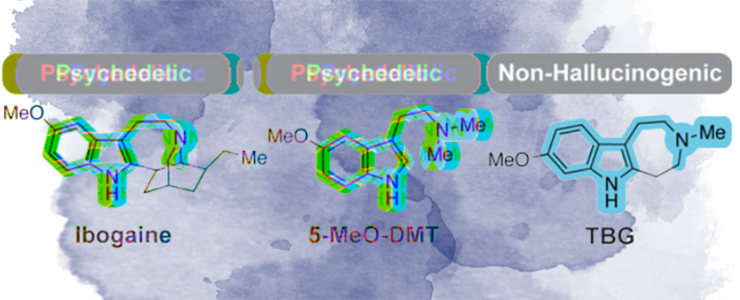
Формулы психоделиков и табернанталога.
Рисунок в полном размере.
коллаж автора с использованием рисунков из [4]
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: О терапевтическом потенциале психоделиков при лечении психиатрических расстройств или расстройств употребления психоактивных веществ известно на протяжении десятков лет. Однако причины, из-за которых психоделики показывают поразительные результаты, не так уж очевидны. Статья A Non-Hallucinogenic Psychedelic Analog with Therapeutic Potential сфокусирована на рассмотрении нейропластичности, вызываемой психоделиками, как одного из главных факторов их эффективности.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Дух vs. материя — новые стороны старого вопроса
Доминирующее представление о наркотической зависимости рассматривает ее как болезнь мозга [2]. В этой модели зависимость характеризуется потерей свободы воли, а объясняется это нейробиологическими причинами — употребление наркотиков превращает нормальные когнитивные процессы, а также процессы, связанные с системой вознаграждения, в патологические. Предполагается, что эта модель дестигматизирует употребление психоактивных веществ: ведь причина не в природной слабости характера, а в болезни. К сожалению, в реальности на походы к наркологу также навешивают ярлыки и, как следствие, снова создают стигму.
Альтернатива — модель обучения — в свою очередь, отталкивается от влияния факторов общества и окружающей среды: неблагоприятные переживания в детстве и подростковом возрасте, физические, психологические травмы и бедность приводят к употреблению психоактивных веществ. В этой парадигме зависимость рассматривается как естественная, контекстно-зависимая реакция на сложные обстоятельства окружающей среды, а не болезнь или слабость характера. Нейробиологические изменения здесь также присутствуют, но их считают следствием обычной работы мозга: поведенческие привычки развиваются по модели «стимул—реакция», а их последующее повторение — обычное научение. Осознание же себя пациентом подразумевает, что первейшая обязанность человека — следовать инструкциям тех специалистов, которые полагаются на медикаментозный подход, что в некоторых случаях приводит к перекладыванию ответственности за выздоровление на медицинский персонал. С точки зрения модели обучения, ключевую роль играет изучение собственных мотивов и убеждений [3].
Большинство доступных лекарств направлены на облегчение синдрома абстиненции или на уменьшение желания употреблять наркотики [4]. Однако расстройство употребления психоактивных веществ связывают с изменением нейропластичности мозга, и это — еще одно направление для разработки терапии [5], [6].
Зонтичным термином «(нейро)пластичность» обозначают способность мозга к изменению существующих нейрональных путей на структурном и функциональном уровне в течение жизни. Структурная пластичность — это морфологические изменения нейронов (в аксонах, дендритах и дендритных шипиках — см. рис. 1) или нейронных путей, появление и удаление синапсов, а также нейрогенез. Синаптическая пластичность означает усиление или ослабление силы синапса в зависимости от увеличения или уменьшения активности между нейронами [7]. На изменение активности влияет опыт: обучение, в процессе которого связь между определенными нейронами усиливается; и забывание, когда связь ослабляется.
Самый красивый рассказ о синапсах, который полезно как и прочитать, так и перечитать: «Как происходит выделение нейромедиатора» [8].
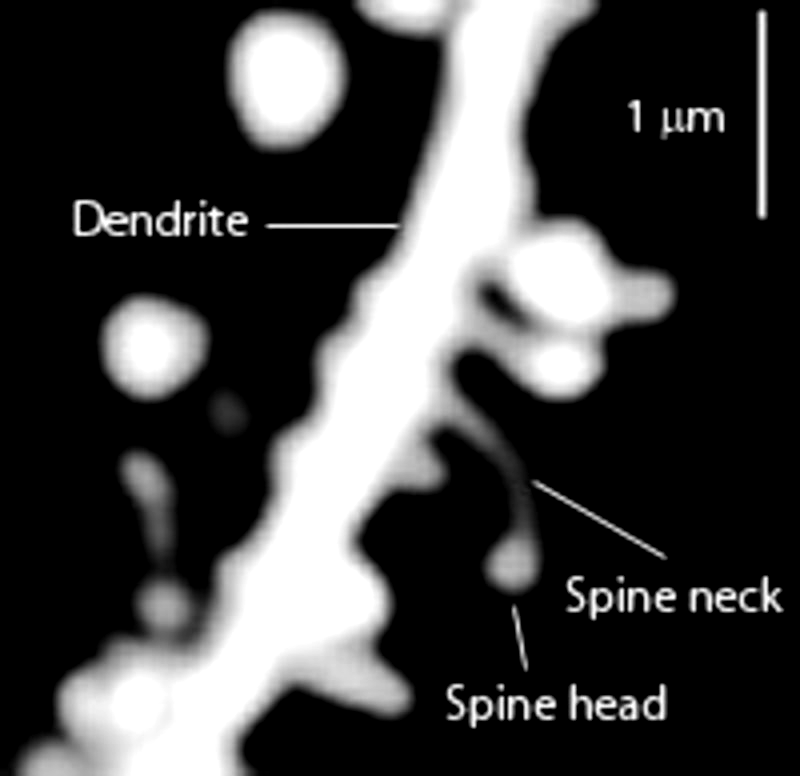
Рисунок 1. Дендритные шипики часто будут упоминаться далее, поэтому полезно знать, кто это такое — богатые актином выросты дендрита, являющиеся основой синаптического контакта нейронов, в основном глутаматергических. Морфологически это «выпуклая голова на тонкой шее», торчащая из дендрита. На эффективность синаптического контакта влияет размер «головы», а суженная «шея» позволяет сохранять метаболическую активность непосредственно рядом с активированным синапсом, не уменьшая передачу электрического заряда на следующий дендрит. Там же находится постсинаптическое уплотнение: сотни различных белков, в том числе — глутаматных рецепторов [9], [10].
Яркий пример пластичности, связанный с адаптивным изменением — реорганизация коры вследствие изменения поступающей информации. Например, у слепых людей зрительная кора активируется при локализации звука, тактильном восприятии и восприятии запахов. По всей видимости, не занятая зрительным восприятием, эта часть мозга начинает обрабатывать сенсорные потоки других модальностей [11]. Не менее яркий пример неадаптивного изменения — аддикция, так как в ее основе лежит пластичность нейронных цепей, вовлеченных в принятие решений; механизмы подкрепления и вознаграждения; изменения нейротрансмиттерных систем, морфологии нейронов и т.д. На личностном уровне это проявляется как ухудшение возможности контролировать употребление, а также меньшая мотивация получать удовольствие от естественных источников, таких как спорт, еда или секс.
Однако можно ли индуцировать пластичность не такими тонкими материями, как когнитивные процессы, а более «прямо» — скажем, таблетками? Похоже, есть ответ!
Вещества, способные значительно изменять пластичность (влиять на рост нейритов, плотность дендритных шипиков, количество синапсов и т.д.) после однократного приема, называются психопластогены [12]. Важные отличительные черты — проявление эффектов после однократного применения и их сохранение в течение длительного времени.
Стоит подчеркнуть, что и уменьшение, и увеличение количества шипиков относится к пластичности. Однако хорошо это или плохо — зависит от области мозга и от типа воздействия на пластичность (употребление стимуляторов, психопластогенов, разгадывание судоку, обучение новому языку и т.д.). Например, больше шипиков может означать возможность нейрона образовывать больше синапсов с другими нейронами.
Подробнее о психопластогенах
Однако исследования психоделиков начинались с другими целями и с другими вопросами. В 1950-х психиатры исследовали возможность применения психоделиков как для понимания природы психозов (принимая самостоятельно), так и для сопровождения психотерапии (в данном случае психоактивные вещества принимали уже пациенты). Однако после того, как ЛСД просочилась из лабораторий на улицы, исследования были запрещены сначала в США, а потом — во множестве других стран. Запрет в США и начало войны против наркотиков связывают с тем, что в 1960-е Америка вела войну со Вьетнамом, а cреди участников антивоенного движения были хиппи — контркультура, отчасти связанная с употреблением психоделиков. Правительство США демонизировало ЛСД, распространяя различные мифы — например о том, что ЛСД содержит яд стрихнин.
Конечно, это не способствовало расцвету научных исследований, расцвет которых начался спустя десятилетия и был назван «психоделическим ренессансом» — с тех пор психоделики были исследованы как средство для лечения депрессии, ПТСР, зависимостей от психоактивных веществ, уменьшения тревоги, связанной со страхом смерти у людей с раком в последней стадии.
Подробнее о психоделическом ренессансе, а также о проблемах методологии можно почитать в предшествующих статьях на «Биомолекуле»: «Дивный новый мир психоделиков», «Новая жизнь психоделиков» [15], [16].
Сегодня методология, использованная в пилотных и последующих исследованиях, начинает пересматриваться, так как психоделический опыт делает проведение двойного слепого плацебо-контролируемого исследования (то, что ученые произносят вместо мантры) крайне затруднительным, поскольку, несмотря на использование активного плацебо, и врач, и пациент, без сомнения, способны отличить высокие дозы психоделиков от плацебо [17]. Теперь исследователи строже относятся к постановке контрольных экспериментов, задают новые вопросы — и вот мы оказываемся в точке, где вместо описания неосязаемого мистического опыта и предположений о коллективном бессознательном, ответственном за видения, ученые высчитывают количество шипиков или рецепторов, чтобы посмотреть на этот феномен с более материалистических позиций.
Говоря о психопластогенах, нельзя не отметить наиболее известный — кетамин, вызывающий быстрые изменения в префронтальной коре через увеличение количества шипиков [5], [12]. Возможно, с этим и связан антидепрессивный эффект кетамина (рис. 3), так как предполагается, что при депрессии количество дендритных шипиков уменьшается, поэтому увеличение их числа может стать базой для выздоровления [12].
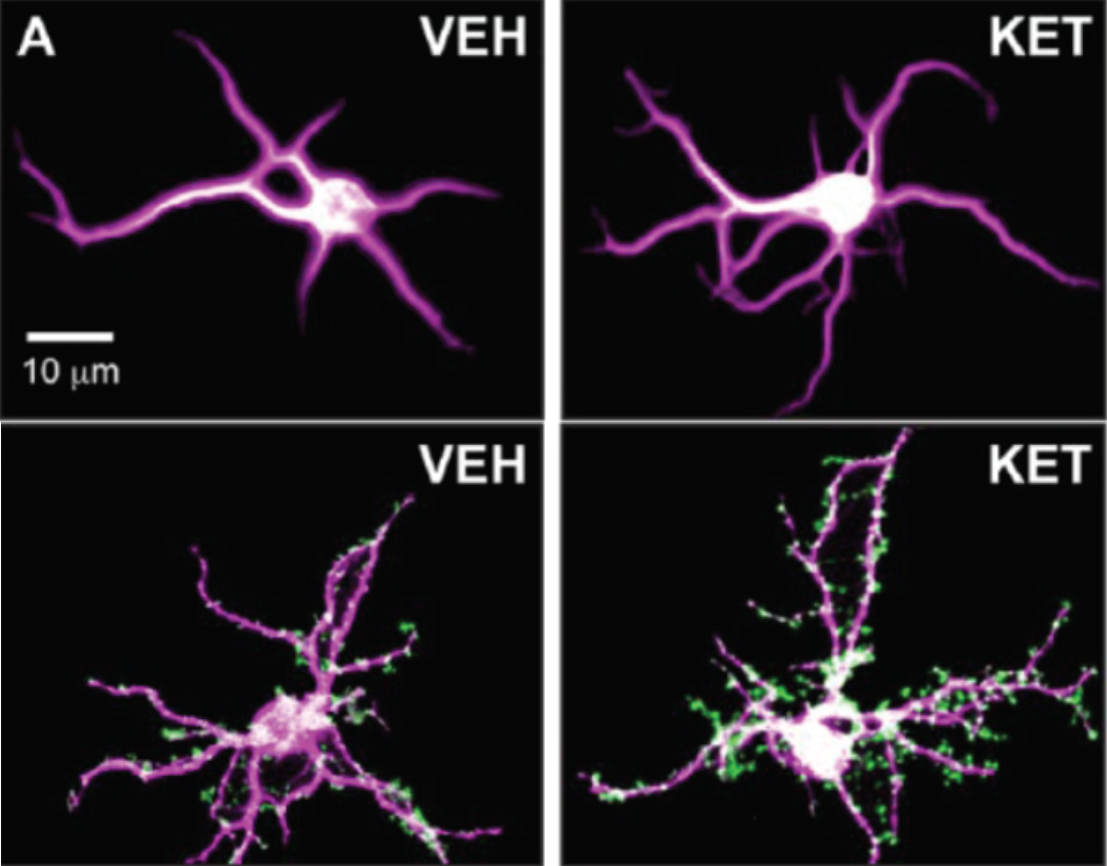
Рисунок 3. Психопластогенные свойства кетамина. Сверху: незрелые кортикальные нейроны. Снизу: зрелые кортикальные нейроны. VEH — контроль, KET — кетамин. На верхних фреймах видно более интенсивное ветвление дендритного дерева на нейронах, обработанных кетамином, по сравнению с контролем, на нижних — большее количество синапсов.
В российской ветеринарии кетамин имеет печальную историю: в начале двухтысячных говорили о «кетаминовых войнах» — периоде, когда кетамин попал в обновленный перечень запрещенных психотропных веществ. На ветеринаров, рискнувших его использовать — а это было широко распространенное, эффективное и дешевое средство для наркоза, которому не было и нет аналогов по данным параметрам — возбуждались уголовные дела («сбыт наркотиков путем инъекции кошке»), а врачи действительно отправлялись в колонию. Позже использование кетамина стало возможным только при наличии сейфа и отдельного помещения, что не решило проблему: такие условия может себе позволить далеко не каждая ветеринарная лаборатория (поэтому разрешение получили только несколько клиник), а о частнопрактикующих врачах в деревнях и селах и говорить не стоит.
Относительно применения в «человеческой» медицине есть работы, где сообщают об отсутствии серьезных побочных эффектов при применении кетамина для облегчения сильной боли в отделениях неотложной терапии, в то время как другие говорят о такой же частоте нежелательных явлений, как и у бензодиазепинов. В рандомизированных РКИ, посвященных послеоперационной боли, кетамин демонстрирует отсутствие нежелательных явлений — и вместе с тем эффективное обезболивание в короткий период, а также уменьшение количества использования опиоидов при добавлении кетамина в качестве адъюванта в общей анестезии. Все это происходит в низких дозах, так как больше 1 мг/кг уже вызывает не только седацию, но и диссоциативное состояние.
Тем не менее, именно галлюциногенный эффект кетамина использовал Е.М. Крупицкий в России для лечения алкогольной и опиоидной зависимостей, пока эти исследования были разрешены [18].
А в США в 2019 году S-энантиомер кетамина, более мощный по сравнению с R-энантиомером, был одобрен FDA (Food and Drug Administration) для лечения резистентной депрессии. Тем не менее, у ученых вызывает беспокойство тот факт, что кетамин вызывает зависимость, поэтому этим исследованиям требуется тщательное масштабное продолжение [19].
Однако следует учитывать и то, что терапевтический потенциал [15], [16] психоделиков может быть ограничен следующими факторами:
- вероятность возникновения кратковременной тревоги или психологического дискомфорта;
- противопоказания к использованию из-за наличия в анамнезе психиатрических расстройств;
- высокая цена психоделически-ассоциированной терапии (из-за необходимости привлекать специалистов, которые будут сопровождать пациента в течение всего времени действия психоделика) [4].
В странах, где эти исследования развиваются, уже есть Центр по изучению психоделиков и сознания (США) и Центр по изучению психоделиков (Великобритания). Отдельно стоит вынести тот факт, что, так как психоактивные вещества находятся вне закона, то для получения разрешения на работу с ними требуется специальная лицензия. И даже если законодательно такая возможность есть — даже в России — далеко не факт, что получится осуществлять подобные исследования.
В книге Станислава Грофа — пионера LSD-ассоциированной терапии — есть пассаж о научной парадигме: насколько она ригидна, когда принята академическим сообществом; настолько скован ею ученый, который становится всего-навсего «решателем задач», а не вопрошающим субъектом, и который исследует только то поле необъясненного, которое считается ценным в рамках этой парадигмы. В таких условиях не рождается революционное знание, новые концепции не рассматриваются и происходит застой на десятилетия (ведь мы уже приняли определенную объясняющую модель, чего еще!)
Сегодня, напротив, амбассадоры психоделического ренессанса не ограничиваются парадигмами прошлого и задаются вопросами: можно ли изменить структуру психоделиков таким образом, чтобы оставить их терапевтический эффект, но убрать галлюцинаторный? И возможно ли, что терапевтические эффекты психоделиков обусловлены именно влиянием на нейропластичность, а не глубоким мистическим опытом [17]?
Антиаддиктивный потенциал ибогаина
Ибогаин — главный алкалоид кустарника Tabernanthe iboga. Низкие его дозы используются некоторыми экваториальными африканскими племенами как стимулятор для предотвращения усталости, голода и жажды на охоте, а высокие — в религиозных ритуалах (рис. 4) [20].
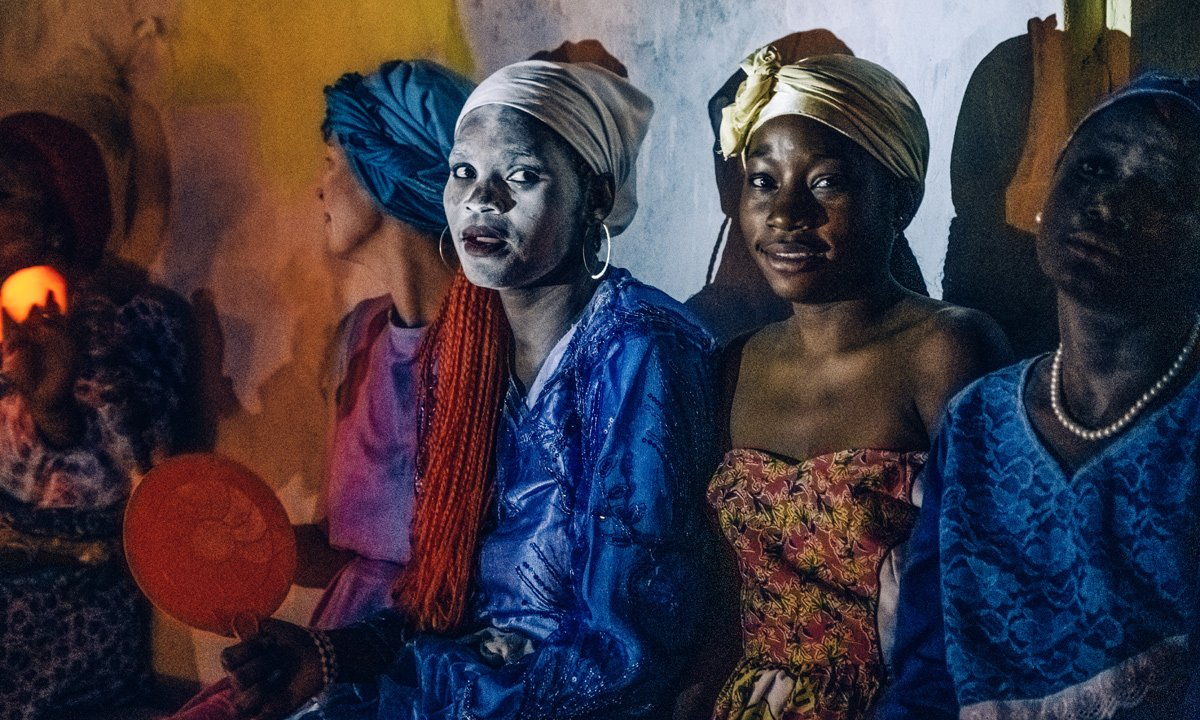
Рисунок 4. Женщины из религиозного движения бвити Центральной Африки, участвующие в одной из церемоний [21]. Приверженцы движения бвити (хотя оно не единственное в Африке, связанное с этим растением) употребляют ибогаин добровольно (без последующего сожаления или раскаяния; в основном, в ритуальных или медицинских целях), так что едва ли здесь можно говорить о «зависимости». Этноботаников, изучавших бвити, это заставило задуматься об использовании терминов «зависимость», «синдром отмены» и «срыв» — центральных для Запада во времена drug wars. На развитие бвити повлиял и французский колониализм — хотя, безусловно, ибогаин употреблялся и до этого. Но французы не только заставляли африканцев тяжело работать, устанавливали непосильные налоги, но и вмешивались в культурные устои. Туземцы переживали отчаяние, изгнанность и чужеродность собственной земле.
Сексуальная жизнь мужчин на плантациях или в лесных лагерях также значительно увеличила венерические заболевания, привела к снижению фертильности как мужчин, так и заболевших женщин. Резкое снижение рождаемости поставило под сомнение возможность сохранения поколений во времени. Религиозные лидеры обещали, среди прочего, что ибога восстановит утерянный контакт с предками, фертильность женщин и появление следующих поколений. Отчаявшиеся туземцы нашли в бвити утешение — так как ибогаин позволяет почувствовать связь с предками сквозь время и пространство, что составляет одну из основополагающих идей этого движения.
Однако ибогаин имеет и негативные побочные эффекты — тахикардия, гипотензия, тошнота, рвота и даже смерть. Некоторые авторы предполагают, что за смертельными исходами у людей может стоять норибогаин — основной метаболит, так как период полувыведения ибогаина составляет 4–7 часов, а смерть наступает через ≥8 часов и через 24–48 часов после приема [22].
Tabernanthe iboga был привезен во Францию в середине 19 века, а его психоактивный компонент был изолирован в 1901 из коры корня. В период с 1939 по 1970 гг. ибогаин продавался как нейромускульный стимулятор под торговым названием Lambarene, рекомендованный к употреблению для лечения усталости, депрессии и восстановления от инфекционных заболеваний [23]. Однако большая часть популярности ибогаина связана с антиаддиктивным эффектом растения, который был известен и раньше [20], но особую популярность приобрел благодаря Говарду Лотсофу.
Молодой человек вместе с группой друзей в 1960-е исследовал влияние ибогаина на психику — можно предположить, что в тот период такими посиделками с друзьями было никого не удивить. К тому же, эти события происходили за несколько лет до того, как ибогаин перестал быть легальным, а продажа Lambarene была остановлена. Среди неожиданных эффектов было отсутствие желания употреблять героин, хотя до этого Г. Лотсоф имел опиоидную зависимость. В течение трипа, который длился около суток, его посещали видения, а под конец случился инсайт: «Если раньше я воспринимал героин как наркотик, дающий мне ощущение комфорта, то теперь этот взгляд изменился — героин был тем, что несет смерть. Следом за этим меня посетила мысль: я предпочитаю жизнь смерти».
Спустя 20 лет после психоделического опыта и интенсивной работы, Г. Лотсоф основал некоммерческую организацию Dora Weiner Foundation, чьей целью было продвижение ибогаиновой терапии.
В этот же период Г. Лотсоф получил патент для использования ибогаина в качестве средства для облегчения синдрома отмены. Позже патенты были получены для лечения кокаиновой, алкогольной, никотиновой, а также полизависимостей, а психиатром Клаудио Наранхо — французский патент для психотерапевтического использования ибогаина. В 1991 Национальный институт по вопросам злоупотребления (NIDA) начал проект по токсикологической оценке ибогаина и созданию протокола исследований на добровольцах. Несмотря на то, что были проведены встречи по разработке 1 и 2 фаз клинических испытаний, NIDA закрыл проект из-за критики представителей фармакологической индустрии [23].
18-метоксикоронаридин
Как и любой известный сегодня психоделик, в конце концов ибогаин был внесен в Перечень наркотических средств 1 категории в США и ряде других стран (аналогичный перечень РФ пополнился ибогаином в 2018 году). Однако Лотсоф не сдавался в своих попытках использовать ибогаин как средство для лечения зависимостей и убедил фармаколога Стэнли Глика протестировать вещество на морфин-зависимых крысах. Пилотное исследование показало, что ибогаин снижает самовведение морфина (по крайней мере, в течение следующего дня) [24]. В результате дальнейшей коллаборации С. Глика, М. Кюне и Ю. Бандараж, исследователи синтезировали соединение 18-метоксикоронаридин (18-MC; рис. 5), которое было эффективным при лечении морфиновой и кокаиновой зависимостей на крысах, будучи одновременно менее нейротоксичным и не вызывающим тремор, по сравнению с ибогаином [25].
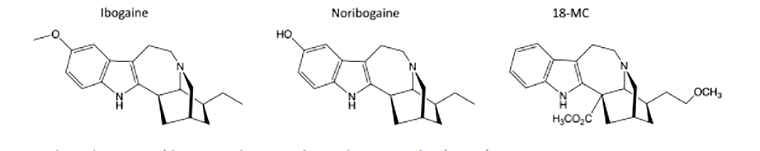
Рисунок 5. Сравнительные формулы ибогаина, норибогаина и 18-МС.
18-МС в настоящее время тестируется на здоровых добровольцах для оценки безопасности, а в дальнейшем — для лечения опиоидной зависимости. Большинство синтезированных аналогов 18-МС ингибировали никтонивые ацетилхолиновые рецепторы α3β4 [20] (расположенные в основном в поводково-межножковом пути), работающие в качестве второй системы вознаграждения — отдельно от мезолимбической. Предполагается, что они реципрокно связаны и могут ингибировать активность друг друга. Гликом и др. предположили, что 18-МС, находясь в поводково-межножковом пути, может ослаблять активность мезолимбического [26], таким образом снижая эйфорию от употребления наркотиков.
Ибогаин и компания — полилиганды!
На данный момент нет четкого понимания, есть ли у ибогаина «любимый рецептор», потому что он связывается со многими с разной аффинностью [27]. Ибогаин, норибогаин и 18-МС связываются с μ-опиоидными рецепторами (МОР) в микромолярном диапазоне. Сам по себе ибогаин не проявляет классический МОР-опосредованный эффект анальгезии, но усиливает ее при наличии морфина [28]. Норибогаин в большей степени связывается с κ-рецепторами, чем с MOP [29].
Ибогаин ингибирует связывание меченого радиолигандом дизоцилпина (MK-801) у крыс, который является неконкурентным антагонистом NMDA [30]. NMDA-антагонисты блокируют эффекты «вознаграждения» (при котором стимулы окружающей среды вызывают желание употреблять) и подкрепления (когда определенные стимулы усиливают это желание) [31] от таких наркотиков, как морфин и кокаин [32]. Можно предположить, что ингибирование NMDA рецепторов играет роль при лечении зависимости.
Неконкурентными антагонистами называются молекулы, необратимо связывающиеся с рецептором при любом количестве агониста (вещества, вызывающего физиологический ответ при связывании с рецептором). А подробнее об NMDA рецепторах можно почитать в статье «Очень нервное возбуждение» [33].
Ибогаин стабилизирует открытую внутрь клетки (inward-open) конформацию транспортеров дофамина (DAT) и серотонина (SERT) in vitro, действуя противоположно амфетаминам. Последние, связываясь с DAT, заставляют дофамин вытекать из клетки в синаптическую щель, а ибогаин, напротив, уменьшает выброс дофамина [20], [34].
Блокада обратного захвата серотонина ведет к его увеличенному количеству в синаптической щели; возможно, с этим связан антидепрессивный эффект, а также действие многих стимуляторов. На крысах показано, что ибогаин блокирует увеличение внеклеточной концентрации дофамина, вызываемое кокаином, морфином и никотином, что и может быть механизмом, подавляющим употребление [34].
Ибогаин и его аналоги также демонстрируют необычное свойство служить «фармакошаперонами» DAT: при добавлении к мутантным транспортерам ибогаина незрелые белки трансформировались в зрелые, а мутантные — в снова работающие [20], [35]. Французский химик Роберт Гутарель выдвинул гипотезу, что ибогаиновая терапия вызывает состояние, функционально похожее на REM-фазу сна. В течение этой фазы происходит реконсолидация выученной информации: все произошедшее за день перекомпоновывается в мозгу, и возникают новые ассоциации. Гутарель предположил, что это соответствует периоду повышенной пластичности, во время которого может происходить ослабление патологических связей между ключевыми стимулами, связанными, в том числе, с употреблением [23].
Табернанталог: что бы сказал Говард Лотсоф?
Однако в чем же кроется тайна фармакологических свойств ибогаина? Исследователи из лаборатории Дэвида Олсона хотели понять, какой фармакофор необходим для проявления психопластогенных свойств (рис. 6). Промежуточный аналог, в котором отсутствовал изохинуклидин, назвали ибогаиналогом (далее — ИБГ). Он действовал как ибогаин, однако имел упрощенную химическую структуру. Выбранная молекула также обладала меньшей липофильностью, что означает (и было показано в тестах in vitro) более низкую кардиотоксичность. Окончательным вариантом стала молекула, получившая название табернанталог (ТБГ). Она была синтезирована по подобию 6-MeO-DMT — аналога сильного галлюциногена диметилтриптамина, — молекулы, предположительно лишенной галлюциноторных эффектов (судя по тестам на животных — она не вызывала у крыс подергивания головой ).
Подергивание головой (head twitch response, HTR) — это поведенческая модель действия галлюциногенов, проявляющаяся в быстрых движениях головы из стороны в стороны у мышей и крыс после активации рецептора серотонина 5-HT2A. Однако некоторые соединения (например, лизурид [36]) не вызывают HTR, хотя, вероятнее всего, и связываются с теми же рецепторами [37].
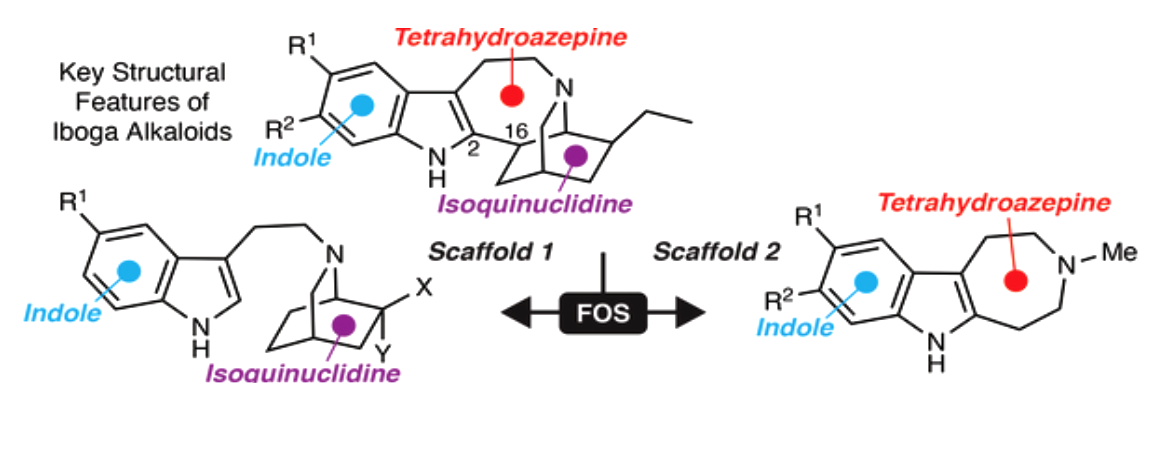
Рисунок 6. Какие загадки таит химическая структура ибогаина? Его структурными особенностями являются индол, 7-членный тетрагидроазепин и бициклический изохинуклидин (сверху). Медицинские химики синтезировали молекулы, лишенные тетрагидроазепина (слева) или изохинуклидина (справа).
Предварительные тесты... мостик в будущее?
Дэвид Олсон, один из соавторов разбираемой здесь статьи [37], также является сооснователем компании Delix Therapeutics с вдохновляющим слоганом — Rewiring the brain to heal the mind. Они хотят создать компанию мирового класса, основываясь на терапевтических возможностях психопластогенов. А своей миссией видят расширение доступа пациентов к безопасным, быстродействующим и долгосрочным лекарствам. Возможно, это им и удастся, ведь у них множество инвесторов, готовых отдавать деньги на многообещающие и прорывные исследования.
Недавняя работа Delix Therapeutics посвящена разработке биосенсора для определения галлюцинаторного эффекта соединений. PsychLight — биосенор на основе химерного серотонинового рецептора — позволяет регистрировать конформационные изменения при связывании с ним серотонинергических галлюциногенов [38]. Эта технология позволит разрабатывать терапевтические вещества, ориентированные на рецепторы 5-HT2A, но не вызывающие галлюцинаций.
А работа, о которой здесь идет речь [37], была опубликована в 2020 году уже при поддержке Национальных институтов здравоохранения США (NIH) и Национального института злоупотребления наркотиками США (NIDA), а также множества других фондов. А в декабре 2021 Delix Therapeutics объявила о партнерстве с этими институтами для тестирования одной из ведущих разработок: негаллюциногенного и нетоксичного аналога ибогаина — табернанталога.
В доклинических исследованиях , направленных на исследование потенциального лекарства, необходимо установить, насколько оно безопасно, канцерогенно, как влияет на фертильность и на множество других факторов, относящихся к здоровью. Данная работа не похожа на полноценное доклиническое исследование (которое, возможно, не за горами, учитывая партнерства с Национальными институтами), однако некоторые элементы оттуда она заимствует.
О доклинических исследованиях уже было хорошо и подробно написано на «Биомолекуле» — «От живого к неживому. Доклинические исследования сегодня и завтра» [39].
С табернанталогом были проведены серии тестов — например, на побочные эффекты со стороны сердечно-сосудистой системы. Тогда как введение ибогаина обездвиженным личинкам рыбок данио снижало частоту сердечных сокращений и увеличивало вероятность возникновения аритмий (что является главной причиной смертей при приеме ибогаина), ни ТБГ, ни ИБГ подобных эффектов не вызывали.
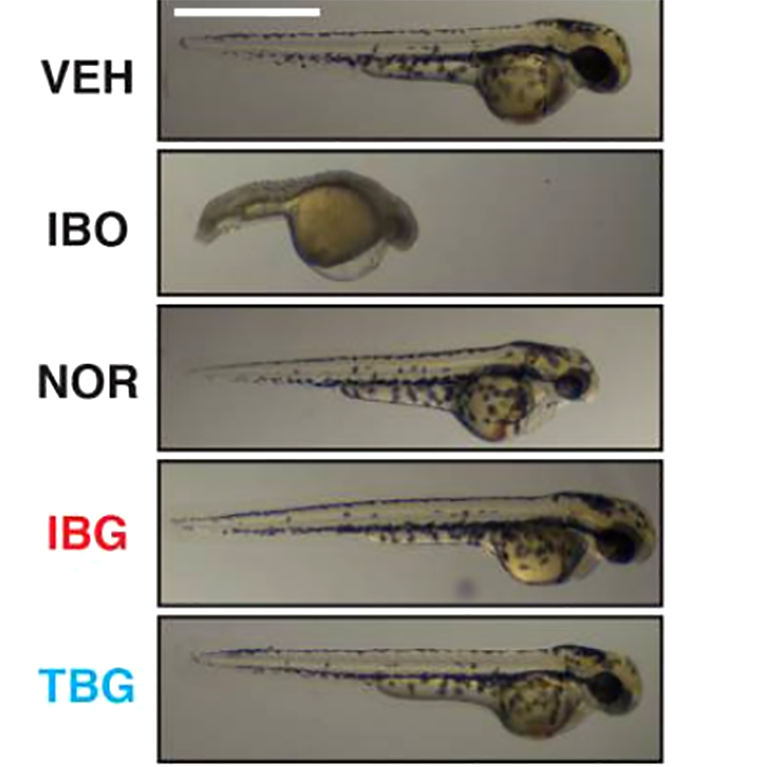
Рисунок 7. Danio rerio: как пороки развития рыб помогают оценить (без)опасность различных соединений. На первом фрейме видно нормальное развитие малька (VEH — это контроль). На двух последующих изображены пороки развития, вызванные ибогаином (IBO) и норибогаином (NOR). Последние два фрейма похожи на контроль — то есть ни ибогаиналог (IBG), ни табернанталог (TBG) не приводят к заметным уродствам.
Помимо аритмий, высокие дозы ибогаина, по некоторым данным, могут вызывать у людей судороги, что может довести даже до летального исхода [40]. Авторы этой работы решили оценить судорожный эффект ибогаина и ТБГ самостоятельно. Для этого использовали личинки рыб, экспрессирующих GCaMP5 — генетически кодируемый индикатор кальция, с помощью которого можно наблюдать деполяризацию нейрона. В этой работе ни ибогаин, ни ТБГ не вызывали чрезмерной нервной активности, ведущей к припадку, что наблюдалось после лечения известным, вызывающим судороги соединением— пентилентетразолом.
Анализ токсикологического влияния ибогаина на развитие рыб показал увеличение количества пороков развития и смертности на 2-й (рис. 7) и 5-й дни после оплодотворения. ИБГ и ТБГ, по сравнению с ибогаином, введенным в такой же концентрации, оставляли в живых достоверно большее количество рыб. Уменьшение концентрации привело к тому, что доля жизнеспособных рыб по отношению к нежизнеспособным не отличалась от контроля. Эти исследования позволяют предположить безопасность ТБГ по сравнению со своим «прародителем», однако, разумеется, чтобы утверждать это окончательно, требуются более масштабные доклинические и клинические исследования.
Что же с рецепторами?
Как мы видели раньше, ибогаин и норибогаин связываются со множеством разных рецепторов. В работе [37] изучали связывание их аналогов ИБГ и ТБГ только с серотониновыми и опиоидными рецепторами, и если активности на последние практически не было, то вот на человеческие и мышиные серотониновые 5-HT2A рецепторы эти молекулы действуют просто отменно. В отношении 5-HT2B рецепторов ТБГ и ИБГ ведут себя как антагонисты, что уменьшает вероятность возникновения сердечной недостаточности.
Несмотря на многообещающие результаты, остается еще один важный вопрос — а не вызывает ли ТБГ привыкание? Хотя известно, что психоделические вещества (вроде бы) не вызывают зависимости (диаграмма 4 в классификации психоактивных веществ), авторы провели тест на условно-рефлекторный выбор места. С помощью данного теста можно показать, проводит животное больше или меньше времени в отсеке клетки, в котором производили экспериментальные манипуляции (в данном случае — вводили ТБГ) по сравнению с другим отсеком. Другими словами, насколько это было приятно или неприятно, и вызывало ли привыкание. Оказалось, что в низких дозах ТБГ не вызывает у животных предпочтения, а в высоких — даже приводит к избеганию этого отсека. В данном случае это помогло получить ответ на вопрос: вызывает ли табернанталог привыкание? Ответ: нет, не вызывает.
Оценка нейрональной пластичности
Как обсуждалось выше, одним из признаков нейропластичности является изменение структуры дендритных ветвей. Введение ТБГ в нейроны коры головного мозга крысиных эмбрионов увеличивало сложность дендритных ветвей (рис. 8), однако эффект блокировался агонистом серотониновых рецепторов кетансирином, что указывает на участие в процессе рецепторов 5-HT2A. Кроме сложности ветвления, смотрели на плотность дендритных шипиков в кортикальных культурах — и она увеличивалась в той же степени, как при обработке нейронов ибогаином. Такие изменения потенциально могут быть полезны при лечении психиатрических заболеваний, так как это стимулирует пластичность, которая может по-новому соединять те нейронные цепи, которые ведут к заболеваниям.
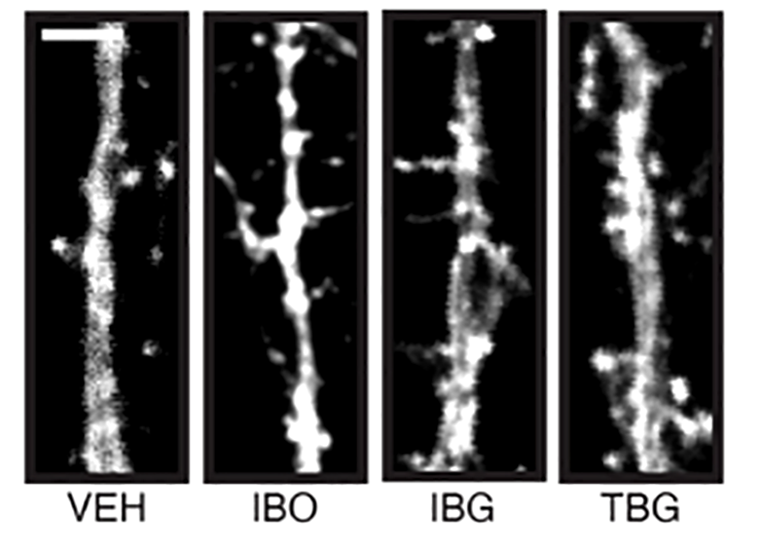
Рисунок 8. Ветвление дендритов культуры кортикальных нейронов эмбриона крысы после обработки ибогалогами в течение 24 часов. На первом (контрольном — VEH) фрейме интенсивного ветвления не наблюдается, по сравнению с обработкой тремя веществами: IBO — ибогаином; IBG — ибогаиналогом; TBG — табернанталогом.
Как читатели, возможно, помнят, особенность психопластогенов — в том, что произошедшие изменения сохраняются, а не являются временным эффектом. Это было подтверждено транскраниальной двухфотонной визуализацией, которая показала, что сформированные шипики не исчезают в течение минимум 24 часов после введения ИБГ и DOI (рис. 9).
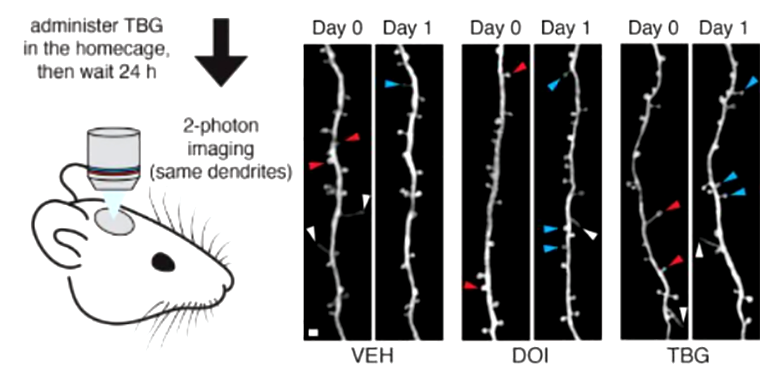
Рисунок 9. Изображения одних и тех же дендритных сегментов первичной сенсорной коры мышей до (день 0) и после (день 1) введения контроля, DOI или ТБГ. Опыт ставили с помощью двухфотонной транскраниальной визуализации на обнаженном черепе мышей. Синие, красные и белые стрелки обозначают недавно сформированные и элиминировавшиеся шипики, а также филоподии.
адаптировано из [37]
Принудительное погружение: тест на поведенческое отчаяние
Предполагается, что повышенная структурная пластичность в передних отделах головного мозга (например, в префронтальной коре) опосредует устойчивые (>24 ч) антидепрессантоподобные эффекты кетамина у грызунов, а кетамин — психопластоген. По результатам предыдущих тестов видно, что и ТБГ влияет на изменение пластичности, но проявляется ли это на поведенческом уровне? Может быть, и ТБГ обладает антидепрессивным эффектом?
Депрессивность мышей оценивается через количество времени, которое они тратят на попытку выбраться из цилиндра, наполненного водой (можно сказать — как быстро они теряют интерес к жизни). Влияние ТБГ на поведение оценивали методом принудительного погружения после недели стресса, в течение которой мыши не могли предсказать, какому из стрессоров они подвергнутся сегодня (рис. 10).
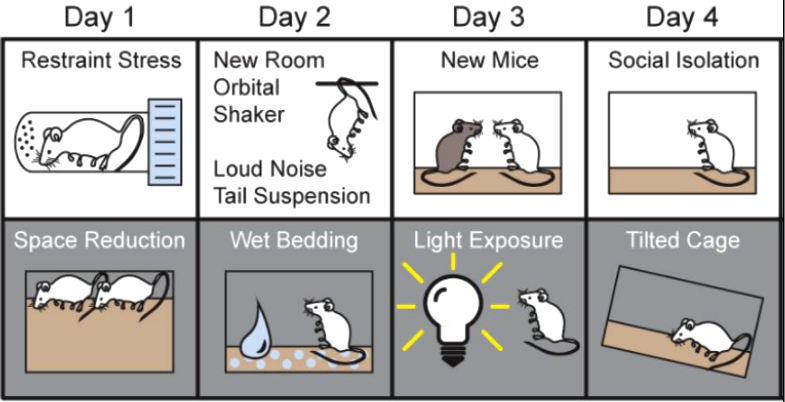
Рисунок 10. Мыши подвергались стрессу в течение недели — и днем (белые квадраты), и ночью (серые квадраты). Для примера приведено четыре дня.
День 1: в световую фазу животное помещали в пластиковую трубу, где нельзя двигаться и откуда нельзя выбраться; в темновую фазу — уменьшение пространства в домашней клетке.
День 2: световая фаза — перенос мыши в новую комнату, помещение в шейкер, громкие внезапные звуки, подвешивание за хвост; темновая фаза — мокрая подстилка.
День 3: световая фаза — знакомство с новой мышью; темновая фаза — нахождение под ярким светом.
День 4: световая фаза — социальная изоляция (особенно после знакомства!); темновая фаза — наклоненная клетка.
[37], приведено неполностью
В результате такого воздействия (достаточно негуманного, стоит заметить) время, в течение которого мыши были неподвижны после того, как прекратили попытки выбраться, значительно увеличилось. А после дозы ТБГ — снова уменьшилось, т.е мыши прикладывали больше усилий, чтобы остаться на плаву! Возможно, это говорит и об антидепрессивном потенциале ТБГ.
Влияние ТБГ на прием алкоголя и героина
Эксперимент, моделирующий неумеренное потребление алкоголя у людей (по-простому — запой), был проведен с помощью теста «двухбутылочной пробы»: когда у мышей есть доступ к поилкам с алкоголем или водой (рис. 11). Мышей подвергали повторяющимся циклам запоя и абстиненции в течение 7 недель, что приводило к высокому потреблению этанола и его содержанию в крови, эквивалентному такому же у людей, регулярно употребляющих алкоголь.
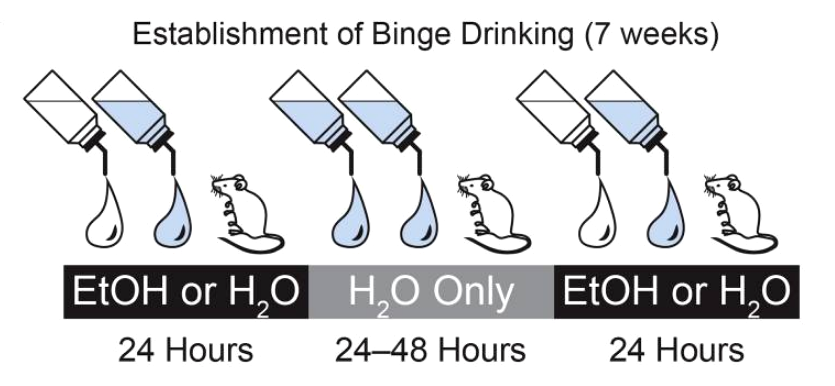
Рисунок 11. Схема теста «двухбутылочная проба». Белый цвет — 20% этанол, синий — вода. На 24 часа мыши предоставляется выбор — пить воду или этанол. На следующие двое суток — только воду. Четвертые сутки — опять на выбор вода или этанол.
Увидим ли мы снижение употребления количества алкоголя, если предварительно дадим инъекцию ТБГ мышам? Да, увидим! Инъекции ТБГ за три часа до доступа к поилкам уменьшали потребление алкоголя в течение первых четырех часов, не влияя на потребление воды. Снова вопрос: а вдруг ТБГ в принципе снижает потребление другого вещества? Оказывается, что нет — предпочтения ни сахарозы, ни воды не изменились, что указывает на избирательное снижение потребления алкоголя.
Всю свою жизнь Лотсоф хотел признания ибогаиновой терапии в качестве лечения зависимостей от психоактивных веществ, и, конечно же, героина. Благодаря его упорству и желанию академического сообщества помочь людям с зависимостью, эксперименты продолжаются: крыс (исключительно ради науки!) приучали ассоциировать свет и звук с дозой героина (рис. 12), чтобы посмотреть: а поможет ли ТБГ и на этот раз?
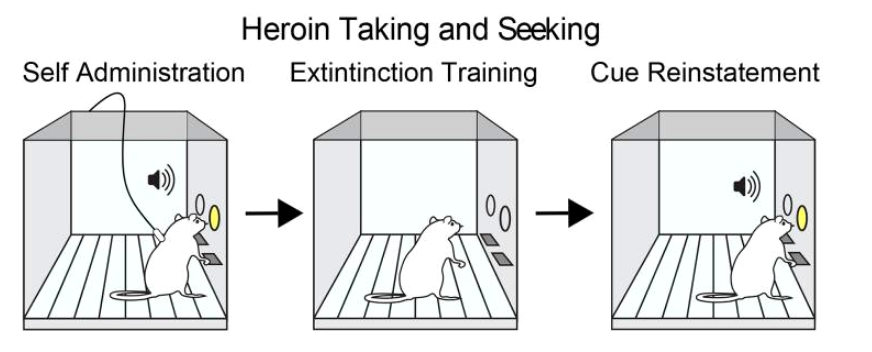
Рисунок 12. Схема эксперимента с самовведением героина. В первом случае (самовведение героина) нажатие на рычаг совпадало с подачей света и тона, после чего через внутривенный катетер поступала доза героина. Во втором случае в той же обстановке крысы могли нажимать на рычаг, но не было ни света, ни тона, ни героина (угасание сформированного рефлекса). В третьем случае после нажатия на рычаг появлялись свет и тон, но не героин (восстановление рефлекса) — это моделирует «срыв».
При всех трех условиях введение ТБГ по сравнению с контролем резко снижало поведение, связанное с поиском героина. Однако введение ТБГ также сильно снижало самовведение сахарозы в аналогичном эксперименте, что говорит о возможности неселективного нарушения оперантного ответа в ответ на дозу ТБГ.
Также было показано, что ответ на условный стимул при предъявлении после угасания был меньше в группах, предварительно получавших ТБГ. Однако ТБГ не оказал влияния на поведение, связанное с поиском сахарозы. Таким образом, однократное введение ТБГ вызывало антиаддиктивный эффект, продолжающийся до 12–14 дней.
Похоже, Говард Лотсоф не зря потратил столько сил, и теперь ученые могут двигаться дальше, с новыми вопросами и научной методологией, позволяющими отвечать на самые смелые вопросы.
Заключение
Случаи из клинической практики, исследования на людях и животных говорят о потенциале психопластогенных соединений как при лечении проблемного употребления психоактивных веществ, так и при психиатрических заболеваниях. Их главное преимущество в обеспечении устойчивого терапевтического эффекта за счет нейропластичности в течение суток и после однократного приема по сравнению с долгосрочным действием фармако- и психотерапий.
Упрощение структуры ибогаина для получения ТБГ сделало соединение не только более безопасным, но и синтезируемым в один шаг, в отличие от 18-МС, для синтеза которого требуется 13 этапов. Да и неизвестно, обладает ли 18-MC психопластогенным действием, по сравнению с продемонстрированным влиянием на нейропластичность ТБГ [37].
Данное исследование говорит о возможности использования как антидепрессивного, так и антиаддиктивного потенциала ТБГ. Попытка ответить на вызовы сегодняшнего дня — растущее количество людей, страдающих расстройством употребления психоактивных веществ, и отсутствие высококачественной терапии — соединилась с возможностями современной науки, которая стремительно двигается вперед.
Мы проследили удивительную историю, начинающуюся с использования африканского растения Tabernanthe iboga религиозным движением бвити, продажу его во Франции в качестве лекарства от разнообразных хворей, получения патентов, запрет и начало многолетних исследований ибогаина благодаря невероятному упорству пассионария Лотсофа и других ученых, и оказались в точке, где эти исследования вышли на новый уровень — ученых уже интересует не только феноменологический опыт, но и то, как можно этот опыт разобрать на части и посмотреть — а будет ли это работать?
И возвращаясь к вопросам, поставленным в начале работы — предварительно на них можно ответить положительно: да, структуру психоделиков можно изменить таким образом, чтобы оставить их терапевтический эффект, но убрать галлюцинаторный; да, возможно и то, что терапевтические эффекты психоделиков обусловливаются влиянием на нейропластичность, а не глубоким мистическим опытом.
Работы, связанные с выявлением фармакофоров внутри соединений, вызывающих мистические переживания, если не переворачивают, то, несомненно, дополняют наши представления об их влиянии на работу мозга. Не стоит и сомневаться, что за табернаталогом последуют и другие соединения, обладающие потенциалом лечения широкого круга психиатрических расстройств, которые будут более эффективными, чем терапии, существующие на текущий момент.
Литература
- Cassandra Willyard. (2015). Pharmacotherapy: Quest for the quitting pill. Nature. 522, S53-S55;
- Nora D. Volkow, George F. Koob, A. Thomas McLellan. (2016). Neurobiologic Advances from the Brain Disease Model of Addiction. N Engl J Med. 374, 363-371;
- Marc Lewis. (2018). Brain Change in Addiction as Learning, Not Disease. N Engl J Med. 379, 1551-1560;
- Jamie Peters, David E Olson. (2021). Engineering Safer Psychedelics for Treating Addiction. J Exp Neurosci. 16, 263310552110338;
- Heather B. Madsen, Robyn M. Brown, Andrew J. Lawrence. (2012). Neuroplasticity in addiction: cellular and transcriptional perspectives. Front. Mol. Neurosci.. 5;
- Jamie Peters, Peter W. Kalivas, Gregory J. Quirk. (2009). Extinction circuits for fear and addiction overlap in prefrontal cortex. Learn. Mem.. 16, 279-288;
- Emilio Fernandez-Espejo, Nieves Rodriguez-Espinosa. (2011). Psychostimulant Drugs and Neuroplasticity. Pharmaceuticals. 4, 976-991;
- Как происходит выделение нейромедиатора;
- Saturnino Spiga, Giovanna Mulas, Francesca Piras, Marco Diana. (2014). The addicted spine. Front. Neuroanat.. 8;
- Anthony Holtmaat, Karel Svoboda. (2009). Experience-dependent structural synaptic plasticity in the mammalian brain. Nat Rev Neurosci. 10, 647-658;
- Amy Kalia Singh, Flip Phillips, Lotfi B. Merabet, Pawan Sinha. (2018). Why Does the Cortex Reorganize after Sensory Loss?. Trends in Cognitive Sciences. 22, 569-582;
- David E Olson. (2018). Psychoplastogens: A Promising Class of Plasticity-Promoting Neurotherapeutics. J Exp Neurosci. 12, 117906951880050;
- Terry E. Robinson, Bryan Kolb. (2004). Structural plasticity associated with exposure to drugs of abuse. Neuropharmacology. 47, 33-46;
- Marc Dos Santos, Marine Salery, Benoit Forget, Maria Alexandra Garcia Perez, Sandrine Betuing, et. al.. (2017). Rapid Synaptogenesis in the Nucleus Accumbens Is Induced by a Single Cocaine Administration and Stabilized by Mitogen-Activated Protein Kinase Interacting Kinase-1 Activity. Biological Psychiatry. 82, 806-818;
- Дивный новый мир психоделической терапии;
- Новая жизнь психоделиков;
- David E. Olson. (2021). The Subjective Effects of Psychedelics May Not Be Necessary for Their Enduring Therapeutic Effects. ACS Pharmacol. Transl. Sci.. 4, 563-567;
- Крупицкий Е.М., Палей А.И., Беркалиев Т.Н., Иванов В.Б., Дубровина О.О., Кожназарова Д.А., Дунаевский И.B., Ржанкова Е.В., Гриненко А.Я. (1993). Психоделическая психотерапия с применением кетамина. Московский психотерапевтический журнал. 2, 1–21;
- Elisabeth Mahase. (2020). Esketamine for treatment resistant depression is not recommended by NICE. BMJ. m329;
- Michael J. Wasko, Paula A. Witt-Enderby, Christopher K. Surratt. (2018). DARK Classics in Chemical Neuroscience: Ibogaine. ACS Chem. Neurosci.. 9, 2475-2483;
- James W Fernandez, Renate L Fernandez. (2001). Chapter 13 “Returning to the path”: The use of iboga[ine] in an equatorial African ritual context and the binding of time, space, and social relationships. The Alkaloids: Chemistry and Biology. 235-247;
- Genís Ona, Juliana Mendes Rocha, José Carlos Bouso, Jaime E. C. Hallak, Tre Borràs, et. al.. (2021). The adverse events of ibogaine in humans: an updated systematic review of the literature (2015–2020). Psychopharmacology;
- Kenneth R Alper. (2001). Chapter 1 Ibogaine: A review. The Alkaloids: Chemistry and Biology. 1-38;
- S.D. Glick, K. Rossman, S. Steindorf, I.M. Maisonneuve, J.N. Carlson. (1991). Effects and aftereffects of ibogaine on morphine self-administration in rats. European Journal of Pharmacology. 195, 341-345;
- STANLEY D. GLICK, ISABELLE M. MAISONNEUVE, KAREN K. SZUMLINSKI. (2000). 18-Methoxycoronaridine (18-MC) and Ibogaine: Comparison of Antiaddictive Efficacy, Toxicity, and Mechanisms of Action. Annals of the New York Academy of Sciences. 914, 369-386;
- Stanley D. Glick, Elizabeth M. Sell, Isabelle M. Maisonneuve. (2008). Brain regions mediating α3β4 nicotinic antagonist effects of 18-MC on methamphetamine and sucrose self-administration. European Journal of Pharmacology. 599, 91-95;
- P. M. Sweetnam, J. Lancaster, Adele Snowman, J. L. Collins, S. Perschke, et. al.. (1995). Receptor binding profile suggests multiple mechanisms of action are responsible for ibogaine's putative anti-addictive activity. Psychopharmacology. 118, 369-376;
- Tamara Antonio, Steven R. Childers, Richard B. Rothman, Christina M. Dersch, Christine King, et. al.. (2013). Effect of Iboga Alkaloids on µ-Opioid Receptor-Coupled G Protein Activation. PLoS ONE. 8, e77262;
- Emeline L. Maillet, Nicolas Milon, Mari D. Heghinian, James Fishback, Stephan C. Schürer, et. al.. (2015). Noribogaine is a G-protein biased κ-opioid receptor agonist. Neuropharmacology. 99, 675-688;
- Phil Skolnick. (2001). Chapter 3 Ibogaine as a glutamate antagonist: Relevance to its putative antiaddictive properties. The Alkaloids: Chemistry and Biology. 55-62;
- Norman M. White. (1989). Reward or reinforcement: What's the difference?. Neuroscience & Biobehavioral Reviews. 13, 181-186;
- Seven Tomek, Amber Lacrosse, Natali Nemirovsky, M. Olive. (2013). NMDA Receptor Modulators in the Treatment of Drug Addiction. Pharmaceuticals. 6, 251-268;
- Очень нервное возбуждение;
- Michael H Baumann, John Pablo, Syed F Ali, Richard B Rothman, Deborah C Mash. (2001). Chapter 5 Comparative neuropharmacology of ibogaine and its O-desmethyl metabolite, noribogaine. The Alkaloids: Chemistry and Biology. 79-113;
- Pieter Beerepoot, Vincent M. Lam, Ali Salahpour. (2016). Pharmacological Chaperones of the Dopamine Transporter Rescue Dopamine Transporter Deficiency Syndrome Mutations in Heterologous Cells. Journal of Biological Chemistry. 291, 22053-22062;
- Clint E. Canal, Drake Morgan. (2012). Head-twitch response in rodents induced by the hallucinogen 2,5-dimethoxy-4-iodoamphetamine: a comprehensive history, a re-evaluation of mechanisms, and its utility as a model. Drug Test. Analysis. 4, 556-576;
- Lindsay P. Cameron, Robert J. Tombari, Ju Lu, Alexander J. Pell, Zefan Q. Hurley, et. al.. (2021). A non-hallucinogenic psychedelic analogue with therapeutic potential. Nature. 589, 474-479;
- Chunyang Dong, Calvin Ly, Lee E. Dunlap, Maxemiliano V. Vargas, Junqing Sun, et. al.. (2021). Psychedelic-inspired drug discovery using an engineered biosensor. Cell. 184, 2779-2792.e18;
- От живого к неживому. Доклинические исследования сегодня и завтра;
- L.J. Schep, R.J. Slaughter, S. Galea, D. Newcombe. (2016). Ibogaine for treating drug dependence. What is a safe dose?. Drug and Alcohol Dependence. 166, 1-5.