«Мал золотник, да дорог», или об использовании золотых наночастиц в бионанотехнологиях
28 октября 2016
«Мал золотник, да дорог», или об использовании золотых наночастиц в бионанотехнологиях
- 3355
- 0
- 2
Наночастицы золота — новый перспективный инструмент, используемый в бионанотехнологиях, диагностике и терапии.
сайт newstracker.ru
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Уникальные свойства золота с давних времен интересуют человека. Хотя золото относится к самым древним объектам научных исследований, основной прорыв в изучении молекулярных особенностей этого материала произошел только сейчас — в первую очередь в контексте бурного развития нанотехнологий. Золотые наночастицы — наиболее стабильные из всех видов наночастиц, и в силу их особенностей и широкого спектра практического применения им суждено стать одним из ключевых материалов 21 века. И конечно, для них всегда найдется место в биомедицинских центрах и лабораториях.
«Био/мол/текст»-2016
Эта работа опубликована в номинации «Бионанотехнология» конкурса «био/мол/текст»-2016.

Спонсор номинации — Фонд инфраструктурных и образовательных программ Роснано.
Генеральным спонсором конкурса, согласно нашему краудфандингу, стал предприниматель Константин Синюшин, за что ему огромный человеческий респект!
Спонсором приза зрительских симпатий выступила фирма «Атлас».
Добыча золота началась в пятом тысячелетии до нашей эры. В это же время стало активно изучаться «растворимое», или коллоидное золото. Вплоть до Средневековья растворимому золоту приписывались волшебные и целебные свойства: считалось, что оно способно излечивать сердечные недуги и венерические болезни, дизентерию, эпилепсию и опухоли. В средневековой алхимической и медицинской литературе постоянно упоминается субстанция aurum potabile («питьевое золото») — предназначенный для приема внутрь раствор солей золота; тогда его считали настоящим эликсиром жизни/молодости. В 1676 году немецкий химик Иоганн Кункель, который использовал коллоидные металлы для изготовления цветного стекла, опубликовал книгу, где предположил, что слабо-розовый цвет aurum potabile обусловлен присутствием в растворе мельчайших частиц металлического золота, невидимых человеческим глазом. Это была абсолютно верная мысль, к которой впоследствии пришел Майкл Фарадей, правда, уже в 1857 году. После того как доверие населения к алхимическому кодексу здоровья пошатнулось, основным назначением коллоидного золота стала диагностика сифилиса — впрочем, в XX веке выяснилось, что этот метод не так уж и надежен. И только в конце века коллоидное золото с триумфом вернулось на страницы экспериментальных статей и обзоров. В настоящее же время золотые наночастицы — это один из наиболее интенсивно изучаемых объектов, который можно использовать для фундаментальных и прикладных исследований, для решения разнообразных биомедицинских, диагностических и терапевтических задач [1].
Свойства золотых наночастиц
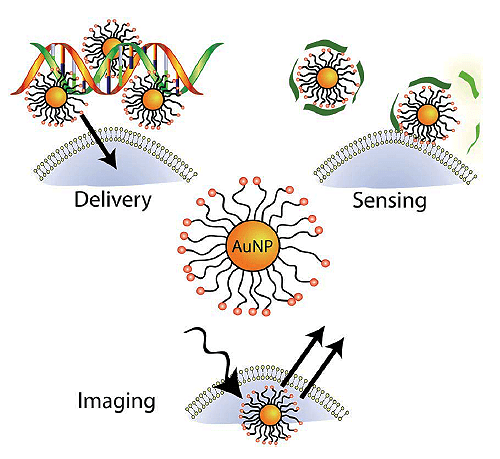
Золотые наночастицы (gold nanoparticles, Au nanoparticles, AuNPs) широко используются в бионанотехнологии из-за своих уникальных свойств и возможности поверхностной модификации множеством функциональных групп [2]. Легкость функционализации золотых наночастиц делает их универсальной платформой для нанобиологических сборок — прикрепления к ним олигонуклеотидов, антител и прочих белков. А универсальность золотых наночастиц делает их незаменимыми для ряда биомедицинских применений (рис. 1). Некоторые свойства AuNPs оказались востребованными в диагностике. Например, во время взаимодействия золотой наночастицы с исследуемым веществом могут изменяться ее физико-химические свойства, такие как поверхностный плазмонный резонанс, проводимость и окислительно-восстановительный потенциал, что и регистрируется специальным оборудованием. Также AuNPs могут выступать в качестве платформ для терапевтических агентов: огромная площадь поверхности наночастицы обеспечивает возможность компактного размещения молекул, выполняющих разные функции —направляющие, детектирующие, лечебные.
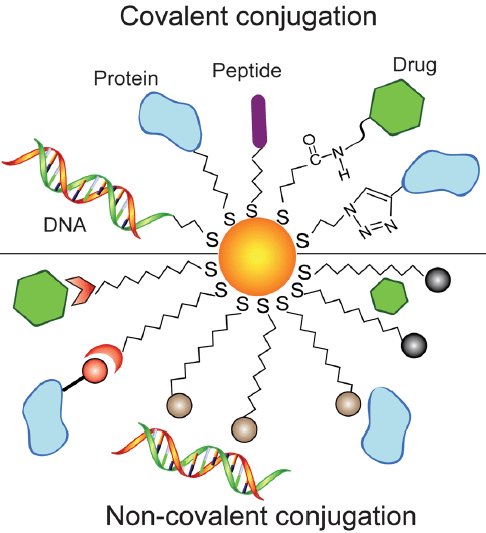
Биоконъюгаты AuNPs пытаются использовать в разработке новых биоматериалов для исследования биологических систем [2]. Как именно получают подобные конъюгаты? Для этого существуют два пути — ковалентная и нековалентная конъюгации (рис. 2). Нековалентная (адсорбционная) конъюгация — более простой способ связывания биомолекул с золотыми наночастицами, обусловленный сразу несколькими механизмами: аффинностью специфического связывания, электростатическими и гидрофобными взаимодействиями [3]. Нековалентные взаимодействия широко используются для получения различных биокомплексов из-за относительной простоты и обратимого характера этих процессов. Ковалентная же конъюгация идеально подходит для получения стабильных конъюгатов — например, предназначенных для длительной визуализации биологических процессов.
Сферические золотые наночастицы обладают такими полезными свойствами, как особые, связанные с размером и формой, оптоэлектронные характеристики, оптимальное соотношение «поверхность—объем», отличная биосовместимость и низкая токсичность. Эти особенности делают золотые наночастицы важным инструментом в бионанотехнологии.
«Биоштрихкод», «химический нос» и другие необычные конструкции на основе наночастиц золота
Золотые наночастицы легко образуют конъюгаты с различными биомолекулами, такими как антитела или олигонуклеотиды. Подобные биоконъюгаты используют для обнаружения разнообразных мишеней: раковых клеток [4], бактерий [5] и вирусов [6]. Например, AuNPs играют важнейшую роль в анализе под названием «биоштрихкод» (bio-barcode assay) [7]. Этот анализ является ультрачувствительным способом обнаружения целевых белков и нуклеиновых кислот [8]. В качестве одного из зондов в этом иммуноанализе используют золотые наночастицы, конъюгированные с олигонуклеотидами («штрихкодами») и антителами, специфично узнающими заданную мишень (какой-то антиген). Но первым делом с этой мишенью должны связаться моноклональные антитела, присоединенные к другому зонду — магнитным микрочастицам. Соответственно, антитела на AuNP-зондах взаимодействуют с мишенью, уже адсорбированной на антителах магнитных частиц — формируется структура, напоминающая сэндвич, где частицы двух типов связаны мостиком из антител и «пойманной» ими мишени (рис. 3). В результате селекции и отмывки из таких комплексов высвобождается определенное число олигонуклеотидов-«штрихкодов», подсчитав которые можно сделать вывод о количестве пойманных молекул мишени. Такой вариант метода в эксперименте позволил обнаружить простатспецифический антиген (ПСА) — сывороточный маркер рака простаты — в количествах, не детектируемых другими методами, что особенно важно для ранней диагностики рецидивов болезни после радикальной простатэктомии [9].
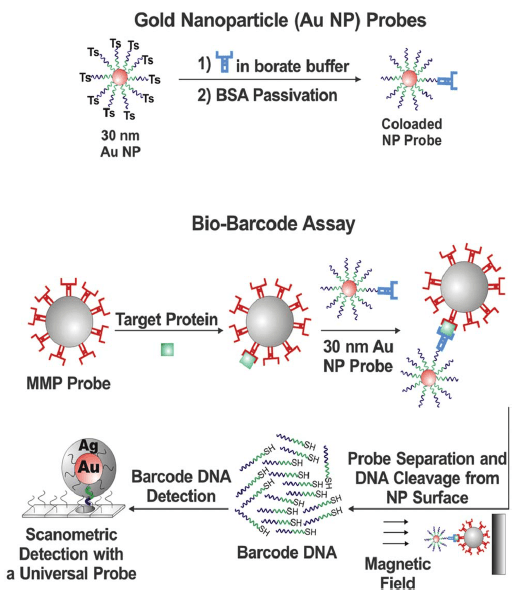
Рисунок 3. Анализ «биоштрихкод», основанный на использовании золотых наночастиц Вверху — Производство AuNP-зондов: наночастицы функционализируют сначала штрихкодовыми ДНК-олигонуклеотидами (сине-зеленые «змейки»), защищенными тозильными группами (Ts), а затем конъюгируют с антителами к простатспецифическому антигену (ПСА). Внизу — Процесс анализа: магнитные микрочастицы (MMP), конъюгированные с антителами к ПСА, добавляют в образец крови, где они взаимодействуют с белком-мишенью, то есть ПСА (зеленый кубик). После отмывки от лишних сывороточных компонентов MMP с адсорбированными на них молекулами ПСА помещают в буфер, куда добавляют полученные ранее AuNP-зонды; из образовавшихся сэндвич-комплексов после магнитной сепарации высвобождают ДНК-штрихкоды, которые детектируют сканометрическим анализом.
Также можно конъюгировать золотые наночастицы с аптамерами. Аптамеры — это олигонуклеотидные или пептидные молекулы, способные специфически связываться с определенными молекулами-мишенями. Конъюгаты «наночастицы—аптамеры» можно использовать для обнаружения малых молекул и раковых клеток [10], [11]. Например, уже разработан биосенсор на основе наночастиц и аптамеров, который позволяет с достаточно высокой чувствительностью обнаружить клетки лимфомы (так называемые RAMOS-клетки) [12].
Еще одна любопытная система создана на основе нековалентных конъюгатов AuNPs и флуорофоров — это «химический нос» (chemical nose) [13–15]. Конструкция способна обеспечить высокочувствительную регистрацию биомолекул-мишеней. Исходная система сенсоров состоит из золотых наночастиц, функционализированных четвертичными соединениями аммония (придают поверхности положительный заряд) и конъюгированных с ППЭ (поли(пара-фениленэтинилен)). ППЭ служит элементом трансдукции (передачи) флюоресценции, которая до контакта с мишенью гасится катионными AuNPs. Однако при конкурентном связывании целевой молекулы с конъюгатом происходит вытеснение ППЭ из комплекса, и регистрируется восстановление флуоресценции ППЭ. С точностью 95% этим способом удалось дифференцировать 12 штаммов бактерий [16], быстро и точно различить нормальные, раковые и метастатические клетки (рис. 4) [17]. Чуть позже было показано, что замена в конъюгате полимерного флуорофора на зеленый флуоресцентный белок (GFP) приводит к четырехкратному повышению чувствительности при регистрации раковых клеток млекопитающих [18].
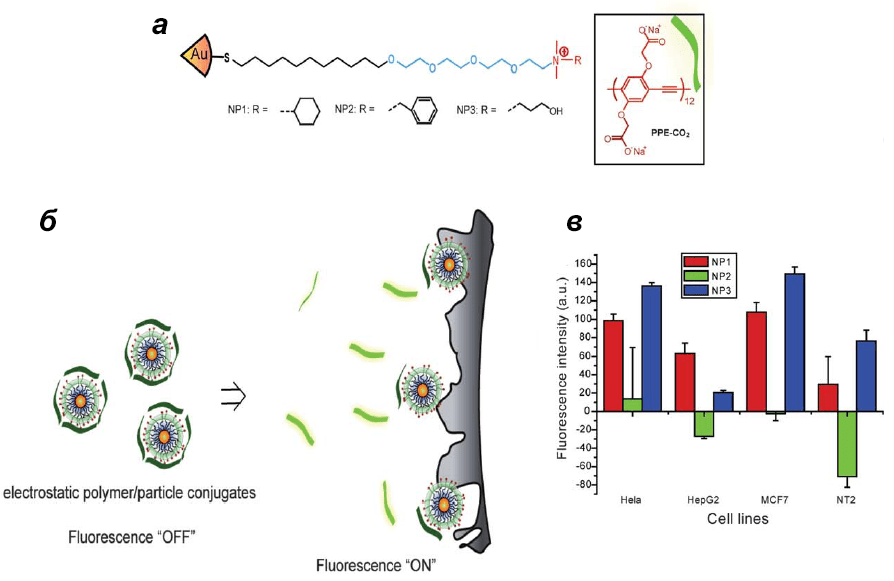
Рисунок 4. Обнаружение нормальных, раковых и метастатических клеток при помощи системы «химический нос». а — Молекулярные структуры катионных (положительно заряженных) золотых наночастиц и флуоресцентного полимера ППЭ (PPE-CO2). б — Вытеснение PPE-CO2 (темно-зеленые ленточки) из конъюгата клеткой-мишенью и восстановление флуоресценции (светло-зеленые ленточки). в — Изменение уровня флуоресценции для четырех различных линий раковых клеток с использованием конъюгатов AuNP—PPE-CO2.
В современных науке и медицине высокочувствительные методики требуются для многих диагностических целей. Одна из разработок на основе AuNPs, отвечающая этому требованию, — это ферментативно усиленная матричная детекция (enzyme-amplified array sensing, EAAS). EAAS — это модифицированная технология «химического носа», в которой для повышения чувствительности используется каталитическая активность фермента. EAAS- система представляет собой сенсорную матрицу, где чувствительные элементы состоят из трех компонентов:
- β-галактозидазы (β-gal) в качестве «фермента-усилителя»;
- флуорогенного или хромогенного субстрата, расщепляемого β-gal: например, MUG — варианта знаменитой молекулы X-gal, обладающего способностью к флуоресценции, или CPRG, при расщеплении окрашивающего раствор в красный цвет (количественно изменение окраски фиксируют с помощью колориметрических приборов);
- золотых наночастиц, которые выступают в качестве рецепторов для белков и, соответственно, обеспечивают их распознавание.
Наночастицы модифицированы четвертичными аммоний-катионами, а потому заряжены положительно и взаимодействуют электростатически, то есть обратимо, с анионной β-галактозидазой, ингибируя ее каталитическую активность. Исследуемый объект (мишень) — белок или клетка — конкурирует с β-галактозидазой за связывание с наночастицей. Принцип работы этой системы таков: при контакте наночастицы с мишенью из комплекса высвобождается β-галактозидаза, и ее активность восстанавливается. Интенсивное расщепление субстрата до «сигнального» продукта регистрируется по изменению окраски либо флуоресценции (рис. 5). Таким образом, сигнал о контакте сенсора с искомым объектом многократно усиливается деятельностью фермента. Такой высокочувствительный метод позволяет обнаруживать 1 нмоль конкретного белка в обессоленной человеческой моче, а также выявлять интересующих, например патогенных, бактерий в растворе при их концентрации всего 102 клеток/мл [19], [20].
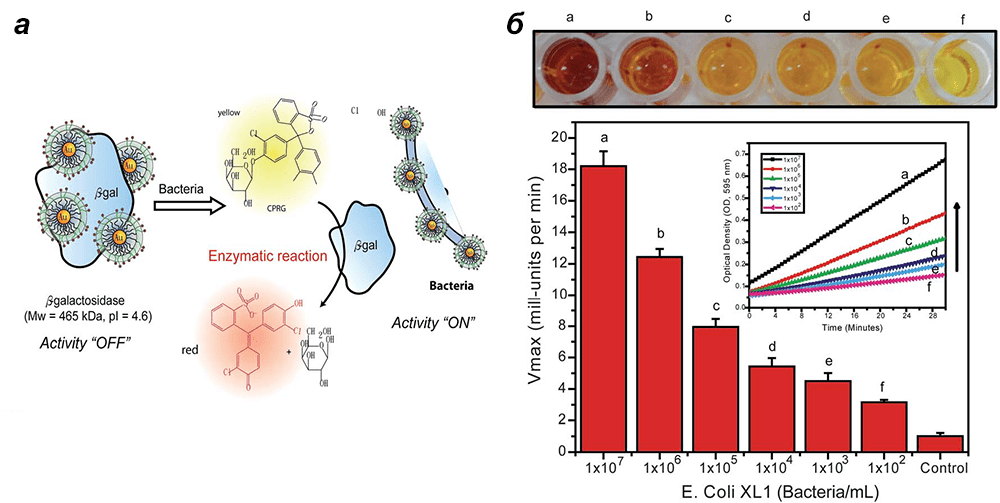
Рисунок 5. Принцип работы ферментативно усиленных сенсорных систем, различающихся способом сигнализации а — Схематическое изображение сенсора EAAS. β-галактозидаза вытесняется из конъюгата AuNPs—β-gal после взаимодействия частицы с анализируемым белком. При этом восстанавливается каталитическая активность β-галактозидазы по отношению к флуорогенному субстрату, что ведет к усилению регистрируемого сигнала. б — Обнаружение бактерий E. сoli в растворе с помощью EA-сенсора. Цвет пробы меняется за счет расщепления хромогенного субстрата CPRG от светло-желтого до коричневатого в зависимости от концентрации бактерий.
Уникальные оптические и электронные свойства AuNPs используются в различных методах визуализации клеток, таких как компьютерная томография (КТ), темнопольная микроскопия, оптическая когерентная томография (ОКТ) и рамановская спектроскопия. Золотые наночастицы, конъюгированные с простатспецифическим мембранным антигеном (PSMA), применяют для визуализации опухолевых клеток простаты. Использование таких конъюгатов в четыре раза увеличивает интенсивность КТ-сигнала именно от раковых клеток. Конъюгаты AuNP—PSMA, нагруженные противораковым препаратом доксорубицином, оказывали гораздо более выраженное действие на опухолевые клетки и меньше повреждали здоровые [21]. Но тут мы уже переходим к разговору о лечебных свойствах золотых наночастиц...
Золотые наночастицы как терапевтическое средство
Одним из самых актуальных вопросов биомедицины является адресная доставка лекарств к клеткам . И конечно, в этом тоже способны помочь золотые наночастицы. Несколько исследовательских групп оценивали варианты функционализации AuNPs с точки зрения взаимодействия частиц с клеточной мембраной — чтобы повысить эффективность доставки лекарственных средств [22]. Было показано, например, что характер расположения лигандов на поверхности AuNPs может регулировать проницаемость клеточной мембраны [23]. AuNPs с упорядоченно расположенными амфифильными молекулами легко проникали в клетку, в то время как AuNPs, покрытые такими же молекулами, но случайным образом, беспорядочно, поглощались везикулярными тельцами.
О передовых способах «принятия» лекарств и изящных механизмах проникновения препаратов в нужные клетки «биомолекула» уже писала: «Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза» [24], «Наномеханика для адресной доставки лекарств — насколько это реально?» [25] и «Невидимая граница: где сталкиваются „нано“ и „био“» [26]. — Ред.
Терапевтические золотые наночастицы могут быть доставлены в клетки путем пассивного или активного таргетинга. Пассивный таргетинг основан на так называемом эффекте улучшения проницаемости и удерживающей способности (enhanced permeability and retention (EPR) effect) наночастиц. Под EPR-эффектом понимают феномен, при котором объекты определенных размеров (липосомы, наночастицы и макромолекулярные препараты) накапливаются в опухолевой ткани в бóльших количествах, чем в тканях нормальных. Объясняется это тем, что в зоне своего размножения опухолевые клетки стимулируют формирование густой сети кровеносных сосудов, через которую те же AuNPs активно поступают в опухоль [27]. Активный таргетинг опирается на специфичность и избирательность поверхностных лигандов, специально подобранных для нацеливания частицы на определенные клетки [28]. Эффективные стратегии таргетинга и доставки веществ с помощью AuNPs уже разработаны для таких лечебных мероприятий, как фототермическая терапия [29], регуляция экспрессии генов [30], ну и просто потребление лекарственных средств [31].
Использование самих по себе золотых наночастиц в терапевтических целях тоже активно обсуждается. Например, уже синтезированы покрытые тиолом AuNPs, замедляющие рост бактерий [32]. «Голые» наночастицы исследуют как возможные инструменты уничтожения множественной миеломы. Было показано, что AuNPs тормозят, или, говоря научным языком, ингибируют деление клеток этой опухоли путем остановки клеточного цикла в фазе G1, когда клетка увеличивается в размерах и синтезирует мРНК и белки, готовясь к митозу [33].
Также ученые предложили ряд интересных решений, основанных на принципах супрамолекулярной химии. Это такая междисциплинарная область науки, рассматривающая химические, физические и биологические аспекты более сложных, чем молекулы, химических систем, которые связаны в единое целое межмолекулярными нековалентными взаимодействиями. Супрамолекулярные комплексы по своей природе весьма функциональны, и из-за свойственных им модульности и непостоянства могут быть спроектированы так, чтобы спонтанно собираться и разбираться в ответ на воздействие ряда веществ [34]. Универсальность супрамолекулярной химии делает ее перспективным инструментом биомедицинской науки. Некоторые супрамолекулярные системы уже используются для доставки лекарств и других веществ в определенные органы и ткани [35].
В основе работы таких систем лежит, как правило, молекулярное распознавание участвующих веществ. Для создания супрамолекулярных систем используют ряд синтетических рецепторов, в том числе такое вещество как кукурбит[7]урил (CB[7]) [36], [37]. Преимущества, которыми обладают вещества семейства CB[n], — это их строго определенная структура и способность к молекулярному распознаванию, а главное —склонность к образованию стабильных комплексов (например, типа гость—хозяин) с широким спектром молекул. Это вещество использовали в схеме, позволяющей регулировать активацию и модулировать цитотоксичность терапевтических золотых наночастиц, модифицированных диаминогексаном (AuNP—NH2). Согласно этой схеме, вначале к поверхности наночастицы присоединяется кукурбит[7]урил (CB[7]), который позволяет клетке «распознать» частицу как токсическую и поместить ее в эндосому. Затем, при добавлении вещества, имеющего высокое сродство к CB[7], — 1-адамантиламина — CB[7] отсоединяется от частицы. В результате она перестает распознаваться как токсическая (хотя на самом деле остается таковой), выходит из эндосомы и убивает раковые клетки (рис. 6).
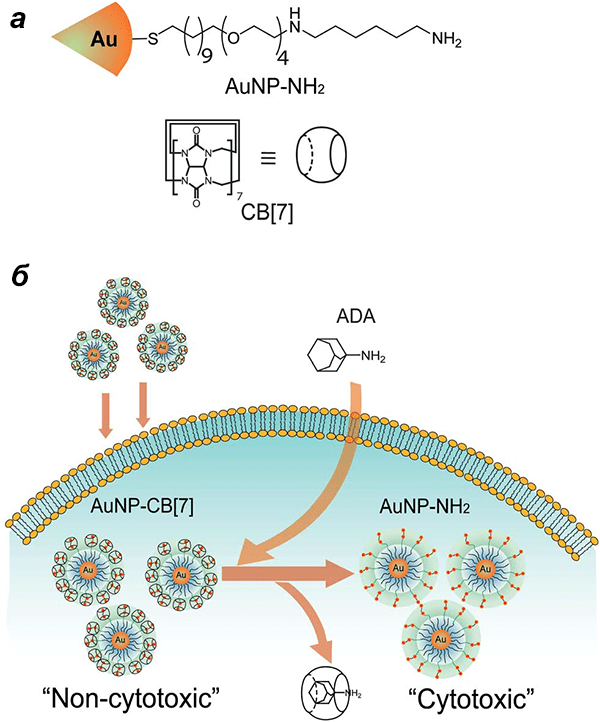
Рисунок 6. Схема работы тандема «цитотоксическая наночастица—кукурбит[7]урил». а — Структуры золотой наночастицы с диаминогексаном (AuNP—NH2) и кукурбит[7]урила (CB[7]). б — Активация цитотоксического комплекса AuNP—NH2—CB[7] путем удаления с поверхности частицы группы CB[7] 1-адамантиламином (ADA).
* * *
Теперь ни для кого не секрет, что золотые наночастицы — это мощный бионанотехнологический инструмент. Широкий спектр функциональных возможностей в сочетании с исключительными физическими свойствами AuNPs делают их крайне ценными для визуализации. На основе этих наночастиц создаются высокочувствительные диагностические системы для изучения целевых аналитов. И крайне успешно AuNPs используются для адресной доставки лекарств в клетки. Всё это делает золотые наночастицы универсальным и невероятно перспективным инструментом для следующего поколения биомедицинских приложений.
Литература
- Daniel M.-C. and Astruc D. (2004). Gold nanoparticles: assembly, supramolecular chemistry, quantum-size-related properties, and applications toward biology, catalysis, and nanotechnology. Chem. Rev. 104, 293–346;
- Yeh Y., Creran B., Rotello V. (2012). Gold nanoparticles: preparation, properties, and applications in bionanotechnology. Nanoscale. 4, 1871–1880;
- Роль слабых взаимодействий в биополимерах;
- Huo Q., Colon J., Cordero A., Bogdanovic J., Baker C.H., Goodison S., Pensky M.Y. (2011). A facile nanoparticle immunoassay for cancer biomarker discovery. J. Nanobiotechnology. 9, 20;
- Fang S.B., Tseng W.Y., Lee H.C., Tsai C.K., Huang J.T., Hou S.Y. (2009). Identification of Salmonella using colony-print and detection with antibody-coated gold nanoparticles. J. Microbiol. Methods. 77, 225–228;
- Laderman E.I., Whitworth E., Dumaual E., Jones M., Hudak A., Hogrefe W., Carney J., Groen J. (2008). Rapid, sensitive, and specific lateral-flow immunochromatographic point-of-care device for detection of herpes simplex virus type 2-specific Immunoglobulin G antibodies in serum and whole blood. Clin. Vaccine Immunol. 15, 159–163;
- Nam J.M., Park S.J., Mirkin C.A. (2002). Bio-barcodes based on oligonucleotide-modified nanoparticles. J. Am. Chem. Soc. 124, 3820–3821;
- Разработан метод анализа экспрессии генов на уровне индивидуальных клеток;
- Thaxton C.S., Elghanian R., Thomas A.D., Stoeva S.I., Lee J.S., Smith N.D. et al. (2009). Nanoparticle-based bio-barcode assay redefines «undetectable» PSA and biochemical recurrence after radical prostatectomy. Proc. Natl. Acad. Sci. USA. 106, 18437–18442;
- Zhang J., Wang L., Zhang H., Boey F., Song S., Fan C. (2010). Aptamer-based multicolor fluorescent gold nanoprobes for multiplex detection in homogeneous solution. Small. 6, 201–204;
- Medley C.D., Smith J.E., Tang Z., Wu Y., Bamrungsap S., Tan W. (2008). Gold nanoparticle-based colorimetric assay for the direct detection of cancerous cells. Anal. Chem. 80, 1067–1072;
- Liu G., Mao X., Phillips J.A., Xu H., Tan W., Zeng L. (2009). Aptamer—nanoparticle strip biosensor for sensitive detection of cancer cells. Anal. Chem. 81, 10013–10018;
- Нос и язык, которым нужны батарейки;
- Bunz U.H. and Rotello V.M. (2010). Gold nanoparticle—fluorophore complexes: sensitive and discerning «noses» for biosystems sensing. Angew. Chem. Int. Ed. Engl. 49, 3268–3279;
- Miranda O.R., Creran B., Rotello V.M. (2010). Array-based sensing with nanoparticles: ‘Chemical noses’ for sensing biomolecules and cell surfaces. Curr. Opin. Chem. Biol. 14, 728–736;
- Phillips R.L., Miranda O.R., You C.C., Rotello V.M., Bunz U.H. (2008). Rapid and efficient identification of bacteria using gold-nanoparticle—poly(para-phenyleneethynylene) constructs. Angew. Chem. Int. Ed. Engl. 47, 2590–2594;
- Bajaj A., Miranda O.R., Kim I.B., Phillips R.L., Jerry D.J., Bunz U.H., Rotello V.M. (2009). Detection and differentiation of normal, cancerous, and metastatic cells using nanoparticle-polymer sensor arrays. Proc. Natl. Acad. Sci. USA. 106, 10912–10916;
- Bajaj A., Rana S., Miranda O.R., Yawe J.C., Jerry D.J., Bunz U.H., Rotello V.M. (2010). Cell surface-based differentiation of cell types and cancer states using a gold nanoparticle-GFP based sensing array. Chem. Sci. 1, 134–138;
- Miranda O.R., Chen H.T., You C.C., Mortenson D.E., Yang X.C., Bunz U.H., Rotello V.M. (2010). Enzyme-amplified array sensing of proteins in solution and in biofluids. J. Am. Chem. Soc. 132, 5285–5289;
- Miranda O.R., Li X., Garcia-Gonzalez L., Zhu Z.J., Yan B., Bunz U.H., Rotello V.M. (2011). Colorimetric bacteria sensing using a supramolecular enzyme—nanoparticle biosensor. J. Am. Chem. Soc. 133, 9650–9653;
- Kim D., Jeong Y.Y., Jon S. (2010). A drug-loaded aptamer—gold nanoparticle bioconjugate for combined CT imaging and therapy of prostate cancer. ACS Nano. 4, 3689–3696;
- Arvizo R.R., Miranda O.R., Thompson M.A., Pabelick C.M., Bhattacharya R., Robertson J.D. et al. (2010). Effect of nanoparticle surface charge at the plasma membrane and beyond. Nano Lett. 10, 2543–2548;
- Verma A., Uzun O., Hu Y., Hu Y., Han H.S., Watson N. et al. (2008). Surface-structure-regulated cell-membrane penetration by monolayer-protected nanoparticles. Nat. Mater. 7, 588–595;
- Доставка лекарственных препаратов на основе рецептор-опосредованного эндоцитоза;
- Наномеханика для адресной доставки лекарств – насколько это реально?;
- Невидимая граница: где сталкиваются «нано» и «био»;
- Kennedy L.C., Bear A.S., Young J.K., Lewinski N.A., Kim J., Foster A.E., Drezek R.A. (2011). T cells enhance gold nanoparticle delivery to tumors in vivo. Nanoscale Res. Lett. 6, 283–293;
- Li X., Zhou H., Yang L., Du G., Pai-Panandiker A.S., Huang X., Yan B. (2011). Enhancement of cell recognition in vitro by dual-ligand cancer targeting gold nanoparticles. Biomaterials. 32, 2540–2545;
- Van de Broek B., Devoogdt N., D’Hollander A., Gijs H.L., Jans K., Lagae L. et al. (2011). Specific cell targeting with nanobody conjugated branched gold nanoparticles for photothermal therapy. ACS Nano. 5, 4319–4328;
- McMahon K.M., Mutharasan R.K., Tripathy S., Veliceasa D., Bobeica M., Shumaker D.K. et al. (2011). Biomimetic high density lipoprotein nanoparticles for nucleic acid delivery. Nano Lett. 11, 1208–1214;
- Brown S.D., Nativo P., Smith J.A., Stirling D., Edwards P.R., Venugopal B. et al. (2010). Gold nanoparticles for the improved anticancer drug delivery of the active component of oxaliplatin. J. Am. Chem. Soc. 132, 4678–4684;
- Bresee J., Maier K.E., Boncella A.E., Melander C., Feldheim D.L. (2011). Growth inhibition of Staphylococcus aureus by mixed monolayer gold nanoparticles. Small. 7, 2027–2031;
- Bhattacharya R., Patra C.R., Verma R., Kumar S., Greipp P.R., Mukherjee P. (2007). Gold nanoparticles inhibit the proliferation of multiple myeloma cells. Adv. Mater. 19, 711–716;
- Klajn R., Olson M.A., Wesson P.J., Fang L., Coskun A., Trabolsi A. et al. (2009). Dynamic hook-and-eye nanoparticle sponges. Nature Chem. 1, 733–738;
- Angelos S., Khashab N.M., Yang Y.W., Trabolsi A., Khatib H.A., Stoddart J.F., Zink J.I. (2009). pH clock-operated mechanized nanoparticles. J. Am. Chem. Soc. 131, 12912–12914;
- Биология и химия: перспектива научного поиска, или Супрамолекулярная химия изучает кукурбитурил;
- Kim C., Agasti S.S., Zhu Z., Isaacs L., Rotello V.M. (2010). Recognition-mediated activation of therapeutic gold nanoparticles inside living cells. Nat. Chem. 2, 962–966.