
Маленькие пузырьки и большие проблемы: роль экзосом в раковом метастазировании
27 января 2021
Маленькие пузырьки и большие проблемы: роль экзосом в раковом метастазировании
- 8968
- 0
- 5
Рисунок в полном размере.
сайт с биологическими мемами Dzu-Doodles
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Существуют некие микроскопические пузырьки, которые играют значительную роль в судьбе нашего организма. Эти пузырьки размером всего одну десятитысячную миллиметра, они вездесущи и могут сильно влиять на нашу жизнь. Они диктуют нам, как расти и развиваться, как переваривать пищу и образовывать кровь, и даже будем ли мы болеть или сопротивляться болезням. Эти пузырьки называются «экзосомы». Экзосомы открыли совсем недавно, но уже стало понятно, что они замешаны практически во всех процессах в организме. И уж совсем-совсем недавно выяснилось, что экзосомы также принимают непосредственное участие в раковом метастазировании и перерождении. Клетки злокачественных опухолей стремятся расселиться по всему организму, и в этом им помогают экзосомы. Они либо готовят «почву» для пришедших раковых клеток, либо, взаимодействуя с нормальными клетками, толкают их на кривую дорожку ракового перерождения. В нашем обзоре мы расскажем, что учёные успели узнать за такой короткий срок о роли экзосом в метастазировании и раковом перерождении.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
О метастазах и экзосомах
Наш многоклеточный организм — дружная и слаженная система, состоящая из десятков триллионов клеток. Когда всё в порядке, эти клетки сотрудничают друг с другом, ведут себя очень вежливо и учитывают интересы своих соседей. Однако в некоторых случаях клетки нарушают законы мирного сосуществования и начинают блюсти только свои интересы. Такие клетки дают начало опухолям. Опухоли появляются в результате того, что какие-то механизмы клетки «ломаются», и клетка начинает неконтролируемо делиться. Если опухоль имеет потенциал к метастазированию, её называют злокачественной. В результате метастазирования опухолевые клетки распространяются по всему организму, нарушают функции многих органов, и избавиться от них становится чрезвычайно трудно. Неудивительно, что на изучение метастазирования направлено огромное внимание учёных: понимая механизмы этого явления, мы можем попытаться его остановить и спасти многие человеческие жизни.
Явление метастазирования известно уже очень давно, один из его механизмов был предложен еще в конце XIX века [1], однако у учёных и врачей до сих пор нет полных знаний об этом процессе. Один из путей метастазирования заключается в том, что опухолевые клетки выходят в кровоток или в лимфатическую систему и начинают путешествовать по организму, пока не осядут в каком-нибудь новом месте. Эти клетки делятся, и вот появляется метастаз — вторичный очаг опухоли. Однако существует еще один путь метастазирования, о котором заговорили всего несколько лет назад — это метастазирование, опосредованное экзосомами [2].
Экзосомы подробно описаны в обзоре «Биомолекулы» [3], поэтому здесь мы ограничимся только краткой характеристикой. Экзосомы — это особые внеклеточные везикулы размером порядка 100 нм [4] (рис. 1), которые выделяют как здоровые, так и раковые клетки всех типов. В этих везикулах заключён участок цитоплазмы вместе с характерным для этой клетки содержимым: белками, РНК и другими веществами [5] (рис. 2).
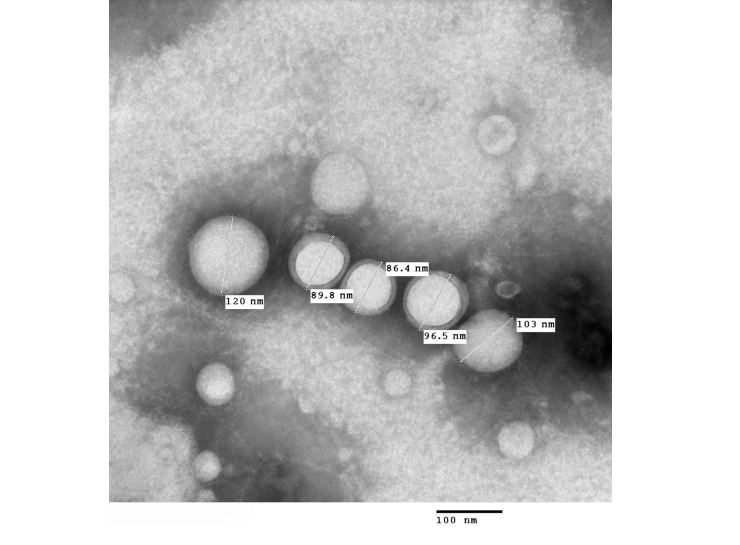
Рисунок 1. Внешний вид экзосом под электронным микроскопом
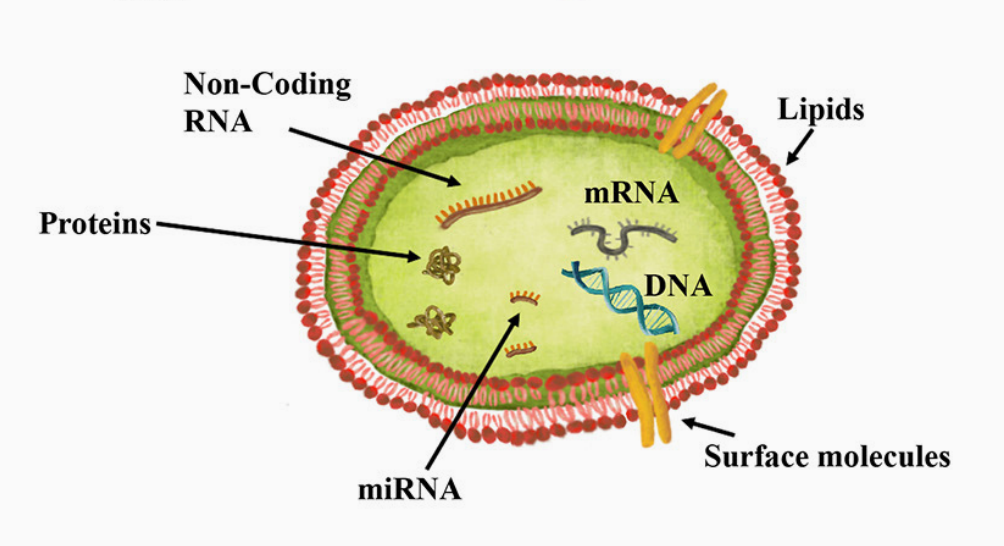
Рисунок 2. Схема организации экзосомы и её содержимое. В мембране находятся липиды и мембранные белки, внутри — нуклеиновые кислоты (РНК и ДНК), растворимые белки и многие другие молекулы.
Экзосомы — это крайне актуальная тема в современной биологии. Они поистине вездесущи и, похоже, участвуют в очень многих (всех?) процессах — в развитии организма, дифференцировке клеток, воспалении, развитии заболеваний, иммунном ответе... Список можно продолжать очень долго. Именно из-за этого к ним приковано внимание многих учёных. По всему миру появляются научные общества, посвященные экзосомам, а количество исследований о них растёт из года в год (данные портала PubMed).
Сначала экзосомы приняли за своеобразный «мусорный контейнер», с помощью которого клетка выбрасывает ненужные ей молекулы , [6].
В некоторых случаях, экзосомы, похоже, и правда работают как мусорные контейнеры. Таким способом может удаляться ДНК из цитоплазмы раковых клеток. Если ДНК попала в цитоплазму, то это сигнал того, что с клеткой что-то не так (а с раковой клеткой как раз что-то не так). Присутствие цитоплазматической ДНК запускает процесс гибели клетки. Раковая клетка, чтобы избежать этого, по-быстренькому избавляется от цитоплазматической ДНК, пакуя ее в экзосомы. Механизмы этого явления пока не изучены [7].
Однако дальнейшие исследования выявили, что экзосомы — это скорее «посылки», которыми клетки обмениваются между собой, чтобы сообщить о своем состоянии и передать важную информацию. Содержимое «посылок» чрезвычайно разнообразно: в экзосомах встречаются 9769 белков, 3408 мРНК, 2838 микроРНК и 1116 липидов (согласно базе Exocarta). Согласитесь, числа впечатляют! Причём содержимое экзосом иногда сильно отличается от содержимого клетки-родительницы. Механизмы, по которым «содержимое» упаковывается в «посылки», остаются невыясненными [8].
Экзосомы раковых клеток
Раковые клетки также выделяют экзосомы, иногда даже в больших количествах, чем обычные клетки [8]. Причём симптомов заболевания может ещё и не быть, а экзосомы уже образуются. Большинство раковых экзосом по внешнему виду похожи на обычные, однако есть и отличившиеся — экзосомы глиобластомы (один из типов злокачественных опухолей мозга) выглядят как пришельцы с щупальцами [9] (рис. 3).
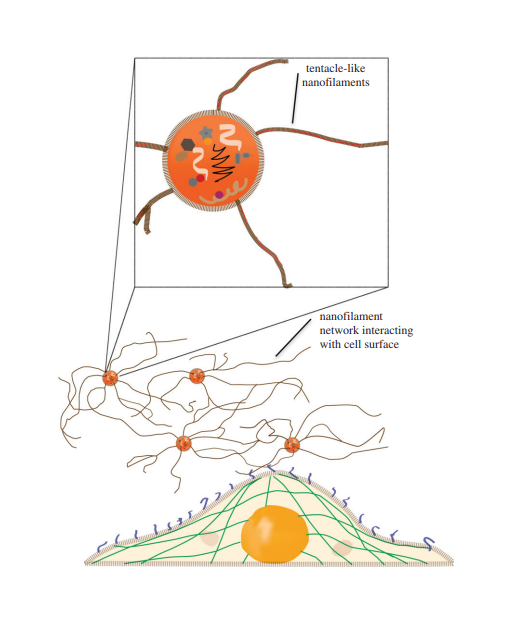
Рисунок 3. Экзосомы из глиобластомы имеют «щупальца», играющие роль во взаимодействии с клеткой.
Раковые экзосомы на поверхности и внутри себя несут особенные молекулы — маркеры рака. Это такие своеобразные метки, которые буквально кричат: «Посмотрите на нас, мы имеем раковое происхождение!» Детекция маркеров рака на экзосомах позволяет проводить раннюю неинвазивную диагностику этих заболеваний. Например, вместо того, чтобы делать болезненную и сложную биопсию, можно взять анализ крови или мочи, в которых как раз и содержатся экзосомы. Однако такая диагностика имеет определенные трудности. Дело в том, что количество маркерных молекул очень мало по сравнению с остальными молекулами в биологических жидкостях. Поэтому напрямую уловить эти маркеры не всегда возможно, остальные молекулы «заглушают» сигналы от них. Приходится использовать сложные высокочувствительные методы или дополнительно выделять экзосомы из биологической жидкости, что в медицинской работе не всегда представляется возможным. Само выделение экзосом представляет значительные трудности, потому что не всегда удается воспроизводить его результат. Содержание экзосом в разных биологических жидкостях (например, в слюне и моче) может значительно варьировать у одного и того же человека в зависимости от времени суток, приема пищи и других условий [4]. На сегодняшний день диагностический потенциал раковых экзосом не реализован, почти не выработаны методы анализа, которыми врачи могли бы пользоваться в клинической практике [8].
Раковые экзосомы не просто сигнализируют, что где-то в организме затаилась опухоль. Они сами являются активными участниками развития заболевания. Они способствуют метастазированию, и делать это могут несколькими путями:
- подготавливая клетки будущей метастатической ниши;
- изменяя свойства межклеточного вещества;
- провоцируя раковое перерождение клеток.
Последний из путей был открыт совсем недавно, и ещё не очень хорошо изучен. Взаимодействуя с нормальной клеткой, экзосомы могут вызывать её раковое перерождение [10]. При этом пути метастазирования раковым клеткам даже нет необходимости расселяться самостоятельно, им достаточно только отправлять экзосомы к другим клеткам.
Каким же образом маленький пузырек с цитоплазмой может изменить судьбу целой клетки и даже всего организма?
Как экзосомы взаимодействуют с клеткой-мишенью
В первую очередь раковая экзосома должна каким-то образом проконтактировать с клеткой-мишенью. Этот контакт может происходить несколькими способами [10], (рис. 4):
- прямое взаимодействие;
- слияние мембран;
- фагоцитоз;
- рецептор-опосредованный эндоцитоз.
В результате прямого взаимодействия молекулы на поверхности экзосомы связываются с мембранными рецепторами клетки, и это запускает каскад ответных реакций. При таком типе взаимодействий не происходит интернализации (захвата клеткой) материала экзосомы, в передаче информации участвуют только поверхностные молекулы. При остальных способах взаимодействия либо целые экзосомы, либо их содержимое попадает внутрь клетки-мишени.
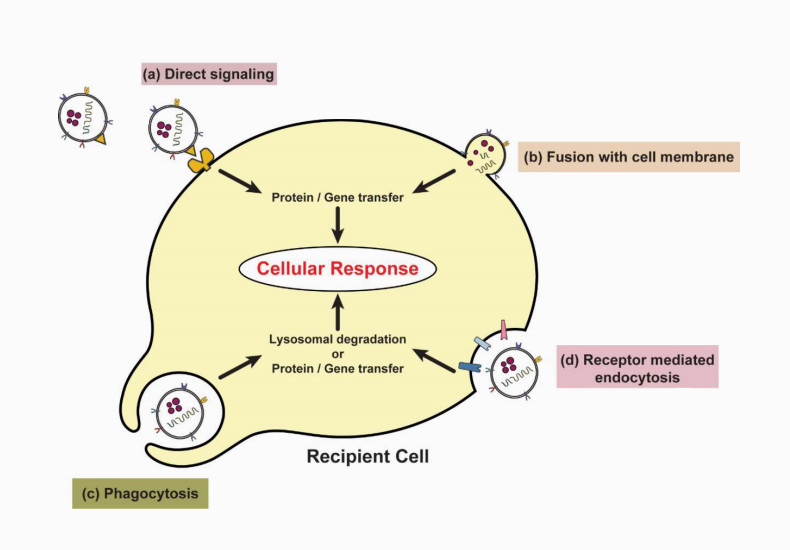
Рисунок 4. Типы взаимодействия экзосомы с клеткой: (a) — прямое взаимодействие, (b) — слияние с клеточной мембраной, (c) — фагоцитоз, (d) — рецептор-опосредованный эндоцитоз.
Молекулы, содержащиеся в экзосоме, воздействуют на клетки-мишени и меняют их метаболизм. Клетки, с которыми взаимодействовали раковые экзосомы, могут стать клетками раковой ниши, которая будет готова принять путешествующие по организму опухолевые клетки. Другой вариант — клетка-мишень может сама переродиться в опухолевую клетку. Эти изменения происходят благодаря сложным, многочисленным и пока ещё не полностью изученным молекулярным механизмам.
Экзосомы и подготовка раковой ниши
Опухолевые клетки, отправляя экзосомы к потенциальным клеткам раковой ниши, как бы готовят почву для дальнейшего вторжения. Раковая ниша — это микроокружение опухоли, которое обеспечивает её жизнедеятельность, снабжает питательными веществами и другими необходимыми молекулами. Экзосомы видоизменяют будущие клетки раковой ниши, и они становятся готовы принять опухолевые клетки с распростертыми объятиями [8].
Для будущего метастаза важно наличие кровеносных сосудов, которые будут поставлять ему кислород и питательные вещества. Раковые экзосомы способствуют делению эндотелиальных клеток и росту сосудов. Это может осуществляться благодаря поверхностным белкам — тетраспанинам и интегринам, которые активируют экспрессию генов ангиогенеза (роста сосудов) через фактор транскрипции NF-κB [8]. Транскрипционный фактор NF-κB — широко распространенный фактор транскрипции, который контролирует экспрессию многих генов: иммунного ответа, клеточной гибели и клеточного цикла. Изменения NF-κB ведут к изменениям во всех этих процессах.
Подготовка самих клеток ниши может идти с помощью разных молекулярных механизмов. Первой молекулой, которую «уличили» в помощи раковым экзосомам, был представитель семейства интегринов [10]. Интегрин — это белок, который ответственен за адгезию (прикрепление) клеток. Взаимодействие интегринов с поверхностью клетки-мишени провоцирует захват экзосомы. Эти белки довольно разнообразны, и было установлено, что наличие того или иного вида интегринов на поверхности экзосом позволяет им специфически индуцировать раковое перерождение разных типов клеток. Например, интегрин альфа-6 (ITGα6) ответственен за воздействие на клетки лёгких, а интегрин бета-5 (ITGβ5) встречается на тех экзосомах, которые взаимодействуют с клетками печени (рис. 5). Интегрины вызывают не просто захват экзосомы, но и запускают дальнейшие изменения в клетке-мишени. В частности, воздействию подвергается белок S100, участвующий в раковой трансформации. Учёным удалось заблокировать интегрины на экзосомах, и они перестали сливаться с клетками и влиять на их метаболизм [11]. Однако это удалось сделать пока только на культуре клеток. Блокировать слияние раковых экзосом с клетками внутри организма мы пока не умеем.
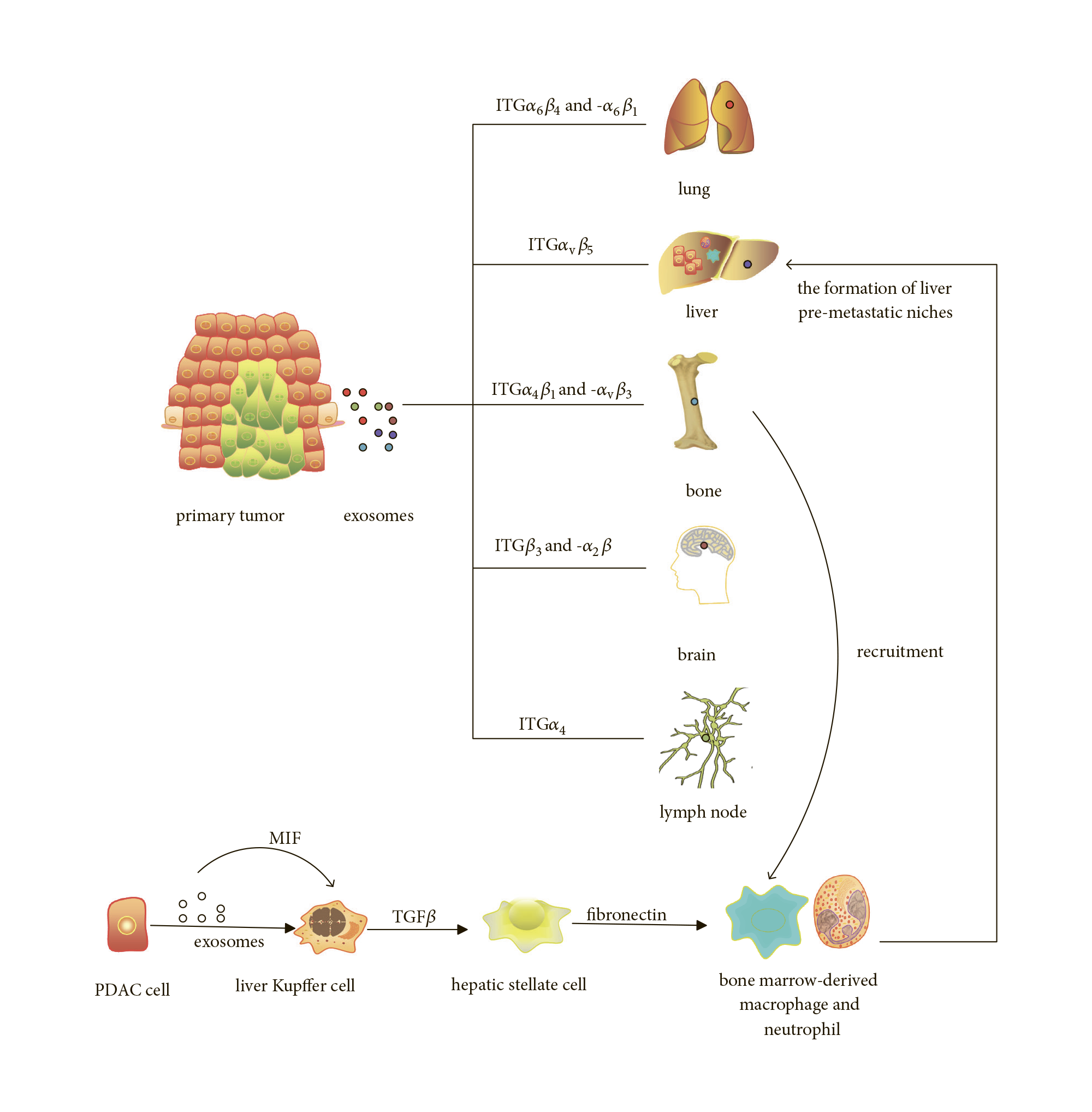
Рисунок 5. Разные виды интегринов (ITG) на поверхности экзосом обеспечивают слияние с клетками разных типов тканей. ITG — интегрины, PDAC — карцинома поджелудочной железы.
Изучение интегринов и других молекул открыло очень важную особенность экзосом. Они взаимодействуют с клетками специфично, в зависимости от своего содержимого [12]. Если экзосома — это посылка, то молекулы на ней — это адрес доставки, а получатель — это клетка-мишень. Зная, какие молекулы содержатся в экзосомах, можно предсказать, с какими клетками они будут взаимодействовать. Это открытие может объяснить так называемое явление органотропии. Органотропия — это когда метастазы распространяются специфично, захватывая одни органы и не трогая другие. Получается, что причина может быть в раковых экзосомах, которые направляются именно к этим органам! Изучение «адреса доставки» на экзосомах дает возможность предсказать, в каком именно месте организма возникнут метастазы.
Вслед за интегринами были открыты другие многочисленные молекулы, опосредующие воздействие экзосом на клетки. Например, экзосомы из рака молочной железы, запускают трансформацию клеток жировой ткани в ассоциированные с опухолью миофибробласты через TGF-бета-опосредованный сигнальный путь. TGF-бета (трансформирующий фактор роста бета) — представитель цитокинов, который контролирует деление, дифференцировку и другие процессы во многих клетках. Связывание TGF-бета, который находится в мембране экзосомы, с рецептором на поверхности клетки запускает сигнальный путь, зависящий от белков семейства под названием SMAD [13]. Сигнал передается в ядро и запускает транскрипцию соответствующих генов [14] (рис. 6).
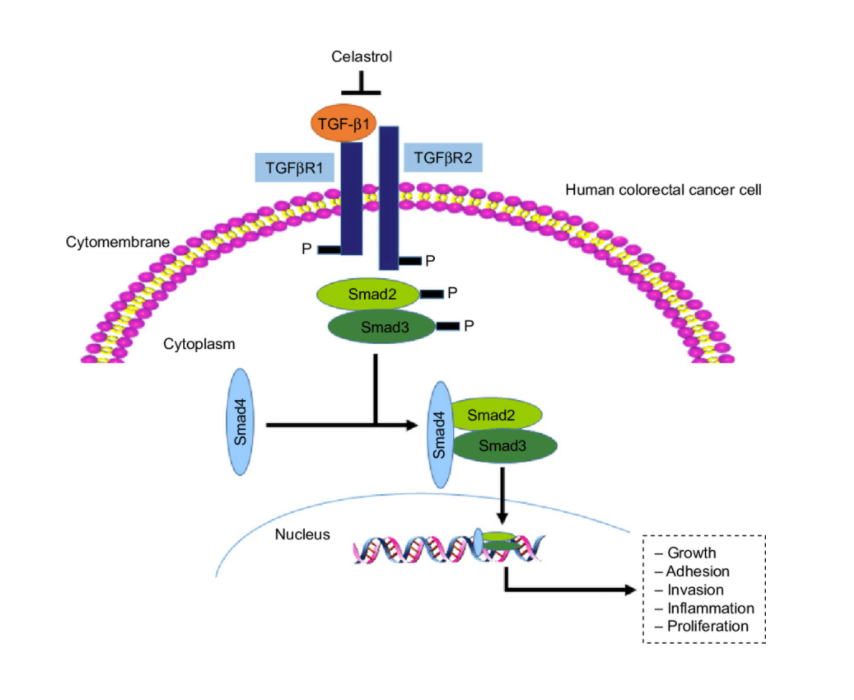
Рисунок 6. Схема сигнального каскада от цитокина TGF-бета. Связывание с рецептором ведет к сборке белков SMAD в единый комплекс, который отправляется в ядро и начинает регулировать транскрипцию генов, ответственных за рост, прикрепление, деление и воспаление.
На данный момент открыто огромное количество других молекул, с помощью которых раковые экзосомы модифицируют клетки [15]. Среди них встречаются различные белки, кодирующие и некодирующие РНК и даже ДНК. Общее их разнообразие огромно, поэтому мы выделили только некоторые из них и представили в таблице 1. Если перечислять их все, то таблица получилась бы размером со всю статью. И это только известные молекулы, а сколько их предстоит еще открыть! Некоторые из них встречаются во многих типах раковых экзосом, некоторые уникальны и зависят от их происхождения. Для каких-то из этих молекул известны пути воздействия на клетку-мишень, но для большинства они остаются загадкой.
| Рак | Компонент экзосом | Клетка-мишень | Клетка-мишень |
|---|---|---|---|
| Миелоидный лейкоз | TGF-β (цитокин) | NK-клетки (иммунная система) | ↓ цитотоксичность. Иммунные клетки хуже уничтожают опухоль |
| Рак молочной железы | микроРНК: miR-10b, miR-122 |
эпителиальные клетки | ↑ миграция |
| Рак кишечника | Hsp 70 (шаперон) | супрессорные клетки | ↑ иммуносупрессия |
| Глиома | рецептор эпидермального фактора роста VIII | клетки рака мозга | ↑ рост опухоли |
| Рак простаты | интегрины αvβ6 | клетки рака простаты | ↑ миграция |
Обмен «посылками» происходит в обе стороны. Клетки ниши посылают экзосомы раковым клеткам, чтобы стимулировать уже их деление (рис. 7). Эта стимуляция также включает разнообразные механизмы, основанные на работе белков, РНК и других молекул. Например, некодирующая РНК под названием RN7SL1 стимулирует прогрессию опухоли [16], а метаболические грузы (глюкоза, аминокислоты, липиды, компоненты цикла Кребса) «подкармливают» быстро растущие раковые клетки в условиях недостатка питательных веществ [17].
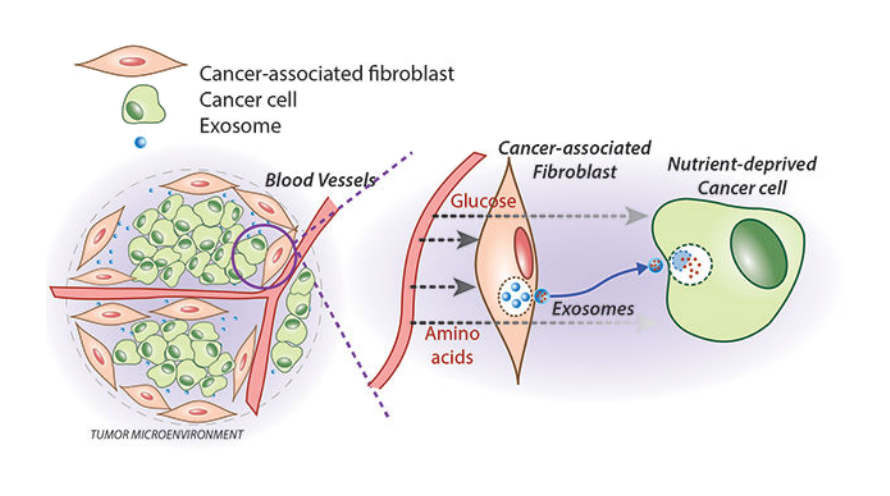
Рисунок 7. Клетки ниши отправляют раковым клеткам экзосомы — «ответные посылки». В них содержатся вещества, стимулирующие деление раковых клеток.
Таким образом, поток экзосом идёт в обе стороны: от раковых клеток к клеткам ниши и в обратном направлении. Раковые экзосомы «готовят почву» для предстоящего заселения в нишу, в то время как экзосомы клеток ниши помогают раковым клеткам адаптироваться на новом месте.
Помимо влияния напрямую на клетки ниши, экзосомы также могут изменять свойства межклеточного вещества и межклеточных контактов. Экзосомы из рака лёгких содержат микроРНК под названием miR-105, которая уменьшает синтез белков межклеточных контактов. Это нарушает эндотелиальный барьер в сосудах и облегчает выход из них раковых клеток [18]. Экзосомы из рака поджелудочной железы и рака лёгких содержат различные литические ферменты — протеазы, которые расщепляют белки межклеточного матрикса и вызывают тем самым его деградацию. Из-за разрыхления матрикса раковым клеткам легче «протиснуться» в будущую нишу [19].
Раковые экзосомы могут действовать и по аутокринному механизму, то есть влиять на клетку, которая сама же их образовала. Например, экзосомы из клеток лейкоза содержат цитокин TGFβ1, который связывается с рецептором TGFβ1 на поверхности этих же клеток, тем самым способствуя росту опухоли и защищая ее от апоптоза. Получается, что экзосомы — это инструмент, которым опухоль может стимулировать собственное развитие [20].
Как избавиться от раковых экзосом?
Если раковые экзосомы стимулируют метастазирование опухоли, то возникает закономерный вопрос: можно ли как-то воздействовать на них, чтобы прекратить этот процесс? Для решения этой проблемы можно использовать несколько стратегий:
- блокировать образование и выделение из клетки. Это можно делать, например, заставляя «замолчать» ответственные за это белки с помощью РНК-интерференции [21];
- «вылавливать» из крови. Эта процедура напоминает гемодиализ: кровь пациента пропускается через специальную систему, которая улавливает раковые экзосомы [22];
- блокировать взаимодействие экзосом с клеткой. Анализ большого количества известных лекарственных веществ показал, что некоторые из них ингибируют функции экзосом. Среди них климбазол, кетоконазол, триадименол и некоторые другие (таблица 2). Примечательно, что некоторые из этих лекарств используются для лечения болезней, на первый взгляд не связанных с раковыми экзосомами (например, грибковые инфекции), и механизмы их действия на экзосомы еще недостаточно изучены [23].
| Название лекарства | Формула | Эффект |
|---|---|---|
| Манумицин А | 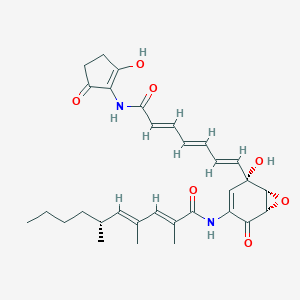 |
Ингибитор фермента фарнезилтрансферазы. Тормозит клеточный рост и ангиогенез, индуцирует апоптоз |
| Типифарниб | 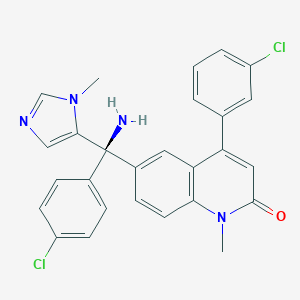 |
Ингибитор фермента фарнезилтрансферазы. Тормозит клеточный рост и ангиогенез, индуцирует апоптоз. Потенциальная антинеопластическая активность |
| Нетиконазол | 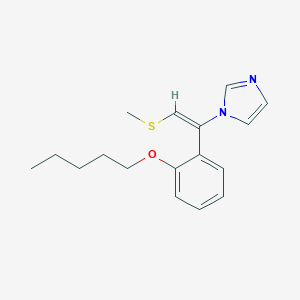 |
Противогрибковый препарат |
| Кетиконазол | 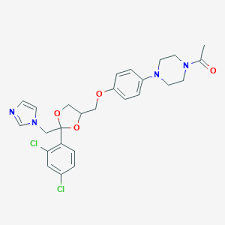 |
Противогрибковый препарат. Также используется для лечения прогрессирующих раков. |
| Климбазол | 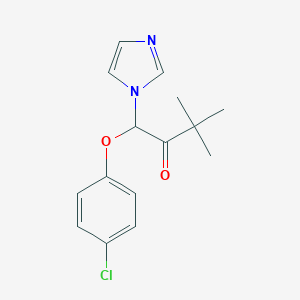 |
Противогрибковый препарат |
Таким образом, экзосомы являются перспективной мишенью для диагностики и лечения рака. Теоретически блокирование их функций должно приводить к снижению метастазного потенциала опухолей. Однако большинство разработанных подходов проверены только в модельных системах (например, на культурах клеток) и ещё далеки от применения в медицинской практике [8].
Литература
- Stephen Paget. (1889). THE DISTRIBUTION OF SECONDARY GROWTHS IN CANCER OF THE BREAST.. The Lancet. 133, 571-573;
- Ayuko Hoshino, Bruno Costa-Silva, Tang-Long Shen, Goncalo Rodrigues, Ayako Hashimoto, et. al.. (2015). Tumour exosome integrins determine organotropic metastasis. Nature. 527, 329-335;
- Экзосома — механизм координации и взаимопомощи клеток организма;
- Zhen Wang, Salisha Hill, James M. Luther, David L. Hachey, Kevin L. Schey. (2012). Proteomic analysis of urine exosomes by multidimensional protein identification technology (MudPIT). Proteomics. 12, 329-338;
- Joana Maia, Sergio Caja, Maria Carolina Strano Moraes, Nuno Couto, Bruno Costa-Silva. (2018). Exosome-Based Cell-Cell Communication in the Tumor Microenvironment. Front. Cell Dev. Biol.. 6;
- R. M. Johnstone. (1992). Maturation of reticulocytes: formation of exosomes as a mechanism for shedding membrane proteins. Biochem. Cell Biol.. 70, 179-190;
- Inbal Wortzel, Shani Dror, Candia M. Kenific, David Lyden. (2019). Exosome-Mediated Metastasis: Communication from a Distance. Developmental Cell. 49, 347-360;
- Lin Zhang, Dihua Yu. (2019). Exosomes in cancer development, metastasis, and immunity. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer. 1871, 455-468;
- Shivani Sharma, Kingshuk Das, JungReem Woo, James K. Gimzewski. (2014). Nanofilaments on glioblastoma exosomes revealed by peak force microscopy. J. R. Soc. Interface.. 11, 20131150;
- Rekha Jakhar, Karen Crasta. (2019). Exosomes as Emerging Pro-Tumorigenic Mediators of the Senescence-Associated Secretory Phenotype. IJMS. 20, 2547;
- Wenjuan Tian, Shanshan Liu, Burong Li. (2019). Potential Role of Exosomes in Cancer Metastasis. BioMed Research International. 2019, 1-12;
- Sanyukta Rana, Shijing Yue, Daniela Stadel, Margot Zöller. (2012). Toward tailored exosomes: The exosomal tetraspanin web contributes to target cell selection. The International Journal of Biochemistry & Cell Biology. 44, 1574-1584;
- Kyo Lee. (2011). Exosomes from breast cancer cells can convert adipose tissue-derived mesenchymal stem cells into myofibroblast-like cells. Int J Oncol;
- Zhitao Jiang, Qianyu Cao, Guoliang Dai, Jianchun Wang, Chundi Liu, et. al.. (2019). Celastrol inhibits colorectal cancer through TGF-β1/Smad signaling. OTT. Volume 12, 509-518;
- Theresa L. Whiteside. (2016). Tumor-Derived Exosomes and Their Role in Cancer Progression. Advances in Clinical Chemistry. 103-141;
- Barzin Y. Nabet, Yu Qiu, Jacob E. Shabason, Tony J. Wu, Taewon Yoon, et. al.. (2017). Exosome RNA Unshielding Couples Stromal Activation to Pattern Recognition Receptor Signaling in Cancer. Cell. 170, 352-366.e13;
- Abhinav Achreja, Hongyun Zhao, Lifeng Yang, Tae Hyun Yun, Juan Marini, Deepak Nagrath. (2017). Exo-MFA – A 13C metabolic flux analysis framework to dissect tumor microenvironment-secreted exosome contributions towards cancer cell metabolism. Metabolic Engineering. 43, 156-172;
- Weiying Zhou, Miranda Y. Fong, Yongfen Min, George Somlo, Liang Liu, et. al.. (2014). Cancer-Secreted miR-105 Destroys Vascular Endothelial Barriers to Promote Metastasis. Cancer Cell. 25, 501-515;
- Shijing Yue, Wei Mu, Ulrike Erb, Margot Zöller. (2015). The tetraspanins CD151 and Tspan8 are essential exosome components for the crosstalk between cancer initiating cells and their surrounding. Oncotarget. 6, 2366-2384;
- Stefania Raimondo, Laura Saieva, Chiara Corrado, Simona Fontana, Anna Flugy, et. al.. (2015). Chronic myeloid leukemia-derived exosomes promote tumor growth through an autocrine mechanism. Cell Communication and Signaling. 13, 8;
- Matias Ostrowski, Nuno B. Carmo, Sophie Krumeich, Isabelle Fanget, Graça Raposo, et. al.. (2010). Rab27a and Rab27b control different steps of the exosome secretion pathway. Nat Cell Biol. 12, 19-30;
- Annette M Marleau, Chien-Shing Chen, James A Joyce, Richard H Tullis. (2012). Exosome removal as a therapeutic adjuvant in cancer. J Transl Med. 10;
- Amrita Datta, Hogyoung Kim, Lauren McGee, Adedoyin E. Johnson, Sudha Talwar, et. al.. (2018). High-throughput screening identified selective inhibitors of exosome biogenesis and secretion: A drug repurposing strategy for advanced cancer. Sci Rep. 8.







