
МикроРНК в канцерогенезе: тонкая грань между спасением и разрушением
01 февраля 2024
МикроРНК в канцерогенезе: тонкая грань между спасением и разрушением
- 2082
- 0
- 12
Гидрогелевый каркас из самоорганизующейся РНК-тройной спирали для модуляции микроРНК в микроокружении опухоли. Криосекция адгезивного гидрогеля дендример—декстран (толщина 12 мкм) с изображением морфологии адгезива (декстрановый альдегид был помечен Alexa Fluor 405). Красные пятна представляют собой наночастицы с тройной спиралью, содержащие олигонуклеотиды Q705 (красный) и Q570 (зеленый).
Рисунок в полном размере.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: В последнее время исследования микроРНК (miRNA) стали важным направлением в изучении канцерогенеза, расширяя наше понимание этого опасного процесса. Они продемонстрировали большую роль этих небольших регуляторов, выполняющих функции как ценных инструментов, повышающих эффективность лечения, так и инициаторов процессов опухолеобразования. Хотя микроРНК и закодированы в небольшой части генома, в нормальных физиологических условиях они выполняют ряд ключевых функций в развитии, дифференцировке клеток, регуляции экспрессии генов, клеточном цикле и апоптозе.
Конкурс «Био/Мол/Текст»-2023/2024
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2023/2024.

Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Эти маленькие регуляторы — крайне важный инструмент организма. Нарушение в работе одной или небольшого подмножества микроРНК оказывает глубокое влияние на особенности экспрессии сотен мРНК. А это уже, в свою очередь, как по цепочке, влечет за собой нарушения в протекании основополагающих биологических процессов клетки. Итогом всех этих изменений зачастую становится опухоль. Так, в одно мгновение из важных контролёров клеточного цикла микроРНК превратились в диверсантов для собственного организма. Такое поведение свойственно онкогенным микроРНК.
Но есть еще и онкосупрессорные микроРНК, которые, будто пытаясь реабилитироваться, ингибируют процессы опухолеобразования и способствуют ремиссии рака. Такое разделение весьма неоднозначно, так как некоторые микроРНК в одних условиях могут быть онкосупрессорными, а в других — онкогенными.
Исходя из настолько противоположных функций, сложно сделать однозначные выводы о роли микроРНК в процессах канцерогенеза, однако многочисленные исследования подробно описали их влияние на клеточный цикл, метастазирование и ангиогенез в контексте развития рака.
Но для начала следует подробнее разобраться в природе микроРНК.
Откуда берутся эти микроРНК
МикроРНК (miRNA) представляют собой класс небольших некодирующих молекул РНК, последовательности средней длиной в 20 нуклеотидов. Они обычно собираются в ядре, следуя двум основным путям: каноническому и неканоническому.
Первый связан с транскрипцией первичной микроРНК (при-микроРНК, от англ. primary — «первичная») при помощи РНК-полимераз II или III. Эта при-микроРНК процессируется в предшественник микроРНК (пре-микроРНК) рибонуклеазой по имени Дроша (Drosha). В конечном результате экспортируется из ядра в цитозоль, где эндонуклеаза семейства РНКаз III (Dicer) преобразует пре-миРНК в дуплекс микроРНК (рис. 1).
Созревание микроРНК завершается образованием рибонуклеопротеинового комплекса — miRISC (комплекс молчания, индуцируемого микроРНК). В цитоплазме происходит ассоциация микроРНК с белками TRBP (transactivation response RNA-binding protein), PACT (protein kinase R activating protein) и одного из белков семейства Argonaute, в результате чего и образуется комплекс RISC. Только после образования этого комплекса микроРНК приобретает функциональную активность. Другая же цепь микроРНК (пассажирская) часто (но не всегда) удаляется [4].
По описанному механизму происходит биогенез большей части микроРНК, но этот путь не единственный. Около 40% микроРНК животных кодируются в интронах белок-кодирующих генов и, следовательно, многие транскрипты при-микроРНК являются одновременно пре-мРНК и при-микроРНК (Cai et al., 2004; Kim et al., 2009). Такие интроны, называемые миртронами, сплайсируются и формируют шпильки микроРНК, подходящие для расщепления Dicer. В таком случае микроРНК минует некоторые этапы канонического пути.
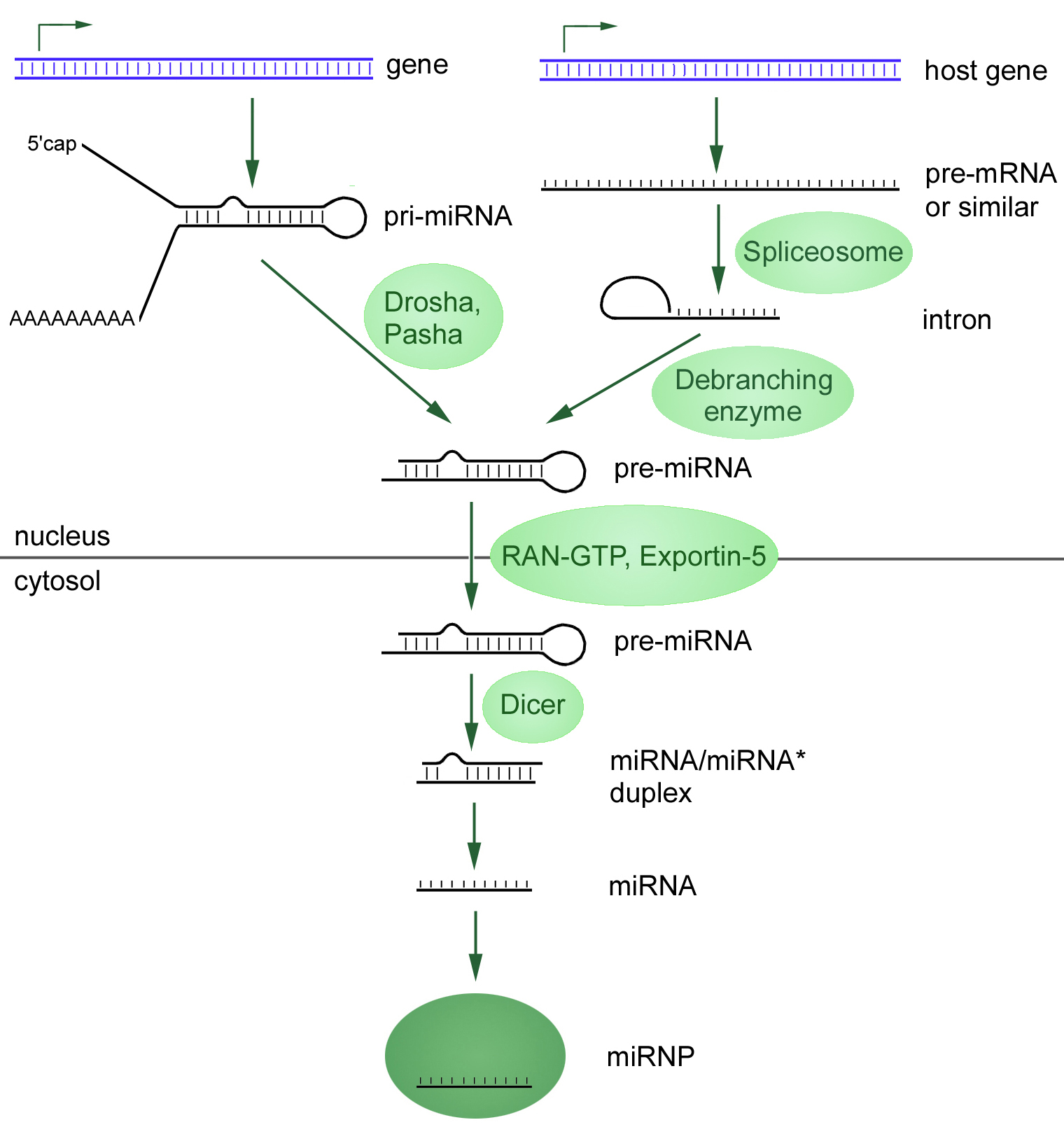
Рисунок 1. Два пути биогенеза микроРНК, начинающиеся в клеточном ядре с транскрипции.
Канонический путь представлен слева: при-микроРНК подвергается 5’- кэпированию и часто 3’-полиаденилированию (исключение составляют гены, прилегающие к Alu-повторам). C помощью ферментов Drosha Pasha при-микроРНК обрезается, преобразуясь в миРНК-предшественницу (пре-микроРНК) с более короткой последовательностью.
Неканонический путь: из интронов (миртронов) транскрибируется первичная микроРНК (при-микроРНК) в ядре, которая дальше сплайсируется сплайсосомами, а после формирует характерную шпильку. Образовавшаяся по итогам двух путей синтеза пре-микроРНК экспортируется из ядра в цитоплазму, где и преобразуется в зрелую микроРНК посредствам фермента Dicer.
Существует куда большее количество всевозможных вариантов биогенеза микроРНК, но эти два можно назвать основными [5].
Такие маленькие, а влияют на весь организм
Не стоит недооценивать роль микроРНК. Это очень важные регуляторы многих биологических процессов. Тот факт, что примерно треть генов, кодирующих белки, контролируется микроРНК, явно указывает на широкий круг влияния этих молекул, в который прямо или косвенно попадают почти все клеточные пути. Основной фактор воздействия микроРНК — регулирование экспрессии генов посредством репрессии, блокировки их трансляции или же разрушения специфических транскриптов матричной РНК (мРНК).
Регуляторная деятельность микроРНК тесно связана с белковым комплексом RISC, который отвечает за два важных этапа: распознавание мишени и осуществление регуляторного эффекта. Распознавание мРНК-мишени и связывание обеспечиваются комплементарным взаимодействием участка узнавания микроРНК и узнаваемого участка (miRNA response element, MRE), находящегося в мРНК-мишени. Регуляторные же эффекты микроРНК обеспечиваются благодаря многим белковым составляющим RISC, таким как AGO (Argonaute), который после узнавания и связывания с мишенью и запускает процесс развития эффекта на мишень.
Белковый комплекс RISC — это очень важная структура, принимающая участие во многих процессах регуляции активности генов (рис. 2А).
Взаимодействие микроРНК с белковым комплексом RISC происходит по следующему сценарию: одна из цепей дуплекса микроРНК (ведущая) внедряется в белковый комплекс, образуя структуру, связывающую 3’-нетранслируемый конец (3’ UTR) мРНК-мишени [6]. После этого микроРНК воздействует на свою мишень, результатом чего может стать разрушение мРНК нуклеазами или же подавление её трансляции (рис. 2Б) [7].
В целом считается, что микроРНК животных в подавляющем большинстве функционируют благодаря репрессии трансляции, тогда как микроРНК растений функционируют посредством посттранскрипционного подавления экспрессии генов. При этом микроРНК способны влиять на трансляцию на этапах инициации и элонгации. Интересно, что, помимо подавления транскрипции, обнаружены и другие механизмы действия микроРНК. Так, микроРНК могут стабилизировать мРНК и усиливать их трансляцию, выполнять функцию «приманки», препятствуя взаимодействию белковых факторов с их РНК-мишенями, а также участвовать в процессе созревания других микроРНК.
Занесло же микроРНК в канцерогенез
Ханахан и Вайнберг [8] описали основные признаки рака с точки зрения главных биологических особенностей: поддержание передачи пролиферативных сигналов; уклонение от воздействия супрессоров роста; предотвращение гибели клеток; обеспечение репликативного бессмертия; индуцирование ангиогенеза; активация инвазии и метастазирования; дерегулирование клеточной энергетики; уклонение от иммунной системы; воспаление, способствующее развитию опухоли; нестабильность и мутации генома (рис. 3) [9].
Как ни странно, но микроРНК играют ключевые роли в большинстве перечисленных признаков (в некоторых они оказывают косвенное влияние). Этот фактор и обуславливает особое внимание к микроРНК в процессах канцерогенеза.
Пару лет назад можно было бы сказать, что «всё больше данных подтверждает значимость микроРНК для понимания канцерогенеза», но сейчас уже ясна определяющая роль этих регуляторов в посттранскрипционной регуляции экспрессии белков, как и способность одной микроРНК воздействовать на широкий спектр продуктов [8].
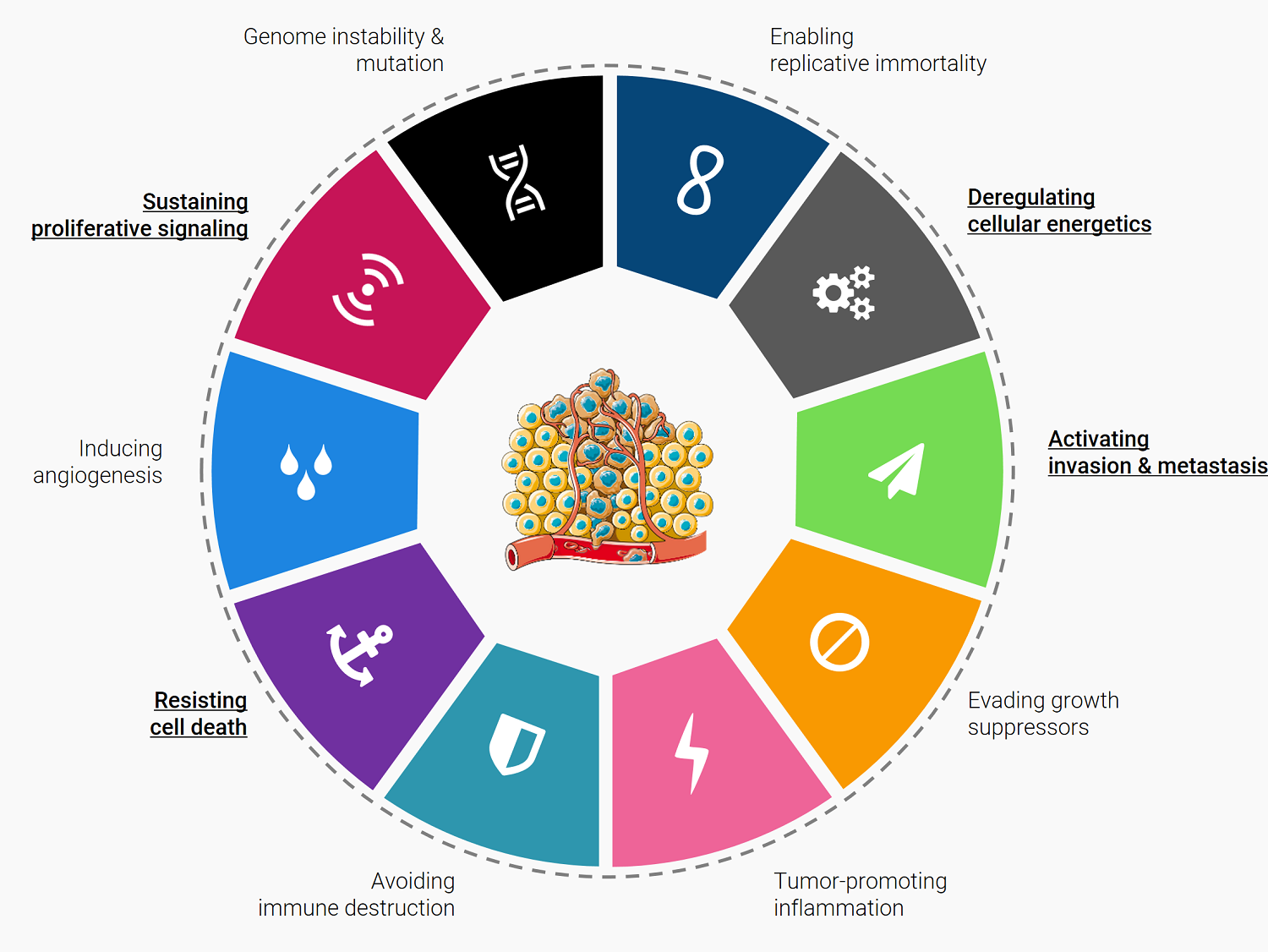
Рисунок 3. Признаки рака.
Как было упомянуто ранее, среди микроРНК принято выделять онкогенные (oncomiRs) и онкосупрессорные (tsmiRs). Такое разделение связано с воздействием микроРНК на процессы образования опухолей. Так, некоторые микроРНК демонстрируют разные уровни экспрессии при раке и способны влиять на клеточную трансформацию, пролиферативную активность или же на процессы метастазирования [10]. Похоже, что к списку функций микроРНК можно добавить еще несколько пунктов, таких как нерегулируемая экспрессия вследствие нарушения ее регуляции, участие в развитии и прогрессировании рака путем специфического взаимодействия с белками [11], [12].
Эффект, оказываемый микроРНК в опухолевых клетках, может быть различным в зависимости от ткани, ведь даже одна и та же микроРНК способна действовать как онкосупрессор в одной ткани и как онкогенный сигнал — в другой. Или же микроРНК могут действовать совместно со многими факторами, способствуя росту опухоли, инвазии и устойчивости к химиотерапии [13], [14].
Примечательно, что снижение активности онкосупрессорных микроРНК (tsmiR), таких как miR-203 (принимающих участие в потере регуляции пролиферации клеток в фазе G1 из-за изменений в SOCS3), также вызывает нарушения регуляции клеточного цикла [15]. В совокупности, любые изменения нормального протекания клеточных процессов, связанных с регуляцией генов, напрямую влияют на пролиферативную активность клеток. Итоги могут быть разнообразны, но в подавляющем большинстве случаев геномная нестабильность — верный шаг к развитию канцерогенеза [8].
Как союзники становятся предателями
Исследования синтеза и функционирования микроРНК представляют собой важное направление современной биомедицины, открывающее новые перспективы для понимания молекулярных механизмов регуляции биологических процессов.
Одним из первых прямых примеров того, что микроРНК играет онкогенную роль, стала miR-155, сверхэкспрессия которой была связана с несколькими типами лимфом, например, с лимфомой Ходжкина и Беркитта [16]. Исследования 2006 года [17] смогли продемонстрировать явную роль этой микроРНК в онкогенезе.
В одном из таких исследований использовали трансгенных мышей, специфически обладающих повышенной экспрессией miR-155 в В-клетках. У этих трансгенных мышей развилось предлейкемическое лимфопролиферативное заболевание, прогрессирующее до В-клеточного лейкоза и лимфомы высокой степени злокачественности. Такие результаты явно свидетельствуют о том, что дерегуляция miR-155 может быть ранним событием в онкогенезе, которое требует дополнительных генетических изменений для развития полностью злокачественного фенотипа (рис. 4).
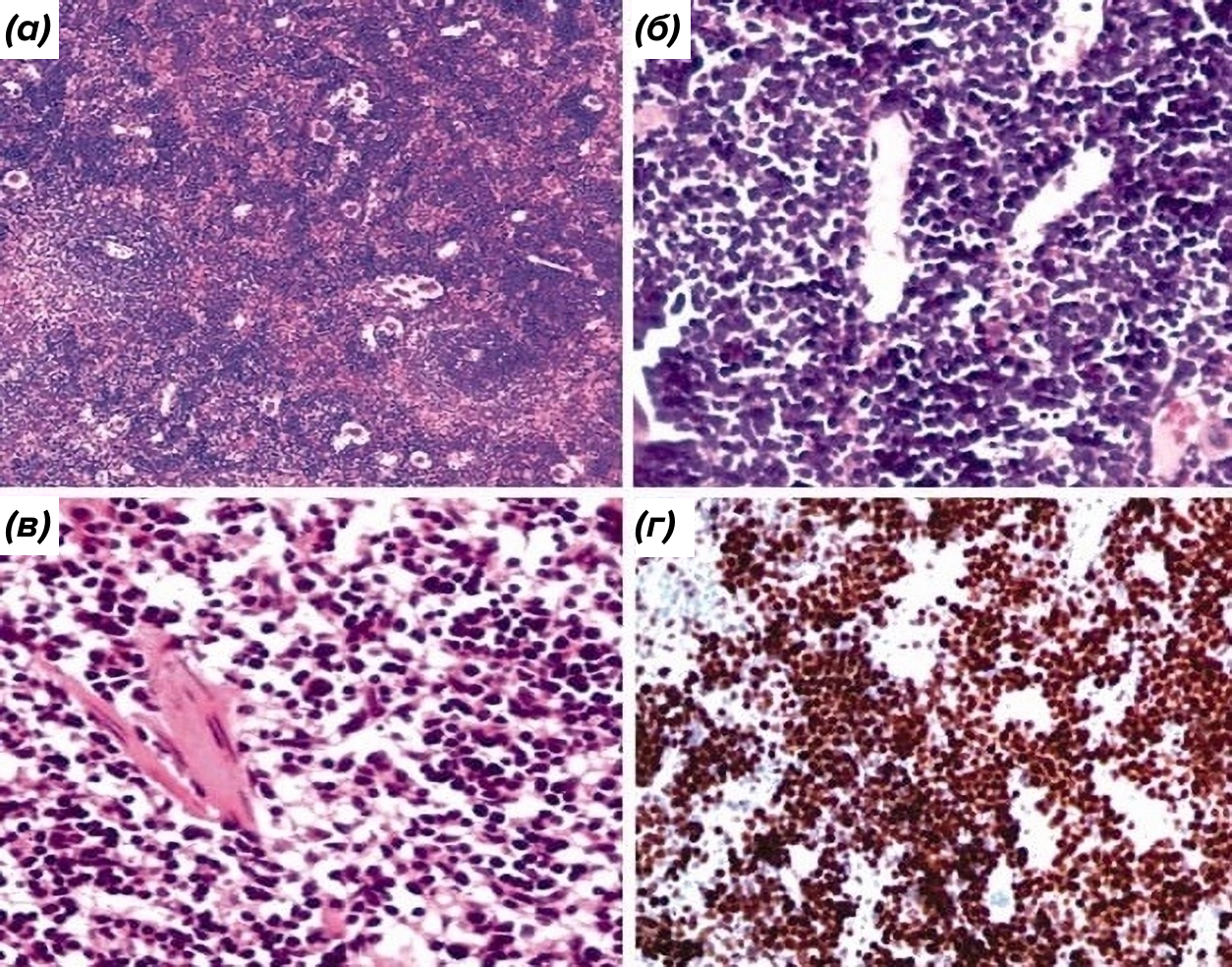
Рисунок 4. (а) — селезенка (×200), трансгенная мышь, архитектура селезенки была почти полностью стерта лимфобластной пролиферацией; (б) — костный мозг (×400) трансгенной мыши, демонстрирующий лимфобластную пролиферацию, которая приводит к замещению кроветворных очагов; (в) — нормальная селезенка (×200); (г) — иммуногистохимический анализ селезенки трансгенной мыши, показывающий повышенную лимфоидную пролиферацию в селезенке (×200).
Еще одним ярким примером можно назвать микроРНК-21 (miR-21). Обширные исследования этой микроРНК показали ее значимость в патогенезе опухолей на разных стадиях канцерогенеза. Так, микроРНК-21 была присвоена роль важного биомаркера неблагоприятного прогноза при злокачественных новообразованиях у человека [18]. Оказалось, что уровень экспрессии микроРНК-21 намного выше при злокачественных новообразованиях на поздних стадиях, чем на начальных, когда рак еще сложно точно диагностировать. Сверхэкспрессия микроРНК-21 была обнаружена в клеточных линиях рака молочной железы человека in vitro, а также в образцах тканей, играющих существенную роль на всех этапах патогенеза рака молочной железы [18].
Экспрессия микроРНК-21, помимо прочего, имеет одно из решающих значений при раке толстой кишки. В процессе канцерогенеза рака толстой кишки микроРНК-21 инициирует стволовость, способствуя подавлению рецептора TGFβ (трансформирующего фактора роста β) и стимулируя инвазию, а также метастазирование путем подавления PDCD4 (ингибитор неопластической трансформации) [19], [20]. МикроРНК-21 была тщательно исследована на предмет прогностического потенциала по меньшей мере в десяти независимых друг от друга исследованиях с участием 2039 пациентов с 2008 года [21], и в настоящее время эта микроРНК активно изучается.
Очень важная роль микроРНК отводится и на более поздних стадиях онкогенеза, при распространенных и метастатических формах рака. Некоторые микроРНК, такие как микроРНК-21 (miR-21) и микроРНК-10b (miR-10b), оказались ключевыми акторами данных явлений. МикроРНК-21 вносит свой вклад в онкогенез частично путем регуляции гена-супрессора опухоли тропомиозина 1 (TPM1), белка, принимающего участие в миграции клеток. Недавние исследования продемонстрировали, что подавление микроРНК-21 в метастатических клетках рака молочной железы или злокачественных гепатоцитах значительно снижает инвазию и метастазирование.
Таким образом, было показано, что микроРНК-10b способствует повышенной миграции и инвазии клеток посредством различных генов-мишеней; помимо этого было показано, что она участвует в прогрессировании опухоли, ангиогенезе и пролиферативной активности [20], [24].
Баланс микроРНК: светлая сторона невидимых регуляторов
Что же мы все о плохом, не всегда же микроРНК только способствуют опухолеобразованию. МикроРНК также способны подавлять процессы канцерогенеза.
Некоторые исследования явно показывают, что большинство микроРНК имеют сильно сниженную экспрессию в опухолях [25]. Интересно, что этот паттерн экспрессии очень схож с обнаруженным на ранних этапах развития млекопитающих. Это еще раз подтверждает тот факт, что экспрессия микроРНК частично ответственна за клеточную дифференцировку. По итогу получается, что изменения в экспрессии микроРНК, наблюдаемые при раке, способствуют менее дифференцированному состоянию клеток, характерному для рака.
Однако какими бы увлекательными ни были данные по экспрессии, они не смогли доказать, что сниженная экспрессия микроРНК является причиной развития рака, а не просто побочным продуктом менее дифференцированного состояния. Исследователи решили разобраться с этим вопросом: они снижали выработку зрелых микроРНК путем нацеливания RNAi (RNA Interference) на процессинговые ферменты Drosha и Dicer (рис. 5).
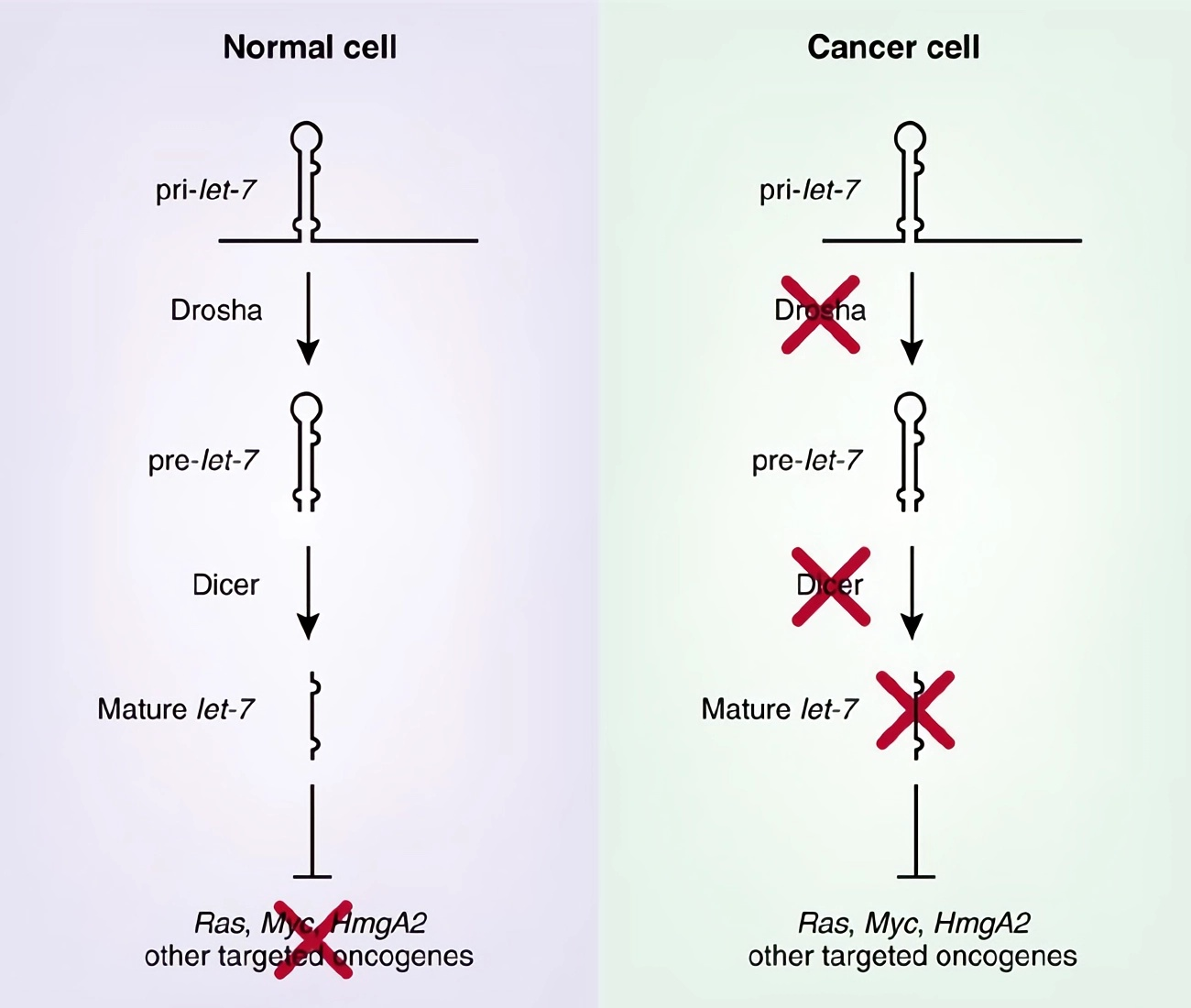
Рисунок 5. В качестве примера показана микроРНК let-7. В нормальных клетках вырабатывается зрелый let-7, который нацелен на несколько онкогенов. В раковых клетках уровни let-7 снижены, что приводит к перепроизводству этих онкогенов, способствуя таким образом опухолевому росту.
Когда уровни микроРНК были снижены в клеточной линии аденокарциномы легкого, эти клетки с «нокдауном микроРНК» показали повышенное образование колоний в культуре и усиленный рост опухоли у подопытных мышей [26–28].
Важно отметить, что этот эффект наблюдался только в клеточных линиях, которые уже были трансформированы. Например, здоровые первичные клетки, в которых удаляли микроРНК, не проявляли никаких трансформированных свойств. Фактически, такие клетки росли даже медленнее, чем клетки дикого типа. По-видимому, снижение уровня микроРНК не является инициирующим событием. А вот в сочетании с экспрессией онкогена Ras сниженная экспрессия микроРНК увеличивала рост в культуре и увеличивала развитие карциномы легких in vivo [29].
Если получится восстановить нормальную выработку микроРНК, это может блокировать рост раковых клеток или способствовать их дифференцировке. Оба этих результата будут иметь высокую терапевтическую ценность.
Развивая новые методы: микроРНК — от угрозы к надежде в лечении рака
Понимание механизмов взаимодействия микроРНК с генетическим аппаратом клетки имеет широкие перспективы для разработки инновационных методик молекулярной диагностики, а также для создания новых подходов к индивидуализированному лечению раковых заболеваний, включая терапевтическое модулирование экспрессии микроРНК.
Полученные данные об уровнях экспрессии микроРНК в опухолях продемонстрировали, что микроРНК — многообещающие претенденты на роль биомаркеров опухолей и подтипов опухолей, а также прогностических маркеров их клинического поведения. Так, профили экспрессии микроРНК показали высокую эффективность при идентификации рака молочный железы и предстательной железы [30]; также они способны облегчить диагностику рака толстой кишки [31] или легких [32], или же многих других видов рака (рис. 6) [33].

Рисунок 6. Равномерно диффузная экспрессия miR-211 (красная) обнаружена во внутрикожных невусных гнездах (a) по сравнению с аномальной частичной потерей miR-211 (цитоплазма черная, а ядра синие) в клетках in situ (стрелка) и инвазивной меланомы (стрелка) (б), что служит маркером неблагоприятного состояния организма.
Полезность биомаркеров сложно переоценить, ведь они используются как важные индикаторы различных патогенных процессов в организме. Множество исследований посвящено потенциальной ценности биомаркеров на основе микроРНК как для диагностики, так и для прогноза злокачественных новообразований человека.
Однако на сегодняшний день ни одна из описанных методик не внедрена в клиническую практику. Несмотря на многообещающие результаты, остается много проблем. Одна из них — сложность точного выявления соответствующих маркеров: необходимо использовать высокоточные инструменты, а также соответствующие статистические и биокомпьютерные анализы для детектирования потенциального изменения в экспрессии микроРНК. Помимо этого, выбор соответствующих контрольных образцов чрезвычайно важен для нормализации биологических вариаций. В итоге пока ни один маркер на основе микроРНК не был внедрен в клиническую практику.
Но потенциальные возможности использования знаний о микроРНК при лечении рака не ограничиваются биомаркерами. Обширные доклинические исследования посвящены применению микроРНК в качестве новых молекулярных мишеней для таргетированной терапии рака, что открывает перед исследователями возможности для разработки инновационных лечебных методик. Метод основывается на применении антисмысловых последовательностей микроРНК (анти-микроРНК) .
На «Биомолекуле» также можно найти статью про антисмысловые последовательности: «Есть ли смысл в антисенсах?» [34].
Анти-микроРНК (antisense oligonucleotides, антисмысловые олигонуклеотиды) — это короткие однонитевые последовательности нуклеотидов, комплементарно связывающиеся с молекулой микроРНК. После связывания с таргетной микроРНК последняя не в состоянии распознавать свою мишень — мРНК, вследствие чего возобновляется синтез белка с мРНК-мишени [35], или же микроРНК расщепляется специфичными белками, связанными с олигонуклеотидной последовательностью. Введение таких антисмысловых олигонуклеотидов способно эффективно ингибировать зрелые вредоносные микроРНК, способствуя значительному уменьшению опухоли.
Основная сложность такого подхода к лечению — высокопродуктивная доставка антисмысловых олигонуклеотидов в опухолевые клетки. Барьеры клеточной мембраны и быстрая деградация в организме создают сложности. Одна из самых больших проблем — быстрое выведение: в условиях обширных опухолей концентрация олигонуклеотидов должна быть высокой для более продуктивного воздействия на сверхэкспрессирующиеся микроРНК, однако данная задача трудновыполнима из-за физиологических особенностей организма.
Интересна смешанная стратегия лечения с использованием микроРНК, опубликованная не так давно. Отличительная особенность этого подхода — одновременное подавление онкогенных микроРНК и применение заместительной терапии опухолевыми супрессорами с использованием гидрогелевого каркаса, содержащего РНК-тройную спираль (RNA-triple-helix), которая обеспечивает высокоэффективную местную противоопухолевую терапию (рис. 7).
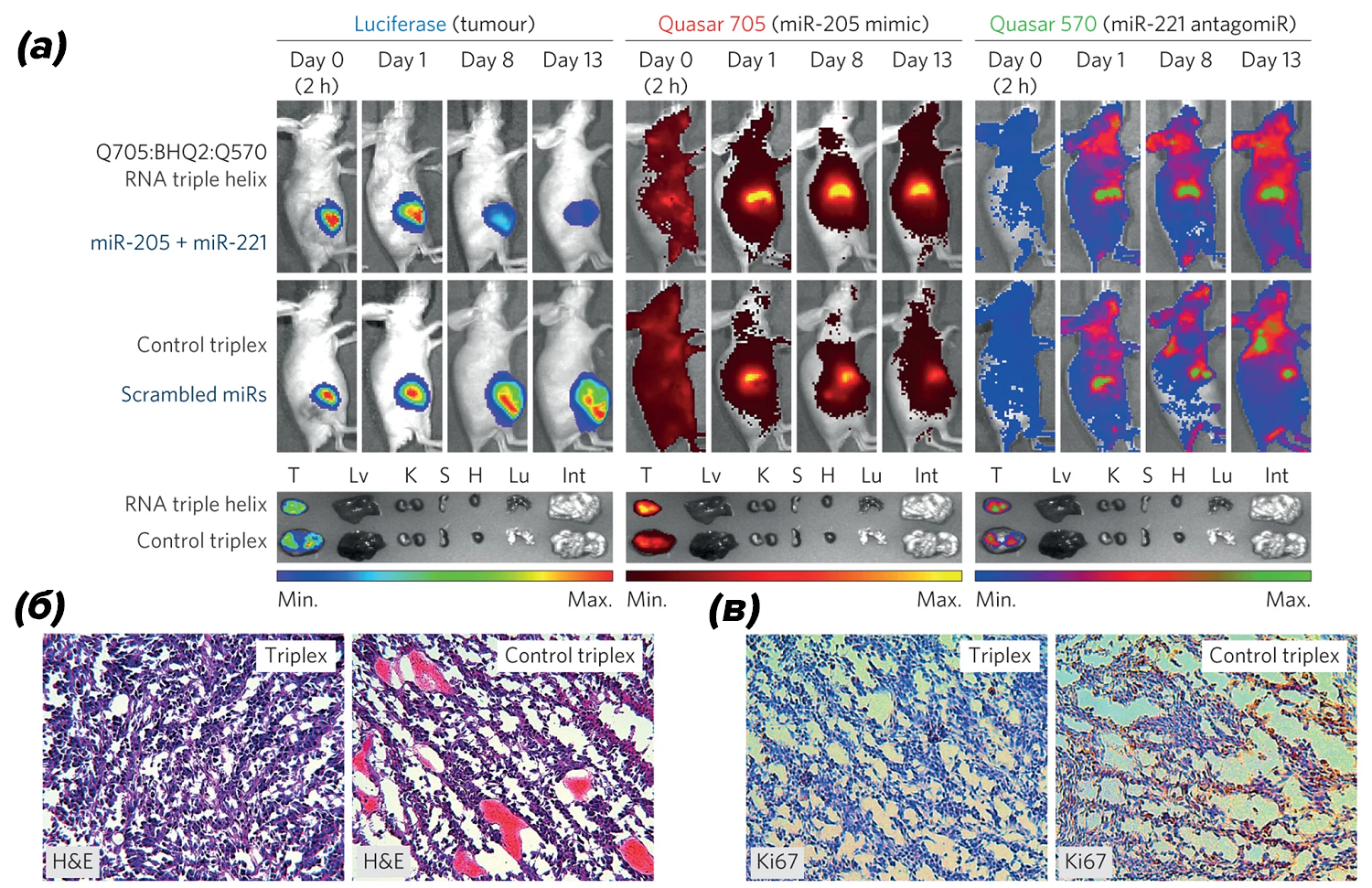
Рисунок 7. (а) — живая визуализация самок безволосых конгенных мышей SCID с ксенотрансплантатом триджы негативной опухоли молочной железы, в которую имплантирован гидрогель со встроенными наночастицами, содержащими РНК-тройной спирали, и с контрольным триплексом (перемешанные миР), (n = 5 на группу). Также представлены изображения ex vivo опухолей молочной железы и некоторых органов (T — опухоль; Lv — печень; K — почки; S — селезенка; H — сердце; Lu — легкие; Int — кишечник);
(б) — окрашивание гематоксилином и эозином (H&E) опухолей из групп, обработанных гидрогелем, со встроенными в наночастицы РНК-тройной спирали и с контрольным триплексом (scrambled miRs);
(в) — иммуногистохимическая оценка опухолей (по маркеру пролиферации Ki67), обработанных гидрогелем, со встроенными в наночастицы РНК-тройной спирали и с контрольным триплексом.
Благодаря использованию самособирающейся структуры РНК-тройной спирали, включающей в себя две микроРНК (микроРНК-супрессор опухоли и ингибитор онко-микроРНК), обеспечивается выдающаяся способность синергически воздействовать на рост опухоли.
Использование гидрогелей с лекарственной нагрузкой в значительной степени замедляло прогрессирование опухоли. Данная стратегия успешно привела к стойкому длительному положительному результату.
Несмотря на то, что данный метод доставки более эффективен по сравнению с ранее предложенными, задача все еще остается до конца нерешенной. Помимо этого, остаются вопросы специфичности воздействия и скорости выведения организмом. Необходимо провести множественные лабораторные и клинические испытания, прежде чем этот способ будет использоваться для лечения настоящих пациентов, а не подопытных мышей.
Активно изучалась и продолжает изучаться возможность терапевтического применения комбинации стандартной терапии с препаратами, оказывающими воздействие на экспрессию микроРНК. Экспрессия микроРНК-21 в гемцитабин-резистентных клетках рака поджелудочной железы может уменьшаться под действием аналогов куркумина, приводя к реактивации гена опухолевого супрессора PTEN [16]. Авторы отметили повышенную экспрессию микро-РНК200с при обработке культуры гемцитабин-резистентных клеток аналогами куркумина, что, возможно, приводит к возврату раковых клеток из эпителиального состояния к менее злокачественному мезенхимальному. Это, как считают авторы, может сопровождаться возвращением чувствительности к гемцитабину [36]. Таким образом, комбинация стандартной терапии с препаратами, влияющими на экспрессию микроРНК, может быть эффективной стратегией при лечении злокачественных опухолей [37].
Но не всё так хорошо, как могло бы показаться. Сам куркумин, как и некоторые его аналоги — достаточно опасное соединение, способное вызывать повреждение и фрагментацию ДНК, приводя к апоптотической гибели клеток как в здоровых, так и в опухолевых тканях. Несмотря на то, что куркумин является антиоксидантом, он может привести к временному увеличению активных форм кислорода и снижению жизнеспособности клеток из-за истощения глутатиона [38], [39].
Очень большие надежды подает метод использования самих микроРНК для подавления опухолевого роста. У ученых получилось снизить инвазию и способность к миграции клеток рака молочной железы с помощью микроРНК-125 (miR-125) [40].
В настоящее время внимание ученых привлекла к себе микроРНК-34а (miR-34a). Так, в недавнем исследовании [41] было продемонстрировано, как увеличение стабильности вместе с повышенной специфичностью воздействия микроРНК-34а способно эффективно ингибировать рост опухоли (рис. 8).
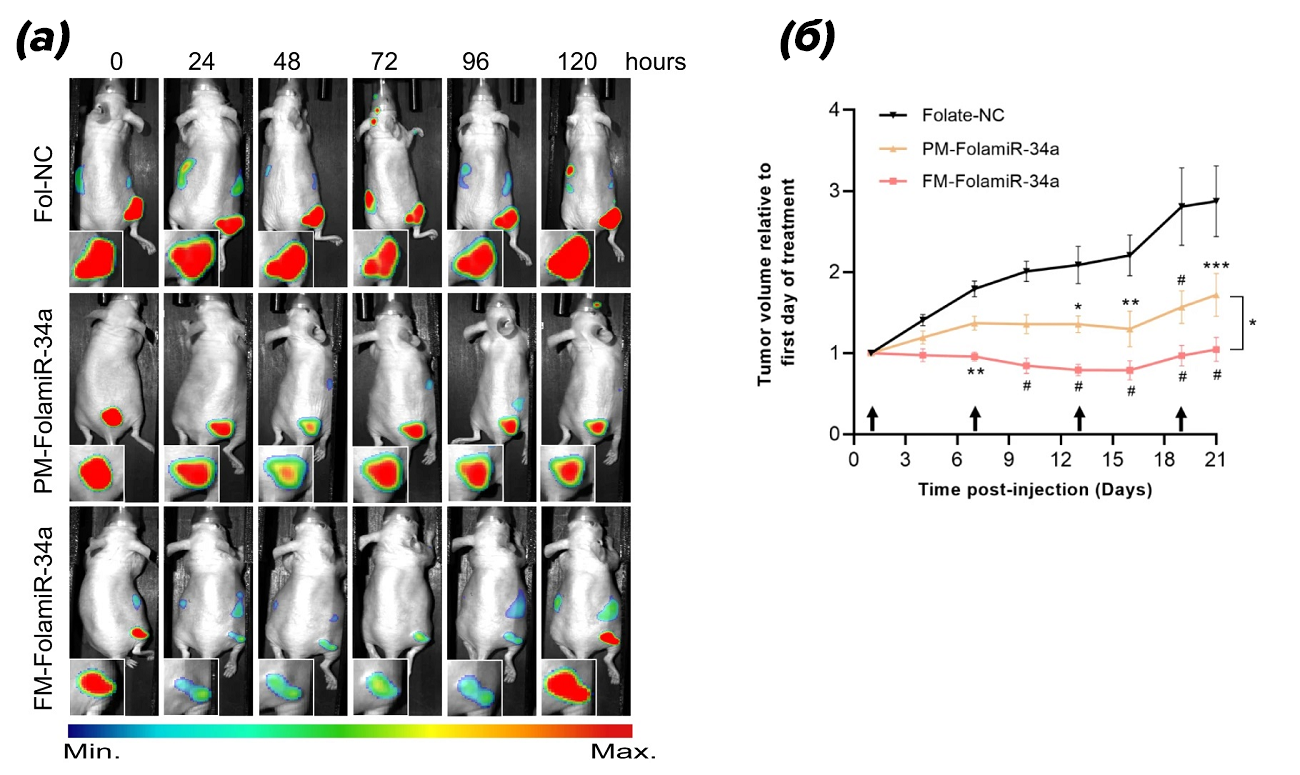
Рисунок 8. (а) — изображение сигнала сенсора люциферазы Renilla у голых мышей, которым имплантировали раковые клетки (MB-231). Представлены данные после однократной внутривенной инъекции в равных дозах частично модифицированной микроРНК-34а (PM-FolamiR-34a), полностью (FM-FolamiR-34a), а также контроль (Fol-NC);
(б) — объемы опухолей в процессе лечения подопытных мышей исследуемыми конъюгатами микроРНК; стрелками обозначены проводимые инъекции (1,5 нмоль, внутривенная инъекция, один раз в 6 дней).
Представленный метод сопряжения микроРНК с нацеливающим лигандом, имеющим высокое сродство к рецепторам клеток-мишеней, обладает высоким терапевтическим потенциалом и решает сложности, с которыми сталкивались другие исследователи, такие как быстрая деградация и токсичность молекул. Повышение сродства модифицированных микроРНК к раковым клеткам позволяет предотвращать побочное токсическое влияние, вызванное неспецифическим поглощением здоровыми тканями.
И хотя ученым удалось добиться значительного уменьшения скорости роста опухоли за время лечения, заявить с облегчением, что лекарство от рака найдено, еще слишком рано. Предстоит решить ряд проблемных вопросов, ведь, как и другие, данный метод не лишен недостатков. Одно из наиболее существенных препятствий на пути использования данного подхода в медицине — секвестрация (удержание) доставленной в клетки РНК внутри эндосом, вдали от цитоплазмы, где микроРНК биологически активна. Тем не менее, авторам удалось явно указать на эффективность применения химически модифицированных микроРНК.
Похоже, что для онкологов открывается большое перспективное направление в терапии онкологических заболеваний. Последние достижения в понимании молекулярных механизмов рака и регуляции микроРНК сияют как новые звезды на горизонте биомедицинской науки, подтверждая их значимость для создания новых подходов к лечению раковых заболеваний и подчеркивая важность дальнейших исследований в этой области.
Такие разные микроРНК
МикроРНК тайно плетут нити судьбы внутри клеток, безмолвно поддерживая баланс экспрессии генов и помогая им раскрывать их генетическую информацию. Но когда регуляция микроРНК нарушается, как это часто бывает в раковых клетках, величественный танец жизни оказывается под серьезной угрозой. Онкогенез пробуждается, заявляет о себе, и рак неуклонно движется вперед, охватывая все большее пространство.
Следует отдать должное огромным усилиям исследователей, направленным на разработку лекарства от рака на основе знаний о микроРНК. Хотя мы еще далеки от заветной цели, научное сообщество активно борется с многочисленными сложностями, возникающими на их пути. Междисциплинарные исследования, разработка инновационных технологий и постоянное стремление к пониманию молекулярных механизмов процессов канцерогенеза открывают новые перспективы в поиске революционного подхода к лечению рака.
Когда-то все эти ценные знания и опыт, полученные в результате бесчисленных исследований, воплотятся в терапевтических прорывах и спасут миллионы жизней. Нам еще предстоит раскрыть все прелести и тайны функционирования микроРНК, чтобы вступить в новую эру борьбы с раком.
Литература
- João Conde, Nuria Oliva, Mariana Atilano, Hyun Seok Song, Natalie Artzi. (2016). Self-assembled RNA-triple-helix hydrogel scaffold for microRNA modulation in the tumour microenvironment. Nature Mater. 15, 353-363;
- МикроРНК — чем дальше в лес, тем больше дров;
- Обо всех РНК на свете, больших и малых;
- И. А. Запорожченко, Е. Ю. Рыкова, П. П. Лактионов. (2020). Основы биологии микроРНК: строение, биогенез и регуляторные функции. Биоорган. химия. 46, 3-17;
- Julia Winter, Stephanie Jung, Sarina Keller, Richard I. Gregory, Sven Diederichs. (2009). Many roads to maturity: microRNA biogenesis pathways and their regulation. Nat Cell Biol. 11, 228-234;
- Claudia Kutter, Petr Svoboda. (2008). miRNA, siRNA, piRNA: Knowns of the unknown. RNA Biology. 5, 181-188;
- Zixiang Wu, Shujing Liang, Wenyu Kuai, Lifang Hu, Airong Qian. (2019). MicroRNAs and long noncoding RNAs: new regulators in cell fate determination of mesenchymal stem cells. RSC Adv.. 9, 37300-37311;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Doris P. Tabassum, Kornelia Polyak. (2015). Tumorigenesis: it takes a village. Nat Rev Cancer. 15, 473-483;
- Pedro P. Medina, Mona Nolde, Frank J. Slack. (2010). OncomiR addiction in an in vivo model of microRNA-21-induced pre-B-cell lymphoma. Nature. 467, 86-90;
- Kaladhar B Reddy. (2015). MicroRNA (miRNA) in cancer. Cancer Cell Int. 15;
- Simon Ng, Yujuan Dong, Jun Yu. (2014). MicroRNA dysregulation as a prognostic biomarker in colorectal cancer. CMAR. 405;
- Keiichi Yonemori, Hiroshi Kurahara, Kosei Maemura, Shoji Natsugoe. (2017). MicroRNA in pancreatic cancer. J Hum Genet. 62, 33-40;
- Mohammad Aslam Khan, Haseeb Zubair, Sanjeev Kumar Srivastava, Seema Singh, Ajay Pratap Singh. (2015). Insights into the Role of microRNAs in Pancreatic Cancer Pathogenesis: Potential for Diagnosis, Prognosis, and Therapy. Advances in Experimental Medicine and Biology. 71-87;
- Leonel Pekarek, Diego Torres-Carranza, Oscar Fraile-Martinez, Cielo García-Montero, Tatiana Pekarek, et. al.. (2023). An Overview of the Role of MicroRNAs on Carcinogenesis: A Focus on Cell Cycle, Angiogenesis and Metastasis. IJMS. 24, 7268;
- Peggy S. Eis, Wayne Tam, Liping Sun, Amy Chadburn, Zongdong Li, et. al.. (2005). Accumulation of miR-155 and BIC RNA in human B cell lymphomas. Proc. Natl. Acad. Sci. U.S.A.. 102, 3627-3632;
- Stefan Costinean, Nicola Zanesi, Yuri Pekarsky, Esmerina Tili, Stefano Volinia, et. al.. (2006). Pre-B cell proliferation and lymphoblastic leukemia/high-grade lymphoma in Eμ-miR155 transgenic mice. Proc. Natl. Acad. Sci. U.S.A.. 103, 7024-7029;
- Wenjia Wang, Jinhui Li, Wei Zhu, Chen Gao, RuiJingfang Jiang, et. al.. (2014). MicroRNA-21 and the clinical outcomes of various carcinomas: a systematic review and meta-analysis. BMC Cancer. 14;
- ZHONG JU ZHANG, SHI LIANG MA. (2012). miRNAs in breast cancer tumorigenesis (Review). Oncology Reports. 27, 903-910;
- I A Asangani, S A K Rasheed, D A Nikolova, J H Leupold, N H Colburn, et. al.. (2008). MicroRNA-21 (miR-21) post-transcriptionally downregulates tumor suppressor Pdcd4 and stimulates invasion, intravasation and metastasis in colorectal cancer. Oncogene. 27, 2128-2136;
- Yingjie Yu, Pratima Nangia-Makker, Lulu Farhana, Sindhu G. Rajendra, Edi Levi, Adhip PN Majumdar. (2015). miR-21 and miR-145 cooperation in regulation of colon cancer stem cells. Mol Cancer. 14;
- Byunghee Yoo, Amol Kavishwar, Alana Ross, Ping Wang, Doris P. Tabassum, et. al.. (2015). Combining miR-10b–Targeted Nanotherapy with Low-Dose Doxorubicin Elicits Durable Regressions of Metastatic Breast Cancer. Cancer Research. 75, 4407-4415;
- Sheedy P., Medarova Z. (2018). The fundamental role of miR-10b in metastatic cancer. American Journal of Cancer Research. 8, 1674–1688;
- Cheng-gong Liao, Ling-min Kong, Ping Zhou, Xiu-li Yang, Jian-guo Huang, et. al.. (2014). miR-10b is overexpressed in hepatocellular carcinoma and promotes cell proliferation, migration and invasion through RhoC, uPAR and MMPs. J Transl Med. 12;
- Scott M Hammond. (2007). MicroRNAs as tumor suppressors. Nat Genet. 39, 582-583;
- Madhu S Kumar, Jun Lu, Kim L Mercer, Todd R Golub, Tyler Jacks. (2007). Impaired microRNA processing enhances cellular transformation and tumorigenesis. Nat Genet. 39, 673-677;
- Jun Lu, Gad Getz, Eric A. Miska, Ezequiel Alvarez-Saavedra, Justin Lamb, et. al.. (2005). MicroRNA expression profiles classify human cancers. Nature. 435, 834-838;
- Arti Gaur, David A. Jewell, Yu Liang, Dana Ridzon, Jason H. Moore, et. al.. (2007). Characterization of MicroRNA Expression Levels and Their Biological Correlates in Human Cancer Cell Lines. Cancer Research. 67, 2456-2468;
- Marilena V. Iorio, Rosa Visone, Gianpiero Di Leva, Valentina Donati, Fabio Petrocca, et. al.. (2007). MicroRNA Signatures in Human Ovarian Cancer. Cancer Research. 67, 8699-8707;
- Michael D Mattie, Christopher C Benz, Jessica Bowers, Kelly Sensinger, Linda Wong, et. al.. (2006). . Mol Cancer. 5, 24;
- Michael M. Z., O’ Connor S. M., van Holst Pellekaan N. G., Young G. P., James R. J. (2003). Reduced accumulation of specific microRNAs in colorectal neoplasia. Molecular Cancer Research. 1, 882–891;
- Yoji Hayashita, Hirotaka Osada, Yoshio Tatematsu, Hideki Yamada, Kiyoshi Yanagisawa, et. al.. (2005). A Polycistronic MicroRNA Cluster, miR-17-92, Is Overexpressed in Human Lung Cancers and Enhances Cell Proliferation. Cancer Research. 65, 9628-9632;
- Sankhiros Babapoor, Michael Horwich, Rong Wu, Shauna Levinson, Manoj Gandhi, et. al.. (2016). microRNA in situ hybridization for miR-211 detection as an ancillary test in melanoma diagnosis. Modern Pathology. 29, 461-475;
- Есть ли смысл в антисенсах?;
- Гапонова С. К. Сиквенс-специфические олигонуклеотид-пептидные конъюгаты и n-(метансульфонил)фосфорамидные аналоги антисмысловых олигонуклеотидов как ингибиторы онкогенных мирнк in vitro и in vivo: дис. канд. биол. наук. — Новосибирск, 2020. — 215 с.;
- Shadan Ali, Aamir Ahmad, Sanjeev Banerjee, Subhash Padhye, Kristin Dominiak, et. al.. (2010). Gemcitabine Sensitivity Can Be Induced in Pancreatic Cancer Cells through Modulation of miR-200 and miR-21 Expression by Curcumin or Its Analogue CDF. Cancer Research. 70, 3606-3617;
- Jun Yu, Kenoki Ohuchida, Kazuhiro Mizumoto, Norihiro Sato, Tadashi Kayashima, et. al.. (2010). MicroRNA, hsa-miR-200c, is an independent prognostic factor in pancreatic cancer and its upregulation inhibits pancreatic cancer invasion but increases cell proliferation. Mol Cancer. 9;
- Neil V. Klinger, Sandeep Mittal. (2016). Therapeutic Potential of Curcumin for the Treatment of Brain Tumors. Oxidative Medicine and Cellular Longevity. 2016, 1-14;
- T. I. Kushnir, N. E. Arnotskaya, I. A. Kudryavtsev, V. E. Shevchenko. (2020). The therapeutic potential of curcumin for the treatment of glioblastoma multiforme. Usp. mol. onkol. 7, 8-16;
- Joacim Elmén, Morten Lindow, Sylvia Schütz, Matthew Lawrence, Andreas Petri, et. al.. (2008). LNA-mediated microRNA silencing in non-human primates. Nature. 452, 896-899;
- Ahmed M. Abdelaal, Ikjot S. Sohal, Shreyas Iyer, Kasireddy Sudarshan, Harish Kothandaraman, et. al.. (2023). A first-in-class fully modified version of miR-34a with outstanding stability, activity, and anti-tumor efficacy. Oncogene. 42, 2985-2999.






