Обо всех РНК на свете, больших и малых
09 июня 2010
Обо всех РНК на свете, больших и малых
- 36445
- 4
- 61
Метафора, лежащая в основе названия явления РНК-интерференции, отсылает к опыту с петунией, когда искусственно введённые в растение гены синтетазы розового и фиолетового пигментов не увеличили интенсивность окраски, а, наоборот, уменьшили её. Аналогично, в «обычной» интерференции наложение двух волн может приводить к взаимному «гашению».
Рисунок в полном размере.
-
Автор
-
Редакторы
Темы
Ещё двадцать лет назад молекулярная биология не знала такого удивительного феномена, как РНК-интерференция. Сегодня же у учёных не вызывает сомнения, что это явление принимает участие в широчайшем спектре физиологических процессов у всех живых существ, а её молекулярные посредники — короткие РНК — по разнообразию и специфичности не уступают антителам крови. У простейших РНК-интерференция обеспечивает иммунитет, в частности — защиту от вирусов. У более развитых организмов этот механизм включается в борьбу не только (и не столько) с внешними, но и с внутригеномными паразитами, а также становится важнейшим регулятором активности генов. На сегодняшний день идентифицированы уже тысячи коротких регуляторных РНК, а механизм РНК-интерференции изучен очень подробно, однако бесспорно и то, что мы наблюдаем пока только верхушку этого айсберга.
В живой клетке поток информации между ядром и цитоплазмой никогда не иссякает, однако понимание всех его «завихрений» и расшифровка закодированной в нём информации — воистину титаническая задача. Одним из важнейших рывков в биологии прошлого века можно считать открытие молекул информационных (или матричных) РНК (иРНК или мРНК), которые служат посредниками, переносящими информационные «сообщения» из ядра (с хромосом) в цитоплазму. Определяющая роль РНК в синтезе белков была предсказана ещё в 1939 году в работе Торбьёрна Касперссона (Torbjörn Caspersson), Жана Браше (Jean Brachet) и Джека Шульца (Jack Schultz), а в 1971 году Джордж Марбэ (George Marbaix) запустил синтез гемоглобина в ооцитах лягушки, сделав инъекцию впервые выделенной матричной РНК кролика, кодирующей этот белок [1].
В 1956–1957 годах в Советском Союзе А. Н. Белозерский и А. С. Спирин независимо доказали существование мРНК, а также выяснили, что основную массу РНК в клетке составляет отнюдь не матричная, а рибосомальная РНК (рРНК). Рибосомальная РНК — второй «главный» вид клеточной РНК — образует «скелет» и функциональный центр рибосом у всех организмов; именно рРНК (а не белки) регулирует основные этапы белкового синтеза. Одновременно был описан и изучен и третий «главный» вид РНК — транспортные РНК (тРНК), которые в комплексе с двумя другими — мРНК и рРНК — формируют единый белок-синтезирующий комплекс. Согласно достаточно популярной гипотезе «мира РНК», именно эта нуклеиновая кислота лежала у самых истоков жизни на Земле [2].
В связи с тем, что РНК значительно более гидрофильна по сравнению с ДНК (за счет замены дезоксирибозы на рибозу), она более лабильна и может относительно свободно перемещаться в клетке, а значит и доставлять короткоживущие реплики генетической информации (мРНК) к месту, где начинается белковый синтез. Однако стоит отметить и связанное с этим «неудобство» — РНК очень нестабильна. Она намного хуже, чем ДНК, хранится (даже внутри клетки) и деградирует при малейшей перемене условий (температура, рН). Кроме «собственной» нестабильности, большой вклад принадлежит рибонуклеазам (или РНКазам) — классу расщепляющих РНК ферментов, очень стабильных и «вездесущих» — даже кожа рук экспериментатора содержит достаточное количество этих ферментов, чтобы перечеркнуть весь эксперимент. Из-за этого работать с РНК намного сложнее, чем с белками или ДНК — последняя вообще может храниться сотни тысяч лет практически без повреждений [3].
Фантастическая аккуратность при работе, тридисстилят, стерильные перчатки, одноразовая лабораторная посуда — всё это необходимо для предотвращения деградации РНК, однако соблюдение таких стандартов не всегда было возможным. Поэтому долгое время на короткие «обломки» РНК, неизбежно загрязнявшие растворы, попросту не обращали внимания. Однако со временем стало ясно, что, несмотря на все усилия по поддержанию стерильности рабочей области, «обломки» закономерно продолжали обнаруживаться, а потом выяснилось, что в цитоплазме всегда присутствуют тысячи коротких двуцепочечных РНК, выполняющих вполне определённые функции, и абсолютно необходимых для нормального развития клетки и организма.
Принцип РНК-интерференции
Сегодня изучение малых регуляторных РНК является одной из наиболее бурно развивающихся областей молекулярной биологии. Обнаружено, что все короткие РНК выполняют свои функции на основе явления, названного РНК-интерференцией (суть этого феномена заключается в подавлении экспрессии гена на стадии транскрипции или трансляции при активном участии малых молекул РНК). Очень схематично механизм РНК-интерференции показан на врезке «Основы РНК-интерференции».
В 2006 году Эндрю Файер (Andrew Fire) и Крейг Мелло (Craig Mello) получают Нобелевскую премию по физиологии и медицине «За открытие явления РНК-интерференции — механизма сайленсинга генов при участии дцРНК». Хотя сам феномен РНК-интерференции был описан задолго до того (ещё в начале 80-х), именно работы Файера и Мелло в общих чертах определили регуляторный механизм малых РНК [4] и обрисовали неведомую до той поры область молекулярных исследований. Вот основные результаты их работ:
- При РНК-интерференции расщепляется именно мРНК (и никакая другая).
- Двуцепочечная РНК действует (вызывает расщепление) значительно эффективнее одноцепочечной. Эти два наблюдения предсказывали существование специализированной системы, опосредующей действие дцРНК.
- дцРНК, комплементарная участку зрелой мРНК, вызывает расщепление последней. Это указывало на цитоплазматическую локализацию процесса и наличие специфической эндонуклеазы.
- Небольшого количества дцРНК (нескольких молекул на клетку) достаточно для полного «выключения» целевого гена, что указывает на существование каскадного механизма катализа и/или амплификации.
Эти результаты заложили фундамент целому направлению современной молекулярной биологии — РНК-интерференции — и определили вектор работы множества исследовательских групп по всему миру не на один десяток лет. К текущему моменту обнаружено три большие группы малых РНК, которые играют на молекулярном поле за «команду РНК-интерференции». Познакомимся с ними подробнее.
Игрок № 1 — короткие интерферирующие РНК
Специфичность РНК-интерференции определяется короткими интерферирующими РНК (киРНК) — небольшими двуцепочечными молекулами РНК с чётко определённой структурой (см. врезку 2). киРНК эволюционно наиболее ранние, и распространены шире всего у растений, одноклеточных организмов и беспозвоночных [5]. У позвоночных в норме киРНК практически не обнаружены, потому что их вытеснили более поздние «модели» коротких РНК (см. далее).
Функции киРНК в клетках беспозвоночных достаточно разнообразны. Первая и основная — это иммунная защита. «Традиционная» иммунная система (лимфоциты + лейкоциты + макрофаги) присутствует лишь у сложных многоклеточных организмов. У одноклеточных же, беспозвоночных и растений (у которых такой системы либо нет, либо она находится в зачаточном состоянии) иммунная защита строится на основе РНК-интерференции. Иммунитет, основанный на РНК-интерференции, не нуждается в сложных органах «тренировки» предшественников иммунных клеток (селезенка, тимус); в то же время, многообразие теоретически возможных последовательностей коротких РНК (421 вариантов) соотносимо с числом возможных белковых антител высших животных. Кроме того, киРНК синтезируются на основе инфицировавшей клетку «враждебной» РНК, а значит, в отличие от антител, они сразу «затачиваются» под конкретный тип инфекции. И хотя вне клетки защита на основе РНК-интерференции не работает (по крайней мере, таких данных пока нет), внутриклеточный иммунитет она обеспечивает более чем удовлетворительно.
Прежде всего, киРНК создаёт антивирусный иммунитет, уничтожая мРНК или геномную РНК инфекционных организмов (например, так киРНК и были открыты у растений [6]). Введение вирусной РНК вызывает мощную амплификацию специфических киРНК на основе молекулы-затравки — самой вирусной РНК. Кроме того, киРНК подавляют экспрессию различных мобильных генетических элементов (МГЭ), а значит, обеспечивает защиту и от эндогенных «инфекций». Мутации в генах RISC-комплекса часто ведут к повышению нестабильности генома из-за высокой активности МГЭ; киРНК может быть ограничителем экспрессии собственных генов, срабатывая в ответ на их гиперэкспрессию. Регуляция работы генов может происходить не только на уровне трансляции, но и во время транскрипции — через метилирование генов по гистону Н3.
В современной экспериментальной биологии значение РНК-интерференции и коротких РНК трудно переоценить. Разработана технология «выключения» (или нокдауна) отдельных генов in vitro (на культурах клеток) и in vivo (на эмбрионах), что уже стало стандартом de facto при изучении любого гена. Иногда даже, чтобы установить роль отдельных генов в каком-нибудь процессе, проводят систематическое «выключение» всех генов по очереди [7].
Возможностью применения киРНК заинтересовались и фармацевты, поскольку способность направленной регуляции работы отдельных генов сулит неслыханные перспективы в лечении массы заболеваний. Небольшой размер и высокая специфичность действия обещают высокую эффективность и низкую токсичность лекарств на основе киРНК; однако решить проблему доставки киРНК к больным клеткам в организме пока не удалось — виной тому хрупкость и недолговечность этих молекул. И хотя сейчас десятки коллективов пытаются найти способ направлять эти «волшебные пули» точно в цель (внутрь больных органов), видимых успехов они пока не достигли. Кроме этого, есть и другие сложности. Например, в случае антивирусной терапии высокая избирательность действия киРНК может оказать «медвежью услугу» — поскольку вирусы быстро мутируют, изменённый штамм очень быстро потеряет чувствительность к киРНК, подобранной в начале терапии: известно, что замена всего лишь одного нуклеотида в киРНК приводит к существенному снижению эффекта интерференции.
В этом месте стоит напомнить ещё раз — киРНК были обнаружены только у растений, беспозвоночных и одноклеточных; хотя гомологи белков для РНК-интерференции (Dicer, RISC-комплекс) присутствуют и у высших животных, киРНК привычными методами не обнаруживались. Каково же было удивление, когда искусственно введённые синтетические аналоги киРНК вызывали сильный специфический дозозависимый эффект в культурах клеток млекопитающих! Это означало, что в клетках позвоночных РНК-интерференция не заместилась более сложными системами иммунитета, а эволюционировала вместе с организмами, превратившись во что-то более «продвинутое». Следовательно, у млекопитающих надо было искать не точные аналоги киРНК, а их эволюционных преемников.
Игрок № 2 — микроРНК
Действительно, на основе эволюционно достаточно древнего механизма РНК-интерференции у более развитых организмов появились две специализированные системы управления работой генов, использующие каждая свою группу малых РНК — микроРНК (microRNA) и пиРНК (piRNA, Piwi-interacting RNA). Обе системы появились ещё у губок и кишечнополостных и эволюционировали вместе с ними, вытеснив киРНК и механизм «голой» РНК-интерференции. Их роль в обеспечении иммунитета снижается, поскольку эту функцию взяли на себя более совершенные механизмы клеточного иммунитета, — в частности, интерфероновая система. Однако эта система настолько чувствительна, что срабатывает и на саму киРНК: появлении в клетке млекопитающих малых двуцепочечных РНК запускает «сигнал тревоги» (активирует секрецию интерферона и вызывает экспрессию интерферон-зависимых генов, что блокирует все процессы трансляции целиком). В этой связи механизм РНК-интерференции у высших животных опосредован в основном микроРНК и пиРНК — одноцепочечными молекулами со специфической структурой, которая не обнаруживаются интерфероновой системой.
По мере усложнения генома микроРНК и пиРНК принимали всё большее участие в регуляции транскрипции и трансляции. Со временем, они превратились в дополнительную, точную и тонкую систему регуляции генома. В отличие от киРНК, микроРНК и пиРНК (открыты в 2001 году, см. врезку 3) не производятся из чужеродных двуцепочечных молекул РНК, а изначально закодированы в геноме организма-хозяина [8].
Функции микроРНК
Физиологические функции микроРНК крайне разнообразны — фактически, они выступают основными небелковыми регуляторами онтогенеза. микроРНК не отменяют, а дополняют «классическую» схему регуляцию генов (индукторы, супрессоры, компактизация хроматина и т. д.). Кроме того, синтез самих микроРНК сложным образом регулируются (определенные пулы микроРНК могут включаться интерферонами, интерлейкинами, фактором некроза опухолей α (ФНО-α) и многими другими цитокинами). В результате вырисовывается потрясающая по своей сложности и гибкости многоуровневая сеть настройки «оркестра» из тысяч генов, но и этим дело не заканчивается.
микроРНК более «универсальны», чем киРНК: «подопечные» гены не обязательно должны быть на 100% комплементарны — регуляция осуществляется и при частичном взаимодействии. На сегодня одна из самых горячих тем в молекулярной биологии — поиск микроРНК, которые выступают альтернативными регуляторами известных физиологических процессов. Например, уже описаны микроРНК, участвующие в регуляции клеточного цикла и апоптоза у растений, дрозофилы и нематоды; у человека микроРНК регулируют иммунную систему [9] и развитие гематопоэтических стволовых клеток [10]. Применение технологий на основе биочипов (micro-array screening) показало, что на различных этапах жизни клеток включаются и выключаются целые пулы малых РНК. Для биологических процессов идентифицировали десятки специфичных микроРНК, уровень экспрессии которых в определённых условиях изменяется в тысячи раз, подчёркивая исключительную управляемость этих процессов.
До недавнего времени считалось, что микроРНК только подавляют — полностью или частично — работу генов. Однако недавно оказалось: действие микроРНК может кардинально отличаться в зависимости от состояния клетки! В активно делящейся клетке микроРНК, связавшись с комплементарной последовательностью в 3′-участке мРНК, ингибирует синтез белка (трансляцию). Однако в состоянии покоя или стресса (например, при росте на бедной среде) то же самое событие приводит к прямо противоположному эффекту — усилению синтеза целевого белка [11]!
Эволюция микроРНК
Количество разновидностей микроРНК у высших организмов ещё до конца не установлено — по некоторым данным, оно превосходит 1% от числа белок-кодирующих генов (у человека, например, говорят о 700 микроРНК, и это число постоянно растет). микроРНК регулируют активность около 30% всех генов (мишени для многих из них пока не известны), причём существуют как повсеместно распространённые, так и тканеспецифичные молекулы — например, один такой важный пул микроРНК регулирует созревание стволовых клеток крови.
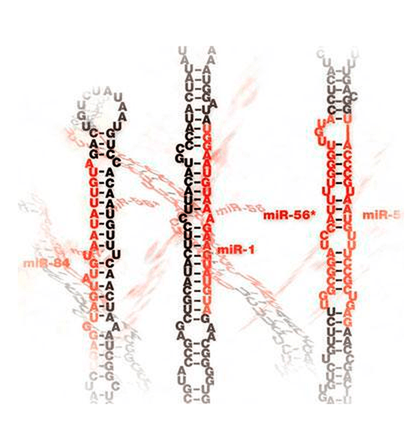
Широкий профиль экспрессии в разных тканях разных организмов и биологическая распространённость микроРНК говорит об эволюционно древнем происхождении. Впервые микроРНК обнаружили у нематод, и долгое время потом считали, что эти молекулы появляются лишь у губок и кишечнополостных; однако позже их открыли и в одноклеточных водорослях [11]. Интересно, что по мере усложнения организмов увеличивается также количество и гетерогенность пула микроРНК. Это косвенно свидетельствует о том, что сложность этих организмов обеспечивается, в частности, функционированием микроРНК [12]. Возможная эволюция микроРНК показана на рисунке 6.

Рисунок 6. Многообразие микроРНК у разных организмов. Чем выше организация организма, тем больше у него обнаруживается микроРНК (число в скобках). Красным выделены виды, у которых обнаружены единичные микроРНК.
Между киРНК и микроРНК можно провести чёткую эволюционную связь, опираясь на следующие факты:
- действие обоих видов взаимозаменяемо и опосредуется гомологичными белками;
- киРНК, введённые в клетки млекопитающих, специфично «выключают» нужные гены (несмотря на некоторую активацию интерфероновой защиты);
- микроРНК обнаруживаются у всё более и более древних организмов.
Эти и другие данные позволяют предположить происхождение обеих систем от общего «предка». Интересно также отметить, что «РНКовый» иммунитет как независимый предшественник белковых антител подтверждает теорию зарождения первых форм жизни на основе РНК, а не белков (напомним, что это любимая теория академика А. С. Спирина [2]).
Чем дальше, тем запутанней. Игрок № 3 — пиРНК
Пока на арене молекулярной биологии было только два «игрока» — киРНК и микроРНК — основное «предназначение» РНК-интерференции казалось совершенно понятным. Действительно: набор гомологичных коротких РНК и белков у разных организмов осуществляет аналогичные действия; по мере усложнения организмов усложняется и функциональность.
Однако в процессе эволюции природа создала ещё одну, эволюционно самую позднюю и узкоспециализированную систему на основе всё того же удачного принципа РНК-интерференции. Речь идет пиРНК (piRNA, от Piwi-interaction RNA).
Чем сложнее организован геном, тем более развит и приспособлен организм (или наоборот? ;-). Однако увеличение сложности генома имеет и оборотную сторону: сложная генетическая система становится нестабильной. Это ведет к необходимости механизмов, отвечающих за поддержание целостности генома — иначе самопроизвольное «перемешивание» ДНК просто выведет её из строя. Мобильные генетические элементы (МГЭ) — один из основных факторов нестабильности генома — представляют собой короткие нестабильные участки, которые могут автономно транскрибироваться и мигрировать по геному. Активация таких мобильных элементов приводит к множественным разрывам ДНК в хромосомах, чреватых летальными последствиями.
Количество МГЭ нелинейно увеличивается с размером генома, и их активность необходимо сдерживать. Для этого животные, уже начиная с кишечнополостных, используют всё тот же феномен РНК-интерференции. Эту функцию также выполняют короткие РНК, однако не те, о которых речь уже шла, а третий их тип — пиРНК.
«Портрет» пиРНК
пиРНК — короткие молекулы длиной в 24–30 нуклеотидов, закодированные в центромерных и теломерных областях хромосомы. Последовательности многих из них комплементарны известным мобильным генетическим элементам, однако есть множество других пиРНК, совпадающих с участками рабочих генов или с фрагментами генома, функции которых неизвестны.
пиРНК (также как и микроРНК) закодированы в обеих цепях геномной ДНК; они весьма изменчивы и разнообразны (до 500 000 (!) видов в одном организме). В отличие от киРНК и микроРНК, они образуются одной цепью с характерной особенностью — урацилом (U) на 5′-конце и метилированным 3′-концом. Есть и другие отличия:
- В отличие от киРНК и микроРНК, они не требуют процессинга Dicer’ом.
- Гены пиРНК активны только в зародышевых клетках (во время эмбриогенеза) и окружающих их эндотелиальных клетках.
- Белковый состав системы пиРНК иной — это эндонуклеазы класса Piwi (Piwi и Aub) и отдельная разновидность Argonaute — Ago3.
Процессинг и активность пиРНК пока достаточно плохо изучены, но уже ясно, что механизм действия совершенно отличается от других коротких РНК — сегодня предложена пинг-понг модель их работы (рис. 7 и 8).
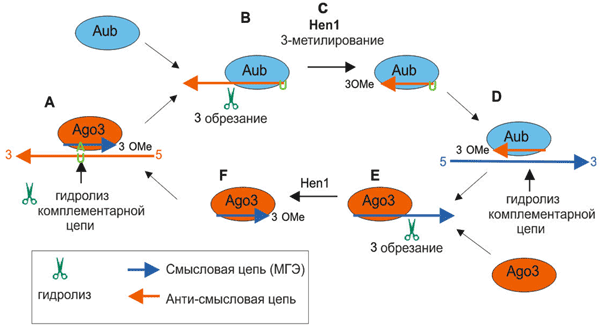
Рисунок 7. Цитоплазматическая часть процессинга пиРНК. Биогенез и активность пиРНК опосредуется семейством эндонуклеаз Piwi (Ago3, Aub, Piwi). Активность пиРНК обеспечивается обеими одноцепочечными молекулами пиРНК — смысловой и анти-смысловой, — каждая из которых ассоциирует со специфической эндонуклеазой Piwi. пиРНК узнает комплементарный участок мРНК транспозона (синяя цепь) и вырезает его. Это не только инактивирует транспозон, но и создает новую пиРНК (связанную с Ago3 с помощью метилирования метилазой Hen1 3′-конца). Такая пиРНК, в свою очередь, узнаёт мРНК с транскриптами кластера предшественников пиРНК (красная цепь) — таким способом цикл замыкается и снова вырабатывается нужная пиРНК.
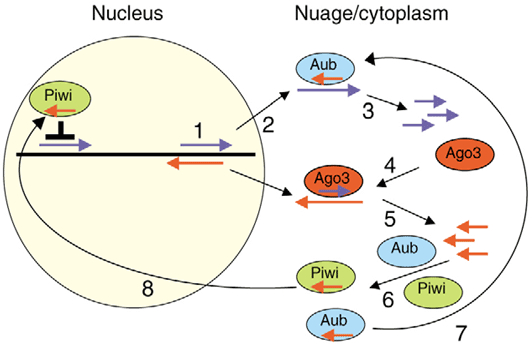
Рисунок 8. пиРНК в ядре. Кроме эндонуклеазы Aub, антисмысловую пиРНК может связывать и эндонуклеаза Piwi. После связывания комплекс мигрирует в ядро, где вызывает деградацию комплементарных транскриптов и перестройку хроматина, вызывающую подавление активности транспозонов.
Функции пиРНК
Главная функция пиРНК — подавление активности МГЭ на уровне транскрипции и трансляции. Считается, что пиРНК активны только во время эмбриогенеза, когда непредсказуемые перетасовки генома особенно опасны и могут привести к гибели зародыша. Это логично — когда иммунная система ещё не заработала, клетки эмбриона нуждаются в какой-нибудь простой, но действенной защите. От внешних патогенов эмбрион надежно защищен плацентой (или оболочкой яйца). Но кроме этого необходима оборона и от эндогенных (внутренних) вирусов, — в первую очередь МГЭ.
Эта роль пиРНК подтверждена опытом — «нокаут» или мутации генов Ago3, Piwi или Aub приводят к серьёзным нарушениям развития (и резкому увеличению числа мутаций в геноме такого организма), а также вызывают бесплодие за счёт нарушения развития половых клеток.
Распространение и эволюция пиРНК
Первые пиРНК обнаруживаются уже у актиний и губок. Растения, видимо, пошли другим путём — белки Piwi у них не обнаружены, а роль «намордника» для транспозонов выполняют эндонуклеаза Ago4 и киРНК.
У высших животных — в том числе и человека — система пиРНК развита очень хорошо, но встретить её можно только в эмбриональных клетках и в околоплодном эндотелии. Почему распространение пиРНК в организме столь ограничено — ещё предстоит узнать. Можно предположить, что, как и любое мощное оружие, пиРНК приносит пользу только в очень специфических условиях (во время развития плода), а во взрослом организме их активность нанесёт больше вреда, чем пользы. Все-таки, число пиРНК на порядок превосходит количество известных белков — и неспецифические эффекты пиРНК в зрелых клетках сложно предсказать.
| киРНК | микроРНК | пиРНК | |
|---|---|---|---|
| Распространение | Растения, Drosophila, C. elegans. Не найдено у позвоночных | Эукариоты | Эмбриональные клетки животных (начиная с кишечнополостных). Нет у простейших и растений |
| Длина | 21–22 нуклеотидов | 19–25 нуклеотидов | 24–30 нуклеотидов |
| Структура | Двуцепочечная, по 19 комплементарных нуклеотидов и два неспаренных нуклеотида на 3′-конце | Одноцепочечная сложная структура | Одноцепочечная сложная структура. U на 5′-конце, 2’-O-метилированный 3′-конец |
| Процессинг | Dicer-зависимый | Dicer-зависимый | Dicer-независимый |
| Эндонуклеазы | Ago2 | Ago1, Ago2 | Ago3, Piwi, Aub |
| Активность | Деградация комплементарных мРНК, ацетилирование геномной ДНК | Деградация или ингибирование трансляции целевой мРНК | Деградация мРНК, кодирующих МГЭ, регуляция транскрипции МГЭ |
| Биологическая роль | Антивирусная иммунная защита, подавление активности собственных генов | Регуляция активности генов | Подавление активности МГЭ во время эмбриогенеза |
Заключение
В заключение хочется привести таблицу, иллюстрирующую эволюцию белкового аппарата, участвующего в РНК-интерференции (рис. 9). Видно, что у простейших наиболее развита система киРНК (белковые семейства Ago, Dicer), а с усложнением организмов акцент переносится на более специализированные системы — увеличивается число изоформ белков для микроРНК (Drosha, Pasha) и пиРНК (Piwi, Hen1). При этом разнообразие ферментов, опосредующих действие киРНК, уменьшается.
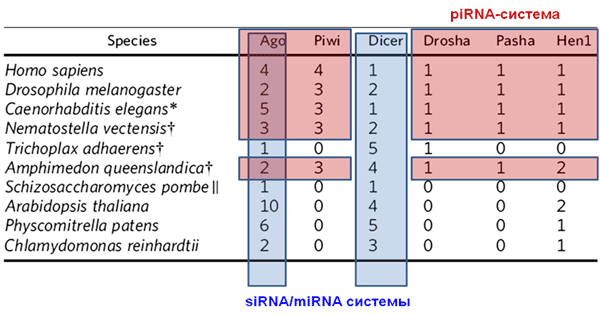
Рисунок 9. Многообразие белков, участвующих в РНК-интерференции (цифры обозначают количество белков каждой группы). Синим цветом подсвечены элементы, характерные для киРНК и микроРНК, а красным — белки, связанные с пиРНК.
Явление РНК-интерференции начали использовать уже простейшие организмы. На основе этого механизма природа создала прототип иммунной системы, а по мере усложнения организмов РНК-интерференция становится незаменимым регулятором активности генома. Два разных механизма плюс три вида коротких РНК (см. таб. 1) — в результате мы видим тысячи тонких регуляторов различных метаболических и генетических путей. Эта поразительная картина иллюстрирует универсальность и эволюционную адаптацию молекулярных биологических систем. Короткие РНК снова доказывают, что «мелочей» внутри клетки нет — есть только мелкие молекулы, всю значимость роли которых мы только начинаем понимать.
(Правда, такая фантастическая сложность говорит скорее о том, что эволюция «слепа» и действует без наперёд утверждённого «генерального плана» [15].)
Литература
- J. B. GURDON, C. D. LANE, H. R. WOODLAND, G. MARBAIX. (1971). Use of Frog Eggs and Oocytes for the Study of Messenger RNA and its Translation in Living Cells. Nature. 233, 177-182;
- Спирин А.С. (2001). Биосинтез белков, мир РНК и происхождение жизни. Вестник РАН. 71, 320–328;
- Элементы: «Полные митохондриальные геномы вымерших животных теперь можно извлекать из волос»;
- Andrew Fire, SiQun Xu, Mary K. Montgomery, Steven A. Kostas, Samuel E. Driver, Craig C. Mello. (1998). Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811;
- МикроРНК впервые обнаружены в одноклеточном организме;
- Simon N. Covey, Nadia S. Al-Kaff, Amagoia Lángara, David S. Turner. (1997). Plants combat infection by gene silencing. Nature. 385, 781-782;
- Молекулярное двурушничество: гены человека работают на вирус гриппа;
- Bing Ren. (2010). Enhancers make non-coding RNA. Nature. 465, 173-174;
- K. D. Taganov, M. P. Boldin, K.-J. Chang, D. Baltimore. (2006). NF- B-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proceedings of the National Academy of Sciences. 103, 12481-12486;
- Ryan M. O'Connell, Dinesh S. Rao, Aadel A. Chaudhuri, Mark P. Boldin, Konstantin D. Taganov, et. al.. (2008). Sustained expression of microRNA-155 in hematopoietic stem cells causes a myeloproliferative disorder. J Exp Med. 205, 585-594;
- МикроРНК — чем дальше в лес, тем больше дров;
- Элементы: «Усложнение организма у древних животных было связано с появлением новых регуляторных молекул»;
- Andrew Grimson, Mansi Srivastava, Bryony Fahey, Ben J. Woodcroft, H. Rosaria Chiang, et. al.. (2008). Early origins and evolution of microRNAs and Piwi-interacting RNAs in animals. Nature. 455, 1193-1197;
- A. A. Aravin, G. J. Hannon, J. Brennecke. (2007). The Piwi-piRNA Pathway Provides an Adaptive Defense in the Transposon Arms Race. Science. 318, 761-764;
- Когда б вы знали, из какого сора….