Молекулярные часы нашего сердца
07 ноября 2014
Молекулярные часы нашего сердца
- 5608
- 3
- 4
В каждой клетке сердца есть встроенные молекулярные часы, и чрезвычайно важно, чтобы ритм работы этих часов был синхронизирован с ритмом главных часов в головном мозге
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Врачи уже давно заметили, что возникновение опасных для жизни обострений сердечно-сосудистых заболеваний, таких как инфаркт миокарда, инсульт, серьезные приступы аритмии, часто связано с определенным временем суток — намного чаще такие осложнения проявляются ранним утром. Заинтересовавшись этой особенностью, доктора провели многочисленные исследования и выяснили, что это явление тесно сопряжено с работой внутренних часов организма, и что при изучении сердечно-сосудистых заболеваний нужно обязательно уделять внимание особенностям регуляции суточных ритмов организма.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Лучший обзор».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Что такое циркадианный ритм
Мы живем в соответствии с ритмами природы: вслед за ночью неизбежно наступает день, тьму обязательно сменяет свет. И, чтобы приспособиться к этому регулярному, заданному внешней средой чередованию условий, наш организм выработал очень сложный и пока еще окончательно не разгаданный механизм внутренних часов — наш «встроенный хронометр», который физиологи называют суточным или циркадианным (циркадным) ритмом. Если дословно переводить с латинского, то «цирка» означает около, а диа — «день». То есть циркадианный ритм — это ритм с периодом около суток. Зачем же понадобилась эта приставка «около»? Дело в том, что время завершения полного цикла нашего «встроенного хронометра» все еще вызывает споры у ученых, так как внутренняя размеренность организма не вписывается точно в те 24 часа, которые составляют наши астрономические сутки.
В 1962 году физиолог-исследователь Ашофф в качестве эксперимента отправил своих сыновей в звуко- и светонепроницаемый бункер, где они жили, ориентируясь только на свои внутренние ритмы, а не на смену светлого дня и темной ночи. Это исследование показало, что внутренние хронометры регулярной изменчивости физиологических функций человека на самом деле настроены на ритм в 25 часов [1]. Но есть и другое мнение. Например, результаты эксперимента под руководством знаменитого спелеолога Мишеля Сифра продемонстрировали, что у участников, заточенных в пещеру на несколько месяцев, наблюдается постепенный переход с 24-часовых ритмов на 48-часовые: 36 часов человеку нужно было для бодрствования и 12 — для сна [2].
Но, так или иначе, не остается сомнений, что в нашем организме работают внутренние биологические часы, и работают они, как выявили генетические исследования последних лет, в каждой клеточке нашего тела. Генетическую природу биологических ритмов начали раскрывать с 1971 года, когда впервые в мире у мухи дрозофилы был найден часовой ген Per — его назвали сокращением от слова «период» (period) [3]. Было замечено, что мутация в этом гене вызывала у мушек отклонения в периодичности суточного ритма. Эти исследования положили начало целому ряду открытий, в результате которых сформировалось современное представление о молекулярном устройстве биологических часов.
Иерархия внутренних биологических часов
Итак, как же устроены наши внутренние часы? Последние исследования указывают на то, что внутренние задатчики ритма в нашем организме организованы по законам иерархии: здесь есть самые главные часы и подчиненные часики. Главным центром циркадианных часов является супрахиазматическое ядро в головном мозге — это плотное скопление из примерно 20 тысяч нейронов, и расположено оно как раз рядом с центром, регулирующем продукцию гормонов в организме. Что касается подчиненных часиков, то, как показал анализ экспрессии генов в клетках внутренних органов, гены, отвечающие за суточные ритмы, экспрессируются в каждой клетке организма, включая даже соединительную ткань. Это навело ученых на мысль, что каждый орган имеет свои внутренние часы. Собственную часовую систему внутренних органов назвали периферическими часами, а управляющее ими супрахиазматическое ядро — центральными часами (рис. 1). Свой собственный хронометр есть у печени, у кровеносных сосудов, у сердца, у почек. Но для эффективной работы организма чрезвычайно важно, чтобы все часовые механизмы были настроены на слаженную работу в одном ритме — синхронизированы.
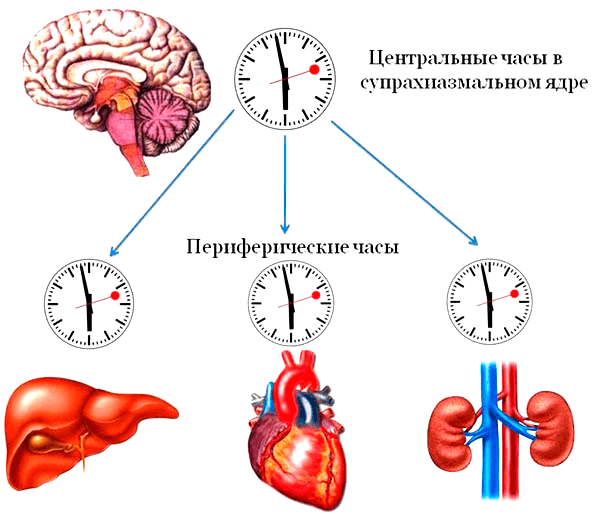
Рисунок 1. Иерархия внутренних биологических часов: главным центром циркадианных часов является супрахиазматическое ядро в головном мозге, задающее ритм работы всем клеткам организма посредством вегетативной нервной системы, специализированных гормонов и различных факторов. Подчиненные часы в клетках внутренних органов называются периферическими.
Фазы внутренних хронометров могут сдвигаться под воздействием определенных стимулов, которые способны навязывать свой ритм. Такие стимулы называются цайтгеберами (от нем. Zeit — «время» и geben — «давать») или задатчиками ритма. Каждые часы способны реагировать на свои специфические задатчики ритма. Например, свет задает ритм центральным часам в супрахиазматическом ядре, тогда как непосредственно на периферические часы он не влияет. Цайтгеберами могут быть не только внешние воздействия, но и особенности поведения: режим физической активности, цикл смены сна и бодрствования и даже режим питания. Например, четко было показано, что внутренние часы печени больше настроены на ритмичность приема пищи, чем на ритмы смены светлого и темного периодов суток [4].
Главный физиологический синхронизатор всех периферических часов — супрахиазматическое ядро. Благодаря своим связям со светочувствительными клетками сетчатки глаза, нейроны супрахиазматического ядра способны получать информацию о световом периоде снаружи и подстроить к внешним условиям внутренние ритмы организма. Синхронизация периферических часовых систем осуществляется посредством вегетативной нервной системы специальными гормонами и, возможно, другими, пока еще мало изученными путями. Ученые с каждым годом открывают и подробно описывают все больше новых факторов, влияющих на регуляцию внутренних ритмов [5].
Потеря синхронизации и прогрессирование болезни
Как показывают эксперименты, синхронизация всех внутренних ритмов — крайне важное условие для сохранения здоровья и продолжительности жизни. Когда ученые изучают взаимосвязь между сбоем биологических часов и сердечными заболеваниями, то у них возникает очевидный вопрос, что же первично: поломки во внутренних часах вызывают болезни сердца, или сама сердечная патология является причиной нарушения работы наших встроенных хронометров? В попытке ответить на этот вопрос выдвинуто как минимум две противоположные гипотезы.
В пользу гипотезы о том, что потеря синхронизации внутренних ритмов в возникновении болезни первична, был проведен целый ряд интереснейших экспериментов. Исследователь Тами Мартино анализировал продолжительность жизни золотистых хомячков с особой мутацией в гене tau, которая уменьшает период суточного ритма в периферических часах до 22 часов (рис. 2). Иными словами, внутренние часы у этой линии щекастых грызунов очень спешат. Оказалось, что и общая продолжительность жизни хомячков с мутацией уменьшается на 20%, а умирают они в раннем возрасте от серьезных заболеваний миокарда — фиброза и кардиомиопатий [6].

Рисунок 2. Золотистый хомячок с мутацией в гене tau: внутренние часы хомячка спешат на два часа в сутки. Отсутствие синхронизации внутреннего и внешнего ритмов привело к тому, что у грызуна возникли серьезные проблемы со здоровьем — гипертрофия миокарда.
Однако, когда таким хомячкам создали искусственные условия так, чтобы период чередования света и темноты составлял 22 часа, то сердечная патология сменилась на нормальное функционирование сердца. Более того, удаление супрахиазматического ядра — главных часов организма — также имело профилактический эффект: гипертрофия миокарда у золотистых хомячков после операции не развивалась. В чем же причина такого чудесного исцеления?
Полученные результаты свидетельствуют о том, что не столько повреждение периферических часов, сколько утрата синхронизации между центральными и периферическими задатчиками ритма приводит к возникновению сердечно-сосудистой патологии. У мутантных хомячков произошла нестыковка 22-часового периода периферических часов и 24-часового периода центральных часов. Когда центральному хронометру через изменения внешних условий (свет/темнота) навязали ритм в 22 часа, то он синхронизировался с периферическими часиками, и сердечная патология не развилась. А когда супрахиазмальное ядро удалили, то периферическим часам снова ничто не мешало свободно реализовывать свой собственный ритм, и сердечко хомяка опять же было спасено.
С другой стороны, и сама болезнь способна нарушить слаженность внутренних биоритмов. Например, во время острого инфаркта миокарда в поврежденных клетках происходит сдвиг фаз циркадианных часов по отношению к здоровым тканям. Эта потеря синхронизации очень опасна и может вызвать угрожающие жизни приступы аритмии.
Восстановление слаженности ритмов клеток сердца с естественными циклами остальных органов и тканей и с циклическими сменами условий окружающей среды может стать многообещающей стратегией в борьбе с сердечно-сосудистыми заболеваниями. Но для реализации этого направления необходимы очень глубокие знания о закономерностях функционирования биоритмов. Интересно, что даже у здоровых людей циркадианный ритм клеток внутренней оболочки вен варьирует в зависимости от их анатомического положения. Необходимы дальнейшие исследования, чтобы как можно точнее идентифицировать все цайтгеберы в организме, и использовать полученные знания для починки наших встроенных хронометров в случае сбоя.
Суточная вариабельность сердечно-сосудистых показателей
Еще один очень важный момент заключается в том, что в течение суток чувствительность сердца к стрессу, эмоциональным и физическим нагрузкам различна. Также меняются во времени и сами показатели сердечно-сосудистой функции: артериальное давление, скорость кровотока, частота сердечных сокращений и другие. Непрерывная запись электрокардиограммы в течение 24 часов у людей в состоянии покоя показывает, что частота сердечных сокращений у человека постоянно варьирует: она достигает минимума на пятом-шестом часу сна и в это время составляет 48–50 ударов в минуту. Максимума она достигает вечером, примерно в 18 часов, а затем снова постепенно начинает снижаться.
Все эти явления возможны благодаря сложным молекулярным механизмам собственных периферических часов в сердечно-сосудистой системе. Около 10% генов, экспрессирующихся в клетках сердца, имеют суточный ритм экспрессии. В настоящее время проводится активный поиск факторов, влияющих на работу сердца и обладающих суточной ритмичностью. Молекулярные часы уже обнаружены в мышечных клетках сердца, в клетках внутренней выстилки сосудов (в эндотелии) и в мышечных клетках сосудов.
Молекулярные часы в мышечных клетках сердца
Недавно ученые опубликовали в журнале Nature сообщение о том, что белок Klf 15 (kruppel-like factor), контролирующий в организме процессы формирования тканей, обмена жиров и воспаления, способен влиять и на суточные ритмы сердца. Концентрация этого белка варьирует в зависимости от стадии цикла «сон—бодрствование». Исследователями были выведены линии мышей с двумя вариантами мутаций в гене, кодирующем Klf 15, которые приводили к тому, что уровень фактора в плазме крови был либо чрезмерно повышен, либо белок отсутствовал вовсе. И в том, и в другом случае мышки страдали от угрожающих жизни сердечных аритмий [7].
При более глубоком изучении оказалось, что Klf 15 — это только первая ступень в сложном молекулярном каскаде, потому что он контролирует другой белок — KСhIP 2 (Kv channel-interacting protein) — фактор, взаимодействующий с калиевыми каналами в мышечных клетках сердца. Изменения концентрации KChIP 2 приводят к электрической нестабильности тканей сердца и, как следствие, к нарушениям сердечного ритма; при этом ген этого фактора имеет суточный ритм экспрессии.
Суточный ритм экспрессии имеют и сами гены калиевых каналов мышечных клеток сердца Kv1.5 и Kv4.2. Интересно, что экспрессия Kv1.5 увеличивается в темное время суток, тогда как матричную РНК белка Kv4.2 в большей концентрации обнаруживают в светлый период. Нарушения ритма в любом звене этой сложной системы могут быть связаны с суточным временем возникновения приступов аритмии.
Синхронизация молекулярных часов мышечных клеток сердца с обменом липидов
Мы уже говорили о том, как важна синхронизация ритмов сердца с циклами других физиологических систем организма. Не менее важно отметить, что некоторые внутренние циклы способны навязывать свой ритм сердечным часам. Одним из таких циклов-задатчиков является суточный ритм циркуляции жирных кислот и уровня липидов, жестко связанный с циркадианным. Жирные кислоты — преимущественное «сердечное топливо»: они на 70% утилизируются сердцем. При избытке жирных кислот сократительная функция сердца подавляется, и сердце отвечает на эти изменения внутренней среды активацией как оксидативного (митохондриального), так и неоксидативного метаболизма. Таким образом сердце уменьшает клеточную токсичность, вызванную нагрузкой жирными кислотами. И этот процесс также связан с суточными ритмами экспрессии генов.
Американская исследовательница Молли Брэй исследовала гены циркадианных часов с помощью метода микрочипов ДНК. Ей удалось выявить 548 генов, регулирующих часы в кардиомиоцитах предсердия, и 176 генов, связанных с циркадианным ритмом мышечных клеток желудочка сердца. Среди них были гены, вовлеченные в липогенез, и белки, связывающие липиды; все они демонстрировали суточную экспрессию [8].
Периферические часы в клетках эндотелия
Несколько групп ученых продемонстрировали роль часовых генов в функции эндотелия — ткани, выстилающей внутреннюю поверхность кровеносных сосудов и сердца. Они выяснили, что у мышей с мутацией в часовом гене Per 2 не расслабляются сосуды в ответ на воздействие главного релаксирующего нейромедитора — ацетилхолина. Кроме этого очень неприятного нарушения функции, в крови мышек выявляется очень высокая концентрация веществ, стимулирующих сжатие сосудов, что чревато возникновением артериальной гипертонии [9].
Но на этом проблемы со здоровьем у несчастных мышек не заканчивались. Исследователь Чао Ванг показал, что если в клетках эндотелия есть мутация гена Per 2, то кровеносные сосуды быстро стареют, плохо восстанавливаются после повреждений, а у самих грызунов сильно уменьшается продолжительность жизни [10].
Периферические часы в мышечных клетках сосудов
Клетки гладкой мускулатуры кровеносных сосудов — миоциты — также имеют собственные периферические часы. Такишиге Куньеда исследовал циркадианную систему в миоцитах стареющих сосудов. Он обнаружил, что в этих клетках потеря циркадной ритмичности связана с укорочением теломер. Введение теломераз предотвращало проблемы с экспрессией часовых генов. Эти исследования показывают, что регуляция теломеразами может стать одним из способов терапии нарушений циркадных ритмов, связанных с возрастом [11].
Заключение
Таким образом, изучение биоритмов, особенно с позиции их синхронизации с циклами внутренней и внешней среды, поможет пролить свет не только на причины сердечно-сосудистой патологии, но и на причины старения и низкой продолжительности жизни.
Жизнь современного человека наполнена событиями, которые не подчиняются естественным циклам природы: мы можем работать в ночную смену или регулярно не спать по ночам, засиживаясь за телевизором, компьютером или чтением книг, у нас есть возможность за один день пересечь сразу несколько часовых поясов. Только все ли из нас задумывались, какие серьезные физиологические перестройки происходят в это время в нашем организме? В статье мы рассмотрели несколько примеров работы внутренних молекулярных часов, связанных с функционированием сердца, и увидели, что внутренние и внешние ритмы взаимосвязаны очень тесно, и нарушение временнóй слаженности в одной системе может повлечь за собой сбои в другой. Исследования в этой области продолжаются и, возможно, когда-нибудь ученые откроют волшебное средство, приняв которое, мы мгновенно синхронизируем работу всех внутренних органов, замедлим старение и будем чувствовать себя бодрыми и веселыми независимо от времени суток. Но пока это средство остается в мечтах, мы должны понимать, что сами можем организовать свою жизнь так, чтобы в наших молекулярных часах было как можно меньше сбоев. Соблюдение регулярности в режимах приема пищи, сна и бодрствования, физической активности, полноценный ночной сон, осторожное отношение к перелетам с пересечением часовых поясов — все это может стать той самой волшебной пилюлей, которая починит молекулярные часы в нашем сердце.
Литература
- J. Aschoff. (1965). Circadian Rhythms in Man: A self-sustained oscillator with an inherent frequency underlies human 24-hour periodicity. Science. 148, 1427-1432;
- Сифр М. «В безднах земли». М.: «Прогресс», 1982;
- R. J. Konopka, S. Benzer. (1971). Clock Mutants of Drosophila melanogaster. Proceedings of the National Academy of Sciences. 68, 2112-2116;
- Найдена связь между обменом веществ и циркадным ритмом;
- Прообраз биологических часов;
- Tami A. Martino, Gavin Y. Oudit, Andrew M. Herzenberg, Nazneen Tata, Margaret M. Koletar, et. al.. (2008). Circadian rhythm disorganization produces profound cardiovascular and renal disease in hamsters. American Journal of Physiology-Regulatory, Integrative and Comparative Physiology. 294, R1675-R1683;
- Darwin Jeyaraj, Saptarsi M. Haldar, Xiaoping Wan, Mark D. McCauley, Jürgen A. Ripperger, et. al.. (2012). Circadian rhythms govern cardiac repolarization and arrhythmogenesis. Nature. 483, 96-99;
- Molly S. Bray, Chad A. Shaw, Michael W. S. Moore, Rodrigo A. P. Garcia, Melissa M. Zanquetta, et. al.. (2008). Disruption of the circadian clock within the cardiomyocyte influences myocardial contractile function, metabolism, and gene expression. American Journal of Physiology-Heart and Circulatory Physiology. 294, H1036-H1047;
- Hema Viswambharan, João M. Carvas, Vladan Antic, Ana Marecic, Corinne Jud, et. al.. (2007). Mutation of the Circadian Clock Gene Per2 Alters Vascular Endothelial Function. Circulation. 115, 2188-2195;
- Chao-Yung Wang, Ming-Shien Wen, Hong-Wei Wang, I-Chang Hsieh, Yuxin Li, et. al.. (2008). Increased Vascular Senescence and Impaired Endothelial Progenitor Cell Function Mediated by Mutation of Circadian Gene Per2. Circulation. 118, 2166-2173;
- Takeshige Kunieda, Tohru Minamino, Taro Katsuno, Kaoru Tateno, Jun-ichiro Nishi, et. al.. (2006). Cellular Senescence Impairs Circadian Expression of Clock Genes In Vitro and In Vivo. Circulation Research. 98, 532-539;
- Norihiko Takeda, Koji Maemura. (2010). Cardiovascular disease, chronopharmacotherapy, and the molecular clock☆. Advanced Drug Delivery Reviews. 62, 956-966.