
Найдена связь между обменом веществ и циркадным ритмом
22 ноября 2009
Найдена связь между обменом веществ и циркадным ритмом
- 10440
- 4
- 6
Периодичность приема пищи тесно связана с циклом сна и бодрствования
-
Автор
-
Редакторы
Темы
Циркадные ритмы — это суточные колебания различных физиологических и биохимических параметров организма, характерные для большинства живых существ, включая и человека. Практически в каждом органе нашего тела есть клетки, обладающие индивидуальным «молекулярным часовым механизмом». Молекулярные часы клеток печени регулируют выработку различных ферментов, необходимых для усвоения питательных веществ. Первостепенную роль в настройке этих часов играет режим питания. Недавнее исследование ученых из Института Солка позволяет предположить, что эта настройка, по крайней мере, частично происходит с помощью аденозинмонофосфат-активируемой протеинкиназы (AMPK), реагирующей на снижение уровня аденозинтрифосфата — главного энергоносителя клетки.
Размышляли ли вы когда-нибудь о том, почему мы обычно спим ночью, а работаем днем? Почему днем уже через 3–4 часа после последнего приема пищи нас снова начинает одолевать голод, а ночью можно спать 8–10 часов подряд, не просыпаясь, чтобы подкрепиться? Почему после быстрого пересечения нескольких часовых поясов на самолете мы нередко страдаем бессонницей и нарушением пищеварения? На сегодняшний день известно, что ответ на все эти «почему» кроется в циркадных ритмах — суточных колебаниях активности органов нашего тела.
В конце прошлого века ученые выяснили, что в мозгу млекопитающих есть биологический «часовой механизм», координирующий работу всего организма. Если точнее, часы эти находятся в супрахиазматическом ядре (СХЯ) гипоталамуса. СХЯ получает информацию об освещенности от специальных рецепторов, расположенных на сетчатке глаза, и посылает соответствующие сигналы другим органам с помощью гормонов и нервных импульсов. Дальше — еще интереснее: оказывается, что некоторые клетки СХЯ, а также клетки многих других органов обладают индивидуальными молекулярными часами. «Шестеренками» в этих часах служат транскрипционные факторы, активность которых меняется с течением дня (рис. 1). От активности этих ключевых транскрипционных факторов зависит синтез целого ряда различных белков, что и порождает циркадные ритмы жизнедеятельности отдельных клеток и целых органов. Яркий свет, включенный ранней ночью, способен сдвинуть циркадный ритм, активируя транкрипцию генов PER, которая обычно происходит утром.
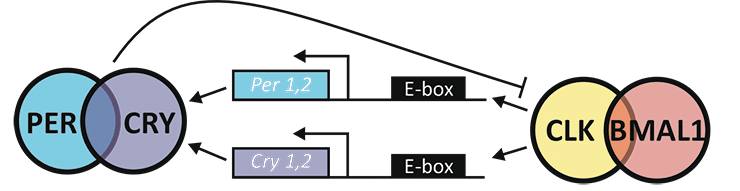
Рисунок 1. Молекулярные часы млекопитающих. В основе часового механизма лежат два белкa: CLOCK (CLK) и BMAL1. Димеризуясь, CLOCK и BMAL1 активизируют транскрипцию генов Period (PER) и Chryptochrome (CRY). У ночных грызунов, как и у некоторых дневных животных, транскрипция генов PER1 и PER2 в СХЯ достигает своего пика утром или днем, а CRY1 и CRY2 — ближе к вечеру. Увеличение концентрации белков PER и CRY в клетке запускает механизм обратной связи, что блокирует дальнейший синтез этих белков. Согласно последним исследованиям, главным ингибитором комплекса CLOCK–BMAL1 является CRY, но действует он, только объединившись с PER. В течение ночи клеточные ферменты постепенно разлагают PER и CRY, и когда их концентрация достигает критически низкой отметки, транскрипция вновь активизируется. Продолжительность цикла зависит от скорости деградации PER и CRY.
Поговорим теперь об обмене веществ и таком органе, как печень. Печень играет очень важную роль в поддержании в крови уровня глюкозы, являющейся важнейшим источником энергии для клеток организма. Печень также участвует в обмене жиров и белков и в переработке токсичных веществ. Известно, что синтез многих ферментов, катализирующих реакции обмена жиров и углеводов, подвержен суточным колебаниям [1]. Считается, что эти колебания необходимы для того, чтобы разделить во времени несовместимые реакции катаболизма (процессы распада биомолекул) и анаболизма (процессы синтеза) [2]. В 1990-х годах господствовало представление о том, что циркадные ритмы всех периферийных органов подчинены СХЯ. Теперь же ученые пришли к выводу, что печень обладает значительной автономией, и на ее цикл в значительной мере влияет периодичность питания (по крайней мере, у лабораторных крыс и мышей). Мыши и крысы — ночные животные, и основной прием пищи у них приходится на темное время суток. Однако если пища доступна только днем, то циркадный цикл печени сдвигается на 12 часов [3]. Тем не менее, пока не ясно, как именно происходит перенастройка молекулярных часов печени.
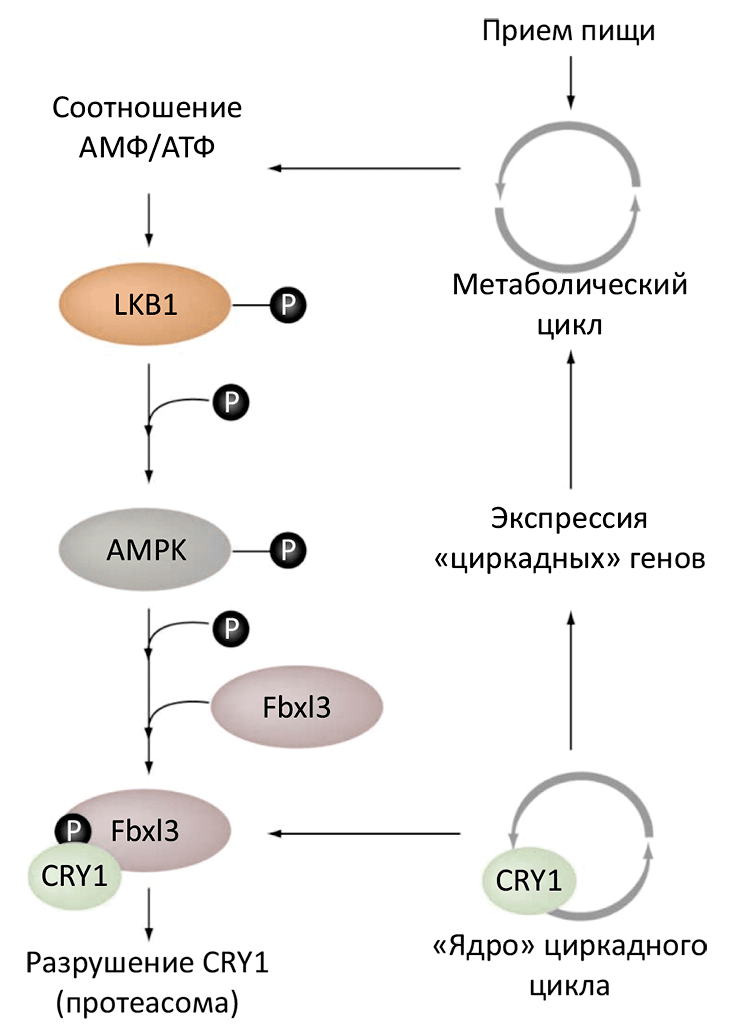
Рисунок 2. Взаимодействие метаболического и циркадного циклов. Энергозатратные процессы биосинтеза (анаболизм) понижают уровень аденозинтрифосфата (АТФ) с одновременным повышением уровня АМФ в клетке. Увеличение соотношения АМФ к АТФ активирует AMPK. Активированная AMPK, в свою очередь, фосфорилирует CRY1, ускоряя его разложение и тем самым приближая реактивацию комплекса CLOCK / BMAL1 и новый этап транскрипции [3]. В печени мышей и крыс реактивация транскрипции обычно происходит во второй половине дня — то есть, в конце периода отдыха, когда запасы питательных веществ, накопленные ранним утром, начинают подходить к концу.
Рональду Эвансу (Ronald M. Evans) и его коллегам из американского Института Биологических Исследований им. Солка удалось продемонстрировать, что фермент, реагирующий на наличие питательных веществ — аденозинмонофосфат (АМФ)-активируемая протеинкиназа (AMPK) — фосфорилирует белок CRY1, тем самым способствуя его разложению (рис. 2) [4]. Ученые идентифицировали в составе CRY1 две аминокислоты, фосфорилирование которых существенно снижает стабильность белка в культуре клеток, — это остатки серина 71 (S71) и 280 (S280). Эксперименты с мутантными клетками, у которых отсутствует активная форма AMPK, доказали, что именно эта киназа фосфорилирует S71.
Фосфорилирование S71 усиливает убиквитилирование (специальное мечение белков, подлежащих уничтожению, — см. «Вездесущий убиквитин» [5]) CRY1 и одновременно разрушает комплекс CRY1–PER2. Еще до этого ученым было известно, что убиквитилирование и деградация CRY1 и CRY2 в значительной степени определяет длину циркадного цикла [6]. Эксперименты с генетически измененными мышами подтвердили зависимость между активностью AMPK и циркадным циклом в печени. Эти результаты находятся в соответствии с моделью, изображенной на рис. 2. Однако есть основания предполагать, что AMPK является не единственным механизмом связи между метаболизмом и циркадным ритмом. В частности, NADP / NADPH и ядерные рецепторы также могут играть немаловажную роль [1], [2].
В самом начале этой статьи уже упоминалось о том, что люди, в короткое время пересекающие несколько часовых поясов, а в особенности те, кто вынуждены делать это регулярно, часто страдают нарушением сна и проблемами с пищеварением — так называемым «джетлагом». Причиной джетлага является сбой циркадных ритмов организма. У мышей СХЯ может настроиться на новый режим на следующий же день после смены часового пояса, однако для перенастройки других органов, в особенности печени, требуется около недели. Таким образом происходит временная десинхронизация ритмов отдельных органов, что не может не сказаться на их работе. Частые сбои циркадных ритмов органов пищеварения в конечном счете нередко приводят к нарушению обмена веществ и ожирению. Будем надеяться, что дальнейшее изучение циркадных ритмов поможет найти средство, способное облегчить адаптацию организма к смене часовых поясов.
Ввиду технических проблем, на сегодняшний день молекулярный механизм циркадных ритмов различных органов достаточно детально изучен только у лабораторных крыс и мышей, о которых не раз упоминалось в этой статье. Однако достоверно известно, что устройство молекулярных часов человеческих клеток и клеток грызунов очень схоже, по крайней мере, в случае клеток кожи [7]. Интересно также, что мутация человеческого гена PER2 вызывает очень редкий синдром ранней фазы сна, при котором люди ежедневно просыпаются ранним утром, примерно в 3–5 часов. Чтобы восстановить свои силы в полной мере, такие люди вынуждены ложиться спать тоже очень рано. Все эти факты заставляют предположить, что достаточно сильное сходство между людьми и лабораторными грызунами есть и в регуляции циркадных ритмов печени.
При написании этой статьи использовались материалы Медицинского Института им. Говарда Хьюза.
Литература
- Carla B. Green, Joseph S. Takahashi, Joseph Bass. (2008). The Meter of Metabolism. Cell. 134, 728-742;
- D. M. Suter, U. Schibler. (2009). Feeding the Clock. Science. 326, 378-379;
- K.-A. Stokkan. (2001). Entrainment of the Circadian Clock in the Liver by Feeding. Science. 291, 490-493;
- K. A. Lamia, U. M. Sachdeva, L. DiTacchio, E. C. Williams, J. G. Alvarez, et. al.. (2009). AMPK Regulates the Circadian Clock by Cryptochrome Phosphorylation and Degradation. Science. 326, 437-440;
- Вездесущий убиквитин;
- L. Busino, F. Bassermann, A. Maiolica, C. Lee, P. M. Nolan, et. al.. (2007). SCFFbxl3 Controls the Oscillation of the Circadian Clock by Directing the Degradation of Cryptochrome Proteins. Science. 316, 900-904;
- Georg A. Bjarnason, Richard C.K. Jordan, Patricia A. Wood, Qi Li, David W. Lincoln, et. al.. (2001). Circadian Expression of Clock Genes in Human Oral Mucosa and Skin. The American Journal of Pathology. 158, 1793-1801.






