
Молекулярные часы работают не так, как мы думали
23 февраля 2015
Молекулярные часы работают не так, как мы думали
- 548
- 0
- 2
Шестеренки-то знают свое дело — вращаются, а вот мы все не поймем, как...
Рисунок в полном размере.
-
Автор
-
Редактор
Темы
Ранее считалось, что молекулярные таймеры живых организмов работают по такой схеме: активируется ген часов, в результате его работы образуется белок-регулятор, который подавляет работу гена. Ген остается неактивным, пока не деградирует белок-регулятор. Благодаря такой петле обратной связи активность гена часов, а также концентрация белка-регулятора меняются циклически, что дает организму нечто вроде метронома — «внутренних часов». Однако в недавно опубликованной в журнале Science работе было показано, что деградация белка-регулятора не является необходимой для того, чтобы поддерживать циклическую активность гена часов. По мнению исследователей, ключевую роль играют модификации этого белка, которые «отключают» его и без физического разрушения молекулы.
Каждые сутки наша планета совершает оборот вокруг своей оси, благодаря чему условия жизни каждого существа на Земле регулярно меняются. Чтобы приспособиться к таким изменениям и быть готовыми к каждому наступлению темноты или похолоданию, организмы ориентируются на внутренние часы. В соответствии с ходом таких часов регулируются процессы обмена [1], а также циклы сна/бодрствования .
О суточных циклах написано немало: например, в виде эволюционного экскурса «Прообраз биологических часов» [2], оригинально «Пусть ворона сохнет, или Как устроены суточные циклы» [3] и понятно даже детям «“Проснись!” — “Усни...” — “Проснись!” — “Усни...” — “Проснись!”» [4] — Ред.
Физически «внутренние часы» представляют собой систему генов, которые активируются и дезактивируются по системе отрицательной обратной связи. В простейшем случае ген часов активируется, в результате чего синтезируется белок, который подавляет работу гена. Ген снова начинает работать только после того, как деградирует этот белок. В результате активность генов часов, а также концентрации белков, участвующих в регуляции работы этих генов, изменяются регулярным образом. А уже имея такой «метроном», организм может отсчитывать промежутки времени, соответствующие циклам смены условий внешней среды.
Однако американские ученые обнаружили, что привычная схема устройства часов нуждается в пересмотре [5]. Объектом их исследования стал гриб Neurospora crassa. Белок-регулятор часов у этого гриба называется FREQUENCY (или FRQ). Было известно, что у мутантов, у которых время жизни этого белка увеличено, длина периода цикла также увеличена. Кроме того, если «сломать» систему уничтожения этого белка, в результате чего он будет накапливаться в клетках, суточные циклы у гриба пропадают. Странно, но в последнем случае, несмотря на то, что суточные циклы у гриба очевидным образом не проявлялись, активность гена frq все-таки продолжала циклически изменяться. Получается, что деградация белка FRQ не была необходима для поддержания циклической активности гена (хотя, видимо, была нужна для того, чтобы организм изменял свою активность в соответствии с ходом часов).
Ученые выдвинули предположение, что на самом деле для поддержания циклической активности генов часов нужна не деградация белка-регулятора, а просто его «выведение из строя», которое происходит под действием модификаций. Белок FRQ фосфорилируется по более чем сотне сайтов, и когда он приобретает определенное количество этих модификаций, они изменяют его структуру. В результате такого изменения структуры белок теряет способность репрессировать работу гена часов, который снова начинает активно работать. Эксперименты со штаммами грибка, у которых не было фермента, ответственного за деградацию FRQ, подтвердили: после того, как белок-регулятор получил достаточное количество модификаций, уже не важно, будет ли он уничтожен или продолжит находиться в клетке — его деградация не требуется, чтобы ген часов продолжал циклически работать. А вот если заблокировать работу ферментов, которые фосфорилируют белок-регулятор, циклические изменения активности гена часов пропадут.
Таким образом, схема работы молекулярных часов на данный момент представляется такой: ген часов работает, в результате чего синтезируется белок, отключающий ген. Белок плавает в цитоплазме, накапливая модификации (фосфорилирование). Модификации, по-видимому, отличаются функционально — более ранние модификации нужны, чтобы сделать возможными более поздние. Когда молекула белка-регулятора соберет необходимый набор модификаций, она перестанет репрессировать ген часов, который снова включится в работу (рис. 1). То есть белку-регулятору совсем не нужно деградировать, чтобы «позволить» гену активироваться.
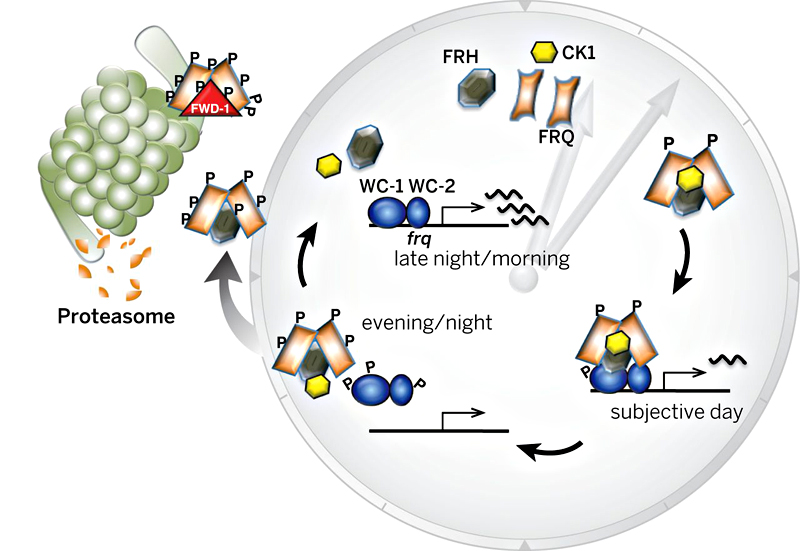
Рисунок 1. Новая модель регуляции циркадных часов. Деградация белка-регулятора (осуществляемая протеасомой, изображенной слева) не важна для поддержания циклов активации-дезактивации генов часов. Главную роль в «отключении» белка-регулятора играют его модификации (фосфорилирование обозначено буквой Р), набрав определенное количество которых, белок перестает работать. Уничтожится ли он после этого или нет — не так важно.
Предложив новую модель, ученые нашли и в других опубликованных ранее работах подтверждения своих выводов. К примеру, у мутантов мушек Drosophila, у которых белок-регулятор медленно деградировал, даже получив множественные модификации, суточные циклы все равно продолжались, хотя и были замедленными [6] . Активность гена часов у них возобновлялась даже в присутствии неактивных «старых» молекул белка-регулятора — то есть, опять же, его деградация была не нужна, чтобы циклы продолжались. Кроме того, известно еще несколько примеров, когда блокирование путей уничтожения белка-регулятора лишь незначительно влияло на ход молекулярных часов [7–9]. Таким образом, есть основания думать, что новая модель устройства молекулярных часов будет применима к самым разным организмам .
Сон, в том числе у мушек, управляется не только циркадным, но и гомеостатическим механизмом, отвечающим за желание поспать: «Бессонные ночи дрозофилы» [10] — Ред.
О рассинхронизации «внутренних часов» в разных тканях, при патологических процессах и старении даже у одного организма можно прочитать в статьях «Эпигенетические часы: сколько лет вашему метилому?» [11] и «Молекулярные часы нашего сердца» [12] — Ред.
Литература
- Найдена связь между обменом веществ и циркадным ритмом;
- Прообраз биологических часов;
- «Элементы»: «Пусть ворона сохнет, или Как устроены суточные циклы»;
- «Проснись!» — «Усни...» — «Проснись!» — «Усни...» — «Проснись!»;
- Luis F. Larrondo, Consuelo Olivares-Yañez, Christopher L. Baker, Jennifer J. Loros, Jay C. Dunlap. (2015). Decoupling circadian clock protein turnover from circadian period determination. Science. 347;
- Silke Reischl, Katja Vanselow, Pål O. Westermark, Nadine Thierfelder, Bert Maier, et. al.. (2007). β-TrCP1-Mediated Degradation of PERIOD2 Is Essential for Circadian Dynamics. J Biol Rhythms. 22, 375-386;
- Silke Reischl, Katja Vanselow, Pål O. Westermark, Nadine Thierfelder, Bert Maier, et. al.. (2007). β-TrCP1-Mediated Degradation of PERIOD2 Is Essential for Circadian Dynamics. J Biol Rhythms. 22, 375-386;
- Arisa Hirano, Kanae Yumimoto, Ryosuke Tsunematsu, Masaki Matsumoto, Masaaki Oyama, et. al.. (2013). FBXL21 Regulates Oscillation of the Circadian Clock through Ubiquitination and Stabilization of Cryptochromes. Cell. 152, 1106-1118;
- Kanae Ohsaki, Katsutaka Oishi, Yuko Kozono, Keiko Nakayama, Keiichi I. Nakayama, Norio Ishida. (2008). The Role of β-TrCP1 and β-TrCP2 in Circadian Rhythm Generation by Mediating Degradation of Clock Protein PER2. The Journal of Biochemistry. 144, 609-618;
- Бессонные ночи дрозофилы;
- Эпигенетические часы: сколько лет вашему метилому?;
- Молекулярные часы нашего сердца.






