
На пути к генотерапии гипертонической болезни
19 октября 2018
На пути к генотерапии гипертонической болезни
- 1505
- 0
- 4
Гипертония — это болезнь, при которой артериальное давление составляет 140/90 мм рт.ст. и выше. Гипертония убивает 465 000 россиян в год.
-
Авторы
-
Редакторы
Темы
Статья на конкурс «био/мол/текст»: Ученые Новосибирского государственного университета с коллегами из Института цитологии и генетики СО РАН, Института катализа СО РАН и Института химической биологии и фундаментальной медицины СО РАН предложили новый подход к лечению артериальной гипертонии с помощью генотерапии.
Конкурс «био/мол/текст»-2018
Эта работа опубликована в номинации «Своя работа» конкурса «био/мол/текст»-2018.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Болезни сердечно-сосудистой системы по-прежнему остаются ведущей причиной смертности в мире. Гипертоническая болезнь играет центральную роль в развитии таких грозных осложнений, как инфаркт миокарда и мозговой инсульт (рис. 1)
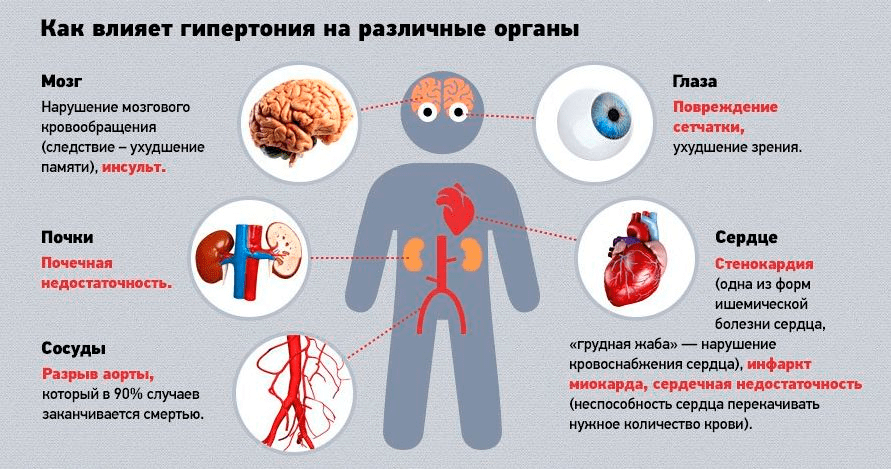
Рисунок 1. Чем опасна гипертония
Несмотря на значительные достижения медицины в создании эффективных препаратов против гипертонии, осуществить необходимый контроль уровня артериального давления удается лишь у каждого третьего больного. Создается впечатление, что эффективность фармакологического лечения гипертонической болезни достигла своего потолка, и дальнейший прогресс зависит от развития принципиально новых подходов к ее терапии.
Лечить болезнь лучше всего, воздействуя на ее первопричину. А причиной часто бывают «неправильные» гены. Знание нуклеотидной последовательности геномов открыло реальную возможность создания селективных лекарственных средств, которые могут специфически воздействовать на экспрессию генов, участвующих в формировании определенной патологии.
Одно из направлений лечения болезней, ассоциированных с нежелательными генами, — генная терапия, о которой «Биомолекула» писала не раз [1], [2].
Генотерапия в широком смысле — это введение в организм специально сконструированных терапевтических нуклеиновых кислот (ТНК), которые могут целенаправленно воздействовать на узловые звенья патогенеза болезни. Механизм действия ТНК на генетический материал в корне отличается от действия фармацевтических лекарственных препаратов, применяемых в настоящее время в медицинской практике.
Что такое терапевтические нуклеиновые кислоты (ТНК)
ТНК — фрагменты нуклеиновых кислот (ДНК или РНК) или их аналогов. Обычно это довольно короткие олигонуклеотиды (от греч. ολιγος — малый, немногий), состоящие из 15–30 мономерных звеньев — нуклеотидов. Идею использовать олигонуклеотиды для адресного воздействия на генетический материал клетки предложили около 50 лет назад российские авторы [3]. Перспективность этого подхода впервые подтвердили американские ученые, которые показали, что синтетические олигонуклеотиды могут подавлять репликацию вируса саркомы Рауса [4]. Сейчас подобные исследования проводятся во всех развитых странах с целью поиска новых подходов к лечению различных заболеваний.
Действие ТНК основано на комплементарном взаимодействии с выбранным участком специфической матричной РНК-мишени, которая ответственна за экспрессию соответствующего гена [5]. ТНК узнает мишень, связывается с ней (рис. 2) и блокирует ее функцию, то есть, в конечном итоге, блокирует действие гена и синтез соответствующего белка.
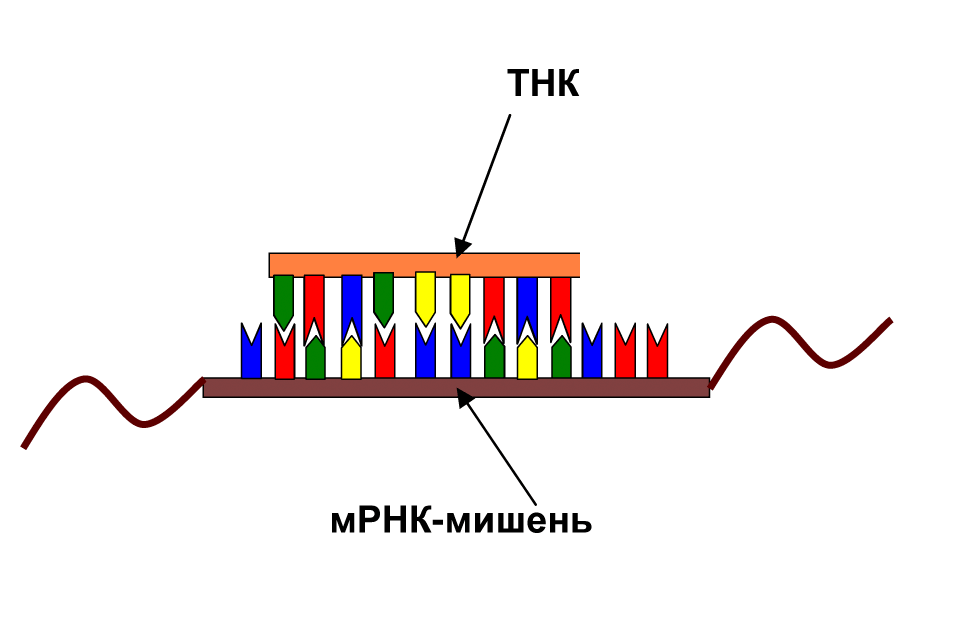
Рисунок 2. Связывание ТНК с матричной РНК-мишенью. Нуклеотидные звенья (A, T, C, G) в ТНК спариваются с комплементарными нуклеотидами мишени в соответствии с уотсон—криковскими взаимодействиями, образуя пары A—U, A—T и C—G.
рисунок авторов статьи
Важное преимущество ТНК перед доступными в настоящее время низкомолекулярными лекарственными препаратами состоит в том, что ТНК действуют строго адресно и таким образом снижают вероятность вредных побочных эффектов. Кроме того, ТНК легко можно направить на другую НК-мишень (например, для лечения другой болезни или для более эффективного лечения той же самой болезни), просто изменив последовательность нуклеотидов. При этом следует отметить, что на поиск новых низкомолекулярных лекарств уходят годы. Препараты на основе нуклеиновых кислот и их аналогов могут использоваться в будущем для индивидуализированной медицины.
Проблема доставки ТНК в клетки
Одна из наиболее значимых, но пока до конца не решенных проблем в области генотерапии — преодоление низкой способности ТНК проникать в клетки из-за одноименных (отрицательных) зарядов на клеточной мембране и ТНК. Это препятствует широкому применению описанного подхода в медицинской практике. Несмотря на многолетние поиски систем доставки фрагментов НК в клетки [6], [7], проблему нельзя считать окончательно решенной.
Идеальные носители для транспорта ТНК в клетки должны удовлетворять следующим критериям: они должны легко проникать через клеточную мембрану, должны быть биосовместимы и нетоксичны, их легко можно синтезировать и присоединять к ним фрагменты нуклеиновых кислот. Использование неорганических наночастиц открывает впечатляющие перспективы для решения этих проблем [8], [9].
Для транспорта олигонуклеотидов в клетки авторы предложили использовать наночастицы диоксида титана, так как известно, что они могут проникать через клеточную мембрану [10], [11]. Нанокомпозиты на основе TiO2-наночастиц готовят следующим образом.

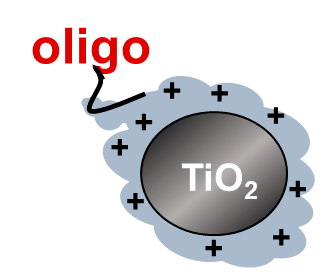
Рисунок 3. Схематическое изображение нанокомпозита TiO2~oligo
Сначала к олигонуклеотиду (oligo) присоединяют молекулу полилизина (PL). Это, полимер, состоящий из 30–100 звеньев аминокислоты лизина. Образующееся соединение PL-oligo смешивают с наночастицами, и образуется достаточно стабильный нанокомпозит TiO2-PL-oligo (TiO2~oligo) (рис. 3).
С помощью метода светового рассеяния показано, что исходные наночастицы TiO2 имеют размер ~25 нм, а образующиеся частицы TiO2~oligo — ~50 нм. При этом заряд меняет знак с отрицательного в исходных наночастицах на положительный в нанокомпозите из-за множества положительно заряженных аминогрупп в составе полилизина. В результате полученная конструкция TiO2~oligo приобретает дополнительную возможность пробраться в клетку [11–13]. Для того чтобы продемонстрировать такую возможность, олигонуклеотид в составе нанокомпозита снабдили флуоресцентной меткой, присоединив остаток флуоресцеина (Flu). Полученный нанокомпозит TiO2~oligo(Flu) инкубировали с разными клетками и регистрировали их изображения с помощью конфокального флуоресцентного микроскопа (рис. 4). Зеленые точки внутри клеток — убедительное свидетельство того, что наночастицы успешно справились с возложенной на них задачей и протащили олигонуклеотид через клеточную мембрану.
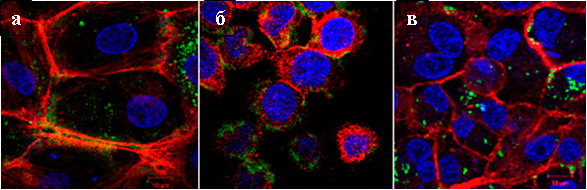
Рисунок 4. Изображение эукариотических клеток КСТ (а), HeLa (б) и MDCK (в) с помощью конфокального флуоресцентного микроскопа после их инкубации с нанокомпозитом TiO2~oligo(Flu). Красный цвет — нитевидные белковые структуры (здесь — границы клеток), синий цвет — клеточные ядра, зеленый цвет — флуоресцеин в составе олигонуклеотида.
Словарик
- Конфокальная лазерная сканирующая микроскопия
- метод, позволяющий получить изображения различных срезов клетки, то есть видеть содержимое внутри клетки.
- КСТ
- линия клеток эпителия коронарных сосудов теленка, используемая при изучении вируса диареи крупного рогатого скота (суррогатной модели вируса гепатита С).
- Эукариотические клетки
- клетки, содержащие клеточные ядра, в отличие от прокариотических клеток бактерий, не содержащих оформленного ядра.
- HeLa
- линия «бессмертных» клеток, используемая во множестве научных исследований в области биологии и фармакологии; линия получена из раковой опухоли шейки матки пациентки по имени Henrietta Lacks, умершей от этого заболевания.
- MDCK
- линия клеток почки собаки (Madin—Darby Сanine Kidney cells), используемая в биомедицинских исследованиях, в частности, для размножения вируса гриппа; впервые получена из почек кокер-cпаниеля американскими учеными S.H. Madin и N.B. Darby.
Влияние синтезированных нанокомпозитов на артериальное давление
Влияние предложенных нанокомпозитов на артериальное давление (АД) исследована на крысах линии НИСАГ (ISIAH). Эту линию крыс получили в результате многолетней селекции на повышение артериального давления в ответ на эмоциональный стресс [14], [15]. В среднем уровень систолического АД у нормотензивных крыс линии Вистар — 120–130 мм рт. ст., а у крыс линии НИСАГ — 180–190 мм рт. ст. Самцы крыс линии НИСАГ в возрасте 5 мес. использовали как модель стрессозависимой артериальной гипертонии.
Авторы выбрали мишенью один из ключевых генов, вовлеченных в патогенез гипертонической болезни. Этот ген кодирует синтез ангиотензин-превращающего фермента (АПФ), который в норме вырабатывается в эндотелиальных клетках кровеносных сосудов (главным образом, в легких) и в небольших количествах в других органах. Будучи одним из ключевых элементов системы регуляции давления, АПФ является мишенью целого класса антигипертензивных средств — ингибиторов АПФ. В клинике для лечения гипертонической болезни широкое применение получили синтетические блокаторы АПФ, например, каптоприл. Эти лекарства довольно хорошо справляются с задачей снижения повышенного АД, однако их использование имеет ряд недостатков и ограничений (большое количество противопоказаний) из-за побочных эффектов. Кроме того, большое неудобство состоит в необходимости принимать таблетки постоянно, по крайней мере, раз в день.
Для воздействия на синтез АПФ были синтезированы нанокомпозиты: TiO2~oligo1, содержащий олигонуклеотид, комплементарный консервативной области мРНК выбранного гена-мишени, и нанокомпозит TiO2~oligo2 со случайной последовательностью нуклеотидов.
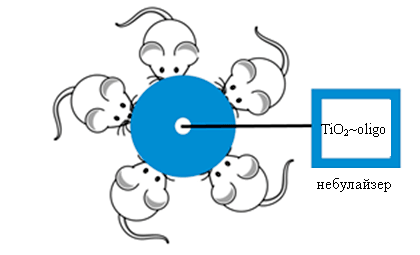
Рисунок 5. Схема проведения процедуры ингаляции. Крысы находятся под тиопенталовым наркозом и размещены вокруг закрытой емкости с отверстиями для носа; аэрозоль с нанокомпозитом поступает в емкость из небулайзера.
Для проведения экспериментов крыс разделили на две группы по пять подопытных в каждой. В течение 30 мин крысы вдыхали аэрозоль нанокомпозита, создаваемый небулайзером (рис. 5). Систолическое артериальное давление у крыс измеряли непрямым методом на хвосте с помощью аппаратуры фирмы Bio Pac System, Inc. (США). АД измеряли за два дня до начала эксперимента, затем на следующие дни после ингаляции препарата.
Олигонуклеотиды, адресованные мРНК гена АПФ, лучше всего вводить с помощью ингаляции, потому что около 80% белка АПФ в организме синтезируется в эндотелии сосудов малого круга кровообращения. Можно было ожидать, что приближение целевого препарата к мишени даст заметный эффект. И действительно — у крыс, которые вдыхали нанокомпозит TiO2~oligo1 с целевым олигонуклеотидом, давление понизилось примерно на 25 мм рт. ст., держалось на таком уровне в течение недели, и только в конце третьей недели уровень АД приблизился к исходному значению (рис. 6).
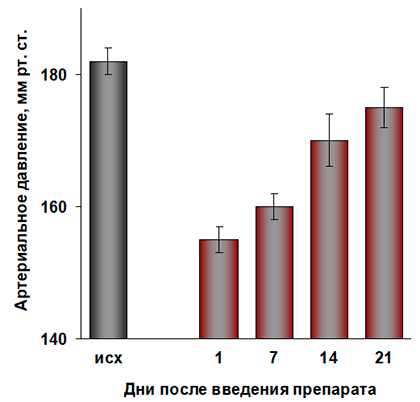
Рисунок 6. Систолическое артериальное давление (АД) у гипертензивных крыс линии НИСАГ после однократной ингаляции нанокомпозитов TiO2~oligo1, содержащих целевой олигонуклеотид против мРНК гена АПФ
Вдыхание нанокомпозита, содержащего олигонуклеотид со случайной последовательностью нуклеотидов (TiO2~oligo2), не привело к понижению АД. Это значит, что предложенный нанокомпозит действует адресно на выбранный ген. Важно отметить, что гипотензивный эффект нанокомпозита TiO2~oligo1 оказался продолжительнее, чем действие традиционных фармацевтических препаратов.
Таким образом, впервые показана перспективность применения нанокомпозитов TiO2~oligo для терапии гипертонической болезни. Более того, для лечения можно применять удобный для клинической практики ингаляционный путь введения препарата.
Результаты работы опубликованы в журнале «Биохимия» в 2017 году [16]. Работа выполнена при финансовой поддержке проекта РНФ № 16-15-10073.
Что же дальше?
Сейчас исследуется возможность использования других наночастиц в качестве доставщиков олигонуклеотидов в клетки. Кроме того, продолжается изучение гипотензивных эффектов нанокомпозитов, адресованных другим генам, участвующим в патогенезе гипертонической болезни.

Рисунок 7. Бегом от инфаркта и инсульта за нанокомпозитами TiO2~oligo
Применение ТНК в композиции с различными наноносителями открывает новые возможности для развития альтернативных методов борьбы не только с гипертонической болезнью, но и с другими патологиями. Преимущество этого подхода заключается, прежде всего, в строго целевой направленности терапевтического агента. Это обеспечивает его высокую специфичность и избавляет от многочисленных побочных эффектов, характерных для традиционных фармакологических препаратов. Конечно, предстоит еще большая исследовательская работа, прежде чем лечение болезней с помощью генной терапии станет рутинной медицинской практикой.
Литература
- 12 методов в картинках: генная инженерия. Часть I, историческая;
- 12 методов в картинках: генная инженерия. Часть II: инструменты и техники;
- A.M. Belikova, V.F. Zarytova, N.I. Grineva. (1967). Synthesis of ribonucleosides and diribonucleoside phosphates containing 2-chloro-ethylamine and nitrogen mustard residues.. Tetrahedron Letters. 8, 3557-3562;
- P. C. Zamecnik, M. L. Stephenson. (1978). Inhibition of Rous sarcoma virus replication and cell transformation by a specific oligodeoxynucleotide.. Proceedings of the National Academy of Sciences. 75, 280-284;
- Ravinay Bhindi, Roger G. Fahmy, Harry C. Lowe, Colin N. Chesterman, Crispin R. Dass, et. al.. (2007). Brothers in Arms. The American Journal of Pathology. 171, 1079-1088;
- Xin Ming, Brian Laing. (2015). Bioconjugates for targeted delivery of therapeutic oligonucleotides. Advanced Drug Delivery Reviews. 87, 81-89;
- M. Jafari, M. Soltani, S. Naahidi, D. N. Karunaratne, P. Chen. (2012). Nonviral Approach for Targeted Nucleic Acid Delivery. CMC. 19, 197-208;
- Suphiya Parveen, Ranjita Misra, Sanjeeb K. Sahoo. (2012). Nanoparticles: a boon to drug delivery, therapeutics, diagnostics and imaging. Nanomedicine: Nanotechnology, Biology and Medicine. 8, 147-166;
- Anirban Samanta, Igor L. Medintz. (2016). Nanoparticles and DNA – a powerful and growing functional combination in bionanotechnology. Nanoscale. 8, 9037-9095;
- Zarytova V.F., Zinov’ev V.V., Ismagilov Z.R., Levina A.S. et al. (2009). Investigation of penetration of titanium dioxide nanoparticles and their conjugates with oligonucleotides into eukaryotic cells. Nanotechnol. Russia. 4, 115–118;
- Kenneth T. Thurn, Hans Arora, Tatjana Paunesku, Aiguo Wu, Eric M.B. Brown, et. al.. (2011). Endocytosis of titanium dioxide nanoparticles in prostate cancer PC-3M cells. Nanomedicine: Nanotechnology, Biology and Medicine. 7, 123-130;
- Asya Levina, Zinfer Ismagilov, Marina Repkova, Natalia Shatskaya, Nadezhda Shikina, et. al.. (2012). Nanocomposites Consisting of Titanium Dioxide Nanoparticles and Oligonucleotides. j nanosci nanotechnol. 12, 1812-1820;
- Marina Repkova, Asya Levina, Boris Chelobanov, Zinfer Ismagilov, Natalia Shatskaya, et. al.. (2017). Efficient inhibition of influenza A viral replication in cells by deoxyribozymes delivered by nanocomposites. International Journal of Antimicrobial Agents. 49, 703-708;
- Markel A.L., Maslova L.N., Shishkina G.T. et al. Developmental influences on blood pressure regulation in ISIAH rats. In: Development of the Hypertensive Phenotype, Basic and Clinical Studies. In the series Handbook of Hypertension / ed. by McCarty R., Blizard D.A., Chevalier R.L. Amsterdam: Elsevier, 1999. P. 93–526;
- Markel A.L. Development of a new strain of rats with inherited stress-induced arterial hypertension. In: Genetic Hypertension Colloque INSERM / ed. by Sassard J. London: John Libbey Eurotext Ltd, 1992. P. 405–407;
- M. N. Repkova, A. S. Levina, A. A. Seryapina, N. V. Shikina, E. V. Bessudnova, et. al.. (2017). Toward gene therapy of hypertension: Experimental study on hypertensive ISIAH rats. Biochemistry Moscow. 82, 454-457.







