
12 методов в картинках: генная инженерия. Часть I, историческая
08 декабря 2017
12 методов в картинках: генная инженерия. Часть I, историческая
- 36438
- 0
- 59
рисунок Ольги Пташник
-
Авторы
-
Редакторы
-
Иллюстратор
Полвека назад человек вплотную приблизился к возможности примерить на себя роль творца, творца самого настоящего, способного целенаправленно наделять создаваемые им организмы нужными чертами. Научившись напрямую манипулировать генами, из селекционера он превратился в инженера. Что же подвело его к этой черте и как изменился мир после? Предлагаем заглянуть в историю генной инженерии: вспомнить важнейшие открытия, сформировавшие ее теоретическую основу и методический арсенал, поразмышлять над этическими вопросами и оценить вес генно-инженерных разработок в денежном эквиваленте.
12 биологических методов в картинках

Генеральный партнер цикла — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Одна из главных миссий «Биомолекулы» — докопаться до самых корней. Мы не просто рассказываем, какие новые факты обнаружили исследователи — мы говорим о том, как они их обнаружили, стараемся объяснить принципы биологических методик. Как вытащить ген из одного организма и вставить в другой? Как проследить в огромной клетке за судьбой нескольких крошечных молекул? Как возбудить одну крохотную группу нейронов в огромном мозге?
И вот мы решили рассказать о лабораторных методах более системно, собрать воедино в одной рубрике самые главные, самые современные биологические методики. Чтоб было интереснее и нагляднее, мы густо проиллюстрировали статьи и даже кое-где добавили анимации. Мы хотим, чтобы статьи новой рубрики были интересны и понятны даже случайному прохожему. И с другой стороны — чтобы они были так подробны, что даже профессионал мог бы обнаружить в них что-то новое. Мы собрали методики в 12 больших групп и собираемся сделать на их основе биометодический календарь. Ждите обновлений!
Генетическая, или генная, инженерия — это не отдельная наука, а огромная и постоянно развивающаяся научно-технологическая платформа, вобравшая в себя самое ценное из генетики, биохимии и химической инженерии, молекулярной и клеточной биологии, микробиологии и вирусологии. Благодаря этой платформе у землян появилась возможность обсуждать такие понятия, как генетически модифицированный организм (ГМО) и генная терапия. Генная инженерия в широком смысле — это третье поколение инструментов для изменения наследственной информации. В отличие от первых двух — селекции, применяемой тысячелетиями, и индуцированного мутагенеза, создавшего с начала 20 века более двух тысяч разновидностей растений [1], — новый инструмент работает прецизионно и быстро. А потому порождает непредставимые ранее научные соблазны и коллективные фобии. Кто-то видит в генной инженерии спасение человечества, кто-то — козни дьявола, но все сходятся в одном: она изменила мир. Инструментарий и технологии генной инженерии мы разберем во второй части статьи, а пока пройдем путем, по которому шли ученые к созданию этой отрасли и ее современным достижениям (рис. 1).

Рисунок 1. Краткая история генной инженерии. 1865 г. — Грегор Мендель, скрещивая горох, описал законы наследственности. 1869 г. — Иоганн Фридрих Мишер выделил из лейкоцитов вещество нуклеин, содержащее ДНК. 1888–1909 гг. — Начала формироваться генетическая терминология: появились понятия «ген», «генотип», «фенотип», «хромосома», «мутация». 1892 г. — Д.И. Ивановский впервые описал передачу болезнетворного начала посредством агентов, проходящих через бактериальные фильтры и позже названных вирусами. 1901 г. — Альбрехт Коссель обнаружил в составе небелкового компонента нуклеина — нуклеиновых кислот — азотистые основания: аденин, гуанин, цитозин, тимин и урацил. 1903 г. — Уолтер Саттон и Теодор Бовери предположили, что физическим субстратом менделевского наследования служат хромосомы. 1910 г. и позже — Морган, Бриджес, Стёртевант и Мёллер показали, как гены расположены на хромосомах, и развили хромосомную теорию наследственности Саттона и Бовери. 1915–1917 гг. — Фредерик Туорт и Феликс д’Эррель обнаружили вирусы бактерий — бактериофаги. 1928 г. — Фредерик Гриффит впервые наблюдал бактериальную трансформацию — горизонтальную передачу наследственной информации между бактериями. 1941 г. — Джордж Бидл и Эдвард Тейтем сформулировали гипотезу «один ген — один фермент». 1944 г. — Эвери, Маклауд и Маккарти показали, что трансформирующий фактор Гриффита представляет собой ДНК. 1952 г. — Альфред Херши и Марта Чейз подтвердили, что субстрат наследственности — ДНК. 1940–1950-е гг. — Описаны конъюгация и трансдукция — процессы переноса генетического материала между бактериальными клетками с помощью плазмид и фагов. 1948 г. — Барбара Макклинток обнаружила в ДНК кукурузы транспозоны. 1953 г. — С помощью рентгеновской кристаллографии установлена структура ДНК. 1955 г. — Северо Очоа и Марианна Грюнберг-Манаго выделили полинуклеотидфосфорилазу и синтезировали с ее помощью цепь РНК. 1956 г. — Артур Корнберг выделил ДНК-полимеразу I, первый из ферментов, способных копировать ДНК, и синтезировал с ее помощью цепь ДНК. 1960 г. — Франсуа Жакоб и Жак Моно описали функциональную единицу прокариотического генома — оперон, — показав, что экспрессия генов регулируется на уровне транскрипции. 1960-е гг. — Изучены структура и функции мРНК и тРНК, расшифрован генетический код. 1967 г. — Бернард Вайсс и Чарльз Ричардсон впервые показали Т4-лигазу в действии. 1969 г. — Говард Темин зафиксировал у ретровирусов обратную транскрипцию — синтез ДНК по матрице РНК. 1969 г. — Изобретена ДНК-ДНК- и РНК-ДНК-гибридизация. 1970 г. — Гамильтон Смит выделил первую эндонуклеазу рестрикции II типа. 1970 г. — Мортон Мандель и Акико Хига нашли способ делать клетки бактерий компетентными — способными лучше принимать ДНК из внешней среды. 1972 г. — Кес Ай и Пит Борст применили электрофорез ДНК в агарозном геле с этидиум бромидом в качестве визуализирующего вещества. 1970-е гг. — Разработаны способы введения генов в растительные клетки с помощью Ti-плазмид и микроинъекций. 1972 г. — Пол Берг получил первую рекомбинантную ДНК. 1972 г. — Ананда Чакрабарти получил генетически модифицированные псевдомонады, в которых уживались несколько разных плазмид биодеградации. 1973 г. — Герберт Бойер и Стэнли Норман Коэн получили первый организм, содержащий рекомбинантную ДНК. 1974 г. — Герберт Бойер и Стэнли Норман Коэн получили первую бактерию, несущую эукариотический ген — ген рибосомной РНК лягушки. 1974 г. — Рудольф Йениш создал первое трансгенное млекопитающее. 1975 г. — Созвана Асиломарская конференция, регламентировавшая работу с рекомбинантными ДНК. 1977 г. — Созданы достаточно производительные методы секвенирования ДНК. 1977 г. — Филлип Шарп и Ричард Робертс обнаружили в ДНК эукариот интроны. 1978–1979 гг. — Genentech произвела первые рекомбинантные белки — соматотропин и инсулин. 1980-е гг. — Разработаны способы введения генов в клетки с помощью электропорации и обстрела из генной пушки. 1982 г. — Томас Чех и Сидни Альтман открыли рибозимы. 1983 г. — Кэри Мюллис разработал метод ПЦР. 1983 г. — Появилось первое трансгенное растение. 1990 г. — Обнаружена РНК-интерференция, механизм которой в 1998 описали Крейг Мелло и Эндрю Файер. 1995–1996 гг. — Секвенированы первые про- и эукариотические геномы. 1996 г. — Сконструированы сайт-специфические нуклеазы «цинковые пальцы» (ZFN). 2000 г. — Создан «золотой рис» — первое инженерное растение с повышенной пищевой ценностью. 2003 г. — Почти полностью прочитан геном человека. 2010 г. — Группа Крейга Вентера и Гамильтона Смита создала Синтию — первый организм с полностью синтетической хромосомой. 2011 г. — Сконструированы сайт-специфические нуклеазы TALEN. 2011 г. — Зарегистрирован первый российский генно-терапевтический препарат, «Неоваскулген». 2012 г. — В Европе одобрено первое генно-терапевтическое лекарство, Glybera. 2012 г. — Разработана технология геномного редактирования CRISPR-Cas9. 2014 г. — Получена бактерия с расширенным генетическим кодом. 2014–2017 гг. — Первые попытки клинического редактирования ДНК человека инженерными нуклеазами. 2017 г. — В США одобрено первое генно-терапевтическое лекарство, Kymriah.
рисунок Ольги Пташник
История генной инженерии
Точка невозврата
Генная инженерия рождалась в 1971–1973 годах сразу в нескольких американских лабораториях. Но, пожалуй, ее инкубатором можно назвать Стэнфорд — именно там и тогда в нужной пропорции знания соединились с реактивами [2]. О роли «рекомбинантного университета» в становлении молекулярной биотехнологии и ее коммерциализации написана целая книга [3].
В 1972-м группа стэнфордского биохимика Пола Берга (рис. 2) впервые провела сплайсинг генов — сшила фрагменты ДНК разного происхождения, получив так называемую рекомбинантную ДНК: в ее состав вошли участки геномов онкогенного вируса SV40 и бактериофага λ, несущего галактозный оперон кишечной палочки [4], [5]. Создание такой химеры сразу же вызвало опасения некоторых биологов относительно безопасности ее введения в клетки живых организмов. Заразился этими опасениями и сам Берг. Группа отложила эксперименты in vivo, добровольно отказавшись от славы создателей первого генетически модифицированного организма. А главное, с тех самых пор развитие генной инженерии постоянно сопровождали и ограничивали всевозможные этические дилеммы (см. врезку «Рекомбинантные ДНК и биоэтика»).

Рисунок 2. Пол Берг со своей невестой Милли. Кстати, будущий нобелевский лауреат родился в семье, перебравшейся в США из маленькой деревушки под Минском.
сайт profiles.nlm.nih.gov
В 1973-м журнал PNAS рассказал о первом организме, полученном с помощью рекомбинантной ДНК. Escherichia coli несла рекомбинантную плазмиду, «сшитую» из фрагментов двух разных плазмид антибиотикорезистентности — векторной pSC101 (plasmid, Stanley Cohen, 101) и R6-5 — и функционально ничем не уступала молекулам природным [6]. В роли демиургов выступили сотрудники Калифорнийского и Стэнфордского университетов: Герберт Бойер (рис. 3), Энни Чен, Роберт Хелинг и Стэнли Коэн (не тот, что нобелевский лауреат, биохимик, а бактериальный генетик, Стэнли Норман Коэн). Этот коллектив осознал и постепенно показал, что в принципе любой ген из любого организма можно с помощью особых ферментов легко внедрить в векторную плазмиду и экспрессировать в совершенно ином генетическом окружении. Как развивалась эта идея и ставились эксперименты по молекулярному клонированию, можно узнать из первых уст — от самого Стэнли Коэна [7].

Рисунок 3. Герберт Бойер и Стэнли Коэн — создатели первого трансгенного организма и обладатели первого генно-инженерного патента.
Что было до?
Конечно, генная инженерия — не плод чьего-то озарения. Для ее возникновения в США сложились удачные научные и политические предпосылки: синергетический эффект дали рузвельтовские программы госфинансирования фундаментальных исследований, возможности новых приборов, накопленный багаж знаний о наследственности. Этот багаж уже давно начали собирать в разных уголках Старого Света: в середине 19 века по Европе бродили сразу два призрака — коммунизма и генной инженерии. Тогда у биологов уже был микроскоп и недооцененные «гороховые» законы наследственности Менделя. В 1869 году к ним добавилась выделенная швейцарцем Иоганном Фридрихом Мишером ДНК. Поначалу странно-кислое вещество из ядер нейтрофилов гноя назвали нуклеином и посчитали, что оно служит хранилищем фосфора — уж больно много его там было. Немец Альбрехт Коссель, будущий нобелевский лауреат, к 1901 году установил, что в состав очищенного небелкового компонента нуклеина — нуклеиновых кислот — входят пять азотистых оснований: аденин, гуанин, цитозин, тимин и урацил. Заподозрить такие простые соединения, как нуклеиновые кислоты, в передаче наследственной информации тогда было невозможно — более подходящими кандидатами казались белки.
В 1886-м голландец Гуго де Фриз ввел термин панген для обозначения гипотетической частицы наследственности (до гена его позже урезал Вильгельм Иогансен), а в 1905-м англичанин Уильям Бейтсон назвал изучение наследственности генетикой. В 1888-м сегменты, на которые распадается хроматин во время клеточного деления, Генрих Вильгельм Вальдейер назвал хромосомами. На рубеже веков огородные эксперименты привели де Фриза и независимо от него австрийца фон Чермака, немца Корренса и американца Шпильмана к «переоткрытию» менделевских законов. В 1903-м де Фриз наблюдал у энотеры первую «мутацию», а Саттон и Бовери предположили, что физическим субстратом менделевского наследования служат хромосомы.
В 1892 году русский микробиолог и физиолог растений Дмитрий Иосифович Ивановский, работая с растениями табака, зараженными мозаичной болезнью, обнаружил совершенно новые инфекционные агенты, проходящие через мельчайшие бактериальные фильтры. Наблюдавший то же самое, но чуть позже, Мартин Бейеринк назвал эти биологические объекты вирусами. Нечто похожее произошло и с открытием вирусов бактерий — бактериофагов. Их обнаружили независимо друг от друга Фредерик Туорт (1915) и Феликс д’Эррель (1917), причем последний дал им имя и использовал их для лечения бактериальных инфекций у людей. Так родилась фаговая терапия [8]. Увидеть всю эту вирусную братию удалось гораздо позже, после появления электронного микроскопа в начале 1930-х [9]. А еще позже научились с помощью фагов доставлять гены в бактериальные клетки и использовать их «запчасти» — ферменты и регуляторные элементы — в работе с нуклеиновыми кислотами. Вирусы животных стали основными векторами, доставляющими нужные гены в клетки человека и других млекопитающих.
Существенно продвинуться в понимании природы наследственности помогли мушки дрозофилы, а затем и бактерии. В 1910-м профессор Колумбийского университета Томас Морган (рис. 4) показал, что гены расположены линейно на хромосомах и образуют группы сцепления. Этим он заслужил Нобелевскую премию [10]. Морган и его сотрудники — Бриджес, Стёртевант и Мёллер — составили первые карты хромосом, экспериментально подтвердили и развили хромосомную теорию наследственности Саттона и Бовери [11].

Рисунок 4. Томас Хант Морган и его жена Лилиан. Благодаря блестящей работе супругов в лабораторную моду надолго вошла дрозофила. Самые интересные ее мутанты разлетались из «мушиной комнаты» Моргана в Колумбийском университете как горячие пирожки.
В 1928-м британский бактериолог Фредерик Гриффит в надежде получить вакцину от пневмококка впервые наблюдал бактериальную трансформацию: посредством какого-то трансформирующего фактора убитый вирулентный штамм бактерий передал свою вирулентность живому неопасному штамму. То, что трансформирующим фактором была именно ДНК, в 1944 году остроумно показали американцы Эвери, Маклауд и Маккарти (рис. 5). «Виновника» вычислили по оружию, которое его убивает: трансформирующий эффект нивелировался исключительно ДНКазами. В 1952 году Альфред Херши и Марта Чейз подтвердили роль ДНК в передаче наследственных признаков уже с помощью радиоактивно меченных бактериофагов. Это серьезно пошатнуло уверенность в белковой природе наследственности (до той поры делали ставку на белковый компонент хромосом), но всё еще не хватало объяснения, как именно работает ДНК.

Рисунок 5. Они показали, что наследственная информация записана в ДНК: Колин Маклауд, Освальд Эвери, Маклин Маккарти.
В 1941-м благодаря рентгеновскому мутагенезу плесени Neurospora crassa, проведенному Джорджем Бидлом и Эдвардом Тейтемом, появилась гипотеза «один ген — один фермент»: каждый ген отвечает за синтез какого-то одного фермента, который катализирует какую-то метаболическую реакцию.
В 1940-х и начале 1950-х Эдвард Тейтем, Нортон Зиндер, Джошуа и Эстер Ледерберги (рис. 6) описали основные процессы переноса генетического материала между бактериальными клетками с помощью плазмид и фагов (в частности, конъюгацию и трансдукцию). Эти мобильные генетические элементы [12] позже стали неотъемлемыми компонентами арсенала генного инженера.

Рисунок 6. Джошуа и Эстер Ледерберги. Несмотря на сексистскую атмосферу тех лет, Эстер Мириам Ледерберг заслужила искреннее восхищение коллег: в числе ее заслуг — открытие и изучение фага λ, F-плазмиды и трансдукции, введение знакомого теперь каждому микробиологу и многим генным инженерам метода реплик, организация в Стэнфорде специализированного плазмидного центра...
сайт alchetron.com

Рисунок 7. «Великая кукурузница» — нобелевский лауреат Барбара Макклинток — и ее коллега, Гарриет Крейтон. Барбара и Гарриет описали рекомбинацию в ходе мейотического кроссинговера хромосом кукурузы. Своему научному объекту Макклинток почти не изменяла. А если и изменяла, то с пользой: прибыв в 1944 году в Стэнфорд по приглашению Джорджа Бидла, Макклинток за пару месяцев полностью цитогенетически охарактеризовала грибок Neurospora crassa.
Еще один класс мобильных ДНК — транспозоны (изначально — «контролирующие элементы») — в 1948 году обнаружила Барбара Макклинток, известная пионерскими работами по кроссинговеру хромосом (рис. 7) [13], [14]. Она предположила, что эти мобильные элементы участвуют в регуляции активности генов. То, что гены — не статичные, а управляемые инструкции, было слишком уж странной мыслью для того времени.
В том же году сотрудник Кембриджа Александер Робертус Тодд, изучавший структуру нуклеотидов, впервые химически синтезировал один из них — аденозинтрифосфат, или АТФ (сахар рибоза + азотистое основание аденин + фосфатные группы).
В 1953 году произошло эпохальное событие — установление молекулярной структуры ДНК. Верную модель обычной, B-формы, ДНК построили сотрудники Кембриджского университета Джеймс Уотсон и Фрэнсис Крик, а базисом для ее создания послужили работы рентгеноструктурщиков из Королевского колледжа Лондона — Мориса Уилкинса и Розалинд Франклин с ее аспирантом, Реймондом Гослингом (рис. 8). Дифракционное изображение кристаллизованной ДНК указывало на ее двуспиральный характер, и Франклин даже удалось рассчитать некоторые параметры этой спирали. Уотсон и Крик, заполучив материалы Франклин и держа в уме пропорции азотистых оснований, вычисленные в 1950-м Эрвином Чаргаффом, предположили, как закодирована и как передается наследственная информация. Полуконсервативный механизм репликации ДНК в знаменитом изотопном эксперименте доказали Метью Мезельсон и Франклин Сталь в 1958 году.
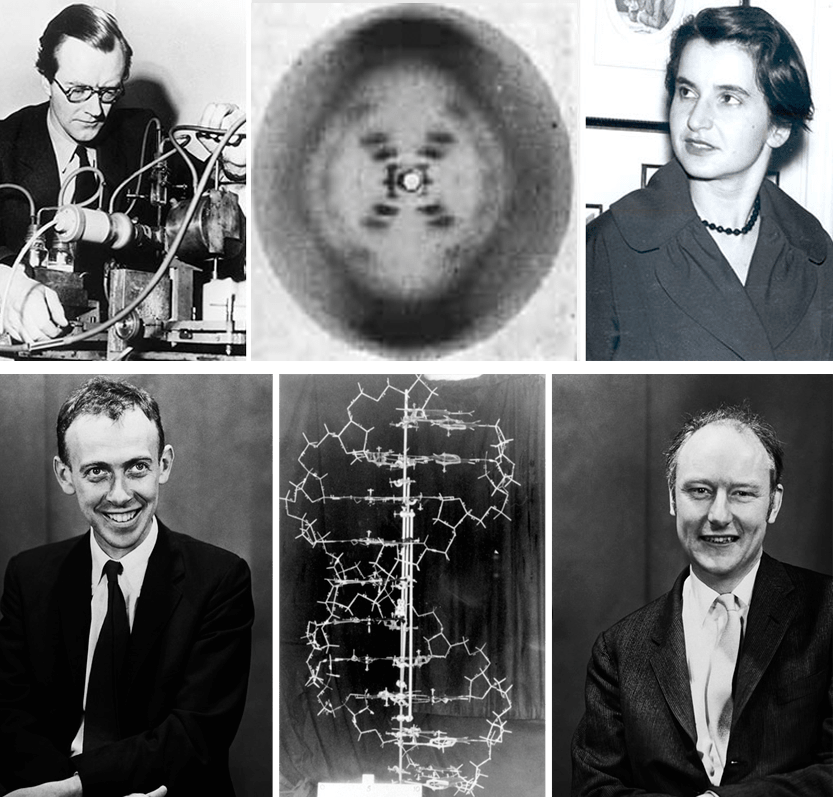
Рисунок 8. Им покорилась двойная спираль. Вверху — Морис Уилкинс и Розалинд Франклин с вошедшим в историю Фото 51 — самой удачной рентгенограммой ДНК. Внизу — Джеймс Уотсон и Фрэнсис Крик со своей моделью ДНК. Им всё-таки удалось опередить другого талантливого ученого — Лайнуса Полинга, известного своей любовью к аскорбинке и расшифровке структуры молекул.
В 1955-м Северо Очоа де Альборнос с аспиранткой, Марианной Грюнберг-Манаго (уроженкой Петрограда и будущим президентом Международного биохимического союза), выделили бактериальную полинуклеотидфосфорилазу и с ее помощью синтезировали в пробирке РНК. Позже оказалось, что синтез для этого фермента скорее хобби, основная же его работа — деградация РНК. В 1956-м Артур Корнберг (рис. 9) со своей женой Сильви выделил один из ферментов синтеза и коррекции ДНК — ДНК-полимеразу I — и получил с его помощью цепочку ДНК [15]. Как и в случае Очоа, фермент Корнберга не был главным строителем полинуклеотидных цепей, однако стал одним из основных инструментов генной инженерии.

Рисунок 9. Артур Корнберг с первой женой, Сильви, и сыновьями (Стокгольм, 1959 г.). Старший сын, Роджер (слева), займется изучением эукариотической транскрипции и снова приедет в Стокгольм в 2006-м — уже за своей «нобелевкой»; средний, Томас (справа), выделит ДНК-полимеразы II и III; младший, Кеннет, будет проектировать биотехнологические здания и лаборатории. Сильви как биохимик, внесший весомый вклад в открытие и изучение ДНК-полимеразы I, не получит никакого признания и скончается в 1986-м. Артуру не удастся пережить только свою третью жену.
сайт www.dnalc.org
В первой половине 60-х Метью Мезельсон, Франсуа Жакоб и Сидни Бреннер подтвердили существование матричной РНК (мРНК), а Роберт Холли описал структуру и даже установил нуклеотидную последовательность транспортной РНК (тРНК) — молекулярного адаптера, объяснившего, как инструкции, заложенные в ДНК и переписанные в мРНК, определяют построение аминокислотных цепочек. Тогда же стартовала «кодовая гонка»: нужно было понять, как именно «буквы» мРНК переводятся на белковый язык. Расшифровкой генетического алфавита активно занимался Очоа, но наработать достаточно для Нобелевской премии материала удалось Хару Коране и Маршаллу Ниренбергу. Благодаря им мы знаем, что одну аминокислоту кодируют три нуклеотида, и даже какую именно аминокислоту какие именно триплеты кодируют.
Примерно тогда же, наконец, всплыли вопросы регуляции работы генов — те, что чуть раньше научное сообщество не хотело слышать из уст Барбары Макклинток. Жакоб вместе с Жаком Моно описали лактозный оперон и показали, что синтез ферментов контролируется внешними условиями посредством регуляторных белков, которые подавляют или активируют транскрипцию.
Ферментативную «иголку», способную сшивать фрагменты нуклеиновых кислот, описали в 1967 году гарвардские биохимики Бернард Вайсс и Чарльз Ричардсон. Одноцепочечные разрывы (ники) в двухцепочечной ДНК они генерировали с помощью панкреатической ДНКазы, а для восстановления фосфодиэфирных связей использовали полинуклеотидлигазу, выделенную из зараженной фагом Т4 E. coli. Так появился один из основных инструментов генных инженеров — Т4-лигаза. Без лигаз не обходится молекулярное клонирование, а также один из вариантов секвенирования нового поколения [16].
В 1969-м вирусолог Говард Темин вплотную приступил к доказательству «обратного тока» информации — от РНК к ДНК (стандартный, «прямой» путь реализации наследственной информации — от ДНК через РНК в белок). На это оказались способны онкогенные РНК-содержащие вирусы типа вируса саркомы Рауса, то есть ретровирусы. Прежде чем встроиться в хромосомы пораженной клетки, эти агенты с помощью собственного фермента, обратной транскриптазы [17], синтезируют ДНК-копию своего генома. Этот же фермент независимо обнаружил и Дэвид Балтимор, работая с вирусом мышиной лейкемии.
В том же году Мэри-Лу Пардью, известный борец против дискриминации женщин в Массачусетском технологическом институте, и Джозеф Голл разработали методы ДНК-ДНК- и РНК-ДНК-гибридизации. Это были варианты технологии «гибридизация in situ», когда радиоактивно меченный фрагмент ДНК или РНК используется в качестве зонда для обнаружения искомой (комплементарной зонду) нуклеотидной последовательности в тканях или клетках. Разные варианты гибридизации эксплуатируются генными инженерами и сейчас, в эпоху рутинного секвенирования.
После «взламывания» генетического кода и получения первых представлений о контроле работы генов появление генной инженерии стало делом техники: не хватало лишь некоторых инструментов.
Полезные ферментативные «ножницы» — эндонуклеазы рестрикции (рестриктазы) II типа — в 1970 году выделили из бактерии Haemophilus influenzae Гамильтон Смит (рис. 10) и Том Келли. До этого Вернер Арбер и Мезельсон описали работу почти бесполезных на практике, но важных для ограничения (рестрикции) размножения фагов, рестриктаз I типа: у бактерий они узнают специфические последовательности чужеродной ДНК и режут обе цепи этой ДНК между случайными нуклеотидами. Ферменты же II типа режут там, где узнают, то есть работают предсказуемо. С их помощью Дэниел Натанс и Кэтлин Данна в 1971 году порезали ДНК вируса SV40 и показали, что получившийся набор фрагментов можно разделять электрофорезом в полиакриламидном геле [18], а значит, так можно картировать ДНК.

Рисунок 10. Благодаря им мы можем резать ДНК только там, где нужно. Слева — Дэниел Натанс, в центре — Гамильтон Смит, справа — Вернер Арбер. За вклад в познание биологической функции рестриктаз и за внедрение их в лабораторную практику в качестве молекулярных «ножниц закройщика» все трое удостоились Нобелевской премии.
Рестриктазы стали жизненно важным инструментом для генной инженерии. Они нашли применение не только в технологии рекомбинантных ДНК, но и в геномной дактилоскопии и техниках секвенирования (прочтения) нуклеотидных последовательностей [16], [19]. Первые рекомбинантные ДНК получили с помощью эндонуклеазы EcoRI, правда, группы Берга и Коэна использовали ее немного по-разному. В считаные годы спрос на эти ферменты так возрос, что академические энтузиасты, выделявшие уже известные и новые рестриктазы, перестали справляться со снабжением всех желающих, и тогда за дело взялись коммерсанты: в 1975-м — New England Biolabs, а позже и другие компании. К октябрю 2017 года было выделено уже 4 155 эндонуклеаз II типа. Найти всю информацию о них и системах рестрикции-модификации в целом можно в базе данных REBASE.
Как резать и сшивать ДНК, стало более или менее ясно, но оставалась проблема универсального (не узкоспециализированного типа конъюгации или трансдукции) внесения нуклеиновых кислот в клетки. У кишечной палочки давно было замечено нежелание поглощать ДНК из среды, но в 1970-м эту проблему разрешили Мортон Мандель и Акико Хига. Обработка клеток E. coli хлоридом кальция сделала их компетентными, то есть способными принимать генетический материал извне. Немного усовершенствованный, этот метод и сейчас широко используют для трансформации бактерий. В те же 70-е изучили трансформирующие свойства Ti-плазмид в отношении растительных клеток и применили микроинъекции, а в 80-е сконструировали электропоратор и генную пушку [20]. С появлением последней стало возможным интегрировать чужеродные гены в хлоропласты.
В 1972 году сотрудники Амстердамского университета Кес Ай и Пит Борст опробовали визуализацию ДНК с помощью электрофореза в агарозном геле с буфером, содержащим бромистый этидий. Это позволило видеть не меченные изотопами молекулы ДНК, просто положив гель на УФ-трансиллюминатор.
Как можно заметить, к технологии рекомбинатных ДНК шли разными путями: кто-то изучал биохимию кишечной палочки, кто-то — ее генетику с помощью бактериофагов, а кто-то — генетику млекопитающих с помощью их вирусов. И постепенно из мелких разнородных фрагментов сложилась общая картина устройства геномов, а заодно открылись и возможности манипулировать ими. Корнберг, например, делал ставку на E. coli, считая ее лучшей моделью для изучения более сложных эукариотических процессов. Своего ученика, Пола Берга, он призывал тоже заниматься бактериальной энзимологией, а не губить свою карьеру, продираясь сквозь генетические дебри млекопитающих. Но история, избрав выразителем своей воли Нобелевский комитет, решила, что правы были оба. При этом далеко не последнюю роль в их успехе и становлении генной инженерии сыграл... один холодильник: только в славном стэнфордском агрегате, именуемом «холодильник Корнберга», можно было найти всё необходимое для резки, склеивания и ретуширования ДНК [2].
Что было после?
Работы Берга и Коэна взбудоражили научный мир, обывателей и фондовые биржи (см. врезку «Генная инженерия и рынок») и открыли эру молекулярной биотехнологии. Уже в ближайшие годы начался отсчет полезных продуктов, полученных с помощью рекомбинантных ДНК. Но были решены далеко не все теоретические и практические задачи, и генная инженерия шаг за шагом, открытие за открытием, развивается по сей день.
В 1974 году Рудольф Йениш создал первое трансгенное млекопитающее — мышь, которой на раннем этапе эмбриогенеза встроили в ДНК ретровирус. Тогда и в дальнейшем «онкомышей» получали, конечно, не ради забавы, а ради выведения модельных линий для изучения канцерогенеза [21].
В 1975 году Фредерик Сенгер (рис. 11), до того занимавшийся установлением первичной структуры белков и РНК, разработал «плюс и минус» метод секвенирования ДНК, не слишком производительный, но в 1977-м усовершенствованный до «дидезокси-метода». Более быстрая и точная технология позволила группе Сенгера справиться с целым геномом бактериофага φX174. Тогда же Уолтер Гилберт и Аллан Максам разработали совершенно иной способ чтения ДНК, воспользовавшись подсказкой сотрудника Института молекулярной биологии им. В.А. Энгельгардта Андрея Мирзабекова, посетившего их лабораторию в 1975-м. Оба подхода требовали радиоактивного мечения ДНК. Метод Гилберта после отличного старта уступил первенство в покорении лабораторий методу Сенгера, и потому именно дидезокси-метод удостоился чести «читать» геном человека. С тех пор секвенирование стало еще проще и производительнее: хронологию появления новых техник и их описание можно найти в статье «Секвенирование нуклеиновых кислот» [16].

Рисунок 11. Благодаря им мы можем читать нуклеотидную последовательность ДНК. Слева — Фред Сенгер отмечает свою первую «нобелевку» — за секвенирование белка инсулина. Вторую он получит совместно с Гилбертом за разработку методов секвенирования ДНК. В центре — Андрей Дарьевич Мирзабеков занимался изучением динамики хроматина, разрабатывал микрочипы для анализа биомолекул, с 1989 по 1993 был вице-президентом организации «Геном человека» (HUGO). Справа — Уолтер Гилберт работал с Джеймсом Уотсоном, организовал несколько биомедицинских компаний и впервые озвучил термин «РНК-мир» [22].
фотография Ф. Сенгера из Sequencing proteins: Insulin
В 1977 году американец Филлип Шарп и британец Ричард Робертс (рис. 12) независимо друг от друга обнаружили, что гены эукариот содержат длинные «смысловые паузы» — интроны, — которые затем вырезаются в процессе сплайсинга из незрелой мРНК. Эту проблему всегда приходится решать при экспрессии эукариотических генов в бактериях.

Рисунок 12. Нобелевские лауреаты Филлип Шарп и Ричард Робертс. Особенно известны как первооткрыватели интронов и инициаторы кампании 2016 года по подписанию нобелиатами открытого письма в защиту ГМО (см. врезку «Генная инженерия и рынок») от посягательств гринписовской братии. «Мы — ученые. Мы понимаем логику науки. Легко заметить, что то, что делает „Гринпис“, вредоносно и антинаучно. Вначале „Гринпис“, а затем и некоторые их союзники сознательно из кожи вон лезли, чтобы напугать людей. Это их способ добывать деньги...» (Р. Робертс, 2016)
На исходе 70-х разработали неизотопные методы мечения нуклеиновых кислот.
В 1978–1979 годах компания Genentech (см. врезку «Генная инженерия и рынок»), используя технологию рекомбинантных ДНК и E. coli в качестве биофабрики, получила первые в мире генно-инженерные лекарства — человеческие инсулин (Humulin) и гормон роста. С тех пор подобными способами созданы сотни биофармацевтических препаратов: гормонов, моноклональных антител, ферментов, генно-терапевтических молекул.
1982 год запомнился открытием рибозимов: Томас Чех и Сидни Альтман показали, что молекулы РНК могут обладать каталитической активностью. Помимо существенной поддержки гипотезы мира РНК, это открытие в 2000-х вылилось в создание инженерных рибозимов для генетической терапии, способных разрезать нужные РНК. Самым логичным выглядело их использование для блокирования ВИЧ и иных РНК-содержащих вирусов [23].
В 1983 году Кэри Мюллис совершил настоящую революцию в молекулярной биологии, разработав метод полимеразной цепной реакции (ПЦР). Теперь можно было легко получать нужные фрагменты ДНК в почти неограниченных количествах, а позже и оценивать с помощью ПЦР экспрессию генов. О почти неисчерпаемых возможностях метода и его новых итерациях подробно рассказывает статья «Полимеразная цепная реакция» [24].
В том же году появилось первое трансгенное растение: Майкл Беван, Ричард Флавелл и Мэри-Дэлл Чилтон модифицировали клетки табака с помощью Ti-плазмиды, несущей химерный ген антибиотикорезистентности.
В 1989-м удалось получить первую мышь с нокаутированными генами, крыс осилили гораздо позже — в 2003-м [25].
В 1990 году калифорнийские биологи пытались сделать цветки трансгенной петунии более яркими, а получили еще более бледные. Так неожиданно себя проявила РНК-интерференция, которую позже, в 1998 году, подробно описали у червя Caenorhabditis elegans Крейг Мелло и Эндрю Файер (рис. 13). Введением небольшой двухцепочечной РНК они вызвали сайленсинг (подавление экспрессии) генов, содержащих комплементарные этой РНК участки. Благодаря малым РНК, регулирующим экспрессию генов на посттранскрипционном уровне, удались на славу гипоаллергенные томаты, табак без никотина, кофе без кофеина и многое другое. Двухцепочечные молекулы оказались более эффективными, чем одноцепочечные (простые антисмысловые РНК), механизм действия которых не относят к интерференции.

Рисунок 13. Крейг Кэмерон Мелло и Эндрю Закари Файер, объяснившие, как можно без манипуляций с генами изменить количество их продуктов. «В мире так много сил, разделяющих людей, — языковой барьер, барьеры традиций, идеологий и верований. Наука противодействует всем этим силам, наука — это международное предприятие, которое нас уравнивает и объединяет для решения проблем и осознания нашего места в мире. Ведь действительно, она говорит нам, что мы обладаем глубокой общей историей как вид и, весьма вероятно, разделим общую судьбу как обитатели маленькой и уязвимой планеты» (К. Мелло, 2015)
В 1995-м секвенировали первый геном свободноживущего прокариота. Как ни странно, пионером стала Haemophilus influenzae, а не классическая модель, E. coli. Хромосому последней досеквенировали спустя два года, уже после прочтения куда более крупной первой эукариотической ДНК (Saccharomyces cerevisiae, 16 хромосом, 1996 год). Стратегии, разработанные для секвенирования дрожжевой ДНК, легли в основу других крупных проектов, включая «Геном человека» [26].
В апреле 2003 года завершились основные работы по секвенированию генома человека, которые стоили правительствам США и еще нескольких стран $3 млрд [26]. Прочтение геномов нескольких анонимных доноров вскрыло много интересных деталей. Оказалось, что обычных — кодирующих белок — генов у нас гораздо меньше, чем полагали ранее, — чуть более 20 тыс. [27]. Они составляют всего 1,5% совокупной человеческой ДНК, а остальное относят к ДНК некодирующей (хотя некоторые ее области кодируют малые регуляторные молекулы и мобильные генетические элементы) [28]. Некодирующая ДНК участвует в поддержании структуры хромосом, клеточном делении и регуляции экспрессии генов. Но самое интересное, что до 90% однонуклеотидных полиморфизмов (SNP), ассоциированных с разными заболеваниями, сосредоточены в некодирующих, преимущественно регуляторных, участках ДНК. Поэтому логическим продолжением прочтения генома человека стали проекты, посвященные его вариабельности: Human Genome Diversity, HapMap, 1000 Genomes, ENCODE.
В 2000 году журнал Science опубликовал статью о разработке первого растения с повышенной пищевой ценностью — золотого риса, впоследствии изрядно нашумевшего (см. врезку «Генная инженерия и рынок») [29], [30]. Этот рис создавался для ликвидации смертельно опасного дефицита витамина А у населения бедных стран Азии и Африки. В ДНК обычного риса для этих целей ввели два чужеродных гена, совершенствующих синтез каротиноидов [29]. В 2005 году Syngenta анонсировала вторую итерацию золотого риса, накапливающую в зернах в 23 раза больше β-каротина. Масштабных посевов золотого риса придется еще подождать, а вот урожаи других генетически модифицированных культур собирают уже с середины 90-х. Сейчас в США бόльшая часть кукурузы, сои и хлопка содержит гены устойчивости к вредителям или гербицидам.
В 2007-м фармгигант Merck успешно завершил клинические исследования рекомбинантной вакцины Gardasil, защищающей от человеческих папилломавирусов высокого онкогенного риска, способных инактивировать гены опухолевых супрессоров и провоцировать развитие карцином шейки матки и некоторых других частей тела. Антигены вирусоподобных частиц, составляющих вакцину, производятся трансгенными дрожжами. Вскоре GlaxoSmithKline выпустила аналогичную, но более эффективную вакцину Cervarix.
В 2010-м сотрудники Института Дж. Крейга Вентера (JCVI), в числе которых были сам Вентер и Гамильтон Смит (рис. 14), создали первую бактерию с полностью синтетической генетической начинкой. Детище, названное Синтией, состояло из «тела» — клетки Mycoplasma capricolum, лишенной собственной хромосомы, — и «мозга» — ДНК, синтезированной по образу и подобию хромосомы Mycoplasma mycoides. В ряду клеточных поколений «мозг», как полагается, возобладал, и «тело» микоплазмы из capricolum превратилось в mycoides. В 2016-м коллектив получил похожую бактерию, но с сокращенным до возможного минимума числом генов (JCVI 3.0). Авторы работы объясняют эти упражнения потребностью в создании легко контролируемых микроорганизмов с полезными свойствами, хотя не все «лидеры мнений» считают такой путь самым подходящим [31–33].

Рисунок 14. Крейг Вентер и Джеф Д. Боеке, не рассчитывающие на милость природы и синтезирующие геномы самостоятельно. Вентер также известен как генератор коммерческих идей, а Боеке — как автор термина «ретротранспозон».
В 2011 году в России зарегистрировали первый генно-терапевтический препарат, причем отечественного дизайна — «Неоваскулген». Это плазмида, несущая ген фактора роста эндотелия сосудов (pCMV-VEGF165), предназначенная для стимулирования построения новых артерий у больных перемежающейся хромотой [34], [35].
В 2012 году Европейская комиссия впервые одобрила клиническое применение генно-терапевтического лекарства на территории ЕС. Препарат Glybera (алипоген типарвовек) создала компания uniQure для полного или долговременного исцеления пациентов с редким наследственным заболеванием — дефицитом липопротеинлипазы, изнуряющим постоянными приступами панкреатита. В 2016 европейское одобрение получил еще один препарат для генной терапии (см. врезку «Генная инженерия и рынок»). Американский регулятор, FDA, впервые одобрил два подобных препарата в 2017 году, оба — для персонализированного лечения B-клеточных лейкозов/лимфом. Первым стал педиатрический Kymriah (Novartis), вторым, уже подешевле и для взрослых, Yescarta (Kite Pharma, Gilead Science). В 2018 году «зеленый свет», скорее всего, получит и молекула с рабочим названием LUXTURNA (Spark Therapeutics) — первый препарат для борьбы с одной из форм наследственной дистрофии сетчатки.
Но 2012 год всё же запомнился другим, действительно прорывным событием: генно-инженерный арсенал пополнился новыми, удобными, точно настраиваемыми «ножницами» — CRISPR-Cas9. Ими можно разрезать выбранные последовательности ДНК не только в пробирке, но и прямо в живых клетках, то есть редактировать геномы in vivo. На подобное способны и другие инженерные нуклеазы — мегануклеазы (природные выделены в 90-х, постоянно совершенствуются), ZFN (получены в 1996) и TALEN (получены в 2011), — но с бόльшими затратами финансов и времени. История открытия и применения CRISPR-систем подробно рассказана в статье «CRISPR-эпопея и ее герои» [36]. Сайт-специфическими нуклеазами уже успели поработать с геномами организмов всех крупных таксонов, в том числе и человеческим.
В 2014 году с помощью ZFN модифицировали Т-лимфоциты инфицированных ВИЧ, чем снизили вирусную нагрузку. В 2015 безнадежной пациентке с лейкемией ввели донорские Т-лимфоциты, модифицированные с помощью TALEN, чем выиграли время для трансплантации костного мозга [37]. Тогда же в Китае покусились на редактирование генома нежизнеспособных эмбрионов CRISPR-системой [38]. В 2016 опухолевые клетки пациента с агрессивной карциномой легкого атаковали его собственными Т-лимфоцитами, подправленными CRISPR-Cas9 [39], [40]. Сейчас компания Sangamo Therapeutics (США) проводит набор участников I фазы клинических исследований ZNF-терапии in vivo: речь идет об исправлении дефектных генов, вызывающих мукополисахаридозы I/II и гемофилии А/В. Другой пионер отрасли, Editas Medicine, планирует начать клинические исследования CRISPR-терапии ex vivo и in vivo [39].
К 2014 году подоспела первая синтетическая и слегка усовершенствованная эукариотическая хромосома — хромосома III Saccharomyces cerevisiae. Поскольку руководитель проекта Джеф Боеке (рис. 14) не располагал финансами, сопоставимыми с возможностями «папаши» Синтии, Крейга Вентера, пришлось прибегнуть к остроумному решению — раздать работу по частям студентам Университета Джонса Хопкинса. Все остались довольны — и дешево, и публикация в Science иным студентам только снится [41], [42]! Международный проект Sc2.0, посвященный синтезу дрожжевого генома с заданными свойствами, уже близок к построению всех 16 хромосом.
В том же 2014-м Денис Малышев с коллегами из Исследовательского института Скриппс и New England Biolabs сконструировал кишечную палочку с расширенным генетическим алфавитом, которая стабильно поддерживает плазмиду с неприродной парой нуклеотидов [43]. В 2017 году эту полусинтетическую бактерию тюнинговали [44].
Развитие генетической инженерии шло одновременно многими путями. Его постоянно сопровождал нобелевский «медалепад» и пристальное внимание СМИ. Биологические процессы, с которыми имели дело генные инженеры, становилось всё сложнее объяснить общественности, а от этого рождались страхи и мифы, слишком далекие от разумных или даже гипертрофированных опасений специалистов (см. врезку «Рекомбинантные ДНК и биоэтика»). Технология рекомбинантных ДНК, ПЦР, синтетическая биология и редактирование геномов сулили просто невообразимые перспективы для человечества, а значит, из них можно было извлечь немало прибыли. Поэтому помимо решения этических вопросов академическим коллективам пришлось разбираться в вопросах монетизации и охраны интеллектуальной собственности (см. врезку «Генная инженерия и рынок»).
Ну а мы в следующей части статьи попробуем разобраться, как создают молекулярные химеры и как используют нуклеиновые кислоты для решения исследовательских и медицинских задач.
Литература
- B.S. Ahloowalia, M. Maluszynski, K. Nichterlein. (2004). Global impact of mutation-derived varieties. Euphytica. 135, 187-204;
- Jones M. (2015). The invention of recombinant DNA technology. Berg, Boyer, Cohen. Life sciences at Chemical Heritage Foundation;
- Doogab Yi. The Recombinant university: genetic engineering and the emergence of Stanford biotechnology. University of Chicago Press, 2015. — 304 p.;
- Jackson D.A., Symons R.H., Berg P. (1972). Biochemical method for inserting new genetic information into DNA of Simian Virus 40: circular SV40 DNA molecules containing lambda phage genes and the galactose operon of Escherichia coli. Proc. Natl Acad. Sci. USA. 69, 2904–2909;
- Великий рекомбинатор;
- Cohen S.N., Chang A.C.Y., Boyer H.W., Helling R.B. (1973). Construction of biologically functional bacterial plasmids in vitro. Proc. Natl Acad. Sci. USA. 70, 3240–3244;
- S. N. Cohen. (2013). DNA cloning: A personal view after 40 years. Proceedings of the National Academy of Sciences. 110, 15521-15529;
- Пожиратели бактерий: убийцы в роли спасителей;
- 12 методов в картинках: микроскопия;
- Повелитель мух;
- 100 лет хромосомной теории наследственности (1915–2015);
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Alu: история одной последовательности;
- Nina V. Fedoroff. (1994). Barbara McClintock, 16 June 1902 - 2 September 1992. Biogr. Mems Fell. R. Soc.. 40, 265-280;
- Артур Корнберг (1918–2007);
- 12 методов в картинках: секвенирование нуклеиновых кислот;
- Мода на ретро. Где встречается обратная транскрипция, и как она эволюционировала;
- 12 методов в картинках: очистка молекул и разделение смесей;
- R. J. Roberts. (2005). How restriction enzymes became the workhorses of molecular biology. Proceedings of the National Academy of Sciences. 102, 5905-5908;
- Игры в демиургов;
- D. Hanahan, E. F. Wagner, R. D. Palmiter. (2007). The origins of oncomice: a history of the first transgenic mice genetically engineered to develop cancer. Genes & Development. 21, 2258-2270;
- РНК у истоков жизни?;
- Asad U. Khan. (2006). Ribozyme: A clinical tool. Clinica Chimica Acta. 367, 20-27;
- 12 методов в картинках: полимеразная цепная реакция;
- Нобелевскую премию по физиологии или медицине вручили за технологию нокаутирования мышей;
- Геном человека: как это было и как это будет;
- В полку генов убыло;
- Сколько сора в нашей ДНК;
- Готовим ГМ-рис вместе;
- Трансгенные растения — спасители планеты или бомбы замедленного действия?;
- Жизнь в эпоху синтетической жизни;
- Синтетическая жизнь;
- С геномом налегке: минимальный размер бактериального генома — это сколько?;
- Деев Р.В. (2013). Генная терапия в России: три года опыта. «Химия и жизнь». 12;
- Roman V. Deev, Ilia Y. Bozo, Nina D. Mzhavanadze, Dmitriy A. Voronov, Aleksandr V. Gavrilenko, et. al.. (2015). pCMV-vegf165 Intramuscular Gene Transfer is an Effective Method of Treatment for Patients With Chronic Lower Limb Ischemia. J Cardiovasc Pharmacol Ther. 20, 473-482;
- CRISPR-эпопея и ее герои;
- Успех в борьбе с лейкозом: на шаг ближе к клиническому применению геномного редактирования;
- Puping Liang, Yanwen Xu, Xiya Zhang, Chenhui Ding, Rui Huang, et. al.. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6, 363-372;
- От слов к делу: технологию CRISPR-Cas впервые применили для лечения онкозаболеваний;
- David Cyranoski. (2016). CRISPR gene-editing tested in a person for the first time. Nature. 539, 479-479;
- Синтетическая хромосома;
- Синтезировать-невысинтезировать!;
- Denis A. Malyshev, Kirandeep Dhami, Thomas Lavergne, Tingjian Chen, Nan Dai, et. al.. (2014). A semi-synthetic organism with an expanded genetic alphabet. Nature. 509, 385-388;
- Yorke Zhang, Brian M. Lamb, Aaron W. Feldman, Anne Xiaozhou Zhou, Thomas Lavergne, et. al.. (2017). A semisynthetic organism engineered for the stable expansion of the genetic alphabet. Proc Natl Acad Sci USA. 114, 1317-1322;
- Berg P., Baltimore D., Boyer H.W., Cohen S.N., Davis R.W., Hogness D.S. et al. (1974). Potential hazards of recombinant molecules. Science. 185, 33;
- Fredrickson D.S. Asilomar and recombinant DNA: the end of the beginning. In: Biomedical Politics / Ed. by Hanna K.E. Washington: National Academies Press, 1991. — pp. 258–292;
- Berg P. (2004). Asilomar and recombinant DNA. Сайт Нобелевского комитета;
- Daniel Gregorowius, Nikola Biller‐Andorno, Anna Deplazes‐Zemp. (2017). The role of scientific self‐regulation for the control of genome editing in the human germline. EMBO Rep.. 18, 355-358;
- Мутагенная цепная реакция: редактирование геномов на грани фантастики;
- Ewen Callaway. (2016). UK scientists gain licence to edit genes in human embryos. Nature. 530, 18-18;
- Глик Б. и Пастернак Дж. Молекулярная биотехнология / пер. с англ. М.: «Мир», 2002. — 589 с.;
- Рак молочной железы с семейной историей;
- Kornberg. A. The golden helix: Inside biotech ventures. University Science Books, Sausalito, California, 1995. — 287 p.;
- Обо всех РНК на свете, больших и малых;
- Regalado A. (2016). The World’s most expensive medicine is a bust. MIT Technology Review;
- Heidi Ledford. (2017). Broad Institute wins bitter battle over CRISPR patents. Nature. 542, 401-401;
- McDivitt P. (2017). Green technology: Disease-resistant GMO tomato that could eliminate need for copper pesticides, double yields–blocked by public fears. Genetic Literacy Project..







