Найти CpG-мотив, или Тонкая работа толл-подобного рецептора 9
21 марта 2015
Найти CpG-мотив, или Тонкая работа толл-подобного рецептора 9
- 1407
- 2
- 2
Вирус уверенно проник бы в клетку и осуществил свои коварные намерения... Если бы не толл-подобные рецепторы!
Рисунок в полном размере.
-
Автор
-
Редакторы
Клеточный толл-подобный рецептор 9 (toll-like receptor 9, TLR9) — один из представителей «первой линии» иммунного ответа организма — специфично связывает вирусные и бактериальные ДНК, образуя характерные m-образные димерные структуры. Взаимодействие с патогенной ДНК происходит благодаря наличию в ней особой составляющей — цитозин-фосфат-гуанин (CpG) динуклеотидного мотива, который избирательно связывается с рецептором в определенных сайтах. Установление кристаллической структуры комплекса «рецептор—мотив» помогло лучше разобраться в особенностях работы этой составляющей врожденного иммунитета.
История открытия толл-подобных рецепторов — это потрясающий путь исследований, берущий начало в 1989 году от революционной идеи Чарльза Джейнуэя и логически завершившийся Нобелевской премией 2011 года [1]. За более чем два десятка лет представление иммунологов о врожденном иммунитете колоссально расширились: на настоящий момент известно большое число его составляющих и исследованы механизмы их работы.
Толл-подобные рецепторы являются первым открытым (но не единственным) и особенно важным классом рецепторов неинфекционного иммунитета. Это трансмембранные белковые молекулы, распознающие широкий класс консервативных структур, принадлежащих патогенным бактериям и вирусам. Эти структуры представляют собой различные фрагменты липополисахаридов клеточных стенок бактерий, белков и гликопротеинов, а также фрагменты вирусной или бактериальной ДНК.
Локализованный в мембране эндосом рецептор TLR9 (один из 10 подобных белков у человека) распознает СpG-динуклеотид в составе одноцепочечной ДНК [2]. В отличие от млекопитающих, у которых СpG-мотив встречается гораздо реже и зачастую метилирован, у бактерий и вирусов данный динуклеотид более распространен и в большинстве случаев не метилируется [3].
Подробное исследование особенностей связывания СpG-мотива с рецептором показало, что иммуностимулирующая активность динуклеотида зависит от нескольких важных факторов.
Первым и самым очевидным из них является количество неметилированных последовательностей цитозин-гуанин во «враждебной» ДНК. Чем больше СpG-мотивов присутствует в нуклеотидной цепи бактерии, тем большее количество рецепторов будет ее связывать.
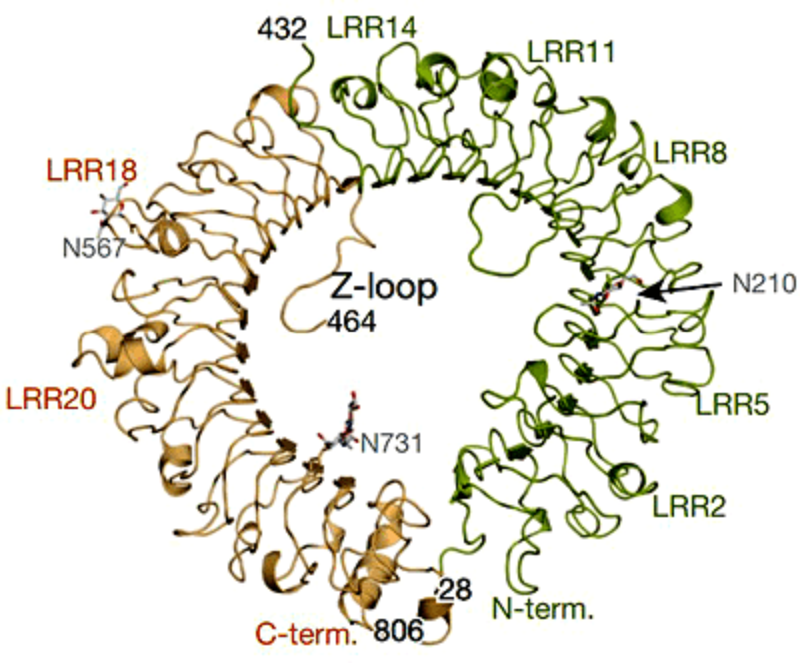
Рисунок 1. LRR-области придают рецептору TLR9 форму «подковы».
Второй особенностью, которую удалось выявить, является определенный «шаблон» мотива, выражаемый формулой RRCGYY (где С — цитозин, G — гуанин, а R и Y — любые пуриновые и пиримидиновые основания соответственно). Примечательно, что инверсия C и G приводит к образованию только неактивного мономерного комплекса TLR9—СpG, в то время как формирование активного подразумевает димерную m-образную структуру с соотношением рецептор:лиганд равным 2:2 [4].
Третьим фактором выступает процессинг рецептора, который необходим для образования стехиометрического димера. Если процессинга не было либо он проходил неверно, образовывались практически лишь мономерные формы. Несвязанный димер TLR9 представляет собой так называемую Z-петлю, состоящую из участков, богатых лейцином (leucine-rich repeat, LRR) (рис. 1).
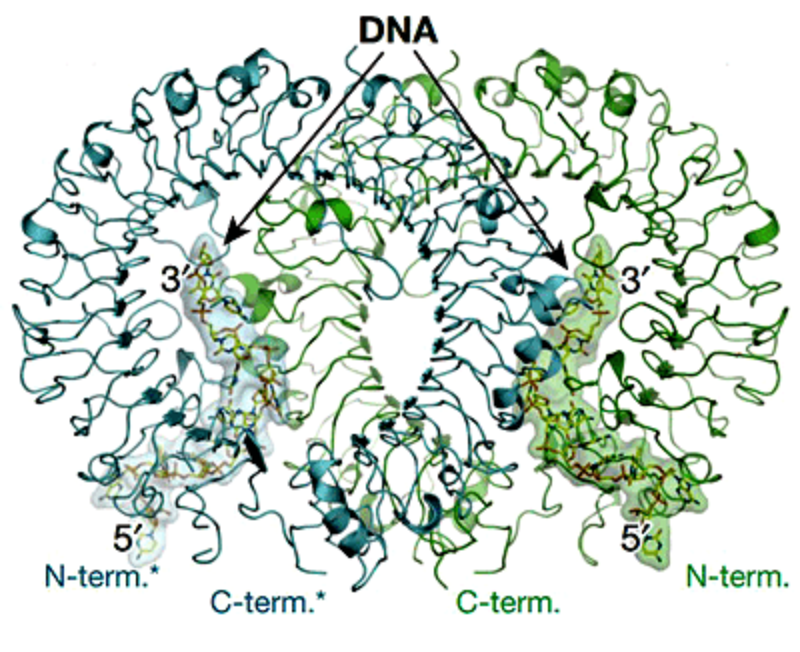
Рисунок 2. M-образный комплекс TLR9-СpG в стехиометрическом соотношении 2:2.
Механизм связывания СpG-мотива с сайтом рецептора авторы исследования красноречиво окрестили «молекулярным клеем» [4]. Фрагмент одноцепочечной ДНК обвивается вокруг рецептора, начиная с N-конца белковой молекулы и охватывая несколько LRR-сайтов. Именно одна нуклеотидная цепь может плотно облегать необходимые участки TLR9: при попытках использования в экспериментах двухцепочечной ДНК аффинитет рецептора резко снижался.
Сам СpG-мотив, согласно вышеуказанному шаблону представленный в виде гексамера, образовывал сложную систему водородных связей с двумя десятками аминокислот и дополнительно координировался Ван-дер-Ваальсовыми взаимодействиями еще с десятком остатков. Важно, что подобной «атаке с флангов» подвергаются две молекулы ДНК, поскольку связанный комплекс рецептора существует в виде гомодимера (рис. 2). Несмотря на обилие аминокислот, связывающих СpG-мотив, мутации некоторых из них даже по отдельности могут серьезно понизить «налипание» динуклеотида на рецептор [4].
Чем может быть полезно такое глубинное выявление особенностей работы TLR9? Конечно же, созданием таргетных препаратов для стимуляции или, наоборот, ингибирования активности этих рецепторов. Нарушения в работе иммунной системы (как в сторону активации, так и супрессии) лежат в основе множества инфекционных и аутоиммунных заболеваний. Знание структуры и механизмов работы участников врожденного иммунитета, несомненно, позволит проводить их регуляцию и возвращать «сбившиеся» параметры в норму.
Видео 1. Механизм работы толл-подобных рецепторов определяет связь между системами врожденного и приобретенного иммунитета.
Литература
- Толл-подобные рецепторы: от революционной идеи Чарльза Джейнуэя до Нобелевской премии 2011 года;
- Mark Rutz, Jochen Metzger, Tanja Gellert, Peter Luppa, Grayson B. Lipford, et. al.. (2004). Toll‐like receptor 9 binds single‐stranded CpG‐DNA in a sequence‐ and pH‐dependent manner. Eur J Immunol. 34, 2541-2550;
- Элементы: «Иммунология в ожидании прорыва»;
- Umeharu Ohto, Takuma Shibata, Hiromi Tanji, Hanako Ishida, Elena Krayukhina, et. al.. (2015). Structural basis of CpG and inhibitory DNA recognition by Toll-like receptor 9. Nature. 520, 702-705.