
«Нано» резать!
27 сентября 2016
«Нано» резать!
- 457
- 1
- 1
-
Автор
-
Редактор
Статья на конкурс «био/мол/текст»: В давние века люди использовали в качестве инструментов заточенные камни. Затем им на смену пришли металлические изделия, надолго закрепившиеся в руках у людей. Однако наука продолжает искать более точные и эффективные орудия для достижения целей. При операциях на клетках и тканях долгое время использовали классические металлические, стеклянные и пластиковые инструменты. В XX веке появились оптические инструменты, которые позволили ученым проводить субмикроскопические операции с клетками и внутри них. Лазерные импульсы, воздействуя на клетку в течение нескольких фемтосекунд (10−15 с) могут вносить нанометровые (10−9 м) разрезы. В этой статье будут кратко описаны прошлое, настоящее и возможное будущее фемтосекундной лазерной нанохирургии.
Как все начиналось
О возможности применения света для проведения операций на биологических объектах заговорили еще в 1912 году. Первым этот метод, который позже был назван «ультрафиолетовым микроуколом», применил российский ученый, биофизик С.С. Чахотин. Он сам сконструировал установку из микроскопа, источника УФ-излучения и оптических элементов. В качестве источника излучения он использовал искру, возникающую между магниевыми электродами. Разработанная установка позволяла сфокусировать луч света размером от 5 до 2 мкм на препарате. Чахотин облучал светочувствительные глазки эвгленовых водорослей, чтобы изучить их фототаксис, с помощью света партеногенетически активировал яйца морских ежей, исследовал влияние света на водоросли и грибы [1].
Позже, в 50-х годах, этот инструмент доработали Бессис и Номарский, которые смогли сфокусировать ультрафиолетовый луч уже на субмикронные объекты. Это позволило им проводить опыты на отдельных клеточных органеллах. Однако долгое облучение клеток зачастую сильно травмировало или вовсе убивало их. Требовался другой, более мощный и надежный инструмент.
В 1960 году он появился. Теодор Майнман, американский физик, создал первый рабочий лазер — на основе искусственного рубина. Мощное излучение позволило ученым-фотобиологам сократить время воздействия света на объект до микросекунды. Прошли первые опыты по инактивации органелл: сначала воздействием рубинового лазера в течение 500 микросекунд удалось «отключить» митохондрии в клетке. Затем, уже с помощью аргонового лазера и воздействия всего в течение 20–30 микросекунд, ученые разрезали хромосомы [2]. Эти опыты открыли новые возможности по изучению ядра и функционированию генетического материала. Сейчас в биологических исследованиях чаще всего используют титан-сапфировый лазер, поскольку у него достаточно широкая полоса излучения и большая энергия импульса.
Достаточно быстро лазеры стали использовать повсеместно: в науке, медицине, промышленности и даже косметологии. Разные лазеры имели разные длины волн излучения, мощность, способы активации и др. (табл.). Одним из последних изобретений стал лазер на свободных электронах, спроектированный в 1971 и опробованный уже в 1976 году. Пучок электронов проходит через ряд магнитов и, теряя энергию, преобразуется в поток фотонов. В результате мы получаем мягкое рентгеновское излучение, которое может быть использовано в изучении структур органелл и даже молекул: разрешение таких лазеров стремится к одному ангстрему (0,1 нм), а значит, в будущем можно будет разглядеть даже отдельные атомы*.
* — Подробности можно прочесть в статье: «Фемтосекундные рентгеновские лазеры — кристаллография будущего» [3]. Также «биомолекула» не раз писала о структурной биологии — направлении, призванном определять пространственное строение максимального числа биологических молекул: «Ловля бабочек, или чем структурная геномика поможет биологии», «Структурная геномика меняет курс», «Структуры рецепторов GPCR „в копилку“» и «Лаборатория перспективных исследований мембранных белков: от гена к ангстрему» [4–7]. — Ред.
| Рубиновый | Аргоновый | Лазер на свободных электронах | Титан-сапфировый | |
|---|---|---|---|---|
| Год создания | 1960 | 1964 | 1971 | 1982 |
| Активная среда | Кристалл корунда (окись алюминия [Al2O3]), где часть атомов алюминия замещена ионами хрома (около 0,05 %) | Газ аргон | — | Кристалл корунда (Al2O3), где часть атомов алюминия замещена ионами титана |
| Источник накачки лазера (перевод активной среды в рабочее состояние) | Импульсная лампа | Электрический разряд | Пучок свободных электронов в вакууме | Другой лазер (обычно алюмо-иттриевый) |
| Свет | Красный | Синий и зеленый | Красный | Красный |
| Длина волны | 694,3 нм | не более 514 нм | 0,085–6 нм | 650–1100 нм |
| Мощность излучения | 10–50 мВт | 1–20 Вт | несколько сотен кВт | до 400 мВт |
| Применение | Голография | Офтальмология, накачка других лазеров | Материаловедение, научные исследования, медицина | Спектроскопия, научные исследования |
Чтобы снизить влияние лазера на клетку, ученые решили использовать краткосрочные воздействия. В начале фотобиологического пути речь шла о секундах и минутах, позже — о микросекундах. С развитием лазерных инструментов ученые стали проводить внутриклеточные операции с помощью пикосекундных импульсов, а затем и фемтосекундных [8]. Такие короткие воздействия помогли изучить сверхбыстрые процессы, происходящие в клетке.
Фемтосекундные лазеры могут вносить тонкие изменения в хромосомы, митохондрии и другие органеллы, отдельные органы и ткани [9]. Это возможно, так как резко уменьшается разрешение лазера (до нескольких нанометров), понижается эффект накопления энергии и клетки не страдают от термического или физического шока. Однако, есть и ограничения: при использовании оптических инструментов в клетке образуются активные формы кислорода, которые могут связываться с биомолекулами (например, ДНК, белками или липидами мембран) и вызывать гибель клетки [10].
Вместо хирургической стали — пучок света
До сих пор в классической биологии для микроопераций используют пьезоманипуляторы — микропипетки, микрозонды и микроскальпели, которые управляются механически или электронно. Понятно, что это наносит повреждения клетке, даже если использовать самые маленькие инструменты и действовать ими крайне аккуратно. Лазерный луч фокусируется именно на нужном нам участке клетки и не повреждает соседние. С его помощью можно осуществлять разрезы размером несколько нанометров, управляя с компьютера шириной и длиной луча, а также глубиной разреза (рис. 1).
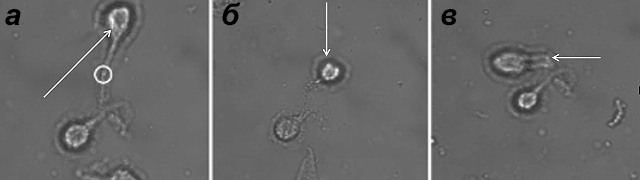
Рисунок 1. Воздействие фемтосекундным лазером на нейроны пиявки и одновременное перемещение клеток с помощью оптической ловушки с использованием фемтосекундного лазерного излучения (ФЛИ). Последовательные кадры видеозаписи: а — начальное положение нейрона; б — смещение нейрона вниз; в — смещение нейрона влево. Стрелками указано направление воздействия фемтосекундного лазера, кружком выделено место воздействия ФЛИ. Рисунок из [11].
Лазером можно не только резать и прокалывать, но также использовать его в качестве... пинцета. Световой пучок захватывает биологический объект и может перемещать его или удерживать в поле зрения в зависимости от цели исследования [11]. Замечательно, что речь идет не только о клетках, но и о субклеточных структурах — можно захватить ядро, ядрышко, различные везикулы и элементы цитоскелета.
В 2008 году, например, исследователи «захватили» молекулу мРНК [12]. Две пластиковые нанобусины были закреплены в «оптических ловушках». К одной из бусин была «пришита» молекула ДНК, которой была комплементарна молекула РНК, появляющаяся с помощью РНК-полимеразы. Манипулируя лазерными лучами, исследователи сводили и разводили бусины, из-за чего молекула РНК сворачивалась и разворачивалась. Всего было записано около 800 «профилей растяжения». После их подробного анализа впервые получилось в режиме on-line проследить за фолдингом синтезирующейся молекулы и даже выявить основные четыре стадии [12]. Разумеется, такое возможно не только с РНК: вероятно, в ближайшем будущем мы сможем прочесть о последовательных процессах сборки ДНК, сворачивании и компактизации хромосом или упаковки белка и других сложных биомолекул.
Где же работают нанохирурги?
Лазерная нанохирургия широко применяется в эмбриологии при редактировании эмбрионов или создании клонов. Для клонирования необходимо создать цитопласт — «пустой» ооцит без ядра или с нерабочим ядром, то есть провести энуклеацию. Классический метод энуклеации заключается в механическом «извлечении» ядра с помощью микропипетки, при чем нарушается мембрана клетки и захватывается часть цитоплазмы. Такой метод достаточно травматичен для клетки и часто заканчивается ее гибелью. С помощью лазера же, напротив, можно парой импульсов достаточно легко инактивировать материал ядра, не повреждая цитоплазму и ядерную мембрану (рис. 2) [13]. После лазерного удаления ядра, или пронуклеуса, ооцит готов к клонированию: в него пересаживают ядро от соматической клетки и наблюдают дальнейшее развитие*.
* — В данном случае мышь все равно остается мышью, а вот если пересадить геном одной бактерии в другую, это фактически приведет к превращению последней в иной организм: «Жизнь в эпоху синтетической жизни» [14]. — Ред.
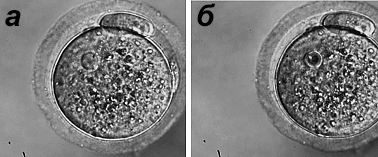
Рисунок 2. Лазерная энуклеация активированных ооцитов мыши. а — Активированный ооцит с ядром. б — После облучения ядра лазером ядро перешло в неактивное состояние. Рисунок из [13].
Что еще можно сделать с помощью наноскальпеля? Например, создать чистую линию животных. Для этого сливают два бластомера — клетки зародыша — и получают тетраплоидный, то есть с удвоенным набором хромосом, эмбрион [15]. При лазерном воздействии в нанолитровом объеме образуется плазма, которая и позволяет «пробуравить» стенки клеток зародыша. В сравнении с эмбрионом область возникновения плазмы крайне мала, что и позволяет проводить слияние без ущерба для зародыша (рис. 3).
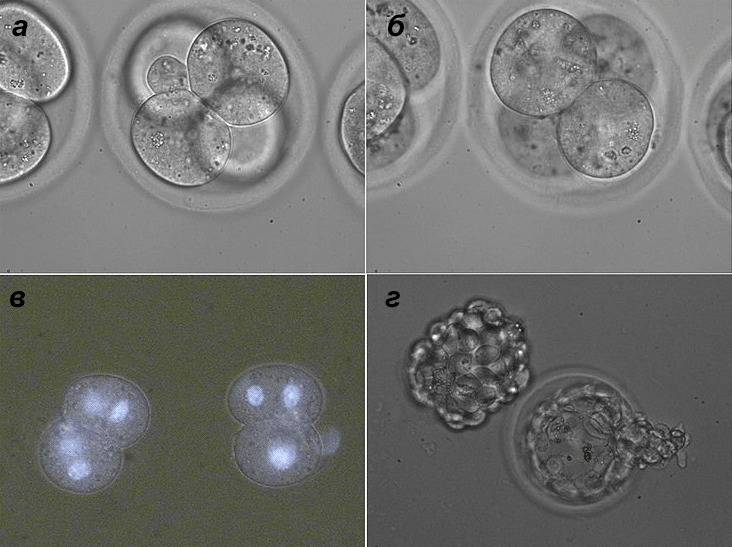
Рисунок 3. Слияние двух пар бластомеров внутри четырехклеточного зародыша крысы. а — Слияние первой пары бластомеров. б — Слияние второй пары бластомеров. в — Двухклеточный зародыш, полученный в результате слияния. Окраска Hoechst 33342 подтверждает двойной набор ядер в каждом бластомере. г — In vitro развитие эмбрионов: вылупившийся и вылупляющийся зародыши. Рисунок из [15].
Как и контрольные, не слитые, эмбрионы, опытные прекрасно растут до стадии бластоцисты, и тогда в них вносят эмбриональные диплоидные клетки животного нужной линии. Чаще всего это трансгенные клетки, например, меченые флуоресцентной меткой*. Природа придумала отличный способ борьбы с неполадками в эмбрионе — внесенные диплоидные клетки постепенно оттесняют клетки с неправильным набором хромосом, которые в итоге становятся его материнской частью — формируют плаценту, хорион и пуповину. В итоге, получается трансгенное животное, полностью состоящее из интересующих исследователей клеток. Потом этого «мутанта» можно пересадить матери-реципиенту: эмбрион приживается в матке и через 14–16 дней рождаются крысята, светящиеся под УФ светом.
* — О флуоресценции, биолюминисценции и различных флуоресцентных репортерах рассказано в статьях: «Флуоресцентные репортеры и их молекулярные репортажи» и «Биолюминесценция: возрождение» [16, 17]. — Ред.
Лазеры могут помочь и в борьбе с раком. В одной из работ исследователи с помощью антител «навешивали» на клетки металлические шарики размером 70 нм. При облучении пикосекундными импульсами происходило неравномерное нагревание оболочки шарика. Манипулируя «горячими областями», инкрустируя клетку разным количеством «бусинок», можно добиться полной фрагментации клеток или локальной оптопорации [18]. Такой фототермолиз — нагревание светом — может убивать раковые клетки. Стоит только ввести необходимые антитела, увешанные металлическими «бусинками».
С помощью лазерных импульсов можно точечно нокаутировать клетки внутри 3D-кластера. Это особенно важно в культурах стволовых клеток (рис. 4), в них часто происходит спонтанная дифференцировка, что снижает чистоту популяции и может привести к образованию тератом [19].
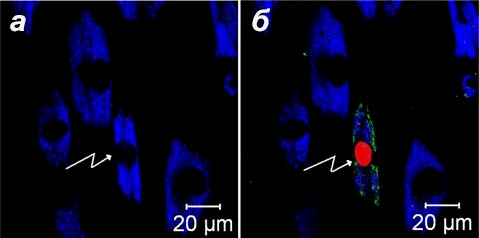
Рисунок 4. Лазерное воздействие на человеческую стволовую клетку поджелудочной железы путем одиночного облучения (200 мВ, 10 мс) привело к появлению флуоресценции апоптотических маркеров аннексина V-Aleха Fluor (зеленый) и этидиум бромида (красный). а — До облучения. б — Через 5 минут после воздействия. Рисунок из [19].
Свой опыт
Сейчас я работаю в институте химической физики имени академика Семенова. Мои коллеги используют лазеры для различных целей: кто-то совершенствует оптоперфорацию стенок клеток [20], кто-то создает «зеленых» мышей, вводя стволовые клетки в зародыш только с помощью лазера [21] или изучает структуры клеток. Моя работа заключается в изучении влияния лазерного излучения на зародыши. Выше я писала о возможностях слияния эмбрионов и получения тетраплоидных бластомеров. Эмбрионы развиваются нормально, не отличаются в темпах роста или в морфологии от своих необлученных собратьев. А можно ли работать с зародышами на более ранних стадиях? Что если мы будем редактировать еще неоплодотворенную яйцеклетку? В мире уже ведутся исследования по созданию «ребенка от трех родителей» [22] — можно ли внести митохондрии в ооцит с помощью лазера, и что мы получим?
Напишу небольшой спойлер: мы активно работаем с незрелыми ооцитами и после воздействия на них лазерными инструментами, и они великолепно превращаются в жизнеспособные яйцеклетки, готовые к дальнейшему оплодотворению. Выходит, лазерные инструменты действительно безопасны? Пока работа не окончена, рано делать выводы, однако мы надеемся доказать их универсальность и показать удобство работы с ними.
Итак...
Надеюсь, я показала вам, что фемтосекундные лазеры — неотъемлемые участники наноопераций. Пока что это единственный неинвазивный инструмент, который можно использовать для манипуляций на наноуровне. Конечно, многое еще не исследовано, поэтому далеко не все возможности используются. Однако метод развивается, и возможно, что оптический «наноскальпель» и «нанопинцет» будут и дальше уменьшаться*. Может быть когда-нибудь мы будем говорить уже об инструментах с приставками атто- и иокто-, которые будут работать с отдельными молекулами или атомами, или даже с субатомными частицами. А пока — до работы со столь малыми величинами нам еще расти и расти.
* — За разработку метода флуоресцентной микроскопии сверхвысокого разрешения («наноскопию») в 2014 году Нобелевская премия по химии была присуждена Эрику Бетцигу, Штефану Хеллю и Уильяму Мернеру, о чьих открытиях можно прочесть в статье «По ту сторону дифракционного барьера: Нобелевская премия по химии 2014» [23]. — Ред.
Литература
- Посудин Ю.И. Биофизик Сергей Чахотин. Киев: Изд-во Нац. аграрного ун-та, 1995. — 98 с.;
- Berns M.W., Olson R.S., Rounds D.E. (1969). Argon laser micro-irradiation of nucleoli. J. Cell Biol. 43, 621–626;
- биомолекула: «Фемтосекундные рентгеновские лазеры — кристаллография будущего»;
- Ловля бабочек, или Чем структурная геномика поможет биологии;
- Структурная геномика меняет курс;
- Структуры рецепторов GPCR «в копилку»;
- биомолекула: «Лаборатория перспективных исследований мембранных белков: от гена к ангстрему»;
- Kohli V. and Elezzabi A.Y. (2009). Prospects and developments in cell and embryo laser nanosurgery. Wiley Interdiscip. Rev. Nanomed. Nanobiotechnol. 1, 11–25;
- Fang-Yen C., Gabel C.V., Samuel A.D.T., Bargmann C.I., Avery L. (2012). Laser microsurgery in Caenorhabditis elegans. Methods Cell Biol. 107, 177–206;
- Kuetemeyer K., Rezgui R., Lubatschowski H., Heisterkamp A. (2011). Mechanisms of femtosecond laser cell surgery in the low-density plasma regime. SPIE Proceedings. 7897. doi: 10.1117/12.874147;
- Барбашов Ю.В., Залесский А.Д., Березуцкая М.А., Максимов Г.В., Рубин А.Б., Саркисов О.М., Надточенко В.А. (2012). Нелинейно-оптическое воздействие фемтосекундного лазерного излучения ближнего ИК диапазона на морфологию и структуру нервной клетки в поле оптической «ловушки». Хим. Физика. 31, 9–15;
- Фолдинг «воочию»;
- Шахбазян А.К., Свиридова-Чайляхан Т.А., Карменян А.В., Кривохарченко А.С., Чои А., Чайлахян Л.М. (2009). Использование лазера для получения реципиентных цитопластов при пересадке ядер у млекопитающих. Докл. Акад. Наук. 428, 1–4;
- Жизнь в эпоху синтетической жизни;
- Krivokharchenko A., Galat V., Ganten D., Bader M. (2002). In vitro formation of tetraploid rat blastocysts after fusion of two-cell embryos. Mol. Reprod. Dev. 61, 460–465;
- биомолекула: «Флуоресцентные репортеры и их молекулярные репортажи»;
- биомолекула: «Биолюминесценция: возрождение»;
- Avetisyan Y.A., Yakunin A.N., Tuchin V.V. (2011). Novel thermal effect at nanoshell heating by pulsed laser irradiation: hoop-shaped hot zone formation. J. Biophotonics. 5, 734–744;
- Uchugonova A., Isemann A., Gorjup E., Tempea G., Bückle R., Watanabe W., König K. (2008). Optical knock out of stem cells with extremely ultrashort femtosecond laser pulses. J. Biophotonics. 1, 463–469;
- Барбашов Ю.В., Залесский А.Д., Айбушев А.В., Саркисов О.М., Радциг М.А., Хмель И.А. и др. (2011). Фемтосекундная оптоперфорация стенки цианобактерии Anabaena sp. PCC 7120 в присутствии наночастиц золота. Российские нанотехнологии. 6, 32–37;
- Шахбазян А.К., Тарантул В.З., Залесский А.Д., Рябова А.В., Лощенов В.Б., Антонов С.А. и др. (2013). Получение химерных бластоцист мыши методами лазерной нанохирургии. Онтогенез. 44, 403–408;
- биомолекула: «Трое в лодке: о легализации замены митохондрий»;
- биомолекула: «По ту сторону дифракционного барьера: Нобелевская премия по химии 2014»..





