
Жизнь в эпоху синтетической жизни
15 июня 2010
Жизнь в эпоху синтетической жизни
- 3184
- 10
- 4
Лавры бога достойны честолюбия Крейга Вентера. На фоне — трансмиссионная электронная микрофотография делящихся клеток нового «синтетического» штамма M. mycoides JCVI-syn1, полученного в Институте Его имени.
-
Автор
-
Редакторы
Не часто бывает, чтобы научное открытие, даже опубликованное на страницах самого престижного научного издания, мгновенно облетело весь мир, запестрев даже на страницах бульварных газет. Однако именно эта судьба постигла последнюю работу одиозного молекулярного биолога, основателя института имени себя, «современного Джеймса Уотсона» — словом, Дж. Крейга Вентера. В институте «его имени» (JCVI) собрали, модифицировали и имплантировали синтезированный «с нуля» геном в бактериальную «оболочку», получив в результате «рабочий» микроорганизм Mycoplasma mycoides. Мы приводим высказывания восьми учёных по этому поводу, собранные и опубликованные журналом Nature.
Сила и слабость
Марк Биду (Mark Bedau),
профессор философии и гуманитарных наук, Колледж Рида, Орегон (США)
«Синтетическая клетка» Крейга Вентера [5] — это обычная бактерия с искусственно созданным геномом. А поскольку генóм составляет не более 1% от сухой массы клетки, только небольшую её часть и можно называть синтетической. Впрочем, генóм — это особый компонент, который несёт всю наследственную информацию и «управляет» всеми процессами, происходящими в клетке.
Умение создавать искусственные геномы — это, бесспорно, огромный шаг вперёд по сравнению с давно уже ставшей привычной инженерией отдельных генов. Искусственный генóм, синтезированный в Институте Вентера, фактически повторяет генóм существующего микроорганизма, за исключением небольшого числа мест, где синтез произошёл с ошибкой, и специально добавленных «водяных знаков» (в частности, адресов электронной почты некоторых из авторов работы). Никакие технологические ограничения не препятствуют тому, чтобы двигаться дальше: любая часть этого генома может быть модифицирована угодным исследователям способом. По сравнению с полученной в JCVI «сегодня», «завтрашняя» синтетическая клетка будет действительно новой формой жизни, которую Земля ещё не видывала.

Рисунок 1. Крейг Вентер у штурвала своей яхты «Чародей II», которая, хоть не так велика и дорогá, как судно Романа Абрамовича, зато использовалась в значительно более интересных целях, нежели вояж на чемпионат мира по футболу в ЮАР. Несколько лет назад на этой яхте Вентер совершил кругосветное плавание, в процессе которого «выловил» из вод пяти океанов генетическую информацию тысяч неизвестных ранее вирусов и бактерий [10]. Такие генетические последовательности, полученные из природных систем, стали называть метагеномом.
Однако самое важное здесь иное, нежели просто биотехнологические (и в частности генно-инженерные) инновации: я перечислю лишь четыре из наиболее очевидных научных и социальных последствий этих достижений.
Во-первых, создание «искусственной жизни» открывает неслыханные перспективы в изучении молекулярных основ жизни «обычной». Держать под контролем весь генетический код — значит иметь небывалую возможность разгадать многие из до сих пор не поддающихся «секретов жизни».
Во-вторых, даже простейшие жизненные формы с завидным постоянством демонстрируют неожиданные и непредсказуемые качества. Часто эти качества могут быть полезны, но, в связи с непредсказуемостью поведения, традиционная биоинженерия не может дать надёжного способа «укрощения». Возможно, синтетическая биология предложит свой подход к решению этой задачи.
В-третьих, новоприобретённая мощь, несомненно, порождает новую ответственность. Никто не знает, к каким последствиям приведёт создание новых форм жизни, но это означает лишь, что надо быть готовыми к любым последствиям. Нужно ожидать появления новой области, со всей ответственностью прогнозирующей потенциальные риски и дающей рекомендации по предотвращению возможных последствий.
Ну и, наконец, в-четвёртых, искусственный геном предвосхищает тот день, когда жизнь сможет быть синтезирована по-настоящему — полностью из неорганических материалов и «без оглядки» на организацию существующих организмов. А это уже в который раз вернёт к «жизни» извечный философский вопрос — что такое жизнь, каково её предназначение в мироздании и играет ли здесь человечество какую-то особенную роль. А эти вопросы, хотя точно не относятся и научным и вряд ли когда-нибудь по настоящему будут разрешены, привлекают к себе умы людей снова и снова.
Подешевле, пожалуйста
Джордж Чёрч (George Church),
генетик, Медицинский факультет Гарварда (США)
Замечательно, что мы живём в эпоху фантастических достижений, подобных работе Института Вентера. Но можем ли мы, не покривив душой, говорить, что в JCVI действительно создали искусственную жизнь? Навряд ли. Полусинтетическая микобактерия по большинству параметров нисколько не отличается от своих «диких» собратьев. Скопировать древний текст — далеко не то же самое, что понять, о чём в нём говорится. Встроенная в клетку и работающая ДНК — это уже далеко не новинка, хотя раньше речь шла, конечно, не о целых геномах, а об отдельных генах. Намного сложнее понять устройство всей машины в целом — того аппарата, который выполняет «инструкции», записанные в геноме. Всё это ещё предстоит долгие годы (если не столетия) изучать биохимикам, генетикам и структурным биологам.
Синтетическая жизнь в состоянии сообщить нам кое-что новое о жизни «обычной». «Раздраконивание» геномов может показать, чтó мы упустили в смысле скорости, эффективности и устойчивости. По этим параметрам быстрая и устойчивая Escherichia coli является отраслевым стандартом по сравнению с более медлительной и прихотливой микоплазмой. Однако достижения в области синтеза геномной ДНК в перспективе позволяют воплотиться в реальность мечтам, возможным только при операциях на целых геномах — например, созданию клеток, устойчивых ко всем разновидностям вирусов, ферментов или химикатов. С этих позиций новое достижение команды Вентера — 1,08 миллионов пар нуклеотидов (против тех 0,58, что были у них раньше [4]) — это существенный скачок вперёд.
Теперь, когда создание новых форм жизни с потенциально опасными свойствами становится реальностью, необходимо уделять особое внимание процедурам регуляции и контроля, защищающим природу и общество от ошибок исследователей или актов биологического терроризма. Это должны быть реалистичные лабораторные экосистемы для наблюдения за развитием и поведением новых форм жизни, их устойчивостью, способностью интегрироваться в существующие экологические сети и обмениваться генетической информацией «на воле».
Что теперь действительно необходимо, это способность конструировать и тестировать миллионы генетических комбинаций с помощью белковых и РНКовых биосенсоров, регистрирующих особенности метаболизма и межклеточной сигнализации новых микроорганизмов. В дополнение к технологиям, которые показали в Институте Вентера (но, естественно, во много раз удешевлённым), это позволит исследователям выработать новый подход к получению новых лекарственных форм, биотехнологических топлив, стереоспецифических химикатов и био(нано)материалов.
«Снизу вверх» было бы честнее
Стин Расмуссен (Steen Rasmussen),
профессор физики, Университет южной Дании
Создание синтетического генома и помещение его внутрь клетки — это важнейшая веха на пути постижения тайн жизни. Однако генетическая инженерия по бескомпромиссному принципу «сверху вниз», которого придерживаются соратники Вентера, не совсем соответствует моему пониманию «синтетической клетки».
Оба противоборствующих лагеря синтетических биологов — приверженцы подходов «сверху вниз» и «снизу вверх» — пытаются проникнуть в основы жизни. Апологеты методологии «сверху вниз», яркими представителями которых являются Вентер со товарищи, пытаются «переписать» генетическую программу и запустить её на том же «железе» (то есть, заставить изменённый генетический код работать в той же самой клетке). Исследователи, работающие по принципу «снизу вверх» (к которым принадлежу и я), стремятся синтезировать жизнь — и «железо», и «код»! — в максимально простой форме, даже если результат будет не совсем совпадать с общепринятым представлением о живом.
Исследователи, придерживающиеся в синтетической биологии концепции «снизу вверх», уверены, что «сборка» жизни из отличных от использованных природой материалов, да ещё по другим «чертежам», научит нас гораздо большему, чем когда мы просто копируем привычные формы.
Два наших лагеря до недавнего времени практически не пересекались — в основном, из-за разного угла зрения на общую, казалось бы, цель, а также из-за совершенно различных используемых методик. Теперь же, после ряда успехов в обоих лагерях, взаимодействие появляется и становится более тесным: многие проекты уже включают сторонников обоих подходов — отличным примером этого является как раз синтетический геном.
Конец витализма
Артур Каплан (Arthur Caplan),
профессор биоэтики, Университет Пенсильвании (США)
Вентер и его коллеги продемонстрировали, что «банальные» манипуляции с объектами материального мира могут использоваться для создания того, что мы называем Жизнью. Их достижение, несомненно, приближает к концу спор о природе жизни, который длится уже тысячи лет. Возможно, по важности для осознания места человека во Вселенной эта работа стоит в одном ряду с открытиями Галилея, Коперника, Дарвина и Эйнштейна.
Более ста лет назад французский философ Анри Бергсон постулировал, что жизнь невозможно объяснить исключительно с механистических позиций. Соответственно, жизнь невозможно создать, соединяя вместе синтезированные молекулы. Он утверждал, что существует élan vital — жизненная сила, принципиально различающая живую и неорганическую материю. И никакие манипуляции с неживой материей принципиально неспособны создать что-либо, к чему применимо слово «живой».
Эта точка зрения, называемая витализмом, донесена до наших дней через века. Гален писал про «дух живого» во втором веке; Луи Пастер с целью объяснения существования жизни в 1862-м году искал «живительный импульс»; биолог Ханс Дриш говорил о «живительной силе» как о неизменном атрибуте жизни в 1894-м. Однако наука XX века — с молекулярной биологией в авангарде — упорно подбирала аргументы не в пользу витализма, разбирая всё новые и новые жизненные процессы до материалистических «шестерёнок». В то же самое время христианство, ислам и иудаизм, также как и остальные религии, продолжали утверждать, что в основе жизни — по крайней мере, человеческой, — находится душа.
И вдруг на все эти метафизические воззрения брошена тень научными исследованиями, которые довольно бесцеремонно создают жизнь из неживых «кусочков», пускай пока что изготовленных по «лекалам» живой клетки. Работы Института Вентера, по-видимому, разрушают тот аргумент, что для существования жизни необходима какая-то особенная нематериальная сила. По-моему, одно это ставит упомянутые достижения на пьедестал наиболее существенных научных открытий в истории человечества.
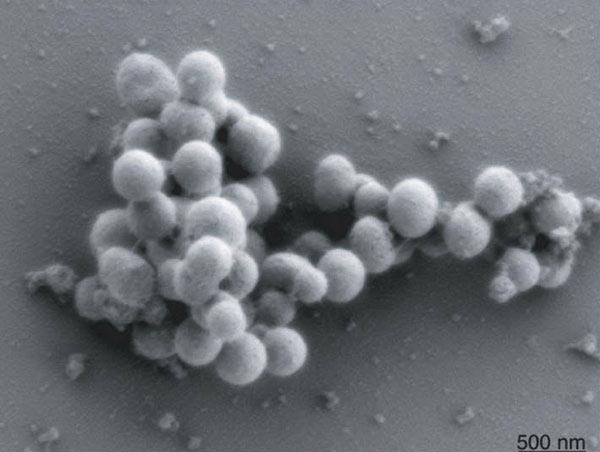
Рисунок 3. Бактерии с химически синтезированным геномом быстро размножаются и внешне практически не отличаются от «диких» бактерий Mycoplasma mycoides
Синтез у руля инноваций
Стивен Беннер (Steven Benner),
Фонд прикладной молекулярной эволюции, Гайнсвилль, Флорида (США)
Синтез сам по себе — не научная область. Однако это основа исследовательской стратегии в любой области науки, где технология позволяет проектировать новые объекты для исследования. Так, технология химического синтеза надолго позволила теории в области химии развиваться более интенсивными темпами, чем в областях, где синтез был недоступен, — например, в планетологии или в биологии.
В биологии переломный момент произошёл в 1970-х, когда биотехнология впервые представила инструменты биологического синтеза. Сначала биологи и генные инженеры могли только вырезать или вставлять отдельные гены, лишь «перемешивая» доступное изначально. Позже, в начале 1980-х, синтетические биологи сумели отклониться от заложенного природой пути, синтезируя гены и создавая искусственные генетические системы и белки с числом аминокислот, превышающим природные двадцать .
Кстати, сейчас уже получены «ортогональные» рибосомы, способные считывать генетический код не триплетами, а квадруплетами, используя для синтеза белкá неприродные аминокислоты — см., например, «Слово из четырёх букв» [8]. — Ред.
Однако чтобы добиться большего, чем просто перемешивание исходных компонентов, синтетический подход обязательно должен находиться «впереди планеты всей», заставляя учёных биться над всё новыми и новыми вопросами. Таким образом, синтез управляет курсом исследований и определяет направление технологических инноваций принципиально иным образом, нежели просто наблюдение и анализ.
Главное, что можно извлечь из последней публикации сотрудников Крейга Вентера, — это что синтез и клонирование генома размером 1,08 млн. пар нуклеотидов является чем-то большим, нежели просто «расширением» работы 1984 года по синтезу гена размером 330 п. н. [9]. Увеличение длины синтезируемого участка ДНК более чем в 3000 раз породило на свет впечатляющий букет технологий синтеза, верификации и манипуляции большими объемами генетической информации.
Результаты исследователей из JCVI могут даже перебросить мостки между химией и естественной историей. Исходя из последовательностей геномов тех микоплазм, с которыми работали учёные — M. capricolum, M. genitalium и M. mycoides — можно восстановить генетический код вымерших микроорганизмов — предков современных микоплазм. Новые технологии позволяют «оживить» такие организмы и изучить их метаболизм и «повадки». Эти данные смогут немало рассказать об экологии микробных сообществ, существовавших на Земле 100 млн. лет назад, — и однажды даже планетология выиграет от сотрудничества с синтетической биологией.
Естественные пределы ещё никто не отменял
Мартин Фуссенеггер (Martin Fussenegger),
профессор биотехнологии и биоинженерии в Швейцарской высшей технической школе в Базеле
На счету исследователей из JCVI впечатляющий послужной список: трансплантация целых геномов между родственными видами прокариот, сборка модифицированных геномов из протяжённых участков синтетической ДНК, направленная модификация хромосом для обхода ограничений, существующих в клетке. Теперь к этому списку добавляется ещё одна яркая строчка: они с высокой точностью собрали геном «с нуля», фактически «запрограммировав» целый микроорганизм.
Конечно, это скорее технологический, а не концептуальный прорыв. Организмы-химеры давно уже создавались путём скрещивания, а с недавних пор — «пересаживанием» цельных геномов в клетки с отсутствующим ядром. Что интересно, природа во всех случаях как бы «противится» слишком большому темпу генетических изменений: мулы, хотя и замечательны по многим качествам, стерильны, а генетические клоны, подобные знаменитой трансгенной овечке Долли, наследуют биологический возраст донора генома (другими словами, быстро умирают).
Технологическая демонстрация Вентера наглядно показывает, как можно «перейти от возможности чтения генетического кода к его записи». Однако нет никаких гарантий, что написанное будет нести в себе хоть какой-то смысл. А если и будет, то закончиться всё может как сказка, драма, научная фантастика или документальный триллер — на выбор.
За время своего существования на планете, человечество редко создавало что-то принципиально новое; по большей части, это было усовершенствование и усложнение уже существовавшего. Так же и сейчас: новая технология просто увеличит скорость, с которой можно получать новые организмы.
Но эта скорость, вместе с бешеным темпом биотехнологических новшеств, уже вызывает дискомфорт, всегда, впрочем, сопутствующий технологическим прорывам. А если организм с синтетическим геномом и в самом деле окажется практически полезным, ему предстоит выйти из «тепличных» условий лаборатории и переместиться в более естественные для живых организмов экосистемы (даже если это будет всего лишь биотехнологический чан). А в этих условиях уже станет понятно — смогут ли они эти микроорганизмы сами обеспечить себе достойное существование среди своих «диких» собратьев.
Химерные организмы содержат хотя и синтетические, но всё же естественные «компоненты», а значит — они подвержены эволюционному процессу, который пока никто не отменял (и обойти не в состоянии). Столкнутся ли «синтетические» организмы на воле с естественными пределами вроде сниженной плодовитости и/или времени жизни — сможет сказать лишь время.
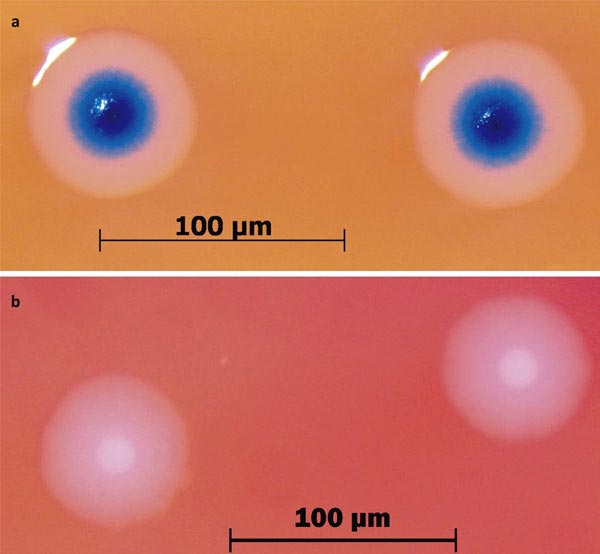
Рисунок 4. Колонии бактерий с синтетическим геномом (вверху) окрашены в синий цвет, потому что их геном содержит ген lacZ, кодирующий фермент бета-галактозидазу. В питательной среде есть вещество X-gal, превращаемое этим ферментом в синий краситель (5,5’-дибромо-4,4’-дихлоро-индиго). «Дикие» бактерии M. mycoides (внизу) не имеют этого гена, поэтому их колонии остаются белыми.
Запчасти есть, а мануала — нету
Джеймс Коллинз (Jim Collins),
профессор биомедицинской инженерии, Университет Бостона (США)
Расслабьтесь — истерику в прессе, раздувающую достижения коллег Вентера до масштабов акта божественного творения, можно смело приравнять к «джинсé». Их работа, бесспорно, существенно продвигает нас в копировании живых организмов, но назвать это созданием жизни «с нуля» никак нельзя.
Микроорганизм из статьи Вентера является синтетическим в том смысле, что его ДНК синтезирована, а не в том, что реально была создана новая форма жизни. То есть, новый геном есть копия с ДНК существующего микроорганизма — с очень небольшими изменениями.
Исследователи, работающие в области синтетической биологии, создают искусственные «схемы» из белков, генов или просто фрагментов ДНК, которые должны придать организму новые качества. Однако эти «схемки» крайне просто устроены и состоят максимум из десятка генов — а это просто меркнет по сравнению с сотнями и тысячами генов живой клетки. На самом деле, очень сложно сделать нормально работающую систему даже всего из двух генов — поведение клетки слишком часто оказывается просто непредсказуемым. Биология принципиально сложна и запутана, и в большинстве случаев не подчиняется принципам рационального конструирования.
Представьте себе, что учёные научились программировать клетки, чтобы те вырастали в искусственное сердце, готовое к трансплантации (кстати, не столь уж нереальная картина). Конечно, счастливчик, жизнь которого будет спасена с использованием этого органа, не будет считаться формой искусственной жизни или синтетическим организмом. Точно в такой же ситуации оказывается и микроорганизм Вентера — только пересаживают ему не сердце, а синтетический геном.
Честно говоря, учёные просто недостаточно знают, чтобы создать искусственную жизнь. И хотя проект «Геном человека» дал нам список «запчастей», для того, чтобы собрать из них работающую клетку, не хватает одной мелочи — «руководства по эксплуатации и ремонту». Ситуация чем-то напоминает попытку собрать аэробус из исходных частей без помощи специалистов — фактически, невыполнимая задача. Некоторые из синтетических биологов, возможно, и страдают от мегаломании, однако реальные наши цели на самом деле довольно скромны.
Происхождение жизни становится ближе
Дэвид Димер (David Deamer),
профессор биомолекулярной инженерии, Университет Калифорнии, Санта-Круз (США)
Достижения учёных из JCVI — это биомолекулярная инженерия высшей пробы. Однако, чего сами авторы и не скрывают, они намеренно воспроизводят уже существующие компоненты жизни, — а, например, цитоплазма «синтетической» клетки вместе со всем содержимым отнюдь не синтетическая. А значит, высказывание врача XVII века Уильяма Гарвея остаётся в силе: Omne vivum ex ovo — «всякая жизнь из яйца». Впрочем, видимо, это ненадолго.
Люди освоили встраивание функциональных генов в бактерии в 1970-х, когда «изобрели» рекомбинантную ДНК. Бактерия захватывает плазмиду, экспрессирует ген и выдаёт требуемый белок. Первое коммерческое использование этого феномена находится на счету биотехнологической фирмы из Сан-Франциско Genentech, которой удалось «уговорить» бактерию E. coli производить рекомбинантный инсулин — это дало начало многомиллиардной индустрии.
Работа Вентера и его коллег вывела этот процесс на новый уровень — теперь можно синтезировать и встраивать целый геном, а не отдельные гены. Чтобы доказать потенциал этой технологии, учёные из JCVI намереваются в будущем получить фотосинтетическую бактерию, которая могла бы использовать энергию света для расщепления воды (с получением водорода), аналогично тому, как дрожжи делают спирт из кукурузного сырья. Если это получится, можно будет освободить миллионы гектар от неэффективного и обременительного для пашен выращивания кукурузы, а вместо этого получать водород в экологически чистых биореакторах, расположенных на бескрайних просторах пустынь.
Теперь, когда возможность синтезировать бактериальный геном становится обыденной, появляется возможность ответа на один из самых насущных вопросов биологии — как зародилась жизнь? Используя инструментарий синтетической биологии, можно будет отложить в сторону белки и ДНК, сконцентрировавшись на молекуле, которая сама может и катализировать реакции, и переносить генетическую информацию, — РНК. Если удастся спроектировать и синтезировать РНК, катализирующую собственное размножение в условиях искусственной мембраны, — вот тогда можно будет уже всерьёз говорить о создании искусственной жизни в лаборатории, которая, возможно, повторит путь, пройденный первыми живыми формами на Земле около четырёх миллиардов лет назад.
Литература
- Геном человека: как это было и как это будет;
- Геном Нобелевского лауреата Джеймса Уотсона скоро будет расшифрован;
- Смыслы «жизни»;
- Геном, собранный вручную;
- D. G. Gibson, J. I. Glass, C. Lartigue, V. N. Noskov, R.-Y. Chuang, et. al.. (2010). Creation of a Bacterial Cell Controlled by a Chemically Synthesized Genome. Science. 329, 52-56;
- Элементы: «Создано первое живое существо с синтетическим геномом»;
- Life after the synthetic cell. (2010). Nature. 465, 422-424;
- Слово из четырёх букв;
- K. Nambiar, J Stackhouse, D. Stauffer, W. Kennedy, J. Eldredge, S. Benner. (1984). Total synthesis and cloning of a gene coding for the ribonuclease S protein. Science. 223, 1299-1301;
- Shannon J. Williamson, Douglas B. Rusch, Shibu Yooseph, Aaron L. Halpern, Karla B. Heidelberg, et. al.. (2008). The Sorcerer II Global Ocean Sampling Expedition: Metagenomic Characterization of Viruses within Aquatic Microbial Samples. PLoS ONE. 3, e1456.







