
Фемтосекундные рентгеновские лазеры — кристаллография будущего
25 декабря 2015
Фемтосекундные рентгеновские лазеры — кристаллография будущего
- 2396
- 0
- 2
Клеточные структуры в фокусе рентгеновского лазера SLAC.
-
Авторы
-
Редакторы
Метод рентгеноструктурного анализа до сих пор является «золотым стандартом» в исследовании пространственной организации биополимеров, в частности белков. Несмотря на это, он не лишен существенных недостатков и ограничений: необходимые кристаллы трудно получать, кристаллизуемые молекулы обычно помещают в условия, далекие от таковых в клетке (температура, ионная сила и т. п.), получаемая структура зачастую является «средним по палате», а информация о подвижности молекул и вовсе напрямую недоступна. Однако новые фемтосекундные рентгеновские лазеры сулят истинный переворот в области структурной биологии. Возможно, в скором будущем кристаллизовать и вовсе не придется, а исследователи будут снимать «кино» про единичные молекулы с атомарным разрешением.
Нет сомнений, что белки — молекулы, определяющие жизнь. С помощью белковых каналов в нервных клетках мы думаем, с помощью белковых ферментов перевариваем пищу, с помощью белков-антител защищаемся. Но белок работает на нас только тогда, когда правильно сложен, то есть приобрел правильную конформацию, укладку. А какая она, правильная? Вновь синтезированный белок — как квадрат белой бумаги для оригами: можно сложить кораблик, а можно журавля. Конечно, выбор ограничен, но огромен, даже если известна длина белка и все входящие в его состав аминокислоты (в нашей аналогии — размер квадрата бумаги).
Знание структуры белка необходимо в первую очередь для медицинских разработок, особенно для подбора эффективных лекарств — драг-дизайна [1]. Если разработчики будут знать точное место белка-мишени, на которое действует активный компонент лекарства, это и удешевит драг-дизайн (а значит, снизит стоимость лекарства), и — с большой вероятностью — устранит побочные эффекты.
На фоне этой необходимости родилось новое направление биологии — структурная геномика, которая, комбинируя компьютерное моделирование и экспериментальные подходы, ставит амбициозные цели определить структуры всех белков, кодируемых данным геномом . За 15 лет существования программа по структурным исследованиям белков (PSI — Protein Structure Initiative) автоматизировала систему кристаллизации и анализа, охарактеризовала около 7000 белков, но породила некоторые споры [2]. Дело в том, что охарактеризованные белки большей частью бактериальные, функции их не всегда известны, и подходят они разве что для «соревнований» компьютерных программ предсказания белковых структур по последовательности аминокислот (I-TASSER и Rosetta), но не для целей драг-дизайна [3].
В структурной геномике для изучения строения белков часто применяют метод рентгеноструктурного анализа. Он основан на взаимодействии рентгеновского излучения с молекулами, пространственную структуру которых необходимо определить. При падении на объект рентгеновских лучей может происходить их поглощение, отражение или дифракция. Дифракция в данном случае — это рассеяние рентгеновских лучей молекулами вещества, при котором из начального пучка лучей возникают вторичные отклонённые пучки той же длины волны. Картина такого рассеяния рентгеновских лучей, зафиксированная на светочувствительном материале, — рентгенограмма — дает исследователям информацию о строении изучаемой молекулы. Подробнее о структурной геномике «биомолекула» рассказывала в статье «Ловля бабочек, или чем структурная геномика поможет биологии» [4].
Однако основное возражение куда более конструктивно, чем «вы определяете структуру не тех белков» (попробуйте, определите структуру «тех»). А такая ли в клетке, in vivo, структура белка, как вы определили? Это указывает на слабое место современной структурной биологии. Главный физический метод, которым она оперирует, — рентгеноструктурный анализ — работает с кристаллами, а при кристаллизации белок может сложиться не так, как в клетке. Кроме того, кристалл не может показать конформационных изменений, происходящих при модификации белка или взаимодействии фермента с субстратом, не говоря уже о том, что мембранные белки — рецепторы и каналы (как раз первые цели лекарств) — вообще плохо кристаллизуются. Однако луч света — яркого света лазеров на свободных электронах — уже забрезжил в темном царстве.
РЛСЭ в структурной биологии
Недавние разработки в области рентгеновских лазеров на свободных электронах (РЛСЭ, XFEL, X-Ray Free-Electron Laser) открывают совершенно новые возможности для структурной биологии. Еще в конце прошлого столетия невозможно было поверить, что появится возможность получать изображения единичной молекулы, используя рассеяние электромагнитного излучения, поскольку необходимые для наблюдения высокоуглового упругого рассеяния дозы излучения попросту разрушат исследуемый объект [5]. Позднее было высказано предположение, что использование кратковременных импульсов позволит избежать разрушений [6]. Если в исследовании применить «мгновенный» и сверхинтенсивный рентгеновский пучок, то картину упругого рассеяния без искажений от разрушения объекта можно будет получить вне зависимости от дозы излучения, разрешения и размера образца — вплоть до уровня единичной молекулы. Фактически молекула «расскажет» о себе всё, еще не успев разрушиться. А там — будь что будет.
Современные эксперименты показали, что, если доза излучения передается за короткое время, действительно можно получить картину рассеяния без следов разрушения [7]. В данном случае рассеяние происходит быстрее, чем последующее разрушение образца, что дает возможность получать «молекулярные снимки» в режиме «рассеяние-до-разрушения». Однако неизбежное разрушение объекта после прохождения луча требует постоянного обновления образца — подбора частиц с идентичными характеристиками: молекул белка и их олигомеров, вирусов и т.д. Достичь атомного разрешения при использовании методики «рассеяние-до-разрушения» возможно только с помощью когерентного суммирования Брэгговского рассеяния от нанокристаллов.
Если «молекулярные снимки» получены для множества случайных ориентаций и молекула имеет предположительно ограниченное число конформаций, то появляется возможность отсортировать полученные данные и объединить их в трехмерное «молекулярное кино». При этом, как было показано в вычислительных экспериментах [8], для реконструкции требуется, чтобы конформационные и ориентационные изменения можно было различить.
Принцип работы систем с использованием РЛСЭ (физика)
На сегодняшний день уже очевидно, что только технические характеристики РЛСЭ и инжекторов образцов (яркость, диаметр пучка, частота повторения импульсов, коэффициент попадания, фоновые эффекты от растворителя и т.д.) ограничивают получение картины рассеяния на уровне единичных молекул.
Рассмотрим физические основы метода РЛСЭ. Для получения лазерного луча (рис. 1), «несущего» необходимое когерентное излучение, используется пучок электронов, разогнанных на линейном ускорителе до скорости, близкой к скорости света (u ≈ c). Эмиссия и усиление электромагнитных волн происходит в системе, состоящей из массива магнитов, поочередно меняющих свою полярность (ондулятор) с периодом L. Периодическое магнитное поле B ондулятора описывается формулой:
Электроны, попадая в такое магнитное поле, начинают осциллировать с поперечной скоростью (vt), что приводит к испусканию ими электромагнитных волн. В отличие от обычного ондулятора, в РЛСЭ электроны испускают скоррелированные электромагнитные волны .
В таком магнитном поле на электрон, движущийся со скоростью vt, действует сила Лоренца, собирающая электроны в микропучок с периодом, равным длине испущенной волны. В результате электроны в пучке под действием ондулятора осциллируют синхронно, и их излучение становится скоррелированным, что также приводит к возрастанию интенсивности полученного рентгеновского луча [9], [10].
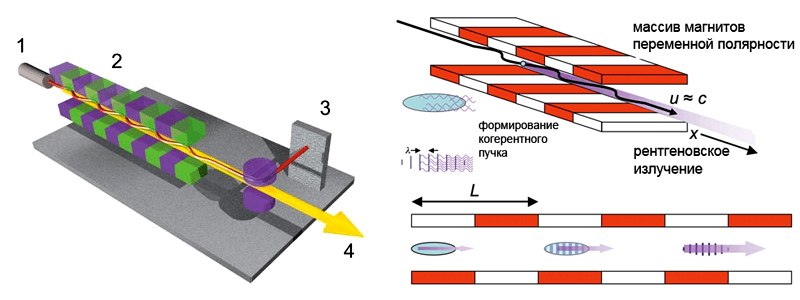
Рисунок 1. Схема работы рентгеновского лазера на свободных электронах. 1. Источник и ускоритель электронов. 2. Система магнитов (ондулятор). 3. Ловушка для электронов. 4. Рентгеновский луч. Траектория движения электронов показана красной синусоидой. Пучок электронов из ускорителя (1) на высокой скорости попадает в периодическое магнитное поле, создаваемое ондулятором (2), и сам начинает испускать скоррелированные электромагнитные волны каждые 10–200 фс (4). После создания лазерного рентгеновского пучка электроны удаляются улавливателем электронов (3).
При использовании РЛСЭ в структурной биологии необходимо знать, что длина импульса излучения обычно составляет 10–200 фс (фемтосекунд), а мощность — примерно 5 МДж. Это соответствует пиковой рентгеновской мощности вплоть до 50 ГВт. При энергии фотонов 8 кЭВ данный импульс несет 4 × 1012 фотонов (или 6 × 1013 — при энергии 500 ЭВ). При этом эффективность передачи излучения от источника к образцу составляет 20%. Импульсы практически полностью когерентны и монохроматичны, разброс в диапазоне частот составляет ~ 0,1% (хотя длина волны от импульса к импульсу может варьировать в пределах 0,3%).
На рисунке 2 показана общая схема установки, используемой в ранних работах по белковой нанокристаллографии в Стэнфорде.
Согласно этой схеме, нанокристаллы изучаемых молекул распыляются в направлении, перпендикулярном рентгеновскому лучу, и дифракционные картины считываются на разделенном детекторе после каждого импульса, который в описываемом примере имеет частоту 120 Гц. Такой способ регистрации позволяет записывать данные одновременно для больших (низкое угловое разрешение) и малых (высокое угловое разрешение) углов. Поскольку ловушка может разрушаться под действием рентгеновского луча, в детекторе необходимо предусмотреть щель, позволяющую свободно проходить нерассеянному пучку после малоуглового рассеяния и затухать далее. Второй детектор (не показан на схеме), также разделенный на две панели, размещается позади первого для регистрации малоуглового рассеяния. Расстояние между первым детектором и образцом, подвергающимся воздействию рентгеновского луча, здесь составляет 10 см [11].
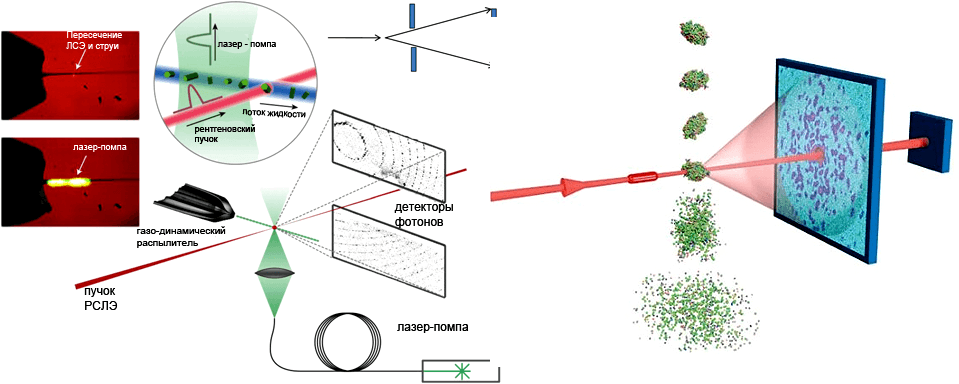
Рисунок 2. Схема стэнфордской установки LCLS для фемтосекундной нанокристаллографии. Частицы образца распыляются в вакууме газодинамическим распылителем. Рентгеновское излучение проходит перпендикулярно сквозь полученную струю. Дифракционная картина регистрируется детектором. Возбуждение образца возможно с помощью дополнительного оптического лазера-помпы.
[11] (слева), Universität Hamburg (справа)
В зависимости от типа исследуемого объекта (например, нанокристаллы белков, вирусные частицы, паста, содержащая мембранные белки и липиды в кубической или губчатой фазе) может варьировать система доставки образца: обычно это струя жидкости или газа с возможным охлаждением. Для нанокристаллов белков подходит доставка в струе жидкости, потому что интенсивность брэгговских пиков от нанокристалла намного выше, чем от окружающего растворителя (воды). Обычно диаметр такой струи составляет несколько микрон (минимум 0,3 мкм) [12]. Кроме того, такие исследования можно проводить при комнатной температуре, что тоже выгодно отличает нанокристаллографию от ее «обычной» разновидности.
На сегодняшний день были апробированы различные варианты стандартных схем доставки. Например, смешивание нескольких растворов, содержащих фермент и субстрат, в инжекторе [13] позволяет получать временны́е серии рентгеновских снимков, отражающих протекание реакции. А использование инжекторов для жидкостей с повышенной вязкостью (как у зубной пасты) сильно облегчает изучение мембранных белков в липидном окружении [14]. Также была показана возможность формирования текучих бислойных плёнок, пересекающих рентгеновский пучок и обеспечивающих постоянный поток мембранных белков, таких как рецепторы, сопряженные с G-белком [15], ионные каналы [16] или даже двумерные белковые кристаллы [17].
Высокий расход белкового материала, характерный для ранних экспериментов, можно уменьшить, изменяя характеристики РЛСЭ. Чтобы получать больше данных от меньшего количества образца, можно, например, увеличить частотный диапазон излучения (c 0,1% до 2%), что планируется реализовать в швейцарской установке РЛСЭ (SwissFEL), или в сотни раз повысить частоты повторения импульсов, что заявлено для Европейского РЛСЭ в Гамбурге (European XFEL). Позволяют оптимизировать необходимое количество биологического образца и свойства инжектора: скорость протекания жидкости, ее вязкость и пр.
Характеристика установки РЛСЭ в Стэнфорде (LCLS)
Первым работающим РЛСЭ стал LCLS (Linac Coherent Light Source; параметры см. в таблице 1), расположенный неподалеку от Стэнфорда (Калифорния, США) и использующий для получения пучка разогнанных электронов Стэнфордский линейный ускоритель длиной 3 км. LCLS запустили в национальной ускорительной лаборатории SLAC в 2009 году, и все основные работы по белковой фемтосекундной кристаллографии были проведены именно на нём. Среди них следует выделить изучение структуры фотосистемы I (мембранного белкового комплекса растений, участвующего в процессе фотосинтеза) с низким, ~ 8 Å, разрешением [18], изучение единичного вириона мимивируса [19] и получение структуры белка (лизоцима) с разрешением 2 Å [20] (подробнее — в соответствующих разделах). Лаборатория активно сотрудничает с Аргоннской и Ливерморской национальными лабораториями США, Институтом Макса Планка (Германия) и многими другими учреждениями по всему миру.
При финансировании Министерством энергетики Соединенных Штатов планируется модификация установки до LCLS-II с частотой миллион импульсов в секунду (106 Гц). Подобная модификация позволит изучить прежде недосягаемые явления в химическом катализе и фотокатализе, изменение структуры биологических объектов в реальном времени, состояние материи в экстремальных условиях, динамику энергии, заряда и материи.
| LCLS | SACLA | European XFEL | |
|---|---|---|---|
| Аббревиатура от... | Linac Coherent Light Source | The SPring-8 Angstrom Compact Free Electron Laser | European X-Ray Free-Electron Laser |
| Местонахождение | Калифорния, США | Япония | Германия |
| Ввод в эксплуатацию | 2009 | 2011 | 2017 |
| Частота РЛСЭ, Гц | 120 | 60 | 27 000 |
| Минимальная длина волны, Å | 1,5 | 0,8 | 0,5 |
| Длина ускорителя, км | 3 | 0,7 | 3,4 |
| Число ондуляторов | 1 | 3 | 5 |
| Число экспериментальных станций | 3–5 | 4 | 6, с возможностью увеличения до 10 |
| Пиковая светимость [фотоны / с / мм2 / мрад2/ 0,1% частоты] | 2 × 1033 | 1 × 1033 | 5 × 1033 |
| Средняя светимость [фотоны / сек / мм2 / мрад2/ 0,1% частоты] | 2,4 × 1022 | 1,5 × 1023 | 1,6 × 1025 |
Характеристика установки РЛСЭ в Японии (SACLA)
Через 2 года после успеха cтэнфордской установки в Японии расцвела «САКУРА» (именно так следует произносить аббревиатуру SACLA: The SPring-8 Angstrom Compact Free Electron Laser). Отличительной чертой установки является малая длина ускорителя (0,7 км), но при этом достигается субангстремное разрешение — 0,6 Å. Интересный факт: компания SPring-8 выпустила научно-популярные аниме, объясняющие широкой публике возможности прибора.
Характеристики строящейся установки РЛСЭ в Гамбурге (European XEFL)
С 2009 года в Гамбурге (Германия) ведется строительство нового центра РЛСЭ (European XEFL). Плановое окончание работ предусмотрено в 2016 году, а первый эксперимент — в 2017. Для создания электронного пучка будет использован ускоритель длиной 3,4 км, расположенный между Шенефельдом и Гамбургом. Основным отличием European XEFL от LCLS станет использование эффекта сверхпроводимости при −271 °С в электронном ускорителе. Сверхпроводимость позволяет создавать электронные пучки повышенного качества. В результате частота рентгеновских импульсов будет в несколько сотен раз выше (27 кГц), чем у LCLS (табл. 1), что значительно увеличит объем получаемых в единицу времени кристаллографических данных, позволит использовать меньшие количества образца, более скоростные инжекторы и т.д.
В целом, многие эксперименты, которые ранее проводились на LCLS, на European XFEL будут выполняться значительно быстрее, а также появится возможность проводить исследования, «неподдающиеся» LCLS. Большее число генерируемых электронных пучков позволит создать больше одновременно работающих экспериментальных станций.
Проект European XEFL реализуется международной командой, в состав которой вошли более 200 исследователей и инженеров из 12 стран. Германия и Россия предоставили 54 и 23% от общего объема финансирования соответственно, что дает этим странам преимущественные права использования установки.
Основные отличия последовательной фемтосекундной кристаллографии с использованием РЛСЭ от классического рентгеноструктурного анализа
Разрешение и «качество» классического рентгеноструктурного анализа (РСА) обычно ограничены качеством исследуемого кристалла и эффектом от его разрушения под действием рентгеновского излучения. Поэтому ключевым моментом для РСА макромолекул является подготовка большого, хорошо дифрагирующего кристалла. На подбор условий кристаллизации разных биомолекул (например, белков) могут уходить годы.
Обычно РСА проводят в низкотемпературных (крио-) условиях, что, с одной стороны, повышает стабильность кристалла, а с другой — ограничивает конформационное разнообразие изучаемой молекулы. Недавние исследования белков с помощью РСА при комнатной температуре показали, что охлаждение приводит к преобладанию «вымороженной» конформации молекулы, в которой зачастую до 35% боковых групп аминокислотных остатков может иметь не такую упаковку, как при комнатной температуре. Это, в свою очередь, может играть критическую роль в изучении аллостерических эффектов связывания лигандов с белком [21]. Многие из перечисленных проблем можно решить с помощью последовательной фемтосекундной кристаллографии (ПФК) с использованием РЛСЭ.
Так, в ПФК нет необходимости растить крупные кристаллы: размер используемых нанокристаллов обычно составляет десятые или даже сотые доли микрона (при этом кристалл содержит всего несколько элементарных ячеек). Можно получать дифракционные картины вообще от единичных биочастиц (например, вирусов). ПФК-исследования обычно проводятся при комнатной температуре, и образец находится в условиях, близких к нативным (водные растворы, липиды в различном фазовом состоянии).
Качество кристалла и его вероятное повреждение под действием излучения практически перестают играть роль. Кроме того, появляется возможность получать данные о конформационных изменениях белковых молекул в ходе различных биохимических процессов. Уже были проведены пробные исследования фотосистемы I в связанном с ферредоксином состоянии, где сравнивали дифракцию от комплекса в темновой фазе и возбужденном (с помощью лазерной помпы) состоянии [22].
Тем не менее стоит отметить, что характер дифракционных картин, получаемых в ПФК (рис. 3а), отличается от таковых при классическом РСА (рис. 3б).
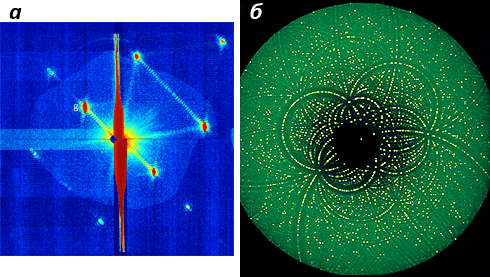
Рисунок 3. Сравнение дифракционных картин, полученных в ходе ПФК и РСА. а — Картина, полученная от одного 40-фс импульса РЛСЭ для единичного нанокристалла фотосистемы I в жидкой струе. Полоса в центре соответствует дифракции от непрерывного столба жидкости. По числу дополнительных минимумов можно определить, что кристалл содержит 17 элементарных ячеек. б — Дифракционный портрет белка, полученный методом рентгеноструктурного анализа на ускорителе HASYLAB/DESY в Германии. Фото: HASYLAB/DESY, Max Planck working groups, Hamburg.
При исследовании субмикронных кристаллов с помощью РЛСЭ дифракционные снимки содержат неполные Брэгговские рефлексы, в отличие от дифракционной картины, получаемой на синхротроне, где непрерывное вращение кристалла обеспечивает угловое интегрирование, необходимое для определения структурных факторов. Для решения прямой кристаллографической задачи необходимо индексирование и объединение миллионов дифракционных снимков, получаемых на LCLS с частотой 120 штук в секунду в течение многих дней, что в итоге генерирует терабайты информации. (Использование нового РЛСЭ в Гамбурге существенно ускорит подобные эксперименты.)
Естественно, процедуры индексирования должны быть полностью автоматическими — в отличие от РСА, где часто этот процесс можно проводить «вручную». При исследовании мельчайших нанокристаллов рассеяние может происходить в не-Брэгговских направлениях, что затрудняет процедуру автоматического индексирования получаемых пиков. В настоящий момент структурные факторы определяют интегрированием методом Монте-Карло всех неполных рефлексов, имеющих одинаковые Миллеровские индексы по всему объему полученных данных.
Как и в классическом РСА, серьезную проблему представляет двоение пиков. Даже если для индивидуального нанокристалла двоение не наблюдается, оно может возникнуть при объединении данных от различных нанокристаллов.
Несмотря на то, что проблема фазирования (сбора информации не только об интенсивности света, попадающего на исследуемый объект, но и о его фазе [23]) так же важна для ПФК, как и для классического РСА, появляются новые способы ее решения — в первую очередь в связи с использованием полностью когерентного рентгеновского пучка. Например, метод «избыточного сэмплирования» предполагает определение точного числа элементарных ячеек (рис. 3а) в нанокристаллах и/или объединение данных от многих кристаллов в 3D. Наконец, для ПФК возникает проблема эффективности попадания лазерного пучка в нанокристаллы, движущиеся в струе инжектора. Многие вспышки могут происходить «впустую» или же взаимодействовать с кристаллом «по касательной», что ведет к искажению дифракционных картин. Эффективность попадания также необходимо учитывать при реконструкции дифракционной картины от многих нанокристаллов.
Помимо исследования нанокристаллов, РЛСЭ позволяет получать дифракционные картины от произвольно ориентированных единичных биочастиц (например, вирусов). В данном случае задача объединения тысяч различных дифракционных снимков сходна с нахождением усредненной электронной плотности в методе криоэлектронной микроскопии.
Использование ПФК в исследовании мембранных белков
ПФК дает уникальные возможности в исследовании белков, с трудом поддающихся кристаллизации. Используемые нанокристаллы настолько малы, что обычно невидимы в оптический микроскоп. Этот метод позволяет изучать белки, которые при кристаллизации дают только россыпь нанокристаллов, формирующих аморфный осадок в растворе для кристаллизации. Возникает вопрос: как много нанокристаллов мембранных белков, которые можно использовать для исследований, уже имеется в различных лабораториях мира?
На сегодняшний день нанокристаллы можно регистрировать с помощью метода SONICC, который при систематическом скрининге позволит выявить более тысячи нанокристаллов различных мембранных белков (около 30% осадков, получаемых при кристаллизации, может содержать нанокристаллы) [24]. Таким образом, стоит ожидать, что в ближайшее время установление структуры мембранных белков может стать вполне рутинной процедурой.
Примеры биологических задач, решенных с помощью ПФК
Структура фотосистемы I
С помощью ПФК (на установке LCLS) недавно удалось получить структуру низкого разрешения (8,5 Å) одного из наиболее крупных комплексов мембранных белков — фотосистемы I (рис. 4) [18]. С использованием импульсов длительностью 70 фс получили около трех миллионов дифракционных картин, собранных с нанокристаллов размером 0,2–2 мкм. При этом все измерения проводились при комнатной температуре с подачей кристаллов в струе жидкости.
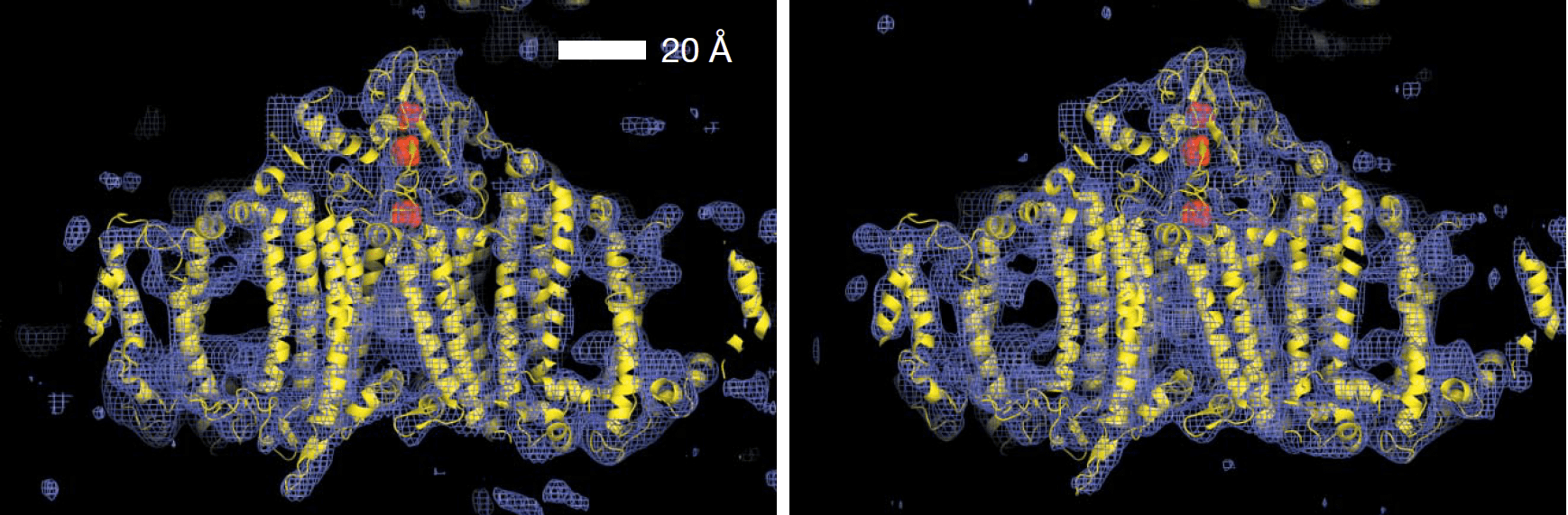
Рисунок 4. Структура фотосистемы I низкого разрешения (8,5 Å). Слева показана электронная плотность, полученная с помощью ПФК при комнатной температуре в струе жидкости, справа — полученная на синхротроне при температуре 100 К. Вписанная модель белкового комплекса показана желтым. Авторы утверждают, что на левом рисунке ясно видны электронно-плотные участки отдельных трансмембранных доменов и даже некоторые петлевые структуры. Действительно, сильно присмотревшись, можно заметить, что модель белкового комплекса вписывается в левую структуру «плотнее», чем в правую. То есть точность полученных методом ПФК структур выше
[18], рисунок адаптирован
Исследование мимивирусов
С помощью ПФК можно получать дифракционные картины с единичных вирусных частиц и крупных макромолекул, находящихся в некристаллическом состоянии. Дифракционные картины высокого качества получили, например, для отдельной частицы мимивируса на LCSL [19]. Несмотря на то, что после прохождения рентгеновского пучка вирусные частицы разрушались в результате нагревания до 105 K (переходили в плазменное состояние), удалось получить карты электронной плотности с разрешением 32 нм, которые показали гетерогенную организацию материала внутри вириона, а также его икосаэдрическую структуру (рис. 5). В исследовании использовали импульсы длительностью 70 фс и гидратированные вирусные частицы в виде аэрозоля. В дальнейшем можно достичь существенного повышения разрешения при уменьшении длительности импульса и области фокусировки и увеличении яркости пучка.
Об этих экзотических вирусах-переростках немного рассказано в статьях «Гигантские вирусы: 4-й домен жизни?» [25] и «Мобильные генетические элементы прокариот: стратификация „общества“ бродяжек и домоседов» [26].
В 2015 году получили 3d-реконструкцию внутренней структуры мимивируса [27]. Исследователям удалось модифицировать алгоритм expand, maximize and compress (EMC) для правильного совмещения 198 полученных дифракционных картин. Это нетривиальная задача, поскольку каждая частица попадает под луч лазера в произвольной ориентации. Исследователи обнаружили асимметричность внутренней структуры вируса (рис. 5).
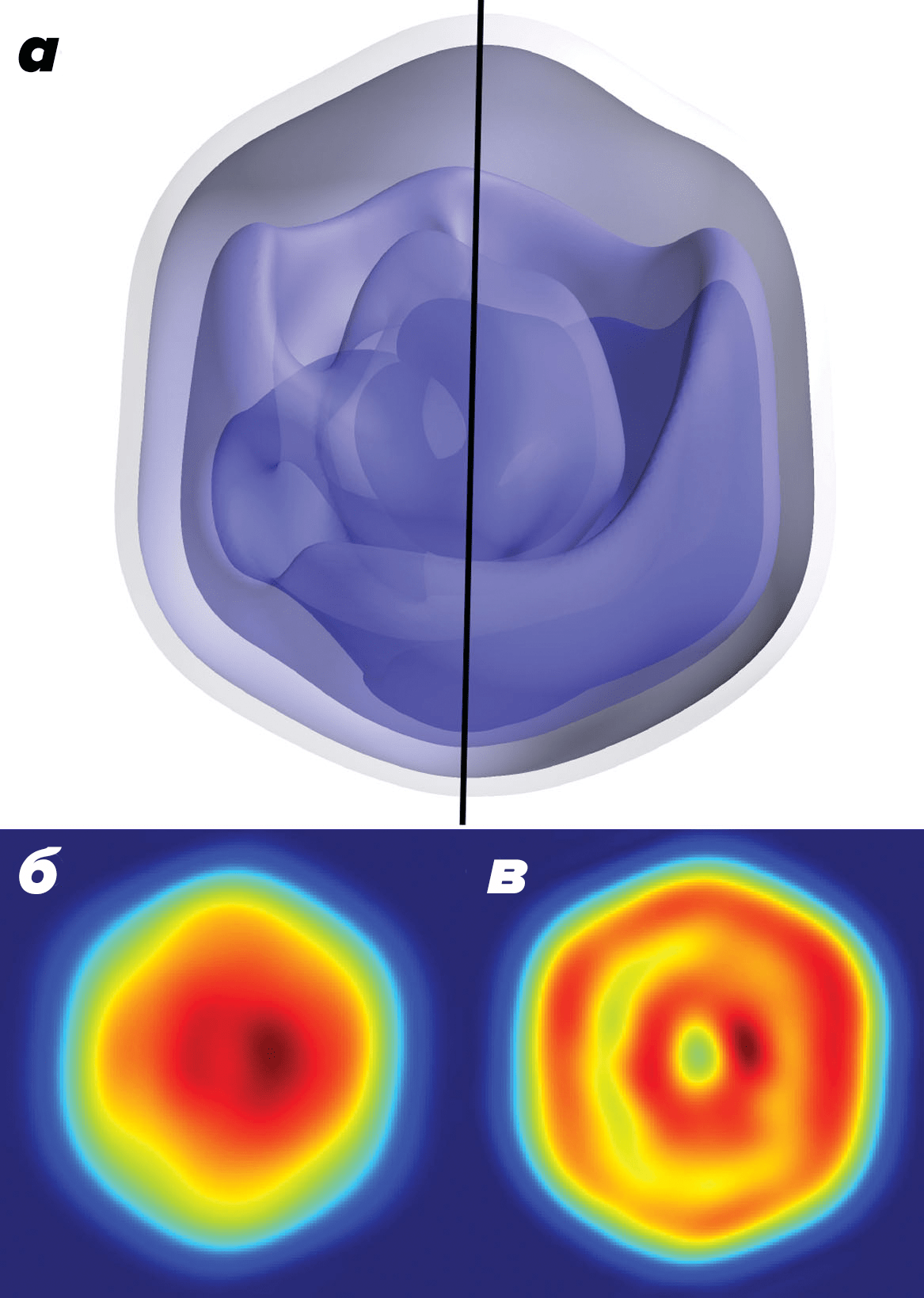
Рисунок 5. Исследование единичных вирионов мимивируса с помощью ПФК. а — 3d-реконструкция. Видна несимметричность «внутренностей» вируса. б — Проекция полученной электронной плотности. в — Срез через центр проекции.
Структура лизоцима высокого разрешения
Наряду с получением структур низкого разрешения была показана возможность достижения атомного разрешения при использовании ПФК в исследованиях белковых кристаллов в струе жидкости при комнатной температуре. Так, для кристаллов лизоцима сравнительно небольших размеров (1 × 1 × 3 мкм3) на LCLS с 40-фс импульсами были получены дифракционные картины с разрешением 2 Å (около 1,5 миллионов изображений). Они позволили реконструировать карту электронной плотности, практически не отличающуюся от полученной на синхротроне в ходе «классического» рентгеноструктурного анализа (рис. 6) [20].

Рисунок 6. Дифракционный снимок кристалла лизоцима. Картина получена с помощью единичного 40-фс импульса РЛСЭ для кристалла лизоцима в струе жидкости при комнатной температуре. Разрешение составляет 1,8 Å. Фоновое рассеяние от растворителя вычтено.
Метод РЛСЭ пока не слишком широко известен из-за своей дороговизны и специфики, однако уже через 2–3 года появится третий в мире и первый в Европе центр, способный использовать такую технологию. В связи с высоким уровнем развития науки в Европе ожидается волна открытий структур важнейших белков и других биомолекул, не поддающихся кристаллизации. В конечном итоге станет возможным и создание «биокино», поэтапно показывающего жизнь одиночной молекулы или ее изменения в ходе какого-то процесса. РЛСЭ — будущее структурной биологии.
Литература
- Драг-дизайн: как в современном мире создаются новые лекарства;
- Структурная геномика меняет курс;
- Торжество компьютерных методов: предсказание строения белков;
- Ловля бабочек, или Чем структурная геномика поможет биологии;
- J. R. Breedlove, G. T. Trammell. (1970). Molecular Microscopy: Fundamental Limitations. Science. 170, 1310-1313;
- Johndale C. Solem. (1986). Imaging biological specimens with high-intensity soft x rays. J. Opt. Soc. Am. B. 3, 1551;
- Henry N. Chapman, Anton Barty, Michael J. Bogan, Sébastien Boutet, Matthias Frank, et. al.. (2006). Femtosecond diffractive imaging with a soft-X-ray free-electron laser. Nature Phys. 2, 839-843;
- Fung R., Shneerson V., Saldin D.K., Ourmazd A. (2008). Structure from fleeting illumination of faint spinning objects in flight . Nat. Physics. 5, 64–67;
- G. Margaritondo, Primoz Rebernik Ribic. (2011). A simplified description of X-ray free-electron lasers. J Synchrotron Radiat. 18, 101-108;
- Понятов А. (2013). Построены подземные сооружения комплекса XFEL. Сайт «Наука и жизнь»;
- J C H Spence, U Weierstall, H N Chapman. (2012). X-ray lasers for structural and dynamic biology. Rep. Prog. Phys.. 75, 102601;
- D.P. Deponte, J.T. Mckeown, U. Weierstall, R.B. Doak, J.C.H. Spence. (2011). Towards ETEM serial crystallography: Electron diffraction from liquid jets. Ultramicroscopy. 111, 824-827;
- Hye Yoon Park, Xiangyun Qiu, Elizabeth Rhoades, Jonas Korlach, Lisa W. Kwok, et. al.. (2006). Achieving Uniform Mixing in a Microfluidic Device: Hydrodynamic Focusing Prior to Mixing. Anal. Chem.. 78, 4465-4473;
- Linda C Johansson, David Arnlund, Thomas A White, Gergely Katona, Daniel P DePonte, et. al.. (2012). Lipidic phase membrane protein serial femtosecond crystallography. Nat Methods. 9, 263-265;
- Структуры рецепторов GPCR «в копилку»;
- О чем не знал Гальвани: пространственная структура натриевого канала;
- André Beerlink, P.-J. Wilbrandt, E. Ziegler, D. Carbone, T. H. Metzger, Tim Salditt. (2008). X-ray Structure Analysis of Free-Standing Lipid Membranes Facilitated by Micromachined Apertures. Langmuir. 24, 4952-4958;
- Henry N. Chapman, Petra Fromme, Anton Barty, Thomas A. White, Richard A. Kirian, et. al.. (2011). Femtosecond X-ray protein nanocrystallography. Nature. 470, 73-77;
- M. Marvin Seibert, Tomas Ekeberg, Filipe R. N. C. Maia, Martin Svenda, Jakob Andreasson, et. al.. (2011). Single mimivirus particles intercepted and imaged with an X-ray laser. Nature. 470, 78-81;
- Sébastien Boutet, Lukas Lomb, Garth J. Williams, Thomas R. M. Barends, Andrew Aquila, et. al.. (2012). High-Resolution Protein Structure Determination by Serial Femtosecond Crystallography. Science. 337, 362-364;
- James S. Fraser, Henry van den Bedem, Avi J. Samelson, P. Therese Lang, James M. Holton, et. al.. (2011). Accessing protein conformational ensembles using room-temperature X-ray crystallography. Proc. Natl. Acad. Sci. U.S.A.. 108, 16247-16252;
- Andrew Aquila, Mark S. Hunter, R. Bruce Doak, Richard A. Kirian, Petra Fromme, et. al.. (2012). Time-resolved protein nanocrystallography using an X-ray free-electron laser. Opt. Express. 20, 2706;
- M. Martínez-Ripoll and Cano F.H. Crystallography. The Spanish National Research Council;
- Petra Fromme, John CH Spence. (2011). Femtosecond nanocrystallography using X-ray lasers for membrane protein structure determination. Current Opinion in Structural Biology. 21, 509-516;
- Гигантские вирусы: 4-й домен жизни?;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Tomas Ekeberg, Martin Svenda, Chantal Abergel, Filipe R. N. C. Maia, Virginie Seltzer, et. al.. (2015). Three-Dimensional Reconstruction of the Giant Mimivirus Particle with an X-Ray Free-Electron Laser. Phys. Rev. Lett.. 114.





