
Не доверяйте рекламе, или Потенциальная связь метаболизма L-карнитина и развития атеросклероза
31 октября 2013
Не доверяйте рекламе, или Потенциальная связь метаболизма L-карнитина и развития атеросклероза
- 49903
- 0
- 6
Повышенное потребление L-карнитина набирает все большую популярность благодаря его благотворному влиянию на состояние человека. Однако отсутствие побочных эффектов чрезмерного потребления L-карнитина не было доказано.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Обильное потребление мясных продуктов в развитых странах связывают с повышенным риском сердечнососудистых заболеваний, объясняя это высоким содержанием насыщенных жиров и холестерина в мясе. Но так ли это? Исследования 2013 года не подтвердили связи между потреблением насыщенных жиров и повышенным риском развития сердечнососудистых заболеваний [1], что подтолкнуло ученых к поиску других факторов, приводящих к патологии. Тут-то и вспомнили про еще одну особенность мясных продуктов — обильное содержание L-карнитина.
Конкурс «био/мол/текст»-2013
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2013 в номинации «Лучшее новостное сообщение».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific. Спонсор приза зрительских симпатий — фирма Helicon.
Думайте, что покупаете!
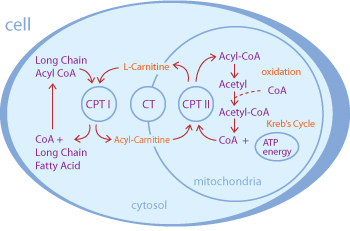
Рисунок 1. Участие L-карнитина в транспорте жирных кислот из цитоплазмы в митохондрию для β-окисления и получения энергии. CPT — карнитин—пальмитоилтрансфераза, CT — карнитин—ацилкарнитинтранслоказа, CoA — кофермент A.
Впервые L-карнитин был выделен двумя русскими учеными в 1905 году. Следовательно, сейчас идет уже второй век с момента открытия и начала изучения роли этой молекулы в организме человека [2]. Это один и самых исследуемых компонентов пищи. Пища, а именно красное мясо — основной источник карнитина у всеядных животных; тем не менее, немного L-карнитина синтезируется из лизина и в самом организме.
Кроме того, все больше и больше людей потребляет L-карнитин в качестве пищевых добавок. Помимо интернет-магазинов, магазинов спортивного питания и аптек, карнитин стал встречаться даже на полках продуктовых магазинов нашей страны, в том числе и в составе витаминов, энергетических напитков, шоколадных батончиков и прочего. Купить L-карнитин или продукты с его содержанием может кто угодно. В большинстве случаев L-карнитин принимают, видимо, в надежде интенсифицировать разрушение жиров, так как считается, что он осуществляет транспорт жирных кислот в митохондриальный матрикс, где происходит их разрушение с выделением энергии (рис. 1).
Реклама L-карнитина обещает быстрое похудение, увеличение мышечной массы, улучшение умственной и физической формы, устойчивости к стрессу, детоксикацию организма и многое другое. Надо сказать, что многие положительные эффекты карнитина действительно научно доказаны, но не стоит забывать о том, что до сих пор неизвестно, вреден ли избыток карнитина для здоровья.
Норма потребления L-карнитина для взрослого человека составляет 300 мг, тогда как для похудения и улучшения спортивных показателей оптимальными считаются дозы от 500 мг до 2 г в сутки. В надежде же обрести идеальное тело, прилагая при этом минимум усилий, люди в несколько раз превышают норму, не задумываясь о возможных последствиях. А зря. Ведь мы знаем, что метаболические пути в организме недостаточно изучены, и что практически все лекарства — да что там, даже витамины при их чрезмерном употреблении — имеют побочные действия. И L-карнитин не является исключением! Исследования 2013 года показали, что метаболит L-карнитина — триметиламин оксид (ТМАО) — вещество, способствующее развитию атеросклероза [3].
Коварные бактерии, или новый взгляд на метаболизм L-карнитина
Задуматься о возможной связи L-карнитина с развитием атеросклероза заставило открытие 2011 года, показавшее связь метаболизма холина — структурного аналога L-карнитина — с патогенезом сердечнососудистых заболеваний [3]. Главным источником холина служит фосфатидилхолин — одна из самых распространенных молекул клеточных мембран, в больших количествах содержащаяся пище животного происхождения.
Как оказалось, холин используется некоторыми кишечными бактериями для синтеза интермедиата триметиламина (ТМА) (рис. 2). В свою очередь, ТМА быстро абсорбируется и окисляется ферментами семейства FMO (флавинмонооксигеназа, FMO3 — главный фермент процесса) в печени до ТМАО, вызывающего развитие атеросклероза.
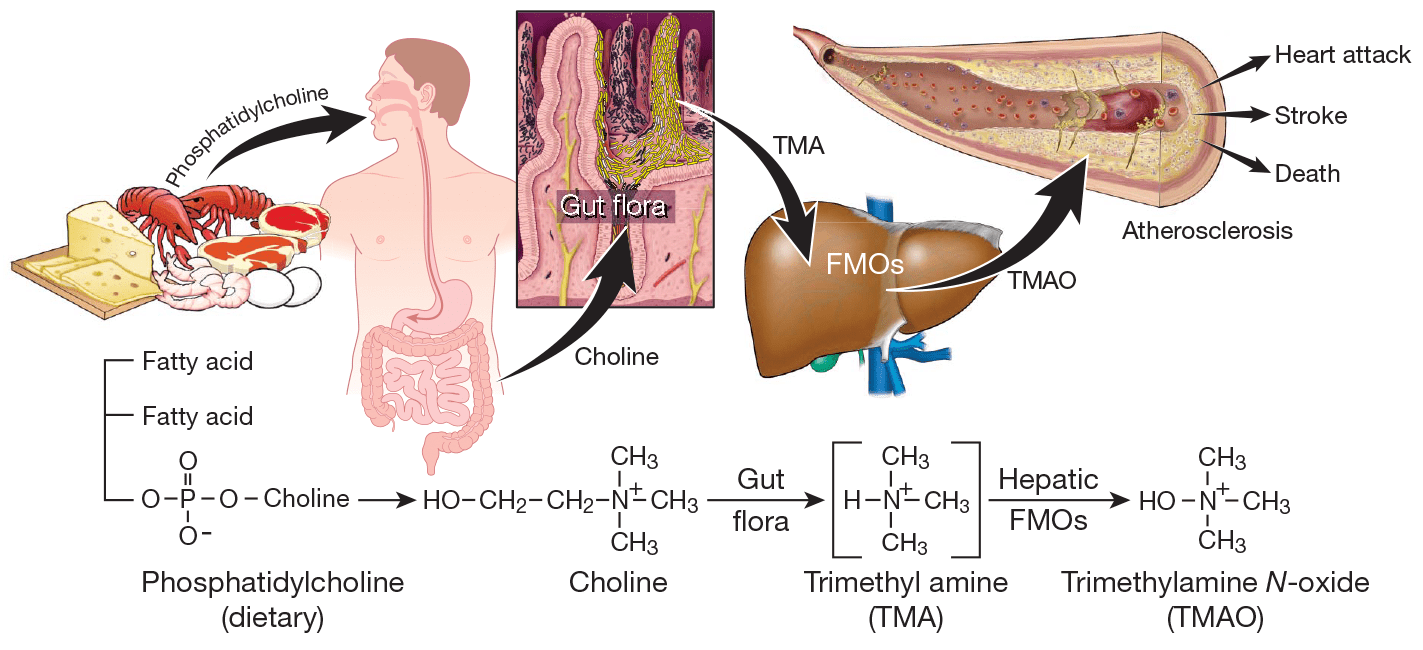
Рисунок 2. Схема синтеза кишечной флорой метаболита фосфатидилхолина, стимулирующего развитие атеросклероза. Фосфатидилхолин служит источником холина, который некоторые бактерии кишечника способны использовать для синтеза ТМА. ТМА, в свою очередь, быстро преобразуется ферментом флавинмонооксигеназой в ТМАО, уровень которого показал строгую корреляцию с развитием атеросклероза.
Использование бактериями триметиламинной группы холина для синтеза ТМА поднимает вопрос о существовании подобных метаболических путей для аналогичных соединений, включающих эту группу. Одна из таких молекул — как раз карнитин (рис. 3). Возникшее предположение о связи продукции ТМАО из L-карнитина подтвердилось исследованиями 2013 года [1], хотя предшествующие эксперименты на крысах не выявляли такой связи [4].
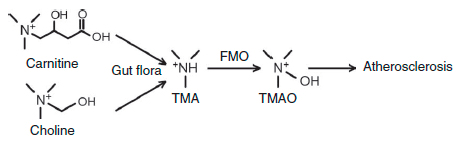
Рисунок 3. Схема синтеза ТМАО, приводящего к развития атеросклероза. Карнитин и холин — триметиламины, получаемые с пищей, — используются для синтеза ТМА микрофлорой кишечника, который быстро окисляется флавинмонооксигеназой до ТМАО.
Метаболит L-карнитина — одна из причин развития сердечнососудистых заболеваний
Два независимых клинических исследования показали связь концентрации L-карнитина и ТМАО в плазме крови с развитием коронарной и периферической недостаточностей, а также сердечнососудистых заболеваний в целом. В первом исследовании участвовала группа из 2595 человек [1], во втором — проводился трехлетний кардиологический контроль 4000 пациентов [5].
Исследования на мышах также подтверждают корреляцию высокого уровня L-карнитина и ТМАО с развитием патологий сердечнососудистой системы [1]. С четырехнедельного возраста четыре группы мышей получали питание определенного типа: 1) обычное, 2) с повышенным содержанием карнитина, 3) с добавлением антибиотиков или 4) с повышенным содержанием карнитина и добавлением антибиотиков. Сравнение ткани корней аорты у мышей по достижении 19-недельного возраста выявило двойное увеличение области атеросклеротического повреждения при добавлении L-карнитина в корм (рис. 4, 5а). У мышей, получающих L-карнитин в комплексе с антибиотиками, нарушений не возникало. Следовательно, виновники развития сердечнососудистых нарушений — бактерии, участвующие в образовании ТМАО, уровень которого значительно возрастает при потреблении L-карнитина (рис. 5б) и коррелирует с развитием атеросклероза.
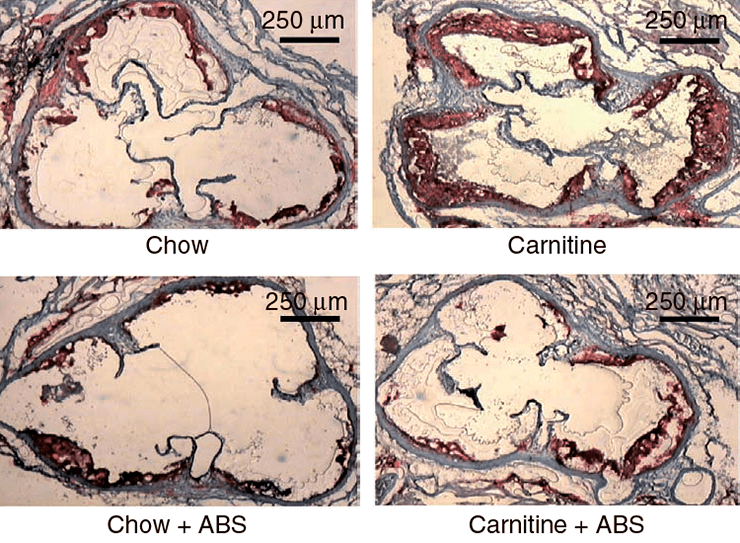
Рисунок 4. Срезы корней аорты 19-недельных мышей. Окраска гематоксилином. Chow — нормальное питание, ABS — отсутствие антибиотика.
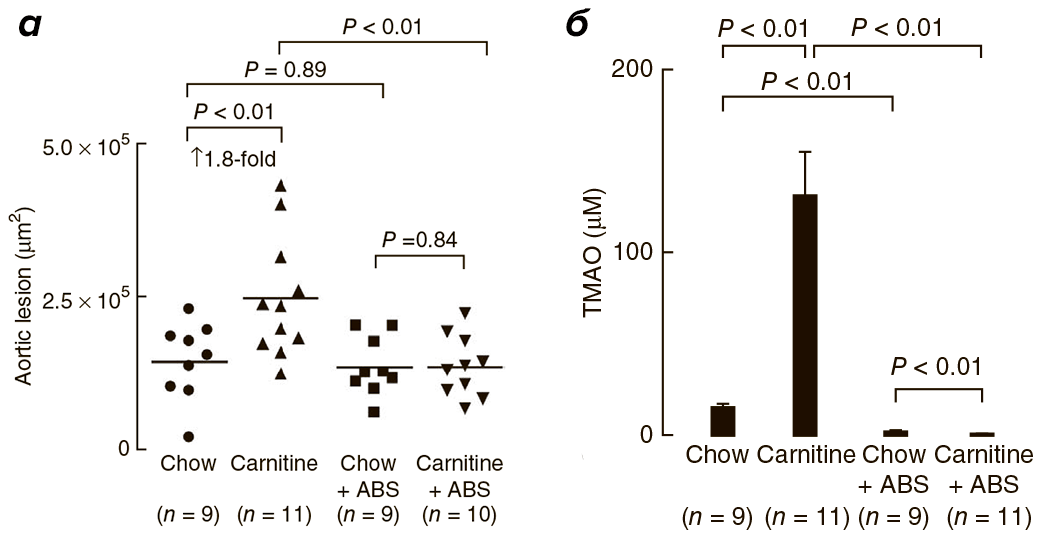
Рисунок 5. а — Оценка площади атеросклеротического повреждения корней аорты у мышей в зависимости от типа питания. б — Зависимость уровня ТМАО от типа питания мышей. Chow — нормальное питание, ABS — отсутствие антибиотика.
Вспомним про веганов (радикальные вегетарианцы, не употребляющие никаких продуктов животного происхождения) и вегетарианцев, не употребляющих красное мясо с высоким содержанием L-карнитина, и задумаемся, есть ли у них в кишечнике группа бактерий, ответственная за образование ТМА, окисляющегося до ТМАО (рис. 3)?
Не секрет, что пищевые предпочтения определяют состав микробиоты [6]. Так, продолжительный избыток карнитина в пище приводит к изменениям состава флоры кишечника, способствуя процветанию бактерий, участвующих в синтезе ТМАО [1]. Сниженное потребление L-карнитина и холина у веганов и вегетарианцев, напротив, не дает им развиваться. Бактерий, синтезирующих ТМАО, практически не остается, и даже при включении L-карнитина в рацион людей, длительное время соблюдающих растительную диету, уровень ТМАО в плазме крови и моче остается низким (рис. 6).
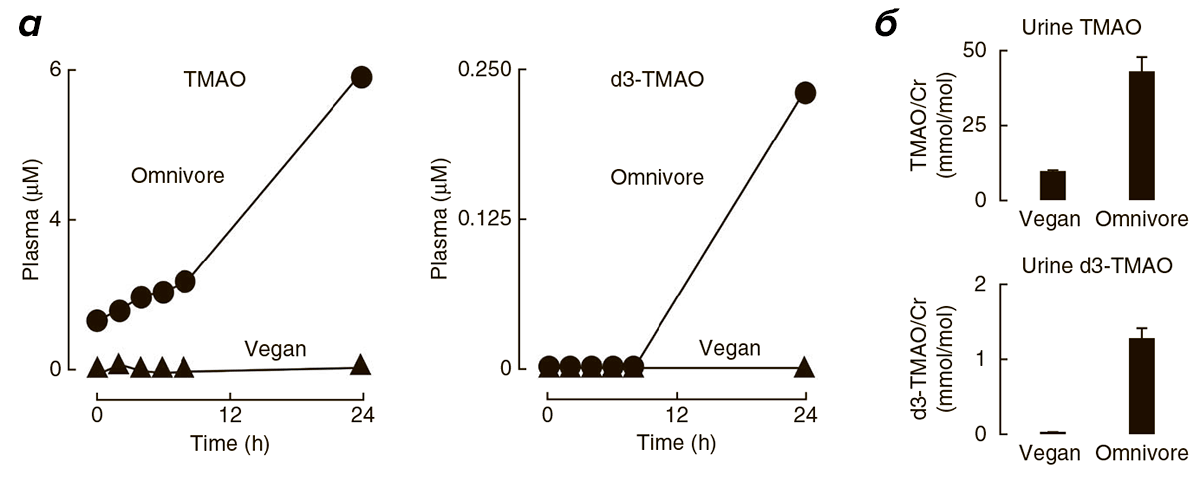
Рисунок 6. Сравнение уровней ТМАО в плазме крови (а) и в моче (б) после приема L-карнитина у веганов и людей, практически ежедневно потребляющих продукты из красного мяса. Синтез ТМАО (или его d3-меченного аналога) после потребления мясного стейка и L-карнитина (или d3-метил карнитина) незначителен у веганов (больше 5 лет отказывающихся от животных продуктов), в отличие от людей, регулярно потребляющих красное мясо. Полученные данные были дополнительно проверены и подтверждены на людях, следующих обычной диете, и людях, ведущих веганский или вегетарианский образ жизни более года.
Из этого можно предположить, что низкий уровень ТМАО и есть основная причина хорошего состояния сердечнососудистой системы веганов и вегетарианцев. Ведь статистика показывает нам более редкую встречаемость сердечнососудистых заболеваний [7], [8] и на 29% сокращенный риск смерти от ишемии сердца для людей этой группы [8].
Эксперименты также говорят о том, что соблюдение сбалансированной растительной диеты приводит к снижению давления, уровня холестерина в крови и риска возникновения атеросклероза [8–10]. Так, отказ от животной пищи может сократить прием лекарств при сердечнососудистых нарушениях. В одном из исследований группе пациентов с атеросклерозом был предложен полный переход на растительную пищу. Через год уже у 82% группы наблюдались улучшения [11]. Повторение эксперимента приводило к сходным результатам [12].
Но, быть может, преимущества соблюдения растительной диеты связаны вовсе не с отсутствием синтеза ТМАО, а с низким содержанием насыщенных жиров и холестерина в рационе? Ведь широко бытует мнение о том, что именно потребление большого количества насыщенных жиров и холестерина является главным фактором риска развития атеросклероза. Однако исследования 2013 года не подтвердили данной связи [1]. Примечательно также, что развитие атеросклеротических поражений у мышей происходило в отсутствие изменений в составе и содержании липидов, липопротеинов, глюкозы и уровня инсулина. Более того, у таких мышей не удалось выявить и признаков ожирения.
Так что возможно, кишечные бактерии, участвующие в синтезе ТМАО, — главные виновники развития атеросклероза. Если это так, то использование антибиотиков — новый возможный способ борьбы с сердечнососудистыми заболеваниями, а также их предотвращения. Как для человека, так и для мышей уже определены роды бактерий, предположительно участвующих в синтезе ТМАО. И хотя полученных данных пока недостаточно для выявления общего таксона, ответственного за синтез ТМАО, дальнейшие исследования вскоре прояснят ситуацию.
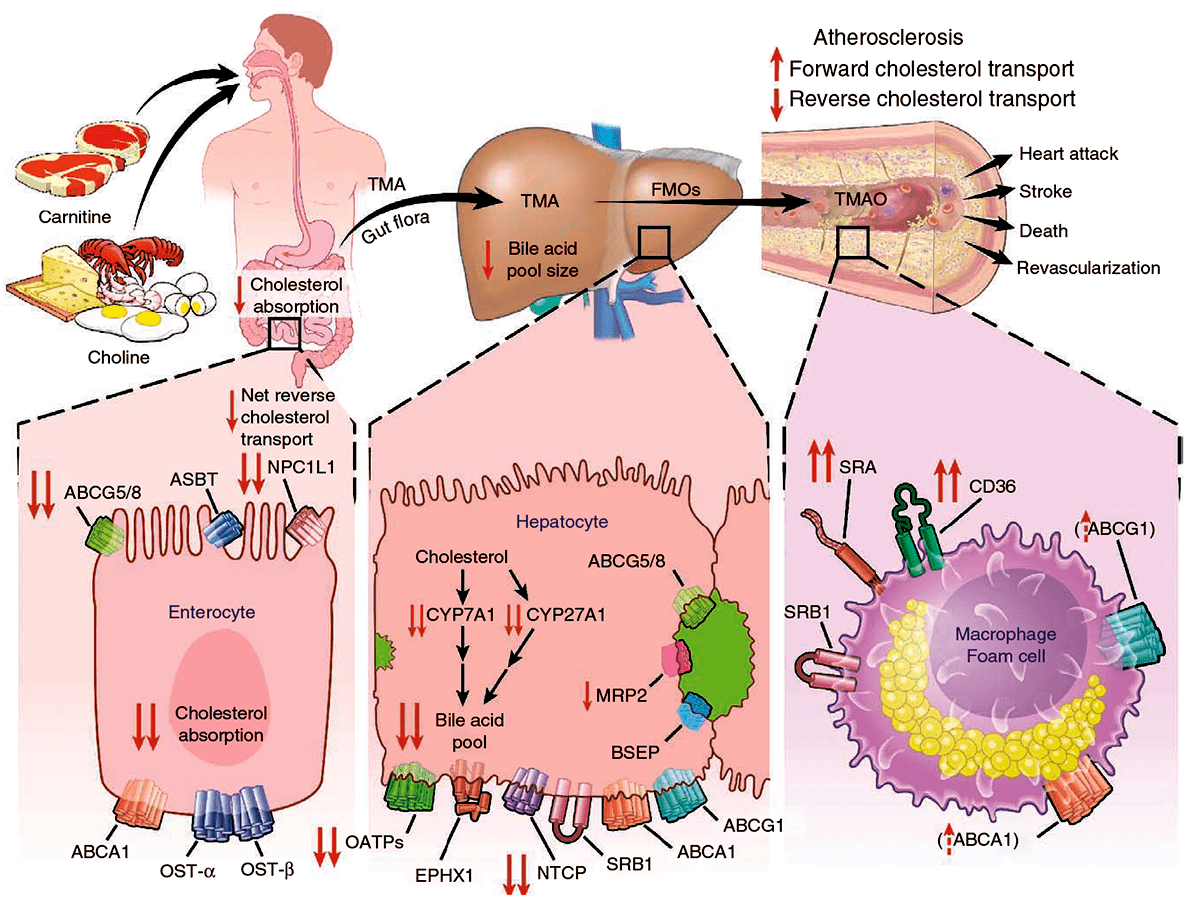
Рисунок 7. Общая схема предполагаемого метаболического пути, посредством которого микробиота влияет на развитие атеросклероза. Кишечные бактерии усваивают L-карнитин и холин, формируя ТМА, а затем ТМАО. ТМАО воздействует на метаболизм холестерина и стерина в макрофагах, печени и кишечнике. Он подавляет обратный транспорт холестерина, увеличивает экспрессию рецепторов SRA и CD36 макрофагов, способствуя образованию пенистых клеток.
Заключение
Вероятно, метаболический путь L-карнитина с участием кишечной микробиоты — главная причина давно замеченной взаимосвязи между обильным потреблением красного мяса и возникновением атеросклероза. Антибиотики, ингибирующие синтез ТМА кишечной флорой, могут стать новым оружием для борьбы и предотвращения сердечнососудистых заболеваний. К тому же открытие синтеза ТМАО из L-карнитина ставит под сомнение убежденность общества в абсолютной безвредности L-карнитина для здоровья и показывает необходимость его дальнейшего исследования.
Литература
- Robert A Koeth, Zeneng Wang, Bruce S Levison, Jennifer A Buffa, Elin Org, et. al.. (2013). Intestinal microbiota metabolism of l-carnitine, a nutrient in red meat, promotes atherosclerosis. Nat Med. 19, 576-585;
- Gulewitsch W., Krimberg R. (1905). Zur Kenntnis der Extrakivstoffe der Muskein, II Mitteilung. Uber das Carnitin. Hoppe-Seyler’s Z. Physiol. Chem. 45, 326–330;
- Zeneng Wang, Elizabeth Klipfell, Brian J. Bennett, Robert Koeth, Bruce S. Levison, et. al.. (2011). Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease. Nature. 472, 57-63;
- Rebouche C.J., Mack D.L., Edmonson P.F. (1984). l-Carnitine dissimilation in the gastrointestinal tract of the rat. Biochemistry 23, 6422–6426;
- W.H. Wilson Tang, Zeneng Wang, Bruce S. Levison, Robert A. Koeth, Earl B. Britt, et. al.. (2013). Intestinal Microbial Metabolism of Phosphatidylcholine and Cardiovascular Risk. N Engl J Med. 368, 1575-1584;
- R. E. Ley, M. Hamady, C. Lozupone, P. J. Turnbaugh, R. R. Ramey, et. al.. (2008). Evolution of Mammals and Their Gut Microbes. Science. 320, 1647-1651;
- Tao Huang, Bin Yang, Jusheng Zheng, Guipu Li, Mark L. Wahlqvist, Duo Li. (2012). Cardiovascular Disease Mortality and Cancer Incidence in Vegetarians: A Meta-Analysis and Systematic Review. Ann Nutr Metab. 60, 233-240;
- Report of the Dietary Guidelines Advisory Committee on the dietary guidelines for Americans, 2010: to the Secretary of Agriculture and the Secretary of Health and Human Services. (2010). Washington, DC: Agriculture Research Service, US Department of Agriculture, US Department of Health and Human Services;
- Philip Tuso. (2013). Nutritional Update for Physicians: Plant-Based Diets. permj. 17, 61-66;
- Yoshiko Takahashi, Satoshi Sasaki, Shunji Okubo, Masato Hayashi, Shoichiro Tsugane. (2006). Blood pressure change in a free-living population-based dietary modification study in Japan. Journal of Hypertension. 24, 451-458;
- D. Ornish, S.E. Brown, J.H. Billings, L.W. Scherwitz, W.T. Armstrong, et. al.. (1990). Can lifestyle changes reverse coronary heart disease?. The Lancet. 336, 129-133;
- M. de Lorgeril, P. Salen, J.-L. Martin, I. Monjaud, J. Delaye, N. Mamelle. (1999). Mediterranean Diet, Traditional Risk Factors, and the Rate of Cardiovascular Complications After Myocardial Infarction : Final Report of the Lyon Diet Heart Study. Circulation. 99, 779-785;
- Мировой отчет по неинфекционным заболеваниям. (2010). ВОЗ;
- Global atlas on cardiovascular disease prevention and control. (2011). WHO;
- Russell Ross. (1993). The pathogenesis of atherosclerosis: a perspective for the 1990s. Nature. 362, 801-809;
- Холестериновая страшилка, которая правит миром;
- Хороший, плохой, злой холестерин;
- Maria Febbraio, Eugene A. Podrez, Jonathan D. Smith, David P. Hajjar, Stanley L. Hazen, et. al.. (2000). Targeted disruption of the class B scavenger receptor CD36 protects against atherosclerotic lesion development in mice. J. Clin. Invest.. 105, 1049-1056;
- Hiroshi Suzuki, Yukiko Kurihara, Motohiro Takeya, Nobuo Kamada, Motoyukl Kataoka, et. al.. (1997). A role for macrophage scavenger receptors in atherosclerosis and susceptibility to infection. Nature. 386, 292-296.






