
Холестериновая страшилка, которая правит миром
29 июня 2013
Холестериновая страшилка, которая правит миром
- 79166
- 26
- 20
Мы говорим «холестерин» — подразумеваем «атеросклероз». Мы говорим «атеросклероз» — подразумеваем «холестерин». Но справедливо ли это?
демотиватор по мотивам картины Эдварда Мунка «Крик»
-
Автор
-
Редакторы
Бытующие в народе заблуждения в медицинских вопросах поистине трагикомичны. И одним из главных действующих лиц в этих комедиях ошибок является пресловутый холестерин — постоянный объект разношерстной рекламы и жарких дебатов, в которых участвуют все: врачи, ученые и далекие от науки и медицины люди. За более чем двухвековой период о нем написаны горы научной, наукообразной и антинаучной литературы, на протяжении XX столетия за его изучение были присуждены 13 Нобелевских премий, но количество мифов, сказок и откровенных нелепиц об этом веществе не убавилось.
Никогда не думайте, что вы уже все знаете.
И как бы высоко ни оценили вас,
всегда имейте мужество сказать себе: «Я — невежда».
И.П. Павлов
Позвольте представить: жизненно необходимый холестерин
Холестерин часто путают с жирами. В отличие от жиров, он не используется организмом для получения калорий и не имеет отношения ни к ожирению, ни, тем более, к целлюлиту. Холестерин (С27Н46О) — жироподобное органическое вещество животного происхождения из группы стероидов — соединений с ядром из трех шести- и одного пятичленного углеродных колец (рис. 1).
Заслуга открытия холестерина всецело принадлежит французским химикам. В 1769 году Пулетье де ла Саль получил из желчных камней плотное белое вещество («жировоск»), обладавшее свойствами жиров. В чистом виде холестерин был выделен химиком, членом национального Конвента и министром просвещения Франции А. Фуркруа в 1789 году. И лишь в 1815 году Мишель Шеврель, также выделивший это соединение, неудачно окрестил его холестерином (др.-греч. χολη — желчь и στερεος — твёрдый). В 1859 году Пьер Бертло доказал, что холестерин принадлежит к классу липофильных спиртов. Это обязывало в химическом названии вещества использовать суффикс «-ол», поэтому в 1900 году холестерин был переименован в холестерол, но в России прижилось неноменклатурное название. Вообще, путаница в названиях химических соединений — дело обычное.
Почти витамины
Из холестерина в организме человека вырабатываются все стероидные вещества, в том числе витамин D и гормоны (рис. 1). Без него невозможно функционирование многих жизненно важных систем организма. В организме содержится до 350 г этого вещества. Только одну треть (примерно 0,3–0,5 г в день) необходимого холестерина мы получаем с пищей, а две трети (0,7–1 г) синтезируем сами: 80% в печени, 10% в стенке тонкого кишечника и 5% в коже. Синтезом собственного холестерина организм компенсирует избыток или недостаток в рационе.

Рисунок 1. Близкие родственники: холестерин, гормоны (кортизол, тестостерон), витамин D, фитостеролы (эргостерол, β-ситостерол).
В печени из холестерина синтезируются желчные кислоты, необходимые для эмульгирования и всасывания жиров в тонком кишечнике. На эти цели уходит 60–80% холестерина. Материнское молоко богато холестерином. Грудные и растущие дети особенно нуждаются в богатых жирами и холестерином продуктах для полноценного развития мозга и нервной системы.
Мембранный строймонтаж
Как трудно представить себе дом без фундамента, так невозможно вообразить эукариотическую клетку без этого вещества. Совместно с фосфолипидами холестерин обеспечивает их прочность и особую мультифункциональность [1], [2]. Так, оболочки эритроцитов содержат 23% холестерина, клеток печени — примерно 17%, митохондриальные мембраны — 3%. Миелиновое многослойное покрытие нервных волокон, выполняющее изоляционные функции, на 22% состоит из холестерина. В составе белого вещества мозга содержится 14% холестерина, а серого — 6%.
Мастер на все руки
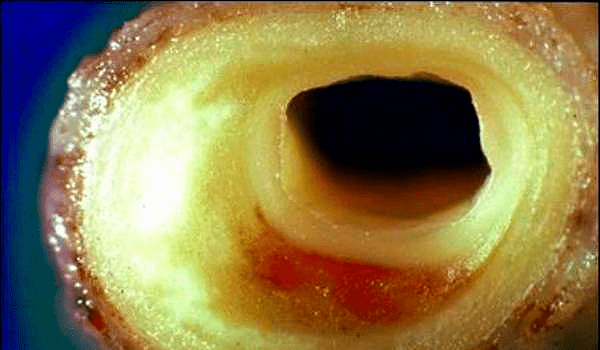
Рисунок 2. Холестериновые бляшки кровеносных сосудов.
Холестерин служит «сырьем» для производства стероидных гормонов коры надпочечников — гидрокортизона и альдостерона, — а также женских и мужских половых гормонов — эстрогенов и андрогенов [3]. У мужчин помешательство на бесхолестериновых продуктах может быть опасным для сексуальной активности [4]. Кстати, вам теперь понятно, почему мужчин нужно кормить мясом? Как давно подмечено в народе, «от крахмала только воротнички стоят».
Следует подчеркнуть, соблюдение бесхолестериновой диеты здоровыми женщинами детородного возраста бессмысленно, поскольку до наступления климакса женские половые гормоны просто не дают холестерину откладываться на стенках сосудов (рис. 2). Никакие диеты им, как правило, потерей сексапильности и сексуальности не грозят [5]. А вот у женщин, страдающих гормональными и обменными расстройствами, нередко прекращаются «критические дни». Увлечение обезжиренными продуктами чревато существенным снижением гормона эстрадиола в лютеиновой фазе менструального цикла [6], что, несомненно, может привести к бесплодию. Кроме того, у таких женщин в фолликулярной фазе менструального цикла регистрируются повышенные уровни триглицеридов и липопротеинов очень низкой плотности [7], что, как будет сказано ниже, сокращает путь к атеросклерозу. Биологическая активность лактогенных гормонов (пролактина и соматотропина) лютеиновой фазы на 28% выше у женщин, потребляющих пищу, богатую жирами, по сравнению с теми, кто «сидит» на диете с низким содержанием жира [8]. Кормящим мамочкам стоит обратить на это особое внимание!
Целенаправленная потеря веса грузными и тучными женщинами в возрасте 50–75 лет посредством низкокалорийных диет сопровождается снижением сывороточного эстрогена и свободного тестостерона [9]. Что из этого следует, полагаю, ясно ;-)
И уж совсем непозволительно экспериментировать с диетами беременным женщинам! Исследованиями сложных взаимоотношений холестерина и гормонов в организме матери и ее будущего ребенка установлено, что изменения в уровне липопротеинов могут вызвать нарушения в обмене стероидов, связанных с полом плода. Концентрации Х-ЛПВП в пуповинной крови новорожденных женского пола были выше, чем у новорожденных мужского пола, в то время как по уровням Х-ЛПНП различий не наблюдалось. В самом организме матери концентрации Х-ЛПНП и стероидов находились вне зависимости от пола ребенка, однако содержание Х-ЛПВП было выше в плазме женщин, родивших девочек [10].
Доведшие себя диетами до состояния анорексии девушки, как известно, теряют не только сексуальную притягательность, но и либидо (по причине недостатка эстрогена) [11]. А после этого говорить об их незавидной участи вообще не хочется.
Счастлив тот, кто...
Холестерин необходим для нормальной деятельности серотониновых (1А) и адренергических рецепторов в мозге, относящихся к обширному семейству GPCR (G-белоксопряженных рецепторов [12]) и ответственных за передачу сигнала через клеточную мембрану. Связывающая активность серотониновых рецепторов ослабляется пропорционально уменьшению содержания холестерола в мембранах клеток гиппокампа, сопровождаясь снижением дипольного потенциала мембран [13–15].
Серотонин называют «гормоном хорошего настроения» [16], и низкий уровень холестерина связывают с депрессией, агрессивным поведением и тенденцией к суициду [17]. Особенно остро это проявляется у пожилых людей [18]. Было установлено, что люди, которым удавалось любым способом снизить уровень холестерина, чаще других попадали в аварии с летальным исходом, становились жертвами насилия и кончали жизнь самоубийством.
В интернете с сайта на сайт кочует довольно оптимистичная информация. Исследователи из Бостонского университета установили, что снижение содержания холестерина в крови чревато снижением интеллектуальных способностей, а их коллеги из Гарварда — что высокие концентрации Х-ЛПВП на 30–40% снижают риск развития болезни Альцгеймера. Однако роль холестерина в этом нейродегенеративном заболевании до конца не установлена [19], [20].
Как видим, холестерин критичен для жизни. Он необходим организму так же, как вода, белки, жиры, углеводы, витамины и другие вещества. Нормальное функционирование целого ряда жизненно важных систем организма человека невозможно без холестерина. Так почему же мы верим, что это вещество — «убийца артерий», «ужас века», «общественная опасность номер один»?
Сомнительная теория
В начале ХХ века группа русских ученых во главе с молодым петербуржским физиологом Н.А. Аничковым проводила эксперименты на кроликах, скармливая им пищу животного происхождения [21]. На плотоядной диете растительноядные кролики протянули недолго, а вскрытие показало, что непосредственной причиной смерти явилась закупорка кровеносных сосудов сердца. Отложения на стенках коронарных артерий содержали сгустки жира, холестерина и солей кальция, напоминающие атеросклеротические повреждения сосудов человека (атероматозные бляшки).
Хотя травоядных кроликов на противоестественной мясной диете нельзя считать адекватной моделью для экспериментального атеросклероза у всеядного человека, эти опыты легли в основу «холестериновой» теории, согласно которой причиной образования атеросклеротических бляшек является проникновение холестерина в стенку сосуда. Эта теория завладела умами мировой общественности и породила очень жизнеспособную и долгоживущую страшилку, а человечество вдохновенно и самозабвенно включилось в антихолестериновую кампанию. В чем же суть данной психологической загадки?
Термин «атеросклероз» происходит от греческих слов αθερος — кашица — и σκληρος — твердый. Характерный признак атеросклероза — образование холестериновых бляшек на внутренней поверхности кровеносных сосудов, которые, деформируя стенку сосуда и уменьшая его просвет, нарушают кровоснабжение органов и тканей (рис. 2). При этом внешние признаки заболевания — боли и нарушение функционирования органов — начинают проявляться лишь тогда, когда просвет сосуда закрыт на 75%. Сведения о заболеваниях артерий, напоминающих по своей морфологической структуре атеросклеротические изменения, встречаются в старинных медицинских трактатах, но лишь в 1904 году Ф. Марчанд выделил атеросклероз в качестве самостоятельной нозологической формы.
Атеросклероз — процесс, лежащий в основе большинства заболеваний системы кровообращения (ишемия, инфаркт миокарда, тромбоз, инсульт мозга, гангрена нижних конечностей и др.) [22]. Смертность от инсультов и сердечнососудистых заболеваний, одной из основных причин которых является атеросклероз, уже давно занимает первое место в мире (в России — немногим более 50%), и, несмотря на все достижения медицины, эта печальная статистика остается неизменной. Согласно ВОЗ, ключевым компонентом в развитии атеросклероза является холестерин. Повышенное содержание холестерина в крови определяет 18% всех случаев сердечнососудистых заболеваний и является непосредственной причиной 4,4 миллиона смертей ежегодно.
Толчком к изучению атеросклероза и, соответственно, холестерина послужили наблюдения врачей, сделанные во время войны между США и Кореей в 1950-е годы. У половины погибших американских солдат в возрасте 20–21 года при патологоанатомическом исследовании был обнаружен атеросклероз артерий сердца, причем у некоторых из них просвет сосудов был сужен более чем на 50%. После опубликования этих материалов в США начался «холестериновый бум». В 1988 году была создана и щедро финансируется общенациональная программа США по борьбе с атеросклерозом. Программа включает в себя исследования по биохимии холестерина и по созданию «рациональной американской диеты» с исключением из пищи жиров, углеводов, соли и холестерина. Рекомендации время от времени модифицируются по мере накопления научных данных; последний (третий) пересмотр сделали в 2001 году [23].
Известным своей тучностью американцам начали объяснять пользу продуктов, не содержащих холестерина. Даже на бутылках с минеральной водой писали: «Не содержит холестерина». Было разработано множество диет [24], диетических продуктов без холестерина и лекарств, снижающих его содержание в организме. Стремление к бесхолестериновому питанию в США стало чуть ли не национальным видом спорта, но, несмотря на то, что холестерину была объявлена настоящая война, число посетителей «Макдоналдсов» не уменьшилось, и американцы остаются самыми тучными людьми на планете.
Не стоит забывать, что, согласно Уставу ВОЗ, «здоровье — это состояние полного физического, душевного и социального благополучия, а не только отсутствие болезней или физических дефектов». Это определение ВОЗ можно трансформировать следующим образом: здоровье — это не только отсутствие болезней и физических дефектов, но и условия, исключающие их появление: здоровый социальный и психологический климат, сопряженный со здоровой физической средой (рис. 3). В связи с этим причину тучности американцев следует искать в многофакторной природе здоровья как такового, что, несомненно, должно стать предметом специальных исследований. Во многом это явление надо связывать с нарушением нормального синтеза гормонов, извращением обмена веществ из-за отказа от натуральной пищи, содержащей холестерин, и употребления гидрогенизированных жиров.
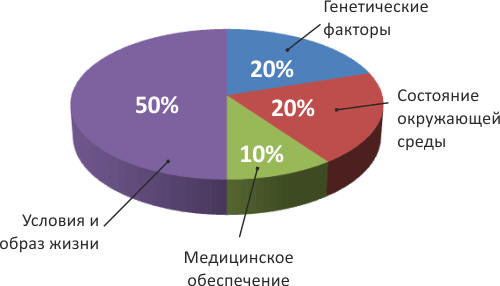
Рисунок 3. Вклад различных факторов в формирование здоровья человека
Прямая связь между количеством холестерина в пище и его концентрацией в крови до сих пор не доказана. Напротив, неоднократно доказано, что холестерин из пищи и холестерин, накапливающийся в атеросклеротических бляшках, — два совершенно разных холестерина. Имеются данные по экспериментам на здоровых добровольцах, которые в течение нескольких месяцев потребляли большие дозы холестерина. Ни у одного из них не отмечено повышения уровня холестерина в крови и признаков атеросклероза [1].
С другой стороны, известно широкое распространение атеросклероза в ряде развивающихся стран, население которых недоедает и голодает. При голодании или неполноценной, низкобелковой диете в сочетании с физическими перегрузками и эмоциональным перенапряжением атеросклероз развивается чрезвычайно быстро [1]. Это было известно и до холестеринового бума — по результатам вскрытия тысяч трупов узников фашистских концлагерей. Даже у молодых заключенных, истощенных и несколько лет не получавших с пищей холестерина, регистрировался атеросклероз в тяжелой форме.
Чтобы разобраться в таких парадоксах, нужно иметь хотя бы общее представление о метаболизме холестерина в организме всеядного человека.
Пути холестерина
Биохимик Конрад Блох (он эмигрировал в Штаты из гитлеровской Германии) и его сотрудники в 1942 г. показали, что в организме человека синтез холестерина начинается с уксусной кислоты. Основные звенья биосинтеза холестерина: ацетат → холестерин → жирные кислоты → половые гормоны (рис. 4). Благодаря этому открытию стало ясно, что холестерин является необходимым компонентом всех клеток организма, и что все стероидные вещества в организме человека вырабатываются из холестерина. В 1964 г. К. Блоху совместно с Ф. Линеном была присуждена Нобелевская премия по физиологии и медицине «за открытия, касающиеся механизмов и регуляции обмена холестерина и жирных кислот».
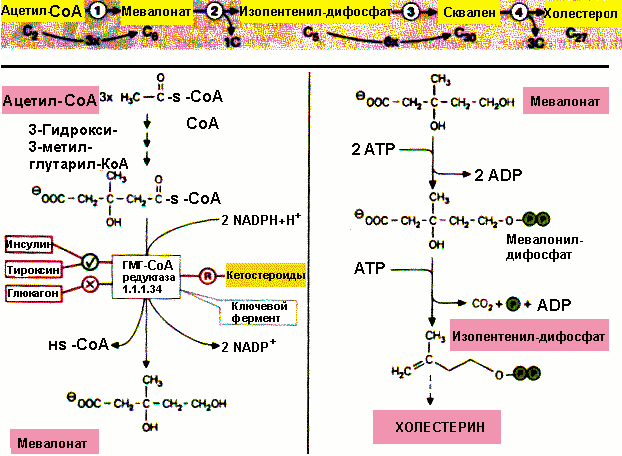
Рисунок 4. Основные этапы синтеза холестерина. На первом этапе этого процесса из трех молекул ацетата и коэнзима А синтезируется 3-гидрокси-3-метилглютарил коэнзим А (ГМГ-КоА). Далее в результате воздействия фермента ГМГ-КоА-редуктазы образуется мевалоновая кислота, которая примерно через 20 последующих этапов превращается в холестерин.
Несмотря на всю сложность и многоэтапность этих процессов, ключевым ферментом, определяющим скорость синтеза холестерина, выступает ГМГ-КоА-редуктаза. Запомним его, дорогой читатель! Работу этого фермента и подавляют статины — широко пропагандируемые гиполипидемические (снижающие уровень холестерина) препараты, о которых речь пойдет позже.
Механизм внутриклеточного холестеринового гомеостаза сложен [27]. Содержание холестерина в клетке регулируется двумя путями. Первый из них контролирует продукцию холестерина по механизму обратной отрицательной связи. Второй связан с регуляцией его транспорта через клеточную мембрану из межклеточного пространства. Этот транспорт осуществляется при участии рецепторов липопротеидов низкой плотности (ЛПНП), о которых будет сказано ниже.
Баланс уровня холестерина в организме достигается благодаря процессам внутриклеточного синтеза, захвата из плазмы (преимущественно из ЛПНП), выхода из клетки в плазму (преимущественно в составе ЛПВП) [26]. Лимитирующая стадия синтеза холестерина в значительной мере определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень. При недостатке этого вещества происходит компенсаторное усиление его захвата и синтеза. Иными словами, поскольку холестерин столь важен для нормальной жизнедеятельности организма, поступление его с пищей (экзогенный холестерин) дополняется синтезом в клетках почти всех органов и тканей (эндогенный холестерин), однако, как указывалось ранее, в значительных количествах он образуется в печени (80%), в стенке тонкой кишки (10%) и коже (5%).
Группа американских исследователей во главе с Маттиусом Чопом из Университета Цинциннати выяснила, что за содержание холестерина в организме отвечает в том числе и мозг, точнее — клетки гипоталамуса, которые реагируют на гормон грелин. Первоначально считалось, что он действует только на выработку гормона роста, но впоследствии оказалось, что этот гормон связан и со многими другими процессами, начиная от чувства голода и заканчивая формированием памяти. Серия экспериментов на мышах показала, что молекулы этого нейропептида взаимодействуют с меланокортиновыми рецепторами 4 типа (MC4R) на поверхности клеток гипоталамуса. Мыши, лишенные взаимодействующих с грелином рецепторов, показали повышенный уровень холестерина. Грелин, взаимодействуя с рецепторами MC4R, влияет на активность гипоталамуса, а уже гипоталамус при помощи ряда других гормонов влияет на переработку холестерина в печени [29].
Как ни парадоксально, но открытия в области механизмов биосинтеза и метаболизма холестерина не то что замалчивают и скрывают от общественности, но и не пропагандируют. Эти сведения лишь породили на свет еще один миф о холестерине — враге тонких талий.
«Перевозчики»
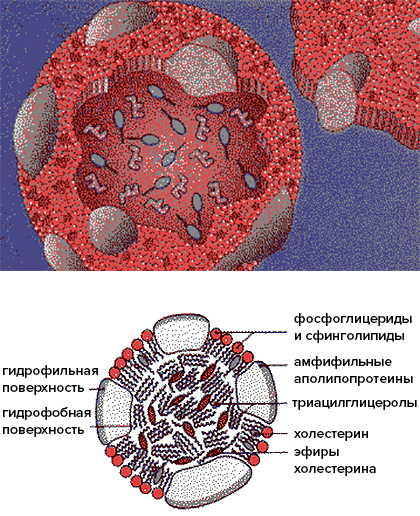
Рисунок 5. Белково-липидный комплекс.
В организме холестерин никогда не бывает сам по себе — он всегда связан с липидами. Будучи гидрофобным соединением, это вещество нерастворимо в воде и плазме крови. Холестерин может переноситься с током крови только в составе так называемых транспортных форм — липопротеинов (белково-липидных комплексов), представляющих собой сферические частицы (рис. 5), наружный (гидрофильный) слой которых образуют фосфолипиды и белки-апопротеины (или просто «апо»), а гидрофобное ядро составляют триглицериды (попросту говоря, жиры) и холестерин (точнее, эфир холестерина). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц и в обмене липидными частями между различными липопротеинами (то есть, служит своего рода контейнером) [30]. Подробнее о строении различных транспортных форм см. во врезке.
Судьбу холестерина в организме определяют аполипопротеины: или холестерин высвободится из «упаковки» и будет поглощен клетками для выполнения своих жизненно важных функций, или излишний холестерин будет удален из тканей и крови и упакован внутрь липопротеиновой частицы, которая унесет его в печень. Аполипопротеины являются структурными элементами, у которых гидрофильный участок контактирует с водными компонентами плазмы, тем самым обеспечивая перенос водонерастворимых липидов кровотоком. Они служат лигандами для рецепторов специфических липопротеинов (например, обеспечивающих первую стадию поглощения липидов клетками). Наконец, некоторые из них — это кофакторы липолитических ферментов, обеспечивающих метаболизм холестерина и липопротеинов.
Основной компонент ЛПВП — аполипопротеин А1, тогда как ключевым компонентом ХМ, ЛПОНП, ЛППП, ЛПНП является аполипопротеин В. Именно он обеспечивает выемку холестерина из «упаковки» и передачу его в клетки, отвечает за способность липопротеинов переносить холестерин из печени в ткани, необходим для образования липопротеинов, богатых триглицеридами. Аполипопротеин В отличается полиморфизмом и встречается в двух формах:
- апоВ-100 — большой белок (4536 аминокислотных остатков), содержащийся в ЛПОНП, ЛППП и ЛПНП. Образуется в печени, прочно связан с липидной сердцевиной и поэтому не способен переходить из одной сферической частицы в другую;
- апоВ-48 обнаруживается в хиломикронах, образуется в тонком кишечнике при расщеплении апоВ-100.
«Плохой» и «хороший»
Термины «плохой» и «хороший» холестерин возникли после того, как было установлено, что в организме холестерин никогда не бывает сам по себе — он всегда связан с липидами [36]. Различные классы липопротеинов по-разному причастны к возникновению атеросклероза. Так, атерогенность липопротеинов частично зависит от размера частиц. Самые мелкие липопротеиды, такие как ЛПВП, легко проникают в стенку сосуда, но так же легко ее покидают, не вызывая образования атеросклеротической бляшки. За это их и называют «хорошими» липопротеинами. ЛПНП, ЛППП и ЛПОНП при окислении легко задерживаются в сосудистой стенке. ЛПНП — наиболее атерогенные липопротеины крови.
А вот хиломикроны сами по себе неатерогенны: они слишком велики, вследствие чего неспособны проникать в сосудистый эпителий и вызывать эндотелиальные дисфункции. Но когда их триглицеридная «начинка» расходуется, их остатки (remnants) сильно уменьшаются в размерах и приобретают потенциальную атерогенность. Такие ремнантные частицы содержат экзогенный (пищевой) холестерин, апоВ-48 и апоЕ. Именно маленький размер ремнантных хиломикронов позволяет им проникать через стенки артерий и связываться со специфическими участками на тканевых макрофагах, вызывая их превращение в «пенистые» клетки и запуская медленный воспалительный процесс в стенках артерий (об этом — чуть позже). В норме апоЕ, расположенный на поверхности таких частиц, в печени связывается с рецепторами Х-ЛПНП и там же утилизируется. Но до этого момента ремнантные частицы (теоретически) могут успеть реализовать свою потенциальную атерогенность, особенно, если печень нездорова (например, поражена вирусом гепатита С) [37]. В общем, именно высвобождение из хиломикронов триглицеридов и последующая неэффективная утилизация ремнантных ХМ и повышают риск атерогенеза [38].
Большая часть того того, что известно о «хороших» и «плохих» свойствах холестерина, касается именно липопротеинов — «перевозчиков». Холестерин, связанный с липопротеинами низкой, промежуточной и очень низкой плотности, стали называть «плохим», а связанный с не имеющими отношения к атеросклерозу липопротеинами высокой плотности — «хорошим» [39]. Это стало очевидным из многочисленных проспективных исследований, в которых было доказано, что повышение уровня «плохого» Х-ЛПНП и понижение концентрации «хорошего» Х-ЛПВП увеличивает риск возникновения и развития атеросклероза, риски фатальных и нефатальных инфарктов миокарда и ишемических инсультов [40], [41].
Полученные результаты послужили платформой для разработки рекомендаций по снижению концентрации «плохого» холестерина, ставших, как считали, основой профилактики атеросклероза и стратегической целью диетического и медикаментозного вмешательства.
Казалось, что исследования ученых, проведенные на самом современном молекулярном уровне, выстроили четкую схему формирования атеросклероза как болезни нарушенного липидного обмена. Эту гипотезу как будто подтверждали и результаты лечения антиатеросклеротическими препаратами, мишенью которых был холестерин. Препараты, воздействующие на различные звенья липидного обмена, уменьшали частоту осложнений атеросклероза, предупреждали его дальнейшее развитие. В который раз казалось, что проблема атеросклероза решена. Но, как оказалось, все не так просто, и остались вопросы, ответов на которые не было. Их довольно много, и, прежде всего, вопрос практических врачей: почему атеросклероз развивается у лиц с нормальным содержанием холестерина в крови, а нередко и при низком его содержании? [42]
«Плохой», «еще хуже» и «совсем плохой»
Дело не только в соотношении концентраций атерогенного и неатерогенного холестерина. Действительно, чем больше в плазме частиц Х-ЛПНП, тем хуже. Но чем меньше их размер, тем еще хуже. Как указывалось выше, частицы Х-ЛПНП очень гетерогенны по своему липидному составу, заряду, размеру и форме. Чем меньше размер таких частиц, тем выше их атерогенность. Такие частицы были названы мелкими плотными, поскольку по сравнению с «нормальными» имеют более высокую плотность и пониженное содержание триглицеридов. К несчастью, они отличаются более длительным сроком жизни в плазме по причине изменения сродства к рецепторам печени, благодаря которым поглощаются и утилизируются ею. Важно подчеркнуть, что уровень мелких плотных частиц Х-ЛПНП в значительной мере предопределяется генетическими факторами, а их повышенные концентрации связаны с повышением риска сердечнососудистых заболеваний (ССЗ), метаболического синдрома и диабета 2 типа. А это означает, что у двух лиц при одинаковом количестве Х-ЛПНП и одинаковой концентрации Х-ЛПВП могут быть разные уровни мелких плотных частиц Х-ЛПНП и, стало быть, различные риски и атеросклероз различной тяжести [43].
Размер частиц Х-ЛПНП был признан предиктором возникновения и развития ССЗ и последующих острых коронарных событий. В марте 2006 года на страницах одного из самых престижных медицинских журналов появился манифест, подписанный тридцатью специалистами из десяти стран [44]. Он призывает к установлению новых правил оценки риска ССЗ. Предлагается заменить общепринятое определение в плазме общего холестерина, Х-ЛПНП и Х-ЛПВП на измерение концентраций АпоВ и АпоА — основных апопротеинов Х-ЛПНП и Х-ЛПВП, соответственно. Именно показатель баланса атерогенных и антиатерогенных частиц АпоВ/АпоА — самый точный индикатор риска ССЗ у лиц с бессимптомными сердечнососудистыми заболеваниями и диабетиков.
К сожалению, уменьшение размера частиц Х-ЛПНП — далеко не все, что делает «плохой» холестерин «еще хуже». Оказалось, что избыточная концентрация глюкозы в крови диабетиков приводит к нарушению обмена холестерина, а главная причина их смертности — ССЗ, вызванные гиперхолестеринемией. В основе такой причинно-следственной связи лежит гликозилирование — неферментативное присоединение глюкозы к апопротеину, в результате чего химически модифицированный АпоВ делает частицы Х-ЛПНП более атерогенными. А это приводит к выводу, что у двух лиц с одинаковым количеством частиц Х-ЛПНП одинакового размера могут быть разные уровни гликозилированного АпоВ и, стало быть, разные судьбы. И закономерно возникает вопрос: можно ли считать нарушение метаболизма холестерина и изменение размера частиц Х-ЛПНП единственными причинами атеросклероза? Ведь изменения концентраций «плохого» холестерина не объясняют всех случаев ССЗ: примерно половина сердечных приступов и ишемических инсультов происходят при нормальных уровнях холестерина.
Было установлено, что в атеросклеротических повреждениях стенок сосудов всегда обнаруживается миелопероксидаза (МПО) — центральный нападающий неспецифического иммунитета. Этот гем-содержащий фермент выполняет одну из ключевых функций в микробицидной системе, опосредованной нейтрофилами. Супероксидные анионы, являющиеся продуктами окислительного и нитрозативного стресса, повреждают не только микроорганизмы, но и ткани макроорганизма. На то он и неспецифический иммунитет! Это происходит при многих воспалительных процессах [45], в том числе и при атеросклерозе. Высокореактивные соединения окисляют и модифицируют в «плохом» Х-ЛПНП практически все его компоненты, вследствие чего пусть «плохой», но «свой» Х-ЛПНП превращается в окисленный и уже «чужой» о-Х-ЛПНП. И тут иммунная система начинает его уничтожать. Макрофаги, признав в модифицированном АпоВ чужака, интенсивно поглощают о-Х-ЛПНП, превращаясь в «пенистые» клетки, перегруженные окисленными фосфолипидами и холестерином [46]. Медленный воспалительный процесс запущен! (рис. 7).
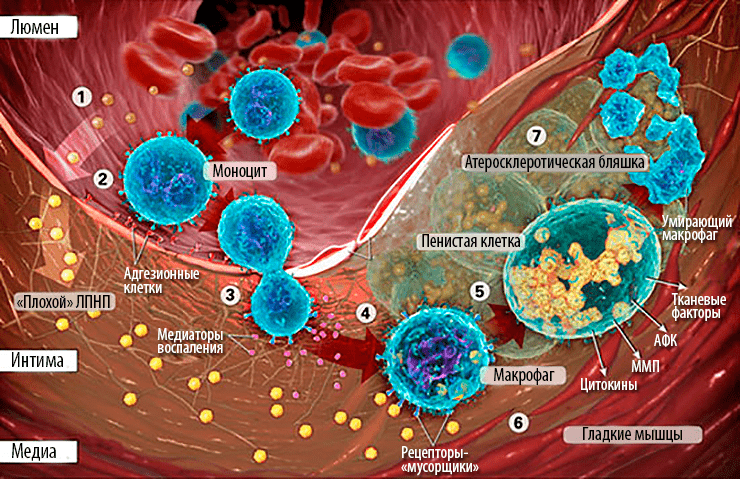
Рисунок 7. Строение атеросклеротической бляшки, образовавшейся в результате воспалительного процесса. «Воспалительная» теория утверждает, что атеросклероз — это вызываемый неспецифическим иммунитетом вялотекущий воспалительный процесс в стенках сосудов.
Следующий участник «ОПГ» («организованной преступной группировки»), причастной к возникновению атеросклероза, — фосфолипаза А2 (ЛП ФЛА2), ассоциированная с липопротеинами. Этот фермент связан преимущественно с Х-ЛПНП, но в малых количествах обнаруживается и в Х-ЛПВП. Он уничтожает окисленные фосфолипиды, содержащиеся уже в «совсем плохом» о-Х-ЛПНП. Благородная цель омрачается тем, что высокие уровни ЛП ФЛА2 присутствуют ни где-нибудь, а в атеросклеротических бляшках. Показано, что повышенная активность ЛП ФЛА2 является предиктором заболеваний коронарных артерий, инфаркта миокарда и, особенно, ишемических инсультов [48]. Известно, что высокий холестерин связан с риском ИБС, но не является надежным предиктором ишемического инсульта у людей среднего возраста. Таким предиктором может быть именно ЛП ФЛА2. Тест для определения уровня этого фермента в плазме одобрен в США для оценки индивидуального риска ишемического инсульта.
Помимо МПО, «обезображенного» ею о-Х-ЛПНП и ЛП ФЛА2, пытающейся это «безобразие» уничтожить, в атеросклеротических повреждениях обнаруживается также С-реактивный белок (СРБ) — центральный нападающий острой фазы воспаления. Установлено, что повышение базовых уровней СРБ позволяет оценить степень риска острого инфаркта миокарда, ишемического инсульта и внезапной смерти у лиц, еще не имеющих диагностированных ССЗ, даже в отсутствие гиперхолестеринемии. Доказано, что СРБ специфически связывается с о-Х-ЛПНП, следствием чего является активация системы комплемента и инициация воспалительного процесса в стенках артерий [49]. Подтверждением «виновности» СРБ в атерогенезе служит синтезированный ингибитор СРБ, на который возлагаются надежды в плане ранней терапии острых инфарктов миокарда. Этот ингибитор снижает риск смертности и предотвращает увеличение зоны инфаркта.
Кажется, с «организованной преступной группировкой» во челе с «плохим» Х-ЛПНП все ясно. Чего же еще ожидать?!
И ты, «Брут»?!
Мы помним, какие хорошие ЛПВП! Ведь они удаляют избыточный холестерин из клеток органов, тканей и крови, то есть проявляют антиатерогенные свойства. Помимо этого, частицы ЛПВП, содержащие «хороший» холестерин (Х-ЛПВП), обладают многими другими положительными характеристиками [50], [51]:
- их основные белки — АпоА1 и АпоАII — являются эффективными антиоксидантами;
- с ними связан особый фермент параоксоназа 1 (ПОН 1), который ингибирует окисление Х-ЛПНП, расщепляя токсичные окисленные липиды в составе о-Х-ЛПНП;
- уменьшая связывание моноцитов крови со стенками артерий, они проявляют противовоспалительные качества;
- стимулируют движение эндотелиальных клеток;
- ингибируют синтез факторов активации тромбоцитов эндотелиальными клетками;
- защищают эритроциты от генерации прокоагулянтной активности, что понижает вероятность образования тромбов;
- стимулируют синтез простациклинов эндотелиальными клетками, продлевая время их жизни;
- уменьшают синтез ДНК в васкулярных гладких мышцах, индуцируемый эпидермальным фактором роста;
- имеют тромболитические свойства;
- модулируют эндотелиальную функцию, очевидно, за счет стимулирования продукции NO.
Количественный вклад каждого из этих факторов в понижении риска атерогенеза пока не ясен, но в целом их значение трудно переоценить [28]. Так можно ли ожидать от такого «хорошего» Х-ЛПВП каких-нибудь «подлянок»? Увы, да!
Оказалось, плазменные частицы Х-ЛПВП очень неоднородны по физико-химическим свойствам, метаболизму и биологической активности. Антиатерогенные свойства Х-ЛПВП могут пострадать при нарушениях обмена веществ, связанных с прогрессирующим атеросклерозом. Действительно, метаболический синдром и диабет 2 типа характеризуются не только повышенным сердечно-сосудистым риском и низким уровнем холестерина в ЛПВП, но также и функциональной дефективностью. Функциональный недостаток ЛПВП глубоко связан с изменениями их внутрисосудистого метаболизма и компонентного состава. Формирование частиц ЛПВП с ослабленным антиатерогенным действием обусловлено обогащением ядра частицы триглицеридами и обеднением эфирами холестерина, изменением структуры аполипопротеина A-I (апоA-I), заменой апоA-I сывороточным амилоидом А и модификацией белковых компонентов в результате окисления и гликозилирования. Функциональная дефективность Х-ЛПВП и их субнормальные уровни могут действовать синергически, ускоряя прогрессирование атеросклероза при нарушении обмена веществ [52].
Также установлено, что при острой фазе воспаления снижается концентрация основного апопротеина Х-ЛПВП — апоА, который обеспечивает обратный транспорт холестерина. Более того, снижается уровень ПОН 1 — независимого показателя риска предрасположенности к ишемической болезни сердца (ИБС) и инфаркту миокарда (ИМ). В результате таких трагических событий при воспалительном процессе большинство антиатерогенных функций Х-ЛПВП превращаются в свою противоположность: «хороший» Х-ЛПВП становится «плохим» [53]. У лиц с ССЗ весьма часто обнаруживается именно провоспалительный и атерогенный вариант Х-ЛПВП.
К сожалению, потеря Х-ЛПВП антиатерогенных свойств — не единственная беда, которая с ним приключается при воспалении. Он также подвергается окислению благодаря действию МПО. Частицы Х-ЛПВП, выделенные из атеросклеротических повреждений, содержат этот фермент. АпоА частиц Х-ЛПВП, циркулирующих в плазме лиц с ССЗ, содержит много 3-нитротирозина и 3-хлортирозина — продуктов активности МПО. Хлорирование и нитрирование АпоА приводят к уменьшению обратного транспорта холестерина, осуществляемого ЛПВП.
Американские ученые выяснили, как холестерин переносится из липопротеидов высокой плотности (ЛПВП) в липопротеиды низкой плотности (ЛПНП), становясь из «хорошего» «плохим». Полученные данные подтвердили существовавшую гипотезу о том, что холестерин перемещается между липопротеидами разных фракций по тоннелю, проходящему через центр молекулы белка-переносчика эфиров холестерина (БПЭХС) (рис. 8). Таким образом, Х-ЛПВП — действительно «хороший», но лишь до поры до времени [54].

Рисунок 8. Белок-переносчик эфиров холестерина (БПЭХС). Исследователи из Национальной лаборатории Лоренса Беркли при Министерстве энергетики США впервые методом электронной микроскопии получили изображение структуры БПЭХС, транспортирующего холестерин из ЛПВП в ЛПНП. БПЭХС является небольшой (53 кДа) молекулой, имеющей форму банана, с заостренным N-концом и сферическим С-концом. N-конец проникает в ЛПВП, а С-конец взаимодействует с ЛПНП, что приводит к образованию трехкомпонентного комплекса. На основании структурного анализа было сделано предположение, что такое взаимодействие может создавать молекулярные силы, изменяющие форму концов БПЭХС с образованием пор с обеих сторон молекулы. Эти поры соединяются с центральными полостями БПЭХС, формируя тоннель, через который холестерин выходит из ЛПВП.
Загадочный участник «преступных действий»
Обнаружено, что повышенный риск стенокардии и первых сердечных приступов также связан с липопротеином (а), который может повышать риск образования тромбов. Некоторые эксперты считают, что высокий ЛП (а) — только маркер (свидетель) атеросклероза на его поздних стадиях, но не его причина. С другой стороны, повышенный уровень ЛП (а) связан с долгожительством, а сам ЛП (а) является родственником плазминогена, участвующего в тромболизисе. Это вещество таит в себе много загадок, с которыми лучше всего познакомиться в обзорной статье Велькова В.В. «Этот загадочный липопротеин (а)», что мы и рекомендуем сделать нашим читателям [35].
Еще один «подозреваемый»
Причины возникновения атеросклероза и механизм его развития на сегодня нельзя считать окончательно установленными. Как видно из сказанного выше, наряду с традиционной «инфильтративной» теорией атерогенеза сосуществует «воспалительная» теория, утверждающая, что атеросклероз — это вызываемый неспецифическим иммунитетом вялотекущий воспалительный процесс в стенках сосудов. Нельзя сказать, что новые теории возникновения атеросклероза скрывают от общественности, их просто не пропагандируют.
Вот что пишет академик Евгений Чазов: «История изучения атеросклероза — это история творчества нескольких поколений врачей и ученых. Труд десятков, сотен исследователей „по камешкам“, как фундамент здания, формировал истину о механизмах развития и лечения атеросклероза. Мы до сих пор не можем ответить достаточно точно на сакраментальный вопрос медицины — что же все-таки представляет собой атеросклероз? Вероятно, мы были бы ближе к выяснению сути этого процесса, если бы долгие годы не оставались под гипнозом авторитета школы Н. Аничкова и не верили слепо в „инфильтративную“ теорию его развития. Конечно, Аничков — великий ученый, который навсегда останется в истории медицины как первый исследователь, связавший развитие атеросклероза с холестерином. Однако вопросов, которые возникали в связи с „инфильтративной“ теорией формирования атеросклероза и его „кроличьей“ моделью, было предостаточно, и многие стали задумываться об истинной сути этого патологического процесса».
Неузнаваемо преобразились методические возможности изучения атеросклероза. Теперь ученые в его возникновении и формировании выделяют четыре определяющих механизма:
- наследственный фактор,
- нарушение липидного обмена,
- состояние сосудистой стенки,
- нарушение рецепторного аппарата клеток.
В каждом из них обнаружено не одно патологическое звено, формирующее в конечном итоге тот комплекс патогенетических факторов, которые определяют возникновение атеросклеротических изменений в стенке сосуда [32]. Многочисленными эпидемиологическими исследованиями было показано, что атеросклероз — это полиэтиологическое заболевание. Приписывание холестерину всех напастей в настоящее время вызывает у специалистов, вырвавшихся из плена «инфильтративной» теории, все больше и больше сомнений.
В процессе формирования атеросклероза состояние сосудистой стенки играет не меньшую роль, чем нарушения липидного обмена. Право на жизнь получила теория, основанная на том, что для возникновения болезни необходимо повреждение стенки сосуда (механическое, химическое или иммунологическое). Нарушение функции эндотелия могут вызвать многие факторы: гемодинамические (артериальная гипертония), избыточный уровень гормонов (гиперинсулинемия), инфекции, токсичные соединения и др. Оказалось, что в местах, предрасположенных к формированию атеросклероза, происходит, прежде всего, трансформация клеток. В этих областях сосудов вместо дифференцированных, четко отграниченных клеток эндотелия появляются крупные многоядерные клетки неправильной формы. Меняются и входящие в состав стенки сосуда гладкомышечные клетки — они увеличиваются в размерах, вокруг их ядер накапливается коллаген [33]. Именно этот факт имеет большое значение в понимании процесса развития атеросклероза у больных с нормальным и даже пониженным содержанием холестерина в крови. Возможно, образование холестериновых бляшек — это патологическое развитие защитной реакции, направленной на устранение дефекта в стенке сосуда, и холестерин здесь не причина, а следствие (рис. 9).
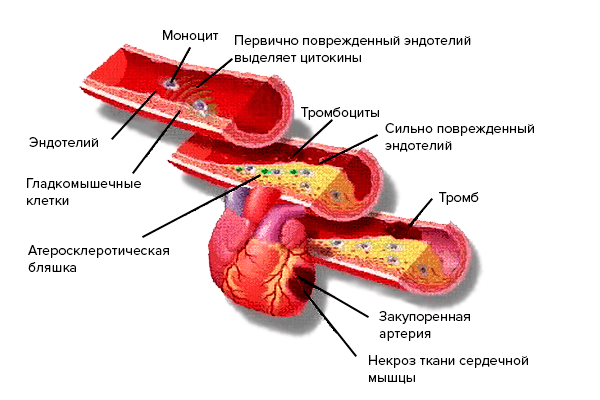
Рисунок 9. От повреждения эндотелия до инфаркта.
Среди факторов, повреждающих стенки сосудов, в последнее время особый акцент делается на гомоцистеин [55]. В 1995 году научный мир потрясло известие о том, что ученые открыли «новый холестерин» [56], хотя это соединение впервые описали еще в 1932 году, а гомоцистеиновая теория атеросклероза возникла еще в 1969 году. До недавнего времени о гомоцистеине практически не говорили, однако сегодня трудно найти авторитетное медицинское издание, которое бы не обсуждало важную роль нарушений его метаболизма в развитии сердечнососудистых и ряда других заболеваний [57].
Гомоцистеин — это промежуточный продукт обмена незаменимой аминокислоты метионина. В окончательные соединения, вырабатываемые организмом, он не входит. В норме гомоцистеин живет в организме очень короткое время и под воздействием фолиевой кислоты и витамина В12 рециклируется обратно в метионин или под влиянием витамина В6 превращается в следующий продукт обмена — цистотионин. Различные наследственные и приобретенные нарушения в организме приводят к тому, что гомоцистеин не утилизируется. В этом случае он накапливается в организме и становится для него опасным. Главное негативное его действие заключается в том, что он, обладая цитотоксичностью, поражает внутреннюю стенку артерий — интиму, покрытую эндотелием [58]. Образуются разрывы эндотелия, которые организм пытается чем-то заживить. Вот тогда он и использует для этого холестерин и другие жирные субстанции.
Даже очень маленькие количества гомоцистеина могут оказывать достаточно сильное действие на сосуды, поэтому нормы этого вещества для человека практически не существует, хотя и принято считать уровень гомоцистеина в крови натощак в диапазоне 5–15 мкМ/л нормальным. Концентрация этого вещества в крови в 1000 раз меньше, чем холестерина, и повышение его уровня всего на 20–30% может вызвать тяжелые последствия [59]. Установлено, что гомоцистеин вклинивается в холестериновый гомеостаз нейронов, а совместное действие с холестерином в присутствии меди существенно повышает уровни реактивных кислородных радикалов, делая нейроны более уязвимыми к амилоиду-β. Гипергомоцистеинемия является фактором риска деменции [60], [61].
Работа ферментов, участвующих в биохимических превращениях гомоцистеина, невозможна без кофакторов («помощников») — витаминов B6, B12 и B9 (фолиевой кислоты). В этом кроется возможный подход к профилактике и лечению атеросклероза с помощью витаминов группы B, прежде всего — фолиевой кислоты [62].
«Фолиум» в переводе с латинского означает «лист». Поэтому неудивительно, что естественным источником фолиевой кислоты являются салаты, капуста, сельдерей, лук, зеленый горошек, спаржа. Немало фолатов и в цитрусовых, бананах, авокадо, свежих грибах, свекле, зерновых, гречневой и овсяной крупах, пшене, орехах и др. Очень хорошим источником витамина В9 является аптека. :-) Однако следует иметь в виду, что беременные женщины не должны злоупотреблять этим витамином. Как показали результаты исследований, дети, родившиеся у матерей с высокими уровнями фолиевой кислоты во время беременности, имеют повышенный риск развития астмы.
Фолиевая кислота прежде ничем не выделялась среди своих собратьев-витаминов. Но в последнее время она стала настоящим возмутителем спокойствия. Именно недостатком в организме человека этого витамина многие ученые объясняют теперь возникновение главной болезни цивилизации — атеросклероза [63].
Гомоцистеиновая теория весьма убедительно объясняет причины возникновения и патогенез атеросклероза, хотя, как и другие теории, не дает исчерпывающих ответов на все поставленные вопросы.
Статины: смертельная борьба
С тех пор, как Всемирная организация здравоохранения объявила холестерин одной из главных причин атеросклероза, это вещество впало в немилость и подлежит изгнанию. Под влиянием обменно-пищевой теории, отводившей главную роль в развитии атеросклероза холестерину, поступающему в организм с пищей, было разработано множество диетических продуктов без холестерина и лекарств, снижающих его содержание в организме. Антихолестериновую теорию стали пропагандировать с помощью лозунгов, поражающих воображение («убийца артерий», «ужас века», «общественная опасность номер один» и др.).
Выработанные наукой догмы о холестерине долгое время не допускали никакой возможности серьезного обсуждения или правильной оценки результатов. Исторически сложилось так, что «холестериновая» теория атеросклероза возникла первой. Производители пищевых продуктов и лекарственных препаратов ее усвоили и заставили работать на себя. Очистить продукт от холестерина сегодня не очень сложно, а затем можно повесить на него лейбл диетического продукта, способствующего оздоровлению. Еще проще сделать заявление «не содержит холестерина» о продукте, в котором этого вещества априори быть не может, как, например, в арбузе или растительном масле. И остановить эту рекламную машину теперь просто никому не позволят [1]!
Увы, и для фармацевтических фирм холестерин — легкая мишень, на которой можно хорошо заработать. Поэтому неудивительно, что основная и логичная причина атеросклероза и спровоцированных им заболеваний была целенаправленно забыта, и любой подход, поддерживающий ее, считался странным, нереалистичным и ненаучным.
Концепция влияния уровня холестерина на развитие атеросклероза по сегодняшний день остается самой живучей и агрессивно активной. Вокруг этой гипотезы «родились» и «возмужали» не только так называемые «диетические» продукты питания и всевозможные пищевые добавки, но и лекарства для понижения уровня холестерина. Основной задачей такого лечения является снижение уровня «плохого» холестерина с целью уменьшения риска возникновения ИБС (первичная профилактика) или ее осложнений (вторичная профилактика).
И врачи, и самые продвинутые из пациентов знают, что холестерин из пищи напрямую не связан с атеросклерозом. Несмотря на это, главная и обязательная врачебная рекомендация по профилактике и лечению атеросклероза — исключить из диеты всё жирное, а также яйца, мозги и другие богатые холестерином продукты и заменить животные жиры на растительные.
Вполне вероятно, что вам порекомендуют прием статинов — главного и чудотворного (по утверждениям разработчиков и продавцов) средства «от холестерина». Интересно, как именно производители продуктов и лекарств добиваются от врачей такого двоемыслия?
Статины — вещества, специфически подавляющие активность 3-гидрокси-3-метилглутарил КоА редуктазы, фермента, необходимого для одного из первых этапов синтеза холестерина, — были открыты в 1976 году. В этот список входят ловастатин (мевакор), правастатин (правакол), симвастатин (зокор), флувастатин (лескол), аторвастатин (липитор). И он постоянно пополняется, несмотря на неоднозначные результаты применения статинов в клинической практике.
«Организм человека физиологически и биохимически является настолько точно и тонко скоординированной системой, что длительное вмешательство в тот или иной естественный жизненный процесс не может остаться без разнообразных, часто неожиданных последствий» [1]. Так, женщинам пожилого нерепродуктивного возраста прием статинов категорически противопоказан, так как эти препараты повышают риск диабета 2 типа [64]. По сравнению со сверстницами, не принимающими гипохолестеринемические средства, у них риск этого заболевания выше на 48% [65]. В метаанализе двух недавно проведенных широкомасштабных плацебо-контролируемых исследований установлено, что статиновая терапия повышает риск диабета 2 типа на 9–13% по сравнению с контролем [66].
Частый побочный эффект такого лечения — миопатия — приводит к слабости и атрофии мышц. Наше сердце тоже мышца, причем самая главная, а ее кровоснабжение в первую очередь страдает при атеросклерозе. И если на эту уже больную мышцу подействовать статинами, нетрудно представить, что за этим может последовать.
Безусловно, статины дают какой-то краткосрочный эффект, особенно у людей, страдающих генетически детерминированной гиперхолестеринемией, но в предупреждении и устранении атеросклероза их роль весьма сомнительна. Они лишь на какое-то время откладывают инфаркт или смерть от него. И здесь необходимо отметить, что эти препараты вводились в широкую практику и прописывались миллионам пациентов в возрасте 50–60 лет, поскольку именно в этой возрастной категории самый высокий риск ССЗ [67]. Впоследствии, спустя десятилетия, длительный прием статинов обернулся для этих людей ослаблением памяти, повышенным риском болезни Паркинсона и болезни Альцгеймера [1], [68]. Был сделан вывод, что статины действительно снижают риск ССЗ у людей среднего возраста, тогда как у людей в возрасте 75–85 лет способствуют повышению частоты их смертности.
Громкие скандалы стали неотъемлемой частью международного фармацевтического рынка. Так, в августе 2001 года немецкая компания Bayer объявила о прекращении продаж церивастатина из-за повышенного риска развития миопатии (нарушения сократительной способности мышечных волокон) и случаев зарегистрированной смерти. К августу 2003 года против этой фирмы было подано более 7800 исков. FDA (комиссия по контролю качества пищевых продуктов и фармпрепаратов США), разрешившая этот препарат к продаже в 1997 году, недавно объявила, что смертность от церивастатина в 16–80 раз выше, чем от других лекарств из группы статинов. Иными словами, вероятность смерти в результате снижения уровня холестерина предусмотрена заранее.
Но сообщения о сомнительной пользе статинов, в том числе опубликованные в весьма уважаемом Американском журнале кардиологии [69], заглушаются множеством других статей, в которых статины в очередной раз оказываются очень, очень полезными [70], [71].
12–15 миллионов американцев принимают статины. Недавно проведенные в США ретроспективные исследования показали, что за период от 1988–1994 до 2007–2008 средняя концентрация общего холестерина крови у взрослых граждан снизилась с 216 мг/дл до 197 мг/дл преимущественно за счет понижающих холестерин препаратов, а не за счет рекламируемых американских диет. За анализируемый период потребление таких лекарств выросло с 1,6% до 12,5% [72]. В России таких подсчетов не проводили, но отдельные работы показывают, что у нас статины принимают только 0,7–5% больных атеросклерозом.
В 1997 году FDA утвердила еще более низкие показатели холестерина, к которым должен стремиться человек, заботящийся о своем здоровье [73]. Это означает, что пока холестериновая теория остается общепринятой, врачи и пациенты вопреки фактам, здравому смыслу и биохимии организма насмерть (в прямом смысле этого слова) должны бороться с веществом, без которого жизнь просто невозможна.
«Судьба всякой истины — сначала быть осмеянной, а потом уже признанной» (А. Швейцер)
До сих пор не имеется ни надежного метода лечения атеросклероза, ни его профилактики. Почему же врачи приписывают больным атеросклерозом и сердечнососудистыми заболеваниями бесхолестериновую диету и/или статины и иже с ними? В чем же причины беспомощности медицины перед этим грозным заболеванием?
Спецкурс «биохимия организма» в медицинском институте никак (увы!) не связан с общей диагностикой болезней, назначением анализов, выписыванием рецептов и т.д. Ну, а об интересах производителей лекарств не стоит повторяться. Поэтому ожидать, что рядовые врачи будут разбираться в нюансах биохимии организма и роли холестерина и не станут поддаваться пропаганде фармацевтических фирм, бессмысленно. Сегодня на наши головы выливается такое количество медицинской информации, что и профессионалу часто сложно в ней разобраться.
Если говорить коротко, то причины беспомощности медицины перед атеросклерозом — это принципиально ошибочные, но укоренившиеся выводы, традиционная в медицине стереотипность мышления, слепая вера в авторитеты и... интересы производителей диетического питания и фармпрепаратов.
Сколько усилий было приложено компаниями для повышения спроса на так называемые «диетические» продукты, пищевые добавки и лекарственные препараты, снижающие уровень холестерина! К сожалению, у врачей сознание «промыто» антихолестериновым лобби еще сильнее, чем у пациентов, особенно, если учесть насколько это прибыльно для медицинской практики некоторых из них. «Массовый медицинский психоз, начавшийся с холестеринофобии, может излечить только время» [1].
Прислушиваясь к возрастающей в последнее время критике, Ассоциация производителей фармацевтической продукции США (Pharmaceutical Research and Manufactures of America) приняла свод правил, определяющих стандарты рекламирования лекарств потребителям. В своде правил говорится, что нацеленная на потребителя реклама фармпрепаратов должна быть точной и не вводить в заблуждение, содержать лишь подкрепленные достаточными доказательствами факты о свойствах лекарств, корректно отражать риски, сопутствующие приему того или иного средства, а также соответствовать требованиям FDA.
Что ж, остается только надеяться, что когда-нибудь здравый смысл восторжествует, и наши потомки смогут и победить атеросклероз, и реабилитировать без вины виноватый и жизненно необходимый холестерин.
Первоначальная версия статьи была опубликована в интернет-журнале «Коммерческая биотехнология» [74]. Автор выражает особую благодарность Велькову В.В., обзорные материалы которого очень помогли в написании данной статьи.
Литература
- Элементы: «Холестерин: наш друг или враг?»;
- Липидный фундамент жизни;
- Ленинджер А. (1976). Биохимия. М.: «Мир»;
- André Tchernof, Fernand Labrie, Alain Bélanger, Denis Prud'homme, Claude Bouchard, et. al.. (1997). Relationships between endogenous steroid hormone, sex hormone-binding globulin and lipoprotein levels in men: contribution of visceral obesity, insulin levels and other metabolic variables. Atherosclerosis. 133, 235-244;
- Xiaohui Cui, Bernard Rosner, Walter C. Willett, Susan E. Hankinson. (2010). Dietary Fat, Fiber, and Carbohydrate Intake and Endogenous Hormone Levels in Premenopausal Women. HORM CANC. 1, 265-276;
- Christine M. Williams, Karen Maunder, D. Theale. (1989). The effect of a low-fat diet on luteal-phase prolactin and oestradiol concentrations and erythrocyte phospholipids in normal premenopausal women. Br J Nutr. 61, 651-661;
- Lejsková M., Alušík S., Valenta Z., Adámková S., Pitha J. (2012). Natural postmenopause is associated with an increase in combined cardiovascular risk factors. Physiol. Res. 6, 587–596;
- Shultz T.D. and Rose D.P. (1988). Effect of high-fat intake on lactogenic hormone bioactivity in premenopausal women. Am. J. Clin. Nutr. 3, 791–794;
- Ernst J. Schaefer, Stefania Lamon-Fava, Donna Spiegelman, Johanna T. Dwyer, Alice H. Lichtenstein, et. al.. (1995). Changes in plasma lipoprotein concentrations and composition in response to a low-fat, high-fiber diet are associated with changes in serum estrogen concentrations in premenopausal women. Metabolism. 44, 749-756;
- Nayar S., Reggio B.C., Henson M.C. (1996). Association of endogenous steroid levels with high and low density lipoprotein concentrations in the human maternal-fetoplacental unit at term. J. Reprod. Med. 2, 91–98;
- Steven Grinspoon, Karen Miller, Caryn Coyle, Judy Krempin, Catharina Armstrong, et. al.. (1999). Severity of Osteopenia in Estrogen-Deficient Women with Anorexia Nervosa and Hypothalamic Amenorrhea1. The Journal of Clinical Endocrinology & Metabolism. 84, 2049-2055;
- Структуры рецепторов GPCR «в копилку»;
- Pushpendra Singh, Sourav Haldar, Amitabha Chattopadhyay. (2013). Differential effect of sterols on dipole potential in hippocampal membranes: Implications for receptor function. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1828, 917-923;
- Md. Jafurulla, A. Chattopadhyay. (2012). Membrane Lipids in the Function of Serotonin and Adrenergic Receptors. CMC. 20, 47-55;
- Roopali Saxena, Amitabha Chattopadhyay. (2012). Membrane cholesterol stabilizes the human serotonin1A receptor. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1818, 2936-2942;
- Рецептор медиатора настроения;
- Durba Sengupta, Amitabha Chattopadhyay. (2012). Identification of Cholesterol Binding Sites in the Serotonin1AReceptor. J. Phys. Chem. B. 116, 12991-12996;
- Joanne M. Murabito, Joseph M. Massaro, Brian Clifford, Udo Hoffmann, Caroline S. Fox. (2013). Depressive symptoms are associated with visceral adiposity in a community-based sample of middle-aged women and men. Obesity. 21, 1713-1719;
- Engelman C.D., Koscik R.L., Jonaitis E.M., Okonkwo O.C., Hermann B.P., La Rue A., Sager M.A. (2013). Interaction Between Two Cholesterol Metabolism Genes Influences Memory: Findings from the Wisconsin Registry for Alzheimer’s Prevention. J. Alzheimers Dis.;
- Mendoza-Oliva A., Ferrera P., Arias C. (2013). Interplay Between Cholesterol and Homocysteine in the Exacerbation of Amyloid-β Toxicity in Human Neuroblastoma Cells. CNS Neurol. Disord. Drug Targets;
- . (1983). Classics in arteriosclerosis research: On experimental cholesterin steatosis and its significance in the origin of some pathological processes by N. Anitschkow and S. Chalatow, translated by Mary Z. Pelias, 1913. Arteriosclerosis, Thrombosis, and Vascular Biology. 3, 178-182;
- Волков В.И. (2002). Атеросклероз и атеротромбоз: патогенез, клинические проявления, лечение. «Лікування та діагностика». 2, 13–22;
- Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel 111). (2001). JAMA. 285, 2486–2497;
- Frank M Sacks, Martijn Katan. (2002). Randomized clinical trials on the effects of dietary fat and carbohydrate on plasma lipoproteins and cardiovascular disease. The American Journal of Medicine. 113, 13-24;
- Э.Н. Вайнер. Валеология: Учебник. М., 2006;
- Хороший, плохой, злой холестерин;
- Grundy S.M. (1978). Cholesterol metabolism in man. West. J. Med. 128, 13–25;
- Вельков В.В. (2005). Холестерин: плохой и хороший — миф и реальность. Пущино: ОНТИ ПНЦ;
- Diego Perez-Tilve, Susanna M Hofmann, Joshua Basford, Ruben Nogueiras, Paul T Pfluger, et. al.. (2010). Melanocortin signaling in the CNS directly regulates circulating cholesterol. Nat Neurosci. 13, 877-882;
- Cox R.A. and Garcia-Palmieri M.R. (1990). Cholesterol, triglycerides, and associated lipoproteins. Clinical methods: the history, physical, and laboratory examinations. 3rd edition. Boston: Butter-worths, 153–160;
- Wójcicka G,. Jamroz-Wisniewska A., Horoszewicz K.., Beltowski J. (2007). Liver X receptors (LXRs). Part I: Structure, function, regulation of activity, and role in lipid metabolism. Postepy Hig. Med. Dosw. 61, 736–759;
- Feig J.E., Feig J.L. (2012). Macrophages, dendritic cells, and regression of atherosclerosis. Front Physiol. 3, 286;
- Ira Tabas. (2009). Macrophage Apoptosis in Atherosclerosis: Consequences on Plaque Progression and the Role of Endoplasmic Reticulum Stress. Antioxidants & Redox Signaling. 11, 2333-2339;
- S. Acton, A. Rigotti, K. T. Landschulz, S. Xu, H. H. Hobbs, M. Krieger. (1996). Identification of Scavenger Receptor SR-BI as a High Density Lipoprotein Receptor. Science. 271, 518-520;
- Вельков В.В. (2007). Этот загадочный липопротеин (а). «Лаборатория. Журнал для врачей». 3, 3–6;
- Наночастицами — по «плохому» холестерину!;
- Lei Yu, Chihiro Morishima, George N. Ioannou. (2013). Dietary Cholesterol Intake Is Associated With Progression of Liver Disease in Patients With Chronic Hepatitis C: Analysis of the Hepatitis C Antiviral Long-term Treatment Against Cirrhosis Trial. Clinical Gastroenterology and Hepatology. 11, 1661-1666.e3;
- Вельков В.В. (2005). Три причины, почему необходимо измерять триглицериды. «Лаборатория. Журнал для врачей». 4, 6–9;
- M. Vergeer, A. G. Holleboom, J. J. P. Kastelein, J. A. Kuivenhoven. (2010). The HDL hypothesis: does high-density lipoprotein protect from atherosclerosis?. The Journal of Lipid Research. 51, 2058-2073;
- José María Ramírez-Moreno, Ignacio Casado-Naranjo, Juan Carlos Portilla, María Luisa Calle, David Tena, et. al.. (2009). Serum Cholesterol LDL and 90-Day Mortality in Patients With Intracerebral Hemorrhage. Stroke. 40, 1917-1920;
- Babiak J. and Rudel L.L. (1987). Lipoproteins and atherosclerosis. Baillieres Clin. Endocrinol. Metab. 3, 515–550;
- Jonathan Belsey, Simon de Lusignan, Tom Chan, Jeremy van Vlymen, Nigel Hague. (2008). Abnormal lipids in high-risk patients achieving cholesterol targets: a cross-sectional study of routinely collected UK general practice data. Current Medical Research and Opinion. 24, 2551-2560;
- Вельков В.В. (2006). Атеросклероз: артиллерия бьет по своим. «Химия и жизнь». 12, 30–36;
- P. J. BARTER, C. M. BALLANTYNE, R. CARMENA, M. CASTRO CABEZAS, M. JOHN CHAPMAN, et. al.. (2006). Apo B versus cholesterol in estimating cardiovascular risk and in guiding therapy: report of the thirty-person/ten-country panel. J Intern Med. 259, 247-258;
- S. J. Klebanoff. (2005). Myeloperoxidase: friend and foe. Journal of Leukocyte Biology. 77, 598-625;
- James E. McLaren, Daryn R. Michael, Tim G. Ashlin, Dipak P. Ramji. (2011). Cytokines, macrophage lipid metabolism and foam cells: Implications for cardiovascular disease therapy. Progress in Lipid Research. 50, 331-347;
- Manuel Mayr, Stefan Kiechl, Sotirios Tsimikas, Elizabeth Miller, Joanna Sheldon, et. al.. (2006). Oxidized Low-Density Lipoprotein Autoantibodies, Chronic Infections, and Carotid Atherosclerosis in a Population-Based Study. Journal of the American College of Cardiology. 47, 2436-2443;
- Muriel J Caslake, Chris J Packard. (2005). Lipoprotein-associated phospholipase A2 as a biomarker for coronary disease and stroke. Nat Clin Pract Cardiovasc Med. 2, 529-535;
- Mark B. Pepys, Gideon M. Hirschfield, Glenys A. Tennent, J. Ruth Gallimore, Melvyn C. Kahan, et. al.. (2006). Targeting C-reactive protein for the treatment of cardiovascular disease. Nature. 440, 1217-1221;
- Philip J. Barter, Stephen Nicholls, Kerry-Anne Rye, G.M. Anantharamaiah, Mohamad Navab, Alan M. Fogelman. (2004). Antiinflammatory Properties of HDL. Circulation Research. 95, 764-772;
- Fatiha Tabet, Kerry-Anne Rye. (2009). High-density lipoproteins, inflammation and oxidative stress. Clin. Sci.. 116, 87-98;
- Anatol Kontush, M. John Chapman. (2006). Functionally Defective High-Density Lipoprotein: A New Therapeutic Target at the Crossroads of Dyslipidemia, Inflammation, and Atherosclerosis. Pharmacol Rev. 58, 342-374;
- Benjamin J. Ansell, Gregg C. Fonarow, Alan M. Fogelman. (2006). High-density lipoprotein: Is it always atheroprotective?. Curr Atheroscler Rep. 8, 405-411;
- Benjamin J Ansell, Gregg C Fonarow, Alan M Fogelman. (2007). The paradox of dysfunctional high-density lipoprotein. Current Opinion in Lipidology. 18, 427-434;
- Kilmer S. McCully, Robert B. Wilson. (1975). Homocysteine theory of arteriosclerosis. Atherosclerosis. 22, 215-227;
- Чаллем Дж. и Долби В. (1999). Гомоцистеин: новый «холестерол». Изд-во «Крон-Пресс»;
- Баранова Е.И., Большакова О.О. (2004). Клиническое значение гомоцистеинемии (обзор литературы). «Артериальная гипертензия». 10;
- D’Angelo A. and Selhub J. (1997). Homocysteine and thrombotic disease. Blood. 1, 1–11;
- Добронравов В.А., Голубев Р.В. (2004). Гипергомоцистеинемия — фактор риска сердечно-сосудистых поражений у диализных больных и в общей популяции. «Нефрология». 8, 44–49;
- Mendoza-Oliva A., Ferrera P., Arias C. (2013). Interplay Between Cholesterol and Homocysteine in the Exacerbation of Amyloid-β Toxicity in Human Neuroblastoma Cells. CNS Neurol. Disord. Drug Targets;
- Werder S.F. (2013). Cobalamin deficiency, hyperhomocysteinemia, and dementia. Neuropsychiatr. Dis. Treat. 6, 159–195;
- T. M. Scott. (2004). Homocysteine and B Vitamins Relate to Brain Volume and White-Matter Changes in Geriatric Patients With Psychiatric Disorders. American Journal of Geriatric Psychiatry. 12, 631-638;
- Jacobsen D.W. (1998). Homocysteine and vitamins in cardiovascular disease. Clin. Chem. 8, 1833–1843;
- Annie L. Culver. (2012). Statin Use and Risk of Diabetes Mellitus in Postmenopausal Women in the Women's Health Initiative. Arch Intern Med. 172, 144;
- Statin use linked to increased risk of diabetes in older women. Risk of type 2 diabetes in postmenopausal women may be up to 48 percent higher than in women who do not use the cholesterol-lowering drugs, but the jury tilts in favor of continuing medication. (2012). Duke Med. Health News. 4, 4–5;
- Uchechukwu K Sampson, MacRae F Linton, Sergio Fazio. (2011). Are statins diabetogenic?. Current Opinion in Cardiology. 26, 342-347;
- David A. Playford, Gerald F. Watts. (1997). Management of Lipid Disorders in the Elderly. Drugs & Aging. 10, 444-462;
- M. N Haan. (2009). Review: statins do not protect against development of dementia. Evidence-Based Mental Health. 12, 114-114;
- Harvey S. Hecht, S.Mitchell Harman. (2003). Relation of aggressiveness of lipid-lowering treatment to changes in calcified plaque burden by electron beam tomography. The American Journal of Cardiology. 92, 334-336;
- Ward S., Lloyd Jones M., Pandor A., Holmes M., Ara R., Ryan A., Yeo W., Payne N. (2007). A systematic review and economic evaluation of statins for the prevention of coronary events. Health Technol. Assess. 11, 1–160;
- Bernadette McGuinness, David Craig, Roger Bullock, Peter Passmore. (2009) Statins for the prevention of dementia;
- Earl S. Ford, Simon Capewell. (2013). Trends in Total and Low-Density Lipoprotein Cholesterol among U.S. Adults: Contributions of Changes in Dietary Fat Intake and Use of Cholesterol-Lowering Medications. PLoS ONE. 8, e65228;
- Ernst N.D., Sempos C.T., Briefel R.R., Clark M.B. (1997). Consistency between US dietary fat intake and serum total cholesterol concentrations: the National Health and Nutrition Examination Surveys. Am. J. Clin. Nutr. 4, 965–972;
- Шаланда А. (2005). О холестерине замолвите слово. Сага в семи частях. «Коммерческая биотехнология».;
- François Mach, Colin Baigent, Alberico L Catapano, Konstantinos C Koskinas, Manuela Casula, et. al.. (2020). 2019 ESC/EAS Guidelines for the management of dyslipidaemias: lipid modification to reduce cardiovascular risk. European Heart Journal. 41, 111-188;
- Benjamin H. Han, David Sutin, Jeff D. Williamson, Barry R. Davis, Linda B. Piller, et. al.. (2017). Effect of Statin Treatment vs Usual Care on Primary Cardiovascular Prevention Among Older Adults. JAMA Intern Med. 177, 955;
- S. Berger, G. Raman, R. Vishwanathan, P. F. Jacques, E. J. Johnson. (2015). Dietary cholesterol and cardiovascular disease: a systematic review and meta-analysis. American Journal of Clinical Nutrition. 102, 276-294;
- Eenfeldt A. (2012). Stunning: Saturated fat and the European paradox. Diet Doctor;
- Robert Hoenselaar. (2012). Further response from Hoenselaar. Br J Nutr. 108, 939-942;
- Rajiv Chowdhury, Samantha Warnakula, Setor Kunutsor, Francesca Crowe, Heather A. Ward, et. al.. (2014). Association of Dietary, Circulating, and Supplement Fatty Acids With Coronary Risk. Ann Intern Med. 160, 398;
- Nathalie Genevieve Puaschitz, Elin Strand, Tone Merete Norekvål, Jutta Dierkes, Lisbeth Dahl, et. al.. (2015). Dietary Intake of Saturated Fat Is Not Associated with Risk of Coronary Events or Mortality in Patients with Established Coronary Artery Disease1–3. The Journal of Nutrition. 145, 299-305;
- Laura Pimpin, Jason H. Y. Wu, Hila Haskelberg, Liana Del Gobbo, Dariush Mozaffarian. (2016). Is Butter Back? A Systematic Review and Meta-Analysis of Butter Consumption and Risk of Cardiovascular Disease, Diabetes, and Total Mortality. PLoS ONE. 11, e0158118;
- Rory Collins, Christina Reith, Jonathan Emberson, Jane Armitage, Colin Baigent, et. al.. (2016). Interpretation of the evidence for the efficacy and safety of statin therapy. The Lancet. 388, 2532-2561;
- Fiona Taylor, Mark D Huffman, Ana Filipa Macedo, Theresa HM Moore, Margaret Burke, et. al.. (2013). Statins for the primary prevention of cardiovascular disease. Cochrane Database of Systematic Reviews;
- Cholesterol Treatment Trialists' (CTT) Collaboration. (2010). Efficacy and safety of more intensive lowering of LDL cholesterol: a meta-analysis of data from 170 000 participants in 26 randomised trials. The Lancet. 376, 1670-1681;
- Ian Ford, Heather Murray, Colin McCowan, Chris J. Packard. (2016). Long-Term Safety and Efficacy of Lowering Low-Density Lipoprotein Cholesterol With Statin Therapy. Circulation. 133, 1073-1080;
- Sang-Eun Lee, Hyuk-Jae Chang, Ji Min Sung, Hyung-Bok Park, Ran Heo, et. al.. (2018). Effects of Statins on Coronary Atherosclerotic Plaques. JACC: Cardiovascular Imaging. 11, 1475-1484;
- Rishi Puri, Stephen J. Nicholls, Mingyuan Shao, Yu Kataoka, Kiyoko Uno, et. al.. (2015). Impact of Statins on Serial Coronary Calcification During Atheroma Progression and Regression. Journal of the American College of Cardiology. 65, 1273-1282.






