Обнаружены управляемые светом анионные каналы
11 августа 2015
Обнаружены управляемые светом анионные каналы
- 707
- 0
- 1
Широкая палитра опсинов позволяет манипулировать активностью нейронов и изучать их взаимодействие.
Рисунок в полном размере.
рисунок Бенедикта Росси из [7]
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: В инструментарии оптогенетики пополнение: обнаружены первые анионные канальные родопсины. Эти белки под действием света пропускают внутрь клетки ионы хлора, что приводит к гиперполяризации мембраны и, следовательно, подавлению электрической активности возбудимых клеток.
Конкурс «Био/Мол/Текст»-2015
Эта работа опубликована в номинации «Лучшее новостное сообщение» конкурса «био/мол/текст»-2015.
Спонсором номинации «Лучшая статья о механизмах старения и долголетия» является фонд «Наука за продление жизни». Спонсором приза зрительских симпатий выступила фирма Helicon.
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Оптогенетика — современный подход, позволяющий изучать работу нервных клеток (нейронов), их сетей и даже органов, образованных ими — головного и спинного мозга [1], [2]. Этот метод основан на использовании конструкций, позволяющих ввести в клетки млекопитающих гены родопсинов [3] простейших организмов — например, водорослей. Родопсины водорослей, использующиеся в оптогенетике, представляют собой ионные каналы, которые открываются при возбуждении их светом определенной длины волны. Ранее были известны канальные родопсины, избирательно пропускающие внутрь клетки катионы (положительно заряженные ионы), что приводит к возбуждению нейрона (подробнее об этом можно прочитать в статье «Светлая голова» [1]). Лишь совсем недавно ученым удалось найти канальные родопсины, через которые в клетку могут поступать только анионы (отрицательно заряженные ионы). Таким образом, теперь стало возможно не только эффективно стимулировать, но и подавлять активность нервных клеток при помощи света.
Концентрация положительно и отрицательно заряженных ионов внутри и снаружи клетки — один из важнейших регуляторов ее жизнедеятельности. Различная проницаемость мембраны для разных ионов, а также наличие в ней белков, способных к активному ионному транспорту, приводит к созданию на мембране электрического потенциала [4]. Этот потенциал определяется в основном катионами натрия и калия и анионами хлора. Когда клетка покоится, внутри она заряжена более отрицательно, чем снаружи (имеет отрицательный мембранный потенциал). Вход в клетку положительно заряженных ионов приводит к деполяризации мембраны, то есть сдвигу ее потенциала в положительную сторону. У нейронов и мышечных клеток деполяризация мембраны приводит к возбуждению — генерации потенциалов действия [5]. Соответственно, если в нейрон искусственно ввести больше катионов, это приведет к его возбуждению, если же закачать анионы — наоборот, наступит торможение.
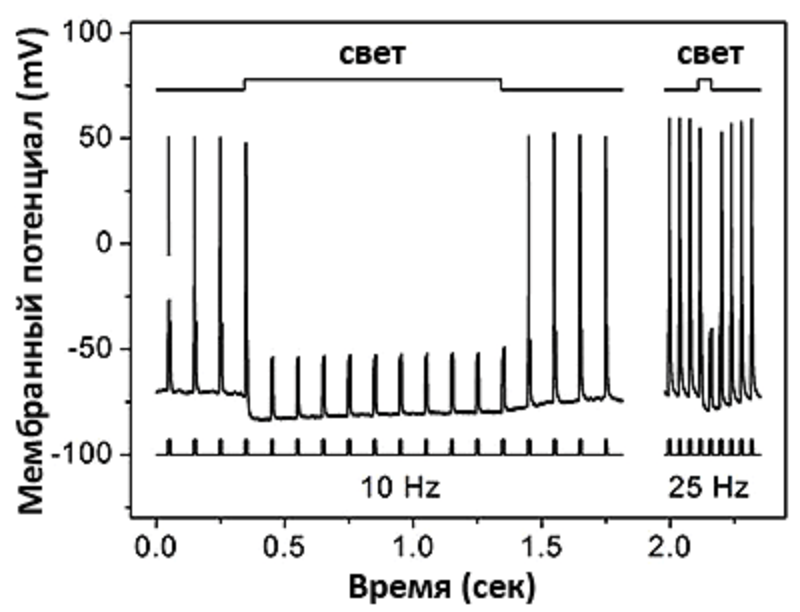
Рисунок 1. Ингибирование работы нейрона, содержащего анионный канальный родопсин, светом. Значения мембранного потенциала при воздействии света определенной интенсивности существенно ниже, чем в его отсутствие. Поэтому канальные анионные родопсины можно использовать для гиперполяризации мембраны клеток.
Ученые из Медицинской школы Техасского университета (интересно, что первые два автора работы — наши соотечественники) провели биоинформатический анализ генома криптофитовой водоросли Guillardia thetа и обнаружили несколько родопсиновых последовательностей, три из которых имели отдаленное сходство с последовательностями канальных родопсинов из других водорослей [6]. Две последовательности, будучи введенными в клетки животных, действительно работают как светоактивируемые каналы. Однако, в отличие от всех прежде известных канальных родопсинов, эти белки избирательно проводят только анионы. Дальнейшие исследования показали, что оба белка, обладая хорошими кинетическими характеристиками и высокой чувствительностью к свету, могут успешно использоваться для гиперполяризации мембраны и подавления электрической активности (торможения) нейронов (рис. 1). Ранее гиперполяризация мембраны осуществлялась с помощью родопсиновых помп, переносящих всего один заряд в ответ на поглощение кванта света. Обнаруженные анионные каналы обладают в несколько тысяч раз большей эффективностью.
Характеристики открытых белков позволяют предполагать, что их применение окажется весьма полезным как для исследования работы нейронов и других клеток организма, так и в качестве терапевтических агентов для лечения эпилепсии [7], шизофрении и других неврологических и психических заболеваний, а также тахикардии и проведения обезболивания.
Комплексные исследования с применением других канальных родопсинов уже позволили открыть новый механизм генерации судорог, а также найти способы их предотвращения и контроля. Ученым из Медицинской школы Стэнфордского университета удалось показать, что торможение одного типа нейронов может привести к подавлению у крыс судорог, которые были видны только на электроэнцефалограмме (ЭЭГ) [8].
Одной из заманчивых перспектив использования канальных родопсинов в оптогенетике выглядит возможность введения разных родопсинов в различные группы нейронов — чтобы посредством избирательного воздействия на них светом разной длины волны проследить вклад того или иного типа нейронов в глобальную клиническую картину, например, эпилептического припадка, а также исследовать их взаимодействие. Именно поэтому расширение набора используемых для оптогенетики канальных родопсинов позволит совершить не только количественный, но и качественный прорыв в изучении работы мозга.
Литература
- Светлая голова;
- Оптогенетика + голография = прозрение?;
- Зрительный родопсин — рецептор, реагирующий на свет;
- Формирование мембранного потенциала покоя;
- Википедия: «Потенциал действия»;
- Elena G. Govorunova, Oleg A. Sineshchekov, Roger Janz, Xiaoqin Liu, John L. Spudich. (2015). Natural light-gated anion channels: A family of microbial rhodopsins for advanced optogenetics. Science. 349, 647-650;
- Jeanne T. Paz, John R. Huguenard. (2015). Optogenetics and Epilepsy: Past, Present and Future. Epilepsy Curr. 15, 34-38;
- Jeanne T Paz, Thomas J Davidson, Eric S Frechette, Bruno Delord, Isabel Parada, et. al.. (2013). Closed-loop optogenetic control of thalamus as a tool for interrupting seizures after cortical injury. Nat Neurosci. 16, 64-70;
- Michiel van Wyk, Justyna Pielecka-Fortuna, Siegrid Löwel, Sonja Kleinlogel. (2015). Restoring the ON Switch in Blind Retinas: Opto-mGluR6, a Next-Generation, Cell-Tailored Optogenetic Tool. PLoS Biol. 13, e1002143.