Один в поле не воин: природная антимикробная система эффективнее антибиотика
20 октября 2017
Один в поле не воин: природная антимикробная система эффективнее антибиотика
- 2341
- 0
- 5
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Открытие и массовое применение антибиотиков в медицине и сельском хозяйстве во второй половине XX века стали причиной одной из главных проблем, стоящих перед современной медициной — появлением резистентных форм патогенных микроорганизмов. Терапевтическая эффективность и коммерческий успех применения антибиотиков сделали нашу зависимость от них абсолютной. Мы уже не можем отказаться от антибиотиков, если только не хотим вернуться в «каменный век» высокой детской смертности, голода и сокращения продолжительности жизни.
Конкурс «био/мол/текст»-2017
Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Резистом
Набор генов устойчивости, обнаруженный у патогенных для человека бактерий, — это лишь часть огромного репертуара генов устойчивости, основным хранителем которых являются почвенные бактерии [1]. В научной среде набор таких генов называют резистóмом . Возможность патогенных бактерий обмениваться генами устойчивости со своими почвенными «собратьями» создает для них защиту, которую специалисты считают непробиваемой [2].
О разнообразных биологических терминах с суффиксом «-ом» рассказывает статья «„Омики“ — эпоха большой биологии» [3]. — Ред.

Рисунок 1. В недавнем прошлом можно было рассчитывать на антибиотики при лечении бактериальной инфекции. Эти дни почти ушли...
В этом свете перспективы существующего арсенала антибиотиков Всемирная организация здравоохранения оценивает довольно пессимистично (рис. 1). Почему? Дело в том, что подобные механизмы рекомбинации под продолжающим свое действие прессом антибиотиков дают селективное преимущество микроорганизмам, одновременно сочетающим в себе устойчивость к разным классам антимикробных препаратов. Медики уже сталкиваются в своей практике с такими мультирезистентными штаммами . И специалисты оценивают как реальную возможность появления так называемого «супербага» — бактерии, которая будет устойчива ко всем существующим антибиотикам (рис. 2). (Superbug существует так же, как птичий грипп, — то есть факт его существования основан на отдельных случаях проявления совокупности его признаков. Но сама бактерия, как таковая, пока еще не выделена. К счастью...)
Проблема появления резистентных бактерий хорошо освещена на «Биомолекуле»: «Антибиотики и антибиотикорезистентность: от древности до наших дней» [4], «Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее» [5] и «Эволюция наперегонки, или почему антибиотики перестают работать» [6]. — Ред.
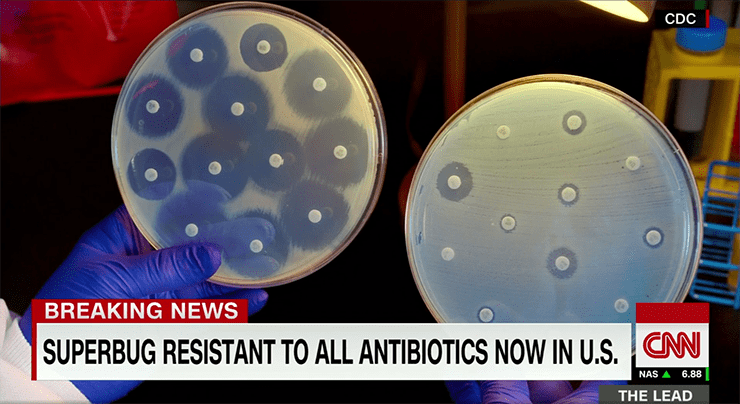
Рисунок 2. Скриншот новостного выпуска телекомпании CNN
Биопленки
Относительно недавно была описана другая, не связанная с передачей генов, форма устойчивости — биопленки (рис. 3). Оказалось, что помимо хорошо изученной планктонной формы существования микробных сообществ (когда бактерии свободно плавают в среде), позволяющей им быстро наращивать свою численность, есть и другая — используемая бактериями в неблагоприятных условиях. Часть бактериальных клеток оседает на субстрате и выделяет биополимеры (белки, углеводы, ДНК), образующие межклеточный матрикс. Клетки, «вмонтированные» в этот матрикс, переходят в состояние метаболического покоя, перестают делиться и активно питаться. Формируется биопленка — сообщество взаимодействующих друг с другом бактериальных клеток [7]. Кто бы мог представить, что у бактерий существуют сложные механизмы химического сигналинга, называемые сейчас quorum sensing (чувством кворума), и межклеточной кооперации, позволяющие им сообща противостоять действию внешних факторов. Еще 20–30 лет назад считалось, что такие уровни организации свойственны только многоклеточным живым организмам.

Рисунок 3. Микрофотография биопленки Escherichia coli. Кажется, что внешне биопленка не сильно отличается от осажденной суспензии. Помимо бактериальных клеток присутствуют компоненты межклеточного матрикса, представленные характерными тяжами. Но главная опасность биопленки не видна, поскольку скрыта внутри клеток.
Подавляющее большинство антибиотиков так или иначе воздействует на метаболизм клетки: блокирует синтез белка, нуклеиновых кислот, компонентов цитоплазматической мембраны и клеточной стенки (рис. 4) [8]. Поэтому обратимое снижение метаболической активности и скорости размножения бактерий помогает им избежать токсического воздействия антибиотиков. В ряде случаев при переходе бактерий к состоянию биопленки эффективность антибиотиков многократно снижается [9].
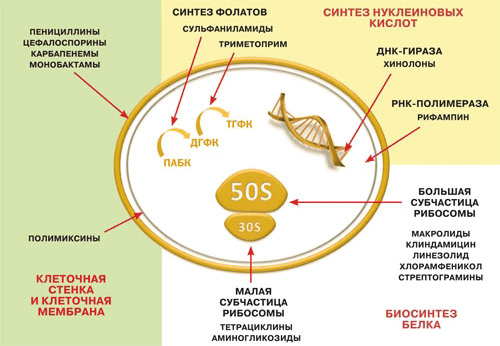
Рисунок 4. Биологические мишени бактериальной клетки, на которые действуют современные антибиотики.
Популяция бактериальных клеток, населяющих биопленку, неоднородна. Среди бактерий есть клетки-персистеры (рис. 5), максимально устойчивые к действию антимикробного препарата: даже в случае разрушения биопленки и гибели бóльшей части популяции эти клетки быстро восстанавливают ее численность [10]. Поэтому в ряде случаев для достижения желаемого терапевтического эффекта концентрацию антибиотика приходилось бы увеличивать до токсической для клеток человека, что означает невозможность дальнейшего применения этого антимикробного препарата на практике.

Рисунок 5. Биопленка Staphylococcus aureus после воздействия антимикробного агента: нарушена структура биопленки, большинство клеток погибло, однако оставшиеся клетки-персистеры стали «точками роста» (хорошо различимы микроколонии-«грозди»). Наличие групп с четным числом клеток свидетельствует о том, что клетки активно делятся: идет восстановление биопленки.
В состоянии биопленки бактерии могут находиться долгое время, пережидая действие неблагоприятного фактора. Принято считать, что именно способность бактерий к образованию биопленок лежит в основе феномена хронических инфекций [11]. Так, среди хирургов существует консенсус, что формирование биопленки в ране гарантированно осложняет ее заживление [12]. Более того, уже установлено, что именно биопленки являются первопричиной ряда онкологических и сердечно-сосудистых заболеваний, которые до этого считались заболеваниями неинфекционной природы [13].
Выход из сложившейся ситуации ученые видят в оптимизации уже существующих схем применения антибиотиков [14], поиске способов блокировать передачу генов устойчивости [15], разработке методов лечения, исключающих применение антибиотиков [16], [17], создании новых материалов для медицинского инструментария, не позволяющих бактериям закрепиться [18].
Комбинация антибиотиков — позаимствовать проще, чем создать
Одним из способов решения проблемы устойчивости многие исследователи считают комбинированную терапию бактериальных инфекций. В основе этого похода лежит поиск сочетаний антибиотиков, одновременно воздействующих на бактериальную клетку. Ключевой критерий эффективности подобных комбинаций — синергизм. Феномен синергизма заключается в том, что у комбинации двух веществ появляется свойство, которым не обладают составляющие ее компоненты по отдельности [19].
Между тем, принцип комплексной защиты от бактерий лежит в основе функционирования всех известных иммунных систем [20]. Для противостояния чужеродной микрофлоре живые организмы, начиная с прокариотов и заканчивая высшими эукариотами, используют не единичные защитные факторы, а комплексы веществ с антибактериальной активностью. Это касается, в частности, антимикробных пептидов — эндогенных антибиотиков, повсеместно представленных в животном мире [21]. По сути, каждую из таких естественных комбинаций можно рассматривать как прототип готового лекарственного препарата. В этом смысле особый интерес представляют те живые организмы, которые находятся в постоянном контакте с патогенами человека.
В 2015 году в журнале PLoS One сотрудники нашей лаборатории опубликовали статью, описывающую свойства антимикробного комплекса FLIP7, выделенного из личинок синей мясной мухи Calliphora vicina, инфицированных бактериями [22]. Мы детально изучили состав комплекса, идентифицировали входящие в него вещества, установили их структуру и свойства. FLIP7 включает в себя четыре класса антибиотиков пептидной природы: дефензины, диптерицины, цекропины и пролин-богатые пептиды, каждый из которых представлен несколькими изоформами (рис. 6). Спектр активности FLIP7 очень широк и включает такие социально значимые виды как Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Acinetobacter baumannii и др.
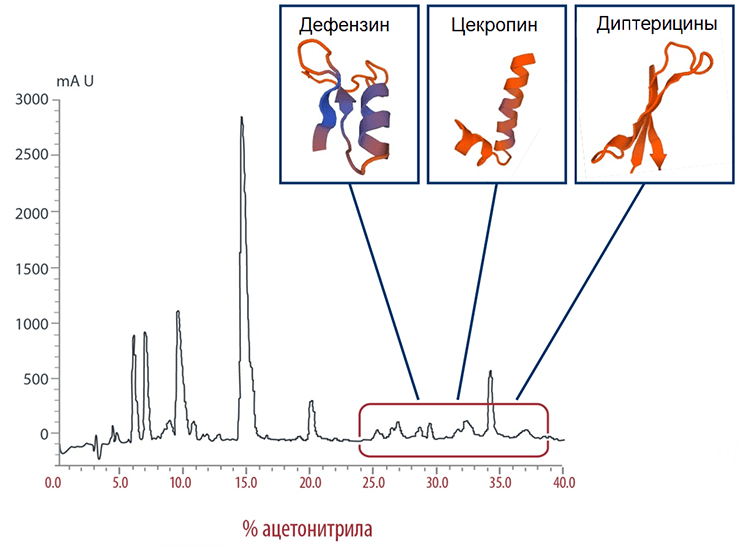
Рисунок 6. Хроматограмма комплекса FLIP7. Метод позволяет разделять сложные смеси на отдельные компоненты, каждому из которых соответствует пик на хроматограмме. Красной рамкой ограничены фракции, содержащие антибактериальные компоненты комплекса. Во врезках представлены 3D-структуры некоторых антимикробных пептидов.
В ходе исследований мы обнаружили у данного комплекса одно очень интересное свойство. Энтеробактерии, на которых изучали антимикробную активность FLIP7, не смогли выработать к нему устойчивость на протяжении более чем 20 пассажей (пересевов), в то время как эффективная концентрация других антибиотиков за время эксперимента возросла многократно (рис. 7). Отметим при этом, что не все бактерии чувствительны к FLIP7, но изначально чувствительные к нему устойчивость действительно не вырабатывают. Интересно, что это свойство напрямую связано с многокомпонентностью FLIP7 — к антимикробным компонентам комплекса, взятым по отдельности, резистентность формируется достаточно быстро.
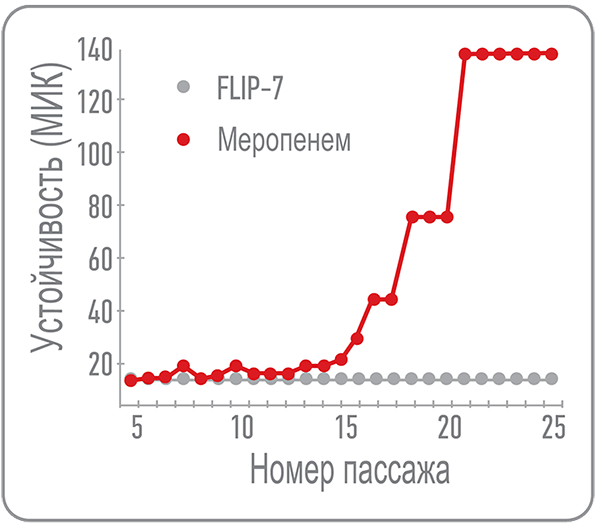
Рисунок 7. Результаты опыта по оценке антибактериальной активности комплекса FLIP7 (серые точки) и меропенема (красные точки) в отношении Klebsiella pneumoniae. После 10-го пассажа постоянное присутствие меропенема в питательной среде приводит к снижению его эффективности, то есть исходной концентрации антибиотика становится недостаточно, чтобы предотвратить рост бактерий. Меропенем по-прежнему сохраняет свою эффективность в отношении бактерий, но с каждым пассажем его количество необходимо увеличивать. Эффективная концентрация FLIP7 при этом остается неизменной на протяжении всего эксперимента.
В другой работе [23] было показано, что FLIP7 не теряет своей эффективности и на биопленочных формах: для разрушения биопленки достаточно тех же концентраций FLIP7, что и для элиминации планктонной культуры. Более того, при одновременном нанесении на биопленку субингибирующих (не разрушающих ее) концентраций FLIP7 и антибиотика наблюдается выраженный синергический эффект. Сочетание с определенными антибиотиками позволяет добиться полного разрушения биопленки и элиминации клеток-персистеров.
Природные антибиотические комплексы — на стыке науки и медицины
Пептидные антибиотики природного происхождения находятся в центре внимания ученых на протяжении более 30 лет и рассматриваются как перспективные кандидаты на роль антибиотических препаратов, защищенных от развития устойчивости [24]. Привлекает исследователей и высокая активность антимикробных пептидов в отношении биопленок [25]. Между тем, существенных успехов в этой области достичь не удалось. Причина неудачи, по-видимому, связана с консервативным подходом к разработке антибиотических препаратов, в основе которого лежит воздействие отдельно взятым веществом на конкретного возбудителя. Однако выясняется, что при использовании в режиме монотерапии антимикробные пептиды не имеют никаких существенных преимуществ перед своими низкомолекулярными «конкурентами», а в большинстве случаев — уступают им в вопросе себестоимости конечного продукта [26]. Предпринимаются попытки создания комбинаций, состоящих из двух, максимум трех, веществ в сочетаниях «антимикробный пептид + антимикробный пептид» [27] или «антимикробный пептид + низкомолекулярный антибиотик» [28], но и эта стратегия пока не привела к существенному прогрессу. В этом смысле «естественные» комбинации антибиотиков имеют одно неоспоримое преимущество перед «искусственными». Оно состоит в том, что природные антибиотические комплексы «отточены» эволюцией в части качественного и количественного соответствия их компонентов друг другу.
Для медицины, в свою очередь, одной из актуальных задач является поиск альтернативных, не основанных на «привычных» антибиотиках, методов лечения бактериальных инфекций. Одним из таких методов является биохирургия — метод безоперационного лечения ран и язв с использованием так называемых «хирургических личинок» [29]. Суть метода биохирургии сводится к использованию личинок мясных мух в качестве «живого скальпеля». Молодых личинок помещают в рану. В процессе питания личинки выделяют в нее экзосекрет, компоненты которого избирательно растворяют некротически измененные ткани и препятствуют развитию бактериальной микрофлоры. Антибактериальные свойства экзосекрета отчасти обусловлены содержащимися в нем антимикробными пептидами. Примечательно, что использование «хирургических личинок» позволяет полностью исключить антибиотики при лечении инфекций кожи и мягких тканей. Проведенные по стандартам доказательной медицины исследования позволили FDA в 2004 году зарегистрировать биохирургию как эффективный метод лечения (FDA K033391). Однако технические, экономические и психологические трудности биохирургии препятствуют ее широкому распространению.
В задачу нашей лаборатории биофармакологии и иммунологии насекомых, помимо изучения фармакологически активных веществ «хирургических личинок», входит разработка технологии промышленного биосинтеза целевых компонентов. Эти исследования поддержал Российский научный фонд (РНФ). Конечной целью проекта является создание антибактериального лекарственного средства на основе природного комплекса антимикробных пептидов, способного внести вклад в решение проблемы лекарственной устойчивости патогенных микроорганизмов.
Идейный вдохновитель и многолетний руководитель исследований, лежащих в основе нашего проекта, — заведующий лабораторией доктор биологических наук Сергей Иванович Черныш. Начало исследованиям было положено в 90-е годы, когда С. И. Черныш работал в Институте клеточной и молекулярной биологии (Страсбург, Франция). В то время в институте создали научную группу под началом Жюля Офмáна (в 2011 году получил Нобелевскую премию по физиологии и медицине). Главной задачей этой научной группы стал поиск новых пептидов с антимикробной и противовирусной активностью. За несколько лет была создана солидная, по-своему уникальная, база, включающая сотни таких веществ. Успешной, однако, оказалась судьба лишь одной находки — пептида аллоферона, выделенного из «хирургических личинок» и обладающего противовирусной и противоопухолевой активностью. Статья, описывающая свойства аллоферона, вышла в журнале PNAS [30] и стала классической в своей области (более 700 цитирований). Аллоферону посчастливилось стать лекарством — инъекционным препаратом, применяемым при лечении таких серьезных заболеваний, как гепатит В, герпесвирусные и ВПЧ-инфекции. Антимикробным пептидам повезло меньше — все кандидаты в антибиотики отсеялись на стадии клинических испытаний. Негативный опыт французских коллег заставил пересмотреть подходы к лечению бактериальных инфекций и предопределил становление идеи природных антибиотических комплексов.
Литература
- K. J. Forsberg, A. Reyes, B. Wang, E. M. Selleck, M. O. A. Sommer, G. Dantas. (2012). The Shared Antibiotic Resistome of Soil Bacteria and Human Pathogens. Science. 337, 1107-1111;
- Julie Ann Perry, Erin Louise Westman, Gerard D Wright. (2014). The antibiotic resistome: what's new?. Current Opinion in Microbiology. 21, 45-50;
- «Омики» — эпоха большой биологии;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Mark E Shirtliff, Jon T Mader, Anne K Camper. (2002). Molecular Interactions in Biofilms. Chemistry & Biology. 9, 859-871;
- Godfrey S. Bbosa, Norah Mwebaza, John Odda, David B. Kyegombe, Muhammad Ntale. (2014). Antibiotics/antibacterial drug use, their marketing and promotion during the post-antibiotic golden age and their role in emergence of bacterial resistance. Health. 06, 410-425;
- Trevor Marshall, Trevor Marshall. (2007). Bacterial Capnine Blocks Transcription of Human Antimicrobial Peptides. Nature Precedings;
- Lewis K. (2005). Persister cells and the riddle of biofilm survival. Biochemistry (Mosc). 70, 267–274;
- Allie Clinton, Tammy Carter. (2015). Chronic Wound Biofilms: Pathogenesis and Potential Therapies. Lab Med. 46, 277-284;
- Jennifer Hurlow, Kara Couch, Karen Laforet, Laura Bolton, Daniel Metcalf, Phil Bowler. (2015). Clinical Biofilms: A Challenging Frontier in Wound Care. Advances in Wound Care. 4, 295-301;
- Adrian D. Schubert, Michel-André Hotz, Marco D. Caversaccio, Andreas Arnold. (2015). Septic thrombosis of the internal jugular vein: Lemierre's syndrome revisited. The Laryngoscope. 125, 863-868;
- A European one health action plan against antimicrobial resistance (AMR). (2017);
- L. A. Marraffini, E. J. Sontheimer. (2008). CRISPR Interference Limits Horizontal Gene Transfer in Staphylococci by Targeting DNA. Science. 322, 1843-1845;
- Пожиратели бактерий: убийцы в роли спасителей;
- Лечебные препараты из живых микроорганизмов;
- Mehdi Kargar, Ji Wang, Amrinder S. Nain, Bahareh Behkam. (2012). Controlling bacterial adhesion to surfaces using topographical cues: a study of the interaction of Pseudomonas aeruginosa with nanofiber-textured surfaces. Soft Matter. 8, 10254;
- Ning Yin, Wenzhe Ma, Jianfeng Pei, Qi Ouyang, Chao Tang, Luhua Lai. (2014). Synergistic and Antagonistic Drug Combinations Depend on Network Topology. PLoS ONE. 9, e93960;
- Кокряков В.Н. Биология антибиотиков животного происхождения. СПб.: “Наука”, 1999. — 162 с.;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Sergey Chernysh, Natalia Gordya, Tatyana Suborova. (2015). Insect Antimicrobial Peptide Complexes Prevent Resistance Development in Bacteria. PLoS ONE. 10, e0130788;
- Natalia Gordya, Andrey Yakovlev, Anastasia Kruglikova, Dmitry Tulin, Evdokia Potolitsina, et. al.. (2017). Natural antimicrobial peptide complexes in the fighting of antibiotic resistant biofilms: Calliphora vicina medicinal maggots. PLoS ONE. 12, e0173559;
- Michael Zasloff. (2002). Antimicrobial peptides of multicellular organisms. Nature. 415, 389-395;
- Dawgul M., Maciejewska M., Jaskiewicz M., Karafova A., Kamysz W. (2014). Antimicrobial peptides as potential tool to fight bacterial biofilm. Acta Pol. Pharm. 71, 39–47;
- Norman Ratcliffe, Patricia Azambuja, Cicero Brasileiro Mello. (2014). Recent Advances in Developing Insect Natural Products as Potential Modern Day Medicines. Evidence-Based Complementary and Alternative Medicine. 2014, 1-21;
- Guozhi Yu, Desiree Y. Baeder, Roland R. Regoes, Jens Rolff. (2016). Combination Effects of Antimicrobial Peptides. Antimicrob. Agents Chemother.. 60, 1717-1724;
- In-sok Hwang, Jae-Sam Hwang, Ji Hong Hwang, Hyemin Choi, Eunjung Lee, et. al.. (2013). Synergistic Effect and Antibiofilm Activity Between the Antimicrobial Peptide Coprisin and Conventional Antibiotics Against Opportunistic Bacteria. Curr Microbiol. 66, 56-60;
- Ronald A. Sherman. (2009). Maggot Therapy Takes Us Back to the Future of Wound Care: New and Improved Maggot Therapy for the 21st Century. Journal of Diabetes Science and Technology. 3, 336-344;
- S. Chernysh, S. I. Kim, G. Bekker, V. A. Pleskach, N. A. Filatova, et. al.. (2002). Antiviral and antitumor peptides from insects. Proceedings of the National Academy of Sciences. 99, 12628-12632.