
От рака вылечит... верблюд!
04 ноября 2014
От рака вылечит... верблюд!
- 4502
- 2
- 2
Верблюд — настоящая загадка природы — обладает чрезвычайной выносливостью, целебной шерстью и даже... уникальными антителами
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Молекулярное биоразнообразие у позвоночных чрезвычайно велико. Однако недавнее открытие полнофункциональных антител сильно упрощенной структуры, существующих в природе в дополнение к традиционным антителам у представителей семейства Верблюдовых и некоторых хрящевых рыб, оказалось одним из важнейших сюрпризов молекулярной иммунологии последних 20 лет. Постоянное увеличение числа публикаций об этих антителах и потребность в технологиях их производства говорят о стремительно возрастающем интересе к этим уникальным молекулам.
Конкурс «био/мол/текст»-2014
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2014 в номинации «Своя работа».
Главный спонсор конкурса — дальновидная компания «Генотек».
Конкурс поддержан ОАО «РВК».
Спонсором номинации «Биоинформатика» является Институт биоинформатики.
Спонсором приза зрительских симпатий выступила фирма Helicon.
Свой приз также вручает Фонд поддержки передовых биотехнологий.
Верблюды — одни из самых необычных животных нашей планеты. Все мы с детства знаем, что они способны жить в довольно-таки экстремальных условиях: ни одно другое животное не выжило бы в жаркой пустыне, питаясь одними лишь колючками и обходясь практически без воды. Внешне верблюды выглядят весьма своеобразно, однако и их «внутренний мир» не менее необычен. Во-первых, эритроциты верблюдов имеют овальную форму, что защищает их организм от обезвоживания (у всех остальных млекопитающих эритроциты круглые, что при обезвоживании приводит к «слипанию» друг с другом). Но есть у верблюдов и другая, не менее удивительная особенность, а именно — наличие особых антител. Именно этому и будет посвящён дальнейший рассказ.
Наши защитники — антитела
Что такое антитела? Это особые молекулы иммунной системы , имеющие гликопротеиновую природу, и способные распознавать чужеродные для организма структуры, такие как вирусы, бактерии, и другие потенциально вредные агенты, называемые одним словом — антигены [1], [2]. При распознавании антигена антитела передают информацию о нём клеткам иммунной системы — лимфоцитам, — и те в свою очередь уничтожают вредоносный агент. У человека и у всех млекопитающих антитело — это структура, состоящая из двух тяжёлых и двух лёгких цепей. Антитела, обладающие такой структурой, называются классическими. Их тяжёлые и лёгкие цепи в свою очередь состоят из вариабельных (V) и константных (C) доменов. Тяжёлые цепи содержат один вариабельный (VH) и три константных домена (CH1, CH2, CH3), лёгкие цепи — один вариабельный (VL) и один константный (CL) домены (рис. 1). Именно такое строение обеспечивает способность антител узнавать конкретные антигены (это называется вариабельностью антител и осуществляется V-доменами) и взаимодействовать с клетками собственной иммунной системы (эффекторная функция антител; за неё ответственны C-домены).
Всё об антителах читайте в нашем спецпроекте «Терапевтические антитела». — Ред.

Рисунок 1. Схема строения классического антитела. CH1, CH2, CH3 — константные домены тяжёлой цепи; CL — константный домен лёгкой цепи; VH — вариабельный домен тяжёлой цепи; VL — вариабельный домен лёгкой цепи. Вариабельные домены образуют антиген-распознающий фрагмент, а константные — эффекторный (связывающийся с лимфоцитами).
Молекулярный сюрприз
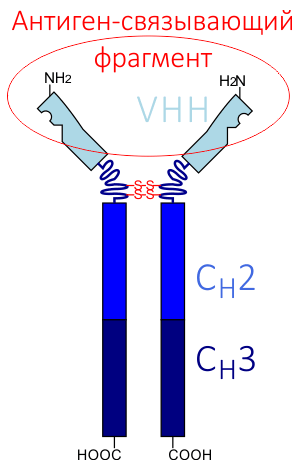
Рисунок 2. Схема строения верблюжьего антитела, HCAb. CH1, CH2 — константные домены. VHH — вариабельный домен. VHH сами по себе образуют наноантитела.
В 1993 году группа бельгийских учёных обнаружила в крови млекопитающих семейства Верблюдовых (верблюдов, лам, викуний и альпак) антитела, структура которых заметно отличалась от структуры вышеописанных классических антител [3]. Позднее подобные антитела были обнаружены также у некоторых видов акул и родственных им хрящевых рыб [4]. Поскольку казалось, что с травоядными млекопитающими работать всё же проще и безопаснее, чем с хищными рыбами, учёные решили взяться за основательное изучение именно верблюжьих антител. И сделали удивительное открытие: антитела, присутствующие в крови у Верблюдовых, имеют уникальную структуру — они состоят только из фрагмента одной укороченной тяжелой цепи, а лёгкие цепи у них отсутствуют (рис. 2).
Эти антитела были названы HCAb (heavy chain antibody). Антиген-узнающий участок HCAb формируется лишь одним вариабельным доменом — VHH (Variable domain of the Heavy chain of the Heavychain antibody). Позднее учёные установили, что VHH — полностью функциональная молекула, которая способна распознавать и связывать антиген ничуть не хуже, чем вариабельные домены классических антител. Даже при их изоляции от константных доменов антитела они сохраняют способность связываться с антигенами так же, как и обычные антитела. Вдобавок к этому, они являются и самыми миниатюрными из всех известных белков с аналогичными свойствами. Их размер достигает примерно 2×4 нм. Поэтому этот фрагмент и получил название «наноантитело», «нанотело» или «мини-антитело».
«Мал да удал» — поговорка именно про нанотела. За счёт своих малых размеров эти антитела получают ряд преимуществ. В первую очередь, важно то, что они легко проникают в труднодоступные органы и ткани организма, куда классическим антителам проникнуть сложно или даже невозможно из-за их крупных размеров. Благодаря структурным особенностям, нанотела способны распознавать такие участки в антигенах, которые недоступны классическим антителам.
Важной особенностью является то, что наноантитела очень стабильны и не разрушаются ни при низких, ни при высоких температурах, ни при различных значениях pH. Их легче, проще и экономичнее синтезировать в больших количествах, что необходимо при производстве лекарств [5]. Также стоит отметить, что с наноантителами легко производить разнообразные генно-инженерные манипуляции, и то, что они практически не иммуногены (то есть не вызывают иммунного ответа). Итак, учёные поняли, что перед ними — мощный инструмент, который можно использовать в терапии и лечении множества заболеваний. Изучением верблюжьих наноантител занимается и наша лаборатория молекулярных биотехнологий в Институте биологии гена РАН.
Нанотела по-русски
Итак, первое и самое главное условие — для того, чтобы получить уникальные наноантитела, нужен верблюд, в организме которого они будут синтезироваться. В 2004 году выбор пал на двугорбого верблюда (Camelus bactrianus), поскольку он является наиболее приспособленным к суровой русской зиме представителем семейства Верблюдовых. Далее начинается основная работа. В нашей лаборатории была отработана и усовершенствована следующая схема получения наноантител (рис. 3) [5]:
- Иммунизация верблюда антигеном для того, чтобы вызвать образование конкретных антител.
- Отбор крови животного. Примечание: ни одно животное при этом не пострадало! Потому что для дальнейших процедур достаточно взять всего 100 мл крови верблюда.
- Клонирование последовательности генов наноантител из В-лимфоцитов, содержащихся в крови. Для этого выделяется РНК, и на её основе синтезируется комплементарная ДНК, а затем последовательности амплифицируются методом ПЦР.
- Встраивание последовательностей наноантител в геном фага и отбор антител, специфических к необходимому антигену, методом фагового дисплея. Эта технология основана на встраивании чужеродных нуклеотидных последовательностей в один из генов, кодирующих белки оболочки бактериофага. Метод фагового дисплея позволяет «разместить» на поверхности бактериофага молекулу антитела, и таких вариантов получают множество. Методика заключается в следующем: бактериофаги, несущие миллионы различных фрагментов антител, наносят на колонку, содержащую нужный антиген. После отмывания ненужных фагов те, которые связывают данный антиген, снимают с колонки и размножают в бактериях. Нуклеотидная последовательность отобранных фагов может быть модифицирована, после чего мутированные фаги размножают в бактериях и повторяют процесс селекции [1].
В нашей лаборатории была предложена модификация, повышающая эффективность отбора наноантител. Она носит универсальный характер и заключается в частичной делеции гена gIII фага M13, использование которого при соответствующих изменениях в процедуре приводит к значительному уменьшению фона и повышению эффективности процедуры селекции [6]. - Анализ отбираемых клонов методом, предложенным в нашей лаборатории — методом параллельного рестрикционного анализа (фингерпринтинга) [7]. Этот метод позволяет лучше контролировать процесс селекции и частично заменяет секвенирование.
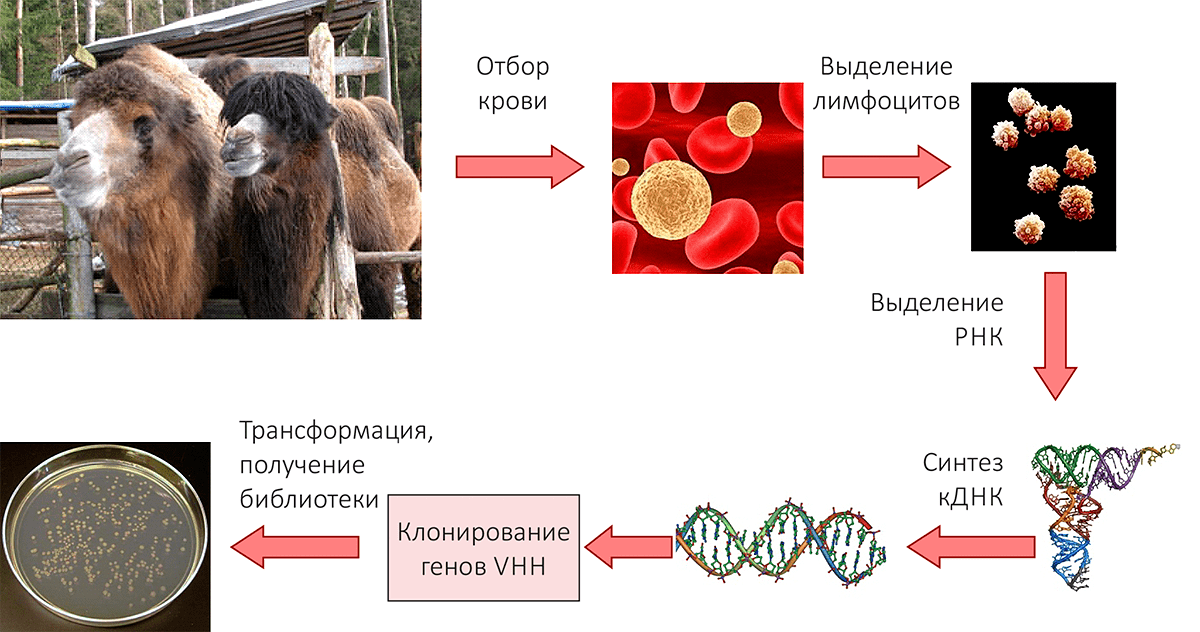
Рисунок 3. Схема получения библиотеки наноантител
Верблюжьи наноантитела — на страже нашего здоровья
Область применения наноантител очень широка — это разные отрасли науки, биотехнологии и медицины. Была продемонстрирована возможность использования наноантител в качестве ингибиторов ферментов [8] за счёт их малого размера и способности проникать в каталитический центр. Также их можно использовать как аффинные лиганды [9], интратела [10], зонды в биосенсорах [11] и как инструмент изучения белок-белковых взаимодействий [12]. Благодаря своим малым размерам, наноантитела являются идеальными кандидатами для разработки небольших пептидомиметиков [13]. Наноантитела могут быть также использованы в пищевой промышленности, — например, при производстве сыра, поскольку способны предотвратить инфекцию молочнокислых бактерий фагом и ускорить брожение [14].
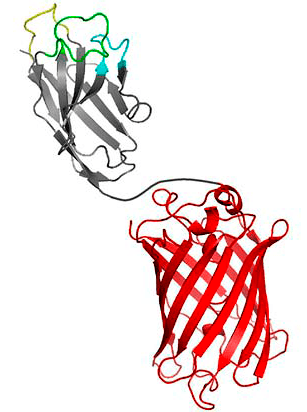
Рисунок 4. Chromobody — нанотело, связанное с красным флуоресцентным белком, RFP
сайт idw-online.de
Сейчас стремительно развиваются методы оптической микроскопии, позволяющие исследовать такие биологические процессы как экспрессия белка, движение клеток, их локализацию и активность. В качестве инструмента визуализации этих процессов часто используют флуоресцентные белки. Эти белки после поглощения света определенной длины волны переизлучают его, но уже в более длинноволновом диапазоне [15]. Если объединить нанотело и флуоресцентный белок с помощью генно-инженерных методов, можно получить конструкцию, называемую chromobody (рис. 4) [10]. Подобный подход открывает принципиально новую возможность исследовать поведение антигенов в живых клетках.
Однако наиболее важная область применения наноантител — улучшение здоровья человека и животных. Особенно актуально их использование в профилактике и лечении раковых заболеваний. Область онкотерапии сейчас развивается бурными темпами. Например, одна из последних тенденций в терапии и лечении рака — применение специальных гликопротеинов лектинов [16]. Использование антител также является одним из новых и перспективных трендов в этой области. Можно синтезировать антитела, которые будут распознавать участки раковых клеток и прикрепляться к ним. За счёт этого опухоль станет более заметной и уязвимой для клеток иммунной системы. Для этих целей можно использовать классические антитела, однако наноантитела являются более удобными и эффективными, — опять же, благодаря малым размерам, поскольку для успешного лечения солидной опухоли прежде всего необходимо обеспечить доступ достаточного количества антител к различным её участкам [17].
Для этих целей как нельзя лучше подходят небольшие наноантитела. Они способны проникать в твердые опухоли более эффективно, чем более крупные классические антитела. Но и выводятся из организма они значительно быстрее, при этом успевая подействовать на опухоль [18]. Наноантитела можно использовать как эффективные тест-системы для диагностики рака. Было создано несколько нанотел, которые распознают человеческий простат-специфический антиген — молекулу, образующуюся при раке простаты у мужчин [19]. Эти нанотела определяют концентрацию простат-специфического антигена, за счёт чего можно установить, болен ли пациент, и предложить ему оптимальную схему лечения [11].
Еще одним из механизмов противоопухолевого действия антител является блокирование ими факторов роста, ускоряющих развитие раковых клеток. В норме эти вещества стимулируют деление и рост нормальных клеток. Однако действие факторов роста неспецифично, и они помогают злокачественным клеткам в том числе. В нашей лаборатории были получены наноантитела, специфичные к фактору роста эндотелия сосудов [19]. Блокирование взаимодействия этого фактора роста с рецептором опухолевой клетки предотвращает ангиогенный эффект, то есть вокруг опухоли не разрастается сеть кровеносных сосудов, и, не получая достаточного кровоснабжения, она перестаёт расти и метастазировать.
Наноантитела, помимо использования для диагностики и лечения рака, также можно применять и при других заболеваниях. Уже есть предварительные исследования, которые показывают, что с помощью нанотел можно лечить болезни Альцгеймера и Паркинсона, вызываемые «слипанием» белков. Нанотела способны не только предотвращать их агрегацию, но и, что более интересно, устранять уже существующие агрегаты [20].
Множество недавних исследований посвящено использованию наноантител для борьбы с вирусами и другими инфекциями [21]. В том числе, это изучается и в нашей лаборатории. Например, было показано, что введение мышам наноантител определённой конфигурации за 2 часа до или через 24 часа после инфицирования вирусом гриппа типа H5N2 защищает животных от летального исхода [22].
«Нет ничего более изобретательного, чем природа», — сказал Цицерон. Нет сомнений в том, что природа приготовила учёным ещё множество загадок. Одна из них — загадка о верблюжьих наноантителах — уже раскрыта. Сделано множество открытий, показывающих, что нанотела верблюда обладают поистине уникальными свойствами. В будущем наноантитела могут использоваться как эффективное дополнение к существующим подходам на основе моноклональных антител, так и в качестве самостоятельной технологии уникальных антиген-распознающих белков.

Рисунок 5. Верблюд — лекарь будущего
Литература
- Моноклональные антитела;
- Иммунологическая Нобелевская премия (2011);
- C. Hamers-Casterman, T. Atarhouch, S. Muyldermans, G. Robinson, C. Hammers, et. al.. (1993). Naturally occurring antibodies devoid of light chains. Nature. 363, 446-448;
- Andrew S. Greenberg, David Avila, Marianne Hughes, Austin Hughes, E. Churchill McKinney, Martin F. Flajnik. (1995). A new antigen receptor gene family that undergoes rearrangement and extensive somatic diversification in sharks. Nature. 374, 168-173;
- Тиллиб С.В. (2011). «Верблюжьи наноантитела» — эффективный инструмент для исследований, диагностики и терапии. «Молекулярная биология» 45, 1–9;
- Вятчанин А.С., Тиллиб С.В. (2008). Модификации процедуры фагового дисплея для повышения эффективности селекции антиген—связывающих доменов особых одноцепочечных верблюжьих антител. «Биотехнология» 4, 32–34;
- Тиллиб С.В., Иванова Т.И., Васильев Л.А. (2010). Фингерпринтный анализ селекции «наноантител» методом фагового дисплея с использованием двух вариантов фагов-помощников. Acta Naturae 6, 100–108;
- Friedrich Koch-Nolte, Jan Reyelt, Britta Schößow, Nicole Schwarz, Felix Scheuplein, et. al.. (2007). Single domain antibodies from llama effectively and specifically block T cell ecto‐ADP‐ribosyltransferase ART2.2 in vivo. FASEB j.. 21, 3490-3498;
- Rinse Klooster, Bram T.H. Maassen, Jord C. Stam, Pim W. Hermans, Mark R. ten Haaft, et. al.. (2007). Improved anti-IgG and HSA affinity ligands: Clinical application of VHH antibody technology. Journal of Immunological Methods. 324, 1-12;
- Ulrich Rothbauer, Kourosh Zolghadr, Sergei Tillib, Danny Nowak, Lothar Schermelleh, et. al.. (2006). Targeting and tracing antigens in live cells with fluorescent nanobodies. Nat Methods. 3, 887-889;
- Lieven Huang, Gunter Reekmans, Dirk Saerens, Jean-Michel Friedt, Filip Frederix, et. al.. (2005). Prostate-specific antigen immunosensing based on mixed self-assembled monolayers, camel antibodies and colloidal gold enhanced sandwich assays. Biosensors and Bioelectronics. 21, 483-490;
- Yanchao Huang, Peter Verheesen, Andreas Roussis, Wendy Frankhuizen, Ieke Ginjaar, et. al.. (2005). Protein studies in dysferlinopathy patients using llama-derived antibody fragments selected by phage display. Eur J Hum Genet. 13, 721-730;
- Andreas Marquardt, Serge Muyldermans, Michael Przybylski. (2006). A Synthetic Camel Anti-Lysozyme Peptide Antibody (Peptibody) with Flexible Loop Structure Identified by High-Resolution Affinity Mass Spectrometry. Chem. Eur. J.. 12, 1915-1923;
- A.M. Ledeboer, S. Bezemer, J.J.W. de Haard, I.M. Schaffers, C.T. Verrips, et. al.. (2002). Preventing Phage Lysis of Lactococcus Lactis in Cheese Production Using A Neutralizing Heavy-Chain Antibody Fragment from Llama. Journal of Dairy Science. 85, 1376-1382;
- Флуоресцентные репортеры и их молекулярные репортажи;
- Лектины — новые инструменты в диагностике и терапии злокачественных опухолей;
- Tunggal J.K., Cowan D.S., Shaikh H., Tannock I.F. (1999). Penetration of anticancer drugs through solid tissue: a factor that limits the effectiveness of chemotherapy for solid tumors. Clin. Cancer Res. 5, 1583–1586;
- Milenic D.E., Yokota T., Filpula D.R., Finkelman M.A., Dodd S.W., Wood J.F., Whitlow M., Snoy P., Schlom J. (1991). Construction, binding properties, metabolism, and tumor targeting of a single-chain Fv derived from the pancarcinoma monoclonal antibody CC49. Cancer Res. 51, 6363–6371;
- S. V. Tillib, T. I. Ivanova, E. Yu. Lyssuk, S. S. Larin, A. V. Kibardin, et. al.. (2012). Nanoantibodies for detection and blocking of bioactivity of human vascular endothelial growth factor a165. Biochemistry Moscow. 77, 659-665;
- Mireille Dumoulin, Alexander M. Last, Aline Desmyter, Klaas Decanniere, Denis Canet, et. al.. (2003). A camelid antibody fragment inhibits the formation of amyloid fibrils by human lysozyme. Nature. 424, 783-788;
- Janusz Wesolowski, Vanina Alzogaray, Jan Reyelt, Mandy Unger, Karla Juarez, et. al.. (2009). Single domain antibodies: promising experimental and therapeutic tools in infection and immunity. Med Microbiol Immunol. 198, 157-174;
- Sergei V. Tillib, Tatiana I. Ivanova, Lev A. Vasilev, Marina V. Rutovskaya, Seda A. Saakyan, et. al.. (2013). Formatted single-domain antibodies can protect mice against infection with influenza virus (H5N2). Antiviral Research. 97, 245-254.








