
Палладиевая Нобелевская премия по химии (2010)
06 октября 2010
Палладиевая Нобелевская премия по химии (2010)
- 2355
- 1
- 0
Палладий — благородный металл из платиновой группы — был выделен из платиновой руды в 1803 году. Что интересно, он назван не непосредственно в честь Афины Паллады, а получил имя астероида Паллада, открытого незадолго до получения первых образцов металла (в 1802 г.), а этот-то астероид как раз и был назван в честь Афины. Рыночная цена палладия — 500–600 долларовза тройскую унцию.
-
Автор
-
Редакторы
Природа является наиболее талантливым химиком — в естественных источниках обнаруживаются вещества, обладающие фантастическим спектром уникальных активностей, многие из которых человечество не отказалось бы поставить себе на службу. Однако природные соединения и устроены намного сложнее, чем может создать современный органический синтез. Нобелевскую премию по химии в 2010 году дали за разработку методик палладиевого катализа, позволяющих очень точно (с минимумом побочных продуктов) «сшивать» атомы углерода, что необходимо для конструкции веществ, приближающихся по своему строению и свойствам к природным молекулам.
Человечество находится в зависимости от тех химических веществ, которые оно производит — это и лекарства, и пластмасса, и резина, и многое другое. Потребность в новых молекулах постоянно растёт, причём новые поколения искусственных молекул отличаются более сложным и изящным строением, чем предыдущие. Но по этому параметру «рукотворным» соединениям далеко до природы, в которой встречаются молекулы очень сложной конфигурации, синтезировать которые не под силу современной химии. (Речь сейчас не идёт о белках или нуклеиновых кислотах, которые состоят из сравнительно простых «строительных блоков».) Если сравнить элементный состав природной «органики» и промышленных веществ, то окажется, что первые состоят практически полностью из углерода, водорода, кислорода и азота, в то время как вторые содержат большие количества галогенов, серы, фосфора. Но зато природные соединения отличаются впечатляющей сложностью углеродного «каркаса» с наличием множества несимметричных (хиральных) атомов, контролировать химические реакции с участием которых человек в большинстве случаев пока не научился.
В то же время природные молекулы высокой сложности часто обладают впечатляющим набором биологических качеств, — например, могут предотвращать развитие рака. Так, в конце 1980-х годов с глубины 33 метров, со дна Карибского моря была выловлена губка Discodermia dissoluta, защищающаяся от своих врагов единственно тем, что производит сложные органические токсины небелковой природы. (Кстати, токсичные молекулы биологического происхождения, независимо от их конкретной химической природы, фантастически разнообразны [1].) Исследователи установили, что многие из веществ, производимых этой губкой, обладают антимикробным, противовирусным или противовоспалительным свойствами. Одно из первых идентифицированных соединений — дискодермолид — замедляло развитие раковых клеток in vitro и в настоящее время проходит испытание как агент для химеотерапии.
Исследования показали, что дискодермолид действует аналогично одному из самых распространённых лекарств, назначаемых при разных формах рака, — «Паклитакселу», — подавляя синтез микротрубочек и не позволяя раковым клеткам делиться. Однако тех микроскопических количеств вещества, которое можно с помощью водолазов достать из глубокого места Карибского моря (дискодермолид разлагается под действием света, так что на отмели его не добудешь), не хватит даже на подробные исследования, не то что на препараты от рака.
История с дискодермолидом на том бы и закончилась, если бы не достижения, отмеченные в этом году Нобелевской премией по химии — полный синтез этого вещества всё-таки удалось завершить с использованием палладиевого катализа, который разработали американец Ричард Хек (Richard Heck) и японцы Эйити Нагиси (Ei-ichi Nagishi) и Акира Судзуки (Akira Suzuki).
Палладий: место «сшивки» изменить нельзя
Чтобы осуществить синтез сложной органической молекулы, надо уметь с невиданной точностью «сшивать» различные фрагменты между собой по чётко определённым углеродным атомам — поскольку органическая химия есть по определению химия соединений углерода, то и «остов» большинства органических молекул углеродный. «Классический» способ заставить атом углерода, уже занимающий своё место в органической молекуле, прореагировать с чем-то — это использование специальных веществ (например, реактива Гриньяра), «активизирующих» углерод (высвобождающих его валентности). Однако проблема этих методов в том, что углерод начинает реагировать буквально со всем подряд, образуя массу побочных продуктов, снижая выход требуемого вещества и делая задачу разделения химической смеси практически нереальной.
Основная черта палладиевого катализа, которая поставила этот метод на почётное место в органическом синтезе, — это способность проводить реакции по «сшивке» углеродных атомов с высочайшей избирательностью и в довольно мягких условиях. Это чрезвычайно важно для многостадийного синтеза (такого как синтез дискодермолида), который практически невозможен в случае большого количества побочных продуктов. Химизм палладиевого катализа основан на том, что два атома углерода располагаются по соседству с одним и тем же атомом палладия и, «активировавшись», соединяются именно друг с другом, а не с какими-то другими атомами. Палладий при этой реакции, как и положено катализатору, не расходуется.
Промышленностью навеяло
Ричард Хек, работавший в американской химической фирме в штате Делавэр, начал работы по палладиевому катализу в 1960-х, когда по миру прошла информация, что немецкий химический концерн Wacker Chemie AG начал использовать палладий для промышленного получения ацетальдегида из этилена. В 1968 году Хек опубликовал ряд работ, в одной из которых он рассказывал про присоединение к ароматическому кольцу молекулы этилена при участии палладиевого катализатора с получением стирола (рис. 1) — исходного сырья для распространённого пластика полистирола. Позже усовершенствованная реакция получила название реакции Хека; в наше время это один из основных способов образования одинарных связей между атомами углерода.
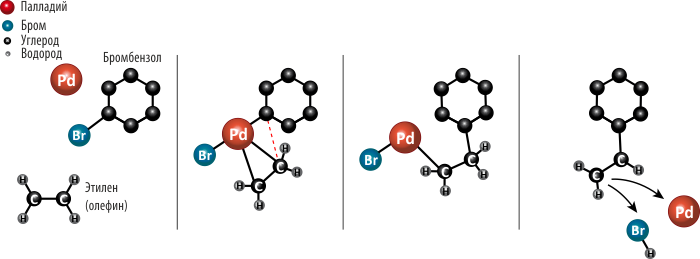
Рисунок 1. Синтез стирола. Ричард Хек с применением палладиевого катализа разработал способ присоединения короткого олефина (этилена) к ароматическому кольцу. Когда два атома углерода «встречаются» около поверхности атома палладия, они уже готовы прореагировать — друг с другом, а не с произвольными атомами! Продуктом этой реакции является стирол, сырьё для получения пластика полистирола.
Навеянная промышленностью, эта реакция сама сейчас широко используется в химическом производстве, — например, противовоспалительного лекарства напроксена или препарата против астмы монтелукаста.
Точность — залог молекулярного конструирования
Эйити Нагиси в 1977 году работал в том же направлении, усовершенствовав реактив Гриньяра путём замены иона магния на цинк и также применяя палладий. При использовании цинка степень активации углерода ниже по сравнению с «классическим» для реакции Гриньяра магнием, но зато цинк позволяет координировать углерод на всё том же атоме палладия, что определяет высокую избирательность реакции Нагиси (рис. 2). Двумя годами позже Судзуки проводил опыты с использованием в качестве «активирующего» атома бора, который является самым мягким и наименее токсичным элементом среди остальных упомянутых, а это очень важно при промышленном синтезе. Реакция Судзуки, в частности, используется в промышленном производстве (тысячи тонн) фунгицидов — веществ, защищающих урожай от уничтожения грибами.
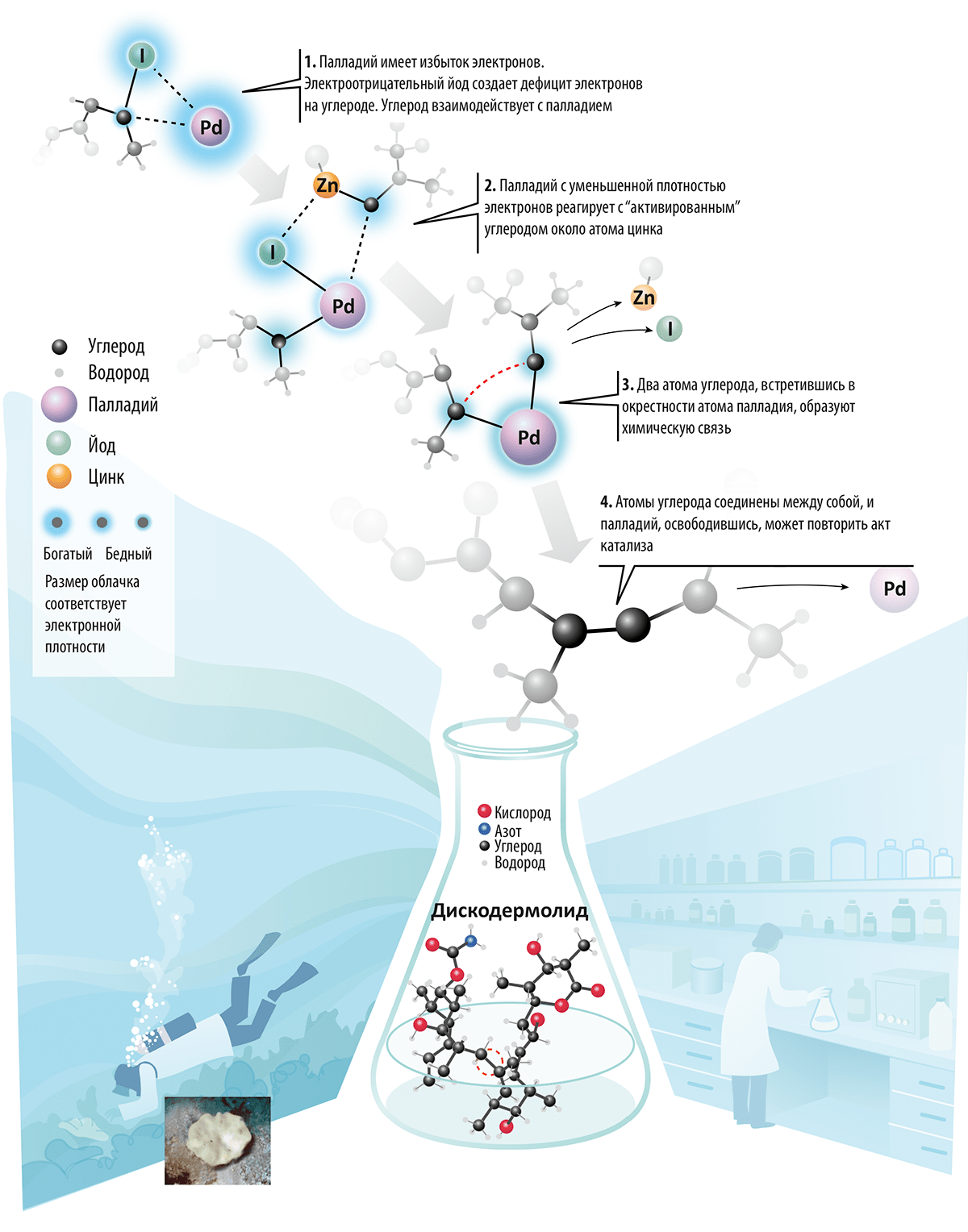
Рисунок 2. Палладий: место «сшивки» изменить нельзя. Дискодермолид — вещество с высокой противораковой активностью — сначала было выделено из яда губки, обитающей в Карибском море (на фото слева внизу). Позже учёным удалось провести лабораторный синтез этого соединения, используя разновидность реакции Нагиси с палладиевым катализом образования одинарной связи между двумя атомами углерода. Дискодермолид действует подобно паклитакселу — одному из самых распространенных в мире лекарств, назначаемых при онкологии.
[5], рисунок адаптирован
В настоящее время реакции Хека, Нагиси и Судзуки широко применяются в органическом синтезе, — например, с их помощью синтезировано одно из наиболее сложных органических веществ — палитоксин (рис. 3), встречающийся в яде шестилучевых кораллов зоонтарий и выделенный впервые в 1971 году на Гавайях. Палитоксин обладает кардиотоксическим действием (вызывает остановку сердца) и традиционно использовался аборигенами для изготовления отравленного оружия. Синтез такого «динозавра» представляет tour de force органической химии, и успешное разрешение задачи подтверждает огромный прогресс, сделанный химиками-синтетиками по сравнению с Гриньяром (кстати, тоже лауреатом Нобелевской премии).
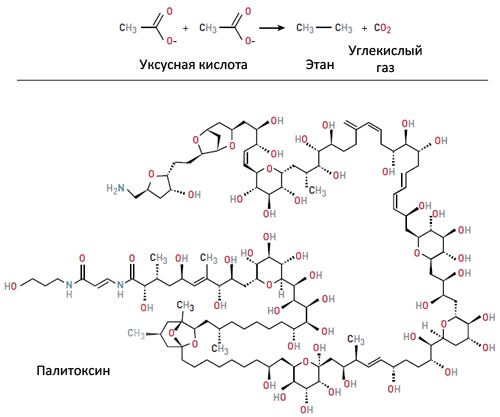
Рисунок 3. Прогресс в органической химии. Одна из первых реакций органической химии — реакция Кольбе (сверху, середина XIX века). Полтора века спустя органики синтезируют палитоксин (снизу), одну из самых сложных известных молекул (брутто-формула: C129O54N3H223).
Инструмент поиска новых лекарств
Реакции с использованием палладиевого катализа уже позволили осуществить сложнейшие органические синтезы, реконструировав различные природные вещества. Однако палладиевый катализатор используют не только для синтеза, но и для модификации природных молекул. В качестве примера можно привести ванкомицин — антибиотик, впервые выделенный в 1950 году из образца почвы джунглей Борнео. В наши дни он используется для борьбы с микроорганизмами, выработавшими резистентность к «обычным» антибиотикам (таким как пенициллин), — метициллин-устойчивым золотистым стафилококком (MRSA) и энтерококками. Учёные с помощью палладиевого катализа стараются создать производные этого антибиотика, чтобы победить резистентность и дать человечеству надёжный инструмент для борьбы с инфекциями в больницах и в полевых условиях.
Напоследок стоит отметить, что область применения палладиевого катализатора не ограничивается синтезом токсинов и антибиотиков — например, в современных тонких дисплеях на органических светодиодах (OLED) синие элементы работают на основе вещества, полученного именно с помощью палладиевого катализа.
Да, и ещё интересно, что, по сравнению с прошлым годом, когда и премия по физиологии и медицине (за теломеры и теломеразу [2]), и премия по химии (за структуру рибосомы [3]) были обе фактически премиями по биологии, в этом году и премия по медицине — по медицине (за разработку метода экстракорпорального оплодотворения [4]), и премия по химии — по стопроцентной химии.
Написано по мотивам официального пресс-релиза нобелевского комитета [5].
Модифицированная версия этой статьи была опубликована в журнале New Scientist [6].
Литература
- Великому комбинатору и не снилось: комбинаторика токсинов пауков;
- «Нестареющая» Нобелевская премия: в 2009 году отмечены работы по теломерам и теломеразе;
- Белоксинтезирующая Нобелевская премия по химии (2009);
- «За экстракорпоральное оплодотворение» — это не тост, а Нобелевская премия!;
- The Nobel Prize in Chemistry 2010. (2010). The Nobel Prize;
- Чугунов А.О. (2010). Noble Metal. Nobel Prize. New Scientist. 2, 8–10.





