Парвовирус — мастер маскировки
19 января 2023
Парвовирус — мастер маскировки
- 9605
- 0
- 5
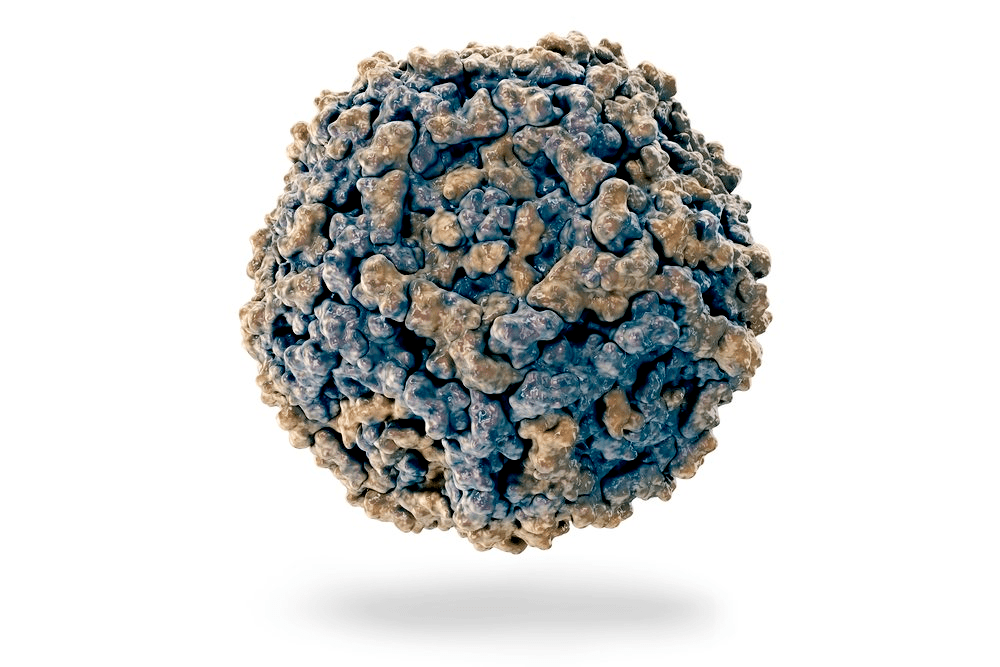
Парвовирус В19 атакует клетки-предшественники эритроцитов в красном костном мозге. Рисунок в полном размере.
рисунок автора статьи
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Парвовирус B19 вызывает заболевание под названием «инфекционная эритема», которому могут быть подвержены и взрослые, и дети. Но мало кто знает, что клиническая диагностика этого заболевания — непростая штука из-за схожести многих симптомов с другими болезнями. Именно поэтому парвовирус неплохо маскируется, вызывая головную боль у врачей. В этой статье мы рассмотрим особенности парвовируса В19 и заболевания, вызываемого им, а также поймем, с чем же его можно перепутать при постановке диагноза.
Конкурс «Био/Мол/Текст»-2022/2023
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2022/2023.

Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Парвовирус В19: история открытия, характеристики и особенности
Парвовирус В19 — вирус из рода Erythrovirus, входящего в состав подсемейства Parvovirinae семейства Parvoviridae (рис. 1 и 2). К этому же семейству относятся парвовирусы, поражающие собак, коров, птиц, овец и других животных, атакуя в основном ЖКТ и систему гемопоэза (кроветворения).
Он был обнаружен аж в 1974 году в образце сыворотки крови донора в Лондонском центре переливания крови. Образцы нанесли на специальный планшет, где положительный к парвовирусу B19 оказался 19-ым в строке В, откуда и получил свое незамысловатое название. Уже тогда исследователи заявили о его свойствах маскировки: «Новый агент можно спутать с антигеном гепатита В как морфологически, так и серологически» [1].
Парвовирус B19 в качестве наследственного материала содержит одноцепочечную ДНК. Его геном кодирует структурные белки VP1 и VP2, которые формируют внешнюю оболочку вируса — капсид. Также в геноме вируса закодированы неструктурный белок NS-1 и другие малые неструктурные белки. VP1 отвечает за инвазию вируса в ядро инфицированной клетки [2]. VP2 обладает способностью к самосборке икосаэдрического капсида в отсутствие вирусной ДНК [3]. Интересно, что ген, кодирующий VP1, используется в качестве маркера в различных наборах для определения ДНК парвовируса B19 в клинических образцах методом полимеразной цепной реакции с гибридизационно-флуоресцентной детекцией [4], [5]. Пример такого набора представлен на рисунке 3.
Рисунок 3. Набор AmpliSens® Parvovirus B19-FRT, используемый для обнаружения маркеров парвовируса B19 в клинических образцах.
фото автора статьи
Неструктурный белок NS-1 участвует в репликации ДНК вируса, служа хеликазой и эндонуклеазой [6]. При изучении репликации и инфекционности парвовируса B19 исследователи из США сконструировали несколько его мутантных штаммов с блокированными генами малых неструктурных белков (pB19-M20 (7.5(–)), pB19-M20 (X(–)), pB19-M20 (11(–))) для изучения их роли в жизни героя статьи (рис. 4) [7]. Числами 7.5 и 11 обозначены молекулярные массы этих белков (кДа), X — впервые найденный белок, а «–» означает блокирование гена изучаемого белка.
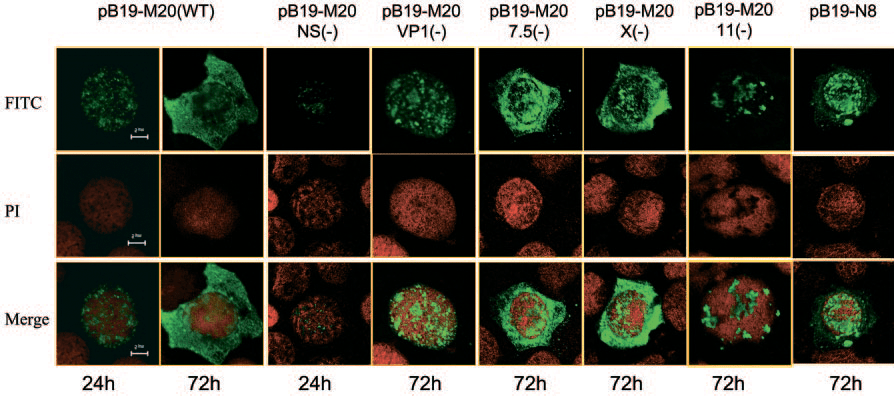
Рисунок 4. Изменения синтеза и распределения вирусного капсидного белка в клетках, трансфицированных мутантами B19. Через 24 или 72 часа после трансфекции вирусные капсидные белки были обнаружены в клетках, трансфицированных инфекционным клоном дикого типа (pB19-M20) или мутантами. Для визуализации капсидного белка VP2 зеленым цветом использовали антитела, а ядро окрашивали йодидом пропидия.
Как видно из рисунка 4, при блокировании гена белка с молекулярной массой 11 кДа происходило изменение в экспрессии генов капсида в клетках, зараженных мутантным штаммом: капсидные белки образовывали большие кластеры в ядре и не экспортировались в цитоплазму. Было доказано, что в результате снижалась инфекционность парвовируса B19. Того же нельзя сказать о мутантах по двум другим генам белков (pB19-M20 (7.5(–)) и pB19-M20 (X(–)), не демонстрировавших никаких значительных изменений. Их функцию в данном исследовании определить так и не удалось [7].
Жизненный цикл парвовируса не менее захватывающий (рис. 5). Репликация вируса происходит в ядре инфицированной клетки, которая находится в S- или G2-фазе своего клеточного цикла. Затравкой для ДНК-полимеразы служит собственная одноцепочечная ДНК, а точнее, ее 3′-конец! Сначала формируется двухцепочечная ДНК (рис. 5, 6a–7а) в виде шпильки, а затем — тетрамерная структура (рис. 5, 7c), превращающаяся в одноцепочечную под действием того же уже нам известного белка NS-1 (рис. 5, 7e), которая затем и встраивается в новые вирусные частицы [8]. Двухцепочечная ДНК также служит для синтеза мРНК вирусных белков. Выход новых вирусов из клетки сопровождается ее лизисом.

Рисунок 5. Жизненный цикл парвовируса B19. При взаимодействии с рецепторами клетки (2) вирус проникает в цитоплазму клетки (3), а затем в ядро (4), где происходит репликация, приводящая к формированию двухцепочечной ДНК (7b), с которой считываются мРНК (9) вирусных белков. Двухцепочечная ДНК также необходима для формирования тетрамерной структуры (7с), которая разрезается белком NS-1 в одноцепочечную форму и встраивается в новые вирусные частицы (7e). Выход вирусных частиц из клетки сопровождается ее лизисом.
Парвовирус B19 предпочитает для своей жизнедеятельности эритроидные клетки-предшественники в красном костном мозге и фетальной печени, а также эритробласты пуповинной крови, что приводит к их неминуемой гибели [9]. Главным необходимым, но не достаточным рецептором является P-антиген (P1) эритроидных клеток-предшественников, с которым, кстати, связана еще одна классификация групп крови — P1PK.
Данный антиген присутствует не во всей популяции людей, а значит, кто-то может оказаться невосприимчивым к инфекции, вызванной парвовирусом B19. Ох, везунчик! Для инфицирования нужны также и некоторые другие корецепторы, такие как интегрин α5β1, альфа-субъединица которого является одним из рецепторов фибронектина, и Ku80 [10], [11].
На рисунке 3 также отмечен еще один рецептор — EpoR, связывающийся с эритропоэтином — гормоном почек. Это взаимодействие приводит к активации JAK-киназы, фосфорилирующей факторы транскрипции STAT, необходимые для воспроизведения вируса, что стимулируется гипоксией [12].
Инфекционная эритема — пятая болезнь: симптомы, опасность, лечение
Впервые связь парвовирусной B19 инфекции с ее возбудителем обнаружили в далеком 1980 году. Молодые солдаты, вернувшиеся из африканской страны Гамбии, почувствовали гриппоподобное недомогание. И никто даже не подумал, что виной всему наш герой — парвовирус B19, открытый в 1974 году. Антитела к нему были обнаружены при серологическом исследовании сыворотки крови на гепатит В [13]. В следующем году парвовирус B19 связали с апластическим кризом — состоянием резкого и быстрого падения уровня гемоглобина и ретикулоцитов (молодых предшественников эритроцитов) в крови.
Инфекционная эритема — пятая болезнь детей, возбудителем которой является парвовирус B19, названная так в честь вида сыпи — эритемы — основного симптома заболевания. По международной классификации болезней она является одной из форм парвовирусной инфекции (ПВИ).
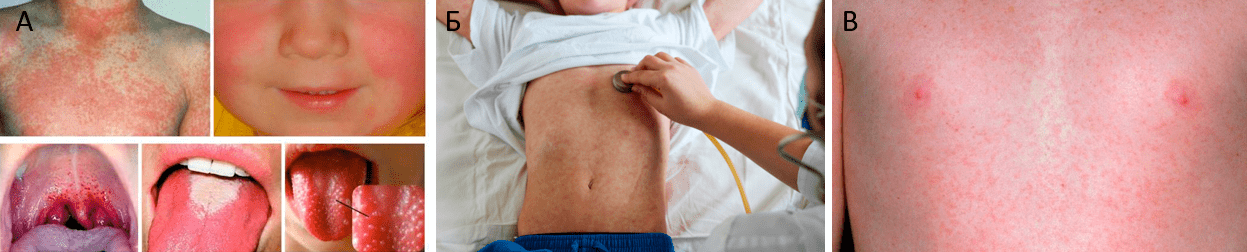
Если есть пятая болезнь, то какие тогда первая, вторая, третья и четвертая? Первой считается корь, скарлатина и краснуха являются второй и третьей соответственно, четвертая — инфекционный мононуклеоз. Шестой является детская розеола (внезапная экзантема). Объединяет эти заболевания один симптом — сыпь, или, как говорят медики, экзантема. Различные виды сыпи при перечисленных болезнях представлены на рисунке 6.
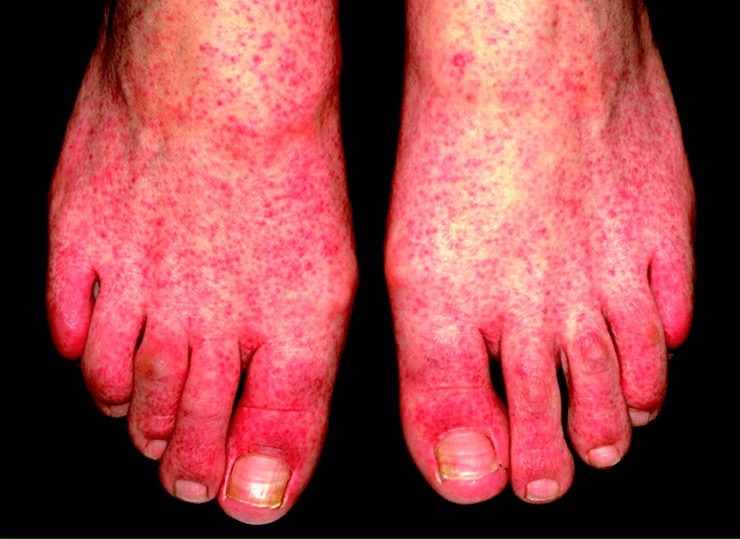
Болеющие ПВИ имеют характерное проявление сыпи. У детей инфекционная эритема сопровождается экзантемой, которая появляется первым делом на щеках (симптом «пощечины», «бабочки») (рис. 7) [14]. Далее сыпь распространяется по всему телу. Иногда развивается синдром папуло-пурпурных перчаток и носков, вид которого представлен на рисунке 8.
Для взрослых же при данном заболевании характерны артропатии (поражения суставов), может проявиться и сыпь (рис. 8), но характерного облика, как у детей, она может и не иметь.
В отдельных случаях заражение парвовирусом B19 может привести к поражению ЦНС, печени, кардиту (поражению сердечной мышцы), анемии и другим последствиям. Особенно опасным, даже летальным, заболевание может оказаться для взрослых людей с хронической анемией и иммунодефицитами, например, СПИДом [15]. Беременные женщины, ранее не переболевшие инфекцией, вызываемой парвовирусом B19, рискуют потерять плод из-за тяжелой анемии эмбриона: вирус беспощадно атакует клетки-предшественники эритроцитов. Наиболее опасен вирус при заражении во втором триместре беременности. По некоторым данным, родившиеся дети, чья мать перенесла парвовирусную B19 инфекцию, будучи в положении, могут отставать в психомоторном развитии [16]. Передача возбудителя происходит воздушно-капельным путем, трансплацентарно и при переливании крови.
Звучит страшно, не правда ли? Но могу вас успокоить, большинство уже переболело инфекционной эритемой в школьные годы. Антитела к парвовирусу B19 обнаруживаются у 2–15% детей 1–5 лет и более чем у 85% пожилых людей [15]. Так что с большой вероятностью они обнаружатся и у вас. Но людям из группы риска есть, о чем переживать.
Лечение инфекции, вызываемой парвовирусом В19, чаще всего не требуется, она проходит сама, оставляя после себя долговечные антитела класса IgG, поэтому обычно люди повторно не заболевают. Иногда прибегают к лекарствам для снятия гриппоподобных симптомов. Терапия с антителами к парвовирусу B19 требуется в случае пациентов с иммунодефицитом, чтобы как можно быстрее сократить потери эритроцитов, не допустить развитие апластического криза, который может перейти в апластическую анемию. При такой патологии сильно изменяется красный костный мозг: количество гемопоэтических клеток снижается, а жировых клеток — растет (рис. 9).
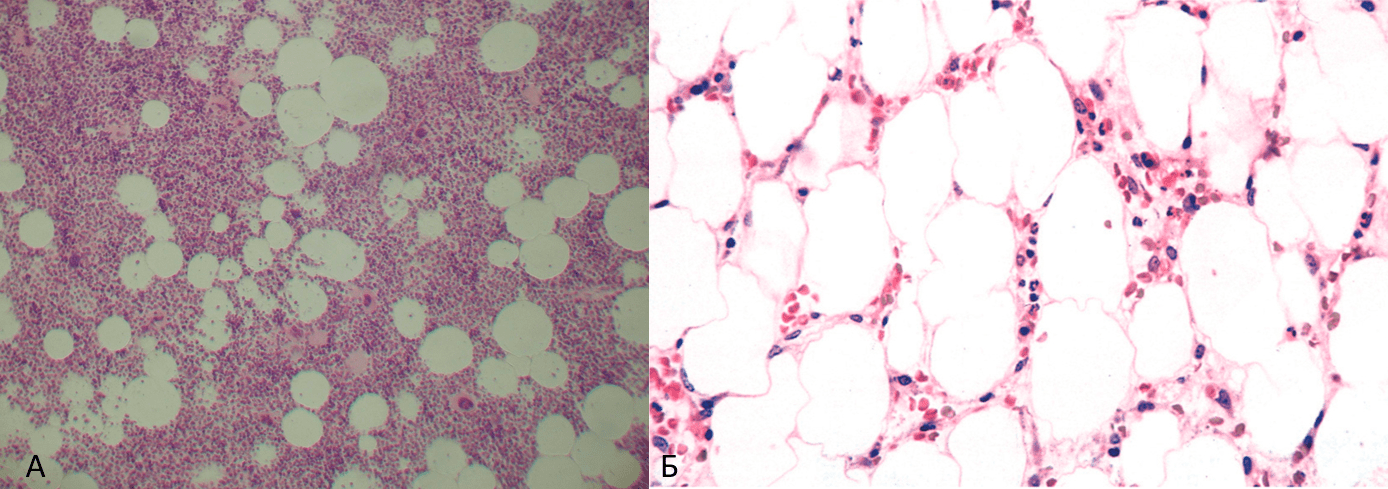
Рисунок 9. Срезы красного костного мозга: А — в норме; Б — при апластической анемии. Белые — жировые клетки, которые замещают кроветворные клетки при развитии данного типа анемии, вследствие гибели вторых.
Для женщин, планирующих беременность, особенно тех, кто работает с детьми, например, школьных учителей, воспитателей детсадов, необходим предварительный анализ крови на наличие антител к парвовирусной B19 инфекции, дабы избежать трагических последствий [17]. Если же заражение произошло, то лечение плода возможно путем внутриматочного переливания крови через пуповинную вену [18].
Вакцины против парвовирусной B19 инфекции, применяемой в обыденной практике, до сих пор не существует, что связано с трудностью ее разработки (парвовирус B19 плохо культивируется в лабораторных условиях). Но, к счастью, исследования идут. Так, в 2022 году вышла статья с доказанной иммуногенностью вакцины на основе вирусоподобных частиц с делецией участка в гене, кодирующем белок VP1. Этот участок отвечает за фосфолипазную активность, которую напрямую связывают с воспалительными реакциями при заболевании. Ранее уже разрабатывались вакцины, но лишь путем введения мутации в этот ген, что только ослабляло активность. Сейчас же провели полную делецию участка: побочной реакции на введение данной вакцины не наблюдалось, а антитела на используемые вирусные частицы оказались схожими с взятыми у доноров с парвовирусной инфекцией [19]. Неплохие результаты, не правда ли? Кандидаты есть, а дальнейшее собеседование почему-то не проходят...
Парвовирсуная B19 инфекция: попробуй обнаружь!
Совершенно очевидно, что парвовирусу B19 легче всего замаскироваться под перечисленные выше экзантемные заболевания. Симптомы очень схожи: сыпь, характер ее проявления. Так, в исследовании, проведенном в Санкт-Петербургском научно-исследовательском институте эпидемиологии и микробиологии им. Пастера, было показано, что наиболее часто антитела IgM к парвовирусу B19, свидетельствующие о течении болезни в конкретный момент времени, обнаруживались у пациентов с первичным диагнозом «краснуха», среди которых была и беременная женщина. Одному из исследуемых врач поставил «корь». Образцы были взяты в 2010–2011 годах [20].
Краснуха и корь на данный момент времени — довольно редкие инфекции. По данным НИИ эпидемиологии и микробиологии им. Г.Н. Габричевского, за 6 месяцев 2022 года в 85 субъектах Российской Федерации корь была выявлена всего лишь у 19 людей на 7 территориях, а краснуха и вовсе не была обнаружена. Так что такой уникальный вердикт, как краснуха или корь, вероятно, вызовет большой интерес у врача и потребует перепроверки, при которой инфекция, вызываемая парвовирусом В19, может быть и обнаружена.
Но самое интересное, что в списке неправильных первичных диагнозов было и ОРВИ, которым болеет каждый второй человек. Казалось бы, как тут спутать, часто ли вы при катаральных симптомах (боли в горле, заложенности носа и тому подобных), являющимися основными проявлениями ОРВИ, замечаете на себе сыпь? Да, наверное, никогда! Сыпь при ОРВИ считается редким явлением, а если и проявляется, то в виде красных пятен на лице [21]. Дальнейшее распространение сыпи также почти никогда не происходит.
Сходство парвовирусной В19 инфекции с ОРВИ наблюдается лишь в начале заболевания, когда появляются первые гриппоподобные симптомы, характерные для обеих болезней. Врач, не задумываясь, ставит ошибочный первичный диагноз и начинает лечить эти симптомы. Казалось бы, ничего страшного, а если это пациент из группы риска? Симптоматическое лечение в этом случае неэффективно, приводит к увеличению времени лечения и его стоимости, а в некоторых случаях и к тяжелым последствиям атаки парвовируса В19. Пациенту может потребоваться переливание крови, а его пичкают индукторами интерферонов.
На данный момент ведется эпидемиологическое исследование частоты встречаемости парвовирусной инфекции в популяции, результаты которого важны и для врачей, и для широкой общественности. Правильное заключение врача — главный путь к сохранению жизни и излечению пациента. А тебе, дорогой читатель, хочется сказать, что предупрежден — значит вооружен!
Литература
- Y.E. Cossart, B. Cant, A.M. Field, D. Widdows. (1975). PARVOVIRUS-LIKE PARTICLES IN HUMAN SERA. The Lancet. 305, 72-73;
- Zoltán Zádori, József Szelei, Marie-Claude Lacoste, Yi Li, Sébastien Gariépy, et. al.. (2001). A Viral Phospholipase A2 Is Required for Parvovirus Infectivity. Developmental Cell. 1, 291-302;
- Bärbel Kaufmann, Paul R. Chipman, Victor A. Kostyuchenko, Susanne Modrow, Michael G. Rossmann. (2008). Visualization of the Externalized VP2 N Termini of Infectious Human Parvovirus B19. J Virol. 82, 7306-7312;
- 12 методов в картинках: полимеразная цепная реакция;
- Цифровая ПЦР: измеряя истину;
- Violetta Kivovich, Leona Gilbert, Matti Vuento, Stanley J. Naides. (2012). The Putative Metal Coordination Motif in the Endonuclease Domain of Human Parvovirus B19 NS1 Is Critical for NS1 Induced S Phase Arrest and DNA Damage. Int. J. Biol. Sci.. 8, 79-92;
- Ning Zhi, Ian P. Mills, Jun Lu, Susan Wong, Claudia Filippone, Kevin E. Brown. (2006). Molecular and Functional Analyses of a Human Parvovirus B19 Infectious Clone Demonstrates Essential Roles for NS1, VP1, and the 11-Kilodalton Protein in Virus Replication and Infectivity. J Virol. 80, 5941-5950;
- Yong Luo, Jianming Qiu. (2015). Human parvovirus B19: a mechanistic overview of infection and DNA replication. Future Virology. 10, 155-167;
- Erik D. Heegaard, Kevin E. Brown. (2002). Human Parvovirus B19. Clin Microbiol Rev. 15, 485-505;
- Kirsten A. Weigel-Kelley, Mervin C. Yoder, Arun Srivastava. (2003). α5β1 integrin as a cellular coreceptor for human parvovirus B19: requirement of functional activation of β1 integrin for viral entry. Blood. 102, 3927-3933;
- Yasuhiko Munakata, Takako Saito-Ito, Keiko Kumura-Ishii, Jie Huang, Takao Kodera, et. al.. (2005). Ku80 autoantigen as a cellular coreceptor for human parvovirus B19 infection. Blood. 106, 3449-3456;
- Aaron Yun Chen, Wuxiang Guan, Sai Lou, Zhengwen Liu, Steve Kleiboeker, Jianming Qiu. (2010). Role of Erythropoietin Receptor Signaling in Parvovirus B19 Replication in Human Erythroid Progenitor Cells. J Virol. 84, 12385-12396;
- J M Shneerson, P P Mortimer, E M Vandervelde. (1980). Febrile illness due to a parvovirus.. BMJ. 280, 1580-1580;
- Лепихина Г.П. и Данилова В.В. (2003). О вспышке инфекционной эритемы среди детей в эндемичном регионе. «Казанский медицинский журнал». 2, 116–117;
- Erik D. Heegaard, Kevin E. Brown. (2002). Human Parvovirus B19. Clin Microbiol Rev. 15, 485-505;
- Hélène T. C. Nagel, Timo R. de Haan, Frank P. H. A. Vandenbussche, Dick Oepkes, Frans J. Walther. (2007). Long-Term Outcome After Fetal Transfusion for Hydrops Associated With Parvovirus B19 Infection. Obstetrics & Gynecology. 109, 42-47;
- Rodis J.F., Hovick T.J. Jr., Quinn D.L., Rosengren S.S., Tattersall P. (1988). Human parvovirus infection in pregnancy. Obstetrics and gynecology. 5, 733–738;
- R. L. Schild, R. Bald, H. Plath, A. M. Eis-Hübinger, G. Enders, M. Hansmann. (1999). Intrauterine management of fetal parvovirus B19 infection. Ultrasound Obstet Gynecol. 13, 161-166;
- Hidehiko Suzuki, Takafumi Noguchi, Noriko Matsugu, Akio Suzuki, Sakika Kimura, et. al.. (2022). Safety and immunogenicity of parvovirus B19 virus-like particle vaccine lacking phospholipase A2 activity. Vaccine. 40, 6100-6106;
- Антипова А.Ю., Лаврентьева И.Н., Бичурина М.А., Семенов А.В. (2012). Лабораторная диагностика парвовирусной инфекции в системе эпидемиологического надзора за экзантемными заболеваниями. «Эпидемиология и вакцинопрофилактика». 2, 26–29;
- Кареткина Г.Н. (2015). Грипп, ОРВИ: проблемы профилактики и лечения. «Инфекционные болезни: Новости. Мнения. Обучение». 4, 25–34;
- Jianming Qiu, Maria Söderlund-Venermo, Neal S. Young. (2017). Human Parvoviruses. Clin Microbiol Rev. 30, 43-113.