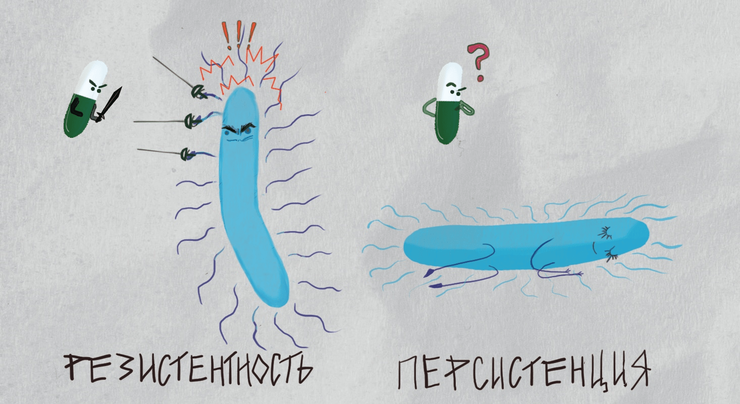
Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью
27 января 2021
Персистенция бактерий — угроза, которую мы не замечаем в страхе перед антибиотикорезистентностью
- 5383
- 0
- 12
Рисунок в полном размере.
рисунок Ольгой Кустовой.
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Антибиотик для бактерий — весьма весомая проблема. Но если не можешь решить её сразу, как это делает резистентная клетка, то имеет смысл отложить проблему на потом. «Утро вечера мудренее», — говорят персисторные клетки бактерий и впадают в состояние замедления метаболических процессов. А после есть шанс, что проблема пропадёт сама собой, когда курс антибиотика подойдет к концу.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Вирусы и микроорганизмы» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Тема резистентности к антибиотикам уже много лет не сходит с новостных заголовков, организации здравоохранения делают по её поводу громкие заявления, про неё пишут учебники и посвящают ей диссертации, научные и научно-популярные статьи [1]. Конечно же, такое пристальное внимание оправдано: наш основной инструмент борьбы с инфекциями — антибиотик — становится бесполезным, если бактерия приобретает специализированные пути его инактивации. Напомню всем ещё раз о сущности этого опасного явления: при резистентности появляется новый штамм возбудителя, который имеет особые мутации, позволяющие ему активно размножаться даже в присутствии конкретного антибиотика. В такой ситуации этот антибактериальный препарат окажется совершенно неэффективным в лечении болезни — у пациента останутся все симптомы острой фазы инфекции. Конечно, можно подобрать другой антибиотик, к которому резистентный штамм чувствителен, но всё чаще появляется информация о штаммах возбудителей с резистентностью к разным группам антибиотиков, и выбирать антибиотик становится всё сложнее. По статистике 2019 года, в России в половине случаев заболевшие имели туберкулёз с множественной лекарственной устойчивостью (МЛУ-ТБ) [2]. Это значит, что штаммы возбудителя туберкулёза были резистентными как минимум к изониазиду и рифампицину, препаратам первой линии (а часть из них — и к другим препаратам), подчёркиваю — в половине случаев.
«Но стакан наполовину полон, — скажут оптимисты. — Хотя бы оставшуюся половину пациентов можно эффективно лечить антибиотиками». Тем не менее, всё далеко не так гладко. Что, если я скажу вам: есть ещё одна угроза, ускользающая от внимания мирового сообщества в тени важной проблемы резистентности — другое свойство бактерий, которое тоже позволяет им справляться с антибиотиками? Притом оно присуще не только особым резистентным штаммам, а любой бактериальной клетке. Этой клетке не нужны никакие новые уникальные мутации, ведь весь защитный потенциал уже закодирован в её ДНК. Этот феномен называют персистенцией бактерий.
В чём же отличие персистенции от резистентности?
При резистентности бактерия изменяет свой геном, получая либо особые гены, которые позволяют ей инактивировать антибиотик (изменить его химически или удалить его из клетки), либо мутации, которые изменяют клеточную мишень антибиотика, делая её недоступной для атаки [3]. Приведу пример. Противотуберкулезный антибиотик канамицин (относящийся к классу аминогликозидов) атакует свою клеточную мишень внутри бактерии — малую 30S-субъединицу рибосом — что нарушает процесс синтеза белка, и бактериальные клетки умирают. Определенные мутации нуклеотидов в 16S рРНК, входящей в состав 30S-субъединицы рибосом, позволяют бактериям расти даже при высоких концентрациях канамицина — пример модификации мишени. А если клетка несёт особый ген резистентности aph, то она может синтезировать белок аминогликозид фосфотрансферазу. Этот фермент фосфорилирует антибиотик канамицин, изменяя его химически и переводя в неактивную форму [4]. В результате таких изменений генотипа бактерия может продолжать расти даже в присутствии огромных концентраций канамицина. Это делает невозможным лечение инфекции этим антибиотиком. Так появляются резистентные клетки.
Но клетка, проявляющая свойство персистенции, не имеет специализированных генов или мутаций для защиты от определённого антибиотика. Вместо этого она запускает свои внутренние защитные механизмы: до воздействия антибиотика клетка впадает в состояние замедления метаболизма, что позволяет в некоторых случаях предотвратить повреждение клеточной мишени антибиотика. Такие клетки-персисторы представляют собой лишь небольшую часть любой популяции бактерии (например, одна клетка-персистор на 100 тысяч обычных). Во временном состоянии торможения метаболизма клетки-персисторы способны пережить действие антибиотика, а по окончании лечения антибиотиком могут восстановить активный метаболизм, размножиться и спустя долгое время вновь привести к возобновлению инфекции. При этом потомство персисторных клеток будет состоять из обычных, чувствительных к антибиотикам клеток. Однако среди них снова сформируется небольшая часть персисторных клеток, которая обеспечит выживание в дальнейшем [5], [6] (рис. 1). При персистенции бактерия особым образом изменяет экспрессию генов или активность белков — такое изменение нестойкое и не будет проявляться у потомков этой клетки. Напротив, резистентные клетки всегда сохраняют свое свойство нечувствительности в ряду поколений, так как оно обусловлено изменением генов, а не метаболизма.
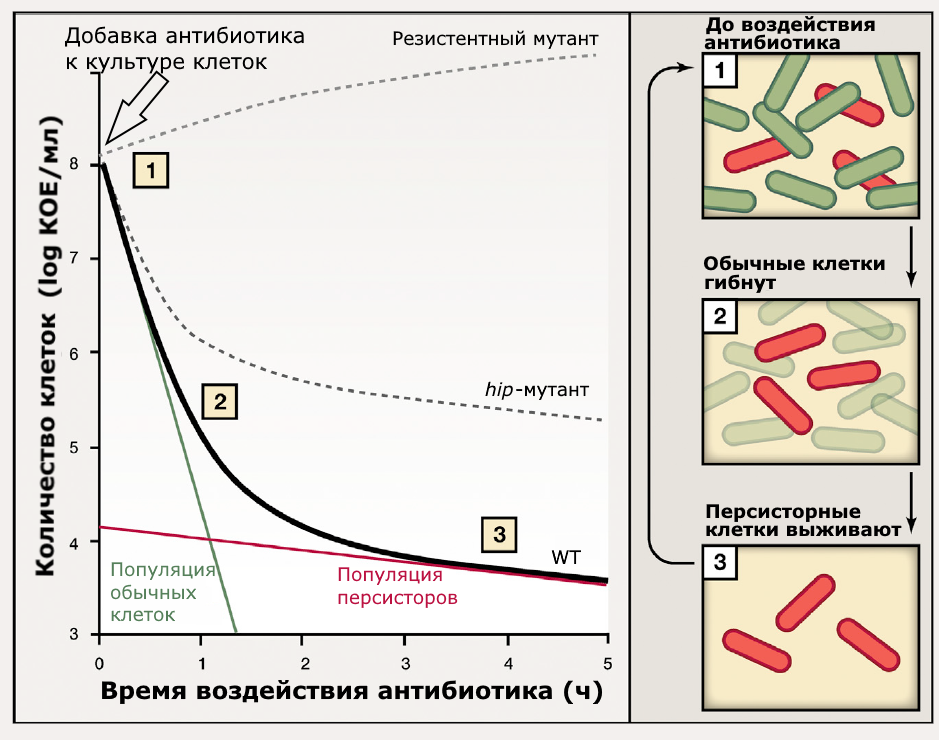
Рисунок 1. Кривая отмирания при воздействии бактерицидного антибиотика. При добавлении антибиотика (1) культура резистентного мутанта (штрих сверху) может даже подрасти, игнорируя воздействие. Клетки в культуре нерезистентного штамма дикого типа (WT, чёрная линия) будут отмирать, притом большая часть погибнет в самом начале (2) — это популяция обычных клеток. 104 оставшихся клеток убывают гораздо медленнее (3), а часть из них выживает до последнего часа инкубации. Эти клетки относятся к популяции персисторных клеток, в 10 000 раз меньшей, чем вся популяция в целом (108). hip-мутант имеет повышенную частоту образования персисторов (штрих ниже).
Оба явления — резистентность и персистенция — представляют собой различные стратегии противодействия бактерий антибиотикам и не реализуются в одном и том же штамме одновременно. Однако в эволюции вида в целом эти стратегии могут взаимно дополнять друг друга [7]. Так, клетки-персисторы испытывают на себе эволюционный пресс антибиотика, но не умирают, а оставляют потомство. С каждым новым поколением в выживших клетках накапливаются случайные мутации, и некоторые из них могут обеспечивать резистентность к антибиотику. Персистенция даёт возможность перебора таких мутаций даже в присутствии антибиотика, а не только перед его воздействием, и в некоторых случаях может конвертироваться в резистентность [8].
История открытия персистенции
В 1944 году Джозеф Биггер, врач из Дублинского университета, работал в военном госпитале в Йорке и проводил эксперименты с пенициллином на заре массового производства этого прорывного лекарства. Добавление пенициллина к культуре стафилококков приводило к видимому лизису бактерий, то есть к разрушению их клеточной оболочки и гибели клеток. Тем не менее, Биггер посеял лизированную культуру на чашки, на которой выросли колонии выживших клеток. После повторного пересева эти колонии выросли в культуру, которая снова лизировалась в присутствии пенициллина, и вновь формировала небольшую субпопуляцию, которую Биггер назвал «персисторы», чтобы отличить их от уже известных на тот момент резистентных мутантов, которые при воздействии пенициллина не были бы лизированы вовсе [9].

Рисунок 2. Джозеф Уорвик Биггер, ирландский врач, исследователь и политик, впервые описавший явление персистенции.
К сожалению, открытие персистенции осталось незамеченным в тени важной проблемы резистентности, страх перед которой возрос в последующие десятилетия [5]. По-видимому, всему виной общечеловеческое свойство психики: мы в большей степени опасаемся редких, но значительных угроз, таких как авиакатастрофы, и меньше тревожимся о статистически более вероятных угрозах, например, об автомобильных авариях.
Несмотря на пессимистичные прогнозы прошлых лет по поводу резистентности, антибиотики остаются эффективным средством в борьбе с инфекциями. Гены резистентности есть не у каждого штамма, а их распространение в популяции возбудителя можно ограничить, если использовать антибиотики разумно. В итоге, только спустя несколько десятков лет после открытия персистенции ученые осознали значимость этой проблемы, когда накопились вызывающие опасения данные о том, что все протестированные виды бактерий способны в той или иной степени проявлять персистентные свойства к любому антибиотику [10].
В чем опасность персистенции?
Персистенция не даёт справиться с болезнью окончательно: в части случаев та же инфекция возобновляется спустя некоторое время даже после успешного первоначального лечения антибиотиками и отступления острой фазы инфекции [5]. Проиллюстрирую этот процесс на примере туберкулёзной инфекции. Туберкулёз может протекать в активной форме, когда микобактерии активно размножаются в организме пациента, вызывая симптомы болезни, но также и в скрытой форме, когда бактерии персистируют в лёгких носителя, не вызывая симптомов болезни. В ходе лечения туберкулёза активно размножающаяся бактериальная популяция устраняется в ходе фазы интенсивной терапии. Но после всегда требуется многомесячная фаза продолжения лечения, цель которой — устранить латентную туберкулезную инфекцию с большим числом персисторов для предотвращения рецидивов [11]. Если штамм не резистентный, то используемые на данный момент антибиотики будут относительно эффективны в первой фазе лечения. Они позволят подавить экспансивный рост бактерий и справиться с проявлениями болезни. Однако в последующей фазе традиционные антибиотики неэффективны против покоящихся персистентных клеток, что приводит к большой доле рецидивов инфекции — в каждом пятом случае [2]. Персистенция является одной из главных причин трудности лечения многих хронических бактериальных инфекций: туберкулёза, рецидивирующих инфекций мочевыводящих путей, брюшного тифа, стафилококковых инфекций и многих других заболеваний инфекционной природы [9]. Кроме того, бактерии, раз за разом переживающие воздействие антибиотика при помощи персистенции, имеют потенциал приобрести мутации, обеспечивающие резистентность [11].
Откуда берутся персисторные клетки?
Каждая отдельная бактериальная клетка уникальна, притом не только на уровне ДНК. Даже если проанализировать популяцию бактерий-потомков одной клетки, геномы которых идентичны, каждая отдельная клетка всё равно будет отличаться от всех других своим составом, экспрессией генов и активностью различных белков. Некоторые клетки отличаются таким образом, что проявляют фенотип персистенции к каким-либо условиям среды [12]: выживают в присутствии антибиотика, при неблагоприятном pH, температуре и т. д. Эти отличия могут появиться как случайным образом в ходе роста и деления клетки (стохастическая персистенция), так и под действием факторов среды (индуцированная персистенция). Среди таких факторов: небольшие концентрации антибиотиков, окислительный стресс, осмотический стресс и даже смена питательного субстрата [13] (рис. 3). Иначе говоря, персисторы образуются вследствие гетерогенности бактериальной популяции. Более того, сама субпопуляция персисторов гетерогенна по природе: в одинаковых условиях формируется множество различных вариантов персистентных клеток, притом персисторы в одних условиях могут и не быть таковыми в других [14].
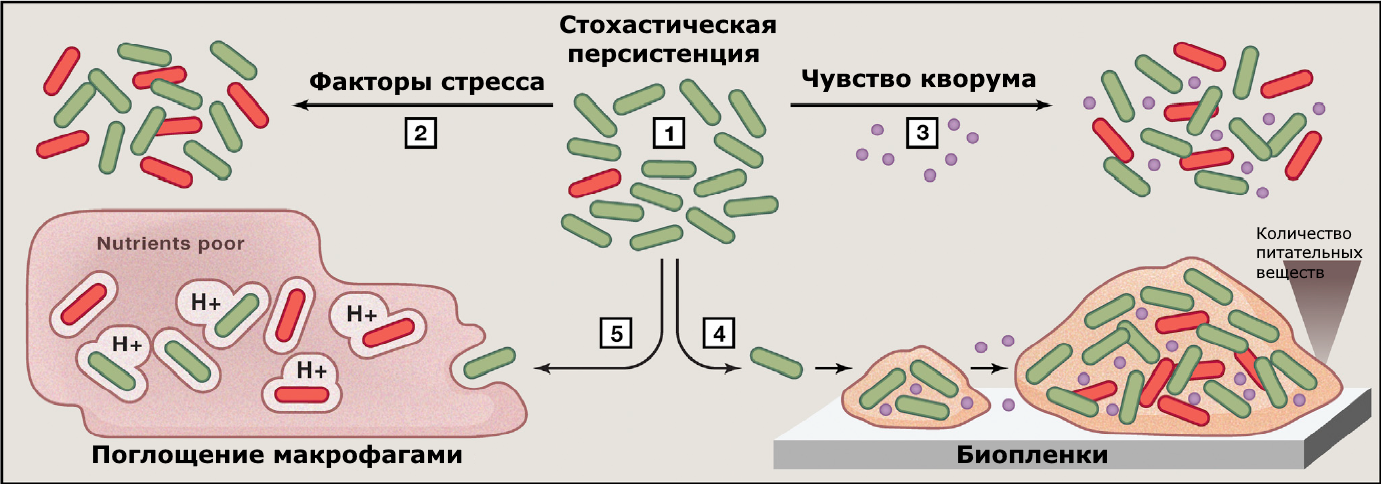
Рисунок 3. Факторы, способствующие формированию индуцированной персистенции. (1) Персисторы образуются случайным образом даже без внешних воздействий на популяцию. (2) Факторы стресса, например, голодание, окислительный, осмотический стресс, повышают долю персисторных клеток в популяции. (3) Чувство кворума — межклеточное взаимодействие при помощи химических сигнальных молекул, выделяемых клетками в среду — способствует образованию персисторных клеток. (4) Питательные вещества ограниченно проникают в глубокие слои биоплёнки, что увеличивает персистообразование. (5) Взаимодействие между хозяином и патогеном также вызывает образование персисторов.
Каждый студент-микробиолог первым делом узнаёт, что такое кривая роста бактериальной культуры. В лабораторных условиях при пересеве бактерий на свежую среду кривая роста имеет две основных фазы: экспоненциальную фазу, когда питательного субстрата много и клетки делятся интенсивно, и стационарную фазу, которая наступает при исчерпании питательных веществ и характеризуется торможением деления клеток и роста популяции. В стационарной фазе число персисторных клеток максимально, а в экспоненциальной — мало. Для кишечной палочки популяцию персисторов можно устранить просто путём нескольких пересевов экспоненциальных культур: если не давать клеткам входить в стационарную фазу, у этого вида можно устранить персисторы к ампициллину и офлоксацину [15]. Важно уточнить, что в природных условиях, в отличие от лабораторных, экспоненциальный рост встречается редко: жизнь «диких» бактерий — это сплошная стационарная фаза. Поэтому персисторные клетки имеются практически в любой природной популяции, в особенности у патогенных бактерий.
Персистенция и биоплёнки
Бактерии в природных популяциях почти всегда существуют в виде биоплёнок: клетки формируют вокруг себя комфортную среду в виде защитного матрикса, который смягчает окружающие условия, а у патогенов образует барьер для крупных молекул иммунитета. Такая защита ограничивает доступ бактерии к новым питательным веществам и приводит к голоданию, за счёт чего стационарная фаза наступает быстрее. Доля персисторов в популяции увеличивается, клетки начинают тормозить свой метаболизм, поэтому недостаток питательных веществ в глубоких слоях биоплёнки способствует формированию персистенции. Сочетание персистенции, которая помогает справляться с антибиотиками, и биоплёнок, которые маскируют клетки от иммунной системы, считается причиной того, что хронические бактериальные инфекции с трудом поддаются лечению [5], [16] (рис. 4). Полиамины, древние регуляторные молекулы, свойственные всем доменам жизни, контролируют адаптацию бактерий к стрессу, образование биоплёнок и чувство кворума, но кроме того, эти молекулы способны влиять на образование персисторных клеток [17].
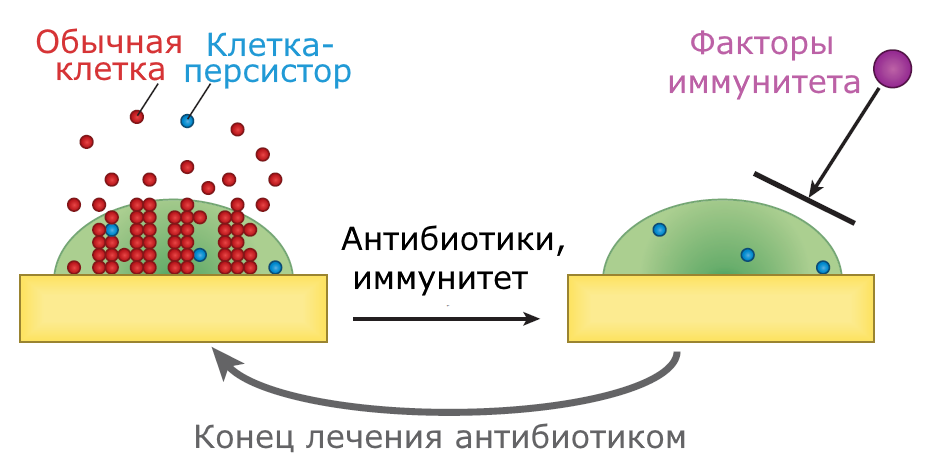
Рисунок 4. Сочетание персистенции и биопленок приводит к хроническим инфекциям. Бактериальная популяция, в которую входят и обычные, и персисторные клетки, формирует биоплёнку, а часть из них начинает колонизировать окружающие ткани. Антибиотик устраняет обычные активно растущие клетки, а иммунная система способна уничтожить и персисторные клетки. Но биоплёнка защищает персисторные клетки от крупных компонентов иммунной системы. Снижение концентрации антибиотика при окончании антибиотикотерапии позволяет персисторным клеткам снова заселить биоплёнку, что приводит к возобновлению инфекции.
Генетические основы персистенции
Наконец мы пришли к самой интересной части повествования: какие гены бактерий ответственны за формирование персистенции. Для этого часто используют такой подход — удаляют определённый ген из хромосомы бактерии (такая процедура называется нокаут) и смотрят, утратится ли исследуемая функция, то есть способность к образованию персисторов. Однако при анализе коллекции Кейо, где есть штаммы E. coli со всеми возможными одиночными нокаутами [18], оказалось, что способность к персистенции не снижается в значительной степени ни у одного штамма с одиночной делецией. Это указывает на то, что персистенция реализуется при помощи множества различных генов [19]. Чтобы развернуть этот клубок, нужно обратиться к ранним исследованиям по этой теме.
Первая подсказка для учёных появилась, когда был получен hip-мутант E. coli (от high persistence), который проявлял в 100 раз большую частоту образования персисторов, чем родительский штамм [20]. Мутировавший у этого штамма ген hipA кодирует белок-«яд» HipA, которым бактерия собственноручно подавляет свою жизнедеятельность — что-то вроде контролируемого суицида. Вместе с соответствующим белком-«противоядием» HipB эта пара генов образует систему токсин-антитоксин (или ТА-модуль). У hip-мутанта ген мутировал так, что продукт больше не обезвреживался антитоксином. Это способствовало образованию нерастущих персисторных клеток [21]. Так была обнаружена роль ТА-модулей в формировании персистенции.
Действуют они по общему механизму: в условиях стресса антитоксин дестабилизируется и расщепляется протеазами. «Противоядия» больше нет, и токсин начинает подавлять тот или иной механизм жизнедеятельности клетки. Бактерия тормозит рост, входит в состояние контролируемого стазиса и становится менее чувствительной к условиям среды и антибиотикам [21]. Кроме того, системы токсин-антитоксин имеют множество других функций: поддержание стабильности плазмид, альтруистическая гибель клетки, противодействие распространению бактериофагов, контроль роста клеток. У каждого вида бактерий десятки таких ТА-модулей. Одним из рекордсменов по их количеству является микобактерия туберкулёза [22].
Можно было бы решить проблему персистенции, разработав лекарство, которое нарушает работу ТА‑модулей. Но сложность как раз в большом числе модулей в геноме каждой бактерии. Из-за этого удаление всего одного ТА‑модуля не уменьшает доли персисторов в культуре. Для E. coli потребовалось нокаутировать 10 ТА-модулей одновременно, чтобы добиться значительного снижения персистенции [23]. Вряд ли удастся найти вещество, способное подавить такое количество разных белков и РНК одновременно.
Но у бактерий также есть ещё одна привлекательная мишень, связанная с персистенцией. Учёные обнаружили, что при удалении из хромосомы генов relA и spoT hip-мутант E. coli перестаёт производить повышенное количество персисторных клеток [21]. Гены relA и spoT кодируют белки алармон синтетазы, которые превращают ГТФ, ГДФ и ГМФ в особые регуляторные молекулы, в целом обозначаемые (p)ppGpp [24] (рис. 5). Эти соединения можно назвать молекулярным «сигналом тревоги» (их так и называют — алармоны — от слияния английских слов «alarm» и hormone»), ведь они синтезируется внутри клеток бактерий при неблагоприятных условиях среды (голодание, окислительный стресс, антибиотики и т. д.).
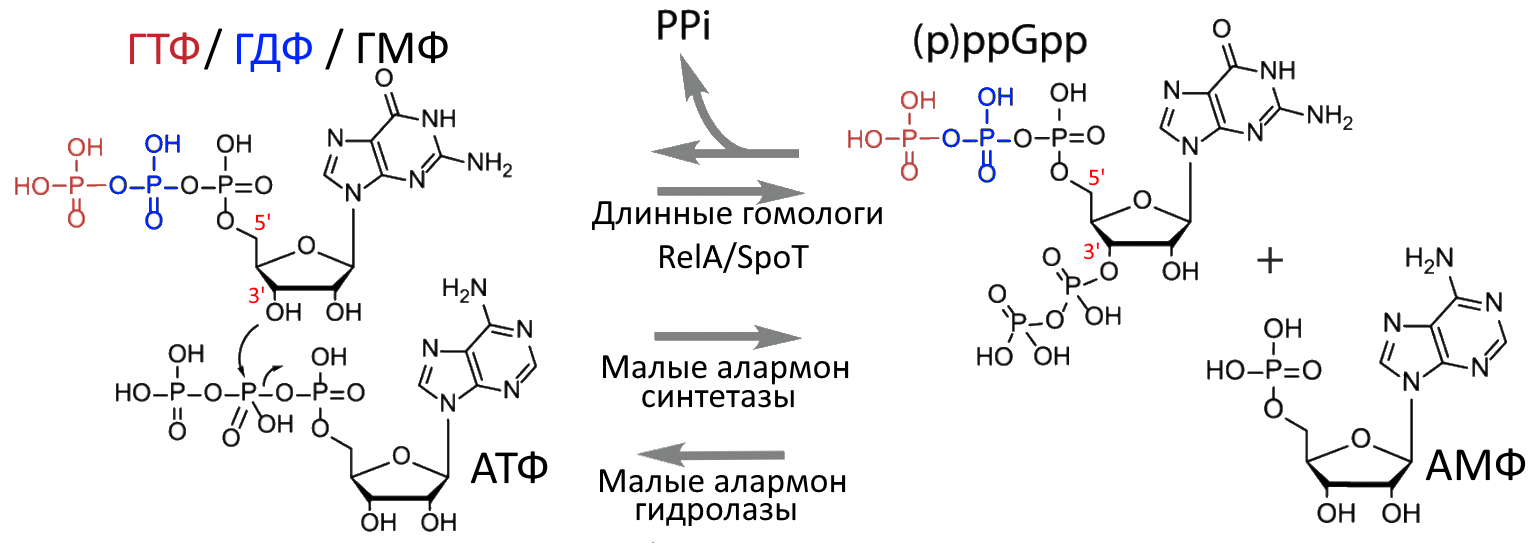
Рисунок 5. Схема синтеза (p)ppGpp. Гуаниновые нуклеотиды ГТФ, ГДФ и ГМФ (гуанозинтрифосфат, гуанозиндифосфат и гуанозинмонофосфат) играют важную роль в энергетических и информационных внутриклеточных процессах, а ГТФ используется РНК-полимеразой для создания нити РНК. Связь соседних нуклеотидов в РНК образуется между 5’-фосфатом и 3’-OH-группой. Но есть и другой способ использования гуаниновых нуклеотидов. Ферменты (p)ppGpp-синтетазы способны переносить пирофосфат с АТФ на 3’-OH-группу ГТФ, ГДФ или ГМФ, таким образом синтезируя pppGpp, ppGpp или pGpp соответственно (также их называют гуанозинпентафосфат, гуанозинтетрафосфат). Эта тройка молекул для простоты именуется (p)ppGpp и является очередным примером регуляторной молекулы, образуемой из легкодоступного для организма метаболита. (p)ppGpp-синтетазы бывают двух типов: длинные гомологи RelA/SpoT в основном способны и к синтезу, и к гидролизу (p)ppGpp, а малые алармон синтетазы — только к синтезу. Еще есть малые алармон гидролазы — они способны только к гидролизу. У каждого вида бактерий свой набор (p)ppGpp-синтезирующих/расщепляющих ферментов.
[24], рисунок дополнен актуальными данными
Впервые (p)ppGpp обнаружили в связи со стринджент-ответом бактерий. Для синтеза почти любого белка требуется материал в виде всех 20 базовых аминокислот. При нехватке даже одной аминокислоты в клетке она является лимитирующей для синтеза всех белков. В таком случае есть риск, что рибосома синтезирует лишь часть белка из доступных аминокислот, но трансляцию придётся остановить до тех пор, пока не появится недостающая аминокислота. Если рибосом слишком много, а какой-либо аминокислоты мало, синтезируется множество незаконченных белков, непригодных для работы клетки [25].
Эту проблему решает стринджент-ответ. Снижение скорости элонгации в синтезе белка приводит к активации (p)ppGpp-синтетаз RelA и SpoT (если брать в пример E. coli), и в клетке накапливается (p)ppGpp. (p)ppGpp способен связывать РНК-полимеразу, влияя на ее избирательность к промоторам генов. Таким образом клетка регулирует: какие гены экспрессировать больше, а какие — меньше. (p)ppGpp подавляет синтез рибосомальных РНК, что приводит к снижению числа рибосом, но повышает уровень транскрипции генов синтеза аминокислот для восполнения запаса. Чтобы обеспечить непрерывность синтеза белка при ограниченном запасе аминокислот, объём синтеза белка снижается до оптимального уровня в ходе стринджент-ответа [25].
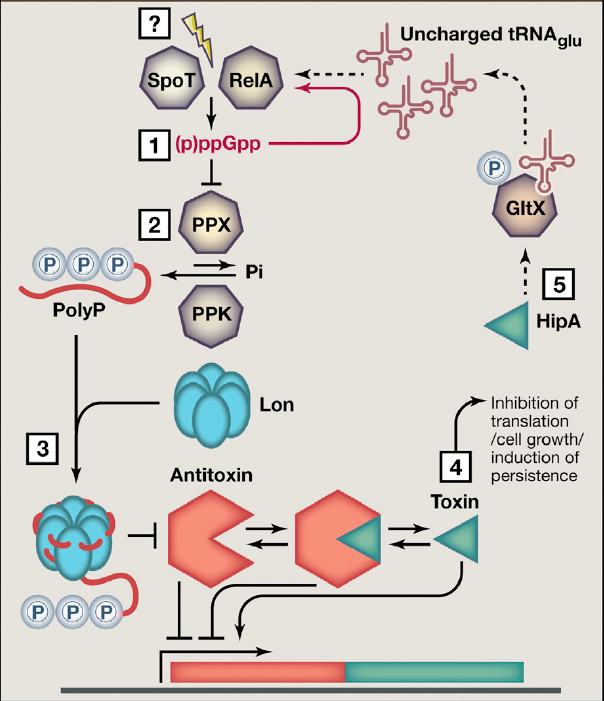
Рисунок 6. (p)ppGpp активирует ТА-модули E. coli, вызывая образование персисторных клеток. (1) Случайная или индуцированная активация белков RelA и SpoT у E. coli приводит к синтезу (p)ppGpp. (2) Алармон (p)ppGpp, помимо прочего, способен подавлять экзополифосфатазу (PPX) — фермент, который расщепляет полифосфаты (PolyP). Это приводит к накоплению полифосфатов, синтезируемых полифосфат киназой (PPK). (3) Полифосфаты активируют Lon-протеазу, которая способна расщеплять все 11 различных антитоксинов E. coli II типа, то есть имеющих белковую природу. (4) Это приводит к активации соответствующих токсинов, которые подавляют трансляцию и рост клетки, таким образом приводя к персистенции. (5) Петля обратной связи дополнительно усиливает эффект. Токсин HipA инактивирует фермент GltX, роль которого — переводить аминокислоту глутамат в форму аминоацил-тРНК, которая может быть использована рибосомой. Это приводит к накоплению пустых тРНК без аминокислоты. (p)ppGpp-синтетаза RelA чувствительна к таким тРНК, поэтому их накопление приводит к дальнейшему синтезу (p)ppGpp. В результате активность всей цепи возрастает ещё больше. Стоит отметить, что у других видов бактерий механизм формирования персистенции может отличаться, но всегда включает в себя (p)ppGpp и ТА-модули.
(p)ppGpp участвует не только в стринджент-ответе, но и во множестве других клеточных процессов: адаптации бактерий к стрессу, образовании биоплёнок, контроле скорости роста [26]. Кроме того, была обнаружена ключевая роль (p)ppGpp в формировании персистенции бактерий. Оказалось, что повышение концентрации (p)ppGpp в клетке приводит к активации ТА-модулей и формированию персистентного фенотипа [27] (рис. 6).
Новый класс антибиотиков с механизмом действия ингибиторов (p)ppGpp-синтетаз, подавляющий синтез (p)ppGpp, потенциально может помочь в лечении поздних фаз инфекции и решении проблемы персистенции [28]. Если у Mycobacterium tuberculosis, возбудителя туберкулёза, удалить ген relMtb, ответственный за синтез (p)ppGpp, бактерия теряет способность к долговременному выживанию в условиях стресса и больше не может вызывать латентный туберкулёз. Последнее было продемонстрировано на модели мышей, заражённых таким штаммом бактерий [29]. Новые антибактериальные вещества, которые подавляют синтез (p)ppGpp, имеют слабую активность в отношении растущих клеток бактерий, но способны эффективно действовать против поздних культур бактерий, где велико число покоящихся клеток [30-32]. Это свойство может решить проблему с традиционными антибиотиками, которые хоть и активны против растущих клеток, слабо действуют на персисторные клетки.
Заключение
В последние десятилетия темп роста резистентности увеличивается, но фармацевтические компании тем не менее сворачивают разработку новых антибиотиков. Коммерческая привлекательность таких разработок снижается. Ведь резистентные штаммы появляются в течение всего нескольких лет клинического использования, тогда как на разработку уходят десятилетия исследований [33]. По моему мнению, кризис здравоохранения в области антибиотиков будет только возрастать, пока организации здравоохранения и медиа (но не учёные!) всё внимание направляют на борьбу с генетически обусловленной резистентностью, при этом игнорируя фенотипические механизмы формирования устойчивости к антибиотикам — персистенцию и образование биоплёнок. Эти механизмы позволяют бактериям переживать воздействие любых антибиотиков [10] и дают возможность эволюционировать в присутствии препарата [8], таким образом делая вклад в формирование резистентности и к классическим, и к современным антибиотикам.
В подходах к лечению хронических бактериальных инфекций требуется смена парадигмы. Решением проблемы могут стать новые антибиотики, направленные на предотвращение формирования персистентных клеток, например, ингибиторы (p)ppGpp-синтетаз, в сочетании с рациональным применением традиционных антибиотиков. Такой подход позволит сохранить то богатство антибактериальных препаратов, которое у нас пока имеется, и предотвратить появление резистентности к новым препаратам, которые появятся в будущем.
Литература
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Эпидемическая ситуация по туберкулезу в Российской Федерации в 2019 году: основные показатели по туберкулезу за 2019 год. (2020). Федеральный центр мониторинга противодействия распространению туберкулеза в РФ;
- Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?;
- Clyde A. Smith, Edward N. Baker. (2002). Aminoglycoside Antibiotic Resistance by Enzymatic Deactivation. CDTID. 2, 143-160;
- Kim Lewis. (2010). Persister Cells. Annu. Rev. Microbiol.. 64, 357-372;
- Etienne Maisonneuve, Kenn Gerdes. (2014). Molecular Mechanisms Underlying Bacterial Persisters. Cell. 157, 539-548;
- T. Vogwill, A. C. Comfort, V. Furió, R. C. MacLean. (2016). Persistence and resistance as complementary bacterial adaptations to antibiotics. J. Evol. Biol.. 29, 1223-1233;
- Jees Sebastian, Sharmada Swaminath, Rashmi Ravindran Nair, Kishor Jakkala, Atul Pradhan, Parthasarathi Ajitkumar. (2017). De Novo Emergence of Genetically Resistant Mutants of Mycobacterium tuberculosis from the Persistence Phase Cells Formed against Antituberculosis Drugs In Vitro. Antimicrob Agents Chemother. 61;
- JosephW. Bigger. (1944). TREATMENT OF STAPHYLOCOCCAL INFECTIONS WITH PENICILLIN BY INTERMITTENT STERILISATION. The Lancet. 244, 497-500;
- Jesus Enrique Salcedo-Sora, Douglas B. Kell. (2020). A Quantitative Survey of Bacterial Persistence in the Presence of Antibiotics: Towards Antipersister Antimicrobial Discovery. Antibiotics. 9, 508;
- Soma Mandal, Samuel Njikan, Anuradha Kumar, Julie V. Early, Tanya Parish. (2019). The relevance of persisters in tuberculosis drug discovery. Microbiology. 165, 492-499;
- N. Q. Balaban. (2004). Bacterial Persistence as a Phenotypic Switch. Science. 305, 1622-1625;
- Stephanie M. Amato, Mehmet A. Orman, Mark P. Brynildsen. (2013). Metabolic Control of Persister Formation in Escherichia coli. Molecular Cell. 50, 475-487;
- Ying Zhang. (2014). Persisters, persistent infections and the Yin–Yang model. Emerging Microbes & Infections. 3, 1-10;
- Iris Keren, Niilo Kaldalu, Amy Spoering, Yipeng Wang, Kim Lewis. (2004). Persister cells and tolerance to antimicrobials. FEMS Microbiology Letters. 230, 13-18;
- D. Nguyen, A. Joshi-Datar, F. Lepine, E. Bauerle, O. Olakanmi, et. al.. (2011). Active Starvation Responses Mediate Antibiotic Tolerance in Biofilms and Nutrient-Limited Bacteria. Science. 334, 982-986;
- Alexander G. Tkachenko, Natalya M. Kashevarova, Elena A. Karavaeva, Mikhail S. Shumkov. (2014). Putrescine controls the formation ofEscherichia colipersister cells tolerant to aminoglycoside netilmicin. FEMS Microbiol Lett. 361, 25-33;
- Tomoya Baba, Takeshi Ara, Miki Hasegawa, Yuki Takai, Yoshiko Okumura, et. al.. (2006). Construction of Escherichia coli K‐12 in‐frame, single‐gene knockout mutants: the Keio collection. Mol Syst Biol. 2;
- Sonja Hansen, Kim Lewis, Marin Vulić. (2008). Role of Global Regulators and Nucleotide Metabolism in Antibiotic Tolerance in Escherichia coli. AAC. 52, 2718-2726;
- H S Moyed, K P Bertrand. (1983). hipA, a newly recognized gene of Escherichia coli K-12 that affects frequency of persistence after inhibition of murein synthesis.. Journal of Bacteriology. 155, 768-775;
- Shaleen B. Korch, Thomas A. Henderson, Thomas M. Hill. (2003). Characterization of the hipA7 allele of Escherichia coli and evidence that high persistence is governed by (p)ppGpp synthesis. Molecular Microbiology. 50, 1199-1213;
- Holly R. Ramage, Lynn E. Connolly, Jeffery S. Cox. (2009). Comprehensive Functional Analysis of Mycobacterium tuberculosis Toxin-Antitoxin Systems: Implications for Pathogenesis, Stress Responses, and Evolution. PLoS Genet. 5, e1000767;
- Etienne Maisonneuve, Lana J. Shakespeare, Mikkel Girke Jørgensen, Kenn Gerdes. (2011). Bacterial persistence by RNA endonucleases. Proc Natl Acad Sci USA. 108, 13206-13211;
- Jelena Beljantseva, Pavel Kudrin, Steffi Jimmy, Marcel Ehn, Radek Pohl, et. al.. (2017). Molecular mutagenesis of ppGpp: turning a RelA activator into an inhibitor. Sci Rep. 7;
- Ткаченко А.Г. Молекулярные механизмы стрессорных ответов у микроорганизмов. Екатеринбург: УрО РАН, 2012. — 265 c.;
- Katarzyna Potrykus, Helen Murphy, Nadège Philippe, Michael Cashel. (2011). ppGpp is the major source of growth rate control in E. coli. Environmental Microbiology. 13, 563-575;
- Etienne Maisonneuve, Manuela Castro-Camargo, Kenn Gerdes. (2013). RETRACTED: (p)ppGpp Controls Bacterial Persistence by Stochastic Induction of Toxin-Antitoxin Activity. Cell. 154, 1140-1150;
- Gajraj Singh Kushwaha, Bolaji Fatai Oyeyemi, Neel Sarovar Bhavesh. (2019). Stringent response protein as a potential target to intervene persistent bacterial infection. Biochimie. 165, 67-75;
- L. A. Weiss, C. L. Stallings. (2013). Essential Roles for Mycobacterium tuberculosis Rel beyond the Production of (p)ppGpp. Journal of Bacteriology. 195, 5629-5638;
- Ezequiel Wexselblatt, Yaara Oppenheimer-Shaanan, Ilana Kaspy, Nir London, Ora Schueler-Furman, et. al.. (2012). Relacin, a Novel Antibacterial Agent Targeting the Stringent Response. PLoS Pathog. 8, e1002925;
- Kirtimaan Syal, Kelly Flentie, Neerupma Bhardwaj, Krishnagopal Maiti, Narayanaswamy Jayaraman, et. al.. (2017). Synthetic (p)ppGpp Analogue Is an Inhibitor of Stringent Response in Mycobacteria. Antimicrob Agents Chemother. 61;
- Noton K. Dutta, Lee G. Klinkenberg, Maria-Jesus Vazquez, Delfina Segura-Carro, Gonzalo Colmenarejo, et. al.. (2019). Inhibiting the stringent response blocks Mycobacterium tuberculosis entry into quiescence and reduces persistence. Sci. Adv.. 5, eaav2104;
- Путь лекарства.