Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?
08 ноября 2019
Антибиотики vs Бактерии. «Война Бесконечности» или всему есть предел?
- 11824
- 1
- 19
Борьба между бактериями и антибиотиками. Победитель уже известен?
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Между исследователями и бактериями развернулась самая настоящая «гонка вооружений». Каждый день в лабораториях моделируются сотни и проверяются десятки потенциальных антибактериальных препаратов, однако лишь единицы проходят все этапы клинических испытаний и выходят на фармацевтический рынок. В данной работе раскрыты механизмы действия антибиотиков (как старых, так и относительно новых классов), прочно вошедших в клиническую практику. Однако статья этим не ограничивается; затронута одна из самых обсуждаемых проблем в современном мире — антибиотикорезистентность (АБР). Рассмотрено несколько сторон данного вопроса: механизмы формирования АБР, ее распространение в популяции бактерий, а также способы защиты микроорганизмов от действия антибиотиков. Ясное понимание всего этого — обязательное условие как в использовании уже имеющихся препаратов, так и в разработке новых, а также, вероятно, в снижении устойчивости бактерий.
Конкурс «био/мол/текст»-2019
Эта работа опубликована в номинации «Сколтех» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Вступление
Антибиотики поистине являются чудом. Они вывели медицину на новый уровень и спасли бесчисленное количество жизней. Однако с большим сожалением вынужден констатировать, что «успех» антибиотиков, возможно, временное явление. Сегодня перед человечеством стоит сложная долгосрочная задача: отыскать новые и совершенствовать уже имеющиеся методы борьбы с устойчивыми к антибиотикам бактериями. Чтобы понять, как найти подход к этой проблеме, требуются знания как механизмов действия антибактериальных агентов, так и устойчивости к ним. Давайте попробуем разобраться в этом.
Бактерии представляют собой отдельный домен жизни. Они радикально отличаются от нас — эукариот (и не только отсутствием оформленного клеточного ядра). Большинство процессов, связанных с репликацией ДНК, синтезом белка, а также основной метаболизм бактерий, их мембрана и клеточная стенка имеют свои особенности, отличающиеся от таковых у эукариот. Эти различия позволяют находить и создавать лекарственные препараты — антибиотики, которые избирательно влияют на бактерий, не затрагивая эукариот.
Основная классификация антибактериальных препаратов строится на их механизме действия и химической структуре. Поэтому дальше мы рассмотрим основные классы и механизмы действия антибиотиков, использующихся во врачебной практике. Однако прежде чем говорить об антибактериальных препаратах, нужно разобрать строение одной из самых главных и «излюбленных» их мишеней — клеточной стенки.
Клетка любого организма — будь то растение, грибы, археи, бактерии или животные, — имеет цитоплазматическую (клеточную) мембрану. Она состоит из двух слоев липидов, в которых «плавают» молекулы белков. Исходя из названия, несложно догадаться, что основным ее предназначением является отделение цитоплазмы и ее компонентов от внешней среды. Конечно, у нее еще множество различных функций и особенностей строения, о которых более подробно вы можете узнать из статьи «Липидный фундамент жизни» [1]. Очень важно, что цитоплазматическая мембрана некоторых клеток (в первую очередь, конечно, бактериальных) может иметь некоторые «надстройки», главной из которых является клеточная стенка (рис. 1).
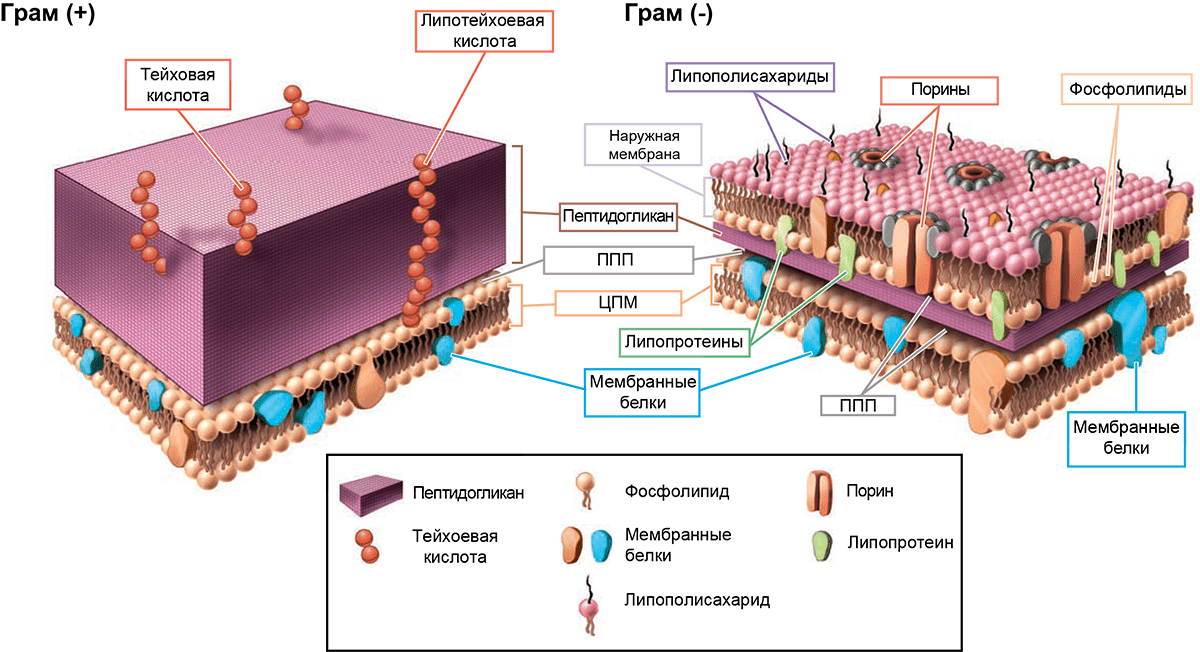
Рисунок 1. Строение клеточной стенки и мембран грамположительных (Г+) и грамотрицательных (Г−) бактерий. Основа любой бактериальной клетки — цитоплазматическая мембрана (ЦПМ), состоящая преимущественно из фосфолипидов и белков, «встроенных» в нее. На поверхности пептидогликана Г+ бактерий выступают тейхоевые кислоты — полимеры, состоящие из повторяющихся остатков (гликозил)полиолов, связанных фосфодиэфирными связями. Если они дополнительно соединены с липидами ЦПМ, их называют липотейхоевыми кислотами. «Барьеры» Г− микрорганизмов устроены немного сложнее. Их пептидогликановый слой намного тоньше, но зато он дополнительно защищен наружной мембраной, которая весьма богата на различные компоненты. Липополисахариды (ЛПС) состоят из трех различных компонентов: липида А, который «заякоривает» молекулу ЛПС в мембране, полисахаридного ядра, соединяющего липид А с последней составляющей ЛПС — антигеном O. Порины регулируют проницаемость наружной мембраны в ответ на изменение условий окружающей среды, а липопротеины «сшивают» наружную мембрану и клеточную стенку. Периплазматические белки, входящие в периплазматическое пространство (ППП), представлены в основном двумя типами: транспортными белками и гидролитическими ферментами. Если с предназначением первых все более-менее ясно, то одна из функций вторых (забегая вперед!) — обеспечивать инактивацию некоторых антибактериальных препаратов.
[2], иллюстрация адаптирована
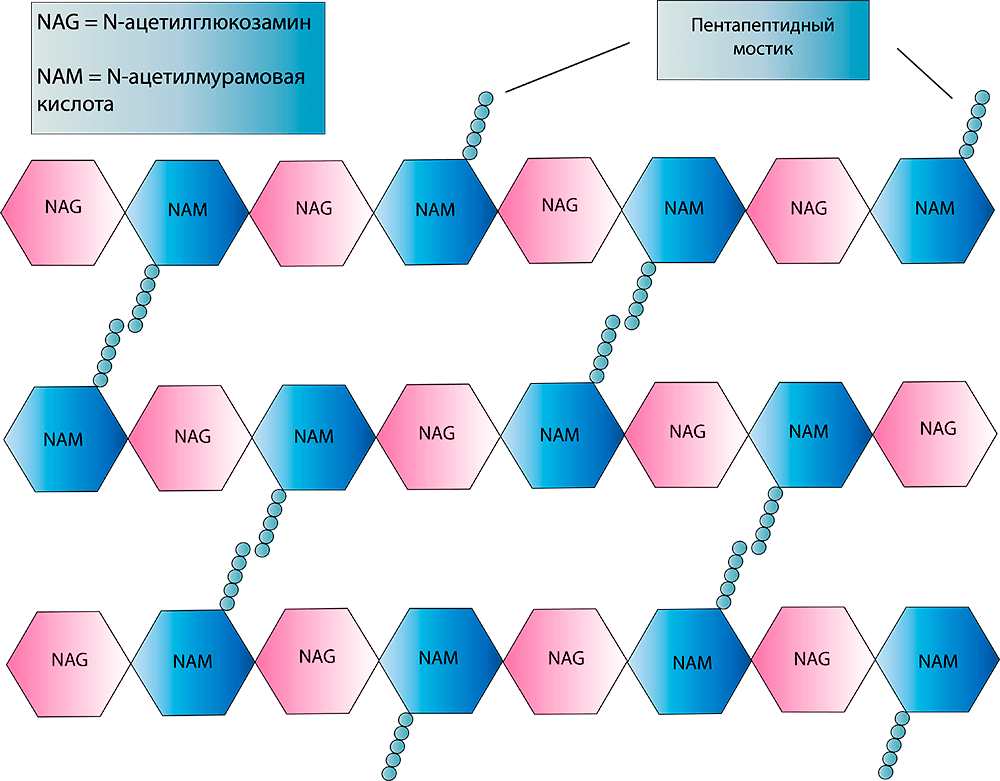
Сразу оговорюсь, что существует классификация микроорганизмов, основанная на особенностях строения клеточной стенки (см. врезку). Главный ее компонент — пептидогликан (его также называют муреином) (рис. 2а); будет важно отметить, что он присущ только бактериям, в то время как, например, основной частью клеточной стенки грибов является хитин, а растений — целлюлоза (у клеток животных клеточная стенка вообще отсутствует!).
Наружная мембрана Г− бактерий представляет собой билипидный слой. На ее поверхности находятся липополисахариды (ЛПС), защищающие мембрану от агрессивных воздействий окружающей среды. Отрицательный заряд ЛПС повышает общий отрицательный заряд микроорганизма и стабилизирует его мембрану. Данная структура (как и тейхоевые кислоты у грамположительных бактерий) может распознаваться иммунной системой нашего организма, которая обеспечивает защитную реакцию в ответ на «вторжение» патогенных микроорганизмов. Еще одной особенностью наружной мембраны является то, что она буквально «пронизана» поринами — белками, которые формируют каналы, обеспечивающие доступ к цитоплазматической мембране для растворимых в воде веществ. Но и это далеко не все! Ведь в мембране, помимо всего прочего, находятся различные липопротеины, связывающие внешнюю мембрану с пептидогликановым слоем, в результате чего такой барьер становится еще более прочным. Периплазматическое пространство присуще как Г+, так и Г− бактериям. Это место, куда погружен пептидогликановый слой, заполнено раствором, в состав которого входят специфические белки, олигосахариды и неорганические молекулы.
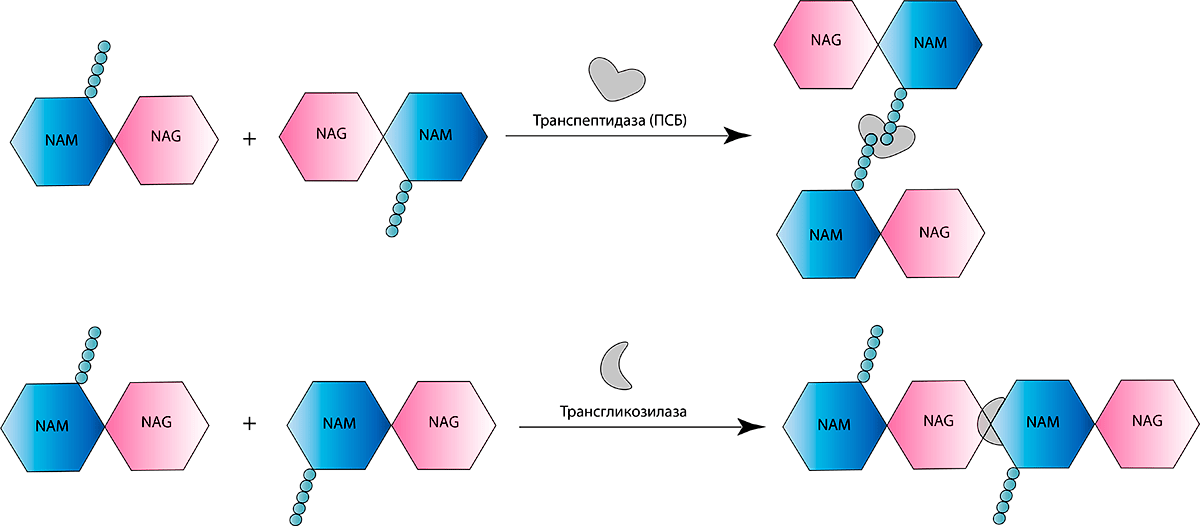
Обычно в цитоплазматическую мембрану встроены специальные ферменты — транспептидазы, катализирующие последние стадии образования пептидогликана. Также их именуют пенициллинсвязывающими белками (ПСБ). Весьма «говорящее» название, не правда ли? Обязательно об этом расскажем, но немного позже. А сейчас перейдем непосредственно к пептидогликану. В его синтезе участвуют как минимум два важных фермента-«строителя». Уже вышеупомянутая транспептидаза «сшивает» пентапептидные мостики между собой, а трансгликозилаза позволяет соединять мономеры «NAG—NAM», удлиняя, таким образом, цепочку пептидогликана (рис. 2б).
В целом со строением мембран и клеточной стенки мы разобрались. Давайте перейдем к обсуждению «виновников торжества».
Антибиотики, действующие на мембрану или клеточную стенку — преодолеваем бактериальные барьеры
β-лактамы
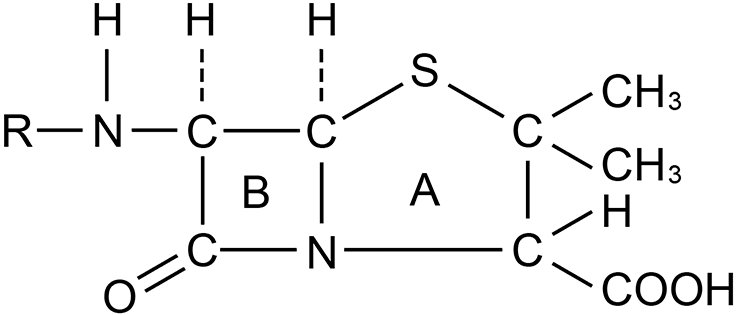
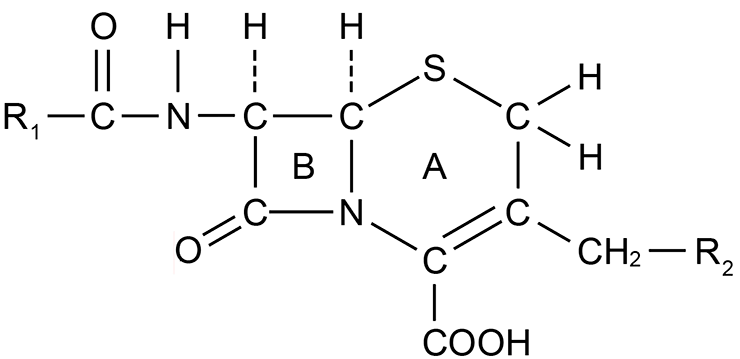
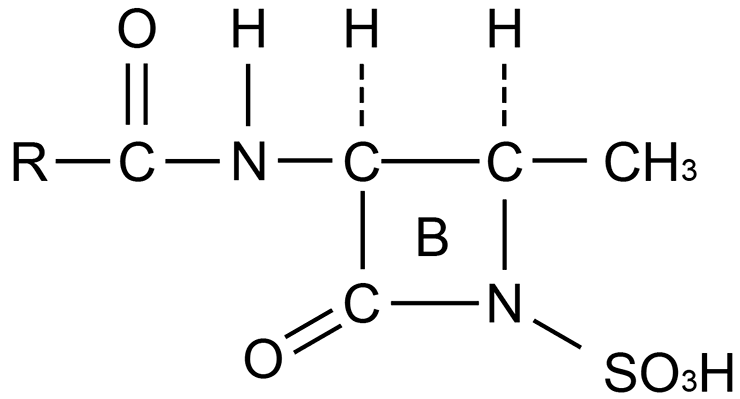
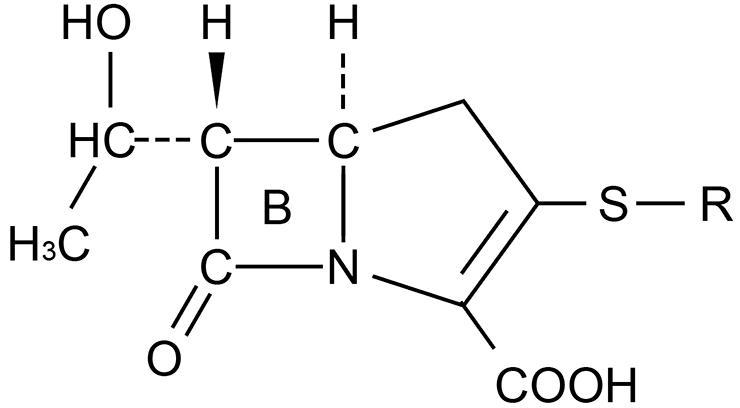
К β-лактамным антибиотикам, помимо всем хорошо известных пенициллинов (рис. 3а) [4], также относятся цефалоспорины (рис. 3б), монобактамы (рис. 3в) и карбапенемы (рис. 3г). Все препараты этих групп объединяет наличие β-лактамного кольца в структуре их молекул.
Пенициллины, как и все β-лактамные антибиотики, вызывают гибель бактерий. Другими словами, они обладают бактерицидным действием. β-лактамный антибиотик, будучи структурным аналогом концевого дипептида пептидогликана D-аланил-D-аланина, ковалентно связывается с активным сайтом (местом присоединения фермента к субстрату) ПСБ. Такое связывание ингибирует реакцию транспептидирования и останавливает синтез пептидогликана (рис. 4). В результате таких нарушений барьера бактериальная клетка становится осмотически неустойчивой и в конце концов разрушается [5]. Интересно, что данный класс антибиотиков (впрочем, как и многие другие) практически не имеет серьезных побочных эффектов, поскольку пептидогликан и ПСБ отсутствуют у эукариот. Нельзя не подчеркнуть, что β-лактамные препараты (впрочем, как и другие препараты, влияющие на синтез клеточной стенки) убивают бактерий только в том случае, когда те активно растут и синтезируют клеточную стенку (ведь «зрелые» бактерии уже образовали свою клеточную стенку, и антибиотику попросту уже не на что влиять!)
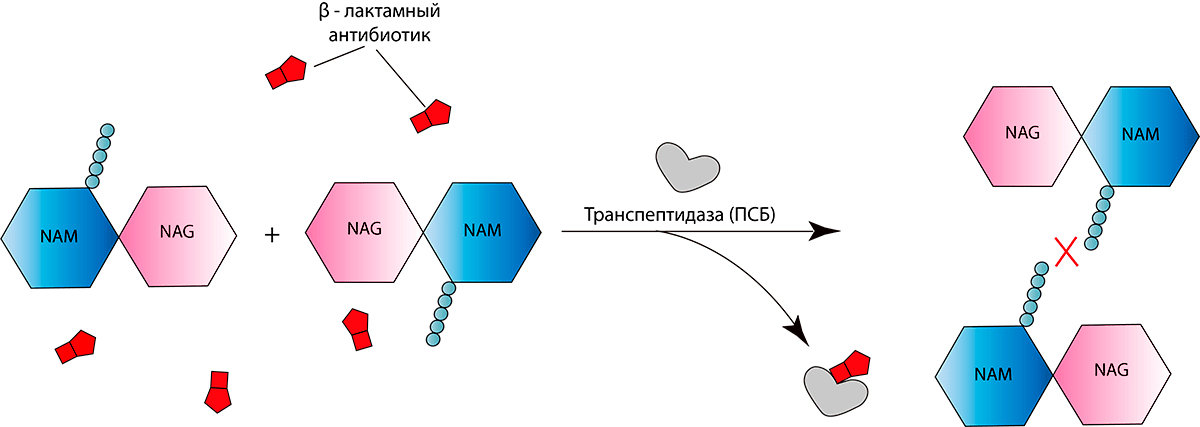
Рисунок 4. Механизм действия β-лактамных антибиотиков. В его основе лежит ингибирование реакции транспептидирования, так как молекулы препарата связываются с ферментом транспептидазой, в результате чего не происходит сшивки пептидных мостиков.
[3], иллюстрация изменена и адаптирована
Гликопептиды
Ванкомицин — родоначальник представителей класса гликопептидов — действует только на грамположительных бактерий. Очень долгое время данный препарат считался «лекарством последней надежды», поскольку применялся он в крайних случаях, и к нему не развивалась резистентность. Но сейчас даже такой «мастодонт» начал потихоньку сдавать свои позиции из-за приобретения бактериями устойчовости к нему. Механизм действия ванкомицина основан на подавлении синтеза клеточной стенки с помощью прямого связывания с терминальной частью пептидного мостика (а именно с D-аланил-D-аланином) липида-II [6–8].
Комплекс «ванкомицин—пентапептид» за счет «стерической изоляции» ванкомицином фрагмента пептидогликана, не позволяет:
- трансгликозилазе осуществлять дальнейшее удлинение пептидогликана — ингибирование реакции трансгликозилирования;
- транспептидазе формировать перекрестные связи — ингибирование реакции транспептидации [10].
Благодаря этому клеточная стенка бактерии становится очень непрочной и подверженной осмотическому давлению, и, как следствие, разрушению (рис. 6).

Рисунок 6. Механизм действия ванкомицина (Van). Молекула препарата связывается с концевой частью пептидного мостика (D-аланил-D-аланин) трансмембранного переносчика липида-II. Благодаря этому трансгликозилаза оказывается заблокирована комплексом «ванкомицин—пентапептид», в результате чего фермент не может «добраться» до места катализирования реакции, а транспептидаза не может сшить пептидные мостики между собой.
иллюстрация автора статьи
Относительно новые представители класса гликопептидов, недавно «ворвавшиеся» в клиническую практику, также имеют несколько механизмов действия, основной из которых подобен механизму действия ванкомицина. В дополнение к этому механизму телаванцин нарушает мембранный потенциал бактериальной клетки и увеличивает ее проницаемость, а сопутствующие механизмы далбаванцина и оритаванцина опосредованы через угнетение синтеза РНК и нарушение проницаемости мембраны, однако до конца эти механизмы пока не выяснены [11].
До этого момента мы с вами обсуждали антибиотики, действующие на последних стадиях синтеза клеточной стенки. Но что, если существуют такие препараты, которые могут «работать» на начальных этапах ee образования? Есть и такие в арсенале ученых и врачей: это циклосерин, фосфомицин и бацитрацин (рис. 7) [3].
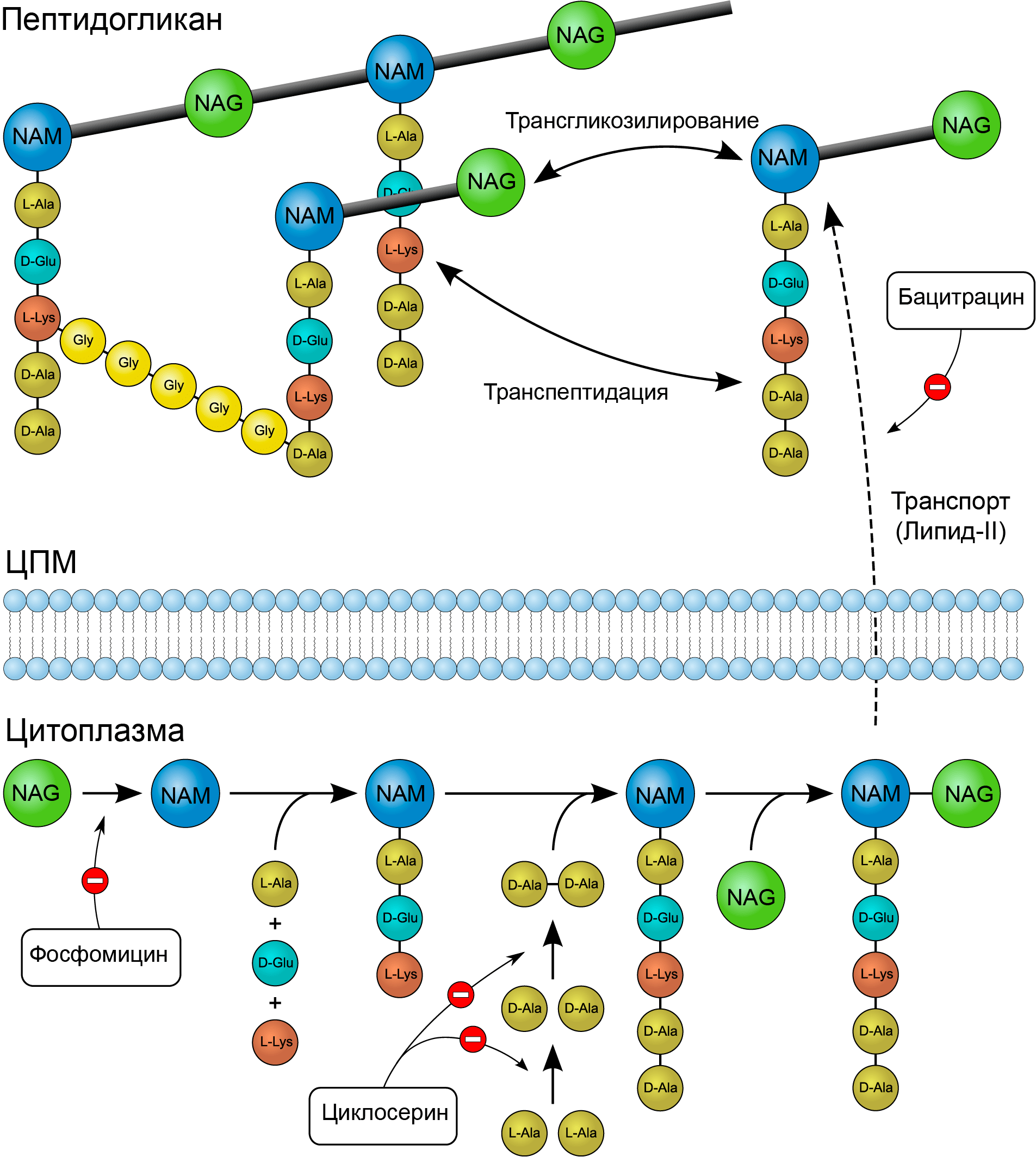
Рисунок 7. Механизмы действия циклосерина, фосфомицина и бацитрацина. Фосфомицин действует на самых ранних этапах образования клеточной стенки. Он подавляет цитоплазматический фермент енолпируваттрансферазу, блокируя присоединение фосфоенолпирувата к UDP-N-ацетилгюкозамину (предшественнику NAM). Циклосерин является структурным аналогом аминокислоты D-аланина. Этот препарат ингибирует включение D-аланина в пентапептид муреина путем подавления активности двух ферментов: аланинрацемазы (превращающающей L-аланин в D-аланин) и D-аланил-D-аланинлигазы (сшивает D-аланил-D-аланин). Бацитрацин, обладающий бактерицидным действием, связывается с активной фосфорилированной формой переносчика, в результате чего не происходит дефосфорилирование липида-II, то есть регенерация его свободной формы. В таком случае не могут осуществиться начальные стадии синтеза пептидогликана, в которых задействован липидный переносчик.
«Википедия», иллюстрация изменена
Но одними препаратами, действующими на клеточную стенку, эта большая группа антибиотиков не ограничивается, поскольку есть еще «мишени» — цитоплазматическая и наружная мембраны.
Даптомицин — представитель группы липопептидов. Его действие направлено преимущественно на устранение Г+ бактерий. Предполагается, что молекулы препарата связываются с мембраной посредством кальций-зависимой вставки в ее билипидный слой, которая сопровождается образованием поры [12]. В результате этого происходит утечка ионов калия, мембрана деполяризуется. Нарушения электролитного баланса клетки и заряда мембраны ведут к подавлению образования бактериальных ДНК, РНК и белков, из-за чего микроорганизм и погибает (рис. 8) [13].
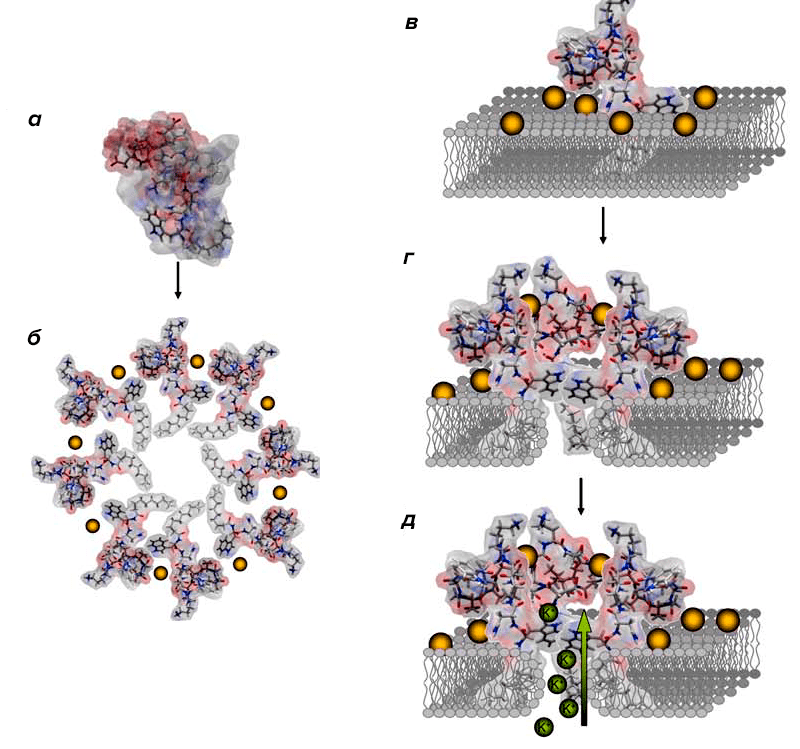
Рисунок 8. Схема действия даптомицина. Даптомицин, несвязанный с ионами кальция (а) обладает низкими амфифильными свойствами. Попадая во внеклеточную жидкость, молекула препарата связывается с Ca2+ и меняет свою конформацию благодаря образованию мицелл, повышая при этом свою амфифильность (б). Благодаря этому свойству и своей химической структуре даптомицин взаимодействует с мембраной и вставляется в нее, при чем кальций связывается с фосфатидилглицерольными «головками» липидного слоя мембраны (в). Инсерция антибиотика в мембрану сопровождается еще одним изменением конформации молекулы препарата (г), вызывая при этом деформацию липидного слоя (д), в результате которой образуется пора в мембране. Через такой дефект и происходит утечка ионов калия.
Полимиксины
Существует еще одна небольшая группа препаратов, влияющих на мембрану — полимиксины (главный представитель которых — колистин). Имея положительный заряд, полимиксины нарушают отрицательный заряд внешней мембраны Г− бактерий, конкурентно замещая ионы кальция и магния у фосфатных групп ЛПС.
Дестабилизация ЛПС приводит к разрывам во внешней мембране, потере периплазматических и цитоплазматических компонентов и ведет к гибели микробной клетки [15]. К дополнительным механизмам действия полимиксинов относят ингибирование дыхательных ферментов на внутренней мембране бактерии, что делает этот препарат еще более «смертоносным».
Антибиотики, нарушающие синтез белка — снижаем «качество жизни» микроорганизмов
До того, как говорить о препаратах, влияющих на синтез белка, следует разобрать сам этот процесс, а точнее ту его часть, на которую так или иначе влияет большинство антибиотиков — трансляцию. Ведь именно рибосомы — «фабрики» по сборке полипептидных цепей — в первую очередь отвечают за этот столь важный процесс. Нужно учесть, что прокариотические рибосомы отличаются от эукариотических, благодаря чему антибактериальные агенты избирательно влияют на работу только бактериальных рибосом, не затрагивая эукариотические.
Ингибирование доставки аминоацил-тРНК
Тетрациклины — антибиотики широкого спектра действия с бактериостатическим эффектом (который заключается в торможение роста и размножения микроорганизмов, не вызывая при этом их гибели; допускается, что наша иммунная система способна самостоятельно справиться с уничтожением микробов). Внутрь микроорганизма тетрациклины попадают как с помощью пассивной диффузии, так и с помощью энергозависимого активного транспорта. В микробной клетке они обратимо связываются с малой 30S субъединицей бактериальной рибосомы [17] и в итоге вызывают остановку синтеза белка [18]. Нет белка — нет ни роста, ни деления бактерии. Антибиотик тигециклин принадлежит к классу глицилциклинов, структурно сходных с тетрациклинами. Однако, по сравнению с ними, тигециклин имеет гораздо большее сродство к 30S субъединице, благодаря чему его бактериостатическое действие более эффективно (рис. 10).
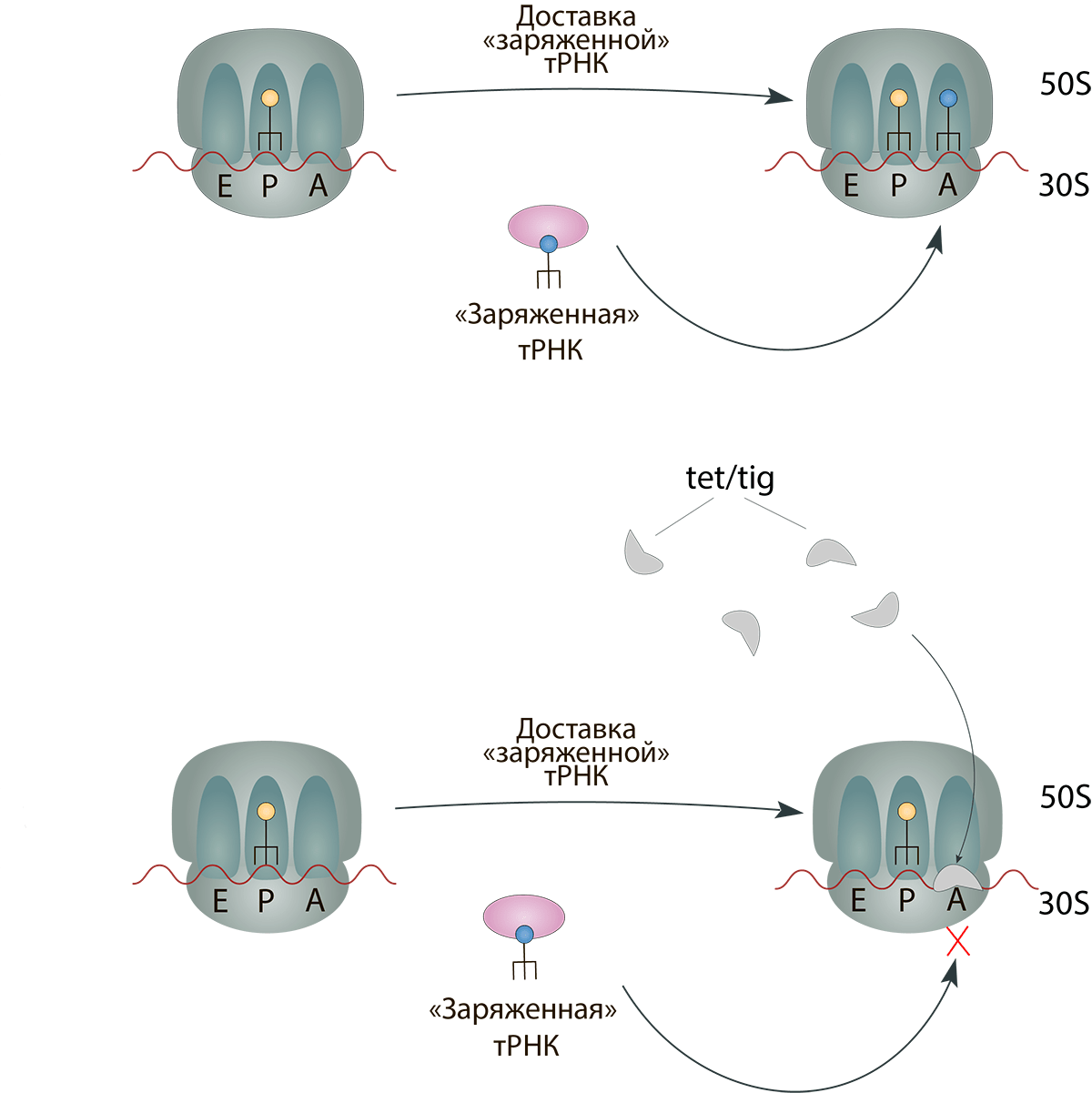
Рисунок 10. Механизм действия тетрациклинов (tet) и тигециклина (tig). Тетрациклины и тигециклин обратимо связываются с малой 30S субъединицей бактериальной рибосомы (а если точнее, то с ее 16S рРНК). Это вызывает блокирование связывания аминоацил-тРНК («заряженной» тРНК) с А-сайтом комплекса «мРНК—рибосома». В итоге такое действие тетрациклинов предотвращает добавление аминокислот к растущей цепи и, соответственно, останавливает синтез белка.
[16], иллюстрация изменена и адаптирована
Пептидилтрансфераза — мишень для многих типов антибактериальных препаратов
Макролиды обратимо связываются с 50S субъединицей рибосом. Сайт связывания находится рядом с активным центром фермента пептидилтрансферазы. Макролиды позволяют синтезироваться лишь очень коротким (6–10 аминокислот), как правило, нефункциональным, полипептидным цепям. В дальнейшем элонгация (удлинение) полипептидной цепи прекращается, поскольку блокируется туннель, через который полипептид покидает рибосому. В конечном итоге пептидил-тРНК (молекула тРНК с присоединенной к ней растущей полипетидной цепью) отделяется от рибосомы [19], [20]. Другими словами, терминация под действием макролидов происходит преждевременно.
Кетолиды, а также стрептограмины A и B (далфопристин и хинупристин соответственно) имеют схожий с макролидами механизм действия, но немного другую химическую структуру.
Линкозамиды и хлорамфеникол связываются с пептидилтрансферазным центром, расположенным в А-сайте 50S субъединицы, так, что нарушается работа пептидилтрансферазы, поскольку меняется его конформация. Стоит отметить, что при этом блокируется перенос аминокислоты из P-сайта в А-сайт, так как нарушается образование пептидной связи между аминокислотами полипептидной цепи [16].
Оксазолидиноны, совсем недавно введенные в клиническую практику, имеют уникальный сайт связывания в пептидилтрансферазном центре [21]. Он расположен на 23S рРНК 50S субъединицы, вследствие чего не развивается перекрестная устойчивость с антибиотиками других классов — линкозамидами и хлорамфениколом. Несмотря на то, что молекула препарата находится в А-сайте, она нарушает позицию инициаторной тРНК в P-сайте, вследствие чего блокируется образование пептидной связи между аминокислотами [22], [23]. Любопытно, что функционирование самой пептидилтрансферазы не затрагивается (рис. 11).
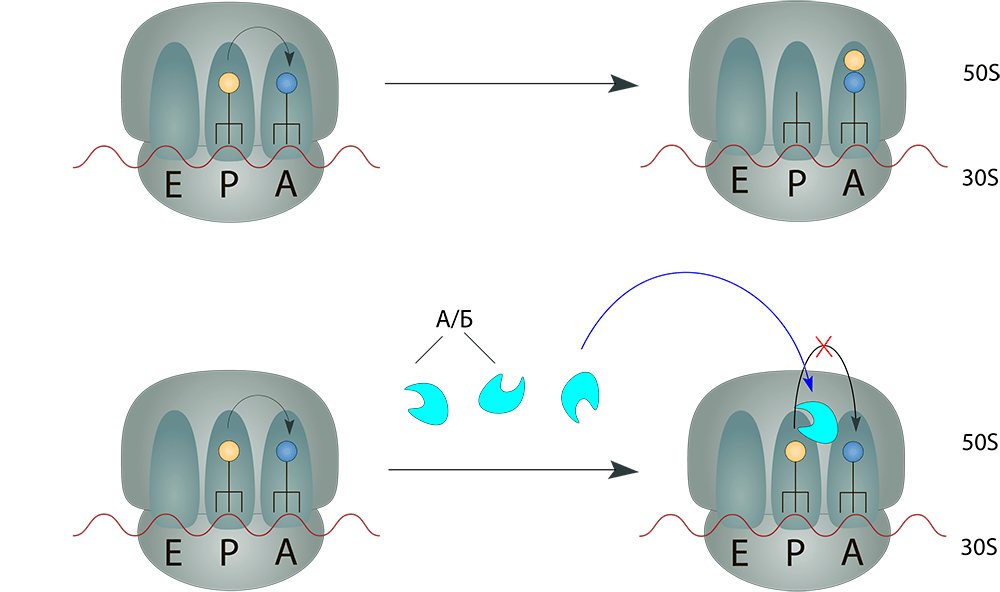
Рисунок 11. Механизм действия линкозамидов, хлорамфеникола и оксазолидинонов. Молекулы препаратов связываются с А-сайтом, так или иначе нарушая реакцию транспептидации.
[16], иллюстрация изменена и адаптирована
Аминогликозиды — класс препаратов с несколькими способами действия
Аминогликозиды обладают бактерицидным действием. Путем пассивной диффузии они проходят сквозь пориновые каналы внешней мембраны [24]. Транспорт аминогликозидов может быть усилен с помощью антибиотиков, влияющих на клеточную стенку — например, пенициллина или ванкомицина. Такое взаимодействие называется синергизмом, когда действие одного лекарственного вещества усиливает действие другого.
Внутри клетки молекулы препарата необратимо связываются со специфическими белками-рецепторами на 30S субъединице рибосом (если точнее, то с 16S рРНК и рибосомальным белком S12), изменяя при этом конформацию А-сайта [25]. Это приводит к ингибированию синтеза белка (рис. 12) [26].
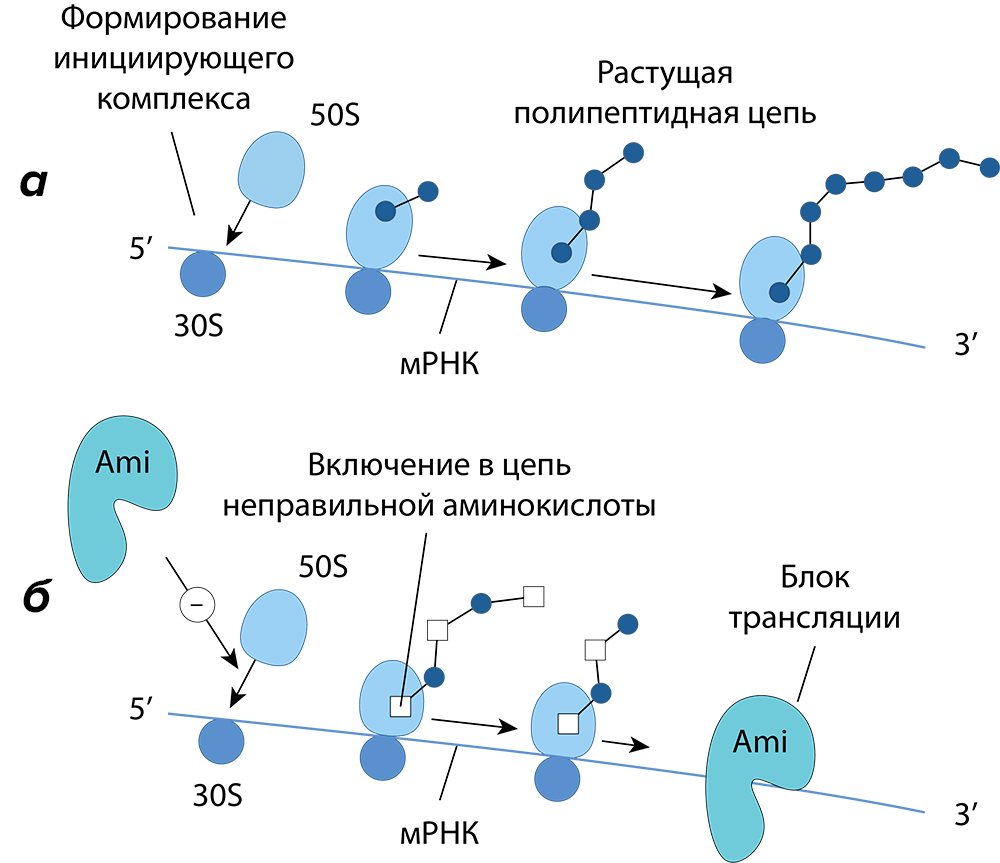
Рисунок 12. Механизмы действия аминогликозидов (Ami). а — Нормальная трансляция белка. б — Нарушенная трансляция белка подавляется как минимум тремя способами:
- Первый связан с вмешательством молекулы препарата в формирование инициирующего комплекса.
- Второй — с неправильным считыванием мРНК рибосомой. Изменение конформации А-сайта приводит к нарушению работы т.н. «декодирующего участка», распознающего антикодоны тРНК. Такое нарушение позволяет связываться с А-сайтом «не той» заряженной тРНК (подобный механизм реализован у тетрациклинов). Это влечет за собой включение в растущую полипептидную цепь неправильных аминокислот, несоответствующих мРНК. В результате синтезируются неполноценные или даже токсичные для микроорганизма белки.
- Третий (и основной) связан с подавлением транслокации на мРНК (процесса, при котором мРНК передвигается на три нуклеотида, а несущая пептид тРНК сдвигается из А-сайта в P-сайт), что вызывает распад полирибосомы на нефункционирующие составные части — моносомы.
[3], иллюстрация изменена и адаптирована
Суммировав полученные данные, можно схематично изобразить процессы трансляции, на которые влияют те или иные антибактериальные препараты (рис. 13). Конечно, нельзя утверждать со 100%-ой уверенностью, что схема точна, так как постоянно меняются представления о том или ином механизме. Например, еще недавно считалось, что сайтом связывания для оксазолидинонов являлся P-сайт 23S рРНК, а не А-сайт.
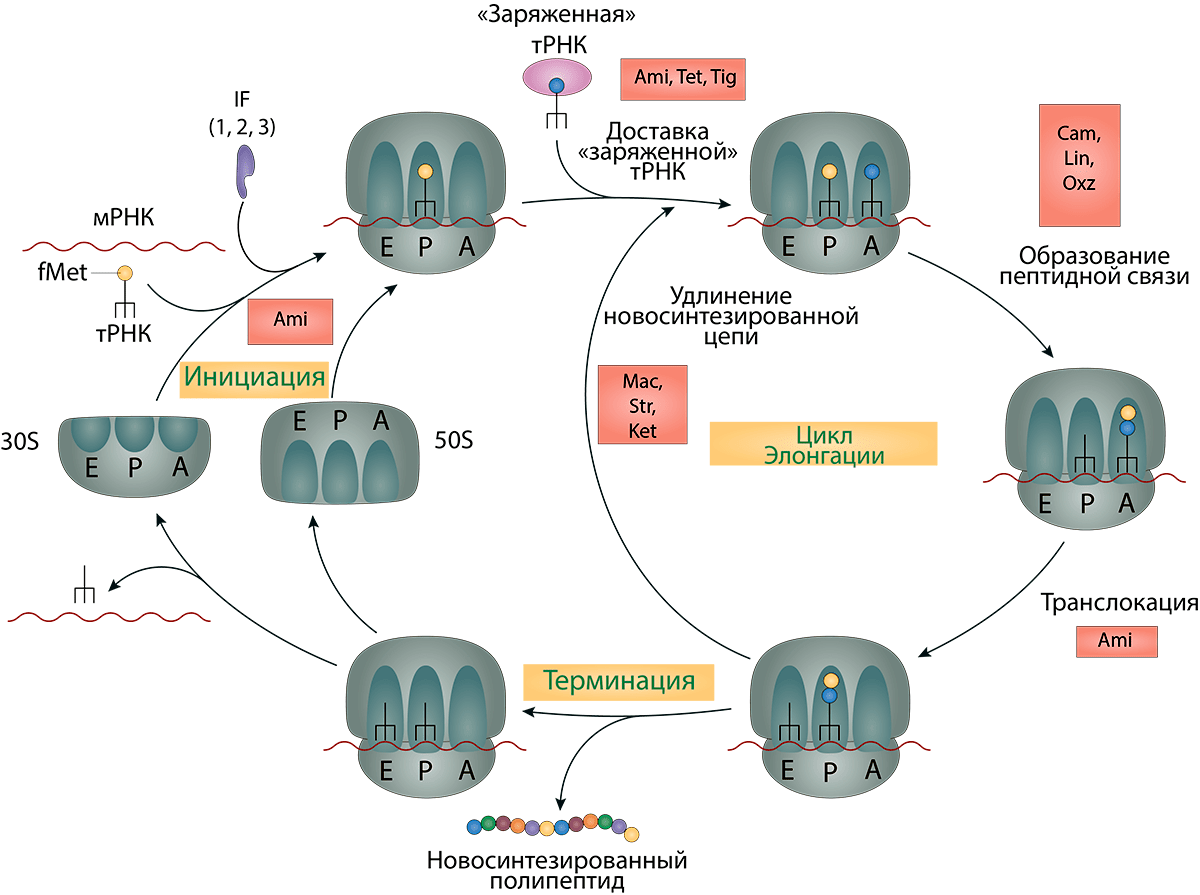
Рисунок 13. Точки приложения антибиотиков (описанных в данной статье), влияющих на синтез белка. Условные обозначения: Ami — аминогликозииды; Tet — тетрациклины; Tig — тигециклины; Cam — хлорамфеникол; Lin — линезолиды; Oxz — оксазолидиноны; Mac — макролиды; Str — стрептограмины; Ket — кетолиды.
[16], иллюстрация изменена и адаптирована
Агенты, нарушающие образование фолатов — бактериальный «авитаминоз»
Сульфаниламиды
Сульфаниламид-восприимчивые организмы, в отличие от нас — млекопитающих, — не могут усваивать экзогенную (получаемую извне — с питательными веществами) фолиевую кислоту — витамин B9, — поэтому они синтезируют ее из ПАБК (парааминобензойной кислоты, или витамина B10). Данный метаболический путь необходим для образования пуринов и, следовательно, нуклеиновых кислот. Сульфаниламиды, являющиеся структурным аналогом ПАБК, конкурентно ингибируют фермент дигидроптероатсинтазу, вследствие чего нарушается синтез фолатов, пуринов и нуклеиновых кислот, необходимых для роста и деления бактерий [27].
Триметоприм
Триметоприм селективно ингибирует бактериальный фермент дигидрофолатредуктазу, который катализирует реакцию превращения дигидрофолиевой кислоты в тетрагидрофолиевую кислоту (он же витамин B9), необходимую для образования пуринов и нуклеиновых кислот. Комбинация сульфаниламидов с триметопримом обеспечивает их синергетическое взаимодействие в результате последовательного подавления синтеза фолатов (рис. 14) [28].
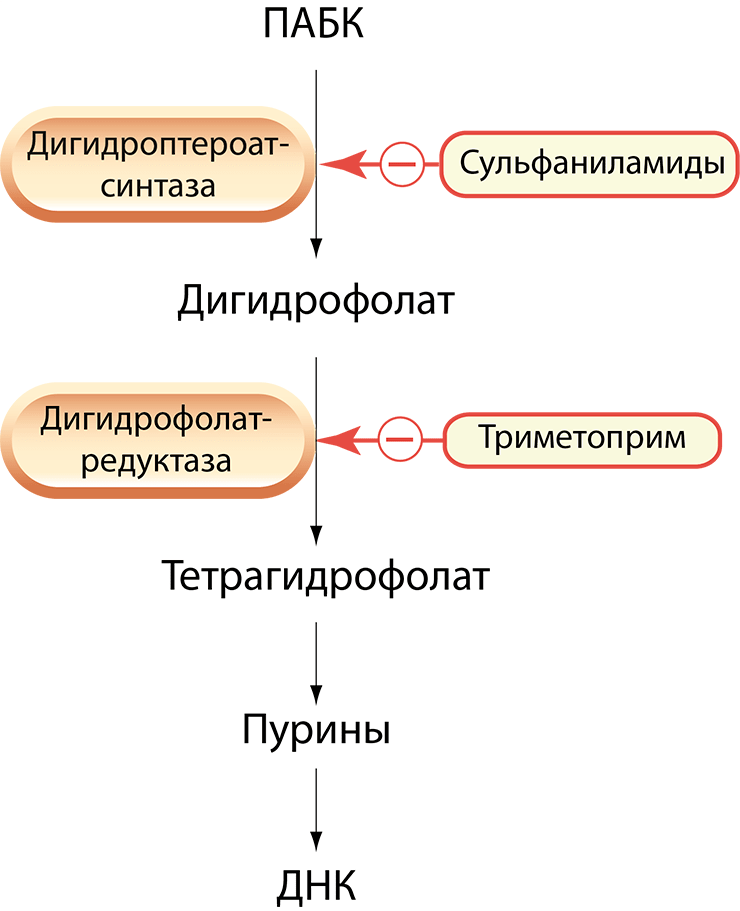
Рисунок 14. Схема бактериостатического действия сульфаниламидов и триметоприма. Метаболический путь превращения ПАБК в тетрагидрофолат (активная форма витамина B9).
[29], иллюстрация изменена и адаптирована
Агенты, нарушающие синтез нуклеиновых кислот — в самое «сердце» микроорганизмов
Группа фторхинолонов обладает бактерицидным действием. Они блокируют синтез бактериальной ДНК за счет ингибирования ферментов — бактериальной топоизомеразы II (ДНК-гиразы) и топоизомеразы IV [30]. Ингибирование ДНК-гиразы предотвращает расслабление (релаксацию) положительно суперскрученной ДНК, что необходимо для процессов транскрипции и репликации. Это, соответственно, влияет на рост, деление и жизнедеятельность бактериальной клетки. Ингибирование топоизомеразы IV нарушает расхождение материнской и реплицированной хромосомных ДНК в соответствующие дочерние клетки во время деления [31], [32].
Антибиотикорезистентность: почему, зачем и как?
Несмотря на обилие различных классов антибиотиков и такое же разнообразие их механизмов действия, быстрая эволюция позволяет бактериям в короткие сроки развивать к ним устойчивость (резистентность) [33]. К сожалению, интервал между введением антибиотика в клиническую практику и появлением первых устойчивых штаммов составляет обычно всего лишь несколько лет.
Начиная с 40-х годов XX века, эффективность и безопасность антибиотиков сильно возросли, вследствие чего заболеваемость и смертность от инфекционных заболеваний упала в разы. К несчастью, вместе с этим стали возникать микроорганизмы, устойчивые к данным препаратам (очень подробно про эту проблему вы можете прочитать в статье «Антибиотикорезистентность: How to make antibiotics great again?» [34] из спецпроекта «Биомолекулы» об АБР). Однако бактериальный резистом — пул генов, определяющих устойчивость, — в действительности появился задолго до возникновения фарминдустрии [35]. Первоначально он сформировался в процессе эволюции для противостояния бактерицидным соединениям естественного происхождения, и только потом стал стремительно меняться за счет того, что бактерии начали взаимодействовать с современными антибактериальными агентами [36]. Короткое время генерации, то есть смены поколений, многих бактерий служит огромным преимуществом для таких эволюционных адаптаций [37]. Явление резистентности налагает серьезные ограничения в выборе лечения многих бактериальных заболеваний. Бактерии становятся устойчивыми к антибиотикам в двух ситуациях:
- в случае возникновения спонтанных мутаций в хромосомной ДНК;
- в случае приобретения новых генов устойчивости при помощи горизонтального переноса генов (ГПГ).
Понимание механизмов, вовлеченных в формирование АБР, является ключевым фактором как в разумном использовании уже имеющихся препаратов, так и в разработке новых [38].
Хромосомные детерминанты устойчивости
Вероятность спонтанной мутации любого гена в популяции бактерий очень низкая: примерно 1 на 10 миллионов. Соответственно, если мутировавшая клетка выживет и будет делиться, то ее дочерняя клетка тоже будет содержать мутировавший ген. Например, устойчивость к стрептомицину (представителю аминогликозидов) может возникнуть в результате замены одной пары оснований в гене, кодирующем рибосомный белок, с которым связывается стрептомицин. Такой мутации будет достаточно для того, чтобы возникла устойчивость к данному антибиотику. Однако если антибактериальный препарат имеет несколько мишеней или несколько сайтов связывания в одной мишени, то приобрести АБР с помощью единичной случайной мутации уже не получится. Отдельно хотелось бы выделить дупликацию и амплификацию генов как способ адаптации бактерий к действию антибиотиков. Увеличение копий гена АБР может привести к усиленной экспрессии продукта, ответственного за ту или иную форму устойчивости [39].
Внехромосомные детерминанты устойчивости
Горизонтальный перенос генов (ГПГ) — способность прокариотических организмов передавать наследственную информацию не только «вертикально» (от предков к потомкам), но и активно обмениваться ею «горизонтально» (между «соседями») — путем конъюгации, трансформации и трансдукции [40] (рис. 15).
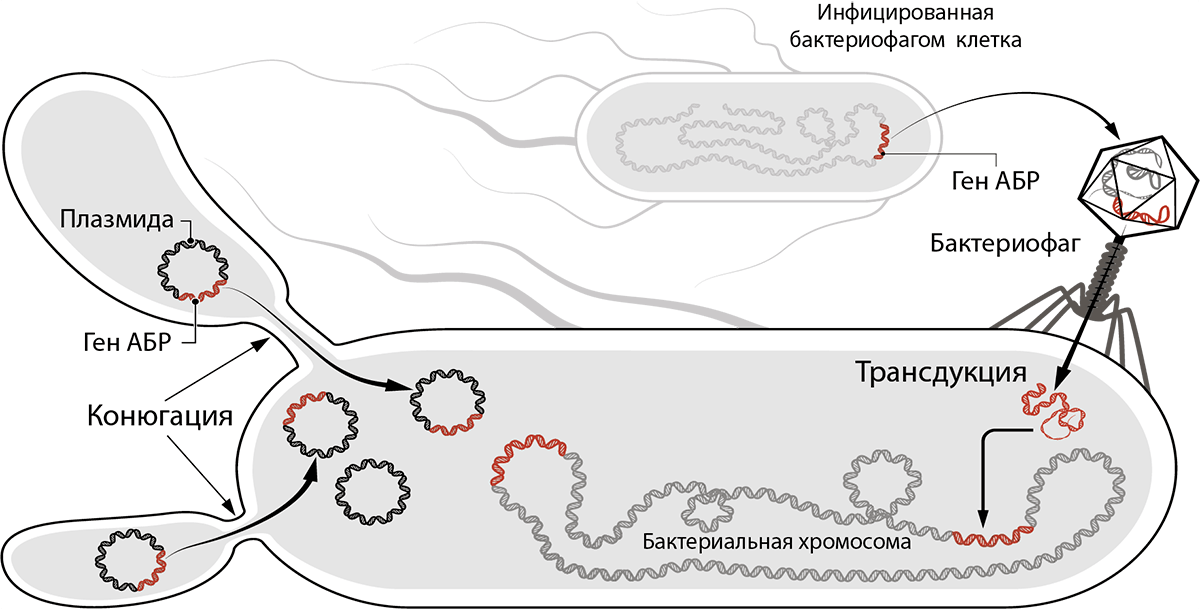
Рисунок 15. Горизонтальный перенос генов (ГПГ). Механизмы ГПГ — конъюгация и трансдукция. Трансформация на рисунке не изображена.
[41], иллюстрация адаптирована
ГПГ осуществляют мобильные генетические элементы (МГЭ) — участки ДНК, способные к случайному переносу внутри одной клетки как в пределах одной молекулы ДНК, так и между разными молекулами (например, между плазмидой и бактериальной хромосомой). К МГЭ относятся транспозоны, интегроны, геномные острова и другие [42]. Большинство мобильных элементов могут реплицироваться только в составе бактериальной хромосомы или плазмиды (которая сама тоже является МГЭ, способным передаваться в другие клетки). Примечательно, что плазмидный или вирусный ген АБР может встраиваться в бактериальную хромосому. В результате такой интеграции резистентность будет передаваться последующим поколениям микроорганизмов.
В дополнение к хромосомам многие бактерии содержат, как отмечалось уже выше, внехромосомные генетические элементы, называемые плазмидами, которые свободно существуют в их цитоплазме. Кроме того, эти генетические элементы могут независимо реплицироваться. Чаще всего плазмиды представляют собой двухцепочечные кольцевые молекулы ДНК, которые могут содержать как единственный ген, так и сотни. Плазмиды, которые несут гены резистентности к антибиотикам (r-гены), называются R-плазмидами. Многие механизмы устойчивости плазмидоопосредованы. С их помощью АБР может распространяться среди других бактерий с ужасающей скоростью.
Все мобильные генетические элементы являются важным механизмом изменчивости и обмена генетическим материалом как между организмами одного вида, так и разных видов.
Пути переноса генов резистентности между генетическими элементами среди бактерий
Конъюгация — основной и самый важный механизм горизонтальной передачи генов. Она включает в себя контакт между клетками, в течение которого происходит перенос хромосомной или внехромосомной ДНК от одной бактерии к другой. Способность к конъюгации закодирована в конъюгативных плазмидах. Эти плазмиды содержат специальные гены, ответственные за синтез наружных белковых трубочек, называемых половыми пилями, которые соединяют между собой две клетки и через которые переносятся плазмиды. Переходя из одной клетки в другую, они иногда захватывают с собой неконъюгативные плазмиды, несущие гены АБР либо копию геномной ДНК. Таким образом конъюгативные плазмиды могут передаваться от одной бактериальной клетки к другой. Стоит отметить, что многие R-плазмиды сами являются конъюгативными (рис. 16) [42].
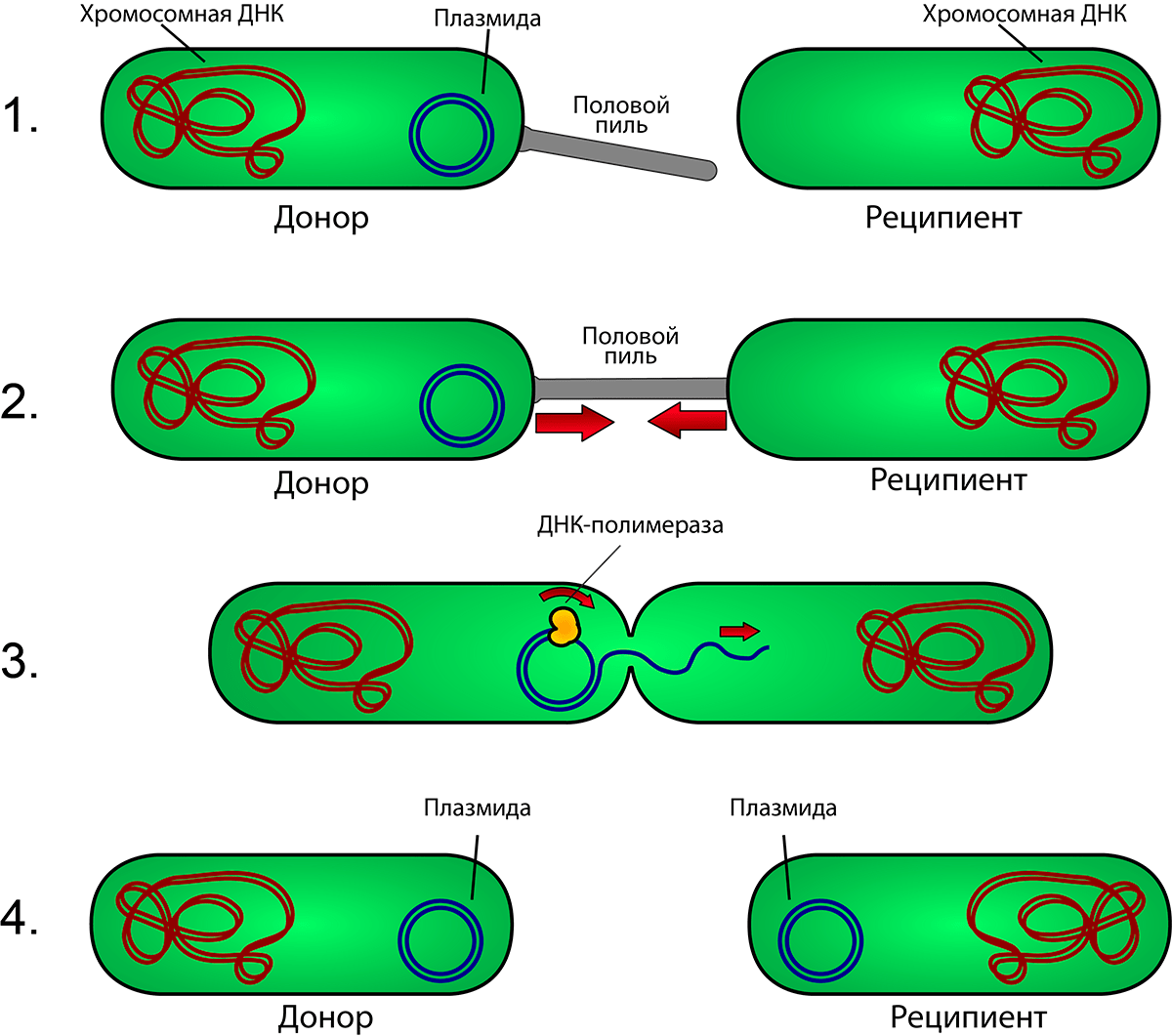
Рисунок 16. Схематическое изображение конъюгации у бактерий. 1. Клетка-донор, имеющая плазмиду, выпускает половой пиль. 2. Пиль прикрепляется к клетке-реципиенту, соединяя две клетки. 3 и 4. В плазмиде происходит однонитевой разрыв, и одна цепь ДНК переходит в клетку-реципиента. Обе клетки достраивают вторую цепь ДНК плазмиды с помощью фермента ДНК-полимеразы, восстанавливая двухцепочечную кольцевую плазмиду. В результате обе клетки становятся полноценными донорами, несущими плазмиды.
[45], иллюстрация адаптирована
Процесс, при котором плазмидная ДНК, изолированно находящаяся в бактериальном вирусе (бактериофаге) [46], передается другим бактериям одного и того же вида, называется трансдукцией. Имеет важное клиническое значение в передаче устойчивости между штаммами стафилококков и стрептококков. Существует разновидность данного процесса — латеральная трансдукция, которая с высокой частотой осуществляет передачу очень длинных фрагментов ДНК, содержащих гены АБР. Любопытно, что эта форма трансдукции описана только у бактерий вида Staphylococcus aureus [47].
Некоторые бактерии могут подвергаться трансформации путем захвата ДНК извне (из окружающей среды от, например, погибшей бактерии) и включать ее в свой геном. Однако данный механизм не является клинически важным в распространении генов устойчивости [48].
Бактериальная Real-time strategy
Так как же бактерия может защитить себя от действия антибиотиков? Для выработки устойчивости к препарату у патогена есть как минимум несколько отработанных стратегий (рис. 17) [49], [50].
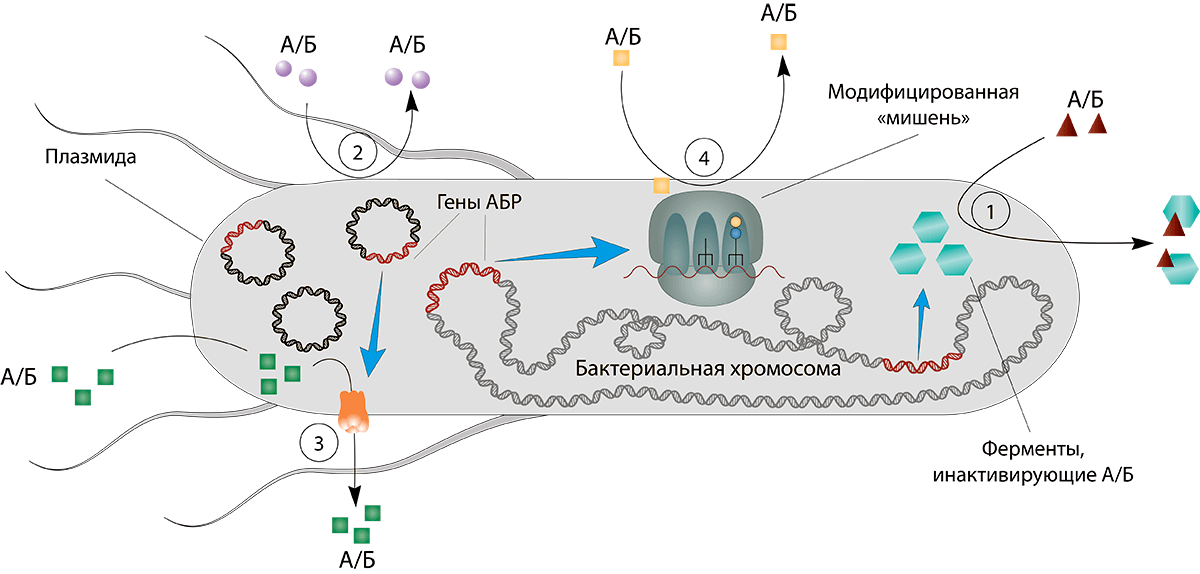
Рисунок 17. Механизмы устойчивости бактерий, которые обеспечиваются генами АБР. 1. Образование ферментов, инактивирующих антибиотик. 2. Уменьшение накопления антибиотика путем снижения проницаемости оболочки бактерии. 3. Усиленная элиминация (выведение из клетки) антибиотика — эффлюкс. 3. Модификация мишеней антибиотиков. 4. Создание «обходных» альтернативных метаболических путей (на иллюстрации не изображены).
иллюстрация автора статьи
Как только микроорганизм случайно «наткнулся» на эффективную стратегию развития устойчивости к препарату, новоприобретенные или мутированные гены, которые и придают ему эту устойчивость, неизбежно распространяются по всей популяции патогена и могут даже перейти к микроорганизмам иных видов [51]. Таким образом, все эти стратегии генетически детерминированы. Помимо этого, есть фенотипически опосредованные способы устойчивости — образование L-форм (см. врезку) и замедление метаболизма клетки бактерии, в результате чего она «впадает в спячку». Относительно недавно была описана другая, не связанная с передачей генов, форма устойчивости — биопленки: сообщество взаимодействующих друг с другом бактериальных клеток [52].
Ферментативная инактивация антибиотиков — «Кто к нам с мечом придет, от меча и погибнет»
Многие микроорганизмы образуют ферменты, химически инактивирующие молекулы антибактериальных препаратов. β-лактамазы — классический пример таких ферментов. Они гидролизуют β-лактамное кольцо в составе, как ни странно, β-лактамных антибиотиков. Представители данной группы ферментов — пенициллиназа и цефалоспориназа — нарушают структуру антибиотиков пенициллиннового и цефалоспоринового рядов соответственно, вследствие чего молекулы препаратов теряют свою активность (рис. 18). При этом перекрестная устойчивость полностью не развивается — ферменты специфичны в отношении своих субстратов. Было идентифицировано более 100 разновидностей этих ферментов. Некоторые из них, например, продуцируются бактериями Staphylococcus aureus, Haemophilus influenzae и Escherichia coli, что ограничивает применение данных антибиотиков при инфекциях, вызванных данными возбудителями. Другой вид β-лактамазы — AmpC, синтезирующийся бактериями Pseudomonas aeruginosa, — гидролизует и пенициллины, и цефалоспорины. Карбапенемы устойчивы к таким видам β-лактамаз, однако восприимчивы к металло-β-лактамазам и карбапенемазам. Например, недавно в Индии появились штаммы (несущие R-плазмиду с комплексом генов blaNDM), устойчивые к карбапенемам за счет выработки металло-β-лактамаз [54].
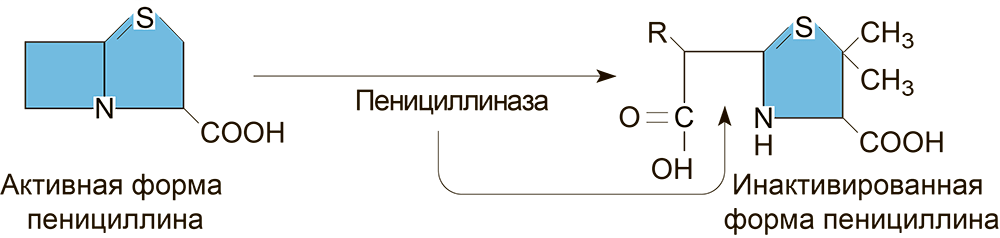
Рисунок 18. Схема действия фермента пенициллиназы, инактивирующей пенициллин. По схожему принципу работают цефалоспориназы, металло-β-лактамазы и другие β-лактамазы.
[2], иллюстрация адаптирована
Хлорамфеникол может быть модифицирован путем присоединения к нему ацетил-CoA. Такая реакция катализируется ферментом хлорамфениколацетилтрансферазой. Данный фермент продуцируют как Г+, так и Г− устойчивые микроорганизмы, а ген АБР находится на плазмиде.
Аминогликозиды инактивируются в результате реакций фосфорилирования, аденилирования или ацетилирования [55]. Необходимые ферменты (фосфаттрансферазы, аденилтрансферазы и ацетилтрансферазы соответственно) были найдены как у Г+, так и у Г− микроорганизмов. Интересно, что существует вариант аминогликозидной ацетилтрансферазы, способный модифицировать ципрофлоксацин (представителя фторхинолонов), что обеспечивает перекрестную устойчивость. Такие гены резистентности в основном расположены на плазмидах, другая часть — на транспозонах.
Эстеразы — это ферменты, гидролизующие лактонное кольцо макролидов [56].
Попробуем подвести промежуточные (и неутишельные) итоги: практически на каждый антибиотик, к сожалению, «найдется» свой фермент.
Уменьшение накопления антибиотика в клетке — враг не пройдет!
Устойчивость некоторых бактерий может быть обусловлена за счет механизма, который предотвращает вхождение антибиотика в клетку. Молекулы препарата попросту не достигают своих мишеней. Белки порины на внешней мембране грамотрицательных микроорганизмов (а у грамположительных, как мы помним, отсутствует наружная мембрана) избирательно пропускают маленькие гидрофильные молекулы внутрь клетки. Изменения в этих белках могут снижать проницаемость мембраны и предотвращать проникновение внутрь клетки некоторых антибиотиков. Помимо этого, наружная мембрана клеточной стенки некоторых Г− бактерий является естественной преградой для некоторых классов антибактериальных препаратов. Такая стратегия справедлива в отношении фторхинолонов, триметоприма, сульфаниламидов, макролидов, тетрациклинов и линкозамидов.
Эффлюкс — вежливо выпроваживаем незваных «гостей»
Некоторые бактерии имеют специальные ферменты — транслоказы, «встроенные» в плазматическую мембрану. Чаще их называют эффлюкс-помпами, и они буквально выкачивают из клетки молекулы антибактериальных агентов. Эти помпы — белки, закодированные в плазмидах или хромосомах. Такие эффлюкс-насосы удаляют молекулы за счет протон-движущей силы (рис. 19). Они обеспечивают резистентность как многим Г+ микроорганизмам (Staphylococcus, Streptococcus), так и Г− (Pseudomonas, E. coli). Данный механизм АБР очень эффективен для микроорганизмов, поскольку обеспечивает устойчивость сразу к нескольким классам антибиотиков — так называемые полирезистентные (multidrug resistance) помпы [57]. Например, многие грамотрицательные микроорганизмы устойчивы к тетрациклинам за счет того, что имеют гены tet(A–E), которые и определяют синтез эффлюкс-помпы [18]. Кроме того, насосы обладают низкой селективностью; они могут выкачивать не только различные виды антибиотиков, но и другие токсичные для клетки вещества. Такой вид защиты бактерии очень часто применяют в отношении макролидов, стрептограминов и β-лактамных антибиотиков.
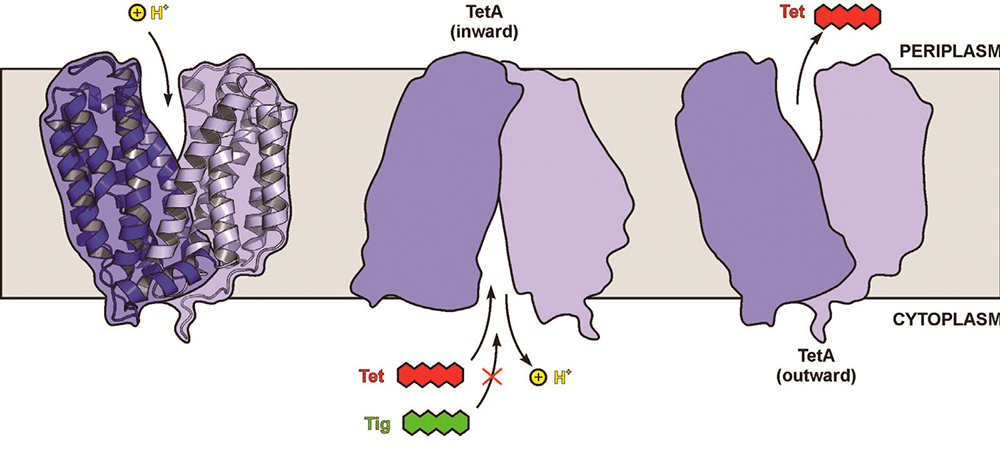
Рисунок 19. Схематическое изображение действие эффлюкс-помпы TetA. Из бактериальной клетки выкачивается молекула тетрациклина (но не тигециклина!) в обмен на протон водорода (H+) против градиента концентрации.
Модификация мишеней антибиотиков — попытки избежать саму «смерть»
Поскольку большинство антибактериальных препаратов воздействует на такие специфические мишени как белки, нуклеиновые кислоты или компоненты мембраны, микробы могут избегать их действия путем изменения структуры этих мишеней.
Устойчивость к пенициллинам у Streptococcus pneumoniae (стоит отметить, что такая устойчивость обусловлена приобретением кусков хромосомной ДНК от других бактерий рода Streptococcus посредством трансформации) и к метициллину у Staphylococcus aureus обусловлена изменениями в пенициллинсвязывающих белках. Важно, что сам метициллин в полной мере не «обезвреживается» β-лактамазами; однако, к несчастью для нас, произошла хромосомная мутация гена, кодирующего дополнительный β-лактам-связывающий белок, в результате чего появился штамм, устойчивый ко многим β-лактамам и другим препаратам, в том числе и к метициллину — метициллин-резистентный золотистый стафилококк (MRSA) (рис. 20) [58].
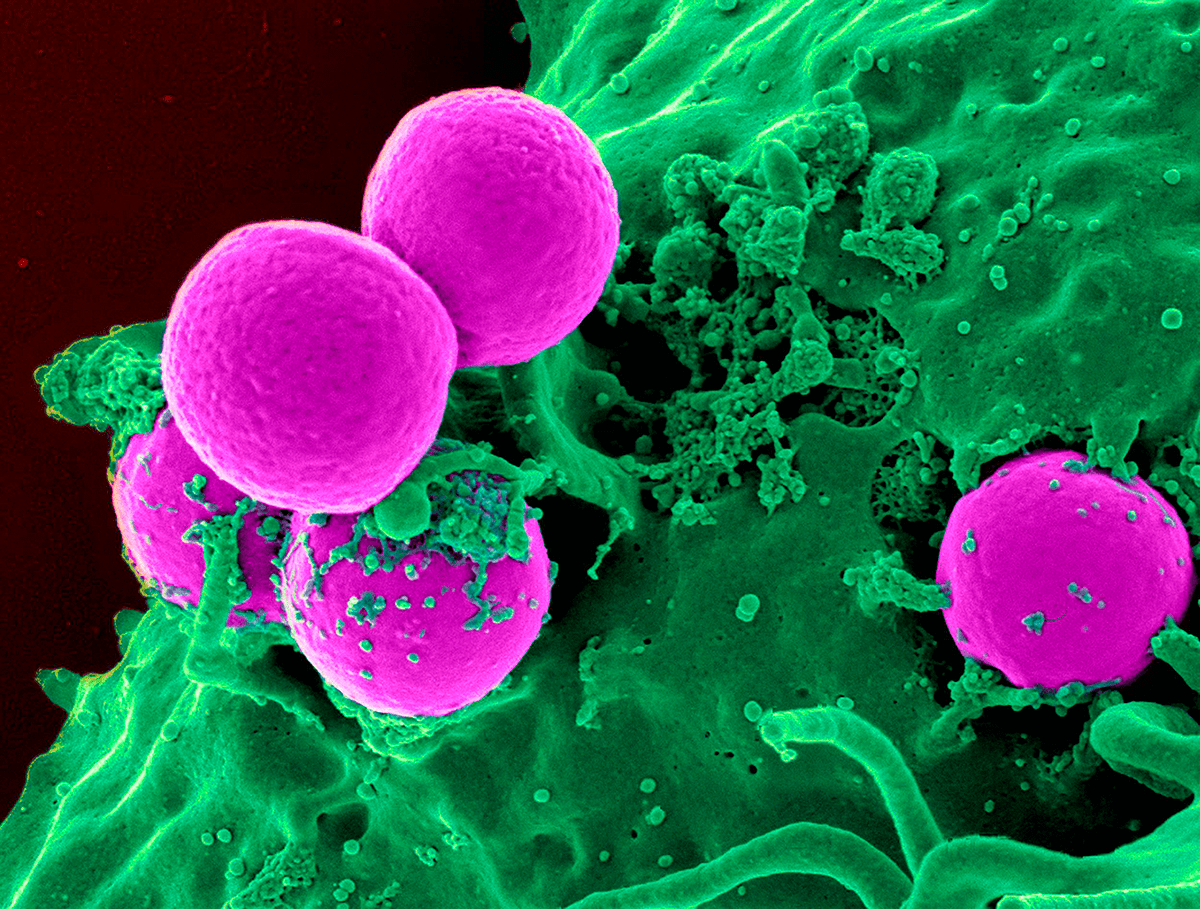
Рисунок 20. Нейтрофилы, поглощающие метициллин-резистентного золотистого стафилококка (MRSA). Электронная микрофотография.
Энтерококки приобрели устойчивость к ванкомицину через похожие изменения в белках клеточной стенки. Их пенициллин-связывающие белки имеют низкую аффинность ко многим β-лактамам. Устойчивость энтерококков к ванкомицину обусловлена их способностью модифицировать терминальную часть (D-аланил-D-аланин) «пептидного мостика» NAM так, что концевой D-аланин заменяется на D-лактат или D-серин. В результате этого теряется критически важная водородная связь, определяющая высокую аффиность ванкомицина к его мишени [59]. Данный механизм устойчивости, которым, к сожалению, «поделились» энтерококки, представлен также у ванкомицин-резистентного золотистого стафилококка (VRSA).
В 2015 году появилась еще одна тревожная новость — в Китае обнаружили E. coli, устойчивых к колистину, несущих R-плазмиду с геном mcr-1. До этого момента не было известно ни одного случая плазмид-опосредованной устойчивости к полимиксинам [60]!
Большинство Г+ микроорганизмов, имеющих ген tet(M), синтезируют специальный белок, который препятствует связыванию антибиотиков тетрациклинового ряда (но не тигециклина) с рибосомой. Модификация рибосомного сайта на 50S-субъединице, или т.н. «рибосомальная протекция», осуществляется либо за счет его мутации, либо синтеза метилаз, в результате чего возникает устойчивость к макролидам [61]. Метилазы кодируются большой группой r-генов erm. Эти ферменты присоединяют метильные группы к сайту-мишени так, что его аффинность к молекулам препарата уменьшается. Кроме того, такое изменение мишени обеспечивает перекрестную резистентность к структурно непохожим, но схожим по механизму действия соединениям, таким как клиндамицин и стрептограмин B (т.н. макролид-линкозамид-стрептограмин-, или МЛС-устойчивость типа B), которые разделяют один и тот же рибосомный сайт связывания.
Резистентность к аминогликозидам достигается путем модификации их сайта связывания — 16S рРНК с рибосомным белком S12. Специальные ферменты — 16S-рРНК-метилтрансферазы — способствуют такому изменению мишени антибиотиков [62].
Устойчивость к сульфаниламидам и триметоприму может быть обусловлена сверхпродукцией ПАБК и дигидрофолатредуктазы соответственно, либо образованием таких ферментов-мишеней, которые имеют низкое сродство к данным антибиотикам. Обычно информация о таких ферментах закодирована в плазмидной ДНК, что обеспечивает быстрое и широкое распространение устойчивости среди большого множества бактерий
Резистентность к фторхинолонам осуществляется благодаря Qnr-белкам, которые защищают ДНК-гиразу от них, либо за счет точечных мутаций сайта связывания ДНК-гиразы А [63], [64].
Альтернативные метаболические пути — умный в гору не пойдет
У некоторых бактерий попросту отсутствуют ферменты, необходимые для синтеза фолатов из ПАБК. Они, как и млекопитающие, зависимы от экзогенных источников фолатов. Исходя из вышесказанного, можно сделать вывод, что к сульфаниламидам такие микроорганизмы будут невосприимчивы.
Наше секретное оружие (*в стадии бета-тестирования)
Как вы уже поняли, АБР приобрела невероятные масштабы. Бактерии непрерывно совершенствуют стратегии самозащиты, вариативность которых растет с каждым годом. Ко многим классам препаратов (даже к тем, что совсем недавно пришли в клиническую практику) уже сформировалась устойчивость. Напрашивается вопрос — существуют ли альтернативы, к которым она не будет вырабатываться? Осторожно позволю себе сказать, что да, но давайте попробуем немного углубиться и в эту проблему [65].
Помните, когда мы обсуждали антибиотики, влияющие на начальные этапы синтеза клеточной стенки, упоминался мембранный переносчик под названием липид-II? Так вот, эта молекула является одной из самых популярных мишеней у альтернатив обычным антибиотикам. И это неудивительно: нарушим работу этого переносчика — нарушим образование клеточной стенки, столь важного компонента клетки бактерии. Напомню, что структура липида-II весьма разнородна. На его белковую часть нацелены многие антибиотики — ванкомицин и другие представители класса гликопептидов. Самый большой минус этих препаратов — их мишень: пентапептид может легко измениться в результате мутации, благодаря чему бактерия приобретает устойчивость. А, например, пирофосфат — другой компонент молекулы липида-II (небелковой природы) — весьма консервативен, поэтому микроорганизмам будет очень и очень непросто стать неуязвимыми к препаратам, влияющим на эту часть транспортной молекулы.
Одной из таких групп являются лантибиотики, ярчайший представитель которых — низин [66]. Это антибактериальное вещество открыли даже раньше «прародителя» всех антибиотиков — пенициллина! Механизм действия низина (а также близких к нему низиноподобных липопептидов) заключается в том, что он связывает пирофосфатный фрагмент липида-II и формирует поры в бактериальной мембране, что приводит к лизису и гибели клеток [9]. К сожалению, по ряду причин (плохие фармакокинетические свойства и нестабильность молекулы) низин не используется в клинической практике (по крайней мере, на данный момент), однако ему нашли другое применение — в пищевой промышленности в качестве консерванта. Но ученые просто так не сдаются, сейчас они активно изучают эти молекулы, пытаясь усовершенствовать их, чтобы использовать и в медицине. Другим представителем лантибиотиков является микробиспорицин [34]. Его место связывания соответствует таковому у низина, но его механизм направлен на остановку образования пептидогликана и накопление его предшественников в цитоплазме клетки бактерии.
Существуют и другие молекулы, нацеленные на «многострадальный» липид-II. Например, недавно открытый тейксобактин (рис. 21), на который возлагают большие надежды [34]. Многие ученые считают, что именно он призван заменить ванкомицин! Ведь кроме того, что он связывается с небелковой частью переносчика (а именно с его пирофосфатом и одним из аминосахаров), тейксобактин способен влиять и на другую молекулу — липид-III, нарушая синтез тейхоевых кислот грамположительных бактерий. Сейчас препарат находится в клинических испытаниях.
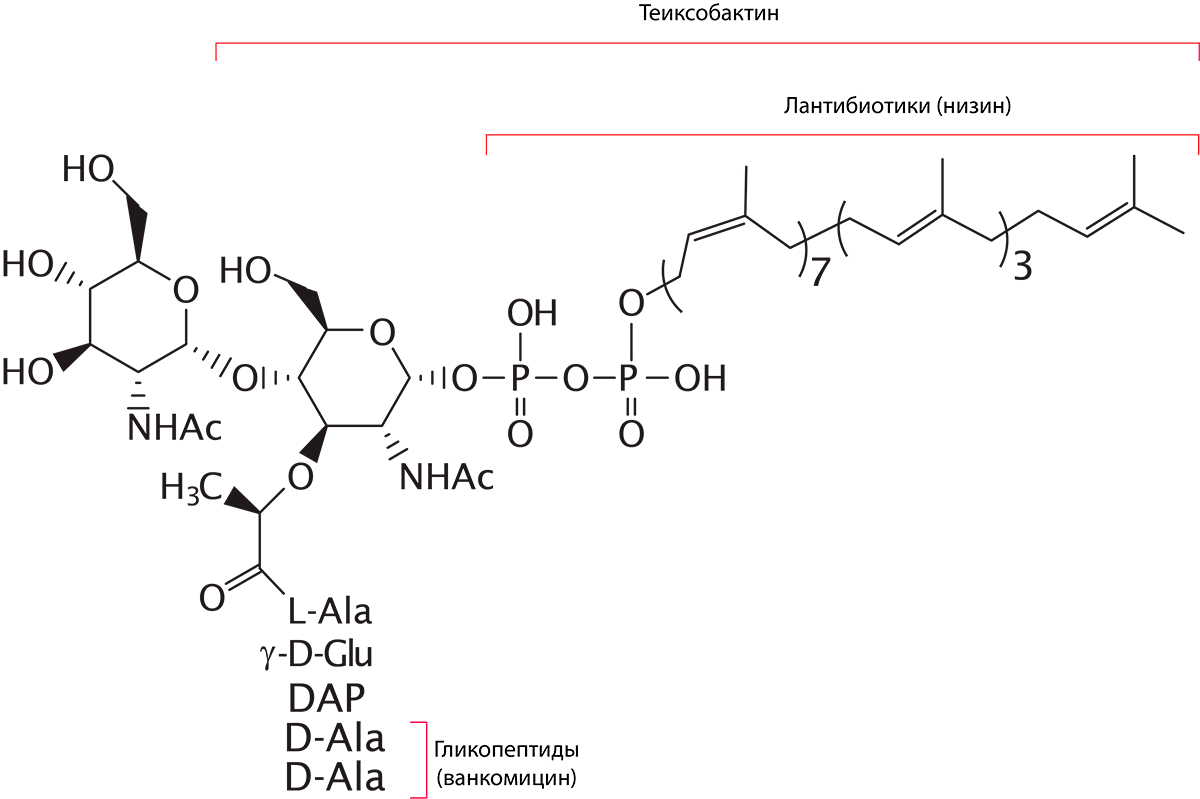
Рисунок 21. Точки приложения различных препаратов, влияющих на молекулу липида-II
Кроме липида-II, существуют и другие мишени, например, тейхоевые и липотейхоевые кислоты Г+ микроорганизмов. Конечно, они являются менее важной частью бактериального барьера, нежели пептидогликан, но если нарушить их образование, то, скорее всего, можно изрядно подпортить жизнь бактериям.
Не стоит забывать и про старые мишени — рибосомы. Например, совсем недавно, в 2017 году, обнаружили новый пептидный антибиотик при изучении Klebsiella pneumoniae — одного из возбудителей пневмонии [67]. Это соединение назвали «в честь» данной бактерии — клебсазолицин. Механизм его работы очень схож с механизмами работы макролидов (эритромицина) и стрептограминов (хинупристина): он ингибирует синтез белка, связываясь с бактериальной рибосомой в туннеле выхода пептида (рис. 22). По итогам опытов «в пробирке» клебсазолицин доказал свою эффективность, особенно в отношении Г− бактерий [68].
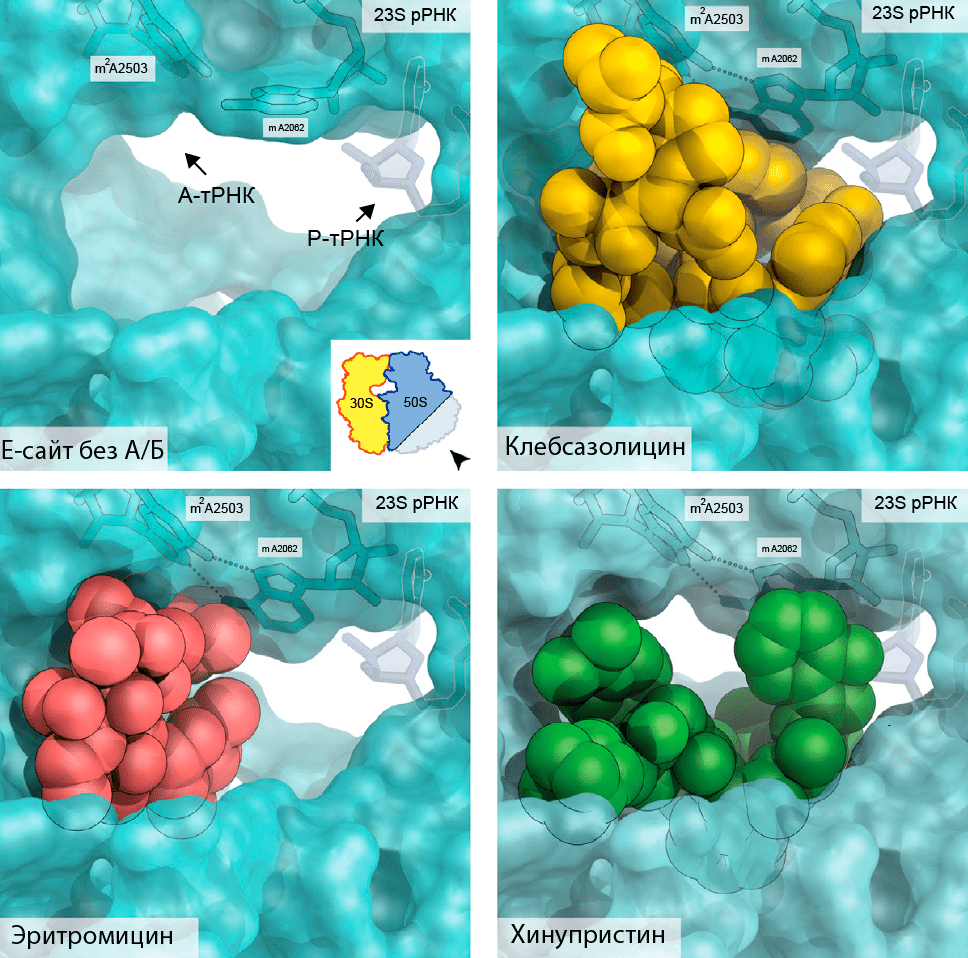
Рисунок 22. Блокирование полипептидного туннеля в рибосоме антибактериальными соединениями. Можно заметить, что клебсазолицин куда эффективнее (по сравнению с макролидами и стрептограминами) закрывает туннель, через который выходит пептидная цепь.
[68], иллюстрация адаптирована
Кстати, все вышеперечисленные препараты с антибактериальной активностью (лантибиотики, клебсазолицин, тейксобактин, ванкомицин и др.) можно объединить в одну огромную группу — антимикробные пептиды (АМП) [69]. Растения, животные, грибы и даже сами бактерии имеют абсолютно разный врожденный иммунитет, но в кое-чем сходны: все они образуют эти пептиды, губительно влияющие на бактерий. Разнообразие АМП поражает воображение.
Выделяют два основных типа воздействия антимикробных пептидов на клетки: подавление метаболических процессов (например лантибиотики) и нарушение целостности цитоплазматической мембраны. Большинство антимикробных пептидов вызывает гибель клетки по второму механизму. Многие АМП пользуются фундаментальным отличием бактериальной мембраны от эукариотической — зарядом. Благодаря своему положительному заряду эти пептиды «отыскивают» отрицательно заряженные мембраны бактерий, интегрируются в них, вызывая деформации ЦПМ (обычно в виде поры), что и приводит к гибели микроорганизма.
Некоторые из них находятся уже на стадии клинических исследований (например рамопланин). К сожалению, большинство из них пока нельзя применять системно, поэтому врачи ограничиваются местным, но довольно успешным применением.
Нельзя обойти стороной и бактериофагов. Как мы уже ранее выяснили, эти вирусы могут служить во благо бактерий, помогая им осуществлять ГПГ. Но, оказывается, ученые нашли им другое применение. Да, все верно — с помощью бактериофагов можно лечить бактериальные инфекции, в том числе вызванные АБР-микроорганизмами. Когда-то давно, чуть меньше ста лет назад, проводили множество исследований по клиническому применению бактериофагов, однако стабильных результатов получено не было. Но в связи с проблемой АБР исследователи начали возвращаться к этому способу лечения, несмотря на его недостатки. Бактериофагам посвящена целая статья на «Биомолекуле» [46].
Заключение
Сейчас хоть и проводится огромное множество исследований, ученым и врачам все сложнее и сложнее что-либо противопоставить патогенным бактериям. Устойчивость к антибиотикам с каждым разом появляется все быстрее, а микрорганизмы действуют все ухищреннее, «придумывая» новые варианты защиты, которыми делятся со своими «товарищами». Парадокс: модифицируем антибиотики — патогены приобретают новую устойчивость, и так происходит почти постоянно. Да, существуют альтернативы антибиотикам, к которым не развивается устойчивость. Скорее всего, за ними будущее, но должно пройти как минимум несколько лет, чтобы их начали использовать в клинической практике. И, конечно, у них есть и другие недостатки, которые предстоит исправить. Поэтому, кроме разработки альтернатив, следует не забывать о совершенствовании уже имеющегося «арсенала» [70].

Рисунок 23. Разработка антибиотиков — как игра в шахматы. Как только ученые делают ход, бактерии совершают ответный незамедлительно. Любителей бьют!
Теория Дарвина гласит: «выживает не самый сильный, а наиболее приспособленный». Кто же в данной ситуации окажется наиболее приспособленным — человечество или бактерии? Вопрос времени. Однако знание механизмов действия, мишеней антибиотиков и механизмов устойчивости к ним обязательно окажет нам услугу в создании новых способов борьбы против бактерий в этой беспощадной «бесконечной войне», унесшей уже множество тысяч жизней.
Литература
- Липидный фундамент жизни;
- Cowan M.K. Microbiology: a systems approach (3rd Edition). McGraw–Hill Publishing Company, 2015. — 740 p.;
- Katzung B.G., Masters S.B., Trevor A.J. Basic & clinical pharmacology. McGraw–Hill Education, 2018;
- Победитель бактерий;
- Karen Bush, Patricia A. Bradford. (2016). β-Lactams and β-Lactamase Inhibitors: An Overview. Cold Spring Harb Perspect Med. 6, a025247;
- Элементы: «Картинка дня — ванкомицин»;
- Hee-Kyoung Kang, Yoonkyung Park. (2015). Glycopeptide Antibiotics: Structure and Mechanisms of Action. J Bacteriol Virol. 45, 67;
- Daina Zeng, Dmitri Debabov, Theresa L. Hartsell, Raul J. Cano, Stacy Adams, et. al.. (2016). Approved Glycopeptide Antibacterial Drugs: Mechanism of Action and Resistance. Cold Spring Harb Perspect Med. 6, a026989;
- Элементы: «Компьютерное моделирование мембран, липид-II и покрывало Пенелопы»;
- Elisa Binda, Flavia Marinelli, Giorgia Marcone. (2014). Old and New Glycopeptide Antibiotics: Action and Resistance. Antibiotics. 3, 572-594;
- George G. Zhanel, Frank Schweizer, James A. Karlowsky. (2012). Oritavancin: Mechanism of Action. Clinical Infectious Diseases. 54, S214-S219;
- Scott D. Taylor, Michael Palmer. (2016). The action mechanism of daptomycin. Bioorganic & Medicinal Chemistry. 24, 6253-6268;
- J. A. Silverman, N. G. Perlmutter, H. M. Shapiro. (2003). Correlation of Daptomycin Bactericidal Activity and Membrane Depolarization in Staphylococcus aureus. Antimicrobial Agents and Chemotherapy. 47, 2538-2544;
- Suzana K. Straus, Robert E.W. Hancock. (2006). Mode of action of the new antibiotic for Gram-positive pathogens daptomycin: Comparison with cationic antimicrobial peptides and lipopeptides. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1758, 1215-1223;
- Nicolas Grégoire, Vincent Aranzana-Climent, Sophie Magréault, Sandrine Marchand, William Couet. (2017). Clinical Pharmacokinetics and Pharmacodynamics of Colistin. Clin Pharmacokinet. 56, 1441-1460;
- Daniel N. Wilson. (2014). Ribosome-targeting antibiotics and mechanisms of bacterial resistance. Nat Rev Microbiol. 12, 35-48;
- I. Chopra, M. Roberts. (2001). Tetracycline Antibiotics: Mode of Action, Applications, Molecular Biology, and Epidemiology of Bacterial Resistance. Microbiology and Molecular Biology Reviews. 65, 232-260;
- Fabian Nguyen, Agata L. Starosta, Stefan Arenz, Daniel Sohmen, Alexandra Dönhöfer, Daniel N. Wilson. (2014). Tetracycline antibiotics and resistance mechanisms. Biological Chemistry. 395, 559-575;
- Daniel N. Wilson. (2009). The A–Z of bacterial translation inhibitors. Critical Reviews in Biochemistry and Molecular Biology. 44, 393-433;
- Krishna Kannan, Alexander S. Mankin. (2011). Macrolide antibiotics in the ribosome exit tunnel: species-specific binding and action. Annals of the New York Academy of Sciences. 1241, 33-47;
- Karen L. Leach, Steven M. Swaney, Jerry R. Colca, William G. McDonald, James R. Blinn, et. al.. (2007). The Site of Action of Oxazolidinone Antibiotics in Living Bacteria and in Human Mitochondria. Molecular Cell. 26, 393-402;
- D. N. Wilson, F. Schluenzen, J. M. Harms, A. L. Starosta, S. R. Connell, P. Fucini. (2008). The oxazolidinone antibiotics perturb the ribosomal peptidyl-transferase center and effect tRNA positioning. Proceedings of the National Academy of Sciences. 105, 13339-13344;
- Karen L. Leach, Steven J. Brickner, Mark C. Noe, Paul F. Miller. (2011). Linezolid, the first oxazolidinone antibacterial agent. Annals of the New York Academy of Sciences. 1222, 49-54;
- Maria Ramirez, Marcelo Tolmasky. (2017). Amikacin: Uses, Resistance, and Prospects for Inhibition. Molecules. 22, 2267;
- Anton Vila-Sanjurjo, Ying Lu, Jamie L. Aragonez, Rebekah E. Starkweather, Manoj Sasikumar, Michael O'Connor. (2007). Modulation of 16S rRNA function by ribosomal protein S12. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression. 1769, 462-471;
- Bernd Becker, Matthew A. Cooper. (2013). Aminoglycoside Antibiotics in the 21st Century. ACS Chem. Biol.. 8, 105-115;
- Lorenzo Zaffiri, Jared Gardner, Luis H. Toledo-Pereyra. (2012). History of Antibiotics. From Salvarsan to Cephalosporins. Journal of Investigative Surgery. 25, 67-77;
- Jerry D. Smilack. (1999). Trimethoprim-Sulfamethoxazole. Mayo Clinic Proceedings. 74, 730-734;
- Rang H.P., Ritter J.M., Flower R.J. et al. Rang and Dale’s: Pharmacology (8th Edition). Churchill Livingstone, 2015. — 776 p.;
- James J. Champoux. (2001). DNA Topoisomerases: Structure, Function, and Mechanism. Annu. Rev. Biochem.. 70, 369-413;
- Drlica K. and Zhao X. (1997). DNA gyrase, topoisomerase IV, and the 4-quinolones. Microbiol. Mol. Biol. Rev. 61, 377–392;
- David C. Hooper, George A. Jacoby. (2016). Topoisomerase Inhibitors: Fluoroquinolone Mechanisms of Action and Resistance. Cold Spring Harb Perspect Med. 6, a025320;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Julie Ann Perry, Erin Louise Westman, Gerard D Wright. (2014). The antibiotic resistome: what's new?. Current Opinion in Microbiology. 21, 45-50;
- РНК-полимераза, горизонтальный перенос генов и связь поколений в лаборатории молекулярной генетики микроорганизмов ИМГ РАН;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Alfonso J. Alanis. (2005). Resistance to Antibiotics: Are We in the Post-Antibiotic Era?. Archives of Medical Research. 36, 697-705;
- Linus Sandegren, Dan I. Andersson. (2009). Bacterial gene amplification: implications for the evolution of antibiotic resistance. Nat Rev Microbiol. 7, 578-588;
- Alison H Holmes, Luke S P Moore, Arnfinn Sundsfjord, Martin Steinbakk, Sadie Regmi, et. al.. (2016). Understanding the mechanisms and drivers of antimicrobial resistance. The Lancet. 387, 176-187;
- R. Craig MacLean, Alvaro San Millan. (2019). The evolution of antibiotic resistance. Science. 365, 1082-1083;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- Тайны «молекулярных паразитов», или Как путешествовать по геному;
- Геном человека: полезная книга, или глянцевый журнал?;
- Геном человека: как это было и как это будет;
- Пожиратели бактерий: убийцы в роли спасителей;
- John Chen, Nuria Quiles-Puchalt, Yin Ning Chiang, Rodrigo Bacigalupe, Alfred Fillol-Salom, et. al.. (2018). Genome hypermobility by lateral transduction. Science. 362, 207-212;
- Jennifer R Huddleston. (2014). Horizontal gene transfer in the human gastrointestinal tract: potential spread of antibiotic resistance genes. IDR. 167;
- Christopher Walsh. (2000). Molecular mechanisms that confer antibacterial drug resistance. Nature. 406, 775-781;
- P. M Hawkey. (1998). The origins and molecular basis of antibiotic resistance. BMJ. 317, 657-660;
- Stuart B. Levy. (1998). The Challenge of Antibiotic Resistance. Sci Am. 278, 46-53;
- Один в поле не воин: природная антимикробная система эффективнее антибиотика;
- Katarzyna M. Mickiewicz, Yoshikazu Kawai, Lauren Drage, Margarida C. Gomes, Frances Davison, et. al.. (2019). Possible role of L-form switching in recurrent urinary tract infection. Nat Commun. 10;
- Hilary D. Marston, Dennis M. Dixon, Jane M. Knisely, Tara N. Palmore, Anthony S. Fauci. (2016). Antimicrobial Resistance. JAMA. 316, 1193;
- K. Poole. (2005). Aminoglycoside Resistance in Pseudomonas aeruginosa. Antimicrobial Agents and Chemotherapy. 49, 479-487;
- G WRIGHT. (2005). Bacterial resistance to antibiotics: Enzymatic degradation and modification. Advanced Drug Delivery Reviews. 57, 1451-1470;
- Georgina Cox, Gerard D. Wright. (2013). Intrinsic antibiotic resistance: Mechanisms, origins, challenges and solutions. International Journal of Medical Microbiology. 303, 287-292;
- P LAMBERT. (2005). Bacterial resistance to antibiotics: Modified target sites. Advanced Drug Delivery Reviews. 57, 1471-1485;
- Cesar A. Arias, Barbara E. Murray. (2012). The rise of the Enterococcus: beyond vancomycin resistance. Nat Rev Micro. 10, 266-278;
- Yi-Yun Liu, Yang Wang, Timothy R Walsh, Ling-Xian Yi, Rong Zhang, et. al.. (2016). Emergence of plasmid-mediated colistin resistance mechanism MCR-1 in animals and human beings in China: a microbiological and molecular biological study. The Lancet Infectious Diseases. 16, 161-168;
- Roland Leclercq. (2002). Mechanisms of Resistance to Macrolides and Lincosamides: Nature of the Resistance Elements and Their Clinical Implications. Clinical Infectious Diseases. 34, 482-492;
- Yohei Doi, Jun-ichi Wachino, Yoshichika Arakawa. (2016). Aminoglycoside Resistance. Infectious Disease Clinics of North America. 30, 523-537;
- Liam S. Redgrave, Sam B. Sutton, Mark A. Webber, Laura J.V. Piddock. (2014). Fluoroquinolone resistance: mechanisms, impact on bacteria, and role in evolutionary success. Trends in Microbiology. 22, 438-445;
- José Manuel Rodríguez-Martínez, Carmen Velasco, Álvaro Pascual, María Eliecer Cano, Luis Martínez-Martínez, et. al.. (2011). Plasmid-mediated quinolone resistance: an update. Journal of Infection and Chemotherapy. 17, 149-182;
- Ряскина Д. (2016). Альтернативы антибиотикам. «Медач»;
- Микробиологические войны: чем бактерии воюют друг с другом;
- Антибиотики, структура генома и CRISPR: чем занимается в Сколтехе лаборатория Северинова;
- Mikhail Metelev, Ilya A Osterman, Dmitry Ghilarov, Nelli F Khabibullina, Alexander Yakimov, et. al.. (2017). Klebsazolicin inhibits 70S ribosome by obstructing the peptide exit tunnel. Nat Chem Biol. 13, 1129-1136;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Полимеры в борьбе с антибиотикорезистентными микроорганизмами.