По следам антибиотиков: что могло пойти не так и как это исправить?
25 октября 2019
По следам антибиотиков: что могло пойти не так и как это исправить?
- 3127
- 7
- 5
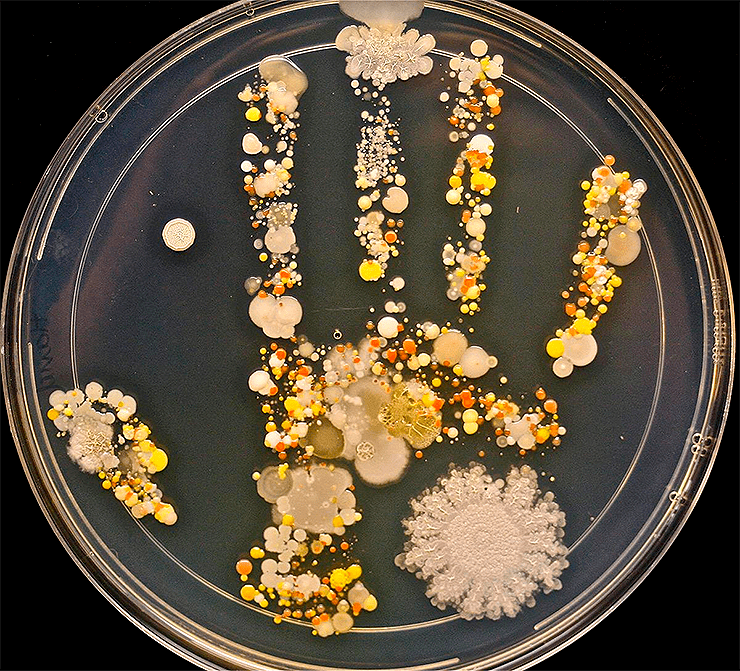
Оставленные ребенком следы на чашке Петри после игр на улице. Именно поэтому нужно мыть руки.
-
Автор
-
Редакторы
Статья на конкурс «био/мол/текст»: Иногда говорят, что раньше трава была зеленей, небо — чище, а антибиотики лучше работали. Про небо и траву — это субъективное мнение, а вот антибиотики действительно с каждым днем теряют свою эффективность. Что же происходит? Дело в том, что каждый антибиотик оставляет следы в жизни бактерий. В данной статье читатель пройдет по этим следам и встретится со сложностями, препятствующими работе антибиотиков — то есть с механизмами антибиотикорезистентности. И хоть выглядит всё довольно безнадежно, им еще можно помочь! Так что помимо проблем со всё чаще возникающей устойчивостью, здесь приводятся некоторые способы их решения.
Конкурс «био/мол/текст»-2019
 Эта работа заняла первое место в номинации «Сколтех» конкурса «био/мол/текст»-2019.
Эта работа заняла первое место в номинации «Сколтех» конкурса «био/мол/текст»-2019.

Генеральный спонсор конкурса и партнер номинации «Сколтех» — Центр наук о жизни Сколтеха.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий выступила компания BioVitrum.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
«Человечество обречено?»
Недавно мне задали этот вопрос именно в такой формулировке — без уточнений и объяснений. Я сразу подумала, что речь идет об антибиотиках — и готова поспорить, что вы подумали так же (вы ведь прочли название статьи).
Конечно же, я (как и вы) оказалась права.
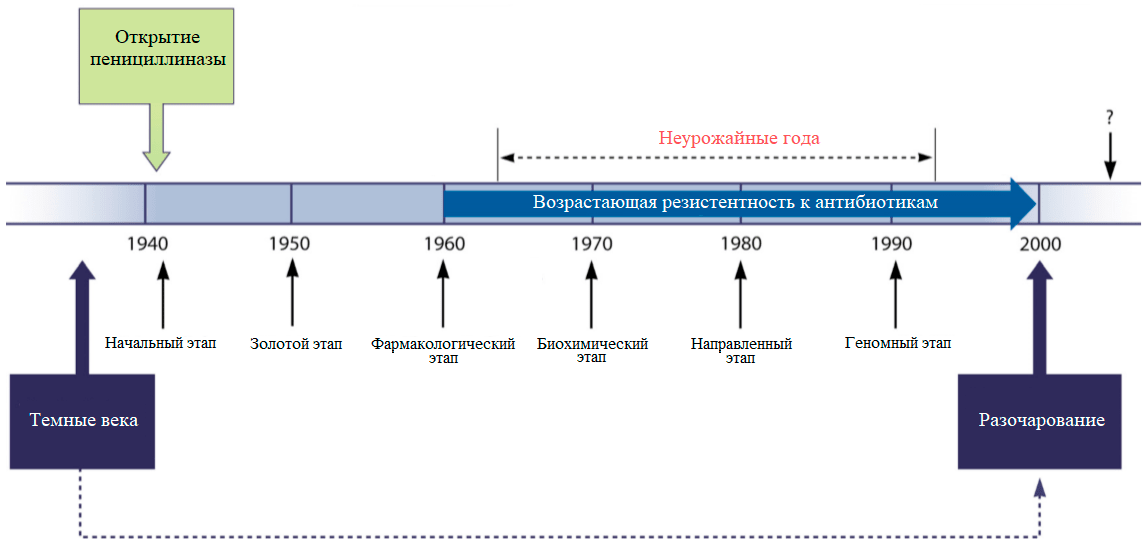
Рисунок 1. События в антибиотиковую эру. Темные века — доантибиотиковая эра; разочарование — прекращение многих поисковых программ. Начальный этап — открытие химиотерапии; золотой этап — открытие большинства используемых классов антибиотиков; фармакологический этап — попытка увеличить эффективность антибиотиков путем изменения дозы; биохимический этап — применение знаний о работе антибиотиков для их модификации; направленный этап — дизайн синтетических соединений; геномный этап — предсказание новых мишеней для антибиотиков.
[3], рисунок с изменениями
Антибиотики ворвались в жизнь человечества в середине XX века и настолько изменили ее, что время до 1940-х годов, то есть до открытия и начала массового использования пенициллина, в научно-популярной литературе часто называют Темными веками, или просто — доантибиотиковой эрой. В ту эпоху большинство людей умирало от инфекционных болезней, тогда как в наше, антибиотиковое, время основной причиной смерти стали проблемы с сердечно-сосудистой системой (инсульт, ишемическая болезнь сердца) и онкологические заболевания [1]. Более того, антибиотики используются не только для лечения всевозможных болезней, но и в сельском хозяйстве. Например, животных специально кормят антибиотиками для предотвращения заболеваний и даже для стимуляции роста их мышечной массы [2].
Но если в начале безмятежной антибиотиковой эры счастливое исцеление человечества от всех болезней, казалось, было не за горами, то сейчас нам хотя бы нужно остаться «при своих».
Почему же мечты о безоблачном будущем сменились мрачными предсказаниями? Дело в том, что ученые и врачи обнаружили одно неприятное свойство бактерий — они могут приспосабливаться к антибиотикам. Это и называется резистентностью, или устойчивостью, к антибиотикам: из-за многократного использования бактерии сумели к ним адаптироваться, и теперь антибиотики либо вообще не действуют на бактерий, либо действуют очень слабо. Антибиотики — изначально природные вещества, и даже сейчас заново синтезированных антибиотиков довольно мало. Обычно исследователи используют уже найденные природой соединения — пенициллин, например. Из-за этого некоторые бактерии оказываются устойчивы к антибиотикам еще до промышленного использования (первые бактерии с резистентностью к пенициллину были открыты еще в 1940 году, за несколько лет до начала его массового производства и использования [3]).
И сейчас, спустя почти сто лет после открытия антибиотиков, проблема устойчивых возбудителей стоит как никогда остро. Всемирная организация здравоохранения сделала крайне пессимистичный прогноз: «в отсутствие неотложных мер на нас начнет надвигаться постантибиотическая эра, когда распространенные инфекции и незначительные травмы вновь могут стать смертельными» [4]. И именно об этой грядущей катастрофе был задан мне вопрос.
Так что же произошло?
И главное — что делать?
Что же случилось?
Если коротко, то — эволюция.
И это очевидный ответ, ведь эволюция неизбежно возникнет, если мы сначала создадим новую среду, а потом поколение за поколением будем отбирать наиболее приспособленных к ней особей — например, если во время бактериальной инфекции (то есть в течение жизни сотен тысяч поколений бактерий) пациента будут лечить антибиотиками (то есть создавать для возбудителя новые условия выживания). И каким бы мощным ни был антибиотик, всегда есть вероятность, что хотя бы у одной бактерии возникнет или была до этого нужная мутация.

Рисунок 2. Наглядно о возникновении резистентности
Так что бороться против появления резистентности довольно бессмысленно. Эволюция неизбежна, и, с одной стороны, это хорошо, ведь именно из-за эволюции мы все и возникли! А с другой стороны — просто чудовищно, потому что также из-за нее возникли все эти полчища неприятных существ от комаров и гельминтов до резистентных бактерий.
А еще что случилось?
Даже если мутация возникла и бактерия приобрела необходимую ей устойчивость к антибиотику, как же эта мутация распространится?
Этот вопрос снова приводит нас к эволюции. Ведь в бактериальной популяции мутация распространится по вполне закономерным причинам: особи с ней будут иметь преимущество перед особями без нее. Но дело в том, что эта мутация может распространиться и среди бактерий других видов тоже.
Так что вторая причина — обмен генами между разными бактериями (который происходит в результате полового процесса и горизонтального переноса генов).

Рисунок 3. Обмен генами антибиотикорезистентности
Да, у бактерий тоже есть половой процесс. Но прокариотический секс сильно отличается от эукариотического: например, в отличие от эукариот, бактерии могут заниматься сексом не только с особями своего таксона. Из-за этого часто даже после ста и более отсеквенированных геномов бактерий одного вида у исследователей не получается полностью описать их геном: они постоянно открывают новые гены, присущие только конкретной разновидности [6]. Поэтому многие микробиологи используют концепцию пангенома: существование у каждого вида основных генов, присутствующих у всех особей, и дополнительных генов, которые встречаются у разных штаммов и обычно появляются из-за перемешивания генов с другими видами.
Горизонтальный перенос генов характерен не только для бактерий, но у них происходит чаще, чем у кого-либо еще. К этому процессу относят трансформацию (которая бывает только у бактерий) и трансдукцию (которая может случиться у кого угодно, но чаще всего у бактерий).
За процесс трансдукции ответственны вирусы (и мобильные элементы, но их мы опустим). Дело в том, что, когда вирус покидает клетку-хозяина, с собой он может «захватить» не только свою ДНК, но и случайно несколько генов хозяина. А потом, при встраивании своей ДНК в геном нового хозяина, туда же встраиваются эти случайно захваченные с собой гены (а ими могут оказаться гены устойчивости к антибиотику — как это было показано на примере бактериофагов и энтерококков [7]). Так совершенно разные между собой организмы — от бактерий до млекопитающих — могут обмениваться генами. Например, считается, что один из белков-антифризов у антарктических рыб возник именно в результате трансдукции [8].
Второй способ получить чужую ДНК — трансформация. Этот процесс встречается только у прокариот и заключается во встраивании в свой геном чужеродной ДНК, найденной в окружающей среде. Несмотря на то, что звучит эта идея крайне странно (явно захват генов мертвых клеток — не самая лучшая затея!), при помощи трансформации бактерии могут решать несколько своих проблем: например, так они получают материал для «строительства» своей собственной ДНК [9], «заделывают дыры» в своем геноме [10] или даже защищаются от геномных паразитов [11]. И гены устойчивости к антибиотикам так получить тоже можно: например, в человеческой толстой кишке [12]. Только представьте, сколько антибиотиков вы съедаете за свою жизнь! А все это время в вашем пищеварительном тракте копятся гены резистентности к антибиотикам [12]: ведь бактерии-симбионты, живущие в вашей толстой кишке, подвергаются тому же самому отбору, что и бактерии-патогены. В результате организм любого взрослого человека — это идеальное место для получения генов устойчивости к антибиотикам, курсы которых он принимал в течение своей жизни. И получить их можно в том числе с помощью трансформации [13]. Но чаще всего бактерии используют для этого другой процесс — конъюгацию.
В отличие от двух предыдущих способов, конъюгация может случиться: только между двумя бактериями и только если у хотя бы одной из этих бактерий есть специальные гены для конъюгации. Эти гены находятся в отдельном кусочке ДНК — плазмиде. При конъюгации клетка с плазмидой (донор) может передать ее копию клетке-реципиенту, у которой плазмиды пока нет. После этого реципиент становится полноценным донором, способным дальше передавать эти гены. В плазмидах, в отличие от основной бактериальной хромосомы, не содержатся гены, нужные для выполнения «базовых» функций роста и размножения. Обычно в них бактерии хранят гены, полезные только в определенных условиях — например, в присутствии антибиотика. И для большинства, если не для всех классов антибиотиков, существуют плазмидные гены устойчивости к ним [14]. Многие из них находятся на одной плазмиде со специальными генами, необходимыми для конъюгации — то есть для их переноса не нужна даже вспомогательная плазмида, которой может и не оказаться в клетке. По данным Абигайль Сэльерс (Abigail Salyers), бактерии, проходящие через пищеварительный тракт человека, проводят от двадцати четырех до сорока восьми часов в контакте с местными бактериями [15]. «Мы превратили свой кишечник в бактериальный аналог сайта eBay. Вместо того чтобы вырабатывать устойчивость к антибиотикам трудным способом (посредством мутаций), можно просто заглянуть туда и приобрести ген, уже созданный какой-нибудь другой бактерией», — говорит она [15]. Кстати, также в плазмидах часто находятся гены вирулентности, обеспечивающие проникновение и выживание в хозяевах. Так что не только проходящие «сквозь» нас бактерии могут найти у нас в толстой кишке необходимые гены устойчивости к антибиотикам, но и какая-нибудь наша безвредная симбиотическая бактерия внезапно может превратиться в вирулентную.
Но даже это еще не все причины наших проблем.
И это всё?
Даже если гены устойчивости так легко распространяются, откуда же берутся селективные условия (то есть вызывающие отбор по определенному признаку) для их возникновения и поддержания существования? Неужели только из-за лечения бактериальных инфекций?
Большой вклад в распространение резистентности внесло неправильное и чрезмерное использование антибиотиков в медицинской сфере. Например, сейчас в России многие антибиотики можно купить в аптеке без рецепта врача, в результате чего ими пытаются вылечить заболевания не только бактериальной природы. А ведь это совершенно неэффективно, потому что антибиотики действуют только против бактерий, поэтому лечить ими ту же простуду, вирусную инфекцию, совершенно бесполезно. Тем более, из-за этого и бактерии человеческого организма лишний раз проходят через селективные условия, необходимые для выработки устойчивости. Также несоблюдение рекомендаций врача по срокам приема антибиотиков может спровоцировать появление генов резистентности к ним: в любой популяции всегда есть организмы менее и более устойчивые, и если первые погибают рано, то вторые могут дожить почти до самых последних дней приема лекарства. Если закончить курс раньше, эти более устойчивые особи смогут распространить свои гены устойчивости — не только путем увеличения количества своих клонов, но и при помощи полового процесса или горизонтального переноса. И в следующий раз справиться с ними будет еще сложнее. Врачи также вносят свою лепту: они могут назначить антибиотики для профилактики или просто в случае сомнительного диагноза и в 30–50% случаях делают это зря [16].
Виновно и сельское хозяйство. В животноводстве антибиотики используются не только для предупреждения инфекционных заболеваний, но и для стимуляции увеличения мышечной массы. Причем иногда на подобные цели тратится больше антибиотиков, чем на лечение человеческих болезней: в Дании в 1994 году для лечения людей было использовано 24 кг ванкомицина, тогда как в животноводстве потратили 24 000 кг авопарцина (аналога ванкомицина) [17]. Даже несмотря на политику ВОЗ по снижению объемов использования антибиотиков в сельском хозяйстве, по данным на 2013 год, около 80% всех антибиотиков в США ежегодно расходуется на домашний скот — почти 14 миллионов килограммов [18]! Не обошла подобная практика и растениеводство: в этой отрасли антибиотики также используются для предотвращения бактериальных заболеваний (например, в 2009 году в США для предотвращения болезней у растений было использовано 16,5 кг антибиотиков [19]).
Конечно, в сельском хозяйстве и медицине используются разные антибиотики, но со схожим принципом действия, из-за чего резистентность, например, к авопарцину, может сработать и против ванкомицина.
Патогены обычно получают гены резистентности через кишечную палочку (Escherichia coli), которая в большинстве случаев является безвредным сожителем человека и других животных [17]. Наиболее известный случай произошел в Восточной Германии, где с 1983 по 1990 годы использовали антибиотик NTC (nourseothricin) в качестве стимулятора роста животных. В 1983 году существовало пренебрежимо мало штаммов, резистентных к этому антибиотику, а в 1985 устойчивость к нему была найдена уже и у штаммов E. coli из кишечника свиней. К 1990 году резистентность к NTC распространилась от свиней к владельцам ферм, местным жителям и пациентам, страдающим от инфекций мочеполовых путей. В 1987 году точно такая же устойчивость была замечена у патогенов, в том числе у представителей рода Schigella, встречающегося только в микрофлоре людей.
К человеку подобная резистентная кишечная палочка попадает множеством способов: из мясных и молочных продуктов, из воды и растений. Стоит только некачественно помыть руки — и она уже тут как тут! Во время прохождения через кишечник такая палочка сможет «поделиться» своими генами резистентности с человеческой симбиотической микробиотой, откуда их уже могут «позаимствовать» какие-нибудь патогены.
Подробнее о последствиях антибиотикорезистентности можно прочесть в статье «Биомолекулы» «Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее» [20].
А как это исправить?
Конечно же, изобретать и находить новые антибиотики. К сожалению, с точки зрения фармацевтических компаний это не очень рентабельный процесс: курс антибиотиков длится не более нескольких недель — в отличие от курсов лекарств от хронических заболеваний [21]. Неизбежное возникновение резистентности тоже способствует угасанию интереса к этой сфере. А так как сейчас некоторые антибиотики бережно хранят «про запас» и используют только в самых безнадежных случаях (то есть в случае множественно устойчивой инфекции) [22], [23], новые антибиотики могут не окупаться очень долго. Из-за этих сложностей в 2013 году из 18 самых крупных фармкомпаний только три вели поиск и разработку новых антибиотиков [24]. А ведь те препараты, которые находились в разработке в 2013 году, — это будущие лекарства 2020–2025 годов.
Однако поиск новых антибиотиков все равно постоянно ведется. Причем действовать здесь можно сразу в нескольких направлениях: искать новые антибиотики у других живых существ [26] или даже у нас самих [27], модифицировать старые антибиотики или проверять базу синтетических веществ на предмет антибиотической активности [21]. Также существуют и другие средства борьбы с бактериями: антимикробные пептиды [28]. На «Биомолекуле» уже есть большая статья про перспективы получения новых антимикробных средств — «Антибиотикорезистентность: How to make antibiotics great again?» [29].
Но можно зайти и с другого конца — бороться с возникающей резистентностью! Этот метод основан на блокировке механизмов устойчивости, возникших у бактерий. Называется такой подход адъювантным, а сам процесс — потенциацией, то есть просто усилением уже существующих препаратов. Поэтому потенциатор всегда нужно применять вместе с антибиотиком, иначе ничего не получится. С помощью потенциации можно «воскресить» множество старых препаратов, против которых у большинства бактерий уже есть резистентность. А это, безусловно, выгоднее — вместо одного нового антибиотика мы получаем десять! Также адъювантный подход превращает многие антибиотики, действующие только на грамположительных бактерий, в универсальные [30]. Впрочем, в большинстве случаев резистентность к таким препаратам будет вырабатываться быстрее: использовать же их будут куда чаще.
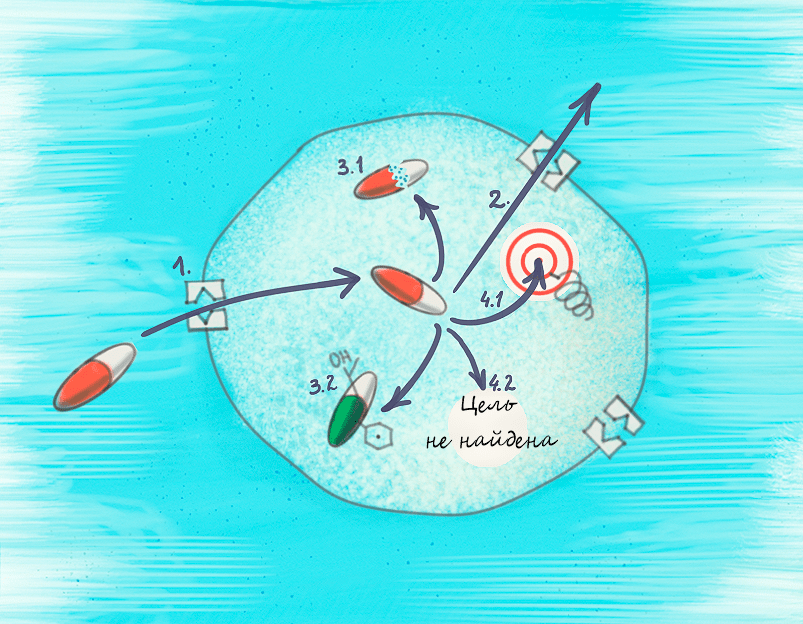
Рисунок 4. Возможные механизмы резистентности. Чтобы начать действовать, антибиотику обязательно нужно попасть внутрь клетки, и довольно распространенный способ устойчивости — не пустить его туда (1). После проникновения внутрь, ему нужно сохраниться в клетке на достаточное время для успешного нахождения мишени и связывания с ней. С этим бактерии борются тремя способами: выкачивают антибиотик наружу по мере его поступления (2), расщепляют его (3.1) или модифицируют (3.2). Даже если препарат избежал этой участи, ему может не удаться связаться с мишенью (4.1) или даже найти ее (4.2). Так что проблемы подстерегают антибиотики на каждом шагу!
рисунок Анастасии Трошиной
Как видно из рисунка 4, возможных механизмов резистентности у бактерий довольно много. И к каждому способу исследователи уже придумали или даже создали противодействующее вещество — потенциатор, который будет помогать антибиотику справляться с подстерегающими его в бактериальной клетке опасностями.
Чувствительность к присутствию антибиотика в среде
Но тут важно сразу отметить, что резистентность к антибиотикам у бактерий работает не все время: все-таки тратить энергию на выработку неиспользуемых в данный момент ферментов бактериям не очень хочется. Так что все способы резистентности «включаются» в ответ на присутствие антибиотика в окружающей среде. И, конечно, бороться с ним можно путем сбивания настроек и нарушения работы этой сигнальной системы: если бактерия не почувствует наличие антибиотика, она просто не будет активировать системы защиты от него!
У бактерий в получении и обработке сигналов задействованы двухкомпонентные системы, состоящие из мембранного белка-киназы (обычно это гистидинкиназа) и внутриклеточного белка-регулятора. Такие системы бактерии используют для получения информации об окружающей среде. Общая схема их работы представлена на рисунке 5.
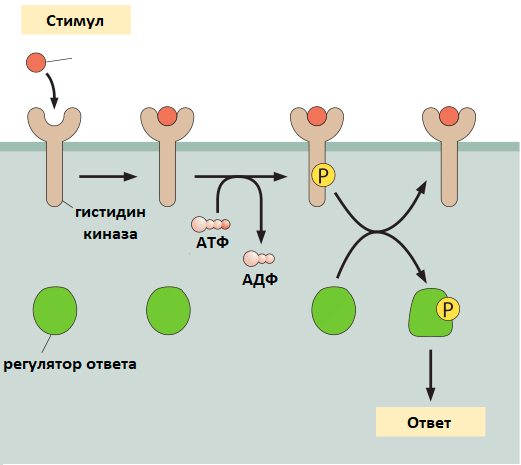
Рисунок 5. Схема работы двухкомпонентной сигнальной системы. 1 — Происходит изменение какого-либо параметра окружающей среды (изменение pH, появление соединений чувства кворума, исчезновение питательных веществ, присутствие антибиотика). 2 — Это изменение улавливается гистидинкиназой: в ответ на него она расщепляет молекулу АТФ и присоединяет фосфат к своему гистидину. 3 — После этого происходит перенос этого фосфата на домен-получатель регулятора. 4 — За счет фосфорилирования домена-получателя активируется эффекторный домен регулятора. 5 — Регулятор запускает клеточный ответ на сигнал, увеличивая или уменьшая экспрессию определенных генов. Существуют различные вариации этой схемы: например, некоторые гистидинкиназы содержат свой собственный домен-получатель, на который переносится фосфат с гистидина, а потом при участии гистидинтрансферазы и на регулятор [33].
What are the absolute numbers of signaling proteins?, рисунок адаптирован
Знания о двухкомпонентных системах можно применять и в бактерицидных целях: при их недостатке бактериальная клетка погибнет. Из-за этого, например, в результате совместного действия валрицина A и валрицина B был побежден устойчивый к метициллину стафилококк (Staphylococcus aureus) [34]. А вот потенциаторов, блокирующих передачу сигнала о присутствии в среде антибиотика, пока что не синтезировано. Но это очень перспективное направление: ведь таким образом можно «вернуть к жизни» практически любой антибиотик!
Проникновение антибиотика в клетку
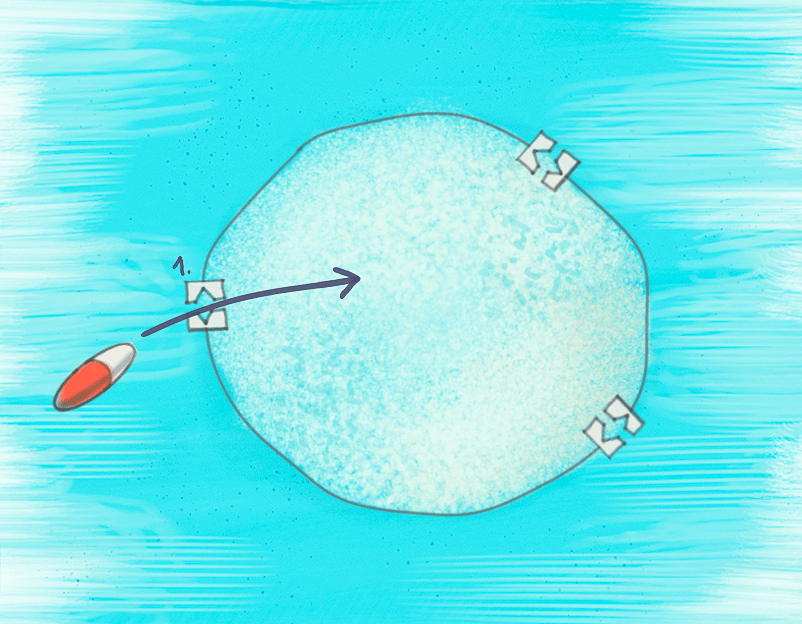
Рисунок 6. У некоторых бактерий резистентность проявляется уже на самом первом этапе работы антибиотика: они просто не дают ему проникнуть внутрь клетки. Достигается это за счет уменьшения количества пор в мембране или даже изменения строения этих пор, из-за чего препарат просто не может пройти через них. Для обхода этого типа устойчивости исследователи научились «дырявить» мембрану бактерий, в результате чего антибиотик проходит через появившиеся отверстия.
рисунок Анастасии Трошиной
Конечно же, сначала антибиотику обязательно нужно проникнуть внутрь бактерии. И уже на этом этапе у него могут возникнуть проблемы. Например, именно так возникла резистентность у кишечной палочки к цефалоспоринам — в результате структурного изменения специальных белков-поринов. Такие белки нужны клетке для пропуска небольших молекул (например, воды), и часто антибиотики проникают внутрь бактерий именно через них. Однако из-за мутации порины кишечной палочки перестали пропускать маленькие гидрофильные молекулы (такие как цефалоспорины) [35]. Впрочем, некоторые кишечные палочки воспользовались еще более простым способом: уменьшили количество поринов в своей мембране [36].
Для обхода резистентности такого вида исследователям пришлось «просверлить» мембрану бактерий. Они нашли специальные соединения, которые нарушают целостность внешней мембраны бактерий, из-за чего антибиотики могут пройти через нее даже при отсутствии поринов и других белков-переносчиков [30].
Сохранение в клетке в течение длительного времени
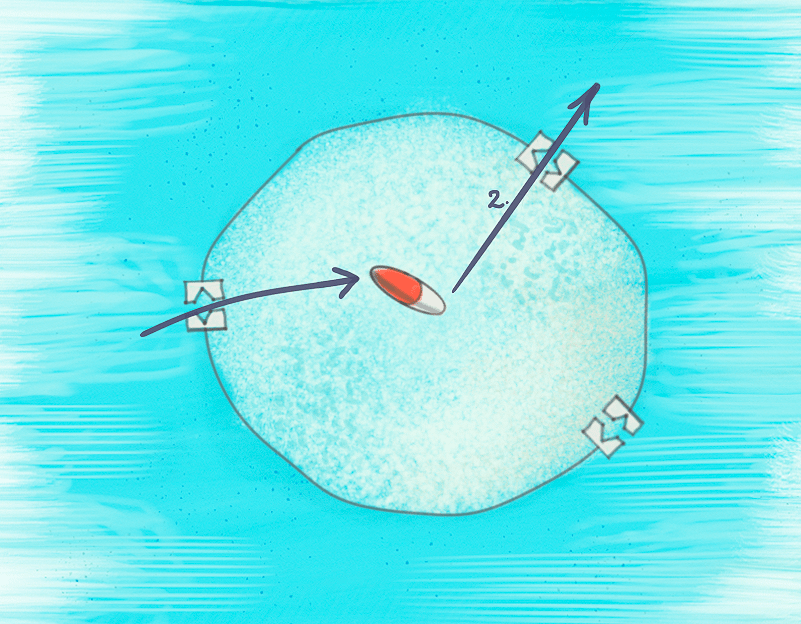
Рисунок 7. После того, как антибиотик проник внутрь клетки, ему нужно найти и связаться со своей мишенью. Но иногда он не успевает это сделать: бактерия через специальные белки-насосы выкачивает его наружу! Подобное поведение весьма распространено среди бактерий. Но исследователи и с ним научились справляться путем блокировки подобных насосов, нарушения их синтеза или добавления конкурирующих за насос соединений.
рисунок Анастасии Трошиной
После попадания в клетку антибиотику необходимо связаться со своей мишенью, для чего нужно побыть внутри подольше.
Самый популярный, неспецифичный и простой способ подобному воспрепятствовать — выкачать антибиотик наружу, пока он не успел найти свою мишень. Для этого даже ничего изобретать не нужно было: тысячелетиями до появления нас и наших антибиотиков бактерии (и не только они!) выкачивали из клетки все, что им казалось подозрительным (в том числе естественные антибиотики). Неудивительно, что и сейчас бактерии тоже пользуются этим способом. Например, именно из-за мутации в гене специальных насосов (norA1199) стафилококк приобрел устойчивость к фторхинолонам [37]. Также этот белок способен выводить и другие лекарственные препараты [38].
Соответственно, для борьбы с таким типом резистентности нужно каким-либо образом нарушить работу этих насосов.
- Можно помешать экспрессии генов, кодирующих насосы, через которые антибиотики выводятся из клетки — например, при помощи РНК-интерференции (про это явление есть подробная статья «Биомолекулы» — «Важнейшие методы молекулярной биологии и генной инженерии» [39]).
- Можно модифицировать антибиотик таким образом, чтобы бактериальная клетка его не смогла распознать. Например, было показано, что бактериальные помпы не распознают глицилциклины, на самом деле являющиеся модифицированными тетрациклинами, и поэтому не выводят их из клетки [40].
- Можно нарушать синтез подобных насосов. Даже уже было найдено соединение — глобомицин, которое препятствует их сборке [41].
- Можно мешать поступлению энергии к насосам, которые без нее работать не будут. CCCP(карбонил цианид m-хлорфенилгидразон) и цианид натрия способны повлиять на уровень энергии бактериальной мембраны, и часто используются в лабораториях для полной остановки выводящих насосов [42]. Однако эти вещества являются сильнейшим ядом и для эукариот (например, цианид калия зачастую фигурирует в детективах про отравителей). Поэтому использование CCCP или цианида натрия в качестве потенциаторов крайне маловероятно.
- Можно заблокировать насос. Обычно подобная блокировка происходит за счет того, что насос захватывает соединение, которое должен вывести, а вот освободиться от связи с ним уже не может. Впрочем, пока что таких соединений найдено не было.
- Можно использовать соединения, конкурирующие с антибиотиками за насосы [43]. В таком случае антибиотик все равно будет выводиться из клетки, но в меньших количествах — за счет того, что другое соединение будет «занимать место» антибиотика.
Все эти идеи хороши, но в них таится одно досадное упущение: вышеперечисленные соединения тоже будут выводиться из клетки при помощи насосов. Так что на самом деле это бег наперегонки: что произойдёт быстрее — антибиотик каким-либо образом успеет ингибировать работу насосов или эти насосы выведут его из клетки. Пожалуй, только последний способ из перечисленных практически лишен этого изъяна. Впрочем, ничего не мешает нам использовать несколько соединений одновременно. Осталось только их изобрести!
Изменение антибиотика
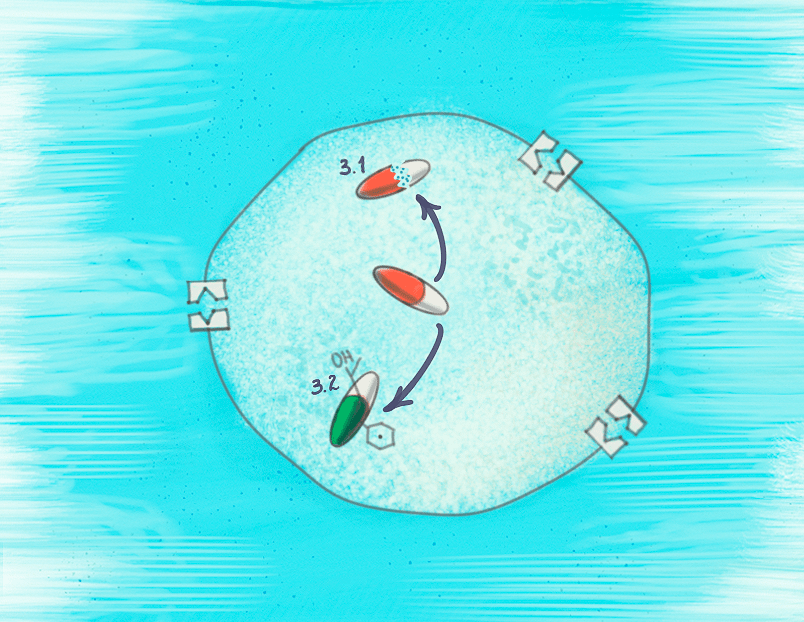
Рисунок 8. Избавиться от антибиотика можно не только путем выброса его из клетки. Многие бактерии поступают по-другому: они добавляют или убирают у него определенные химические группы, из-за чего препарат становится неактивным и бесполезным. Занимаются подобными вещами специальные ферменты, и, к счастью, исследователи уже нашли для них ингибиторы. Потенциация антибиотиков за счет них довольно распространена уже сейчас — например, препарат «Аугментин» существует на рынке больше 30 лет.
рисунок Анастасии Трошиной
Другой путь появления резистентности — поменять антибиотик каким-либо образом до того, как он успеет найти свою мишень.
Например, некоторые бактерии режут в антибиотике связи, в результате чего он не может связаться со своей мишенью. Самый известный пример подобной реакции — бета-лактамазная. Специальный фермент бета-лактамаза разрезает у бета-лактамных антибиотиков (например, пенициллина) их бета-лактамное кольцо. Кстати, эту устойчивость открыли еще до массового использования пенициллина. Другой пример подобного фермента — эстераза, которая режет эфирные связи в макролидах. Судя по всему, ее ген находится в мобильном генетическом элементе [44], [45], так что распространение этого фермента не за горами.
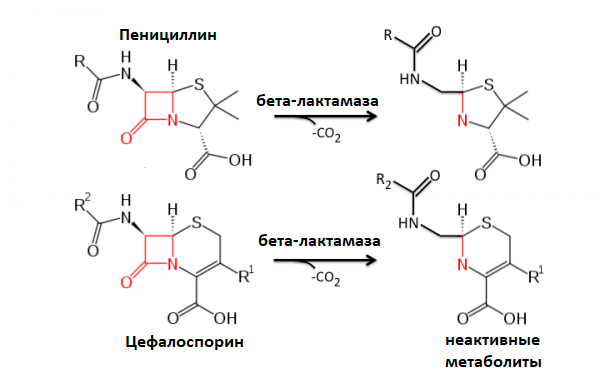
Рисунок 9. Схема работы бета-лактамаз
коллаж автора статьи
Любопытно, что часто такие ферменты выбрасываются из клетки, чтобы успеть расщепить антибиотик еще до того, как он попадет внутрь [47]. Из-за этого бактерии с ними крайне устойчивы к антибиотикам, которые расщепляются еще до попадания в клетку и не могут ничего ей сделать.
Другие же бактерии решают проблему антибиотиков прямо противоположным путем — присоединяют что-нибудь к ним так, чтобы они перестали работать. Таким образом бактерии поступают чаще, чем что-то режут, и используют они самые разные группы: ацильные, фосфатные, нуклеотидные, рибозные, тиольные... Для этого у бактерий существуют специальные ферменты трансферазы, и уж их так много, что и не перечислишь. Для работы этих ферментов требуются различные помощники (например АТФ), поэтому работать трансферазы могут только внутри клетки.
Довольно долго исследователи пытались победить в этой гонке путем создания соединений, которые бета-лактамазы, эстеразы или эпоксидазы не могут разрезать, а всевозможные трансферазы — модифицировать (но, конечно, в итоге они все равно все резали и модифицировали). Теперь же начался новый виток этой борьбы: открыли ингибиторы бета-лактамаз, поэтому сейчас фармацевтические компании создают и ищут соединения, которые способны ингибировать работу подобных ферментов. Для бета-лактамаз, например, уже найдено семь таких ингибиторов [48]. А препарат «Аугментин», состоящий из клавулановой кислоты и амоксициллина, используется уже так долго — больше тридцати лет! — что и к нему успела появиться резистентность [49]. Недавно вышли на рынок другие препараты: например, в 2015 ВОЗ одобрила Avycaz, состоящий из антибиотика цефтадизима и ингибитора бета-лактамазы авибактама [48].
Помимо ингибирования работы всех этих -аз, также можно, как и во всех предыдущих случаях, прервать передачу сигнала о присутствии в среде антибиотика. Тогда бета-лактамазы и прочие вредные ферменты просто не будут синтезироваться, а, значит, и не будут мешать антибиотикам делать их работу. Такие исследования уже ведутся, и, например, было показано, что чувствительность к бета-лактамным антибиотикам восстанавливается в присутствии специальных искусственно синтезированных ингибиторов протеинкиназ [50], [51].
Изменение мишени

Рисунок 10. Иногда, даже если антибиотик проник в клетку и сумел продержаться в ней достаточное время, его все равно ждет неудача: он не может найти свою мишень. Дело в том, что бактерии могут модифицировать ее, чтобы препарат не узнал и не связался с ней, а также они даже «включают» специальные обходные метаболические пути, в которые мишень не входит.
рисунок Анастасии Трошиной
Если антибиотик все-таки проник в клетку и избежал описанных выше опасностей, дальше он должен найти свою мишень. Но и с этим у него могут возникнуть сложности.
Например, мишени может просто не быть: бактерия изобрела обходной метаболический путь, в котором мишень не участвует. Конечно, такие случаи довольно редки, ведь одной спонтанной мутацией тут не обойдешься. Однако если уж это произошло, справиться с подобной резистентностью с помощью потенциаторов сложнее.
Довольно интересный пример такого случая — возникновение резистентности к ванкомицину у грамположительных бактерий [52]. Этот антибиотик ингибирует синтез клеточной стенки за счет образования водородных связей с ацил-D-аланил-D-аланином на конце растущего пептидогликана. Из-за того, что его мишень — не белок, к ванкомицину довольно долго не вырабатывалась устойчивость — целых 30 лет. Мало какой антибиотик может похвастаться такой длинной жизнью! Даже сейчас ванкомицин все еще считается антибиотиком «последней надежды» и применяется лишь в том случае, если другие препараты не помогли.
Но бактерии, конечно же, все-таки смогли развить к нему резистентность. Она появилась из-за возникновения аж пяти новых генов. Два из них отвечают за сигнальную двухкомпонентную систему, которая улавливает присутствие ванкомицина в среде и индуцирует экспрессию остальных трех генов. То есть, опять же, этот обходной путь работает в клетке не все время, а только в присутствии антибиотика. Оставшиеся три гена ответственны за то, что вместо ацил-D-аланил-D-аланина в клеточной стенке синтезируется ацил-D-аланил-D-лактат. Замена амидной связи (аланил—аланин) на эфирную (аланил—лактат) оказалась критическим фактором для работы ванкомицина: с аланином он связаться способен, а вот с лактатом — уже нет...
Пока что никаких потенциаторов для ванкомицина синтезировано не было. Конечно, идеи есть: например, таким потенциатором может быть ингибитор работы чувствительной двухкомпонентной системы, закодированной в двух новых генах. Однако к нему резистентность выработается довольно быстро — все-таки в ее составе только белки! — так что золотые годы ванкомицина все равно не вернуть.
Если мишень антибиотика очень важна, и изобрести обходной путь без нее не получается, тогда некоторые бактерии специальным образом модифицируют ее. После этого антибиотик не может с ней связаться — и, соответственно, не сработает.
Именно так, например, иногда проявляется резистентность к фторхинолонам. Эти антибиотики связываются с расплетающими нити ДНК ферментами (топоизомеразами) и таким образом препятствуют репликации ДНК в клетке. Однако одна-единственная мутация в гене фермента приводит к резистентности: в результате замены одной аминокислоты на другую (серина на лейцин, триптофан или изолейцин) фторхинолонам связаться с ферментом гораздо сложнее [52]. И чем больше подобных замен произошло, тем устойчивей клетка к этим антибиотикам.
Потенциатор в подобном случае придумать весьма непросто. В разделе про сигнальные двухкомпонентные системы я говорю, что нарушение их работы может помочь преодолеть резистентность почти всегда. Так вот, именно этот тип резистентности — причина появления «почти». Ведь модифицированные топоизомеразы вырабатываются в клетке все время, вне зависимости от присутствия антибиотика. Но тут может помочь другой способ, который я уже упоминала (и уж он-то работает действительно всегда): регуляция экспрессии генов топоизомераз при помощи РНК-интерференции. Впрочем, тогда это будет уже не потенциация, а настоящий бактерицид.
В этой истории хорошо одно: гены топоизомераз находятся в хромосоме бактерий, а не в плазмидах. Так что распространиться эта мутация сможет либо из-за банального деления клеток, либо с помощью реже встречающихся трансдукции и трансформации. А вот конъюгация ей уже не поможет, и это очень здорово.
Также бактерии могут изменять мишень уже после ее синтеза — при помощи специальных ферментов. Например, в этом заключается устойчивость стафилококков к макролидам, линкозамидам и стрептограминам. Эти антибиотики (весьма разные по структуре!) обладают похожим действием: они прикрепляются к рибосоме и закрывают выход пептидов из ее большой субъединицы, из-за чего нарушается синтез белка в клетке. А стафилококки изобрели фермент, метилтрансферазу, которая присоединяет к большой субъединице рибосомы метильную группу, из-за чего все перечисленные выше антибиотики связаться с рибосомой не могут [52].
К сожалению, тут тоже придумать потенциатор весьма трудно. Разве что какой-нибудь ингибитор метилтрансфераз. Или — опять же — ингибиторы работы сигнальной двухкомпонентной системы. Пока что, впрочем, это только идеи, и никаких соединений с подобными свойствами найдено не было.
Но, к счастью для нас, существует такая вещь как эволюционный trade-off.
Эволюционные компромиссы (trade off)
Хороший пример эволюционного компромисса — длина хвоста у павлина. Чем длиннее хвост, тем больше самок он привлекает, но и летать с длинным хвостом сложнее. Поэтому длина хвоста у каждого конкретного павлина — это компромисс между его представлениями о вероятности размножиться и вероятности быть съеденным. С подобного рода решениями мы сталкиваемся каждый день: лечь попозже и дописать статью для «Биомолекулы» или выспаться? Позавтракать вкусно или позавтракать полезно? Погладить крысу на улице и, вероятно, подцепить бешенство или пройти мимо, но остаться без острых ощущений?
На самом деле бактерии тоже проводят всю свою жизнь за решениями подобных компромиссов. И к резистентности это тоже относится. Дело в том, что при приобретении устойчивости к антибиотику A может произойти два разных события: бактерия приобретет устойчивость к B (например, если это антибиотики одного класса) или, наоборот, бактерия приобретет чувствительность к B (такая чувствительность называется коллатеральной). Соответственно, во втором случае мы видим возможность появления компромисса: при одновременном использовании A и B выживут только те бактерии, которые найдут баланс в борьбе против этих двух антибиотиков.
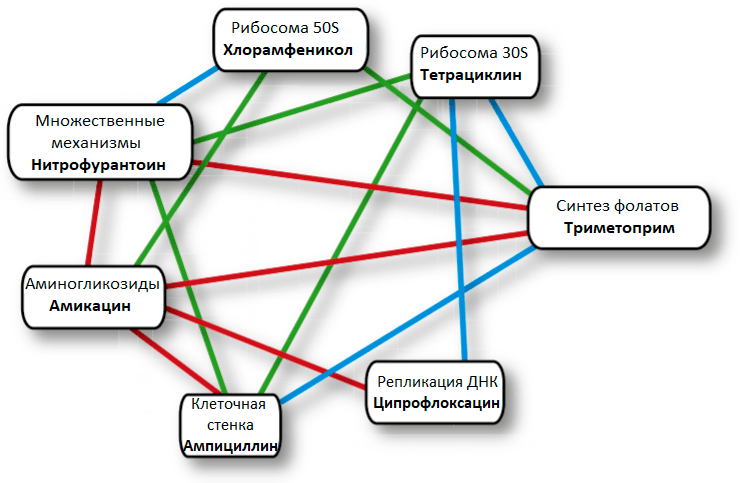
Рисунок 11. Пример антибиотической сети взаимодействий для E. coli. Синими линиями обозначено супрессивное взаимодействие (один антибиотик подавляет действие другого), зелеными линиями обозначено антагонистическое взаимодействие (антибиотики не действуют в паре), красными линиями обозначено синергическое взаимодействие (один антибиотик делает другой более эффективным).
Хороший пример второго случая — повышение чувствительности бактерий к аминогликозидам при получении устойчивости к ампициллину. Дело в том, что аминогликозиды обычно транспортируются в клетку специальными насосами, использующими заряд на мембране. И, соответственно, резистентность обычно проявляется в уменьшении этого заряда. Однако устойчивость ко многим другим антибиотикам заключается в выводе их через специальные насосы из клетки, и для работы этих насосов тоже нужен этот заряд! Классический компромисс: чем меньше заряд, тем меньше молекул аминогликозидов проникает в клетку, но одновременно с этим меньше молекул других антибиотиков выводится из клетки [53].
Из этого можно сделать вывод, что не всегда нужно изобретать велосипед и искать новые потенциаторы: достаточно смешать два старых антибиотика и посмотреть, что получится. Необязательно даже, чтобы оба вещества были антибиотиками! Например, тиклопидин (препарат для разжижения крови) и цефуроксим (антибиотик) вместе смогли одолеть золотистого стафилококка [56].
Также у этого подхода есть еще одно преимущество: из-за наличия эволюционного компромисса эволюция замедляется, и на выработку резистентности к двум антибиотикам в случае коллатеральной чувствительности требуется больше времени. А в нашем случае время — против нас, ведь для бактерий в эволюционном смысле оно течет быстрее.
А что можем сделать мы?
Это все здорово, но как обычному человеку внести свой вклад в борьбу против резистентности?
Во-первых, нужно почаще мыть руки. И это не шутка [4]! Впрочем, лучше не перестараться: например, не надо использовать антибактериальное мыло. Хотя оно и, возможно, убивает всех болезнетворных бактерий на вашей коже, но полезные бактерии ведь страдают от него тоже! А они выполняют очень важную функцию — защищают нас от всевозможных грибков. В микромире конкуренция очень высока, поэтому чистые руки никогда не останутся таковыми надолго: всегда там кто-нибудь успеет поселиться. Но лучше пусть это будут безвредные бактерии с легкой примесью патогенов, чем опасные грибки. Да и про выработку устойчивости не стоит забывать.
Во-вторых, нужно внимательно подходить к лечению себя и своих близких. Например, ВОЗ рекомендует принимать антибиотики только по назначению лечащего врача и всегда соблюдать рекомендации при их использовании. Медработникам же советуют назначать и отпускать антибиотики только при необходимости, а также беседовать с пациентами об опасности их неправильного использования.
В-третьих, важно помнить, что борьба против бактерий — это бесконечная гонка. Победить мы в ней не сможем, а вот проиграть — легко. Как говорила Черная королева (а эволюционисты подхватили): «Ну, а здесь, знаешь ли, приходится бежать со всех ног, чтобы только остаться на том же месте, а чтобы попасть в другое место, нужно бежать вдвое быстрее». Чтобы поддерживать наши успехи в медицине, необходимо заниматься изобретением новых антибиотиков, потенциаторов к ним, антимикробных пептидов (кстати, к ним тоже есть потенциаторы [57]!) и других бактерицидных средств каждый день. Здесь не получится изобрести что-то один раз и выдохнуть: рано или поздно бактерии эволюционируют, поэтому человечеству лучше припасти в рукаве хотя бы десять антибиотиков «последней надежды». (И еще десять — на совсем уж черный день. И еще десять — на всякий случай. Короче, вы меня поняли.)
А в-четвертых — не паниковать! Обещаю, что однажды все будет хорошо: будет ласковый дождь.
Литература
- 10 ведущих причин смерти в мире. (2018). ВОЗ;
- Madhab K. Chattopadhyay. (2014). Use of antibiotics as feed additives: a burning question. Front. Microbiol.. 5;
- J. Davies, D. Davies. (2010). Origins and Evolution of Antibiotic Resistance. Microbiology and Molecular Biology Reviews. 74, 417-433;
- Устойчивость к антибиотикам. (2018). ВОЗ;
- Антибиотики и антибиотикорезистентность: от древности до наших дней;
- Duccio Medini, Claudio Donati, Hervé Tettelin, Vega Masignani, Rino Rappuoli. (2005). The microbial pan-genome. Current Opinion in Genetics & Development. 15, 589-594;
- R. Mazaheri Nezhad Fard, M.D. Barton, M.W. Heuzenroeder. (2011). Bacteriophage-mediated transduction of antibiotic resistance in enterococci. Letters in Applied Microbiology. 52, 559-564;
- Laurie A. Graham, Stephen C. Lougheed, K. Vanya Ewart, Peter L. Davies. (2008). Lateral Transfer of a Lectin-Like Antifreeze Protein Gene in Fishes. PLoS ONE. 3, e2616;
- R. J. Redfield. (1993). Genes for Breakfast: The Have-Your-Cake and-Eat-lt-Too of Bacterial Transformation. Journal of Heredity. 84, 400-404;
- Richard E. Michod, Harris Bernstein, Aurora M. Nedelcu. (2008). Adaptive value of sex in microbial pathogens. Infection, Genetics and Evolution. 8, 267-285;
- Redfield R.J. (1988). Evolution of bacterial transformation: is sex with dead cells ever better than no sex at all? Genetics. 1, 213–221;
- A SALYERS, A GUPTA, Y WANG. (2004). Human intestinal bacteria as reservoirs for antibiotic resistance genes. Trends in Microbiology. 12, 412-416;
- Jennifer R Huddleston. (2014). Horizontal gene transfer in the human gastrointestinal tract: potential spread of antibiotic resistance genes. IDR. 167;
- P M Bennett. (2009). Plasmid encoded antibiotic resistance: acquisition and transfer of antibiotic resistance genes in bacteria. British Journal of Pharmacology. 153, S347-S357;
- Сакс Дж.С. Микробы хорошие и плохие. М.: «АСТ», Corpus, 2013. — 496 с.;
- Ventola C.L. (2015). The antibiotic resistance crisis: part 1: causes and threats. P.T. 4, 277–283;
- W. Witte. (1998). BIOMEDICINE: Medical Consequences of Antibiotic Use in Agriculture. Science. 279, 996-997;
- Aidan Hollis, Ziana Ahmed. (2013). Preserving Antibiotics, Rationally. N Engl J Med. 369, 2474-2476;
- V.O. STOCKWELL, B. DUFFY. (2012). Use of antibiotics in plant agriculture. Rev. Sci. Tech. OIE. 31, 199-210;
- Противостояние с резистентными бактериями: наши поражения, победы и планы на будущее;
- Roberta J. Melander, Christian Melander. (2017). The Challenge of Overcoming Antibiotic Resistance: An Adjuvant Approach?. ACS Infect. Dis.. 3, 559-563;
- WHO updates Essential Medicines List with new advice on use of antibiotics, and adds medicines for hepatitis C, HIV, tuberculosis and cancer. (2017). WHO;
- ВОЗ предлагает новую методику для ускорения действий по борьбе с устойчивостью к противомикробным препаратам. (2019). ВОЗ;
- J. G. Bartlett, D. N. Gilbert, B. Spellberg. (2013). Seven Ways to Preserve the Miracle of Antibiotics. Clinical Infectious Diseases. 56, 1445-1450;
- Устойчивость к противомикробным препаратам. (2018). ВОЗ;
- Кто живет во рту у медведя;
- Антибиотики прямо под нашим носом;
- Антимикробные пептиды — возможная альтернатива традиционным антибиотикам;
- Антибиотикорезистентность: How to make antibiotics great again*?;
- Thomas P Zabawa, Michael J Pucci, Thomas R Parr, Troy Lister. (2016). Treatment of Gram-negative bacterial infections by potentiation of antibiotics. Current Opinion in Microbiology. 33, 7-12;
- Эволюция наперегонки, или Почему антибиотики перестают работать;
- Один в поле не воин: природная антимикробная система эффективнее антибиотика;
- Ann M. Stock, Victoria L. Robinson, Paul N. Goudreau. (2000). Two-Component Signal Transduction. Annu. Rev. Biochem.. 69, 183-215;
- Yasuhiro Gotoh, Akihiro Doi, Eiji Furuta, Sarah Dubrac, Yoshimasa Ishizaki, et. al.. (2010). Novel antibacterial compounds specifically targeting the essential WalR response regulator. J Antibiot. 63, 127-134;
- L. Martinez-Martinez, M. C. Conejo, A. Pascual, S. Hernandez-Alles, S. Ballesta, et. al.. (2000). Activities of Imipenem and Cephalosporins against Clonally Related Strains of Escherichia coli Hyperproducing Chromosomal beta -Lactamase and Showing Altered Porin Profiles. Antimicrobial Agents and Chemotherapy. 44, 2534-2536;
- S P Cohen, L M McMurry, D C Hooper, J S Wolfson, S B Levy. (1989). Cross-resistance to fluoroquinolones in multiple-antibiotic-resistant (Mar) Escherichia coli selected by tetracycline or chloramphenicol: decreased drug accumulation associated with membrane changes in addition to OmpF reduction.. Antimicrobial Agents and Chemotherapy. 33, 1318-1325;
- G W Kaatz, S M Seo, C A Ruble. (1993). Efflux-mediated fluoroquinolone resistance in Staphylococcus aureus.. Antimicrobial Agents and Chemotherapy. 37, 1086-1094;
- A A Neyfakh, C M Borsch, G W Kaatz. (1993). Fluoroquinolone resistance protein NorA of Staphylococcus aureus is a multidrug efflux transporter.. Antimicrobial Agents and Chemotherapy. 37, 128-129;
- Важнейшие методы молекулярной биологии и генной инженерии;
- Ian Chopra. (2002). New developments in tetracycline antibiotics: glycylcyclines and tetracycline efflux pump inhibitors. Drug Resistance Updates. 5, 119-125;
- Toshihiro Kiho, Mizuka Nakayama, Kayo Yasuda, Shunichi Miyakoshi, Masatoshi Inukai, Hiroshi Kogen. (2004). Structure–activity relationships of globomycin analogues as antibiotics. Bioorganic & Medicinal Chemistry. 12, 337-361;
- Jean-Marie Pagès, Leonard Amaral. (2009). Mechanisms of drug efflux and strategies to combat them: Challenging the efflux pump of Gram-negative bacteria. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics. 1794, 826-833;
- Abdallah Mahamoud, Jacqueline Chevalier, Sandrine Alibert-Franco, Winfried V. Kern, Jean-Marie Pagès. (2007). Antibiotic efflux pumps in Gram-negative bacteria: the inhibitor response strategy. Journal of Antimicrobial Chemotherapy. 59, 1223-1229;
- L. Biskri, D. Mazel. (2003). Erythromycin Esterase Gene ere(A) Is Located in a Functional Gene Cassette in an Unusual Class 2 Integron. Antimicrobial Agents and Chemotherapy. 47, 3326-3331;
- I. Plante. (2003). An integron cassette encoding erythromycin esterase, ere(A), from Providencia stuartii. Journal of Antimicrobial Chemotherapy. 51, 787-790;
- Мобильные генетические элементы прокариот: стратификация «общества» бродяжек и домоседов;
- G WRIGHT. (2005). Bacterial resistance to antibiotics: Enzymatic degradation and modification. Advanced Drug Delivery Reviews. 57, 1451-1470;
- Gerard D. Wright. (2016). Antibiotic Adjuvants: Rescuing Antibiotics from Resistance. Trends in Microbiology. 24, 862-871;
- S. M. Drawz, R. A. Bonomo. (2010). Three Decades of -Lactamase Inhibitors. Clinical Microbiology Reviews. 23, 160-201;
- Roberta J Worthington, Meghan S Blackledge, Christian Melander. (2013). Small-molecule inhibition of bacterial two-component systems to combat antibiotic resistance and virulence. Future Medicinal Chemistry. 5, 1265-1284;
- Viktória Lázár, Gajinder Pal Singh, Réka Spohn, István Nagy, Balázs Horváth, et. al.. (2013). Bacterial evolution of antibiotic hypersensitivity. Mol Syst Biol. 9, 700;
- Gerard D. Wright. (2011). Molecular mechanisms of antibiotic resistance. Chem. Commun.. 47, 4055;
- Tobias Bollenbach. (2015). Antimicrobial interactions: mechanisms and implications for drug discovery and resistance evolution. Current Opinion in Microbiology. 27, 1-9;
- Bo Peng, Yu-bin Su, Hui Li, Yi Han, Chang Guo, et. al.. (2015). Exogenous Alanine and/or Glucose plus Kanamycin Kills Antibiotic-Resistant Bacteria. Cell Metabolism. 21, 249-262;
- Kyle R. Allison, Mark P. Brynildsen, James J. Collins. (2011). Metabolite-enabled eradication of bacterial persisters by aminoglycosides. Nature. 473, 216-220;
- Maya A. Farha, Alexander Leung, Edward W. Sewell, Michael A. D’Elia, Sarah E. Allison, et. al.. (2013). Inhibition of WTA Synthesis Blocks the Cooperative Action of PBPs and Sensitizes MRSA to β-Lactams. ACS Chem. Biol.. 8, 226-233;
- William F. Walkenhorst. (2016). Using adjuvants and environmental factors to modulate the activity of antimicrobial peptides. Biochimica et Biophysica Acta (BBA) - Biomembranes. 1858, 926-935.