
Почему болеют растения и как они борются с инфекцией на примере фитопатогенных бактерий
11 марта 2021
Почему болеют растения и как они борются с инфекцией на примере фитопатогенных бактерий
- 3793
- 0
- 5
Сосудистый бактериоз капусты (справа).
Рисунок в полном размере.
сайт Botanichka
-
Автор
-
Редакторы
Статья на конкурс «Био/Мол/Текст»: Растения болеют. Наверное, этот тезис у читателя не вызовет какого-то особенного удивления. Данный факт кажется весьма очевидным, учитывая, что многие обыватели любят выращивать растения у себя дома или в саду и с большой вероятностью сталкивались с подобной проблемой. Однако, что может быть не совсем очевидным, так это то, что растения обладают своеобразной иммунной системой, защищающей их организм от внедрения различных патогенов — грибов, бактерий, вирусов, круглых червей. Да-да, все прямо как у людей, или нет? Давайте разбираться.
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.

Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.

Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Инфекционные болезни растений и их возбудители
Болезни растений принято делить на неинфекционные и инфекционные. Причинами первых является недостаток или избыток того или иного фактора неживой природы — воды, света, минеральных веществ и т.д. Вторые вызываются различными микроорганизмами — бактериями, вирусами, грибами, круглыми червями-нематодами [1].
С болезнями растений человечество сталкивалось с незапамятных времен, и порой подобные «столкновения» заканчивались для нас не самым лучшим образом.
Например, эпидемии «Антониевого огня» в Средние века были вызваны массовыми отравлениями людей токсинами грибка-спорыньи (Claviceps purpurea), паразитирующего на пшенице и ржи (рис. 1) [2].

Рисунок 1. Антониев огонь или эрготизм — заболевание, вызываемое отравлением алкалоидами гриба спорыньи (Claviceps purpurea).
(а) — склероции спорыньи на колосе злакового растения, содержащие большое количество алкалоидов.
(б) — больной эрготизмом, изображенный на Изенгеймском алтаре художником Маттиасом Грюневальдом (1506–1515 гг.). Болезнь была крайне распространена в Средневековье в Европе и в России, однако встречалась вплоть до XX века (известна вспышка в 1951 году во Франции) [2]. Масштабное распространение эрготизма объяснялось низкими требованиями к качеству зерна, которое в сырые и холодные годы активно поражалось спорыньей. Алкалоиды спорыньи (в особенности эрготин) при попадании в организм вызывают длительные спазмы гладкой мускулатуры, судороги, расстройства нервной системы, а при больших дозах — смерть. У эрготизма существует две формы: гангренозная (известная как «Антониев огонь») и конвульсивная ( «ведьмина корча»).
Голод в Ирландии в 1845–1849 годы, в свою очередь, стал следствием масштабной гибели посевов картофеля по причине заражения оомицетом фитофторой (Phytophthora infestans) [3].
Грибковые заболевания растений преследуют человечество и по сей день, являясь, наверное, одной из самых распространенных причин гибели посевов в сельском хозяйстве. Помимо спорыньи и фитофторы, возбудителями заболеваний растений являются представители родов Fusarium, Alternaria, Microdochium, Typhula и других [4].
В зависимости от стратегии, к которой прибегают грибы для «захвата» растения- хозяина, их, как и все фитопатогены в целом, принято разделять на три группы — некротрофы, биотрофы и гемибиотрофы. Некротрофы убивают клетки растительных тканей, после чего заселяют пораженный участок и поглощают из него питательные вещества, биотрофы же извлекают необходимые вещества непосредственно из живых клеток. Гемибиотрофы — промежуточный вариант: сначала они питаются биотрофно, а затем, после гибели зараженных тканей, продолжают жить на них как некротрофы [1]. Внешние проявления фунгиозов крайне разнообразны: от различного рода бурых пятен, ржавчины или белоснежного налета на листьях до гниения корней и масштабных некрозов отдельных органов [5].
Не менее часто растения становятся жертвами бактериозов — заболеваний, вызываемых патогенными бактериями. Например, Pseudomonas syringae — возбудитель базального бактериоза зерновых — один из самых распространенных фитопатогенов в Европейской части России: он способен поражать до 70% урожая некоторых сортов пшеницы и ячменя.
Стратегии колонизации бактериями организма хозяина могут быть достаточно разнообразными: от грубого разрушения клеток литическими ферментами до искусного внедрения в геном растения части своей плазмидной ДНК. Внешние проявления бактериозов самые различные — мокрые гнили, бурые пятнистости, увядание, образование опухолей [5].
Растения, подобно животным и бактериям, могут также поражаться и вирусными частицами. Интересно, что первым открытым вирусом стал вирус табачной мозаики (Tobacco mosaic virus) — фитопатоген, паразитирующий на представителях семейства пасленовых (табак, картофель и т.д.). Вирусы проникают в клетки растения через уже имеющиеся повреждения, после чего происходит высвобождение и репликация вирусной нуклеиновой кислоты и синтез вирусных белков на рибосомах организма-хозяина. Внутри растения вирусы распространяются либо по сосудистой системе, либо через плазмодесмы (специальные соединительные мостики между клетками растений) [6]. Внешними характерными признаками вирусных заболеваний у растений могут быть мозаичная окраска, желтушность или скручивание листьев, их неравномерный рост, иногда — усиление ветвления и укорочение междоузлий (рис. 2) [4].

Рисунок 2. Листья табака, пораженного вирусом табачной мозаики.
сайт Forestry Images
Кроме грибов, бактерий и вирусов, на растения охотятся еще и круглые черви. Наиболее вредоносными нематодами в мире считаются виды родов Meloidodyne, Heterodera, Uobodera, Ditylenchus,Tylenchulus [7].
Практически все известные нам высшие растения могут быть потенциальными хозяевами одного или более видов паразитических червей. В ротовой полости фитопатогенных нематод расположен стилет — специальный колюще-сосущий орган, которым нематода прокалывает ткани растений и высасывает из них питательные вещества, вызывая образование галл или язв на корнях (галловые нематоды), деформацию и некроз листьев (листовые нематоды), общее угнетение роста и развития организма хозяина (рис. 3). Помимо этого, нематоды зачастую переносят на себе болезнетворные грибы, вирусы и бактерии, способные вызывать сопутствующую инфекцию [8].

Рисунок 3. Внешние проявления поражения растений нематодами.
(a) — нематода (Globodera rostochiensis) как пример фитопатогенного круглого червя;
(б) — внешние проявления поражения растений нематодами: защитные цисты золотистой нематоды на корнях картофеля;
(в) — внешние проявления поражения растений нематодами: галлы на корнях пораженного галловыми нематодами паслена;
(г) — засохшие кончики листьев и порча семян у риса;
(д) — бурые пятна на листьях папоротника.
коллаж автора статьи по материалам сайтов Animal Pictures, «Инфоиндустрия», «Управление Россельхознадзора», College of Agriculture, Kete New Plymouth
Бактериозы растений
Поскольку мы будем рассматривать тему фитоиммунитета на примере бактериальных инфекций, о последних стоило бы рассказать подробнее.
Бактериозы растений считаются животрепещущей проблемой мирового сельского хозяйства XXI века. Долгое время опасность бактерий недооценивали, отдавая пальму первенства в этом вопросе грибам. Тем не менее, как было сказано ранее, фитопатогенные бактерии способны вызывать развитие серьезных патологий у растений, таких как бактериальный рак, мягкие гнили (рис. 4), некрозы, ожоги и увядания отдельных органов, потенциально приводящие к смерти целого организма. Наиболее опасными фитопатогенными бактериями являются представители родов Pectobacterium, Xanthomonas, Pseudomonas, Dickeya, Agrobacterium и другие.
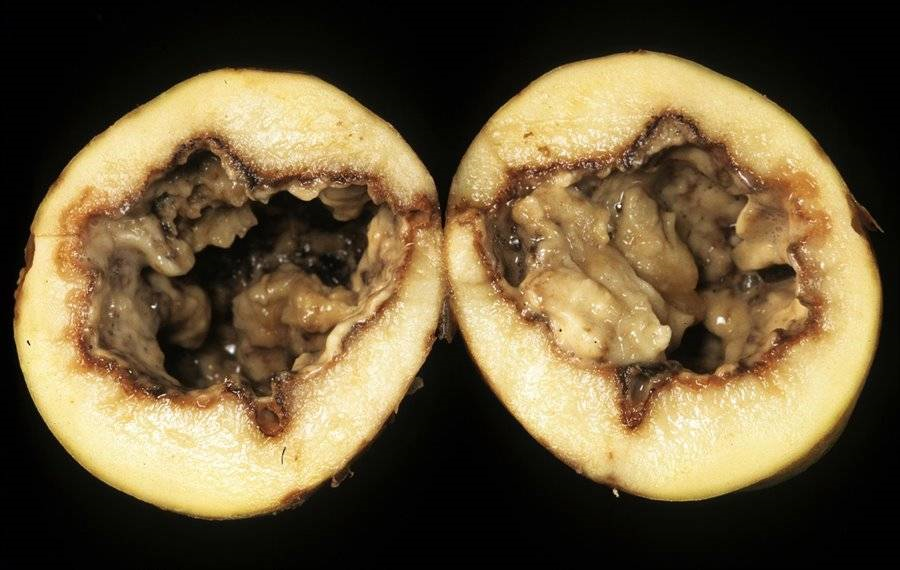
Рисунок 4. Мягкая гниль картофеля, вызванная фитопатогенной бактерией Pectobacterium carotovorum.
У бактерий существует ряд инструментов, с помощью которых они колонизируют организм растения-хозяина. Первое оружие — это наличие у фитопатогенных бактерий огромного разнообразия выделяемых наружу литических ферментов, разрушающих растительную клеточную стенку. Второе — фитотоксины, особые низкомолекулярные вещества, направленные на убийство растительных клеток или же подавление иммунного ответа хозяина. Третье — сидерофоры, тоже низкомолекулярные соединения, необходимые бактериям для транспорта железа из внешней среды внутрь клетки. Бактерии используют железо для синтеза веществ, позволяющих им успешно развиваться в организме растения. Четвертое — жгутики и пили, обеспечивающие подвижность микроорганизмов. Пятое — экзополисахариды, которые выполняют множество функций: структурную (объединяют бактерии в единые структуры — биопленки); адгезивную (позволяют бактериям прикрепляться к субстрату, что особенно важно при колонизации фитопатогенами сосудов ксилемы, где у растений идет транспорт воды); защитную (предохраняют клетки бактерий от высыхания, от активных форм кислорода, а также могут работать наподобие стелс-технологии, скрывая от защитных систем организма растения патогенные детерминанты, например, флагеллин — белок жгутиков). У некоторых патогенных микроорганизмов, например, у агробактерий, имеются специальные системы, позволяющие им встраивать часть своей ДНК в геном растения, тем самым заставляя последнее синтезировать необходимые фитопатогену вещества [9].
Как видно, военный арсенал у фитопатогенных организмов действительно крайне разнообразен. А что же растения? Поверьте, им тоже есть, чем ответить.
Как растение борется с «заразой» на примере бактериальных инфекций
В отличие от животных, у растений нет специальных иммунных клеток (лейкоцитов) для того, чтобы противостоять фитопатогенам. Почти все клетки растения способны запускать иммунный ответ и защищать себя с помощью так называемых факторов устойчивости. Что же это такое?
Факторы устойчивости — это особые структуры, метаболиты, сигнальные системы, существующие в растении и участвующие в защите последнего от фитопатогенов.
Здесь стоит отметить, что культурные растения в целом гораздо более подвержены заражению различными фитопатогенами по сравнению с своими «дикими родственниками» в том числе именно потому, что селекция новых сортов часто идет вразрез с желанием растения синтезировать разнообразные защитные метаболиты.
Факторы устойчивости принято делить на конститутивные и индуцируемые. Под конститутивными факторами подразумеваются особые барьерные структуры клетки: целлюлозная клеточная стенка, наружная кутикула, покрывающая листья и стебли многих растений, а также постоянно синтезируемые в растении особые вещества, губительно действующие на незваных гостей. Индуцированный же иммунный ответ запускается растением исключительно в присутствии того или иного патогена. Организм понимает, что в него попал кто-то «чужой» благодаря специальным рецепторам, расположенным внутри или снаружи клетки. Они распознают особые «сигналы опасности» и активируют защитные системы. Подобными сигналами (элиситорами) могут быть консервативные молекулы, являющиеся компонентами клеточных структур фитопатогенов, разнообразные вещества (факторы вирулентности), секретируемые паразитами наружу (в апопласт), или «обломки» собственных полимеров растения, которые разрушаются в процессе колонизации патогенами организма хозяина. Элиситоры бывают специфичными, то есть характерными чуть ли не исключительно для конкретного штамма, и неспецифичными, свойственными для многих фитопатогенов.
Индуцированная устойчивость бывает локальной и системной. Локальная устойчивость — это по сути индуцированная устойчивость, которая развилась строго в том месте, где произошло попадание патогена в организм растения. С биохимической точки зрения она может проявляться в усилении синтеза активных форм кислорода, защитных белков или фитоалексинов. Не стоит путать с реакцией гиперчувствительности, речь о которой пойдет позже; она является лишь частным проявлением локальной устойчивости! Системная устойчивость развивается в результате физиологических изменений, происходящих в неинфицированных клетках во всем организме растения в результате локальных изменений, вызванных инвазией патогена, и тесно связана с синтезом специальных антимикробных белков [9].
Раунд 1. Растительная клеточная стенка — первый барьер на пути непрошенных гостей
Растительная клеточная стенка (РКС) — достаточно сложно устроенная структура. И недаром! Именно она «стоит на страже» клеточного метаболизма и является первым форпостом на пути непрошенных гостей. РКС состоит из трех основных компонентов — микрофибрилл целлюлозы, связующих гликанов и пектиновых веществ (рис. 5) [10].
На первый взгляд, растительная клеточная стенка воистину неприступна, и в какой-то степени это действительно так. Далеко не все фитопатогены, потенциально способные заразить растение, прорываются через нее. Вирусы, например, в принципе не способны проникать сквозь РКС; они попадают внутрь клетки только в том случае, если она повреждена по каким-либо другим причинам. Бактерии сами по себе также не могут ее преодолеть, поскольку поры между фибриллами целлюлозы крайне малы.
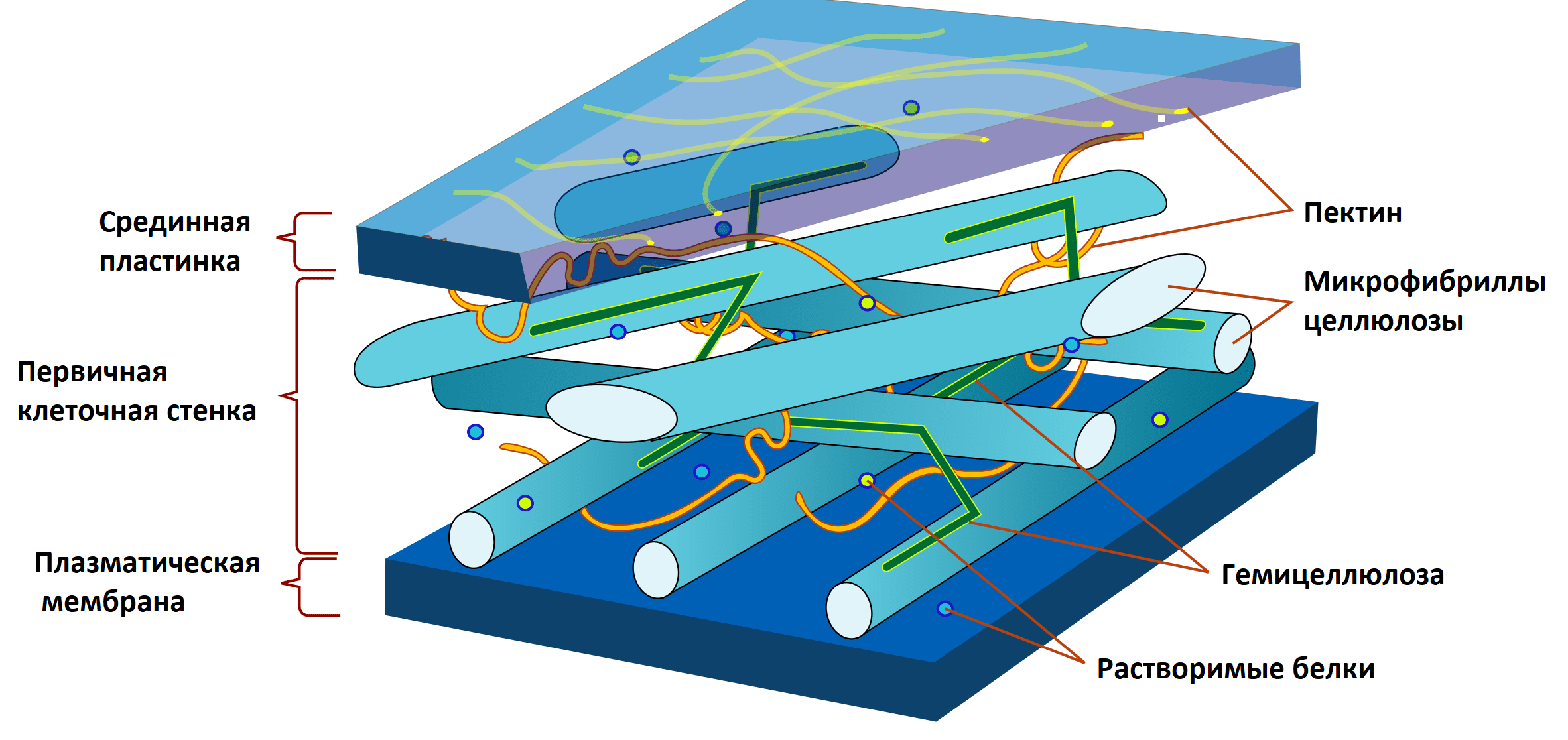
Рисунок 5. Строение растительной клеточной стенки. Целлюлоза представляет собой углеводный полимер, мономером которого является глюкоза, чьи цепочки собраны в прочные фибриллы, расположенные в виде перекрывающихся слоев. Они соединены между собой специальными углеводными «склейками» — связующими гликанами, которые называют гемицеллюлозами. Более того, вся описанная выше конструкция, как в «желе», погружена в матрикс из пектиновых веществ. Стоит отметить, что, помимо основных компонентов, РКС насыщена ионами кальция, а также содержит огромное количество разнообразных белков.
Если нельзя протиснуться сквозь барьер, значит, его нужно разрушить! Именно это зачастую и случается с РКС, когда в дело вступают специализированные фитопатогены, секретирующие огромное количество литических ферментов, позволяющих уничтожить, казалось бы, неприступную «крепость». Но нельзя сказать, что растение на этом этапе сдается. РКС может быть заведомо укреплена специальными веществами, такими как лигнин, суберин и кутин, образующими гидрофобный слой, доставляющий фитопатогенам дополнительные проблемы. К тому же лигнин и суберин можно отнести еще и к факторам индуцированной устойчивости, потому что синтез этих веществ активируется непосредственно в ответ на присутствие микроба [10], [11].
Раунд 2. Вторичные метаболиты
Что ж, клеточная стенка разрушена, патоген ворвался внутрь клетки, и именно здесь начинается следующий раунд — встреча с вторичными метаболитами...
Вторичные метаболиты — это «дополнительные» химические соединения, не участвующие в основном клеточном обмене. Они могут присутствовать не во всех клетках организма, однако имеют при этом важное функциональное значение на уровне целого растения. Вторичные метаболиты — незаменимые помощники растений. Они способны выполнять самые разнообразные функции: защищать от фитопатогенов, участвовать в размножении растений и их взаимодействии с другими организмами и т. д.
Не каждое вещество, синтезируемое растением, можно назвать вторичным метаболитом. Для них существует несколько критериев:
- выраженная биологическая активность;
- небольшая молекулярная масса
- ограниченное число предшественников их биосинтеза.
На самом деле, вторичные метаболиты способны синтезировать и животные, но растениям в этом плане нет равных! Они являются бесспорными чемпионами по количеству и разнообразию таких веществ. К слову, именно вторичными метаболитами определяются лекарственные свойства растений [9].
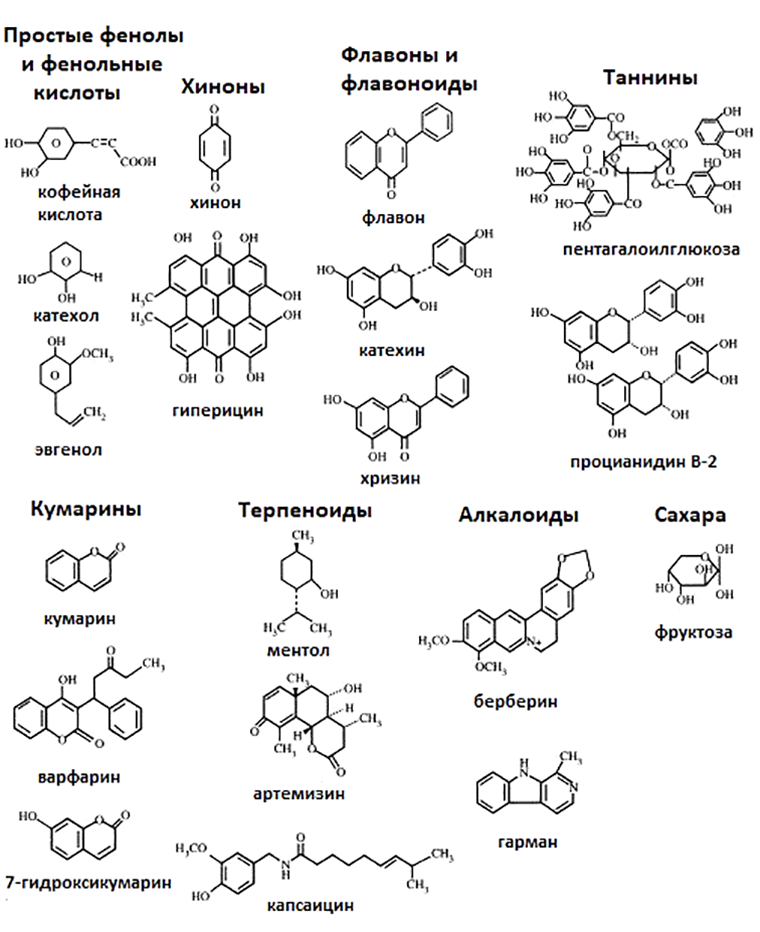
Рисунок 6. Химические структуры разнообразных вторичных метаболитов растений, обладающих антимикробными свойствами.
Наиболее изученными из данных веществ в плане фитоиммунитета являются фенольные соединения, алкалоиды и изопреноиды (терпеноиды). Все они обладают бактерицидным действием и воздействуют на широкий спектр патогенов (рис. 6). Основными мишенями вторичных метаболитов в бактериальной клетке, как правило, являются мембраны, различные белки и нуклеиновые кислоты [12].
Например, фенольные соединения (вещества ароматической природы) способны встраиваться в мембраны бактерий, приводя к их разрыву, инактивировать белки, влиять на работу их электрон-транспортных цепей, нарушая тем самым синтез АТФ, служить в качестве акцепторов электронов и окислять разные группы соединений, а также сшивать полимеры РКС, создавая тем самым дополнительные преграды на пути патогена [13].
Среди фенолов флавоноиды (окисленные формы фенольных соединений) наиболее знакомы нам, простым обывателям. Мы с удовольствием употребляем их вместе с едой и напитками растительного происхождения: с лимонами, луком, зеленым чаем, красным вином и даже черным шоколадом. Считается, что флавоноиды оказывают положительный эффект на наше здоровье. Например, известно, что флавоноиды цитрусовых снижают риск развития сердечно-сосудистых заболеваний и диабета, поскольку обладают антиоксидантными свойствами, подавляют процесс воспаления, улучшают толерантность к глюкозе и чувствительность к инсулину, модулируют метаболизм липидов [14].
Алкалоиды же — представители другой большой группы азотсодержащих вторичных метаболитов растений; они оказывают губительное влияние на синтез нуклеиновых кислот и репарацию ДНК бактерий, а также выступают в качестве ингибиторов синтеза аминокислот [15]. К алкалоидам относится такое хорошо известное вещество, как никотин: он необходим растениям для защиты от насекомых, а человеком успешно применяется как инсектицид.
Принцип действия терпеноидов на данный момент не выяснен до конца, однако считается, что он связан с нарушением структуры и функций бактериальных мембран, поскольку эти соединения являются липофильными. Известно, что они активны против бактерий, вирусов, грибов и протозоев. Кстати, именно наличием терпеноидов объясняется антимикробный эффект эфирных масел [12].
Также стоит отметить, что, в зависимости от времени синтеза, вышеупомянутые антимикробные вторичные метаболиты принято делить на три группы: фитонциды — образуются в клетках растений постоянно (конститутивный иммунитет); фитоалексины — синтезируются только в присутствии фитопатогена и являются частью индуцированного ответа; полуиндуцибельные — до внедрения патогена хранятся в клетке в неактивной форме [9].
Таким образом, огромное разнообразие вторичных метаболитов и многообразные механизмы их действия позволяют растениям эффективно противостоять непрошенным гостям. Эти метаболиты способны выводить из строя жизненно важные системы микроорганизмов, а также способствовать укреплению барьеров растительной клетки.
Раунд 3. Индуцированный иммунный ответ
Хотя факторы конститутивной устойчивости и способны препятствовать проникновению в растение большинства потенциальных патогенов, ряд микроорганизмов может преодолевать подобные преграды. Здесь вступают в бой особые сигнальные системы растения, способные распознать чужеродные вещества (элиситоры) и активировать адекватный ответ на них.
Локальная устойчивость
Мы уже знаем, что, в зависимости от локализации и механизма иммунного ответа, различают локальную и системную устойчивость. Локальную устойчивость можно разделить еще на два типа:
- количественная устойчивость (патоген-ассоциированный молекулярный паттерн (ПАМП)-индуцированная или горизонтальная устойчивость);
- качественная устойчивость (эффектор-индуцированная или вертикальная устойчивость).
Количественная устойчивость считается эволюционно более древним типом индуцированной устойчивости, характерным для всех семенных растений. Она называется количественной, поскольку в процессе ее «работы» болезнь у растения может проявляться в той или иной степени или не проявляться совсем — тогда растение будет абсолютно устойчивым к фитопатогену. Количественная устойчивость абсолютно не специфична и участвует в защите организма от широкого спектра фитопатогенов. Вещества, способные вызывать количественную устойчивость, делятся на две основные группы:
- Метаболиты патогенных микроорганизмов, без которых существование последних было бы невозможно (например, хитин у грибов, входящий в состав их клеточной стенки, или флагеллин бактерий — основной компонент их жгутиков) — то есть в процессе эволюции патогены не могут от них избавиться.
- Продукты распада собственных растительных полимеров, которые сигнализируют растению об опасности. Ими могут быть, например, олигосахариды, образующиеся в процессе разрушения РКС.
Рецепторы количественной устойчивости, распознающие внешние и внутренние «сигналы опасности», расположены на мембране клетки. Они, как правило, либо сами обладают киназной активностью, либо связаны с внутриклеточными киназами — ферментами, присоединяющими остатки фосфора к другим белкам.
Резуховидка Таля — это всем известный арабидопсис, верный помощник биологов и генных инженеров. Чем же он так хорош? Читайте в статье «Модельные организмы: арабидопсис» [16]. — Ред.
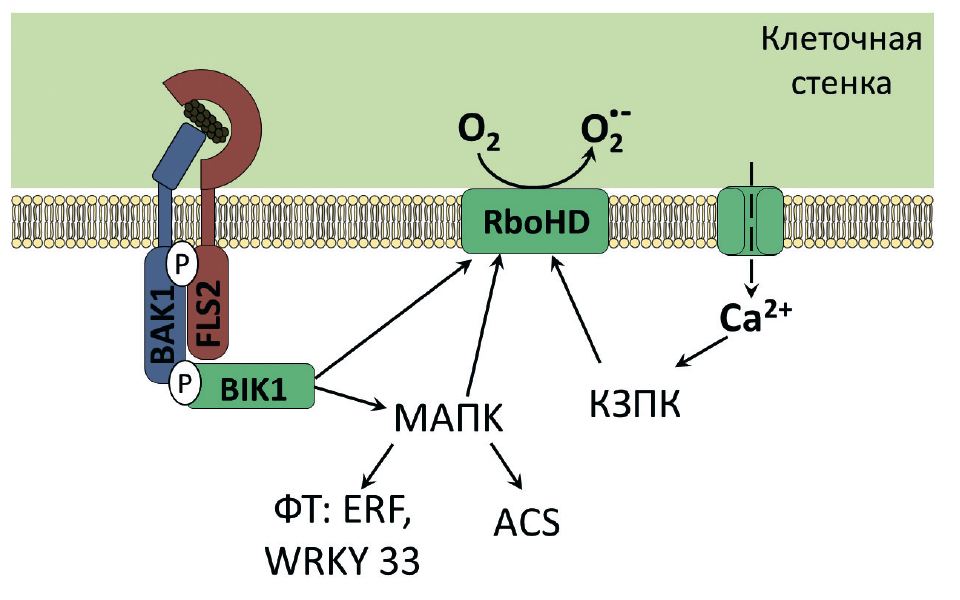
Рисунок 7. Схема развития иммунной реакции растения в ответ на узнавание внеклеточными рецепторами фрагментов бактериального флагеллина.
Рецептор (FLS2) находится на мембране растительной клетки. При проникновении в организм патогенной бактерии он связывается с консервативными участками флагеллина, после чего взаимодействует с двумя ферментами — мембранной киназой BAK1 и цитоплазматической киназой BIK1. В результате киназные домены последних фосфорилируются, что приводит к активации различных флагеллин-индуцируемых ответов. Среди них выброс ионов Ca2+ в цитоплазму, что активирует кальций-зависимые протеинкиназы (КЗПК), запускающие НАДФН-оксидазу RboHD. НАДФН-оксидаза RboHD образует большое количество свободных форм кислорода — происходит мощный окислительный взрыв, приводящий к гибели клетки фитопатогена. Еще одним результатом фосфорилирования киназного домена BIK1 является запуск МAPK сигнального каскада (МАПК), который активирует ферменты биосинтеза этилена (ASC), НАДФН-оксидазу RboHD, о которой уже шла речь выше, и факторы транскрипции (ФТ) ERF и WRKY33, контролирующие экспрессию защитных генов [9], [17].
Однако, как любой клеточный рецептор, рецептор количественной устойчивости не может быть активирован вечно. Клетке обязательно необходимо его выключить спустя какое-то время, иначе это приведет к истощению ресурсов растения. Поэтому существуют системы, ответственные за разрушение активированных рецепторов, например, убиквитин-лигазная система, которая метит целевые белки особыми убиквитиновыми последовательностями. Эти последовательности распознают протеасомы — белковые комплексы, служащие для разрушения отработанных белков. Другой системой, выключающей рецептор, является механизм эндоцитоза, за счет которого последний оказывается внутри клетки на эндоцитозном пузырьке и не может больше взаимодействовать со своими экстраклеточными лигандами.
Сигнализация количественной устойчивости устроена таким образом, чтобы обеспечить растению эффективную мобилизацию и своевременную демобилизацию ее защитных систем, что позволяет вовремя препятствовать проникновению патогенного организма, не приводя при этом к большим энергетическим затратам.
К сожалению, несмотря на то, что механизмы количественной устойчивости запускаются в ответ на жизненно важные метаболиты фитопатогенов, они далеко не всегда способны защитить растение. Дело в том, что в ходе эволюции патогены выработали механизмы защиты и обмана данной иммунной реакции организма-хозяина. Например, у бактерий есть экзополисахариды, способные в какой-то степени экранировать их консервативные антигенные детерминанты. Также фитопатогены имеют особые системы секреции, позволяющие им доставлять свои специфичные метаболиты, необходимые для блокировки количественной устойчивости, непосредственно внутрь клетки растения.
Качественная (эффектор-индуцированная или вертикальная) устойчивость является более новым типом устойчивости и по характеру эволюции напоминает гонку вооружений. Немного позже объясним, почему.
Качественная устойчивость на то и качественная, что она либо запускается и убивает патоген на все 100%, либо не запускается совсем. В отличие от количественной устойчивости, качественная — высокоспецифична, вплоть до того, что может сработать на один штамм фитопатогена, но совершенно никак не отреагировать на другой. Она запускается в ответ на особые белки фитопатогенов, называемых специфичными эффекторами, уникальными для каждого вида или даже штамма, которые, как правило, секретируются паразитами непосредственно внутрь клетки растения с целью подавления иммунной защиты хозяина, а также для изменения его метаболизма в своих целях. Растения же «научились» распознавать подобные эффекторы патогенов как сигнал опасности и активировать в ответ на них губительные для микроорганизма защитные реакции. Поскольку специфичные элиситоры доставляются преимущественно внутрь клетки растения, то и рецепторы качественной устойчивости (R-белки) расположены в основном в цитоплазме или же в нуклеоплазме, хлоропластах и эндомембранных структурах [9].
Взаимоотношения растения и фитопатогена при данном типе устойчивости характеризуют еще как отношение «ген на ген». Эта теория была разработана Генри Гарольдом Флором в ходе изучения взаимодействия льна (Linum usitatissimum) и ржавчинных грибов (Melampsora lini). Ее основная идея заключается в следующем: иммунитет развивается, когда продукт некоего гена устойчивости растения (вышеупомянутые R-белки) взаимодействует с продуктом гена авирулентности фитопатогена (тот самый специфичный эффектор). Если же продукт гена авирулентости не соответствует продукту гена устойчивости, то развивается заболевание.
Поскольку качественная устойчивость вызывает абсолютную гибель фитопатогена, она оказывает селективное влияние на его популяцию, что приводит к возникновению устойчивых штаммов, секретирующих новые элиситоры, которые организм хозяина не способен распознать. В ответ на это спустя какое-то время у растений появляются дополнительные системы, позволяющие им бороться с устойчивыми патогенами, что запускает очередной цикл естественного отбора у микроорганизмов. Поэтому эволюционное развитие качественной устойчивости у растений часто сравнивают с гонкой вооружений и описывают так называемой моделью «зигзаг» (рис. 8) [18].
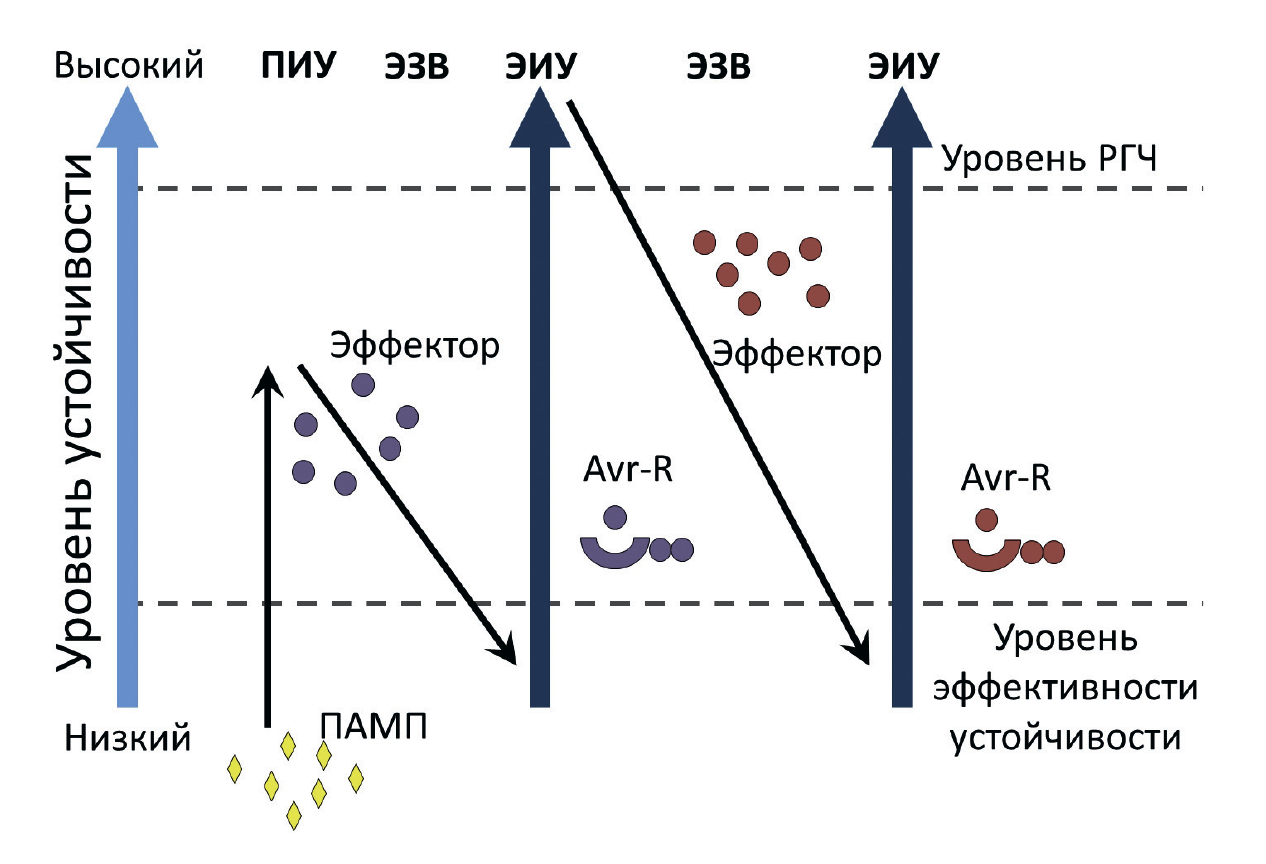
Рисунок 8. Модель «зигзаг», демонстрирующая механизм эволюции качественной устойчивости растений.
Растение успешно распознает патоген-ассоциированный молекулярный паттерн (ПАМП), что приводит к развитию ПАМП-индуцированной устойчивости (ПИУ). Затем у патогена появляется эффектор, способный заблокировать формирование количественного иммунитета, что становится причиной эффектор-зависимой восприимчивости (ЭЗВ). Растительные R-белки распознают эффекторы, блокирующие ПИУ, и активируют эффектор-индуцированную (качественную) устойчивость (ЭИУ). Появление у фитопатогенов в дальнейшем новых эффекторов сводит на нет развитие качественного иммунитета, что опять приводит к развитию заболевания. Появление новых R-белков у растения восстанавливает высокий уровень качественной устойчивости. Уровень РГЧ — это уровень, при котором развивается реакция гиперчувствительности.
Физиологически качественная устойчивость может проявляться примерно так же, как и количественная: кальций входит в цитоплазму через открытые ионные каналы; начинают работать Са2+-зависимые протеинкиназы, происходит формирование активных форм кислорода, запускается процесс лигнификации РКС, отложения каллозы, синтез PR-белков, фитоалексинов, этилена, салициловой и жасмоновой кислот и т.д. Однако характерной особенностью именно эффектор-индуцированной устойчивости является так называемая реакция гиперчувствительности — особая форма программируемой клеточной смерти (в месте проникновения фитопатогена происходит мощный «окислительный взрыв», приводящий к гибели клеток растения вместе с паразитом). Еще одним отличием является то, что качественный иммунный ответ во много раз сильнее и энергозатратней количественного и запускается, как было описано выше, по совершенно другим молекулярным механизмам [9].
Системная устойчивость
Системные ответы развиваются в незараженных клетках инфицированного растения и позволяют последнему формировать резистентность при повторной инвазии фитопатогена. Существуют индуцированная системная устойчивость (ИСУ) и системная приобретенная устойчивость (СПУ).
Индуцированная системная устойчивость формируется в ответ на различные повреждения (раневые сигналы), вызванные, например, некротрофами или насекомыми, а также на элиситоры PGPR (Plant-Growth Promoting Rhizobacteria) — ризосферных бактерий, которые могут не только стимулировать рост растения, но и способствовать его защите от фитопатогенных микроорганизмов. Подобные элиситоры по химической природе могут быть крайне разнообразными (сидерофоры, липополисахариды, фрагменты жгутиков). Основными сигнальными молекулами ИСУ являются жасмонат и этилен, которые приводят растение в некое состояние готовности и могут активировать синтез защитных PR-белков, фитоалексинов и окислительных ферментов (пероксидаз, липооксигеназ) и т.д. [19].
Системная приобретенная устойчивость является следствием локальной эффектор-индуцированной устойчивости, возникающей в ответ на внедрение фитопатогена, и представляет собой что-то наподобие иммунной памяти. В качестве своеобразного сигнала SOS, от места инфекции по организму растения распространяется целый комплекс различных веществ (азелаиновая кислота, глицеральдегид-3-фосфат и т.д.), который запускает образование салициловой кислоты в клетках, не подверженных атаке фитопатогена, и активацию синтеза защитных веществ (например, PR-белков). Системная приобретенная устойчивость может передаваться по наследству, поскольку в ходе иммунного ответа происходят эпигенетические изменения ДНК растения [9], [19].
Что синтезирует растение в ответ на инвазию патогенов?
Факторы индуцированной устойчивости
Выше мы уже обсудили, какие виды индуцированной устойчивости бывают у растений, какие молекулы распознают растения, где располагаются рецепторы, ответственные за активацию тех или иных сигнальных путей, однако сейчас хотелось бы подробнее остановиться на том, что именно синтезирует растение в ответ на инвазию патогенов.
Читатель мог заметить, что физиологические проявления различных видов индуцированной устойчивости во многом схожи, что говорит о том, что у растения есть определенный набор инструментов, которые оно использует в борьбе с фитопатогенами.
Первое, о чем мы уже упоминали, — это синтез лигнина (полиароматического соединения) в ответ на появление «непрошеного гостя». Лигнин в целом способствует укреплению растительной клеточной стенки, защищает ее структурные углеводы от действия литических ферментов, ограничивает приток воды и питательных веществ к месту расположения фитопатогена. Помимо лигнина, в ответ на инвазию паразита может синтезироваться еще и суберин (глицерид феллоновой [СН3(СН2)19СН(ОН)СООН] и пробковой [СООН(СН2)6СООН] кислот), который откладывается в сосудах и препятствует распространению фитопатогена по растению [11].
Еще одним вариантом иммунного ответа, связанного с укреплением внешних барьеров клетки, является образование полисахарида каллозы, необходимого для экстренной заделки дыр, образовавшихся в растительной клеточной стенке. Каллоза откладывается в виде особых структур — паппил между цитоплазматической мембраной и РКС (рис. 9). Данный полисахарид во многом удобен потому, что его синтез происходит достаточно быстро, и при этом он обладает свойством полупроницаемости — подобно бывшей на этом месте растительной клеточной стенке [20].
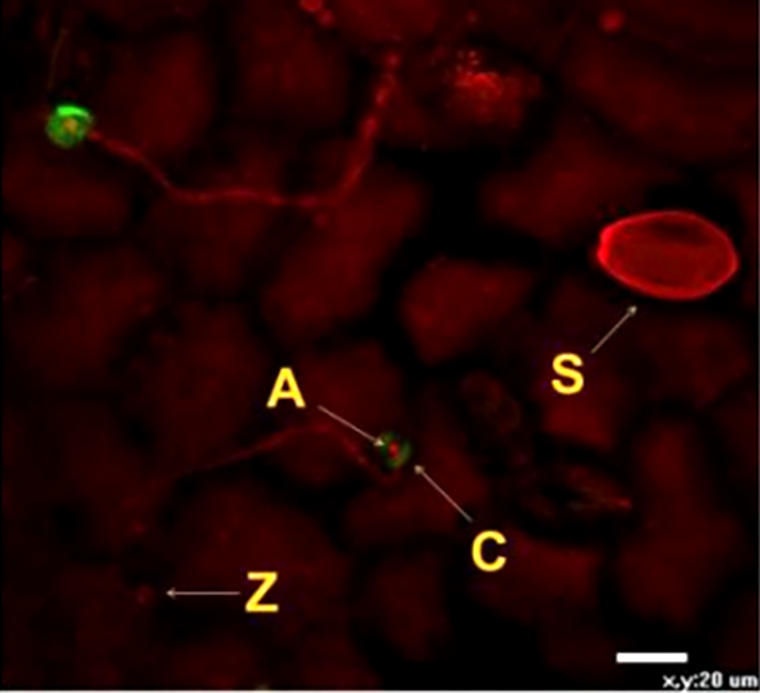
Рисунок 9. Формирование паппил из каллозы клетками огурца. Паппилы (C) образуются вокруг аппрессории фитопатогенного гриба Pseudoperonospora cubensis (A), которая образовалась на конце зародышевой трубки, выросшей из зооспоры (Z). Буквой S обозначен спорангий гриба. Процесс образования каллозы часто происходит и при бактериальной инвазии.
Помимо непосредственного усиления барьерных функций РКС, растения синтезируют множество защитных веществ. Что такое фитоалексины с химической точки зрения, мы уже подробно говорили в одной из предыдущих глав, поэтому теперь обратим внимание на другие метаболиты.
Патогенез-ассоциированные белки (Pathogenesis-related proteins, PR) являются факторами как локальной, так и системной индуцированной устойчивости. Существует множество групп PR-белков; при этом все еще неизвестна роль многих из них в защите растения. Среди PR-белков, чьи функции известны, встречаются ферменты (глюканазы и хитиназы), расположенные либо в апопласте, либо в вакуоли, участвующие в деградации клеточных стенок фитопатогенов, пермантины, дефензины и тионины — белки, нарушающие работу мембранных каналов и тем самым приводящие к лизису клеток, ингибиторы различных микробных гидролаз и многие другие [21].
Также растения способны синтезировать в ответ на инвазию бактериальных патогенов так называемые репрессоры чувства кворума. Что это такое?
«Чувство кворума» — это особая регуляторная система, распространенная среди прокариот. По сути, это некий феномен межклеточной коммуникации у бактерий с помощью низкомолекулярных соединений, позволяющий микроорганизмам действовать согласованно при достижении определенного порога плотности популяции. На примере фитопатогенов этот феномен можно продемонстрировать следующим образом. Когда бактерия проникает в организм растения, она прекрасно «понимает», что, если она сейчас начнет синтезировать ферменты, разрушающие клеточную стенку хозяина, то последний явно этому не обрадуется и уничтожит ее в ближайшее время. Однако, если она подождет, размножится и только после этого начнет синтезировать те же гидролазы, то растению будет намного сложнее справиться с инфекцией.
Но что же при этом происходит на биохимическом уровне? Дело в том, что низкомолекулярные соединения, служащие медиаторами чувства кворума, при достижении бактериями определенной плотности активируют синтез самих себя по принципу положительной обратной связи, а также синтез ферментов, участвующих в развитии бактериальной инфекции (рис. 10).
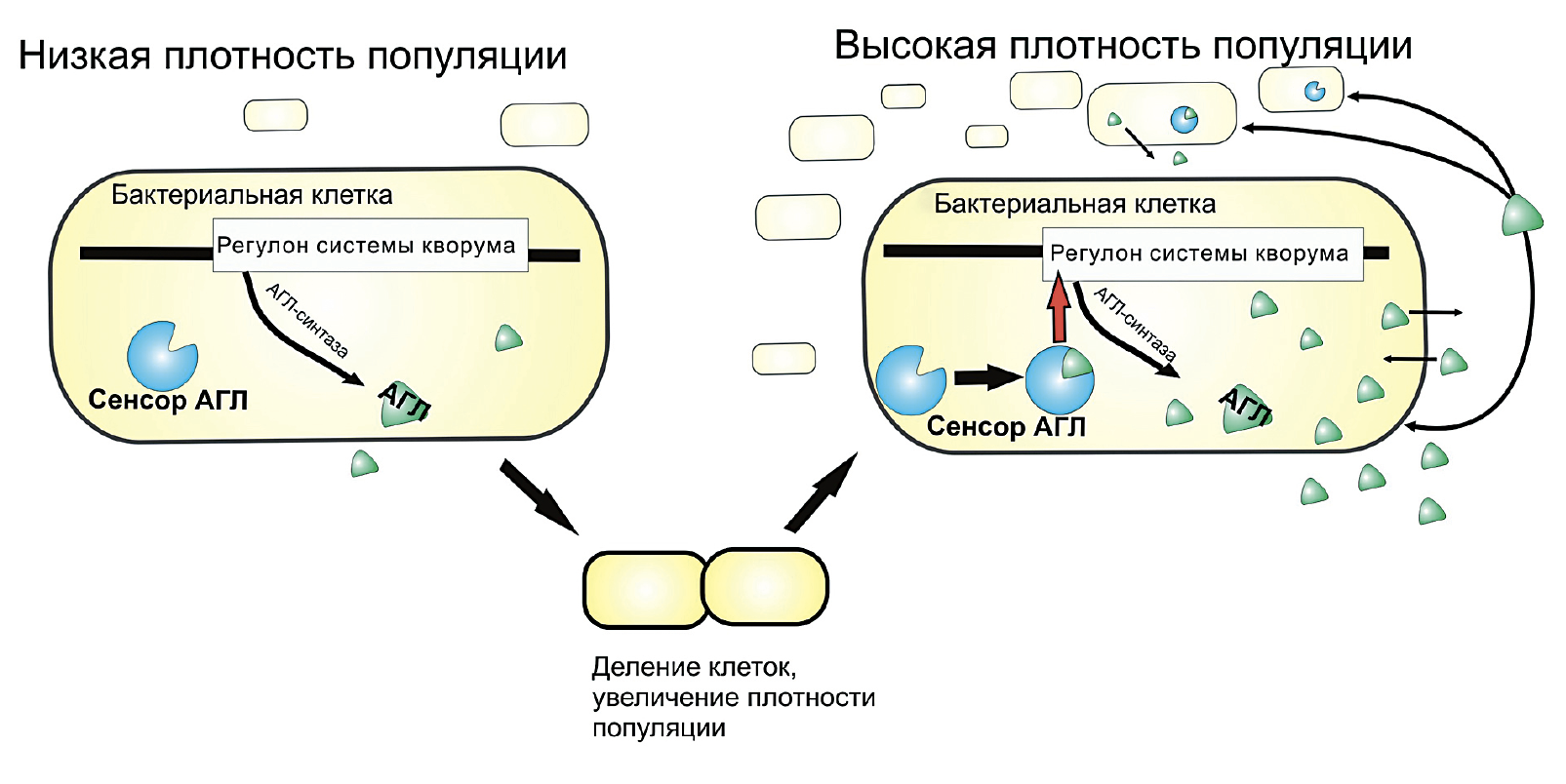
Рисунок 10. Схема регуляторной системы чувства кворума бактерий, где в качестве медиатора выступает ацил-гомосерин лактон (АГЛ). Когда плотность популяции низкая, АГЛ вырабатывается мало, следовательно, экспрессия генов факторов вирулентности затруднена. При увеличении плотности популяции бактерий данного медиатора становится много, и тогда он связывается со своим внутриклеточным сенсором. Комплекс «Сенсор + АГЛ» активирует экспрессию соответствующих генов (регулон системы кворума), кодирующих, например, литические ферменты, разрушающие растительную клеточную стенку, а также ген АГЛ-синтазы, тем самым способствуя образованию ацил-гомосерин лактона.
Что же делают растительные репрессоры чувства кворума? По своей структуре они похожи на низкомолекулярные медиаторы системы кворума бактерий, поэтому способны связываться с внутриклеточными рецепторами этих соединений у микроорганизмов и подавлять экспрессию соответствующих генов фитопатогенов. Иногда растения поступают еще хитрее: они «привлекают» в свою ризосферу такие микроорганизмы (например, представителей рода Bacillus и Rhodococcus), которые способны разрушать медиаторы системы чувства кворума фитопатогенных бактерий [9], [22].
Еще одним часто упоминавшимся выше вариантом ответа растения на внедрение паразитов является синтез активных форм кислорода. Наверное, ни для кого не секрет, что активные формы кислорода (гидроксил-радикал, перекись водорода, супероксид анион и другие) крайне опасны как для растительной, так и для животной клетки, поскольку способны активировать цепные реакции окисления различных биологических молекул от липидов до ДНК. Так при чем тут защита от фитопатогенов? Увеличение синтеза АФК характерно для количественной устойчивости. Активные формы губительно действуют на клетки фитопатогенов, способствуют сшивке полимеров растительных клеточных стенок, являются компонентами защитных сигнальных каскадов. Также они принимают участие в развитии реакции гиперчувствительности (РГЧ) — особого типа быстрой программируемой клеточной смерти (качественная устойчивость). Она приводит к полному уничтожению фитопатогена вместе с клеткой растения-хозяина и является своего рода экстренной мерой. В данном случае активный синтез АФК осуществляется в основном за счет активации НАДФ-оксидазы, расположенной в плазмалемме. Этот фермент окисляет НАДФ, находящийся в цитоплазме, и переносит электрон на кислород, расположенный в апопласте, приводя к формированию оксид радикала. Развитию окислительного взрыва также способствует ингибирование антиоксидантных ферментов, таких как каталаза или пероксидаза, участвующих в детоксикации перекиси водорода. Обязательным регулятором РГЧ является салициловая кислота [23].
Фитогормоны и фитоиммунитет
Мы знаем, что большинство процессов, происходящих в нашем организме, регулируется веществами различной химической природы: гормонами, которые синтезируются специальными органами — железами внутренней секреции. Растения в этом случае не являются исключением. У них нет специализированных тканей, ответственных за синтез подобных веществ, но растительных гормонов существует довольно много. Это и классические гормоны: ауксины, гиббереллины, цитокины — их еще называют ростовыми, а также этилен, абсцизины (абсцизовая кислота и ее производные) [24].
Фитогормоны играют огромную роль в формировании иммунного ответа — от них во многом зависит степень устойчивости или восприимчивости растения к конкретному патогену. Более того, иногда патогенные организмы способны влиять на гормональный статус растения, заставляя его работать так, как им выгодно.
Основными гормонами, которые играют главную роль в фитоиммунитете, считаются салициловая, жасмоновая кислоты и их производные, а также этилен.
Салициловая кислота
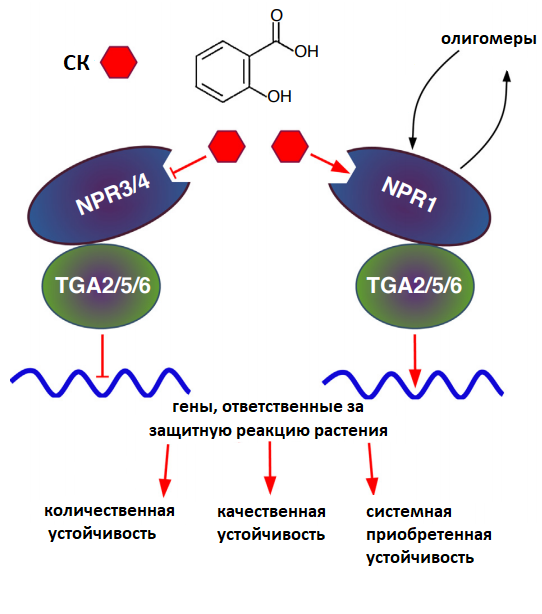
Рисунок 11. Схема сигнального пути салициловой кислоты внутри клетки растения. СК участвует в развитии как качественной (эффектор-индуцированной устойчивости), так и количественной (паттерн-индуцированной устойчивости) и системной приобретенной устойчивости. У СК существует 3 основных внутриклеточных рецептора — NPR1, NPR 3, NPR 4. В отсутствии фитогормона белки NPR3/4 ингибируют активность факторов транскрипции TGA2/5/6, ответственных за экспрессию генов, участвующих в реализации различных видов иммунного ответа растений. СК ингибирует действие этих белков, следовательно TGA2/5/6 могут быть активированы под действием второго рецептора фитогормона — NPR1, который после связывания с СК переходит из мультимерного состояния в олигомерное и способен активировать факторы транскрипции.
Первое сообщение о том, что салициловая кислота (СК) играет роль в защите растений от фитопатогенов, относится к 1979 году. Тогда было показано, что обработка табака СК способствует повышению его устойчивости к вирусу табачной мозаики. Позднее ученые установили, что салициловая кислота регулирует множество иммуномодулирующих процессов, принимает участие в развитии локальной количественной и качественной, а также системной приобретенной устойчивости (рис. 11).
Салициловая кислота может ингибировать каталазу и аскорбат пероксидазу — ферменты, участвующие в детоксикации перекиси водорода, вызывая тем самым в растении окислительный взрыв, что, в свою очередь, приводит к гибели фитопатогена вместе с клетками организма-хозяина (реакция гиперчувствительности).
Стоит отметить, что количество салициловой кислоты, задействованное при количественной, системной приобретенной и качественной устойчивости, достаточно разнится. Дело в том, что в первых двух вариантах синтез СК активизируется на значительно более низком уровне по сравнению с последним, что определяет в том числе и силу иммунного ответа. В случае системной приобретенной устойчивости салициловая кислота служит в основном в качестве сигнала, оптимизирующего транскрипцию защитных генов (PR-белков и др.).
К слову, стоит сказать, что увеличение количества СК далеко не всегда приводит к усилению защиты растения от паразитов. Для некоторых фитопатогенов (например, Xanthomonas campestris pv. vesicatoria), наоборот, характерно накопление данного фитогормона при развитии инфекции, а снижение его количества приводит к повышению устойчивости растения. Подобная картина характерна и для некротрофов, которым выгодна смерть растительных клеток под действием салициловой кислоты.
Таким образом, данный фитогормон может рассматриваться не только как фактор устойчивости, но и как фактор восприимчивости — все будет зависеть как от патогена, так и от степени активации СК-индуцируемого ответа [9], [26].
Жасмоновая кислота и этилен
Если мы говорим о защите растений от фитопатогенов, жасмоновая кислота (ЖК) и этилен обычно работают вместе. ЖК служит ключевым компонентом защиты от насекомых-фитофагов, но при этом она также играет важную роль во взаимодействии растений и микроорганизмов. ЖК — это продукт перекисного окисления жирных кислот. Рецепторами жасмоновой кислоты в клетке являются белок COI1 — компонент комплекса, участвующего в деградации белков, и белки JAZ, которые связываются с фактором регуляции транскрипции MYC2 и препятствуют экспрессии ЖК-индуцируемых генов. Жасмоновая кислота в этом случае выступает своего рода клеем между белками COI1 и JAZ, что в конечном итоге приводит к деградации JAZ-белков и активации экспрессии ЖК-индуцируемых генов. ЖК также активирует экспрессию генов, кодирующих ферменты ее собственного биосинтеза и гены JAZ-белков, что обеспечивает регуляцию сигнала, вызываемого этим фитогормоном по принципу положительной и отрицательной обратной связи [27].
Что же касается этилена, то его роль в растении воистину многогранна. Этот фитогормон регулирует множество физиологических процессов в растении: созревание плодов, старение, реакцию на абиотический стресс и т.д [24]. В растениях этилен синтезируется из 1‑аминоциклопропан-1‑карбоновой кислоты, которая является промежуточным продуктом метаболизма метионина. В рецепции данного фитогормона участвует множество белков: ETR1, ETR2, EIN4, ERS1, ERS2, расположенных на мембранах эндоплазматического ретикулума или аппарата Гольджи. Этилен является ключевым регулятором образования в сосудах ксилемы тилл (особых выростов клеток осевой или лучевой паренхимы, заполняющих полости сосудов и трахеид в поврежденных участках), которые блокируют водный транспорт, что может иметь двойной эффект (рис. 12) [28].
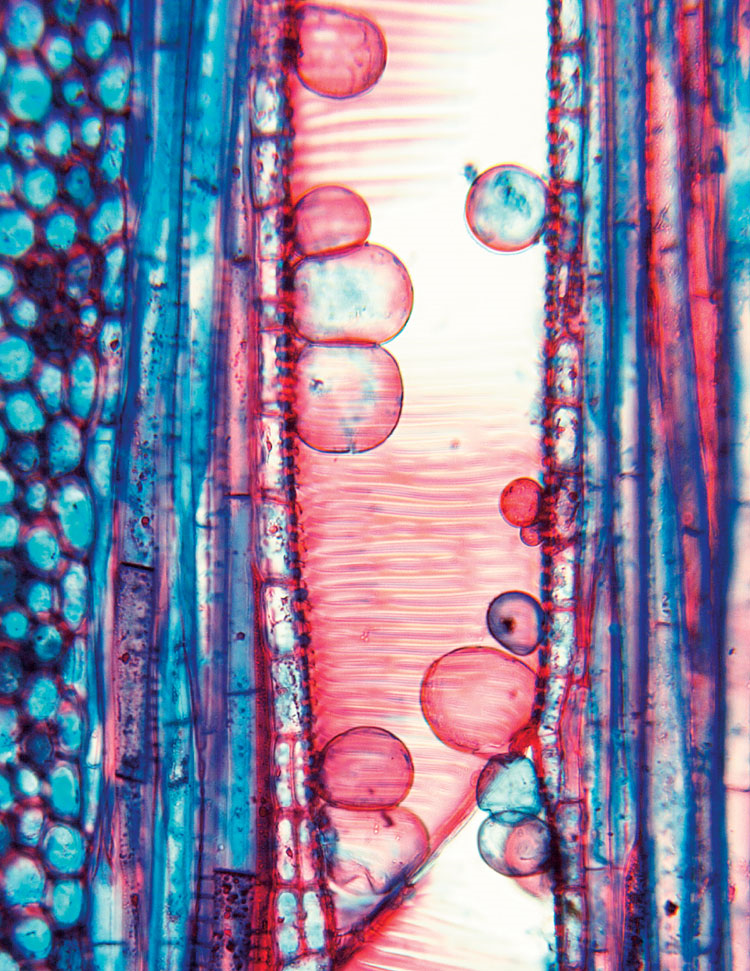
Рисунок 12. Ксилема растения с тиллами — пузыревидными выростами соседних паренхимных клеток, которые выпячиваются непосредственно в просвет сосуда.
Таким образом, с одной стороны, растение препятствует распространению фитопатогена, но с другой стороны, для бактерий это может оказаться выгодным, поскольку образование тилл снижает ксилемный ток в растении, что способствует активной коммуникации бактерий между собой.
В целом, работая вместе, жасмоновая кислота и этилен активируют синтез фитоалексинов, PR-белков, а также стимулируют лигнификацию клеток растения [29]. Этилен и ЖК обеспечивают активацию систем количественной и индуцированной системной устойчивости. Учитывая тот факт, что салицил-индуцируемая и жасмонат-индуцируемая сигнальные системы являются взаимоисключающими, некоторые микроорганизмы «специально» активируют ЖК/этилен-опосредуемые ответы, поскольку те могут способствовать развитию инфекции, вместо, например, салицил-индуцируемых.
А зачем нам изучать, как работает иммунитет растений?
Как видно из вышесказанного, иммунная система растений крайне запутанная, интересная и во многом еще плохо изученная область, которая имеет огромный потенциал в плане практического применения фундаментальных знаний.
Но зачем человеку изучать работу целой иммунной системы растений, если против бактерий, грибов и других убийц урожая давно придумано идеальное оружие — химические «яды»? Эх, если бы все было так просто! Во-первых, пестициды — крайне опасные вещества: они могут обладать канцерогенными и мутагенными свойствами, — а потому их применение и содержание в растениях должно жестко контролироваться, что происходит далеко не всегда. Более того, загрязнение окружающей среды пестицидами является серьезной экологической проблемой, а следовательно, применение таких веществ не может быть лучшим решением [30].
Подробнее о том, какими бывают пестициды и как осуществляется контроль за ними в России и в мире, можно прочесть в спецпроекте «Пестициды» на «Биомолекуле». — Ред.
Во-вторых, если мы постоянно будем «бить фитопатоген дубинкой по голове», то мы лишь поспособствуем появлению новых, устойчивых к дубинке штаммов. Да-да, здесь работает то же правило, что и с бактериальной антибиотикорезистентностью!
Другой вариант — создавать сорта растений, абсолютно устойчивых к фитопатогенам, например, методом генной инженерии . Но и здесь есть несколько подвохов. Во-первых, подобные сорта действуют на патоген так же, как пестициды. В геном таких растений часто встраивают некий ген устойчивости, продукт которого прямо или косвенно убивает микроорганизм, что в целом оказывает тот же самый селективный эффект на популяцию фитопатогенов, что и применение токсичных химических веществ. Такими генами устойчивости могут быть последовательности, кодирующие ферменты, непосредственно действующие на патогены (трансгенный картофель, экспрессирующий ген лизоцима бактериофага Т4 устойчив к Erwinia carotovora atroseptica); гены, чьи продукты ингибируют апоптоз клеток растения (синтез в табаке белков CED-9 нематоды и Bcl-2 человека значительно повышает его невосприимчивость к грибу-некротрофу Sclerotinia sclerotiorum) или, наоборот, стимулируют гибель клеток, вызывая тем самым реакцию гиперчувствительности [31], [32]. Еще одним вариантом может быть искусственное усиление экспрессии уже имеющихся у растений генов, кодирующих защитные белки. Во-вторых, значимой проблемой генетически измененных растений является трудность создания сортов, которые были бы устойчивы сразу к нескольким фитопатогенам.
В статье «От ГМО к растениям будущего. Все самое интересное о сложной работе современного селекционера» можно подробнее познакомиться с геномными методами селекции растений [33]. — Ред.
Интересной альтернативой перечисленным способам борьбы с болезнями растений стало подавление, сдерживание патогенов в рамках латентных инфекций — таких, при которых микроорганизм может размножаться в организме растения, но не вызывать в нем патологических процессов. Читатель вправе спросить: «А возможен ли такой расклад в природе»? Да, так бывает, и довольно часто. Латентные инфекции — результат длительной совместной эволюции патогена и хозяина, но результат не окончательный. Ведь от любви до ненависти один шаг. Пока остается не ясным, что заставляет микроорганизм быть добрым или агрессивным соседом, учитывая то, что в любой момент он может перейти от мирных действий к атаке — и это следствие недостатка наших фундаментальных знаний [9].
Но изучение растительно-микробных сообществ уже дает свои плоды. Например, было выявлено, что подселение к растению «полезной микрофлоры» способно увеличить его устойчивость к фитопатогенным микроорганизмам . Симбиотические ризобактерии, как уже было сказано выше, способны запускать в растении жасмонат-индуцируемые иммунные ответы, конкурировать с фитопатогенами за важные микроэлементы (например, железо), а также синтезировать антибиотики, пагубно влияющие на патогенную микрофлору. Поэтому обработка сельскохозяйственных культур пробиотиками (смесью полезных микроорганизмов) является перспективным направлением в агропромышленности, не лишенным, правда, своих недостатков (например, после высадки в поле растения с симбиотическими бактериями вся его полезная микрофлора может быть вытеснена естественными штаммами).
Подробнее об использовании пробиотиков для борьбы с фитопатогенами читайте в статье «Пробиотики для растений: как накормить растущий мир» [34]. — Ред.
Таким образом, изучение фитоиммунитета, а также растительно-микробных сообществ в целом может подарить нам новые возможности в борьбе с заболеваниями сельскохозяйственных культур.
Литература
- Чикин Ю.А. Общая фитопатология (часть 1): учебное пособие. Томск: Томский государственный университет, 2001. — 170 с.;
- G. Glazer, K. A. Myers, E. R. Davies. (1966). Ergot poisoning. Postgraduate Medical Journal. 42, 562-568;
- Brian J. Haas, Sophien Kamoun, Michael C. Zody, Rays H. Y. Jiang, Robert E. Handsaker, et. al.. (2009). Genome sequence and analysis of the Irish potato famine pathogen Phytophthora infestans. Nature. 461, 393-398;
- Левитин М. М. (2009). Фитопатогенные грибы и болезни человека. Защита и карантин растений. 1, 24–25;
- Желдакова Р. А., Мямин В. Е. Фитопатогенные микроорганизмы: Учеб.- метод. комплекс. Минск: БГУ, 2006. — 116 с.;
- Генералов И.И. Медицинская вирусология: учебное пособие. Витебск: ВГМУ, 2017. — 307 с.;
- Замотайлов А.С. Фитогельминтология : курс лекций. Краснодар: КубГАУ, 2015. — 27 с.;
- Приданников М. В. (2014). Фитопатогенные нематоды: урожай под угрозой. Наука из первых рук. ,1, 193–197;
- Горшков В. Ю. Бактериозы растений: молекулярные основы формирования растительномикробных патосистем. Казань: Изд-во Сергея Бузукина, 2017. — 304 с.;
- L. A. Urry, M. L. Cain, S. A. Wasserman, P. V. Minorsky, J. B. Reece. Campbell Biology (11th Edition). Pearson Education, 2017;
- C P Vance, T K Kirk, R T Sherwood. (1980). Lignification as a Mechanism of Disease Resistance. Annu. Rev. Phytopathol.. 18, 259-288;
- Marjorie Murphy Cowan. (1999). Plant Products as Antimicrobial Agents. Clin. Microbiol. Rev.. 12, 564-582;
- Caroline S. Rempe, Kellie P. Burris, Scott C. Lenaghan, C. Neal Stewart. (2017). The Potential of Systems Biology to Discover Antibacterial Mechanisms of Plant Phenolics. Front. Microbiol.. 8;
- Ayman M. Mahmoud, Rene J. Hernández Bautista, Mansur A. Sandhu, Omnia E. Hussein. (2019). Beneficial Effects of Citrus Flavonoids on Cardiovascular and Metabolic Health. Oxidative Medicine and Cellular Longevity. 2019, 1-19;
- T.P. Tim Cushnie, Benjamart Cushnie, Andrew J. Lamb. (2014). Alkaloids: An overview of their antibacterial, antibiotic-enhancing and antivirulence activities. International Journal of Antimicrobial Agents. 44, 377-386;
- Модельные организмы: арабидопсис;
- Thomas Boller, Georg Felix. (2009). A Renaissance of Elicitors: Perception of Microbe-Associated Molecular Patterns and Danger Signals by Pattern-Recognition Receptors. Annu. Rev. Plant Biol.. 60, 379-406;
- Jonathan D. G. Jones, Jeffery L. Dangl. (2006). The plant immune system. Nature. 444, 323-329;
- Devendra K. Choudhary, Anil Prakash, B. N. Johri. (2007). Induced systemic resistance (ISR) in plants: mechanism of action. Indian J Microbiol. 47, 289-297;
- Marcin Nowicki, Małgorzata Lichocka, Marzena Nowakowska, Urszula Kłosińska, Elżbieta U. Kozik. (2012). A Simple Dual Stain for Detailed Investigations of Plant-Fungal Pathogen Interactions. Vegetable Crops Research Bulletin. 77, 61-74;
- L. C. van Loon, W. S. Pierpoint, Th. Boller, V. Conejero. (1994). Recommendations for naming plant pathogenesis-related proteins. Plant Mol Biol Rep. 12, 245-264;
- Christopher M. Waters, Bonnie L. Bassler. (2005). QUORUM SENSING: Cell-to-Cell Communication in Bacteria. Annu. Rev. Cell Dev. Biol.. 21, 319-346;
- Miguel Angel Torres, Jonathan D.G. Jones, Jeffery L. Dangl. (2006). Reactive Oxygen Species Signaling in Response to Pathogens: Figure 1.. Plant Physiol.. 141, 373-378;
- Князева Т.В. Регуляторы роста растений в Краснодарском крае: монография. Краснодар: ЭДВИб, 2013. — 128 с.;
- Yuelin Zhang, Xin Li. (2019). Salicylic acid: biosynthesis, perception, and contributions to plant immunity. Current Opinion in Plant Biology. 50, 29-36;
- Philip J. O'Donnell, Jeffrey B. Jones, Francis R. Antoine, Joseph Ciardi, Harry J. Klee. (2001). Ethylene-dependent salicylic acid regulates an expanded cell death response to a plant pathogen. The Plant Journal. 25, 315-323;
- Johan Memelink. (2009). Regulation of gene expression by jasmonate hormones. Phytochemistry. 70, 1560-1570;
- Q. Sun, T. L. Rost, M. A. Matthews. (2006). Pruning-induced tylose development in stems of current-year shoots of Vitis vinifera (Vitaceae). American Journal of Botany. 93, 1567-1576;
- Bruce Adie, José Manuel Chico, Ignacio Rubio-Somoza, Roberto Solano. (2007). Modulation of Plant Defenses by Ethylene. J Plant Growth Regul. 26, 160-177;
- Коварные помощники человечества: пестициды;
- Klaus Düring, Petra Porsch, Matthias Fladung, Horst Lörz. (1993). Transgenic potato plants resistant to the phytopathogenic bacterium Erwinia carotovora. The Plant Journal. 3, 587-598;
- M. B. Dickman, Y. K. Park, T. Oltersdorf, W. Li, T. Clemente, R. French. (2001). Abrogation of disease development in plants expressing animal antiapoptotic genes. Proceedings of the National Academy of Sciences. 98, 6957-6962;
- От ГМО к растениям будущего. Всё самое интересное о сложной работе современного селекционера;
- Пробиотики для растений: как накормить растущий мир.







